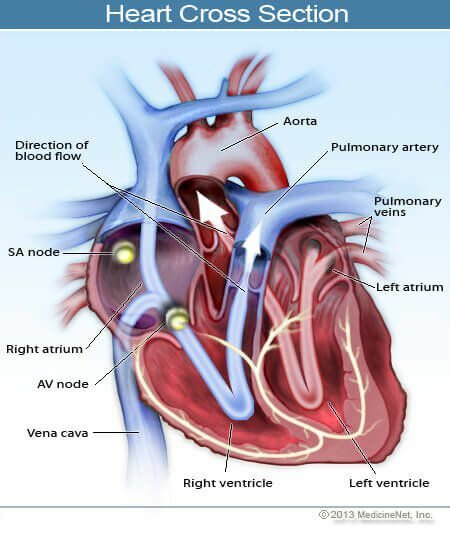
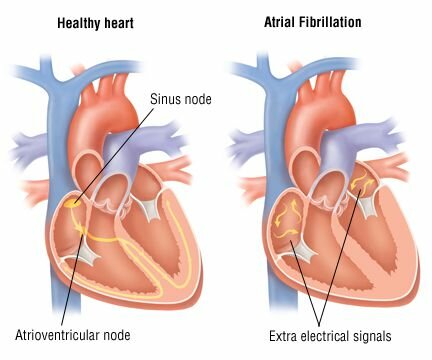
Malvinder S. Parmar, MD, FRCPC, FACP
управление
Контроль скорости: Первым шагом в лечении мерцательной аритмии, несмотря на причину, является контроль желудочкового ответа.
Какой агент следует использовать?
Выбор агента для контроля скорости зависит от сосуществующих заболеваний. Бета-адренергические блокаторы, блокаторы кальциевых каналов и дигоксин являются эффективными агентами, которые можно использовать для контроля скорости.
Бета-адренергические блокаторы: Бета-адренергические блокирующие агенты эффективны в контроле частоты желудочков и являются препаратами выбора [8] при отсутствии декомпенсированной застойной сердечной недостаточности. Эти агенты также помогают облегчить опосредованные бета-рецептором симптомы, такие как беспокойство и дрожь. Пациент нуждается в мониторинге сердечного и неинвазивного артериального давления из-за потенциальных рисков гипотонии, ухудшения сердечной недостаточности или брадикардии. Часто требуются более высокие, чем обычно, дозы этих агентов из-за повышенного клиренса плазмы при гипертиреозе. [9] Применение бета-адреноблокаторов должно быть тщательно продумано у пациентов с легкой сердечной недостаточностью из-за риска обострения.
Какой бета-блокатор? Из бета-адреноблокаторов пропранолол обладает тем преимуществом, что снижает периферическую конверсию Т4 к Т3; однако этот эффект имеет незначительное терапевтическое значение, и другие кардиоселективные агенты с более длительным периодом полураспада одинаково эффективны. [10] Препарат короткого действия, такой как эсмолол, [11] можно испытывать под контролем сердечного ритма и инвазивного артериального давления у пациентов с ассоциированной сердечной недостаточностью, чтобы определить его переносимость.
Блокаторы кальциевых каналов: Блокаторы пероральных кальциевых каналов, такие как дилтиазем или верапамил, могут быть полезны для длительного контроля частоты желудочков 12 у пациентов, которым противопоказана бета-адренергическая блокада, но эти агенты могут также иметь отрицательные инотропные эффекты. Можно рассматривать внутривенные блокаторы кальциевых каналов, при которых бета-блокаторы противопоказаны, но их следует применять осторожно, так как они могут вызвать тяжелую гипотензию [13] и дальнейшее снижение системного сосудистого сопротивления, которое уже является низким у пациентов с тиреотоксикозом.
Дигоксин: Дигоксин может быть рассмотрен для контроля скорости у пациентов с сердечной недостаточностью, которым бета-блокаторы или блокаторы кальциевых каналов могут не подходить. Тем не менее, гипертиреоидная фибрилляция предсердий, как правило, устойчива к дигоксину, что отчасти вызвано увеличением почечного клиренса и видимого объема его распределения [14], а также повышением симпатической чувствительности и снижением тонуса блуждающего нерва. Требуется доза дигоксина, превышающая обычную, [9], которая увеличивает риск его токсичности. Несмотря на эти ограничения, дигоксин все же следует учитывать у пациентов с сердечной недостаточностью и сопутствующей тиреотоксической фибрилляцией предсердий.
Может ли амиодарон использоваться у пациентов с тиреотоксической фибрилляцией предсердий?
Амиодарон является жирорастворимым, богатым йодом антиаритмическим препаратом с доказанным преимуществом в лечении пациентов с симптомами желудочковой и предсердной аритмий. Это запрещает преобразование T4 к Т3 в большинстве тканей. [15] Из-за высокого содержания йода он также ингибирует синтез и секрецию гормонов щитовидной железы, а также снижает связывание Т3 к его ядерным рецепторам. [16] Это торможение Т3 производство приводит к более быстрому разрешению симптомов, чем классические блокаторы Т4 синтез и выпуск. Амиодарон может вызывать дисфункцию щитовидной железы у пациентов с ранее существовавшим заболеванием щитовидной железы и деструктивный тиреоидит у пациентов с нормальной щитовидной железой. Общая частота гипер- и гипотиреоза у пациентов, принимающих амиодарон, составляет от 14 до 18%, и из-за чрезвычайно длительного периода полураспада любая проблема может возникнуть через несколько месяцев после прекращения приема препарата. Антитреоидный препарат, вводимый одновременно, блокирует йодную организацию и предотвращает обострение тиреотоксикоза, вызванное йодидом. [17] Следовательно, вызванный тиреотоксикозом эффект амиодарона не должен исключать его использования при тиреотоксической фибрилляции предсердий [18], при условии, что он назначается в сочетании с антитиреоидными препаратами. Однако амиодарон, являющийся антиаритмическим агентом, может преобразовывать мерцательную аритмию в синусовый ритм. У пациента с фибрилляцией предсердий неизвестной продолжительности ранняя конверсия фибрилляции предсердий может быть нежелательной из-за возможных тромбоэмболических осложнений. Тем не менее, иногда у нас не может быть другой альтернативы, и ее следует использовать только в случае неудачи других методов лечения.
Каков риск тромбоэмболии?
Исследования, изучающие риск эмболии при тиреотоксической фибрилляции предсердий [19, 20], ограничены, но предполагают, что частота эмболии при тиреотоксической фибрилляции предсердий превышает таковую при нетиротоксической фибрилляции предсердий, не связанной с ревматическим пороком сердца. [20] Следует отметить, что большинство клинически выраженных эмболий при тиреотоксической фибрилляции предсердий затрагивают центральную нервную систему и возникают на ранних стадиях заболевания; [20], однако, ретроспективный анализ 610 пациентов не обнаружил статистически значимых различий, когда пациенты с мерцательной аритмией сравнивались с пациентами по возрасту и полу. [21]
Доступные исследования не подтвердили однозначно, что тиреотоксическая фибрилляция предсердий является более мощным фактором риска развития инсульта. [4] Несколько независимых клинических и эхокардиографических предикторов повышенного риска тромбоэмболии у пациентов с неревматической фибрилляцией предсердий: возраст, история сердечной недостаточности, история гипертонии или сахарного диабета, предшествующая тромбоэмболия, увеличение левого предсердия и глобальная дисфункция левого желудочка. [22,23] Эти подтвержденные факторы риска следует использовать для выявления пациентов, которым грозит риск и которые с наибольшей вероятностью получат пользу от антикоагуляции.
Кто должен быть антикоагулянт?
Решение о лечении этих пациентов с помощью краткосрочной или долгосрочной антикоагулянтной терапии должно приниматься индивидуально с учетом возраста, сопутствующих заболеваний сердца и рисков, связанных с такой терапией. Два недавних систематических обзора [24, 25] об эффективности долгосрочной антикоагулянтной или антиагрегантной терапии у пациентов с неревматической фибрилляцией предсердий пришли к диаметрально противоположным выводам, а в другом обзоре [26] рекомендуется применение аспирина вместо антикоагулянтов у пациентов с не клапанной фибрилляцией предсердий. Однако 7-я конференция Американского колледжа грудных врачей (ACCP) [27] по антитромботической терапии при фибрилляции предсердий рекомендует выбирать антитромботическую терапию на основании наличия подтвержденных факторов риска инсульта, независимо от наличия или отсутствия тиреотоксикоза.
У более молодых пациентов с тиреотоксической фибрилляцией предсердий, у которых нет основного заболевания сердца, гипертонии или независимых факторов риска эмболизации, риски антикоагулянтной терапии, вероятно, перевешивают преимущества. И наоборот, у пожилых пациентов, у которых известно или предположительно имеется заболевание сердца, или у пациентов с хронической фибрилляцией предсердий, следует начинать антикоагулянтную терапию. Рекомендуемая нагрузочная доза варфарина аналогична для пациентов с эутиреозом, но требуется более низкая поддерживающая доза из-за ускоренного клиренса витамин К-зависимых факторов свертывания. [9] Если не противопоказан, аспирин следует использовать в тех, кто не антикоагулянт.
Когда следует учитывать кардиоверсию?
Попытки кардиоверсии не следует предпринимать до восстановления эутиреоидного состояния, поскольку поддержание синусового ритма маловероятно, пока у пациента сохраняется гипертиреоз. [28] Как только состояние эутиреоза достигается при лечении гипертиреоза, спонтанная реверсия синусового ритма происходит почти у двух третей пациентов в течение 8-10 недель, но лишь немногие из них самопроизвольно возвращаются к синусовому ритму после 3 месяцев. [28] В дополнение к продолжительности мерцательной аритмии факторами, влияющими на самопроизвольный возврат к синусовому ритму, являются возраст, наличие основного заболевания сердца и размер левого предсердия. В случае отсутствия самопроизвольного возврата к синусовому ритму в течение этого периода, электрическую или фармакологическую кардиоверсию следует пытаться проводить только после того, как пациенту сделана эутиреоидная опухоль и она оптимально антикоагулирована в течение по крайней мере 3 недель, и антикоагуляция должна продолжаться в течение по крайней мере 4 недели после успешной кардиоверсии. [27] Антиаритмические препараты класса I (IA — хнидин и прокаинамид; IC — флеканид и пропафенон) или класса III (амиодарон, дофетилид или ибутилид) могут рассматриваться для фармакологической кардиоверсии и непрерывного электрокардиографического мониторинга для первых 48- 72 часа после начала терапии следует рассмотреть.
Как следует контролировать гипертиреоз?
Быстрое облегчение тиреотоксикоза, основы лечения тиреотоксической фибрилляции предсердий, лучше всего достигается в 2 этапа: антитиреоидная медикаментозная терапия с последующей аблацией щитовидной железы радиоактивным йодом. Специалист по щитовидной железе должен быть вовлечен в окончательное ведение таких пациентов. У этих пациентов показана абляция из-за риска рецидива, что характерно для пациентов, получающих длительную терапию антитиреоидным препаратом. Должно быть заметное клиническое улучшение в течение 10-14 дней, и большинство пациентов будет биохимически эутиреоидным через 4-6 недель после начала антитиреоидной лекарственной терапии. Лечение следует начинать с антитиреоидного препарата [13], либо метимазола, либо пропилтиоурацила, потому что медикаментозная терапия приводит к более быстрому снижению уровня Т в сыворотке крови.4 и т3 концентрации, чем радиоактивная йодная терапия. Пропилтиоурацил также ингибирует периферическое превращение Т4 к Т3. Потому что эти агенты ингибируют синтез Т4 и т3, они истощают запасы этих 2 гормонов, тем самым предотвращая обострение тиреотоксикоза, которое может возникнуть в результате радиационного тиреоидита после терапевтической дозы радиоактивного йода. Антитреоидный препарат следует назначать в течение 4-8 недель, а затем отменять за 3-5 дней до введения терапевтической дозы радиоактивного йода. Эти агенты могут быть восстановлены через 1 неделю, чтобы обеспечить контроль, пока не произойдет терапевтический эффект радиоактивного йода.
Тиреотоксикоз может быть уменьшен еще быстрее за счет введения неорганического йода, который резко ингибирует [29] секрецию Т4 и т3. По крайней мере, 1 доза антитиреоидного агента должна быть дана первой, чтобы предотвратить попадание йодида в новые запасы гормонов. Терапию неорганическим йодом следует рассматривать [13] и назначать на 3-5 дней у пациентов, которым важен быстрый контроль состояния гипертиреоза, например у пациентов с тяжелой застойной сердечной недостаточностью или нестабильной стенокардией.
Что такое прогноз?
Гипертиреоз связан с увеличением сердечно-сосудистой и цереброваскулярной смертности, и в большом исследовании стандартизированный коэффициент смертности составлял 1,8: 1 (95% доверительный интервал 1,6-L2: 1) в год, следующий за радиоактивной терапией. [30] Предсердные удары чаще встречаются у тиреотоксических пациентов, чем у контрольной группы до и после лечения. [31] Это свидетельствует о сохраняющемся аритмическом субстрате, несмотря на восстановление биохимического эутиреоза и влияния на электрическое ремоделирование миокарда, особенно предсердий, гормонами щитовидной железы.
По материалам сайта: www.medscape.com