Артериальная гипертония — это синдром, этиология и патофизиологические механизмы которогодоконцанеизучены 116]. Рольпочекв патогенезе и развитии артериальной гипертонии продолжает оставаться предметом дискуссии [1 1]. Известны множественные механизмы регуляции гемодинамического гомеостаза. Каждому отведено то или иное место.
Различают группы быстро и длительно действующих прессорных и депрессорных факторов. К прессорным механизмам быстрого действия относятся барорецепторный, хеморе-цепторный и ишемическая реакция центральной нервной системы. Они включаются в первые секунды от момента острого изменения артериального давления. Им принадлежит решающая роль в таких ситуациях, как изменение положения тела, вращение в центрифуге, быстрая кровопотеря и др. Промежуточное положение по времени включения и длительности действия занимают механизм стрессовой релаксации, ренин-ангитензиновая вазоконстрик-ция и перемещение жидкости в капиллярах. Они действуют в пределах от нескольких минут до нескольких часов и играют важную роль, например, при медленной кровопотере или чрезмерных трансфузиях. Функцию этих быстрореагирующих систем можно рассматривать как физиологическую реакцию организма [7].
К прессорным системам длительного действия относятся альдостероновый и натрий-объемзависимый механизмы. Они начинают действовать через несколько часов после сдвига в величине артериального давления. Но если они активируются, то продолжают функционировать неопределенно долгое время. Механизмы регуляции артериального давления длительного действия ориентированы на почки, неспецифичны и не имеют нозологической направленности [17].
Депрессорные механизмы повторяют структуру прессорных. Можно говорить о группе быстродействующих факторов, к которым относятся натрийуретический гормон и атриальный натрийуретический пептид, и длительно действующей депрессорной системе, представленной простагландинами. Срединное положение между ними по длительности действия и времени включения занимает калликреин-ки-ниновая система.
Относительно недавно идентифицированы сильные сосудосуживающие вещества — эндо-телины. Им противодействует эндотелиальный релаксирующий фактор (окись азота, NO) — эндогенный вазодилятатор. Оба фактора вырабатываются эндотелиальными клетками сосудов. Эндотелины действуют локально на сосудистую стенку, вызывая вазоконстрикцию. Хотя повышение сосудистого сопротивления, вызываемое эндотелинами, может вести к гипертен-зии, взаимоотношения между концентрацией этих веществ в плазме и системным артериальным давлением обнаружено не было. Поэтому сейчас все же принято считать, что эндотелины могут участвовать в развитии артериальной гипертензии через местное воздействие на сосуды почек с последующим включением ре-нин-ангиотензин-альдостероновой и натрий-объемзависимой прессорных систем. Снижение синтеза эндотелиального релаксирующего фактора (NO) может играть существенную роль в развитии гипертензии. У пациентов с уремией обнаруживаются повышенные концентрации ингибиторов NO-синтетазы в крови. Однако роль нарушения метаболизма эндотелиального релаксирующего фактора в патофизиологии гипертензии при терминальных болезнях почек точно не определена [16]. Еще один из механизмов регуляции артериального давления связан с деятельностью гипофизарно-надпочечниковой системы и выработкой таких гормонов, как адренокортикотропный гормон, вазопрессин, кортизол, хромогранин А. Вазопрессину приписывается важная роль в патогенезе злокачественной гипертонии. Есть данные, согласно которым ангиотенэин-11 и вазопрессин наряду с вторичным повреждающим действием на сосуды, связанным с высоким давлением, способны непосредственно стимулировать пролиферацию мезангия почечных клубочков. В связи с этим ингибиторы конвертирующего энзима и блокаторы рецепторов ангиотензина-11, а также блокаторы рецепторов вазопрессина типа VI способны препятствовать развитию нефроангиосклероза [2].
Наконец, существует мнение о генетической предрасположенности к развитию гипертензии. Одни авторы связывают ее с количеством функционирующих нефронов при рождении (малое их количество способствует нефросклерозу)[16]. Другие считают, что ведущий механизм — это полигенный структурный дефект клеточных мембран [7].
Как прессорные, так и депрессорные системы осуществляют действие через одни и те же неспецифические механизмы: сердечный выброс, объем циркулирующей крови и общее периферическое сопротивление.
О том, что почки играют ключевую роль в развитии хронической систолодиастолической артериальной гипертонии, можно судить по существенному снижению артериального давления и периферического сопротивления при удалении почек в терминальной стадии хронической почечной недостаточности. По-видимому, именно с почечным фактором связана трудность коррекции артериальногодавления в процессе проведения гемодиализа при сохраненных почках. Однако говорить о какой-то определенной форме гипертензии, связанной схро-нической почечной недостаточностью, нельзя, так как не все механизмы развития артериальной гипертонии при хронической почечной недостаточности могут быть признаны нефроген-ными в точном смысле этого слова. Экспериментальные исследования выявили существенную роль афферентных импульсов из поврежденной почки в симпатические центры заднего гипоталамуса [2].
Таким образом, в патофизиологических механизмах развития артериальной гипертензии тесно переплелись как почечные, так и вне-почечные факторы. Такое же переплетение патологических субстратов наблюдается в мор-фогенезе артериальной гипертензии. Как правило, гистологические признаки хронической систолодиастолической артериальной гипертонии одинаковы, независимо от ее первопричины. Однако в клинической практике принято разделять артериальную гипертонию на первичную и вторичную в зависимости от исходной причины ее развития. При своевременном устранении этой причины можно прервать патофизиологические звенья стабилизации артериальной гипертензии и нормализовать артериальное давление.
Среди вторичных артериальных гипертоний заболевания почек занимают ведущее место. Практически в 100% случаев синдром артериальной гипертонии сопровождает опухоли почек (рениному, гипернефрому) и поражение почечных магистральных сосудов (реноваскулярная гипертония). При диффузных заболеваниях почек синдром артериальной гипертонии с наибольшей частотой выявляется при первичных и вторичных гломерулонефритах, а также диабетической нефропатии. Встречаемость артериальной гипертонии при этих заболеваниях с сохранной функцией почек колеблется в пределах 30-85%. По мере снижения функции почек частота артериальной гипертонии резко возрастает, достигая уровня 85-90% в стадии почечной недостаточности, вне зависимости от нозологии почечного процесса [4].
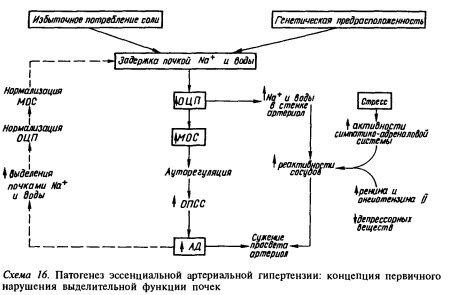
Более, чем у 95% больных с артериальной гипертонией не удается выявить ее причину. Такую артериальную гипертонию характеризуют как первичную или эссенциальную. При этом варианте гипертензии регистрируется поражение почек, которое заключается в сужении афферентных артериол некоторых клубочков почек и развитии вследствие этого ишемии клубочков. Кроме того, как считается в настоящее время, остающиеся интактные нефроны могут подвергаться усиленному системному давлению, что ведет к гломерулярному застою, гипертензии и гиперфильтрации с последующим повреждением клубочков в результате перегрузки [4]. Однако соотношение ишемического и гипертонического механизмов гломерулярного повреждения остается до конца невыясненным [11]. Таким образом, поражения клубочков почек при гипертонической болезни представляют собой неоднородно распределенную структуру. Было точно определено, что поврежденные в результате ишемии или гиперфильтрации клубочки составляют лишь незначительную субпопуляцию: большинство нефронов выглядят нормально васкуляризованными [11].
В процессе стабилизации эссенциальной гипертонии развивается гиперпластический эластический атеросклероз внутридольковых артерий и афферентных артериол клубочков почек, что сопровождается нарастающей потерей клубочков и нефроангиосклерозом. Нефро-ангиосклероз, в свою очередь, в результате гибели субстратов, продуцирующих депрессорные факторы, способствует прогрессированию и злокачественному течению артериальной гипертонии и, в конце концов, приводит к хронической почечной недостаточности. Известно, что нефроангиосклероз, развившийся в результате продолжительного воздействия гипертонии на почки, ответственен за 10-20% всех новых случаев хронической почечной недостаточности. требующих проведения гемодиализа [ 11]. На этой стадии заболевания у клиницистов возникают затруднения в интерпретации нозологической формы стойкой систолодиастолической артериальной гипертонии. Возникшая вначале как эссенциальная, она не поддается медикаментозному контролю, в моче может появиться белок, что заставляет ложно думать о каком-то первичном заболевании почек и вторичном (симптоматическом) характере артериальной гипертензии. Именно на этой стадии эссенциальной гипертонии при исключении ва-зоренальной гипертонии нередко выставляются диагнозы пиелонефрита и гломерулонефрита. Артериальная гипертония в этих случаях действительно должна рассматриваться как вторичная, только в основе ее лежит нефроангиосклероз. В большинстве случаев стойкой систоло-диастолической артериальной гипертонии (за исключением вазоренальной и эндокринной) лечение не зависит от ее причины, что, помнению некоторых авторов, объединяет первичную и вторичную формы артериальной гипертонии [7]. Таким образом, связь между состоянием почек и артериальной гипертонией сложна и образует порочный круг. Гипертензия может быть и причиной, и следствием заболевания почек, и иногда трудно определить, что первично.
Однако частота случаев явного повреждения почек у людей с гипертонической болезнью невысока. В связи с этим представляет интерес расхождение между результатами ретроспективных эпидемиологических исследований и проспективных испытаний. В то время как с ретроспективной точки зрения гипертония представляется явным «виновником» развития конечной стадии заболевания почек, особенно у пожилых людей, выраженное повреждение почек при слабой и умеренной гипертонии наблюдается реже других сердечно-сосудистых осложнений. Такое расхождение, какуказывалось выше, объясняется, во-первых, тем, что на стадии нефросклероза трудно определить исходное заболевание почек. Во-вторых, при высокой распространенности слабой и умеренной формы гипертонии среди населения в целом, нефросклероз, даже редко развивающийся, возможно, объясняет высокий процент пациентов, нуждающихся в диализе [11]. Не исключено, что у части больных эссенциальной гипертонией, у которых происходит быстрое прогрессирова-ние нефроангиосклероза, существуют определенные предрасполагающие к этому факторы. Это могут быть сердечная недостаточность, гиперхолестеринемия, курение, резистент-ность к инсулину, наследственная отягощен-ность [3]. В этом плане интересна роль антител к фосфолипидам, которые также могут вызывать дисфункцию эндотелия сосудов и включить все вышеуказанные механизмы развития артериальной гипертонии. Иммунологическая опос-редованность развития артериальной гипертонии рассматривается в рамках антифосфолипидного синдрома.
ДФС — это иммуноопосредованный синдром, связанный с циркуляцией антител к фосфолипидам и характеризующийся рецидивирующими тромбозами сосудов артериального и венозного русла различного калибра и локализации. Крометромбозов АФС может проявляться тромбоцитопенией, гемолитической анемией, а у женщин — привычным невынашиванием беременности и внутриутробной гибелью плода. Основными представителями антител к фосфолипидам, относящихся к классу имму-ноглобулинов (lgG, lgA и lgM) являются:
а) антитела, обусловливающие биологическую ложно-положительную реакцию Вассермана (Б-ЛПРВ);
б) волчаночные антикоагулянты (ВА) — антитела, способные in vitro подавлять фосфолипид-зависимые коагуляционные реакции;
в) антитела к кардиолипину (аКЛ), реагирующие с иммобилизованным отрицательно заряженным фосфолипидом (кардиолипином).
Кроме этого, в последних работах появились сообщения о важной роли антител к ^2- гликопротеину 1 (ц^-ГП 1> в развитии тромбозов при АФС [8].
Морфологически при АФС выявляют тромбозы и/или пролиферацию клеток эндотелия сосудов при отсутствии воспалительной инфильтрации сосудистой стенки. Эти изменения получили название тромботической и/или про-лиферативной васкулопатии [1,6,10,14,15].
Клинически различают первичный и вторичный антифосфолипидный синдром. В основе вторичного АФС часто лежат аутоиммунные ревматические заболевания, и, прежде всего, системная красная волчанка (СКВ). По результатам некоторых исследований при СКВ приблизительно у 40-47% выявляются аКЛ [6]. Кроме того, циркуляцию аФЛ обнаруживают при некоторых инфекционных заболеваниях, злокачественных новообразованиях и других состояниях, таких как: неврологические синдромы (синдром Гийена-Барре, синдром Дего, миастения), спондилопатии, цирроз печени, уремия, атеросклероз и др. Однако в этих случаях циркуляция аФЛ, как правило, не сопровождается тромбозами сосудов. При развитии клиники АФС в отсутствие исходного аутоиммунного ревматического заболевания говорят о первичном АФС.
Из характеристики АФС следует, что артериальная гипертония при этом заболевании имеет вторичный генез и обусловлена тромбозами, которые могут развиться в любом участке артериального русла почки [6,10.14,15]. Это могут быть:
- тромбоз брюшного отдела аорты с клиникой псевдокоарктации, острой ишемии и вазоренальной гипертонии;
- тромбоз ствола почечной артерии с клиникой острой ишемии (инфаркта) и вазоренальной гипертонии;
- тромбоз внутрипочечных артериол с клиникой инфарктов почек и вторичной артериальной гипертонией;
- тромбоз клубочковых капилляров с клиникой, похожей на клинику гломерулонефрита и вторичной артериальной гипертонией.
Кроме тромбозов или совместно с ними при АФС наблюдается пролиферация эндотелия сосудов почек с сужением их просвета вплоть до полной облитерации. Клинические проявления зависят от размера сосуда и скорости развития окклюзии [12]. Склероз и гиали-ноз капилляров почек может проявляться синдромом «лабильной» артериальной гипертонии с транзиторным нарушением функции почек или «стабильной», даже «злокачественной», артериальной гипертонией с прогрессирующей почечной недостаточностью часто без мочевого синдрома [9]. В основе ее лежит очаговое или диффузное поражение капилляров почек, в том числе клубочковых, по типу пролиферативной васкулопатии. При этом артериальная гипертония даже у молодых пациентов с АФС трактуется как гипертоническая болезнь, то есть, как первичная артериальная гипертония [12,15]. С другой стороны, имеются сообщения о выявлении циркуляции антифосфолипидных антител при гипертонической болезни в отсутствие тромбо-тического анамнеза. Так, при обследовании 47 пациентов с гипертонической болезнью II стадии у 9 чел. был отмечен повышенный уровень аКЛ. При осложнениях гипертонической болезни острым нарушением мозгового кровообращения и инфарктом миокарда частота выявления аКЛ возрастала: уже у 17 чел. из 59 обследованных с гипертонической болезнью III стадии выявлен повышенный уровень аКЛ [5]. В этих случаях дифференциальная диагностика эссенциальной гипертонии и пролиферативной васкулопатии при АФС сложна даже при морфологическом исследовании нефробиоптата.
Почечная тромботическая и/или пролиферативная васкулопатия встречается и у беременных женщин, поэтому о ней необходимо подумать при дифференциальной диагностике артериальной гипертонии, обнаруживаемой при беременности [9,15].
Кроме того, в последнее время описаны случаи развития злокачественной артериальной ги-пертензии во время приема оральных контрацептивов с обнаружением антител к ДНК и аФЛ [9].
Поражение почечных вен, как правило, не сопровождается артериальной гипертонией, если только это не смешанный артериовенозный тромбоз.
Таким образом, говорить о какой-то определенной форме гипертензии, связанной с АФС, нельзя. Патофизиологические механизмы и морфогенез артериальной гипертонии при АФС не отличаются от таковых при других видах артериальной гипертонии. По пусковым механизмам артериальная гипертония при АФС относится к вторичной (симптоматической) и клинически определяется либо как вазоренальная в случае тромбоза почечных артерий, либо как ренопаренхиматозная при тромбозе артериол и капилляров почек, либо как эссенциальная при изолированной пролиферации эндотелия сосудов почек. При этом отсутствуют признаки гло-мерулонефрита и васкулита. Возраст пациентов, в которомдебютирует артериальная гипертония при АФС, как правило, моложе 40 лет. В этом случае антитела к фосфолипидам относятся к факторам риска, обусловливая имму-нологическую опосредованность развития артериальной гипертонии при АФС.
Для уточнения частоты встречаемости и характера артериальной гипертонии у нефро-логических больных с АФС мы провели исследование, целью которого явился анализ синдрома артериальной гипертонии у больных АФС.
Мы исследовали 76 пациентов с АФС. Диагноз АФС устанавливался согласно диагностическим критериям G.R.V. Hughes (1986) и основывался на основных и дополнительных клинических признаках АФС с обязательным присутствием лабораторных маркеров АФС (ВА и/ илиаКЛ)[13].
К основным клиническим признакам АФС отнесены рецидивирующие тромбозы (венозные/артериальные), привычное невынашива-ниебеременности,тромбоцитопения» 100000 в1 мкл)болеедвухраз.Кдополнительнымкли-ническим признакам АФС отнесены хронические язвы ног, сетчатое ливедо, неврологические нарушения (мигрень, эпилептиформный синдром, энцефалопатия), поражение клапанов сердца, асептические некрозы головок бедренных костей. Диагноз первичного АФС ставился при наличии у больного одного основного или двух и более дополнительных клинических признаков аФС в сочетании с обнаружением повышенных титров аКЛ или ВА.
Для диагностики вторичного АФС при СКВ использовались классификационные критерии, разработанные D.AIarcon-Segovia et а1. (1992). Они включали семь клинических признаков: венозный тромбоз, артериальный тромбоз, привычное невынашивание беременности, язвы ног, сетчатое ливедо, гемолитическая анемия, тромбоцитопения, — в присутствии среднего или высокого уровня аКЛ.
Среди исследованных нами больных были 9 (11,84%) мужчин и 67 (88,16%) женщин. Средний возраст составил 36,8 лет. Первичный АФС диагностирован у 52 чел. (68,42%), вторичный АФС — у 24 чел. (31,58%). Из больных с вторичным АФС 18 пациентов страдали системной красной волчанкой, удвухбольныхбыласистем-ная склеродермия. Еще по одному человеку с дерматомиозитом, криоглобулинемическим васкулитом, инфекционным эндокардитом и первичным амилоидозом также имели клинические признаки антифосфолипидного синдрома.
Артериальная гипертония выявлена у 40 (52,63%) пациентов. Она чаще соответствовала артериальной гипертонии второй стадии (АГ11), но разница не была статистически значимой (р>0,05).
Так как первичная патология почек может быть пусковым механизмом для развития артериальной гипертонии, для решения вопроса о непосредственной роли аФЛ в развитии артериальной гипертонии при АФС мы разделили исследуемую группу больных на две подгруппы. В первую подгруппу вошли 44 (57,89%) чел. с патологией почек. Вторая подгруппа включала 32 (42,11%) чел. без патологии почек.
Распределение первой подгруппы больных с клиническими признаками антифосфолипидного синдрома и патологией почек по нозологическим формам заболеваний почек представлено в табл. 1. Как видно, наиболее часто диагностировался тубулоинтерстициальный нефрит (р 0,05).
Таким образом, артериальная гипертония является частым синдромом, ассоциирующимся с антифосфолипидным синдромом, причем она чаще наблюдалась при сопутствующей патологии почек. Среди нозологических форм патологии почек у больных с АФС преобладал тубулоинтерстициальный нефрит. Тем не менее, артериальная гипертония второй стадии достоверно чаще регистрировалась при первичном и вторичном гломерулонефрите.
В целом, артериальная гипертония при антифосфолипидном синдроме, скорее всего, имеет почечное происхождение. Возможно, имеет смысл проводить диагностическую не-фробиопсию больным с антифосфолипидным синдромом и артериальной гипертонией, как с мочевым синдромом, так и без него, для выявления тромботической и/или пролиферативной микроангиопатии, так как назначение дезаггре-гантов и антикоагулянтов предупреждает повторные тромбозы и прогрессирование артериальной гипертонии, хронической почечной недостаточности. Требуются дальнейшие исследования по изучению роли антител к фос-фолипидам в патогенезе развития артериальной гипертонии как в рамках антифосфолипидного синдрома, так и без него.
Таблица 1. Распределение больных с анти-фосфолипидным синдромом и патологией почек по нозологическим формам болезней почек
Нозологические формы болезней почек
Количество больных
Артериальная гипертония. Факторы риска
Факторы, способствующие развитию гипертонии. Причины гипертонии
В развитие артериальное гипертонии участвует множество сложных механизмов, а сама болезнь может быть спровоцирована или усугублена множеством факторов. В этой статье мы познакомим читателя с основными механизмами развития артериальной гипертонии, а также расскажем о наиболее важных факторах, задействованных в развитии гипертонии.
Артериальная гипертония – это заболевание сердечно-сосудистой системы человека, которое характеризуется стойким повышением артериального давления и сопутствующими этому нарушениями работы внутренних органов. Причины развития артериальной гипертонии могут быть самыми различными. Ниже мы подробно рассмотрим формы артериальной гипертонии в зависимости от причин, вызвавших болезнь. Помимо факторов напрямую провоцирующих болезнь, существует множество факторов предрасполагающих к развитию артериальной гипертонии.
Причины возникновения артериальной гипертонии. Этиологическая классификация гипертонии
Этиология (причины развития) гипертонии может быть самой разнообразной. В зависимости от причин, вызвавших развитие артериальной гипертонии, различаем следующие формы болезни:
Классификация артериальной гипертонии
1. Гипертоническая болезнь (эссенциальная гипертония) – составляет 80% всех случаев гипертонии. Точные причины развития болезни не известны. В развитии болезни важную роль играют различные факторы внутренней и внешней среды.
2. Симптоматическая гипертония – возникает на фоне других болезней, при которых наблюдается нарушение механизма регуляции артериального давления.
a. Гемодинамическая артериальная гипертония – возникает вследствие нарушений циркуляции крови внутри сердца и по артериальным сосудам. Такой тип артериальной гипертонии встречается при атеросклерозе, при заболеваниях, характеризующихся поражением клапанного аппарата сердца и пр.
b. Нейрогенная артериальная гипертония – возникает вследствие нарушения нервных механизмов регуляции артериального давления. Встречает при таких болезнях как опухоли мозга, энцефалопатия при атеросклерозе и пр.
c. Эндокринная артериальная гипертония – развивается на фоне эндокринных болезней, при которых имеет место повышенное выделение гормонов, повышающих артериальное давление: болезнь Иценко-Кушинга (повышенное выделение кортикостероидных гормонов коры надпочечников), феохромоцитома (повышенное выделение адреналина и норадреналина), токсический зоб (повышенное выделение гормонов щитовидной железы), ренинома (повышенное выделение ренина).
d. Нефрогенная артериальная гипертония – наблюдается при различных болезнях почек, протекающих с разрушение почечной ткани или нарушениями циркуляции крови внутри почек (атеросклероз почечных артерий, гломерулонефрит, пиелонефрит, удаление почек).
e. Лекарственная артериальная гипертония – появляется на фоне приема медикаментов, вызывающих повышение артериального давления.
В развитие приведенных выше видов артериальной гипертонии (артериальной гипертензии) имеет место нарушение различных механизмов регуляции артериального давления, о которых мы говорили в статье «Что такое артериальное давление? ».
Гипертоническая болезнь (эссенциальная гипертония), как предполагается, развивается вследствие генетически обусловленного нарушения равновесия электролитов внутри клеток и во внеклеточной среде. Симптоматические виды артериальной гипертонии возникают из-за нарушения нейро-гуморальных механизмов регуляции артериального давления, которые имеют место на фоне различных болезней.
Факторы риска развития артериальной гипертонии
В развитии артериальной гипертонии (артериальной гипертензии) важную роль играют предрасполагающие факторы. Факторы, предрасполагающие к развитию артериальной гипертонии это различные условия внешней и внутренней среды. Эти условия повышают риск развития гипертонии посредством различных нарушений обмена веществ и изменений деятельности внутренних органов. Наиболее важными факторами развития гипертонии являются:
Возраст – риск развития гипертонии значительно повышается у людей старшего возраста, наибольшая заболеваемость артериальной гипертонией наблюдается у людей 45-60 лет.
Пол – у мужчин гипертония развивается несколько чаще, чем у женщин.
Вредные привычки – курение и злоупотребление алкоголем значительно повышают риск развития артериальной гипертонии.
Хронические болезни – риск развития артериальной гипертензии значительно выше у людей страдающих сахарным диабетом. хроническими заболеваниями почек, заболеваниями печени.
Ожирение – является одним из наиболее важных факторов риска развития артериальной гипертонии, ишемической болезни сердца, сахарного диабета 2 типа.
Несбалансированный образ жизни – неправильное питание и малоподвижный образ жизни способствуют возникновению первичных нарушений обмена веществ, которые затем приводят к развитию различных сердечно-сосудистых заболеваний, в том числе и артериальной гипертонии.
Хронический стресс – также является важным фактором развития артериальной гипертонии. Кроме заболеваний сердечно-сосудистой системы хронический стресс способствует возникновению таких патологий как язвенная болезнь желудка и двенадцатиперстной кишки, нарушения сна и пр.
Действуя одновременно и на протяжении длительного времени, описанные выше факторы действительно приводят к развитию артериальной гипертонии (и других болезней). Воздействие данных факторов на человека уже больного гипертонией способствует утяжелению развития болезни и повышает риск развития различных осложнений.
Устранение этих факторов, напротив, способствует излечению гипертонии или облегчению ее лечения.
Этиология, механизмы развития и основные клинические синдромы артериальной гипертонии.
Главная → Статьи доктору → Кардиология → Этиология, механизмы развития и основные клинические синдромы артериальной гипертонии.
Проблема АГ в нашей стране стала настолько острой, что привлекает внимание не только терапевтов, кардиологов, педиатров, но и правительства. Это заболевание в совокупности со своими сосудистыми осложнениями нарушает трудоспособность людей самого активного возраста, способствует инвалидизации больных, определяет более половины всех случаев смерти взрослого населения. Нас тревожит тот факт, что гипертония существенно помолодела и не является казуистической редкостью даже у детей и подростков. Так, по данным НИИ педиатрии и детской хирургии, в России в 1998-99 гг. отмечен рост сердечно-сосудистой патологии у детей и подростков на 60% и 70% соответственно. Распространенность АГ среди школьников в 2000 году составила от 12 до 18%.
Именно поэтому в данный момент проводится обсуждение федеральной программы "Профилактика артериальной гипертонии на 2002-2008 гг.".
Актуальность проблемы АГ в педиатрии обусловлена еще и широчайшими возможностями массовой профилактики заболевания в детской популяции, поскольку воспитать правильное, разумное отношение к своему здоровью, с самого раннего возраста привить навыки к регулярному активному движению неизмеримо легче и проще, чем искоренить вредные привычки или изменить стиль жизни у взрослого человека. Большой неисследованной областью является медикаментозное лечение детей и подростков, больных АГ, то есть использование сравнительно новых эффективных групп препаратов, которые широко внедряются в последнее время в терапевтическую практику, но не апробированы у детей и подростков.
Согласно определению ЭАГ или ГБ — это та форма артериальной гипертензии, при которой повышение АД изначально обусловлено функциональными причинами. В тех случаях, когда в основе болезни лежит органическая патология, гипертензивный синдром считают вторичным, устанавливают симптоматическую гипертонию.
В педиатрии нет утвержденной классификации АГ, но есть классификация уровней повышенного АД у детей разного возраста. Эта классификация, предложенная второй рабочей группой по контролю АД у детей в 1987 г. была принята ВОЗ и является тем ориентиром, который помогает нам в диагностике АГ. Она представлена в таблице. Выделены два уровня — умеренная и выраженная гипертензия. Цифры, расположенные в столбике под названием "умеренная гипертензия", превышают 95 перцентиль.
Причины повышения артериального давления у детей весьма многообразны. Но так же, как и у взрослых больных, вторичные АГ встречаются примерно в 10% случаев, а основные 90% — это больные эссенциальной гипертонией.
Среди факторов, способствующих формированию АГ, в первую очередь необходимо назвать наследственную предрасположенность. На сегодняшний день выделены гены, определяющие уровень ренина и ангиотензина, обеспечивающие образование А II из А I, мутации этих генов ассоциированы с эссенциальной гипертонией, повышением содержания ангиотензиногена в плазме крови. Известно, что генетически детерминированы дефекты мембран вызывающие повышенную солевую чувствительность, нарушенная толерантность к углеводам, повышенная адренергическая реактивность и нарушения липидного обмена и т.д. Каждый из этих генов создает лишь умеренное предрасположение к гипертонии, различные комбинации генных вариантов в разной степени нарушают адаптивность отдельных индивидов и снижают приспособляемость популяции в целом. То есть чем больше патологических аллелей сочетается в организме, чем выраженнее экспрессия гена, тем раньше возникает и тяжелее протекает АГ.
Давным-давно, когда человечество жило в условиях постоянного избытка дикорастущих плодов и витаминсодержащих растений, был утрачен ген, позволяющий синтезировать аскорбиновую кислоту (который, кстати, широко представлен у остальных представителей класса млекопитающих). Тогда же укрепилась система выведения излишков калия и сохранения в организме вечно дефицитного натрия, будущей поваренной соли. Многие тысячи лет люди не страдали от маленького дефекта генофонда, который стал всеобщим, так как витамина С было вдоволь во всякой пище. Но условия жизни изменились, и утрата гена проявилась клинически: появилась жесточайшая цинга, от которой страдали прежде всего моряки, уходившие в дальние плавания. Цинга сопровождалась перикардитами и тампонадой сердца. В Англии в ХVIII веке в рацион моряков ввели квашеную капусту и лимоны, и за одно столетие страна стала крупнейшей морской державой. Этот пример очень наглядно демонстрирует нам, как особенности человеческого генофонда при изменяющихся условий жизни становятся очень опасными.
Наследственно же закрепленные механизмы форсированной экскреции калия и сохранения натрия стали неадекватными тогда, когда поваренная соль оказалась у человечества в достатке и проявила себя лучшим консервантом, а фрукты и овощи стали роскошью на столе многих народов, перемещавшихся на северные территории. Правда, только в середине ХХ века избыточное потребление соли стали относить к факторам риска АГ.
Безусловно, наследственный фактор играет большую роль в возникновении гипертоний. Это доказывают клинико-генетические исследования, которые выявляют 100% общность генов у однояйцевых близнецов, 50% — у родственников I степени (родители, дети, братья, сестры), 25% — у родственников II степени (бабушки, дедушки, дяди, тети, племянники, внуки) и 12,5% общность генов при III степени родства (у двоюродных сибсов).
Однако наследственная предрасположенность не является предопределенностью, то есть заложенная программа возможного развития АГ может не реализоваться никогда. Это доказывает тот факт, что народы нецивилизованных стран Африки, Новой Гвинеи, имея те же генетические дефекты, что и население цивилизованных стран, не страдают гипертонией. Зато эмигранты этих же стран, переезжая в цивилизованные государства, болеют чаще и тяжелее коренных жителей.
Это означает, что остаются открытыми возможности профилактики АГ даже у людей с отягощенной наследственностью. И это подводит нас к центральной причине развития пандемии гипертонической болезни во второй половине ХХ века. Что же заставляет заболевать людей? Очевидно, что к развитию болезни приводят такие внешние воздействия и отступления от биологически запрограммированного образа жизни, которые нарушают стабильность системы кровообращения. Этих факторов несколько, и коренным является недостаток физической активности — гиподинамия. Еще полвека назад движение было тяжелым, но обязательным условием труда. А для сердечно-сосудистой системы оно было фактором, тренирующим защитные адаптивные механизмы. Стремительная научно-техническая революция ХХ века освободила нас от тяжелого труда, обеспечила комфорт и нарушила естественную систему контроля за деятельностью кровообращения. Причем с возрастом двигательная недогруженность имеет тенденцию к накоплению.
Совершенно точно известно, что для формирования функций и навыков у человека существует определенный возрастной период. Так, если ребенок до 3-5 лет не слышал человеческой речи — он не заговорит никогда. А для того чтобы воспитать музыканта или спортсмена, нужно начать обучение ребенка не позже 7-8 лет. То есть отсутствие запроса в период "уточнения программы" у младенца, одностороннее развитие ребенка, нетренированность подростка формируют приобретенный дефицит возможностей. Учитывая сложившуюся ситуацию с гипертонией в нашем обществе, становится очевидным то, что школьная программа по физической подготовке безнадежно устарела и требует немедленного пересмотра, а в детских дошкольных учреждениях практически отсутствует.
К гиподинамии тесно примыкают и другие факторы риска, подчеркивая ее ведущее значение. Мы вернемся к генетически запрограммированному механизму сохранения в организме натрия, который был дефицитом сотни тысяч лет. Почему избыток натрия в нашем рационе приобрел значение лишь к середине ХХ века? В то время, когда человек трудился "в поте лица своего", кожа брала на себя часть функции по выведению избытка натрия, разгружая почки. С того момента, как гиподинамия стала непременным спутником цивилизованного общества, этот механизм был утрачен. У 60% солевая нагрузка легко выявляет компенсированную до этого недостаточность экскреторной способности почек и запускает "объемный" механизм повышения АД.
Следующими важными факторами, тесно связанным с гиподинамией, являются ожирение, гиперлипидемии, нарушение толерантности к углеводам. Сегодня известно, что объем физических нагрузок и масса тела оказываются обратно пропорциональными, и многим гипертоникам достаточно похудеть, чтобы обеспечить нормализацию АД без лекарств. Получены прямые данные, что физическая нагрузка приводит к снижению атерогенных фракций липопротеидов и повышает толерантность к сахарам. Бег, ходьба на лыжах, плавание и другие интенсивные нагрузки увеличивают кровоток в регионарных мышцах в 20 раз по сравнению с покоем, нагрузки стимулируют активность липопротеидлипазы в мышцах и жировой ткани и приводят к значительному снижению содержания триглицеридов, общего холестерина ЛПНП и повышению фракции ЛПВП.
Далее в ряду факторов риска следуют отрицательные эмоции и стрессовые ситуации, переутомление, курение, иммунологические конфликты, хроническая алкоголизация.
Уровень АД в организме обеспечивается периферическим сопротивлением сосудов, состоянием сосудистой стенки, насосной функцией сердца и объемом циркулирующей крови. Регуляция соотношения этих четырех факторов представлена нервным и гуморальным звеньями, и у здорового человека вазопрессорные влияния уравновешены вазодилатирующими. Это не означает, что в физиологических условиях АД не выходит за пределы установленных возрастных нормативов. Система кровообращения мобильна, она обеспечивает нашу адаптацию к различным ситуациям, и прежде всего к физической деятельности. Однако у здоровых людей подъемы АД не бывают чрезмерными, и они самостоятельно и в короткий период времени возвращаются к исходному уровню. А у здоровых тренированных людей этот уровень оказывается существенно ниже, чем у нетренированных, и феномен "спортивной гипотонии" обеспечивает системе кровообращения спортсмена более высокие функциональные резервы и большую экономичность деятельности.
Механизм развития АГ сложен и многогранен, имеет несколько основных звеньев.
Поскольку основной точкой приложения от начала заболевания и до конца являются артерии, мы начнем обсуждать патогенез АГ с тех структурно-функциональных изменений, которые происходят в сосудистой стенке. По современным представлениям, ключевая роль в динамике состояния сосудистой стенки принадлежит эндотелию — внутреннему слою сосудов. Благодаря исследованиям последних лет выяснилось, что эндотелий служит важнейшим регулятором сосудистых функций. По выражению Е. Е. Гогина, "дирижером местного кровообращения". Эндотелиоциты обладают механосенсорами, которые смещаются по течению крови. Этот феномен получил название напряжения сдвига, степень которого зависит от объемной скорости кровотока, вязкости крови и внутреннего радиуса сосуда. С помощью механосенсоров эндотелий изменяет толщину внутреннего слоя сосуда, массу его мышечной оболочки и гасит, смягчает перепады АД, которые реализуют нейрогуморальные механизмы в интересах конкретного органа или мышечной группы.
Запас прочности у системы саморегуляции местного кровообращения достаточно велик, и она защищает организм от гипертонии даже при частых подъемах АД.
Тем не менее наступает момент, когда в результате слишком частых сосудосуживающих ответов происходит утолщение стенки резистивных сосудов в целях ограничения местной перфузии с учетом потребности органов и тканей. Утолщение стенки артерий рассматривается как ее моделирование, влекущее за собой повышение периферического сопротивления даже при нормальном тонусе гладкой мускулатуры.
Второй важной составляющей в повышении периферического сопротивления являются атеросклеротические изменения интимы сосудов. В качестве повреждающих факторов в первую очередь выступают гемодинамические. Атеросклеротические бляшки располагаются в устьях и в начальных отрезках артерий, отходящих от аорты. На участках спокойного кровотока эндотелий не поврежден, а там, где создается перепад гидростатического давления, кровоток становится турбулентным, и клетки эндотелия располагаются все более хаотично, меняют форму и размеры. Подобные изменения гомогенности эндотелиального покрова аорты и ее крупных ветвей выявляются уже у детей 3-5 лет.
Местное кровообращение управляется также тканевыми метаболитами по механизму обратной связи. Установлено, что эндотелиальные клетки вырабатывают эндотелий-зависимый релаксирующий фактор (ЭРФ), физиологически снижающий тонус сосуда и вазоконстрикторные вещества, из которых самым активным является эндотелин. В условиях повышения АД, гипоксии, гиперлипидемии и сахарного диабета биохимия эдотелиальной клетки нарушается и продукция ЭРФ снижается, а эндотелина и других вазоконстрикторов — нарастает, способствуя гипертрофии стенки артерий.
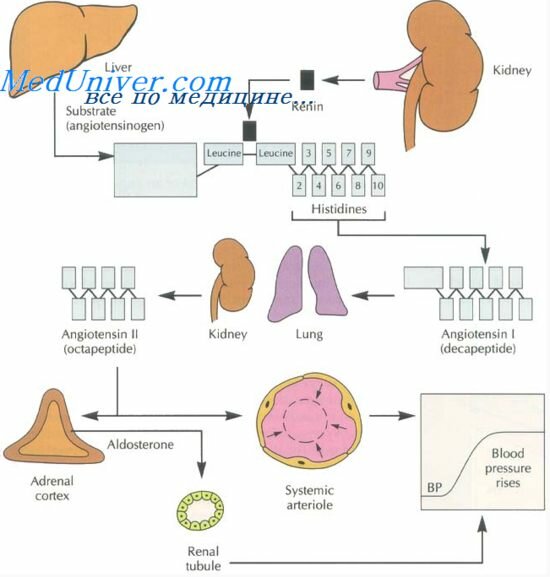
С самых ранних этапов гипертонии в механизмах ее формирования принимают участие почки посредством РААС и регуляции водно-солевого баланса. Неспособность почки адекватно выводить соль или избыточное потребление соли может вызвать объемозависимую гипертонию с увеличенным сердечным выбросом и нормальным периферическим сопротивлением. Следом за увеличением объема циркулирующей крови нарастают внутриклеточные концентрации натрия и кальция, которые, в свою очередь, повышают реактивность гладких мышц сосудистой стенки.
Интересно то, что почка не только является участником формирования гипертонии, но и ее жертвой. Условия и объем клубочковой фильтрации зависят от системного АД (то есть величины кровотока и перфузионного давления) и тонуса афферентных и эфферентных артерий клубочка. Поэтому объем фильтрации прямо пропорционален среднегемодинамическому АД. Нормальный уровень фильтрации у взрослых соответствует АД 90 мм рт. ст. при АД 50 он падает, отражая почечный компонент коллапса. А при повышении АД он должен возрастать в несколько раз. Тем не менее таких грубых потерь воды и солей не происходит благодаря тому, что почка перестраивается структурно и функционально на новый режим фильтрации. Это помогает избежать неадекватного диуреза, но закрепляет АГ и с течением времени вызывает рабочую гипертрофию мышечного слоя почечных артерий, утолщение интимы, сморщивание капилляров клубочка, диффузный склероз интерстициальной ткани и гибель клеток мозгового слоя почки, синтезирующих простагландины — мощные эндогенные вазодилататоры.
Очень сложным оказалось взаимодействие отдельных звеньев РААС и участие в патогенезе АГ. У одних больных гипертония носит гипер-, у других гипоренинный характер, у большинства показатели ренина в пределах нормы. Причем эти различия не рассматриваются в качестве разных вариантов гипертонии, а скорее квалифицируются как разные фазы течения болезни.
Неотъемлемым звеном патогенеза АГ является генетически детерминированный дефект плазматических мембран, который сопровождается нарушением транспорта одновалентных катионов натрия, кальция и калия. Именно он приводит к перестройке мембран клеток, вызывая клеточный ресетинг, и опосредует накопление кальция в гладкомышечных клетках сосудистых стенок, нарушение его внутриклеточного перераспределения, а также вызывает активизацию симпатической нервной системы, усиление кортикостероидной функции надпочечников, гиперинсулинемию и другие изменения нейрогуморальной регуляции. В конечном итоге формируется гипертрофия сосудистой стенки и повышение тонуса сосудов.
Одним из наиболее изученных механизмов, участвующих в АГ, является нарушение нейрогуморальной регуляции сосудистого тонуса. Вегетативная нервная система обеспечивает регуляцию системного кровообращения, согласованность местных и общих сосудистых реакций в покое и в условиях мобилизации организма при мышечной деятельности и эмоциональных нагрузках. Активное участие в адаптации к разным ситуациям принимает симпато-адреналовая система, антидиуретический гормон, предсердный натрийуретический фактор (ПНУФ), адренокортикотропный гормон.
У больных АГ отмечается преобладание симпатического звена вегетативной нервной системы. Концентрации циркулирующих катехоламинов повышаются не часто, но отмечаются увеличения количества и/или чувствительности адренорецепторов, нарушения метаболизма норадреналина в синаптической щели и чрезмерное его депонирование, а также вследствие снижения парасимпатического контроля.
Гипотеза Г.Ф. Ланга о том, что в основе гипертонической болезни лежит "невроз высших центров регуляции", была очень популярной. Но научные исследования последних 40 лет установили, что при гипертонии организатором патологического процесса является вовсе не ЦНС, а множество механизмов, регулирующих местные сосудистые реакции, когда нарушается их оптимальное соотношение или не обеспечивается адекватная адаптация к запросу. Роль ЦНС в патогенезе сводится к тому, что ее влияния недостаточно, чтобы восстановить адекватность сердечно-сосудистых реакций. То есть ЦНС осуществляет только высший уровень координации кровообращения, эндокринная система выступает в качестве посредника между центральной регуляцией и местным сосудистым руслом. Конечный результат целиком зависит от состояния исполнительных органов, которые в достаточной мере сохраняют свою автономность. Так, сердце не только моделирует свой рабочий уровень и минутный объем кровообращения, но и располагает ПНУФ, влияющим на почки. Почки помимо обеспечения водно-электролитного баланса выступают спонсором внепочечного аппарата мощной ренин-ангиотенз-альдостероновой системы. Все эти механизмы, взаимодействуя друг с другом, выступают как патогенетические звенья в формировании АГ в отличие от монофакторных симптоматических гипертоний.
Клиника АГ. В научно-популярных публикациях АГ называют "тихим убийцей". Часто пациенты в дебюте заболевания совсем не предъявляют жалоб, поэтому повышенное АД у них выявляется случайно. Субъективные ощущения появляются уже у больных с солидным стажем заболевания в виде гипертонического криза или сосудистых осложнений. У некоторой части больных жалобы ограничиваются периодически возникающей головной болью. Иногда отмечаются повышенная утомляемость, раздражительность, нарушения сна, выраженная эмоциональная лабильность, неустойчивость к психологическому стрессу; а также тяжесть в голове (особенно по утрам), головокружения, метеозависимость, неприятные ощущения или боли в области сердца.
Поскольку мы знаем, что основное поле битвы при гипертонии — это сосуды русла микроциркуляции, становится понятно, что ранние клинические симптомы следует искать именно там. Наиболее доступной, удобной и информативной оказалась оценка конъюнктивы глазного яблока и офтальмоскопия — исследование глазного дна. Методика микроскопии сосудов конъюнктивы гораздо проще, чем осмотр глазного дна, и специалисты считают ее более предпочтительной, особенно на ранних этапах развития АГ. Кроме того, изменения сосудов конъюнктивы нередко обнаруживаются раньше, чем патология сосудов глазного дна. Состояние тонуса сосудов определяют по соотношению диаметров артериол и венул. У больных АГ 1 стадии (то есть нестабильной) отмечается уменьшение соотношения диаметров артериол и венул от 1:1,5 _1:2 у здоровых людей до 1:3 — 1:4 в 50% случаев.
По мере прогрессирования гипертонии усугубляются изменения сосудистой стенки: артериоловенулярное соотношение составляет уже 1:5 — 1:6. Следом отмечаются сужение и неравномерность калибра артерий в связи с ангиоспазмом и начинающимися склеротическими изменениями. На фоне общей дилатации венул отмечаются локальные ампулообразные аневризматические их расширения. В микрососудах конъюнктивы происходит замедление кровотока, агрегация эритроцитов, иногда встречаются зоны ишемии вследствие облитерации капилляров и микрогеморрагии. У детей и подростков гипертензивная микроангиопатия характеризуется повышением периферического сопротивления и сопровождается усилением пульсового толчка.
Не потеряла своего диагностического значения и широко используется в диагностике АГ офтальмоскопия глазного дна. Сокращенные артериолы сетчатки создают иногда световой рефлекс и выглядят узкими белыми или желтоватыми поблескивающими полосками, описывается симптом "серебряной проволоки" или "медной проволоки". Наличие этих признаков дает право окулисту диагностировать гипертоническую ретинопатию.
Изменения сосудов на глазном дне имеют тесную корреляцию с состоянием церебральных сосудов. И наиболее грозными симптомами, определяющими неблагоприятный прогноз, являются отек соска зрительного нерва и ишемия.
Важнейшим органом-мишенью АГ является сердце. Его трансформацию в течение болезни называют ремоделированием. Поскольку основным фактором, воздействующим на сердце в начале заболевания, является увеличивающаяся преднагрузка (так как повышение сопротивления сосудов еще не сформировалось, а увеличение объема циркулирующей крови обеспечивает повышенный венозный приток) — самыми первыми появляются симптомы диастолической дисфункции ЛЖ. Они возникают раньше нарушения систолы.
Изучение диастолической функции сердца стало возможным в последние 20 лет благодаря использованию допплер-эхокардиографии. Расслабление желудочков — это активный энергозависимый процесс, который заканчивается примерно к середине диастолы. Основным показателем, определяющим величину сердечного выброса, является диастолическое наполнение левого желудочка. Поступающая в ЛЖ кровь заполняет его на 60-80% уже в первую треть диастолы (фаза быстрого наполнения). ЛЖ заполняется, даже если давление в ЛП равно нулю — за счет присасывающей силы эластических элементов стенки желудочка, сжатых во время систолы. Раннее наполнение заканчивается, когда уравниваются давление в предсердиях и желудочках. С этого момента наступает медленная фаза диастолы. В систолу предсердий вновь возникает градиент давления, и желудочки дозаполняются (приблизительно на 25%), возрастает давление в желудочке и его объем (КДД и КДО). Соотношение КДО И КДД отражает податливость стенки ЛЖ. Чем давление выше, тем ЛЖ жестче. Оценивают также начально-диастолическую (волна Е) и конечно-диастолическую (волна А) скорость трансмитрального кровотока. У больных АГ обнаружено снижение волны Е, что указывает на нарушение диастолической функции, повышение волны А и соотношение А к Е. То есть усиленная предсердная сократимость не может полностью компенсировать уменьшение раннего диастолического заполнения, вызванного нарастающей гипертрофией и повышением жесткости стенок ЛЖ. Эти симптомы появляются даже при отсутствии гипертрофии ЛЖ. По мере прогрессирования заболевания, формирования структурно-функциональных изменений сосудистой стенки вступает следующий патогенетический фактор — повышение постнагрузки, то есть ЛЖ вынужден теперь преодолевать сопротивление резистивных сосудов. В результате развивается один из основных симптомов поражения сердца — гипертрофия ЛЖ. Исследования сердца у детей, родители которых страдают АГ, выявили, что 40% детей с повышением уровня АД имеют ГЛЖ. Степень ГЛЖ тесно коррелирует с избыточной массой тела, но не всегда соответствует степени повышения АД, гипертрофии ЛЖ. На фоне ГЛЖ могут появиться ишемия отдельных участков миокарда, коронарная недостаточность, нарушения проводимости электрического импульса.
В качестве органа-мишени при АГ выступает и почка.
К ранним маркерам поражения почек относят микроальбуминурию (экскрецию альбумина с мочой), b2-микроглобулинурию, скрытую гиперфильтрацию. К поздним симптомам — транзиторную, а затем постоянную протеинурию; нарушение концентрационной функции почек, определяемой по снижению относительной плотности мочи и никтурии; увеличение креатинина крови, снижение скорости клубочковой фильтрации по клиренсу эндогенного креатинина.
Таким образом, прогрессивные научные изыскания последних 40 лет открыли происхождение эссенциальной АГ и расшифровали закономерности ее развития. Достигнуты убедительные успехи в профилактике и лечении АГ у взрослых. В настоящее время благодаря активной деятельности Всемирной организации здравоохранения, Международного общества по изучению артериальной гипертонии, Всероссийского научного общества кардиологов врачи-терапевты располагают реальными возможностями для снижения смертности взрослого населения России от сосудистых осложнений АГ.
Остаются недостаточно изученными особенности возникновения и течения заболевания у детей и подростков; обращает внимание малочисленность научных трудов, посвященных проблеме АГ в детском возрасте. Между тем актуальность вопросов выявления, лечения и профилактики АГ у детей и подростков ни у кого не вызывает сомнений. Все это убеждает авторов принять активное участие в работе региональной программы по выявлению, лечению и профилактике АГ среди детского населения Красноярского края и обеспечить решение практических задач программы, опираясь на результаты комплексного научного исследования.