Главная
Классификация врожденных пороков сердца
Классификация врожденных пороков сердца затруднена в связи с большим количеством их форм и разновидностей, а также с очень частым сочетанием различных пороков друг с другом, что предопределяет различные гемодинамические режимы функционирования системы кровообращения, а следовательно и клинические проявления пороков. Тем не менее все предлагаемые клинические и хирургические классификации разработаны, исходя из таких наиболее гемодинамически важных и клинически манифестных показателей, как характер нарушения кровотока в малом кругу кровообращения, направление шунта (сброса) крови, наличие цианоза, выраженность легочной гипертензии, степень недостаточности кровообращения.
В педиатрической практике наиболее удобна классификация Marder (1957), в основу которой положены характеристика кровотока в малом кругу кровообращения и наличие цианоза. Эту классификацию с некоторыми дополнениями можно использовать в первичной клинической диагностике врожденных пороков сердца на основании общеклинических методов исследования (анамнез, физикальное обследование, электрокардиография, фонокардиография, эхокардиография, рентгенография). Ниже представлена классификация врожденных пороков сердца.
общий артериальный ствол, единственный желудочек сердца
Дистрофия
Анемия
Рецидивирующая пневмония
Инфекционный эндокардит
Тромбоэмболический синдром
Нарушения ритма и проводимости
Более 50—60% пороков относятся к врожденным порокам сердца с обогащением (гиперволемией) малого круга кровообращения, протекающим преимущественно без цианоза и с артериовенозным шунтом (сбросом) крови в малом кругу кровообращения.
Для всех этих пороков характерны общие патогенетические закономерности:
1) величина сброса крови через дефект определяется размером сообщения и соотношением сосудистых сопротивлений обоих кругов кровообращения, т. е. чем значительнее величина дефекта и выше разница давления между аортой и легочной артерией, тем больше величина артериовенозного (лево-правого) шунта и выраженнее гиперволемия малого круга кровообращения;
2) развивающиеся с течением времени под влиянием повышенного легочного кровотока и высокого давления вторичные склеротические изменения легочных сосудов ведут к резкому увеличению легочно-сосудистого сопротивления, выравниванию разницы между давлением в легочной артерии и аорте и извращению направления сброса крови («смене шунта»), который становится веноартериальным (право-левым). Смена шунта проявляется возникновением вначале транзиторного цианоза (при задержке дыхания, физической нагрузке, крике, беспокойстве, сосании, плаче, спастическом кашле, дефекации и др.), а затем и постоянного цианоза, который служит клиническим эквивалентом (маркером) легочной гипертензии у пациента с врожденным пороком сердца бледного типа.
Оценка характера гемодинамики в малом кругу кровообращения и степени легочной гипертензии крайне важна. Умеренная легочная гипертензия чревата такими частыми осложнениями, как хроническая или рецидивирующая пневмония. Выраженная легочная гипертензия, увеличивая сопротивление выбросу крови, и, следовательно, являясь причиной гипертрофии и систолической перегрузки правых отделов сердца, ухудшает эффективность операционной коррекции порока и повышает послеоперационную летальность. При легочной гипертензии высокой степени наряду с колоссальной систолической перегрузкой правых отделов сердца появляется и постепенно увеличивается веноартериальный сброс крови через дефект в аорту и, несмотря на появление цианоза, это уменьшает нагрузку на правые отделы сердца и частично разгружает малый круг кровообращения. В данной ситуации хирургическое закрытие дефекта быстро устраняет этот «предохранительный клапан», и правому желудочку приходится выбрасывать весь ударный объем крови против высокого сопротивления в легочной артерии. Поэтому в остро возникшей новой гемодинамической ситуации правые отделы сердца оказываются не в состоянии справиться с возросшей нагрузкой и развивается послеоперационная острая правожелудочковая недостаточность, которая грозит летальным исходом. Кроме более высокого риска острой послеоперационной летальности, выраженная легочная гипертензия ухудшает и пролонгированное послеоперационное течение и реабилитацию больных.
Причины легочной гипертензии:
1) длительный хронический бронхолегочный процесс (хроническая пневмония, хроническая обструктивная болезнь легких, хроническая эмфизема легких, бронхоэктатическая болезнь и др.), при котором пневмосклероз сопровождается запустеванием и облитерацией сосудов малого круга кровообращения;
2) длительно существующая хроническая сердечная недостаточность (митральные и аортальные пороки сердца, кардиомиопатии и др.) с длительным венозным застоем в МКК (венозная или застойная гипертензия);
3) длительное артериовенозное шунтирование крови при врожденном пороке сердца с обогащением малого круга кровообращения (гиперкинетически-гиперволемическая или артериальная прека-пиллярная легочная гипертензия);
4) первичная (идиопатическая) легочная гипертензия неизвестной этиологии или болезнь Аэрза (Ayerza) (1901), встречающаяся очень редко (0,25— 3% случаев) и вызванная стойким утолщением и фиброзным перерождением стенок артерий среднего и мелкого калибра и их облитерацией, что у детей раннего возраста («врожденная форма», «эмбрионально-гиперплакстическая», «врожденный комплекс Эйзенменгера») связывают с задержкой фетального развития сосудов легких, сохраняющих внутриутробный тип строения, а у взрослых — с прогрессирующим общим склерозом, болезнью Рейно, рецидивирующими множественными тромбозами мелких сосудов легких, неспецифическим воспалением токсического или аллергического характера и др.
У детей, страдающих врожденным пороком сердца с обогащением малого круга кровообращения, формирование легочной гипертензии проходит три основных фазы:
1) гиперволемическую;
2) смешанную;
3) склеротическую.
Для гиперволемической фазы характерны большой артериовенозный сброс в малый круг кровообращения, гиперволемия сосудов легких, в ответ на которую возникает незначительный защитный спазм сосудов, без увеличения общелегочного сопротивления. Давление в легочной артерии остается нормальным или умеренно возрастает. Необходимо отметить, что малый круг кровообращения обладает колоссальной депонирующей способностью и увеличение кровотока даже в 2—3 раза может не сопровождаться существенным повышением давления в легочной артерии.
Для смешанной фазы характерно защитное повышение давления в системе легочной артерии, вызванное спазмом сосудов легких. За счет этого механизма уменьшается величина артериовенозного сброса крови при увеличении общелегочного сопротивления кровотоку. Данная гипертензия является функциональной, т. е. обусловлена в основном гиперволемией и повышением тонуса сосудистой стенки за счет вазоконстрикции и гипертрофии средней оболочки мелких мышечных артерий. После успешной хирургической коррекции порока давление в легочной артерии у большинства пациентов почти полностью нормализуется.
Для склеротической фазы характерны деструктивные изменения сосудистой стенки, когда на фоне гипертрофии средней оболочки мелких мышечных артерий наступает склероз внутренней оболочки с последующим истончением стенки артерий их генерализованной дилатацией и развитием некротизирующего артериита. В склеротической фазе отмечаются высокая необратимая легочная гипертензия, расширение легочной артерии, стойкий цианоз и выраженная гипертрофия с систолической перегрузкой правых отделов сердца, часто с проявлениями хронической правожелудочковой недостаточности, т. е. с развитием вторичного комплекса Эйзенменгера.
Выделение стадий легочной гипертензии имеет чрезвычайно большое практическое значение, ибо помогает определять тактику консервативного ведения больного, уточнить рациональные сроки оперативного вмешательства, прогнозировать результаты хирургической коррекции (процент послеоперационной летальности), характер реабилитации и качество жизни, продолжительность жизни пациентов и др.
В.И.Бураковским и соавт. (1975) создана клиническая классификация легочной гипертензии (ЛГ), основанная на показателях процентного отношения величины систолического давления влегочной артерии к величине системного артериального давления (систолическое артериальное давление легочной артерии/систолическое артериальное давление аорты, %), процентного отношения величины артериовенозного сброса крови через дефект к величине минутного объема крови М КК, процентного отношения величины общего легочного сосудистого сопротивления к величине системного периферического сопротивления (см. таблицу).
Классификация легочной гипертензии
Стадия гипертензии
Отношение систолического давления
Врожденные пороки сердца (ВПС). Классификация ВПС. Открытый артериальный проток
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
РЕФЕРАТ
На тему:
« Врожденные пороки сердца (ВПС). Классификация ВПС. Открытый артериальный проток »
МИНСК, 2008
В большинстве случаев диагноз порока сердца можно поставить на основании анамнеза и результатов физикального исследования с последующим подтверждением полученных данных и уточнением количественных показателей с помощью выбранных неинвазивных и инвазивных методов. Количественные показатели позволяют оценить, прежде всего, состояние насосной функции сердца, которая может быть нарушена у этой категории больных.
Для диагностики пороков сердца традиционно используется электрокардиография (ЭКГ), данные которой позволяют в определенной мере оценить гипертрофию миокарда тех или иных отделов сердца, выявить признаки ишемических и дистрофических изменений миокарда, нарушения проводимости и ритма.
При анализе фронтальных и боковых (реже косых) рентгенограмм грудной клетки необходимо оценивать размеры и форму сердечной тени, а также состояние сосудистого рисунка легких.
В настоящее время эхокардиография (ЭхоКГ) является основным методом диагностики пороков сердца и предназначена для:
диагностики и определения степени структурного поражения клапанов сердца;
определения размеров камер сердца, функционального состояния миокарда желудочков и нарушений внутрисердечной гемодинамики;
динамического наблюдения за пациентами с установленным диагнозом;
динамического наблюдения за пациентками с пороками сердца при наличии беременности;
интраоперационного и послеоперационного контроля коррекции пороков сердца и внутрисердечной гемодинамики.
Как правило, используют три основных режима ЭхоКГ — одномерный (М), двухмерный (В) и допплеровский (D), которые взаимно дополняют друг друга и должны применяться в комплексе. Разработан, по пока редко применяется трехмерный режим ЭхоКГ. Кроме этого выделяют спектральную допплеровскую, цветную допплеровскую, контрастную и чреспищеводную ЭхоКГ. Дополнительным источником информации может слу-жить стресс-ЭхоКГ (нагрузочная или фармакологическая), позволяющая оценить функциональный резерв миокарда ЛЖ.
Для визуализации внутренних структур сердца с помощью одномерной и двухмерной ЭхоКГ используют импульсный отраженный ультразвук. Одномерная ЭхоКГ способна показать быстрые движения различных структур сердца, прежде всего клапанов. Двухмерная ЭхоКГ позволяет получить изображение сердца в разрезе и визуально оценить его внутреннее строение. В основе D-режима лежит так называемый эффект Допплера — измерение разницы между частотой исходящих и отраженных волн, зависящей от скорости и направления перемещения объекта или частиц. При спектральном и цветном допплеровском исследовании регистрируют ультразвуковые сигналы, отраженные от крови, движущейся в сердце и сосудах, и тем самым отображающие движение потоков крови внутри сердца. Используют импульсный, непрерывный и цветной допплеровский режимы. Цветная допплер-ЭхоКГ представляет собой по существу двухмерный допплеровский метод, в котором применено кодирование сигнала в цвете, что позволяет выявить направление потока. При контрастной ЭхоКГ в кровь вводят жидкость с взвешенными в ней мельчайшими пузырьками, которые создают множество отражений эхосигнала и тем самым контрастируют полости сердца и сосуды.
Легкие, ребра, мышцы и жировая клетчатка нередко затрудняют проведение ЭхоКГ исследования. Чреспищеводная эхокар-диография (ЧП-ЭхоКГ) имеет значительно более высокую разрешающую способность и носит полуинвазивный характер.
Трансторакалыюе эхокардиографическое исследование сердца обычно начинают из левой парастернальной области, установив датчик в зоне абсолютной сердечной тупости УЗ-плоскостью вдоль продольной оси сердца. Экранное изображение позволяет оценить, прежде всего, левые отделы сердца, основание аорты, аортальный и митральный клапаны. Парастерналыюе поперечное сечение на уровне аорты позволяет наблюдать «рассеченную» поперек аорту и все три полулуния аортального клапана, которые во время систолы прижимаются к стенке аорты, а во время диастолы смыкаются в центре. Исследование в режиме Допплера из парастериального доступа позволяет оценить сопутствующую недостаточность и рассчитать по скорости аортального кровотока систолический градиент на клапане. Аналогично можно «рассечь» в поперечной плоскости митральный клапан и рассчитать диастолический градиент на нем.
ЭхоКГ позволяет оценить состояние всех полостей сердца, измерить толщину стенки и размеры полости ЛЖ и ПЖ в различные фазы сердечного цикла. Допплеровские методы исследования дают информацию о таких показателях гемодинамики, как величины минутного и ударного объемов, давление в сердечных полостях, направление и характер кровотока.
Катетеризация сердца и коронарография показаны пациентам:
с клапанными пороками сердца, требующими оперативного лечения, в возрасте старше 40-45 лет для оценки состояния коронарного русла;
с целью уточнения показаний к операции в случаях расхождения между клиническими данными и данными неинвазивных методов исследования (прежде всего ЭхоКГ).
Обычно во время катетеризации измеряют давление в полостях сердца и крупных сосудах, регистрируют кривые пульсового давления и градиенты на клапанах. При снижении насосной функции сердца одним из самых ранних признаков недостаточности миокарда может быть повышение конечно-диастолического давления (КДД) до величин > 12 мм рт. ст. в ЛЖ или > 8 мм рт. ст. в ПЖ. Измерение диастолического давления в Л Ж в сочетании с точными данными об объеме этой полости позволяет определить податливость ЛЖ. Без показателей объема ЛЖ причина колебаний давления в нем остается неясной. Киноангиокардиография (КАКГ) полезна для оценки объема, подвижности стенок и производительности ЛЖ. Одно- или двухплоскостная КАКГ позволяет рассчитать, конечно-систолический (КСО) и конечно-диастоличсский (КДО) объемы желудочка и величину фракции выброса (ФВ). Разность между КСО и КДО составляет систолический объем (СО), а отношение СО/КДО соответствует фракции выброса. У здорового человека в покое сердце изгоняет при каждой систоле 50-60% конечно-диастолического объема КАКГ также позволяет определить степень регургитации на клапанах сердца.
Из радиоизотопных методов оценки наиболее полную информацию о сократительной способности миокарда позволяет получить равновесная вентрикулография (используются эритроциты, меченые Тс99m; серийная сцинтиграфия сердца, синхронизированная с зубцом R ЭКГ больного и компьютерная обработка изображений). Компьютер выдает результат в виде динамически изменяющегося изображения, аналогичного сокращающемуся сердцу. Этот метод позволяет получить множество количественных показателей, характеризующих функцию обоих желудочков, включая ФВ, скорости изгнания и наполнения, объем ЛЖ и показатели относительной перегрузки объемом желудочков. У больных с клапанными пороками исследование в покое и при физической нагрузке чаще всего проводятся при патологии, ведущей к перегрузке ЛЖ объемом. При недостаточности аортального клапана падение ФВ покоя до патологического уровня или отсутствие роста ФВ во время нагрузки является признаком ухудшения функции сердца и может служить показанием к замене клапана. Другие радиоизотопные методы используются значительно реже.
Компьютерная томография (КТ) может быть полезна в диагностике острого или хронического расслоения аневризм восходящей аорты с аортальной регургитацией.
Магнитно-резонансная томография (МРТ) и ангиография могут быть использованы в отдельных случаях с целью получения информации о метаболическом состоянии миокарда, в диагностике аневризм или объемных образований сердца.
Врожденные пороки сердца (ВПС)
К врожденным порокам сердца принято относить те пороки, которые возникают в результате нарушения эмбриогенеза или задержки окончательного развития сердца в постнатальном периоде. Рождаемость детей с пороками сердца высока и составляет 0,7-1,7%. Известно более 200 вариантов ВПС и множество их сочетаний. По клиническим данным чаще других встречаются: дефекты межпредсердной перегородки (ДМПП) — 7-21%, дефекты межжелудочковой перегородки (ДМЖП) — 15-20%, тетрада Фалло — 8-13%, коарктация аорты — 7,5%, открытый артериальный проток (ОАП) — 10-18%. Среди детей, родившихся с ВПС, 14-22% умирают в первую педелю жизни. Смертность до года составляет 40-50%. После первого года жизни смертность от ВПС резко снижается и в возрасте от 1 года до 15 лет погибают не более 5% детей (ВОЗ, 1971). Примерно у 23-30% детей с ВПС имеются сопутствующие аномалии желудочно-кишечного тракта, мочеполовой системы, ЦНС. ВПС составляют 30% от числа всех врожденных пороков развития.
Этиология. Среди причин ВПС можно выделить следующие: хромосомные абберации (5%), мутации одного гена (2-3%), повреждающие факторы внешней среды — 1-2% (рентгеновское и ионизирующее излучение, некоторые лекарственные препараты, инфекционные и вирусные агенты, алкоголизм родителей), полигенно-мультифакторное наследование (90%).
Помимо этиологических факторов следует выделять факторы риска рождения ребенка с ВПС, которыми являются возраст («пожилой») матери, эндокринные нарушения у супругов, токсикозы в первом триместре и угрозы прерывания беременности мертворождения в анамнезе, наличие других детей с врожденными пороками развития, прием женщиной эндокринных препаратов для сохранения беременности и др.
Классификации ВПС
Создание единой классификации ВПС встречает определенные трудности в связи с огромным количеством разновидностей пороков (более 200).
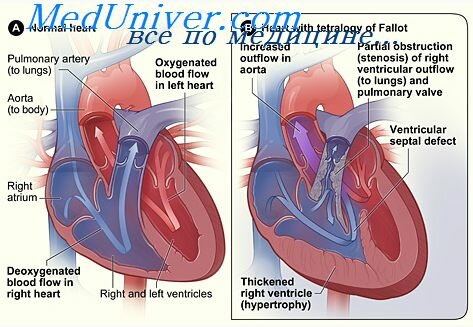
Классификация Тауссиг (Taussig, 1948) основана на различной степени оксигенации крови. По данной классификации ВПС делятся на:
«синие» (тетрада Фалло, транспозиция магистральных сосудов — ТМС, атрезия трикуспидального клапана);
«белые» (ДМПП, ДМЖП, ОАП).
Некоторые пороки могут попадать в обе эти группы.
Такое деление ВПС весьма условно и в практическом отношении не имеет большого значения.
Классификация ИССХ им. А. Н. Бакулева (1982) разделяет ВПС с учетом анатомических особенностей порока и нарушений внутрисердечной и общей гемодинамики. Эта классификация имеет 15 групп пороков, из которых наиболее часто встречаются первые четыре:
ВПС с повышенным легочным кровотоком (ОАП, ДМПП, ДМЖП, дефект аортолегочной перегородки);
ВПС с препятствием оттоку крови из желудочков (СЛА, стеноз аорты);
ВПС с аномальным отхождением магистральных сосудов и нормальным положением желудочков (тетрада Фалло, полная транспозиция магистральных сосудов — ТМС, общий артериальный ствол — ОАС);
аномалии дуги аорты и ее ветвей (коарктация аорты, двой-ная дуга аорты).
Открытый артериальный проток (ОАП) и коарктация аорты (КоА) являются врожденными аномалиями магистральных сосудов. Эти пороки развития традиционно рассматриваются вместе с врожденными пороками сердца в силу нередкого сочетания и одинакового с внутрисердечными аномалиями воздействия на центральную гемодинамику.
Открытый артериальный проток (ОАП)
Открытый артериальный проток был впервые описан Галленом (II век н. э.). Впоследствии приоритет приписывали Боталлу (Италия, 1560-1600), вследствие чего получил распространение термин «бота л лов проток».
Анатомические данные. ОАП представляет собой короткий сосуд мышечного типа (чем отличается от аорты и легочного ствола), начинающийся па границе дуги и нисходящей части аорты в области, так называемого «перешейка» аорты и впадающий в легочную артерию в зоне ее бифуркации, смещаясь чаще на правую ветвь. Длина ОАП составляет 8-20 мм, а диаметр 3-20 мм. ОАП иннервируется блуждающим и симпатическим нервами. В его адвентиции находятся гломусные тельца.
Функциональное значение ОАП в кровообращении плода
Кровь, насыщенная питательными веществами и кислородом, поступает к плоду по пупочной вене из плацентарных ворсинок. Перед воротами печени от пупочной вены отходят веточки к паренхиме печени. Продолжением пупочной вены является открытый венозный или аранциев проток, впадающий в нижнюю полую вену. В нижней полой вене плацентарная кровь смешивается с венозной кровью, поступающей от нижних конечностей, органов брюшной полости и таза. Давление в нижней полой вене у плода выше, чем в правом и левом предсердиях. Нижняя полая вена впадает в правое предсердие, куда впадает и верхняя полая вена, доставляющая венозную кровь. Благодаря наличию в правом предсердии клапанообразной складки над устьем нижней полой вены (евстахиевой заслонки) более 60% крови из нижней полой вены через овальное отверстие направляется в левое предсердие, левый желудочек и аорту. Оставшаяся кровь из нижней полой вены и кровь из верхней полой вены (смешанная кровь) поступает в правый желудочек и легочную артерию.
Через легкие плода протекает лишь 25% всей циркулирующей в организме крови. Легочные артерии имеют выраженный мышечный слой и находятся в спазмированном состоянии из-за низкого содержания в крови кислорода и высокого содержания углекислого газа. Давление в легочной стволе во время систолы повышается до 70-80 мм рт. ст. превышая давление в аорте в среднем на 10 мм рт. ст. Поэтому кровь из легочной артерии через артериальный проток перетекает в аорту ниже места отхождения сосудов, доставляющих кровь к голове и верхним конечностям плода. В связи с этим в наиболее выгодных условиях питания и доставки кислорода находятся сердце, голова, верхние конечности, что обеспечивает их нормальное развитие.
После рождения ребенка происходит резкая перестройка системы кровообращения. С началом легочного дыхания в крови повышается парциальное давление кислорода, расширяются кровеносные сосуды легких, их кровенаполнение увеличивается в 4-10 раз, начинает функционировать малый круг кровообращения.
Повышается давление в левом предсердии, снижается давление в правом предсердии, что приводит к прекращению функционирования и закрытию овального окна. Давление в аорте повышается, а в легочной артерии падает. Артериальный проток суживается, по-видимому, за счет мышечного спазма (функциональная фаза закрытия), а затем происходит его облитерация к 2-3 мес. Артериальный проток считается аномалией, если по клиническим данным он функционирует спустя 1-2 нед после рождения.
Патофизиология. Сразу после рождения сопротивление малого и большого круга кровообращения примерно равны и давление в аорте и легочной артерии почти одинаково. Поэтому сброс крови через ОАП практически отсутствует. В дальнейшем давление в аорте постепенно повышается, а в легочной артерии снижается. У детей первых месяцев жизни часто отсутствует диастолический градиент давления между аортой и легочной артерией, поэтому сброс крови через ОАП происходит только в систолу. В связи с этим при крике, пневмонии (давление в легочной артерии повышается) возникает обратный сброс крови через ОАП, появляется цианоз.
По мере нарастания градиента сброс крови из аорты в легочную артерию происходит и во время систолы, и в период диастолы, так как в обе эти фазы давление в аорте превышает таковое в легочной артерии. В результате сброса крови через проток возникают, прежде всего, нарушения внутрисердечной и легочной гемодинамики. Во-первых, поступление дополнительной балластной крови в легочную артерию, малый круг кровообращения и левые камеры сердца увеличивает объемную нагрузку на левый желудочек, вызывая гипертрофию его миокарда. Во-вторых, со временем развивается легочная гипертензия. В начале легочная гипертензия носит функциональный характер и связана с возникновением нейроциркуляторного рефлекса, вызывающего спазм артериол. Этот рефлекс направлен на ограничение поступления крови из аорты в легочную артерию вследствие уменьшения аортолегочного градиента.
В дальнейшем нарастающая легочная гипертензия становится все менее обратимой вследствие развития органической фазы, которая вначале обусловлена гипертрофией медии и гиперплазией интимы артерий мышечного типа, суживающих их просвет. В поздних стадиях легочной гипертензии происходит истончение медии, дилатация этих сосудов и гемосидероз легких. В-третьих, турбулентное движение крови в области пульмонального конца протока может способствовать повреждению эндотелия и отложению в этой зоне тромботических масс, которые склонны к гематогенному инфицированию, в результате чего возникает эндартериит протока, текущий по типу септического эндокардита.
ЛИТЕРАТУРА
1. Сердечно-сосудистая хирургия./ под ред. Буравского В.И. Бокерия Л.А. М: Медицина, 2002г.
2. Литман И. Оперативная хирургия, Будапешт, 1992г.
3. Маколкин В.М. Приобретенные пороки сердца, М. Медицина, 1986г.
4. Новиков В.И. Методика эхокардиографии, СПб, СПбМАМО, 1994г.
Шпаргалка
ПОРОКИ СЕРДЦА.
Классификация .
1. врожденные — диагностируются как правило в детском возрасте ( новорожденности).
2. приобретенные — человек их поучает в молодом. как правило юношеском возрасте.
К врожденным порокам сердца относят:
· дефект межжелудочкового перегородки ( ДМЖП) — в мембранозной или мышечной ее части
· открытый артериальный проток ( ОАП)
· диспозиции сосудов
· аномалии клапанного аппарата
Приобретенные пороки сердца ( ППС). Подавляющее большинство их них — пороки клапанные, также относится перфорация межжелудочковой перегородки вследствие ОИМ или инфекционного эндокардита.
При постановке диагноза порок сердца надо учитывать, что любой порок имеет прямые симптомы то есть непосредственно связанные с нарушением тока крови, что создает шумы и дрожание, а также симптомы косвенные которые связаны либо с изменениями самого сердца ( гипертрофия, дилатация) и симптомы связанные с особенностью нарушений периферического кровообращения ( то есть те жалобы, с которыми приходит пациент к врачу). Для каждого изолированного порока существует своя классификация, но на сегодняшний день предложена и широко используется на практике общая классификация для всех пороков сердца, которая была предложена Нью-йоркской ассоциацией кардиохирургов.
Согласно этой классификации все пороки можно поделить на 4 класса.
1. Первый функциональный класс — порок есть, но изменений в отделах сердца нет ( порок незначим). пример пролапс митрального клапана.
2. Второй функциональный класс — есть изменения со стороны сердца, но они обратимы. Изменений в других органах нет. Успех операции 100%.
3. Третий функциональный класса — появляются необратимые изменения со стороны сердца и обратимые изменения со стороны других органов.
4. Четвертый функциональный класс характеризуется появлением необратимых изменений со стороны других органов и систем.
Эта классификация позволяет оценить прогноз трудоспособности, дать рекомендации относительно физической активности. Фактически диагноз может быть сформулирован следующим образом:
n порок ( название)
n этиология порока
n функциональный класса порока
n функциональный класса сердечной недостаточности.
Приобретенные пороки сердца.
1. ревматизм — более ѕ случаев ( у молодых пациентов в 95-97%)
2. инфекционный эндокардит
3. атеросклероз и кальциноз
4. сифилис — вызывает порок аортального клапана
5. инфаркт миокарда
6. другие. редкие причины.
Клиника и диагностика.
Рассмотрим изолированные пороки, хотя на практике чаще наблюдаются комбинированные пороки ( 2 вида пороков в одном клапане) и сложные пороки ( когда одновременно поражено несколько клапанов).
МИТРАЛЬНЫЙ СТЕНОЗ.
Этиология: как правило ревматическая, 0.5% случаев — другие причины.
Патоморфология. Преимущественно пролиферативное воспаление у основания клапана, сужение собственно отверстия и сращение створок.
Патофизиология. В результате сужения АВ-отверстия предсердию нужно создать большее давление ( появляются одышка и тахикардия при нагрузке, что часто объясняется нетренированностью). Далее левое предсердие либо дилятируется, либо к мерцательной аритмии. И то, и другое приводит к резкому уменьшению сократительной способности левого предсердия, вследствие этого возникает повышение давления в венах возникает рефлекс Китаева, а отсюда одышка. Увеличивается давление в артериях малого круга и возникает гипертрофия правого желудочка, в результате чего малый круг переполняется кровью и возникает клиника левожелудочковой недостаточности, которая сама по себе является злокачественной. Затем правый желудочке дилятирует и наступает изменения по большому кругу кровообращения. Нормальная площадь митрального отверстия 4.5 см кубический, критичес4ая 1.5 см. Таким образом 1/3 площади отверстия ещеоставляетвозможности для компенсации, далее идет упорная декомпенсация.
Клиника. Кроме сердцебиения, жалобы на перебои в работе сердца, одышку и эпизоды удушья необходимо отметить кровохарканье. Также часто отмечаются слабость и усталость.
Осмотр.
· инфантильность ( то есть пациент выглядит немного моложе своего возраста)
· facies mitralis — яркий румянце щек на фоне обще бледности, является одним из проявлений периферического цианоза (так как уменьшен сердечный выброс)
· при пальпации асимметрия пульса и давления так как увеличенное левое предсердие сдавливает сосудистый пучок: слева пульс реже, АД ниже, нежели справа
· сердечный толчок
· осиплость голоса — так как левое предсердие сдавливает левый возвратный нерв
· при перкуссии сердце увеличено влево и вверх.
· мерцательная аритмия — зачастую способствует тромбоэмболии
· резкое усиление первого тона ( хлопающий). Это связано с недостаточным наполнением левого желудочка, систола его короче чес в норме.
· появление щелчка открытия митрального клапана ( следует тотчас за вторым тоном)
· в диастоле появляется шум: на фоне синусового ритма появляется пресистолический шум, который обусловлен сокращением левого предсердия; шум может быть диастолическим.
Эта симптоматика лучше всего выслушивается на верхушке. в точке Боткина и в аксиллярной области в положении пациента на левом боку. Может быть акцент второго тона на a.pulmonalis как следствие легочной гипертензии.
Дополнительные методы исследования.
1. ЭКГ: признаки гипертрофии правого желудочка и левого предсердия. Если возникает мерцательная аритмия — характерна ЭКГ картина
2. ФКГ — фактически дает данные о том, что мы слышим. Позволяет оценить интервал 2 тон — митральный щелчок. Чем интервал короче. тем степень стеноза тяжелее.
3. ЭхоКГ — позволяет оценить размеры отделов сердца, площадь митрального отверстия. Имея доплеровский датчик, можно регистрировать скорость движения крови через митральное отверстие.
4. Рентгенография грудной полости: увеличение сердца влево и вверх. Признаки легочной гипертензии.
5. Катетеризация полостей сердца. измерение давления в них. Происходит увеличение давления в левом предсердии с 25 мм.рт.ст. до 80 -100-110 мм.рт.ст.
ЛЕЧЕНИЕ. Радикальное — хирургическое.
1.баллонная вальвулопластика — самая атравматическая операция, можно использовать лишь на ранних стадиях порока.
2.комиссуротомия — через левое предсердия разрезаются створки митрального клапана. Эти операции нерадикальны, они переводят стеноз в недостаточность, которая течет более благоприятно. Через 10 лет у подавляющего числа больных появляется рестеноз.
3.Радикальное лечение заключается в протезировании митрального клапана
Терапия. если операция невозможна: вазодилататоры ( прямые и АСЕ-ингибиторы), диуретики, сердечные гликозиды при мерцательной аритмии ( тахисистолическая форма).
МИТРАЛЬНАЯ НЕДОСТАТОЧНОСТЬ.
Этиология: инфекционный эндокардит, инфаркт папиллярных мышц, пролапс митрального клапана.
Патофизиология: в систолу происходит сброс крови в левое предсердие. Для компенсации происходит дилатация и гипертрофия левого желудочка. Возникает нагрузка объемом предсердия — он дилятирует, повышается давление в малом круге — гипертрофируется правый желудочек, но компенсаторные возможности левого желудочка лучше чем правого. вот почему правый желудочке дилятирует быстрее левого. В итоге у больного формируется сердечная недостаточность с недостаточностью кровообращения по большому кругу кровообращения.
Клиника. Характеризуется жалобами. связанными прежде всего с сердечной недостаточностью ( одышка, утомляемость, отеки, бои в правом подреберье и т.д.)
Осмотр. Нет патогномоничных признаков.
Пальпация: границы сердца смещены влево вниз. Аускультация: первый тон на верхушке ослабевает вплоть до полного его исчезновения. Систолический шум возникает тотчас за первым тоном, занимает всю систолу. Максимально хорошо выслушивается на верхушке, а также в аксиллярной области в положении больного на левом боку.
Дополнительные методы исследования.
1. ЭКГ — признаки гипертрофии преимущественно левого желудочка
2. ФКГ
3. ЭхоКГ — дает представление о движение клапанов ( величина отверстия). Доплерография позволяет оценить степень регургитации.
4. Рентгенография. Признаки гипертрофии левого желудочка.
ЛЕЧЕНИЕ:
1. Консервативное — лечение сердечной недостаточности по общепринятым схемам.
2. Оперативное: вальвулопластика (сшивают хорды, и т.д.); протезирование митрального клапана.
АОРТАЛЬНЫЙ СТЕНОЗ.
Этиология: ревматизм, кальциноз, реже — гипертрофия межжелудочковой перегородки, миксома.
Патологическая анатомия: пролиферативное воспаление в основании клапана, сращение его створок.
Патологическая физиология: левый желудочек вынужден создавать давление, дабы обеспечить ток крови через суженный аортальный клапан в аорту. В ответ на это появляется его концентрическая гипертрофия левого желудочка. Темпы развития порока медленные, поэтому порок в течение 20-30 лет остается компенсированным и жалоб нет. Когда левый желудочек дилятируется, декомпенсация развивается быстро. Нормальная площадь аортального отверстия 3 см,критическаяплощадь порока 1 см.
Клиника. Появляется в период декомпенсации. Первоначальная клиника связана с тем, что стеноз лимитирует сердечный выброс в условиях физической нагрузки — головные боли, усталость, слабость. В условиях покоя сердце компенсирует ишемию головного мозга.
Далее у больных появляются боли в проекции сердца при нагрузке (очень похожи на ангинозный приступ. но возникает и уходит постепенно, они связаны с ишемией миокарда). Наблюдаются синкопальные состояния ( обмороки) при физической нагрузке. Последний — проявление у больного признаков левожелудочковой недостаточности ( одышка, отек легких).
Период компенсации. При осмотре — усиление верхушечного толчка. при аускультации — типичный ромбовидный систолический шум. Он слышен над всей поверхностью сердца, проводится на сосуды шеи и в межлопаточную область. Обрывается в области верхушки сердца, лучше слышен над аортой. Также появляются признаки гипертрофии левого желудочка, которая достигает огромных размеров.
Период декомпенсации. Резко уменьшается пульсовое давление. Появляется клиника левожелудочковой недостаточности.
Лечение. нитраты, бета-блокаторы, диуретики. Бета -блокаторы показаны лишь на стадии компенсации. Хирургическое лечение — лишь протезирование.
ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА (ПРОДОЛЖЕНИЕ)
Аортальная недостаточность. Этот порок может развиваться вследствие либо деформации, разрушения, сморщивания аортальных клапанов, либо при растяжении аортального кольца, что может быть следствием растяжения корня аорты либо значительной дилятации левого желудочка.
4 наиболее частые причины аортальной недостаточности:
1. ревматический эндокардит
2. инфекционные эндокардит
3. сифилис (гуммозный)
4. идиопатическое расширение устья аорты, которое чаще наблюдается у больных с высокой длительной артериальной гипертензией ( самый частый вариант).
5. Среди редких причин аортальной недостаточности нужно отметить болезнь Марфана — врожденная генетически обусловленная патология, характеризующаяся дисплазией основного вещества соединительной ткани. Это очень высокие люди с астенической грудной клеткой, паукообразными кистями рук, у них часто наблюдается расслоение аорты, разрывы ее, недостаточность аортального клапана. Также аортальная недостаточность нередко встречается, при некоторых коллагенозах: СКВ, болезнь Бехтерева ( анкилозирующий спондилоартроз).
ПАТОГЕНЕЗ. в момент диастолы левого желудочка аортальный клапана не смыкается и часть крови возвращается назад из аорты в левый желудочек. Вследствие этого возникает нагрузка объемом на левый желудочек, которая практически сразу вызывает его дилатацию, и при хроническом течении одновременно гипертрофию, которая позволяет увеличить абсолютную величину ударного выброса. Это приводит к тому, что величина сердечного выброса остается без изменений. Таким образом данные компенсаторные механизмы поддерживают суммарную функцию сердца на неизмененном уровне. Увеличение ударного объема клинически очень быстро проявляется увеличением систолического АД. Далее происходит декомпенсация, уменьшается диастолическое давление и развивается сердечная недостаточность.
Жалобы. Ощущение биения сердца, особенно на левом боку в положении лежа, что связано с периодом декомпенсации порока: одышка, эпизоды сердечной астмы, обмороки, головокружения — связаны с недостаточностью эффективного кровотока и гипоксией головного мозга, по мере дилятации левого желудочка появляются кардиалгии длительные, ноющие.
Объективное исследование.
Усиление верхушечного толчка и смещение его кнаружи от медиоклавикулярной линии. Пульс быстрый, увеличивается пульсовое давление за счет преимущественно роста систолического давления и затем снижения диастолического давления. По мере увеличения пульсового давления у больного развиваются следующие симптомы:
1. вагонный симптом. Пациент закидывает ногу на ногу, верхняя нога начинает ритмично в такт пульсу поддергивается.
2. Симптом Мюссе — качание головы в такт пульсу
3. капиллярный пульс Квинке — ритмическое покраснение и побледнение ногтевого ложа или конъюнктивы
4. шум пистолетного выстрела — при аускультации a.femoralis выслушивается громкий хлопающий тон, а при надавливании фонендоскоп появляется двойной шум Траубе
5. значительная асимметрия систолического давления при измерении на руках и ногах. В норме эта разница составляет 20-30 мм.рт.ст. здесь же 80-100 и выше.Этосвязано с тем, что калибр бедренной артерии в 2-3 раза более плечевой артерии
6. пляска каротид
Вся остальная симптоматика связана с развитием сердечной недостаточности, преимущественно левожелудочковой.
Аускультация: выявляется дующий высокочастотный диастолический шум, который локализуется на линии, соединяющий 2 межреберье справа от грудины по направлению к середине грудины. Шум высокочастотный, вот почему он раньше выслушивается ухом, нежели ФКГ.
Дополнительные методы исследования.
ЭКГ — гипертрофия левого желудочка.
Рентгенограмма грудной клетки: очень ранее увеличение размеров левого желудочка ( за счет дилятации)
ЭхоКГ — гипертрофия и дилатация левого желудочка, вибрация закрытых митральных клапанов.
1. Терапия основного заболевания (причины развития порока). Терапия этиотропная.
2. Хирургическое вмешательство — протезирование аортального клапана, а в ряде случаях вальвулопластика. Операция показана не ранее 2 функционального класса порока.
3. Терапия сердечной недостаточности, ограничение нагрузки
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ.
Синонимы: бактериальный, септический эндокардит. До 1940 года заболевание протекало подостро с летальностью 100% в сроки от 6 дней до 1 мес. Появление пенициллина создало впечатление, что заболевание будет побеждено, и к середине 60 гг. Заболеваемость действительно резко упала. В последние годы наблюдается неизменный рост частоты бактериального эндокардита, сегодня без хирургического лечения летальность очень высока.
Диагностика инфекционного эндокардита довольно сложна от начала заболевания до постановки диагноза.
Этиология: зеленящий стрептококк, белый стафилококк, кишечная палочка, синегнойная палочка, клостридии, грибы рода Кандида.
Диагноз неспецифический эндокардит складывается из двух составляющих:
1. генерализованная инфекция, чаще всего протекающая по типу сепсиса
2. инфекция, которая первично локализована на эндокарде (Это отличает инфекционный эндокардит от других вариантов сепсиса).
Причины развития инфекционного эндокардита:
1. Бактериемия при стоматологические процедурах — в 1/3 случаев ( удаление зуба, нагноившиеся гранулемы сопровождающиеся бактериемией — в 12 случаев. При обычной чистке зубов — в 15-20% случаев.
2. Бактериемия, связанная с катетеризацией мочевого пузыря, бужировании.
3. гинекологические процедуры
4. ЛОР-процедуры.
Однако далеко не у всех людей, у которых возникает бактерия, развивается инфекционный эндокардит. Для возникновения инфекционного эндокардита необходимо повреждение эндокарда. Поэтому становится ясным, почему мы имеем инфекционный эндокардит у лиц страдающих которая пороком сердца. При пороке сердца наблюдается нарушение тока крови: турбуленции, завихрения, которые повреждают эндотелий, причем турбуленции чаще возникают при поражениях левых отделов сердца, они более выражены при митральном стенозе, который часто осложняется эндокардитом. Раньше. 25 лет назад, даже был термин “септический ревмокардит”, то есть инфекционный эндокардит рассматривался как вариант течения ревматизма. Часто инфекционный эндокардит возникает у больных с дефектом межжелудочковой перегородки.
Надо отметить что в последние годы значительно увеличилась частота возникновения инфекционного эндокардита правых отделов сердца, что связывают с внутривенными процедурами. Оказывается, что в жидкостях, вводимых внутривенно, содержится огромное количество микроскопических пузырьков воздуха. Это не тот воздух, который “повинен” в возникновении ТЭЛА, размеры пузырьком намного меньше, они повреждают эндокард.
Таким образом инфекционный эндокардит рассматривают как первичный, если порок сердца был, и как вторичный если порока не было.
Клиника. Клиника обусловлена:
1. наличием сепсиса. Может быть классическая лихорадка с ночными проливными потами, а может быть субфебрилитет. Характерны симптомы общей интоксикации: анурия, слабость, похудание. Циркулирующие иммунные комплексы осаждаются на мембранах капсул, развивается нефрит. Считается, что изменения в моче являются вторым про значимости симптомом в диагностике инфекционного эндокардита; могут быть от минимальных изменений до клинически выраженного нефрита. Ускорена СОЭ. При высокой лихорадке лейкоцитоза не бывает, что и объясняет подострое течение заболевания — нет достаточно адекватного ответа организма. Возможно появление у пациента “барабанных палочек”, развитие спленомегалии, узелков Ослера — маленькие диаметром 2-3 мм, образующие под кожей, разрешающиесявтечение 10-15 дней. Узелки Ослера по своей сути являются метастазами инфекционного процесса, микроэмболиями в сосуды кожи. Точно такие же отсевы наблюдаются и во все остальные органы. Сам же очаг инфекции образно можно представить в виде слоеного пирога, то есть в области очага образуется вегетация, состоящая из колоний микробов, тромбов, фибрина и других элементов. Вегетации нередко отрываются, давая эмболии. При локализации инфекционного эндокардита в левых отделах сердца это эмболии большого круга кровообращения, в том числе головного мозга, коронарных артерий с развитием инфаркта миокарда, почек, конечностей. Иногда эмболии бывают первым симптомом инфекционного эндокардита.
2. Развитием недостаточности аортального клапана, реже митрального, а при локализации процесса в правых отделах — трикуспидальной недостаточности.
Для верификации диагноза необходимо доказать 2 критерия:
1. у больного имеется генерализованная инфекция проводится посев крови на стерильность. Но микроциркуляторное русло является своеобразным ситом, в котором часть возбудителей задерживается. Посев чаще бывает положительным, если сеется артериальная кровь. Посев надо брать до начала антибактериальной терапии, лучше на высоте лихорадки.
2. Очаг инфекции находится на эндокарде. Здесь используется аускультация, ЭхоКГ (вегетации от 2-3 до 10-12 см)
Лечение. сегодня включает в себя 2 компонента.
1. Обязательный — адекватная антибактериальная терапия:
· микроорганизм должен быть чувствителен к антибиотику
· антибиотики применяются в максимально допустимых количествах
· максимально длительно
Пример. На посеве — стрептококк. Препарат выбора — бензилпенициллин натрия, доза 24-32 млн. Ед. в сутки. Время лечения 4 недели.
Пенициллин в комбинации с гентамицином. Пенициллин в той же дозе, гентамицин 240 мг в сутки, на 3 введения. Сроки терапии до 4 недель.
2. необязательный компонент — хирургическое лечение.