Применение ипидакрина в восстановительном периоде ишемического инсульта
Катунина Е.А.
Сосудистые заболевания головного мозга продолжают оставаться важнейшей медико–социальной проблемой. По данным ВОЗ, ежегодно от цереброваскулярных заболеваний умирают около 5 млн. человек. Около 80% больных, перенесших инсульт. становятся инвалидами, из них 10% – тяжелыми, и нуждаются в постоянной посторонней помощи. Только 10% инсультов заканчиваются полным восстановлением нарушенных функций уже в первые недели заболевания [3,4].
Определяющим для формирования резидуального неврологического дефекта, степени адаптации и функциональной компенсации больных является восстановительный период инсульта. Восстановительный период начинается с 21–го дня острого нарушения мозгового кровообращения и делится на ранний восстановительный период (до 6 мес.) и поздний восстановительный период (от 6 мес. до 2 лет). К 3–4–й неделе инсульта завершается формирование очага инфаркта. Однако процессы, запущенные в первые часы заболевания, прежде всего механизмы программированной клеточной смерти – апоптоза, нарушения микроциркуляции и проницаемости гематоэнцефалитического барьера сохраняют свою значимость. В раннем восстановительном периоде инсульта идут активно репаративные процессы. Эти процессы обусловлены регрессом отека, абсорбцией некротизированных тканей, коллатеральным кровообращением в зоне повреждения. Кроме того, большое значение для процесса восстановления нарушенных функций имеет пластичность здоровой ткани, окружающей область инфаркта [1,2]. Пластичность представляет собой совокупность ряда механизмов – функционирование ранее неактивных путей, спруттинг волокон сохранившихся клеток с формированием новых синапсов, реорганизация нейрональных цепей.
Влияние на процессы пластичности может быть осуществлено препаратами, обладающими:
1. полимодальным действием на метаболические процессы в мозге (ноотропы);
2. холинергическим и антихолинэстеразным действием (холин альфосцерат, ривастигмин, ипидакрин );
3. антиоксидантным эффектом (мексидол, эмоксипин);
4. нейротрофическим действием (церебролизин, актовегин).
При необходимости также проводится ангиопротекторная и симптоматическая терапия, направленная на коррекцию мышечного тонуса, улучшение нервно–мышечной проводимости, уменьшение болевого синдрома, коррекцию сна и психического статуса у больных.
Антихолинэстеразные препараты
в восстановительном периоде
ишемического инсульта
Применение антихолинэстеразных (АХЭ) препаратов в раннем восстановительном периоде инсульта обусловлено возможностью влияния на обмен ацетилхолина, который является важнейшим медиатором как центральной, так периферической и вегетативной нервной системы. В центральной нервной системе холинергические нейроны находятся в стриатуме, ядре Мейнерта, лимбической системе, коре больших полушарий. Холинергическая система играет определяющую роль в процессе внимания, памяти, обучения. Ацетилхолинергическая недостаточность приводит к когнитивным нарушениям, лежит в основе «бродяжничества» и бесцельной двигательной активности, нарушений цикла «сон–бодрствование» (дневная сонливость и ночная спутанность – так называемый синдром захода солнца), зрительных галлюцинаций и др. Ацетилхолин является медиатором проведения в центральных проводящих системах мозга. Недостаток ацетилхолина в периферической нервной системе ведет к нарушению проведения импульса по периферическим нервам, блоку нервно–мышечной передачи.
Назначение АХЭ препаратов при инсульте может способствовать ускорению темпов восстановления двигательных функций за счет нормализации проведения импульсации как по центральным, так и периферическим проводникам, улучшению когнитивных функций в результате повышения содержания ацетилхолина в стратегически важных областях мозга, а также уменьшению выраженности вегетативно–трофических расстройств.
Механизм действия АХЭ препаратов связан с блокированием активности фермента ацетилхолинэстеразы, что сопровождается накоплением медиатора ацетилхолина в области синапса, то есть в области холинореактивных рецепторов. АХЭ препараты обладают также некоторым прямым возбуждающим действием на М,Н–холинорецепторы.
Действие ацетилхолина очень кратковременно (1–2 мс), часть ацетилхолина диффундирует из области концевой пластинки, а часть гидролизуется ферментом ацетилхолинэстеразой (т.е. расщепляется на неэффективные компоненты: холин и уксусную кислоту).
Исходя из стойкости взаимодействия АХЭ препаратов с ацетилхолинэстеразой, их подразделяют на 2 группы:
1) АХЭ средства обратимого действия. Их действие длится 2–10 часов. К ним относятся: физостигмин, прозерин, галантамин, оксазил, ипидакрин и другие. 2) АХЭ средства необратимого типа действия. Эти средства очень мощно связываются с ацетилхолинэстеразой на несколько дней, даже месяцев. Однако постепенно, примерно через 2 недели, активность энзима может восстанавливаться. К данным средствам относятся: армин, фосфакол и другие АХЭ средства из группы фосфорорганических соединений (инсектициды, фунгициды, гербициды, боевые отравляющие вещества).
Механизм действия АХЭ препаратов складывается из облегчения:
1) нервно–мышечной передачи;
2) передачи возбуждения в вегетативных ганглиях.
В результате этого АХЭ препараты вызывают значительное повышение силы сокращения скелетных мышц, расширяют периферические кровеносные сосуды, улучшают кровоснабжение мышц.
Выбор препаратов АХЭ определяется их активностью, способностью проникать через тканевые барьеры, длительностью действия, наличием раздражающих свойств, токсичностью. Так, пиридостигмин и оксазил отличаются большей продолжительностью действия, чем прозерин. Галантамин лучше проникает через ГЭБ.
Кроме торможения активности ацетилхолинэстеразы, важное значение имеет продолжительность воздействия на ионные каналы, влияющая на транспорт ионов калия. Блокада калиевых каналов вызывает удлинение периода возбуждения.
Механизм действия ипидакрина
В основе действия ипидакрина лежит комбинация двух молекулярных механизмов: блокады калиевой проницаемости мембраны и ингибирования холинэстеразы. Влияние на калиевую проницаемость мембраны и удлинение периода возбуждения в пресинаптическом волокне во время прохождения нервного импульса обеспечивает выход больших количеств ацетилхолина в синаптическую щель. Ипидакрин прочно связывается с каналом, эта связь потенциал–независима. Ипидакрин блокирует и натриевую проницаемость мембраны, но существенно слабее, чем калиевую. С действием ипидакрина на натриевую проницаемость мембраны можно частично связать его слабые седативные и анальгетические свойства.
Следует подчеркнуть, что ипидакрин действует на все звенья проведения возбуждения: он стимулирует пресинаптическое нервное волокно, увеличивает выброс нейромедиатора в синаптическую щель, уменьшает разрушение медиатора ацетилхолина ферментом, повышает активность постсинаптической клетки прямым мембранным и опосредованным медиаторным воздействием. В отличие от этого, типичные ингибиторы холинэстеразы воздействуют лишь на одно звено в цепи процессов, обеспечивающих проведение возбуждения. Они уменьшают метаболизм медиатора только в холинергических синапсах, способствуют накоплению ацетилхолина в синаптической щели. Следует также отметить, что АХЭ эффект ипидакрина отличается кратковременностью (20–30 мин.) и обратимостью, в то время как блокада калиевой проницаемости мембраны обнаруживается в течение 2 часов после введения препарата.
Изучение эффективности ипидакрина в раннем восстановительном периоде ишемического инсульта
Изучение эффективности действия ипидакрина на восстановление двигательных функций у больных, перенесших ишемический инсульт каротидной локализации, было проведено Селиховой М.В. (1992–1993 гг.) [6] под руководством проф. А.Б. Гехт на кафедре неврологии и нейрохирургии лечебного факультета РГМУ (зав. кафедрой – академик РАМН, профессор Е.И. Гусев). Ипидакрин назначался внутримышечно в дозе 2 мл 0,5% раствора 1 раз в сутки в течение 10 дней на фоне стандартизированной сосудистой и метаболической терапии. В исследование вошли 23 больных в возрасте от 30 до 70 лет (21 мужчина; 2 женщины). Результаты исследования сравнивались с контрольной группой (29 больных; 27 мужчин, 2 женщины в возрасте от 45 до 68 лет), которые получали ту же терапию, но без включения АХЭ препаратов. Больные, получавшие ипидакрин, и контрольной группы были сопоставимы по тяжести общего состояния и неврологического дефицита.
Для детальной оценки двигательных, тонусных, чувствительных, вегетативных нарушений были применены шкалы: Линдмарк (1988) с балльной оценкой неврологического дефицита; а также нейрофизиологические методы исследования – магнитная стимуляция двигательных зон коры (определялось время центрального проведения, амплитуда и длительность М–ответа с m. abd. pol. brevis в покое и при фасилитации); исследование скорости распространения возбуждения по срединному нерву и регистрацией М–ответа с m. abd. pol. brevis; вызванный кожный симпатический потенциал с ладоней (ВКСП). Исследования проводились на электронейрографе «Базис» итальянской фирмы «О.Т.Е.–Биомедика». Для магнитной стимуляции использовался магнитный стимулятор Novametrix (Великобритания). Клинические и нейрофизиологические исследования проводились на 2–3–й недели инсульта (за 1–2 дня до назначения ипидакрина) и в динамике на 4–5–й неделе.
Согласно рекомендациям фармкомитета, ипидакрин не назначался больным с выраженным замедлением сердечного ритма, с сопутствующими признаками стенокардии, бронхиальной астмой, гиперкинезами, эпилепсией. В группу обследуемых больных не включались больные, страдающие нервно–мышечными заболеваниями, а также с заболеваниями периферической нервной системы.
Трое больных прервали курс лечения в связи с развитием аллергической реакции в виде кожной сыпи на лице, шее (2 больных), в том числе в сочетании с диареей (1 больной). Ни в одном случае не возникли боли в сердце или нарушения сердечного ритма, не было ухудшения ЭКГ.
Среди больных, прошедших курс лечения ипидакрином, у 9 был инсульт с ограниченными последствиями (суммарный балл по шкале Линдмарк 400–447), у 7 – инсульт средней тяжести (суммарный балл по шкале Линдмарк 350–400) и у 4 больных – тяжелый инсульт (суммарный балл по шкале Линдмарк меньше 350). Двигательные нарушения были представлены монопарезами руки (6), гемипарезами (14) с преимущественным вовлечением руки (6), диффузным парезом руки и ноги (8). Изменения мышечного тонуса были умеренными у 12 больных, выраженными у 3, легкими у 1 пациента.
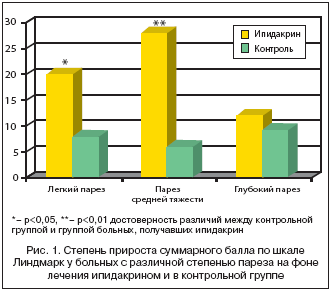
В зависимости от степени двигательного дефекта в руке, оцениваемого по подшкале Линдмарк «рука», были выделены 3 группы больных: с легким парезом (9 больных), при котором степень нарушений двигательных функций руки составила 45–57 баллов, парезом средней степени (6 больных) – 20–45 баллов, глубоким парезом (5 больных) – от 0 до 20 баллов. У больных с легким парезом повышение мышечного тонуса было минимальным. Чувствительные нарушения были представлены в виде легкой гемигипалгезии. Вегетативные нарушения встречались редко в виде расстройств вазомоторных реакций и потоотделения. В группе больных со средней тяжестью пареза в руке в 63% случаев были нарушения мышечного тонуса в виде умеренной и легкой спастичности. Преобладали умеренные чувствительные и вегетативно–трофические нарушения. У третьей группы больных с глубоким парезом нарушения мышечного тонуса были значительны: гипотония, спастичность с элементами пластики, в 15% случаев с формированием мышечных контрактур. У большинства больных наблюдались глубокие расстройства всех видов чувствительности, вегетативно–трофические нарушения в виде болевого синдрома, отечности кисти, гиперкератоза, что подтверждало тесную взаимосвязь трофических и двигательных нарушений.
Результаты проведенного исследования на 5–6–й неделе инсульта после проведения курса лечения ипидакрином показали его эффективность у больных с легкой и средней степенью тяжести пареза, что проявлялось не только нарастанием мышечной силы, но также улучшением ловкости, скорости движений, уменьшением вегетативных и чувствительных расстройств. Из 20 больных, прошедших лечение ипидакрином, полное восстановление нарушенных функций наступило у 5 больных (25% случаев), в контрольной группе – в 14%.
При оценке динамики нарушенных функций в подгруппах с различной степенью тяжести пареза получены данные, представленные в таблице 1. В группе с легким и парезом средней тяжести имелось достоверное уменьшение степени общего неврологического дефицита (р
Существенных изменений мышечного тонуса у данной группы больных не наблюдалось. У одного больного с легкой гипотонией в паретичных мышцах наблюдалась нормализация мышечного тонуса. У 2 больных гипотония в руке сменилась легкой и умеренной спастичностью после 2–3 инъекций ипидакрина.
В группе больных с глубоким парезом руки достоверных отличий динамики неврологического дефицита, степени пареза по сравнению с контрольной группой отмечено не было (табл. 1). Несколько более значительным был регресс чувствительных нарушений. У 3 больных с высоким мышечным тонусом на фоне инъекций ипидакрина спастичность увеличилась. Увеличение тонуса у 2 больных сопровождалось увеличением объема активных движений в конечностях, нарастанием мышечной силы. Значительной динамики вегетативно–трофических нарушений выявлено не было.
У больных с легким и парезом руки средней тяжести на фоне лечения ипидакрином наблюдалось достоверное уменьшение времени центрального моторного проведения (ВЦП) при магнитной стимуляции на пораженной стороне, более выраженное у больных с легким парезом (р
У больных с глубоким парезом из 5 больных с полным блоком проводимости по двигательным волокнам при магнитной стимуляции на паретичной стороне только у 1 больного наблюдалось появление М–ответа. При ЭНМГ–исследовании, а также исследовании ВКСП достоверной динамики показателей не наблюдалось (табл. 2, 3). Отсутствие динамики электрофизиологических показателей коррелировало с отсутствием значимых изменений в клинической картине этой группы больных.
Результаты проведенного исследования показали, что применение ипидакрина у больных в восстановительном периоде ишемического инсульта эффективно у больных с легкой и средней тяжестью пареза. Назначение ипидакрина данной группе больных способствовало более полному восстановлению двигательных, чувствительных, вегетативно–трофических нарушений по сравнению с больными контрольной группы. Надо отметить, что нарастание силы в конечностях сопровождалось увеличением мышечного тонуса. Усиление спастичности наблюдалось у больных с изначально высоким мышечным тонусом и глубоким парезом. У больных с гипотонией нормализация или небольшое повышение мышечного тонуса расценивались как положительный момент, способствующий нарастанию двигательной активности.
Положительная динамика со стороны двигательных нарушений на фоне лечения ипидакрином сопровождалась уменьшением времени центрального моторного проведения при магнитной стимуляции, что свидетельствовало об улучшении проводимости по кортико–спинальным волокнам, улучшении функциональной активности мотонейронов коры при подготовке и реализации движений. Подобный эффект, вероятно, связан с блокирующим влиянием ипидакрина на калиевые каналы пресинаптической мембраны, увеличением высвобождения ацетилхолина и увеличением чувствительности интернейронов коры к возбуждающим импульсам.
На фоне применения ипидакрина также наблюдалось улучшение проводимости по постганглионарным симпатическим волокнам (уменьшалась латентность и увеличивалась амплитуда ВКСП), что отражало способность препарата стимулировать процессы передачи нервного импульса в вегетативных ганглиях.
Эффективность назначения ипидакрина у больных с ишемическим инсультом в каротидном и вертебрально–базилярном бассейнах была показана в исследовании, проведенном в Запорожском государственном медицинском университете А.А. Козелкиным и соавт. [5]. Ипидакрин назначался по 20 мг 3 раза в сутки в течение 3–4 недель. Результаты исследования показали, что назначение ипидакрина способствовало уменьшению выраженности двигательных и афатических нарушений. У больных с вертебрально–базилярным инсультом ускорялся регресс бульбарных нарушений (дизартрии, дисфонии, дисфагии). Наилучшие результаты отмечены при раннем назначении препарата, с 1–2–й недели инсульта.
Таким образом, назначение ипидакрина способствовало увеличению эффективности реабилитационных мероприятий в восстановительном периоде ишемического инсульта в каротидной и вертебро–базилярной системах и ускоряло регресс очаговой симптоматики, особенно двигательных и бульбарных нарушений.
Литература
1. Гехт А.Б. Ишемический инсульт: вторичная профилактика и основные направления фармакотерапии в восстановительном периоде. Журн. Consilium medicum, 2001, том 3, №5.
2. Гусев Е.И. Скворцова В.И. Ишемия головного мозга.М. 2001.
3. Гусев Е.И. Проблема инсульта в России. Приложение к журналу неврологии и психиатрии «Инсульт», выпуск 9, 2003.
4. Гусев Е.И. Скворцова В.И. Стаховская Л.В. и соавт. Эпидемиология инсульта в России. Журн. Consilium medicum, 2003. Специальный выпуск.
5. Козелкин А.А. Сикорская М.В. Козелкина С.А. Опыт применения препарата нейромидин у больных с ишемическими инсультами в остром и раннем восстановительном периодах. //Журн. Украинский вестник психоневрологии, 2004. том 12, выпуск 12 (39).
6. Селихова М.В. Диагностика и лечение двигательных нарушений у больных в раннем восстановительном периоде ишемического инсульта. Дис. канд. мед. наук. М. 1993.
7. Столярова Л.Г. Реабилитация больных, перенесших инсульт. М. 1979.
Ишемический инсульт
Ишемический инсульт – одно из наиболее распространенных патологических состояний цереброваскулярного типа, которое является эпизодом развивающегося поражения сосудов при различных отклонениях сердечнососудистой системы.
Ишемический инсульт нередко развивается на фоне атеросклероза. артериальной гипертензии, ишемической болезни сердца, ревматического порока сердца, сахарного диабета и некоторых других отклонений, сопровождающихся поражением сосудов. Ишемический инсульт представляет собой нарушение мозгового кровообращения, которое характеризуется неожиданным появлением локальной общемозговой или неврологической симптоматики, наблюдающейся более суток, либо вызывающей смерть пациента в более короткий период. Вследствие недостаточного поступления крови повреждается ткань мозга, и возникают нарушения в его функционировании. Распространенность ишемического инсульта составляет 85% от всех случаев инсульта. Наиболее часто он встречается среди мужчин.
В настоящее время различают несколько вариантов патогенетического развития ишемического инсульта. Согласно наиболее распространенной классификации TOAST. выделяют следующие разновидности патологического отклонения такого типа.
Атеротромботический инсульт связан с атеросклерозом крупных артерий, из-за которого развивается артерио-артериальная эмболия;
Кардиоэмболический инсульт развивается вследствие клапанного порока сердца, аритмии, инфаркта миокарда;
Лакунарный инсульт возникает из-за окклюзии артерий малого калибра;
Ишемический инсульт неизвестного происхождения характеризуется невозможностью определения точных причин возникновения или наличием нескольких причин;
Ишемический инсульт, возникающий на фоне более редких причин (расслоение стенки артерий, гиперкоагуляция крови, неатеросклеротические васкулопатии).
Еще существует такая разновидность отклонения как малый ишемический инсульт, при котором симптоматические проявления самостоятельно регрессируют на протяжении первых трех недель развития.
Процесс развития ишемического инсульта можно подразделить на несколько этапов. Острейший период наблюдается в течение трех суток после возникновения отклонения. При этом первые три часа именуются «терапевтическим окном», так как в это время можно осуществить системное введение тромболитических препаратов. 50% развития инсульта происходит именно в первые три часа. Если на протяжении острейшего периода появляются признаки регресса симптоматических проявлений, то диагностируется транзиторная ишемическая атака. До 4-х недель продолжается острый период. Ранний восстановительный период длится до полугода. Поздний восстановительный период – до двух лет. Период после двух лет характеризуется остаточными явлениями.
Также различают тромбоэмболический, гемодинамический и лакунарный ишемический инсульт. Тромбоэмболия характеризуется закупоркой сосудов. В мозговых сосудах тромбоз возникает в результате нарушений структуры эндотелия (сосудистой стенки), повышения свертываемости крови и замедления кровотока. Эмболия в таком случае может образоваться из-за распавшихся атеросклеротических бляшек, при опухолях, переломах, тромбофлебите, при операциях на шее и на грудной клетке. Образованию тромбов может способствовать нарушение сердечного ритма, причем вероятность развития инсульта в такой ситуации повышается в 5 раз. Гемодинамический инсульт развивается в результате длительного спазма мозговых сосудов, когда мозг не обеспечивается необходимым количеством питательных веществ. Такая ситуация нередко возникает при пониженном или повышенном артериальном давлении. Лакунарный инсульт не превышает 15 мм и возникает в результате поражения перфорирующих артерий. Обычно характеризуется двигательными или чувствительными нарушениями.
Этиология и патогенез
Ишемический инсульт не может иметь единый этиологический фактор, так как не представляет собой самостоятельного заболевания. Но можно выделить две группы факторов, провоцирующих возникновение инсульта: модифицируемые и немодифицируемые. Группа модифицируемых факторов включает в себя артериальную гипертензию, инфаркт миокарда , сахарный диабет. мерцательную аритмию, поражение сонных артерий, дислипопротеинемию. К немодифицируемым факторам относят наследственную предрасположенность и возраст. Кроме того, риск развития инсульта повышается при нездоровом образе жизни с низкой физической активностью, частыми стрессами и психоэмоциональными нарушениями, избыточной массой тела и частым курением.
Вследствие острой фокальной ишемии мозга может возникнуть ряд молекулярно-биохимических изменений в мозговом веществе, что нередко является причиной тканевых нарушений, вызывающих отмирание клеток (инфаркт мозга). Выраженность и тип произошедших изменений зависит от продолжительности снижения кровотока, уровня этого снижения и чувствительности вещества мозга к ишемии. Этими же факторами определяется возможность обратимости тканевых изменений на различных этапах патологического процесса. Очаг необратимого повреждения именуется «ядром инфаркта». Зона, повреждения которой имеют обратимый характер, известна как «ишемическая полутень». Важна также длительность существования пенумбры, так как обратимые изменения со временем могут трансформироваться в необратимые. Ещё выделяют зону олигемии, в которой все необходимые потребности тканей обеспечиваются, несмотря на нарушение мозгового кровотока. Эта зона не относится к пенумбре и может существовать очень долго.
Симптоматика
Клинические проявления ишемического инсульта могут быть различны и зависят от размеров пораженного очага и его локализации. В 85% случаев место поражения локализуется в каротидном бассейне, гораздо реже – в вертебрально-базилярном. В целом клиника при инсульте характеризуется резким выпадением функции какого-либо отдела головного мозга. Чаще всего наблюдаются расстройства чувствительных и двигательных функций, зрения и речи. Чувствительные нарушения проявляются в виде полных или частичных соматосенсорных изменений на одной стороне тела (гемигипестезия). Двигательные расстройства характеризуются развитием гемипареза – снижением активности и силы движения конечностей с одной стороны. В некоторых случаях нарушение движения имеет двустороннюю локализацию (парапарез, тетрапарез). Может наблюдаться дисфагия (нарушение глотания) и атаксия (нарушение координации). В качестве речевых нарушений отмечается афазия (проблемы с пониманием или использованием речи), алексия и аграфия (нарушения чтения и письма), дизартрия (смазанность речи). Вестибулярные расстройства могут характеризоваться системными головокружениями. Также наблюдаются поведенческие и когнитивные нарушения (расстройства памяти, проблемы с пространственной ориентацией и самообслуживанием: трудно чистить зубы, одеваться, причесываться и т.д.).
Диагностика
Первоначальная диагностика ишемического инсульта заключается в сборе анамнеза пациента и его жалоб. При этом необходимо установить степень развития симптоматических проявлений и время начала нарушения мозгового кровообращения. При ишемическом инсульте наблюдается внезапное развитие неврологических нарушений. Также учитывается наличие провоцирующих факторов (артериальная гипертензия, сахарный диабет, атеросклероз и т.д.). После этого проводится более подробное обследование, включающее ряд процедур. В ходе физикального обследования оценивается общий неврологический статус, наличие общемозговых проявлений (нарушение сознания, головные боли и др.), менингеальных симптомов и локальной неврологической симптоматики. Лабораторные исследования включают анализ мочи, коагулограмму, общий и биохимический анализ крови.
Для определения ишемического инсульта также привлекаются инструментальные методы нейровизуализации. Компьютерная томография и магнитно-резонансная томография привлекаются и для динамического контроля над изменениями ткани головного мозга в процессе лечения. При проведении КТ на ранних стадиях развития ишемического инсульта, локализованного в системе средней мозговой артерии, из-за развивающегося цитотоксического отека отсутствует визуализация коры островка или чечевицеобразного ядра. Иногда в качестве ранних проявлений обнаруживается гиперденсивность отдельных участков средней или задней мозговой артерии со стороны поражения, что является признаком эмболии или тромбоза этих сосудов. Через 5-7 дней после начала развития инсульта наблюдается повышение плотности серого вещества, что свидетельствует о восстановлении кровотока и развитии неовазогенеза. Из-за этого затрудняется определение границ поражения в подострый период.
На диффузно-взвешенных МРТ-изображениях можно обнаружить в виде повышенного сигнала структурные повреждения вещества головного мозга, которые развиваются из-за цитотоксического отека, вследствие которого водяные молекулы переходят из внеклеточного пространства во внутриклеточное, что приводит к уменьшению скорости их диффузии. Дифференциальная диагностика ишемического инсульта проводится с геморрагическим инсультом, токсической или метаболической энцефалопатией, гипертонической энцефалопатией, инфекционным поражением мозга (энцефалит, абсцесс), опухолью мозга.
Лечение
При появлении подозрений на ишемический инсульт необходима госпитализация пациента. При транспортировке пациента его голова должна быть приподнята на 30 градусов. Если начало инсульта произошло не позднее 6 часов до госпитализации, то больной помещается в блок интенсивной терапии. Немедикаментозные терапевтические методики направлены на коррекцию глотательной функции, грамотный уход за пациентом, терапию инфекционных осложнений и профилактику их возникновения (инфекции мочевыводящих путей, пневмонии и т.д.).
Наибольшая эффективность медикаментозного лечения наблюдается на самом раннем этапе заболевания (3-6 часов после появления первых признаков). Основная задача при этом заключается в поддержании гомеостаза и коррекции жизненно необходимых функций, для чего необходимо поддержание и коррекция гемодинамических показателей, дыхания, водно-электролитного баланса, мониторинг важных физиологических показателей, коррекция отека мозга и повышенного внутричерепного давления, борьба с осложнениями и их профилактика. Как правило, основным лечебным раствором в данном случае является хлорид натрия, так как использование глюкозосодержащих растворов грозит развитием гипергликемии. В первые двое суток заболевания необходим контроль над насыщением гемоглобина кислородом из артериальной крови. Если этот показатель доходит до 92%, рекомендуется оксигенотерапия. Показанием к инкубации трахеи пациента является снижение уровня его сознания до 8 баллов и меньше по шкале комы Глазго. При появлении признаков внутричерепного давления или отека мозга требуется держать голову пациента приподнятой на 30 градусов. При сильных расстройствах глотательной функции показано энтеральное зондовое питание. В процессе приема пищи и в течение 30 минут после окончания пациент должен находиться в положении полусидя. Для предотвращения развития тромбоза глубоких вен рекомендуется соответствующее бинтование или ношение специальных чулок. Для этого же назначается прием прямых антикоагулянтов.
Важным направлением терапевтических действий является нейропротекция, подразумевающая введение препаратов с нейротрофическими и нейромодуляторными действиями. Делать это необходимо с первых минут развития инсульта, так как отсутствие кровотока в спинном и головном мозге в течение 5-8 минут способствует отмиранию нейронов. Таким образом, медикаментозное лечение, включающее нейропротекцию в сочетании с реперфузией и базисной терапией, позволяет добиться определенных успехов.
При оперативном лечении проводится хирургическая декомпрессия, направленная на сохранение церебрального кровотока, уменьшение внутричерепного давления и увеличение перфузионного давления. Как показывает статистика, данная процедура снижает риск летального исхода при инсульте. Основная задача в реабилитационном периоде заключается в восстановлении речевых и двигательных функций пациента. Для этого назначается специальный массаж, электростимуляция, механотерапия, ЛФК.
Прогноз при ишемическом инсульте может быть различным и зависит от объемов поражения, его локализации, возраста пациента, наличия сопутствующих отклонений и т.д. В некоторых случаях возможно полное восстановление неврологических функций и работоспособности пациента, в других случаях инсульт может завершиться инвалидизацией или летальным исходом.
Профилактика возникновения ишемического инсульта включает в себя предотвращение тромбоза сосудов, что происходит в результате образования холестериновых бляшек. Для этого нужно вести здоровый образ жизни, не допускать развитие ожирения и отказаться от курения. Рекомендуется грамотное лечение сахарного диабета, артериальной гипертензии, гиперхолестеринемии.
Вторичная профилактика подразумевает гипотензивную терапию, гиполипидемическую терапию, антитромболитическую терапию и хирургическое лечение каротидных артерий.
Методы лечения больных ишемическим инсультом
Ишемический инсульт – это острое очаговое нарушение кровоснабжения мозга вследствие прекращения поступления крови в какой-либо его участок. Эта патология очень актуальна, потому что является причиной инвалидизации и смертности многих людей. Проблема инсульта так же состоит в том, что раньше он возникал только у пожилых людей, но сейчас все чаще заболевание диагностируется у трудоспособного населения в возрасте 40 – 50 лет.
Симптомы и периоды ишемического инсульта
Лица с заболеваниями сердечно-сосудистой системы должны знать главные признаки, предшествующие инсульту и при возникновении хотя бы одного из них срочно обращаться за медицинской помощью.
- Появление слабости в конечностях с одной стороны;
- Замедление речи;
- Беспричинная интенсивная головная боль, сопровождающаяся головокружением и обморочным состоянием.
Симптомами ишемического инсульта являются:
- Появление ассиметричной улыбки, одностороннее опущение уголка рта;
- Невнятное произношение;
- Слабость в руке и ноге с одной стороны. Невозможность поднять, согнуть конечность.
Периоды ишемического инсульта
- Острейший период – длится 24 часа после атаки;
- Острый период – составляет следующие 4 недели;
- Период раннего восстановления – последующие полгода;
- Период позднего восстановления – длится около двух лет;
- Период остаточных явлений – начинается через два года после атаки и характеризуется неизлечимыми, стойкими последствиями.
Диагностика ишемического инсульта
Важно не просто диагностировать инсульт, но и определится с тем, что он ишемический. Выделяют так же геморрагический инсульт, тактика лечения которого, принципиально отличается от терапии ишемического поражения.
- Сбор жалоб и анамнеза заболевания. Уже на этом этапе врач должен заподозрить патологию, потому что комплекс симптомов ишемического инсульта в основном являются специфическими;
- МРТ для визуализации структур мозга. Магнитно-резонансная томография является методом ранней диагностики ишемического инсульта;
- Ангиография позволяет выявить место нарушения проходимости и определится с причиной развития заболевания;
- Физикальное обследование. Пациентов с подозрением на нарушение мозгового кровообращения должен обследовать терапевт, кардиолог и невролог что бы получить полную картину о состоянии организма и определится с тактикой лечения.
Лечение ишемического инсульта
- Базисная терапия, направленная на коррекцию функции систем жизнеобеспечения. Для поддержания дыхания нужно обеспечить проходимость воздухоносных путей, при необходимости провести интубацию и подключить пациента к аппарату искусственной вентиляции легких. Также базисная терапия включает контроль электролитов, обеспечение адекватного кровоснабжения органов и ликвидацию отека мозга.
- Тромболизис. В большинстве случаев ишемический инсульт обусловлен тромбозом сосудов мозга, поэтому для восстановления кровообращения необходимо растворить тромб. Сделать это можно в первые несколько часов после атаки и в том случае, если диагноз подтвержден. Потому что если провести тромболизис пациенту с геморрагическим инсультом, то он умрет.
- Специфическая терапия ишемического инсульта предназначена для восстановления структурных повреждений мозговой ткани, обеспечения адекватного обмена веществ и предотвращение возникновения неблагоприятных последствий.
Восстановление после ишемического инсульта
Ишемический инсульт при отсутствии быстрого лечения приводит к тому, что отмирает участок мозга, и развиваются очаговые неврологические нарушения. В зависимости от того, насколько быстро и правильно было проведено лечение, развиваются нарушения разной степени выраженности, которые необходимо корректировать. Однако коррекция неврологических нарушений – это долгая и кропотливая работа.
Реабилитация должна начинаться сразу после окончания лечения и длиться минимум полгода. Проводятся двигательные и речевые упражнения в сочетании с профилактикой повторных ишемических атак.
Для профилактики ишемических инсультов необходимо:
- Назначение антитромбоцитарных лекарственных препаратов снижает риск повторного развития инсульта на 25%;
- Лечение основного заболевания, которое привело к инсульту;
- Обязательный отказ от курения, борьбу с лишним весом и малоподвижным образом жизни;
- Проводить коррекцию обменных нарушений в организме.
Для восстановления нарушенных функций назначается:
- Ежедневное посещение занятий по лечебной физкультуре;
- Упражнения на тренажерах, эрготерапия;
- Аппаратная вертикализация и локомоторные упражнения для восстановления ходьбы;
- Физиотерапевтические процедуры, санаторно-курортное лечение.
Хоть реабилитационные мероприятия и дают лучший результат, в первое время после инсульта, необходимо помнить, что в течение всего острого периода пациент должен находиться в постели.
Статья подготовлена специалистами Израильского Онкологического Центра — http://www.cancertreatments.ru/ .