Немедикаментозные методы лечения фибрилляции предсердий. Неотложные реанимационные мероприятия. Многоцентровые исследования и мета-анализы профилактики внезапной смерти
Немедикаментозные методы лечения ФП
Электрокардиостимуляция показана при бради и тахи-бради формах ФП (т.е. при синдроме слабости синусового узла и при АВ блокадах). Двухкамерная (DDD, при пароксизмальной форме ФП) или предсердная (AAI, в том числе с положением электрода в межпредсердной перегородке) стимуляция могут уменьшать частоту возникновения рецидивов. Различные виды электрокардиостимуляции (в том числе чреспищеводная) не купируют ФП.
Имплантируемый предсердный кардиовертер-дефибриллятор осуществляет разряды прямого тока с энергией _ 6 Дж, в ранние сроки (почти сразу) после детекции ФП. С учетом феномена электрофизиологического ремоделирования, раннее купирование ФП не позволяет измениться рефрактерностям предсердий, что уменьшает предпосылки для частого рецидивирования и самоподдерживания ФП. Однако эффективность этого метода и его значение остаются до конца не изученными.
Хирургические методы в лечении ФП сейчас используются редко. Среди них выделяют операции хирургической изоляции предсердий, «коридор», «лабиринт». Все они направлены на разрушение множественных колец re-entry, и создание единственного пути («коридора», «лабиринта») от предсердий к АВ узлу. Главный их недостаток то, что они выполняются на «открытом» сердце (общая анестезия, аппарат искусственного кровообращения, холодовая кардиоплегия и вытекающие из этого осложнения и последствия). При необходимости выполнения операции на «открытом» сердце (протезирование клапана или аневризмэктомия) можно параллельно выполнить операцию по поводу ФП.
Интервенционные методы в лечении ФП (трансвенозные катетерные радиочастотные абляции) в настоящее время находят все больше сторонников. Самый простой способ при ФП (широко распространенный еще 3 — 5 лет назад) — это деструкция АВ соединения (создание искусственной АВ блокады) и имплантация электрокардиостимулятора в режиме VVI(R). При этом нарушается физиология сердца, не уменьшается эмболический риск, часто возникает зависимость от электрокардиостимулятора и проявляются все недостатки VVI режима. Сейчас с целью контроля частоты сокращений желудочков все чаще выполняется модификация АВ проведения без имплантации электрокардиостимулятора (то есть создается ограничение проведения предсердных импульсов на желудочки). Наиболее перспективной является трансвенозная абляция re-entry предсердий и/или очагов эктопической активности (по типу операции «лабиринт»). Такая процедура высокоэффективна, но весьма сложна технически и трудоемка.
Основной вывод — лучшая тактика лечения больных ФП еще не найдена!
Наджелудочковая очаговая тахикардия
Для купирования используют средства подавляющие активность пейсмекеров: сердечные гликозиды по схемам быстрого или среднего насыщения, пропранолол, верапамил, амиодарон. Плановое лечение состоит из радиочастотной катетерной аблации аномального очага пейсмекерной активности или (при неуспешности операции или отказе от нее больного) подбора купирующей (при редких пароксизмах) или профилактической антиаритмической терапии.
Желудочковые нарушения ритма.
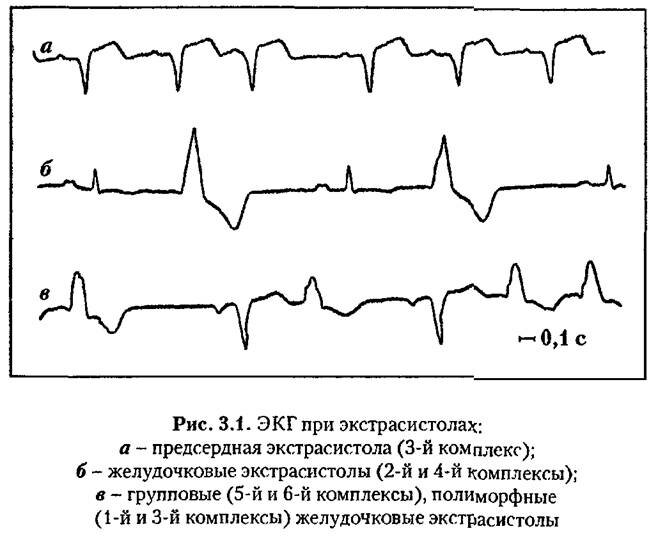
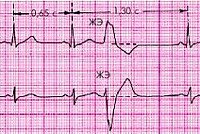
Желудочковая экстрасистолия
Классификация экстрасистол:
По локализации — синусовые, предсердные, из АВ соединения, желудочковые.
По времени появления в диастоле — ранние, средние, поздние.
По частоте — редкие (менее 5 в 1 мин), средние (от 6 до 15 в 1 мин) и частые (более 15 в 1 мин).
По плотности — одиночные и парные.
По периодичности — спорадические и аллоритмированные (бигеминия, тригеминия и т.д.).
По скрытому характеру экстрасистолии — скрытые экстрасистолы.
По проведению экстрасистол — блокада проведения (антеро- и ретроградная), «щель» в проведении, сверхнормальное проведение.
Классификация желудочковых экстрасистол (по B.Lown, M.Wolf, M.Ryan, 1975):
0. — отсутствие желудочковых экстрасистол за 24 ч. мониторирования. 1. — не больше 30 желудочковых экстрасистол за любой час мониторирования. 2. — больше 30 желудочковых экстрасистол за любой час мониторирования. 3. — полиморфные желудочковые экстрасистолы. 4. А — мономорфные парные желудочковые экстрасистолы. 4. Б — полиморфные парные желудочковые экстрасистолы. 5. желудочковая тахикардия (более 3 подряд экстрасистол).
В предыдущей классификации B. Lown & M. Wolf (1971) к 5 классу относили ранние (R на T) желудочковые экстрасистолы, как наиболее прогностически не благоприятные. Позднее выяснилось, что ранние экстрасистолы не несут прогностической нагрузки.
В большинстве случаев специфической антиаритмической терапии при экстрасистолии не требуется. Прогностически наиболее неблагоприятны желудочковые экстрасистолы высоких градаций по B. Lown — 2 класс и выше. Профилактическое лечение желудочковой экстрасистолии высоких градаций соответствует лечению желудочковой тахикардии (см. ниже).
Желудочковая тахикардия — частый и в основном регулярный ритм, характеризующийся наличием на ЭКГ трех или больше комплексов, исходящих из а) сократительного миокарда желудочков, б) сети Пуркинье, в) ножек пучка Гиса. Приступы длительностью менее 30 с называются неустойчивыми (нестойкими), а более 30 с — устойчивыми (стойкими). Желудочковые тахикардии бывают:
Реципрокные,
Очаговые автоматические,
Очаговые триггерные.
Неотложная помощь при состояниях, требующих реанимационных мероприятий
При фибрилляции желудочков и невозможности немедленной дефибрилляции нанести удар кулаком в прекордиальную область и начать сердечно-легочную реанимацию.
Закрытый массаж сердца с частотой 90 в 1 мин и ИВЛ любым доступным способом (массаж и дыхание при работе вдвоем — 5. 1, а одним врачом — 15. 2). Ингаляции 100% кислорода. Интубация трахеи (не дольше 30 с, не прерывать СЛР более чем на 30 с).
Катетеризация центральной или периферической вены.
Адреналин по 1 мг каждые 3 — 5 мин проведения СЛР.
Дефибрилляция последовательно с нарастающей мощностью — 200, а затем 360 Дж.
Массаж сердца и ИВЛ 1 мин, дефибрилляция 360 Дж и последовательное введение препаратов в/в:
Лидокаин 1,5 мг/кг
Повторить инъекцию лидокаина
Прокаинамид 1 г
Пропафенон 280 мг
Мониторировать жизненно важные функции.
При желудочковой тахикардии без остановки гемодинамики показаны — лидокаин 1 -1,5 мг / кг в/в медленно, далее каждые 5 минут в 1/2 дозы до эффекта или дозы 3 мг / кг. При неэффективности — ЭИТ последовательно 200 — 360 Дж, при неэффективности прокаинамид, пропафенон или амиодарон.
Имеет смысл выделять тахи- и бради- зависимые формы желудочковой тахикардии. Урежение или учащение основного ритма в таких случаях приводит к исчезновению аритмии. При желудочковой тахикардии для профилактической терапии препаратами выбора являются b-блокаторы (Пропранолол, Атенолол, Надолол, Метопролол, Соталол) и Амиодарон. Альтернативой медикаментозного лечения является имплантация кардиовертера-дефибриллятора. Препараты 1 класса (флекаинид, хинидин, пропафенон, дизапирамид, прокаинамид и т.д.) при наличии ИБС для длительной антиаритмической терапии не рекомендуются. Сейчас в лечение желудочковых нарушений ритма (даже ишемического генеза) активно внедряются методы радиочастотной катетерной аблации. Однако эффективность этого метода и его значение остаются до конца не изученными.
Желудочковая тахикардия спортсменов (триггерная) — отдельный вид желудочковой тахикардии, прогностически относительно благоприятный. Для его диагностики необходимо исключение ишемической болезни сердца (коронарография, сцинтиграфия с таллием). Лечение подбирают индивидуально, в зависимости от частоты возникновения приступов. Единичный приступ такой тахикардии может больше ни разу не повториться.
Нарушения электрокардиостимуляции и вопросы курации больных с ЭКС подробно рассмотрены в лекции профессора Подлесова А.М. в данном сборнике.
Доказательная медицина в аритмологии.
Окончание 20 века и начало нынешнего связано с широким внедрением в кардиологии позиций доказательной медицины. Мы попытались собрать воедино данные по различным клиническим испытаниям в аритмологии.
1. Многоцентровые исследования.
Первичная профилактика внезапной смерти:
CASCADE (1984-1991) — 228 больных, 6 лет. Сравнение амиодарона с другими принятыми схемами лечения больных с желудочковой тахикардией и синкопами, требующими кардиоверсии. Общая смертность при приеме амиодарона — 47%, при других видах лечения — 60% (р=0,007).
Wever et al. (1995) — 60 больных, 2 года. Оценивали эффективность имплантируемого кардиовертера-дефибриллятора при остановке кровообращения. Общая смертность снизилась с 35% до 14% (статистически не достоверно).
CASH (1987-1992) — 346 больных, 2 года. Исследование эффективности имплантируемого кардиовертера-дефибриллятора, амиодарона, метопролола и пропафенона у выживших после остановки кровообращения. Исследование пропафенона прекращено досрочно из-за увеличения смертности. Пациенты с кардиовертерами имели смертность на 38% меньше, чем в группах амиодарона и метопролола. У больных с кардиовертерами внезапная смерть достоверно снизилась с 11% до 2% (р.=0,001).
AVID (1997) — 1016 больных, 18 месяцев. Сравнивали эффективность имплантации кардиовертера-дефибриллятора и прием препаратов III класса (в основном амиодарона) при фибрилляции желудочков в анамнезе. Общая летальность при имплантации кардиовертера — 15,8%, при приеме лекарств — 24% (р<0,02).
CIDS (1998) — 659 больных, 3 года. Сравнивали эффективность имплантации кардиовертера-дефибриллятора и прием амиодарона при желудочковых тахикардиях. Общая летальность при имплантации кардиовертера — 25%, при приеме амиодарона — 30% (р=0,072).
ESVEM (1993) Изучали действие 7 препаратов при желудочковой тахикардии в течение 12 месяцев. 80% выживаемости при приеме соталола. 1 класс препаратов применялся у 60% больных, через 1 год, 3 и 6 лет: рецидивы аритмий у 36%, 59% и 68% соответственно. Внезапная смерть в те же периоды: 7%, 13% и 18%. Общая смертность — 12%, 24% и 35%. Через год рецидивы тахикардии при соталоле — 21%, а при приеме других лекарств — 44%.
Вторичная профилактика внезапной смерти:
CAST I (1989) — 1455 больных, 300 дней. Оценивали эффективность энкаинида, флекаинида и морицизина при желудочковой экстрасистолии у больных после инфаркта миокарда со сниженной фракцией выброса. Общая смертность увеличилась с 3,0% (плацебо) до 7,7% (р<0,01).
CAST II (1992) — 1325 больных, 18 месяцев. Оценивали эффективность морицизина при желудочковой экстрасистолии у больных после инфаркта миокарда с фракцией выброса ниже 40%. Внезапная смертность увеличилась с 3% (плацебо) до 17% (р<0,02).
SWORD (1994) — 3121 больной, 18 месяцев. Сравнивали прием d-соталола и плацебо у больных после инфаркта миокарда с фракцией выброса ниже 40%. Смертность при приеме плацебо составила — 3,1%, а при приеме d-соталола — 5% (р<0,01).
DIAMOND — 1518 больных хронической сердечной недостаточностью и 1510 больных после перенесенного инфаркта миокарда с фракцией выброса менее 35%. Сравнивали прием дофетилида и плацебо. Различий в выживаемости не выявлено. Отмечен положительный эффект дофетилида — профилактика фибрилляции предсердий.
BASIS (1990) — 312 больных после инфаркта миокарда с желудочковой экстрасистолией 3 и выше класса по Лауну. Сравнивали прием препаратов 1 класса, небольшие дозы амиодарона и отсутствие антиаритмической терапии. Применение амиодарона снизило смертность по сравнению с группой контроля (5% против 13%, р<0,05). Достоверных различий применения амиодарона или препаратов 1 класса не получено.
SSSD (1993) — 368 больных, 1 год. Сравнивали прием амиодарона, метопролола и отсутствие антиаритмической терапии при желудочковой экстрасистолии у больных после инфаркта миокарда и низкой фракцией выброса. Смертность при приеме амиодарона была ниже, чем в группе метопролола (3,5% против 15,4%, р<0,006), хотя достоверно не отличалась от пациентов без лечения.
EMIAT (1997) — 1486 больных, 21 месяц. Оценивался эффект амиодарона у больных с левожелудочковой дисфункцией после инфаркта миокарда. Общая смертность не изменялась.
CAMIAT (1997) — 1202 больных, 1,8 лет. Изучался амиодарон у постинфарктных больных с желудочковой экстрасистолией. Выявлено не достоверное снижение риска общей смертности.
GESICA (1994) — 516 больных, 2 года. Сравнивали действие амиодарона с плацебо у больных с зарегистрированной желудочковой тахикардией при хронической сердечной недостаточности с фракцией выброса менее 35%. Общая смертность в группе амиодарона была — 33,5%, в контрольной группе — 41,4% (р<0,024).
CHF-STAT (1995) — 674 больных, 45 месяцев. Исследовались больные хронической недостаточностью кровообращения с, как минимум, 10 желудочковыми экстрасистолами в час при суточном мониторировании ЭКГ. Достоверной разницы между приемом амиодарона или плацебо в отношении смертности не получено. Имелась тенденция к снижению смертности на фоне приема амиодарона у больных не ишемической кардиомиопатией.
MADIT (1996) — 196 больных, 27 месяцев. Включались больные после инфаркта миокарда с фракцией выброса менее 35%, с документированной и резистентной к прокаинамиду желудочковой тахикардией. У больных с имплантированными кардиовертерами общая смертность составила 15%, а у больных только на медикаментозной терапии — 38% (р=0,009).
CABG-Patch (1997) — 900 больных, 32 месяца. Изучалась эффективность имплантируемого кардиовертера-дефибриллятора у больных после аорто-коронарного шунтирования с фракцией выброса менее 36% и наличием поздних потенциалов. Различий в уроне летальности не выявлено.
Исследования эмболического риска и прием антикоагулянтов при фибрилляции предсердий.
BAATAF (1990) — 420 больных, 2,2 года. Сравнивали прием варфарина или плацебо при фибрилляции предсердий. При приеме варфарина частота эмболических эпизодов составила 0,45%. Снижение риска инсульта при приеме варфарина — 82% (p<0,002).
AFASAK — снижение риска инсульта при приеме антикоагулянтов на 58% (p<0,03).
CAFA (1991) — 378 больных. Сравнивали прием варфарина или плацебо при фибрилляции предсердий. Эмболические эпизоды составили — 3,5% против 5,2% (плацебо). Легкие (не смертельные) кровотечения развивались при антикоагулянтах — 16%, при плацебо — 9%. Снижение риска инсульта при приеме варфарина — 42% (p>0,2).
SPAF (1990-1992) — сравнивали прием варфарина или аспирина при фибрилляции предсердий. Варфарин оказался эффективнее аспирина. Снижение риска инсульта — 67% (p<0,01).
SPINAF (1992) — 571 больной. Сравнивали прием варфарина или плацебо. Включали мужчин с хронической неревматической фибрилляцией предсердий. Частота инсультов составила — 0,9% против 4,3% (плацебо). Старше 70 лет — 0,9% против 4,8% (плацебо). Снижение риска инсульта — 79% (p<0,002).
EAFT (1993) — 1007 больных, 1 год. Включались больные с неревматической фибрилляцией предсердий. Сравнивали прием варфарина или аспирина (300 мг). Частота инсультов снизилась с 12% до 4%. Антикоагулянты оказались эффективнее аспирина. Массивные кровотечения при антикоагулянтах развивались в 2,8% случаев, а при аспирине — 0,9%.
2. Мета-анализы. С целью еще большей достоверности исследователи стали объединять базы данных нескольких многоцентровых исследований и подсчитывать результаты заново. Такие работы называются мета-анализами. Приведем несколько из них.
Обзор исследований амиодарона по профилактике внезапной смерти. (Quantitative overview of randomized trials of amiodarone to prevent sudden cardiac death / Sim I, McDonald K M, Lavori P W, Norbutas C M, Hlatky M A. Circulation 1997; 96(9): 2823-2829.) В обзор включено 15 рандомизированных контролируемых исследований с общим количеством 5864 пациентов (2936 — амиодарон и 2928 — контроль). Амиодарон снижает общую смертность на 10 % — 19 % у пациентов с риском внезапной кардиальной смерти. Амиодарон также снижает риск у пациентов после инфаркта миокарда, с остановкой сердца или с клинически доказанной аритмией. Очевидная непоследовательность среди результатов рандомизированных контролируемых исследований, кажется, была из-за маленьких размеров и типа используемой контрольной группы, а не типа включенных пациентов.
Антиаритмическая терапия при профилактике внезапной смерти (Antiarrhythmic therapies for the prevention of sudden cardiac death / McAlister F A, Teo K K. Drugs 1997; 54(2): 235-252.) В обзор включены исследования применения класса I антиаритмических средств: 61 исследование (23,486 пациента), класса II: 56 исследований (53,521 пациент), класса III: 14 исследований (5,713 пациентов), класса IV: 26 исследований (21,644 пациента). Обычное профилактическое использование класса I антиаритмических средств у пациентов с высоким риском связано с увеличением риска смерти (отношение разности 1.13; 95 % доверительный интервал: от 1.01 до 1.27). Наоборот, применение бета — блокаторов связано с высоко достоверным снижением риска смерти у постинфарктных пациентов (0.81; 95 %: от 0.75 до 0.87). Данные трайлов по амиодарону говорят, что это средство эффективно снижает риск смерти (0.83; 95 %: от 0.72 до 0.95) хотя дальнейшее изучение необходимо, чтобы лучше определить типы пациентов, которые потенциально больше всего извлекут выгоду от этого средства. Никаких преимуществ не было замечено при применении кальциевых блокаторов (1.03; 95 %: от 0.94 до 1.13).
Побочные эффекты амиодарона: мета-анализ (Adverse effects of low dose amiodarone: a meta-analysis / Vorperian V R, Havighurst T C, Miller S, January C T. Journal of the American College of Cardiology 1997; 30(3): 791-798.) Анализировали 4 двойных слепых плацебо-контролируемых исследования (1465 пациентов: 738 — амиодарон и 727 — плацебо). Более высокая вероятность проявлений различных неблагоприятных эффектов при применении низких доз амиодарона была найдена: щитовидная железа — отношение разницы 4.2 (95 % доверительный интервал: от 2.0 до 8.7), p=0.001; неврология — 2.0 (от 1.1 до 3.7), p=0.02; кожа 2.5 (от 1.1 до 6.2), p=0.05; глаза 3.4 (от 1.2 до 9.6), р=0.02; брадикардия 2.2 (от 1.1 до 4.3), p=0.02. Разница вынужденного прекращения приема лекарственного средства в группе амиодарона была приблизительно в 1.5 раза выше, чем в группе плацебо (1.52, от 1.2 до 1.9, p=0.003). Подобные печеночные и желудочно-кишечные эффекты встречались в группе амиодарона и группе контроля (1.2 (95 % доверительный интервал: от 0.4 до 3.3), p=0.7 и 1.1 (от 0.7 до 1.9), p=0.678 соответственно). Имелась тенденция к увеличению разницы токсичного воздействия на легкие 2.0 (от 0.9 до 5.3), p=0.07.
Исходы применения имплантируемых дефибрилляторов (Outcomes from the use of the implantable cardiac defibrillator. / Hider P. New Zealand Health Technology Assessment (NZHTA) 1997 (NZHTA Report 1): 99.) Имеется некоторое общее признание в литературе, что ICD наиболее подходит пациентам, которые находятся в одной из двух групп высокого риска внезапной кардиальной смерти. Две группы: выжившие после остановки сердца; больные с высоким риском злокачественной тахиаритмии или с аритмией в анамнезе или с индуцированной аритмией, без остановки сердца, кому не могут назначить или оказались неэффективными другие медицинские или хирургические методы лечения и обычно имеют ишемическую болезнь сердца и/или низкую фракцию выброса левого желудочка.
Пропафенон в лечении наджелудочковых тахикардий и фибрилляции предсердий (Propafenone for the treatment of supraventricular tachycardia and atrial fibrillation: a meta-analysis / Reimold S C, Maisel W H, Antman E M. American Journal of Cardiology 1998; 82: N66-N71.) Изучали 60 исследований, включая: купирование наджелудочковой тахикардии — 8 исследований, n=153 пациента; хроническое подавление наджелудочковой тахикардии — 6 исследований, n=214 пациентов; купирование фибрилляции предсердий — 27 исследований, n=1843 пациента; и подавление фибрилляции предсердий — 25 исследований, n=1105 пациентов. Пропафенон успешно купировал 83.8 % (95 % доверительный интервал: 78.1 — 89.7 %) наджелудочковых тахикардий и пропорция пациентов, остающихся на синусовом ритме без аритмии в течение 1 года была 64.6 % (95 %: 58.1 — 71.1). Вероятность купирования пароксизма фибрилляции предсердий увеличилась в течение суток, до 76.1 % (95 %: 72.8 % — 79.4 %) пациентов на синусовом ритме через 24 часа после начала терапии. Пациенты, получавшие внутривенную терапию, более вероятно, восстанавливают синусовый ритм в первые 4 часа после назначения лекарственного средства. Преимущество применения пропафенона против плацебо в восстановлении синусового ритма было самое большое в первые 8 часов после начала лечения (преимущество лечения в первые 4 часа — 31.5 %, 95 %: 24.5 — 38.5; в первые 8 часов — 32.9 %, 95 %: 24.3 — 41.5, p < 0.01). Это преимущество лечения уменьшилось к 11.0 % (95 %: -0.6 — 22.4) после 24 часов. Пропафенон был эффективен в подавлении рецидивов фибрилляции предсердий в 55.4 % (95 %: 51.3 % — 59.7 %) случаев в течение 6 месяцев и 56.8 % (95 %: 52.3 — 61.3) в течение 12 месяцев.
Имплантируемые кардиовертеры-дефибрилляторы при аритмиях: систематический обзор (Implantable cardioverter defibrillators: arrhythmias. A rapid and systematic review. / Parkes J, Bryant J, Milne R. Health Technology Assessment Vol.4: No.26 2000: 69.) Было включено семь рандомизированных контролируемых трайлов по эффективности, восемь анализов рентабельности и два литературных обзора хорошего качества. Они показали изменения абсолютного риска общей смертности в пределах от увеличения на 1.7 % к снижению на 22.8 % (относительное снижение риска от -7 % до +54 %). Оцененные преимущества данными рандомизированных контролируемых исследований составляют — 0.23 — 0.8 дополнительных лет жизни больному с ICD терапией по сравнению с антиаритмической лекарственной терапией.
Амиодарон-ассоциированные проаритмогенные эффекты: обзор (Amiodarone-associated proarrhythmic effects: a review with special reference to Torsade de Pointes Tachy-cardia / Hohnloser S H, Klingenheben T, Singh B N. Annals of Internal Medicine 1994; 121(7): 529-535.) Изучались 6 описаний случаев (в дополнение к 59 обнаруженным в обзоре 1989 года), 17 наблюдательных исследований и 7 плацебо-контролируемых исследований. Во многих случаях развития torsade de pointes на фоне приема амиодарона присутствовали другие предрасполагающие факторы. Из 2878 пациентов в неконтролируемых исследованиях в 2 % развивались проаритмические события, включая 0.7 % torsade de pointes. В 7 плацебо-контролируемых исследованиях применение амиодарона не было связано с развитием проаритмических событий. Амиодарон связан с низким числом проаритмических событий (включая torsade de pointes), развивающимся менее чем в 1 % случаев.
Профилактический эффект амиодарона после острого инфаркта миокарда и при хронической недостаточности кровообращения: мета-анализ (Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of indi-vidual data from 6500 patients in randomised trials / Amiodarone Trials Meta-Analysis Investigators. The Lancet 1997; 350: 1417-1424.) Изучали восемь рандомизированных контролируемых исследований пациентов, недавно перенесших инфаркт миокарда (5101 пациент); из них 6 были двойными слепыми плацебо-контролируемыми и пять рандомизированных контролируемых исследований пациентов с хронической сердечной недостаточностью (1452 пациента); из них 3 были двойными слепыми плацебо-контролируемыми. Профилактический прием амиодарона снижает уровень аритмической / внезапной смерти у пациентов с высоким риском с недавним инфарктом миокарда или застойной сердечной недостаточностью и приводит к снижению на 13 % общей смертности.
Корзун А. И. Подлесов А. М.
Кафедра военно-морской и общей терапии, Военно-Медицинской Академии
Автореферат и диссертация по медицине (14.00.06) на тему: Мозговой кровоток при желудочковой экстрасистолии и фибрилляции предсердий в аспекте целесообразности антиаритмической терапии
Автореферат диссертации по медицине на тему Мозговой кровоток при желудочковой экстрасистолии и фибрилляции предсердий в аспекте целесообразности антиаритмической терапии
□03058154
Зафираки Виталий Константинович
МОЗГОВОЙ КРОВОТОК ПРИ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ И ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ В АСПЕКТЕ ЦЕЛЕСООБРАЗНОСТИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
14 00 06 — кардиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
003058154
Зафиракп Виталий Константинович
МОЗГОВОЙ КРОВОТОК ПРИ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ И ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ В АСПЕКТЕ ЦЕЛЕСООБРАЗНОСТИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
14 00 06 — кардиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в ГОУ ВПО «Кубанский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук профессор Канорский Сергей Григорьевич
Официальные оппоненты:
Ведущая организация:
доктор медицинских наук профессор Адамчик Анатолий Семенович кандидат медицинских наук Ковалев Дмитрий Владимирович ГОУ ВПО «Ростовский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита состоится " ¿¿с^/"
2007 г в
часов на
заседании совета К 208 038 01 при ГОУ ВПО "Кубанский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию" (350063, Краснодар, ул Седина, 4, тел (861)262-73-75)
С диссертацией можно ознакомиться в научной библиотеке ГОУ ВПО "Кубанский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан
2007 г.
Ученый секретарь совета
по защите кандидатских диссертаций
Ю С Кокарев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Аритмии сердца способны оказывать значительное влияние на состояние церебрального кровообращения (В Б Симоненко, Е А Широков, 2001, АВФонякин и соавт, 2005) Установлена, что снижение мозгового кровотока всего на 20% тормозит синтез белков в нейронах и нарушает их активность (С М Виничук и соавт, 2003)
Наиболее часто встречающимися аритмиями сердца являются желудочковая экстрасистолия (ЖЭ) и фибрилляция предсердий (ФП) (М С Кушаковский, 2001) В то же время, их влияние на церебральную гемодинамику остается недостаточно изученным Известно, что ЖЭ может вызывать снижение скорости мозгового кровотока (3 А Суслина и соавт, 2003, MDMalkoff et al, 1996) Однако, пока еще не разработано четких критериев, следуя которым, можно бьгло бы оценить степень отрицательного влияния ЖЭ на церебральную гемодинамику
Хроническая редукция мозгового кровотока развивается также у больных с постоянной ФП (Р Petersen et Al, 1989) Тем не менее, остается неизвестным, как разная частота желудочковых сокращений (ЧЖС) при ФП и функциональное состояние миокарда влияют на церебральное кровообращение Между тем, это имеет принципиальное значение при проведении урежающей ритм терапии с целью поддержания оптимальной ЧЖС Считается, что оптимальными значениями ЧЖС являются 60-80 в мин в покое и 90-115 — при умеренной физической нагрузке Однако не проведено ни одного адекватного исследования, обосновывающего эти критерии (Г К Киякбаев и соавт. 2006) С другой стороны, отсутствуют исследования по количественной оценке гемодинамических нарушений при ЖЭ и ФП в зависимости от состояния диастолической функции левого желудочка (ДФЛЖ)
В этой связи цель работы сформулировали следующим образом установить влияние фибрилляции предсердий и желудочковой экстрасистолии в зависимости от ее характера на скорость мозгового кровотока в средней мозговой артерии (СМА) и определить изменения качества жизни (КЖ) больных при этих нарушениях ритма в процессе антиаритмической терапии
Задачи исследования:
1 Определить влияние локализации желудочковых экстрасистол и длительности интервала С?Т экстрасистол на скорость мозгового кровотока в средней мозговой артерии при нормальной диастолической функции левого желудочка и при ригидном типе диастолической дисфункции
2 Оценить изменения скорости мозгового кровотока в средней мозговой артерии при разной частоте желудочковых экстрасистол
3 Сравнить показатели скорости мозгового кровотока в средней мозговой артерии при тахи-, нормо- и брадисистолической формах фибрилляции предсердий в зависимости от состояния диастолической функции левого желудочка
4 Установить влияние антиаритмической терапии на качество жизни больных желудочковой экстрасистолией, а также влияние урежающей ритм терапии и восстановления синусового ритма на качество жизни больных с фибрилляцией предсердий
Научная новизна. Определено влияние диастолической функции левого желудочка на скорость мозгового кровотока в средней мозговой артерии у пациентов с различными видами желудочковой экстрасистолии и формами фибрилляции предсердий Уточнен диапазон частоты желудочковых сокращений как показателя эффективности урежающей ритм терапии при фибрилляции предсердий для больных без изменений функции левого желудочка и при его диастолической дисфункции
Практическая значимость. Установлено, что медикаментозное подавление желудочковой экстрасистолии у больных без органических заболеваний сердечно-сосудистой системы, исходя из такого показания как «негативное влияние аритмии на гемодинамику», нецелесообразно Антиаритмическая терапия показана больным с диастолической дисфункцией левого желудочка и периодами бигеминии У пациентов с фибрилляцией предсердий и нормальной диастолической функцией левого желудочка значения скорости мозгового кровотока, наиболее близкие к таковым при синусовом ритме с нормосистолией, отмечаются при частоте сокращения желудочков в интервале 75-135 в минуту При ригидном типе диастолической дисфункции левого желудочка и фибрилляции предсердий этот диапазон составляет 75-110 в минуту, что необходимо учитывать при проведении медикаментозной терапии, урежающей частоту желудочковых сокращений
Апробация результатов. Материалы и основные положения работы представлены и обсуждены на Российском национальном конгрессе кардиологов (Томск, 2004, Москва, 2005), Седьмом конгрессе с международным участием «Паллиативная медицина и реабилитация» (Кемер, Турция, 2005), Всероссийской конференции молодых ученых-кардиологов (Москва, 2005) Результаты работы используются в педагогическом процессе на кафедре госпитальной терапии КГМУ при обучении студентов и внедрены в клиническую практику в кардиологических отделениях №1 и №2 МУЗ «Краснодарская городская клиническая больница скорой медицинской помощи»
Первичная апробация диссертации проведена на совместном заседании кафедры госпитальной терапии и кафедры пропедевтики внутренних болезней ГОУ ВПО КГМУ Росздрава 29 июня 2006 г
Объем и структура работы. Диссертация изложена на 138 страницах машинописного текста, состоит из введения, обзора литературы, описания материала и методов исследования, 3 глав собственных исследований, обсуждения, выводов, практических рекомендаций и приложения Работа иллюстрирована 11 таблицами и 7 рисунками Библиографический указатель оформлен по ГОСТ 7 1-2003, ГОСТ 7 80-2000 и включает 80 источников на русском и 136 — на иностранных языках
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование включены 175 больных с ЖЭ и 102 больных с ФП Для пациентов с экстрасистолией критериями включения в исследование служили наличие частой ЖЭ, с ФП — персистирующей, либо пароксизмалыюй ее формы с частыми рецидивами
Группа больных с ЖЭ состояла из 64 мужчин и 111 женщин, средний возраст которых равнялся 42,6±8,6 лет В группе с ФП было 63 мужчины и 39 женщин (49,5±8,4 лет) Основным заболеванием в группе с ЖЭ у 62,3% пациентов была гипертоническая болезнь (ГБ) 1-П стадии, у 5,7% -ишемическая болезнь сердца (ИБС), у 22,3% — нейроциркуляторная дистония (НЦД) и у 9,7% пациентов — идиопатическая ЖЭ В группе больных с ФП основным заболеванием у 66,7% пациентов являлась ГБ 1-П стадии, у 3,9% -ИБС, у 7,8% — алкогольная миокардиодистрофия и у 21,6% — идиопатическая ФП
В группы не включали больных с перенесенным инсультом или транзиторной ишемической атакой, со стенозирующим атеросклерозом сонных артерий, перенесенным инфарктом миокарда, кардиомиопатиями, клапанными пороками сердца, систолической сердечной недостаточностью и фракцией выброса менее 50%, а также при наличии на ЭКГ блокады ножек пучка Гиса Исследуемые не принимали лекарственных средств, способных
существенно повлиять на систолическую функцию сердца Состав больных включал лиц от 18 до 65 лет
Всем больным проводили запись стандартной ЭКГ в 12 отведениях (электрокардиограф «Mortara»), эхокардиографию (ЭхоКГ) с использованием допплеровского режима и транскраниальное дуплексное сканирование (ТКДС) СМА и сонных артерий с помощью ультразвуковых сканнеров «Acusón 128хР10» (США) и ALOKA-5500 (Япония) У 69 больных выполняли амбулаторное суточное мониторирование ЭКГ («КАРДИОТЕХНИКА-4000», Россия) и исследование КЖ по методике «Качество жизни больных с аритмиями» (Р А Либис и соавт, 1998)
Методом ТКДС определяли линейную скорость кровотока (см/с) в СМА при синхронной регистрации ЭКГ Измеряли интеграл линейной скорости кровотока (ИЛСК) в СМА при экстрасистолическом и постэкстрасистолическом сокращениях сердца Оценивали достоверность различий средней величины отношения ИЛСК при экстрасистолическом сокращении (ИЛСКЖэ) к ИЛСК при синусовом сокращении (ИЛСКсин) Такие сравнения проводили в зависимости от право- или левожелудочковой локализации ЖЭ, а также с учетом длительности экстрасистолического возбуждения желудочков и состояния ДФЛЖ
Для оценки влияния частоты ЖЭ на скорость кровотока в СМА проводили измерение ИЛСК в течение 10 последовательных сердечных сокращений на участках записи с ЖЭ и с синусовым ритмом Соотнесение количества ЖЭ к 10 наблюдаемым сердечным циклам позволяло определять частоту экстрасистолии непосредственно во время проведения исследования Затем вычислялось процентное отношение ИЛСК при ЖЭ к ИЛСК при синусовом ритме
В группе больных с ФП 79 человек имели персистирующую форму, а 23 — частые пароксизмы Часть больных (п=54) имела тахисистолическую форму ФП, другая (п=48) — нормосистолическую Все больные получали амиодарон пероралыю или внутривенно для урежения ЧЖС или для
восстановления синусового ритма (п=59) У 43 пациентов амиодарон применяли для подготовки к электрической кардиоверсии У всех больных исходно измеряли ИЛСК в СМА В дальнейшем после урежения ЧЖС амиодароном проводилось повторное измерение ИЛСК После восстановления синусового ритма у всех пациентов исследование повторяли Кроме того, всем больным после восстановления синусового ритма проводилась ЭхоКГ в допплеровском режиме для оценки ДФЛЖ
В ходе исследования КЖ больных с ЖЭ (п=38) и ФП (п=20) определяли до начала и после проведенного антиаритмического лечения
Для статистической обработки и анализа данных использовали программу Statistica 6 0 (StatSoft, США) Результаты представлены средними значениями и их среднеквадратическими отклонениями (M±SD) Для выявления межгрупповых различий и избежания эффектов множественных сравнений использовали критерий Ныомена-Кейлса При статистическом анализе повторных измерений применяли Т-критерий Стьюдента для связанных выборок Статистически значимыми считали различия при значении р<0,05
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Изменения церебрального кровотока в зависимости от локализации ЖЭ, частоты, продолжительности их электрической систолы и состояния ДФЛЖ. Среднее значение ИЛСК в СМА при синусовых сокращениях составило 38,7±7,2 см/с, а при экстрасистолических сокращениях — 28,4±5,5 см/с (р<0,001) Полученные данные согласуются с имеющимися в литературе, согласно которым ИЛСК в СМА при синусовых сокращениях составляет в среднем 40,1±5,8 см/с, а при экстрасистолических — 26,0±4,0 см/с (В Г Лелюк, С Э Лелюк, 2003, М D Malkoff et al, 1996) Однако разброс абсолютных значений ИЛСК оказался настолько велик, что это могло нивелировать возможные различия в гемодинамических эффектах при разных
видах ЖЭ Поэтому использовали относительный показатель, рассчитываемый индивидуально для каждого наблюдения как процентное отношение ИЛСКЖэ к ИЛСКСин Среднее его значение составило 73,5±6,3% Таким образом, установили, что экстрасистолическое сокращение сердца по сравнению с синусовым приводит к уменьшению ИЛСК в СМА более чем на четверть (на 26,5%)
У больных с правожелудочковыми экстрасистолами (ПЖЭ) и нормальной ДФЛЖ степень снижения ИЛСК в СМА при экстрасистолическом сокращении в сравнении с синусовым оказалась достоверно большей, чем при левожелудочковых экстрасистолах (ЛЖЭ) (73,9±6,0% против 76,4±6,1%, р<0,05) В этой связи можно было полагать, что такие различия определяются временем возбуждения ЛЖ при разных типах ЖЭ Подтверждением этому служат значительные различия между средними интервалами, измеренными от вершины комплекса (^ЛБ экстрасистолы до начала допплеровской волны в СМА При ПЖЭ этот интервал составил 194,4±19,3 мс, а при ЛЖЭ — 120,6.^14,2 мс (р<0,0001) В результате при ПЖЭ может в большей степени нарушаться правильная последовательность охвата возбуждением ЛЖ, ответственного за системную гемодинамику, нежели при нахождении эктопического очага в проводящей системе ЛЖ
При ЖЭ с длительностью интервала <ЗТ, превышающей 380 мс, снижение ИЛСК в СМА оказалось большим, чем при ЖЭ с более коротким интервалом С?Т (73,0±5,7% против 77,2±5,4% соответственно, р<0,01) Статистически значимые различия определялись и при сопоставлении средних значений интервала времени от вершины комплекса <3118 экстрасистолы до начала допплеровской волны в СМА при ЖЭ с разной длительностью интервала ОТ (170,1±38,5 и 153,8±40,5 мс при удлиненном и укороченном интервале (>Т соответственно, р<0,05) Выявили также наличие выраженной корреляционной связи между величиной интервала от вершины комплекса (ЗЯБ экстрасистолы до начала допплеровской волны и значением ИЛСКжэ/ИЛСКсш (г= -0,78)
В случаях с ПЖЭ и ригидным типом ДДЛЖ отметили более выраженное снижение величины ИЛСКЖэ/ИЛСКсшь чем у пациентов с таким же расстройством ритма, но при нормальной ДФЛЖ (70,1±5,8% против 73,9±6,0% соответственно, р<0,01)
Среднее значение ИЛСК при постэкстрасистолическом сокращении достоверно не отличалось от ИЛСКсин (39,4±7,6 см/с и 39,2±7,4 см/с соответственно) Процентное отношение ИЛСК в СМА за два последовательных сердечных сокращения (экстрасистолического и постэкстрасистолического) к ИЛСКсин не имели достоверных различий при ПЖЭ и ЛЖЭ Таким образом, различия в гемодинамических эффектах ЖЭ в значительной степени сглаживались за счет постэкстрасистолического сокращения Однако, значимые отличия при ЖЭ все же определялись при удлинении интервала (¿Т более 380 мс (84,9±3,9% против 87,0±3,9% соответственно, р<0,05) и при наличии ДДЛЖ (83,3±4,1% против 85,3±4,3% соответственно, р<0,05)
Важной частью следующего фрагмента исследования стало измерение ИЛСК в СМА в зависимости от частоты ЖЭ (табл 1)
Таблица 1
Показатели церебральной гемодинамики в зависимости от частоты ЖЭ (М±8Б)
Соотношение ЖЭ и общего числа сердечных сокращений Число наблюдений ИЛСКжэ (см/с) ИЛСКсин (см/с) ИЛСКжэ о/о ИЛСКсин Значение Р
1 10 40 39,3±7,2 39,6±7,6 99,4±2,9 0,11
2 10 36 36,2±6,3 38,3±6,6 94,4±2,9 <0,0001
3 10 36 33,3±5,9 36,9±6,5 90,3±4,1 <0,00001
4 10 33 33,6±7,5 37,8±8,3 88,8±3,7 <0,00001
5.10 30 31,0±5,1 36,6±5,6 84,8±4,0 <0,00001
Примечание- различия между ИЛСКжэ и ИЛСКсин по Т-критерию Стьюдента для парных выборок
При частоте ЖЭ, составляющей 10% (1 ЖЭ на 10 сердечных сокращений) на момент регистрации ИЛСК в СМА, скорость кровотока достоверно не отличалась от ее значения при регулярном синусовом ритме При частоте ЖЭ 20% и 50% ИЛСК составлял 36,2±6,3 м/с и 31,0±5Д м/с, а ИЛСКжэ/ИЛСКсин — 94,4±2,9% и 84,8±4,0% Итак, при указанных частотах ЖЭ скорость мозгового кровотока по ИЛСК в СМА была снижена на 6,1±3,3% и 18,2±5,7% соответственно У больных с ДДЛЖ и бигеминией снижение мозговою кровотока составило 20,2±6,4% Следовательно с учащением ЖЭ выше 20% уровня происходит редукция мозгового кровотока, которая достигает максимального значения при 50% частоте экстрасистолии
Влияние ЧЖС и состояния ДФЛЖ на церебральную гемодинамику при ФП. На данном этапе исследования были изучены показатели мозгового кровотока методом ТКДС СМА у больных с ФП, которое проводили последовательным измерением исходного ИЛСК, а также после урежения ЧЖС амиодароном и после восстановления синусового ритма Результаты измерений представлены в табл 2 Как следует из данных табл 2, ИЛСК в СМА при тахисистоли-ческой форме ФП после восстановления синусового ритма увеличился
Таблица 2
Показатели церебральной гемодинамики у больных с ФП в зависимости от ЧЖС (М±8Б)
Форма ФП Исходный ИЛСК (см/с) Средняя ЧЖС в мин ИЛСК после восстановления синусового ритма (см/с) Средняя ЧЖС в мин Р
Тахисис-толическая (п=54) 33,9±7,8 142,7±10,0 35,4±6,5 63,9±8,0 0,02
Нормосис-толическая (п=48) 34,4±6,7 74,9±6,8 35,2±7,1 61,3±б,4 >0,05
Примечание различия между ИЛСК при ФП и ИЛСК после восстановления синусового ритма по Т-критерию Стьюдента для парных выборок
Свидетельством тому является не только абсолютный прирост скорости кровотока, но и показатель отношения ИЛСК при ФП к ИЛСК после восстановления синусового ритма, который составил 95,7±13,7% Это показывает, что прирост ИЛСК с восстановлением ритма увеличивается в среднем на 4,4%
У этих же пациентов с ФП в период урежающей ритм терапии амиодароном (ЧЖС !07,9>9,8) рассчитанное таким же образом отношение ИЛСК составило 107,7±5,8%, то есть скорость кровотока оказалась выше, чем после восстановления синусового ритма (р<0,0001) Следовательно у больных с тахисистолической формой ФП при ЧЖС 140 в мин и выше имеется редукция ИЛСК в СМА, в ходе лечения амиодароном и урежения ЧЖС в пределах 100-115 в мин происходит существенное ее повышение, а при восстановлении синусового ригма с частотой 55-70 в мин — уменьшение, однако на уровне ИЛСК большем, чем в исходном состоянии
При нормосистолической форме ФП с ЧЖС 74,9^6,8 в мин ИЛСК в СМА после восстановления синусового ритма не изменился Однако в ходе лечения амиодароном у 29 из 48 наблюдавшихся развилась брадисистолия (ЧЖС 51,2±5,7) В таких случаях наблюдалось снижение ИЛСК в СМА на 25%, а после восстановления ритма его повышение на 37% Таким образом, максимальная скорость мозгового кровотока при ФП регистрируется при ЧЖС в интервале 100-115, и наоборот, наибольшее ее снижение отмечается при брадисистодической форме
Далее, аналогичным образом оценили изменения скорости мозгового кровотока с учетом состояния ДФЛЖ (табл 3) Сравнение показателей ИЛСК в СМА у больных с тахисистолической формой ФП при нормальной ДФЛЖ и при ригидном типе ДДЛЖ обнаружило отличия как по абсолютным значениям, так и по значению отношения ИЛСК до и после восстановления ритма При таком сравнении ИЛСК в СМА оказался на 24% ниже при ДДЛЖ (р<0,0001) Раздельный анализ после восстановления ритма показал, что при
нормальной ДФЛЖ ИЛСК уменьшился на 9% (р<0,001), а в случаях с ригидным типом ДДЛЖ ИЛСК в СМА увеличился на 19% (р<0,0001)
Таблица 3
Показатели церебральной гемодинамики у больных с ФП с учетом состояния ДФЛЖ и ЧЖС (М±8Б)
Состояние ДФЛЖ Интеграл линейной скорости кровотока (см/с)
Тахисистолическая ФП (п=54) Нормосистолическая ФП (п=48)
исходный после восстановления синусового ритма исходный после восстановления синусового ритма
Норма (п=41) 39,1 ±6,1 110,8 + 7,6 (п=21) 35,6±6,4 35,7 ±6,2 98,2 ±7,9 (п=20) 36,6±6,7
Ригидный тип (п—61) 29,7 ± 7,2 * 83,4 ± 8,3 * (п-33) 35,3±6,7 32,6 ±6,4 98,1 ±7,1 (п=28) 34Д±7,4
Примечание в числителе дроби абсолютное значение ИЛСК, в знаменателе — отношение ИЛСК при ФП к ИЛСК после восстановления синусового ритма, * — значение р<0,0001 в сравнениях показателей при нормальной ДФЛЖ и ригидном типе
При нормосистолической форме ФП ИЛСК в СМА и отношение их до и после восстановления синусового ритма сохранялись на прежнем уровне вне зависимости от состояния ДФЛЖ
По выбранному алгоритму оценили результаты при проведении урежающей ЧЖС терапии Снижение средней ЧЖС от 144 до 108 в мин у больных с тахисистолической ФП и нормальной ДФЛЖ не сопровождалось увеличением ИЛСК, нормированного к величине ИЛСК при синусовом ритме (с 110,8±7,6% до 111,5±4,5%) Медиана данного показателя на фоне лечения амиодароном равнялась 111,1%, а медиана ЧЖС — 136 в мин Сравнение в отклонениях между показателями ИЛСК и ЧЖС показало следующую закономерность При ЧЖС в интервале 131-143 в мин
(136,3±4,7) ИЛСК, нормированный к ИЛСК при синусовом ритме находился в пределах 112,1-128,0% (116,9±5,1) и снижался при более высокой ЧЖС При ригидном типе ДДЛЖ в ходе лечения амиодароном средняя ЧЖС снизилась со 144 до 110 в мин При этом ИЛСК, нормированный к величине ИЛСК при синусовом ритме, увеличился с 83,4±8,3% до 105,2±5,3% (р<0,0001) Сопоставление значений этого же показателя при нормальной ДФЛЖ и ригидном типе ДДЛЖ выявило ту же тенденцию в сохранении более высоких показателей кровотока в первом случае, чем во втором (111,5±4,5% против 105,2±5,3% соответственно, р<0,001)
Следовательно, ригидный тип ДДЛЖ при тахисистолической форме ФП сопровождается снижением мозговою кровотока в большей мере, чем при нормальной ДФЛЖ В первом случае такое снижение отмечается при ЧЖС, превышающей 135 в мин, а во втором — 110 в мин С другой стороны, ИЛСК при нормосистолической форме ФП не зависел от состояния ДФЛЖ
Следовало полагать, что длительность пауз между желудочковыми активациями будет оказывать влияние на показатели мозгового кровотока Обычно в клинической кардиологии для подсчета пауз между очередными активациями желудочков используют критерий удлинения интервала Ш1>2 с (АДабровски и соавт, 1999, Л М Макаров, 2003) В нашем исследовании такие паузы регистрировались у 18 из 29 больных с брадисистолической ФП, развившейся на фоне урежающей ритм терапии амиодароном Измерение у них мозгового кровотока по ИЛСК в СМА во время пауз длительностью 2,23±0,15 с показало снижение его до 59,0±3,4% от соответствующего значения скорости у пациентов с нормосистолической ФП В свою очередь, увеличение частоты пауз, особенно во время сна, может привести к значительному ухудшению мозгового кровотока Свидетельством тому, что количество таких пауз во время сна значительно возрастает, являются многочисленные исследования В частности, количество пауз в ночное время может увеличиваться в десятки раз по сравнению с активным периодом (Л В Чирейкин, Б А Татарский, 1999, Ю В Шубик, 2001)
В этой связи важными являются сообщения о возможности очагового ишемического поражения головного мозга при нарушении ауторегуляции мозгового кровотока в случаях даже коротких, но часто повторяющихся пауз между желудочковыми активациями (А В Фонякин и соавт, 2005) По данным А М Вейна и соавт (2002), в норме мозговой кровоток во время сна должен увеличиваться Это предполагает, что с увеличением количества пауз может возникнуть несоответствие между потребностью мозга в крови и возможностью ее доставки Сравнительно небольшое, но длительное снижение перфузии головного мозга, сопровождающее ФП, увеличивает вероятность ишемического повреждения и с течением времени может вести к когнитивному дефициту (Ь.Кл1апс1ег й а1, 1998) Поэтому в практической деятельности следует учитывать возможность гемодинамических расстройств у больных с брадисистолической формой ФП
Качество жизни при ЖЭ и ФП и изменение его в процессе антиаритмической терапии. Наблюдавшиеся с ЖЭ (п-38) были представлены пациентами без органической патологии сердечно-сосудистой системы (п=21) и с ГБ II стадии (п=17) По исходному суточному количеству ЖЭ между ними не было достоверных различий (х2=0,366, р=0,978) Все обследованные имели частую ЖЭ не менее двух тысяч за сутки Лечение их бетаксололом привело к уменьшению суточного количества ЖЭ как минимум на 50% Между пациентами не было также отличий по исходному показателю качества жизни (23,3±12,3 против 17,2±9,7) Уменьшение количества ЖЭ после 10-дневной антиаритмической терапии составило 85,1±7,1% от исходного у пациентов с НЦД и 81,1-6,7% с ГБ II стадии
После проведенной терапии сравнительный анализ по КЖ выявил следующие особенности (рис 1) Состояние КЖ по балльной оценке у больных с НЦД осталось прежним Однако у пациентов с ГБ II стадии КЖ улучшилось, о чем свидетельствовало снижение оценки с 17,2±9,7 баллов до 13,2±6,7 (р=0,002) В то же время не было выявлено корреляционной связи между суточным количеством ЖЭ и КЖ ни при НЦД, ни при ГБ
КЖ в баллах
ГБ 11 ст.
р<0,05;
ЕЗ До лечения □ После лечения
Рис. 1. Изменение КЖ у больных с НЦЦ и ЖЭ о процессе антиаритмической терапии бетаксололом (уменьшение числа баллов соответствует улучшению КЖ)
Среднее САД у пациентов с ГБ II стадии исходно составляло 148.3±5,8 мм рт, ст. ДАД — 94,3±3,9 мм рт. ст, В процессе лечения САД снизилось в среднем на 8,1 ±3,4% (р<0,05), а ДАД на 6,5±2,5 (р<0,05). Между степенью снижения АД и улучшением КЖ обнаружилась умеренная корреляционная связь (гелд =0.54, р=0,02; гддд -т0,50, р—0.03). Возможно, различия в динамике КЖ определялись выраженной «невротизацией» больных с НЦД, и наоборот, позитивный эффект с улучшением КЖ был достигнут у больных с ГБ в связи с антигипертензивным действием бетаксолола.
У 20 больных с тзхисистолической формой ФП КЖ исследовали исходно, после насыщения ам подареном VI через 3 недели на фоне восстановленного синусового ритма. Средняя ЧСС по данным суточного мониторирования ЭКГ исходно составила 110,5±10,1, после урежения ЧЖС амиодароном — 73.2±6,4 и после восстановления синусового ритма — 58,9±5,6 в мин. В го же время количество баллов по анкете КЖ оказалось у них
равным 20,6±8,3, 17,9±6,6 и 12,7±4,3 соответственно. КЖ достоверно улучшилось после урежения ЧЖС амиодароном и перехода ФП из тахисистолической формы в нормоси столичес кую, а также после восстановления синусового ритма (рис.2).
КЖ в баллах 25 -20 -15 -10 -5 —
Рис. 2. Изменение КЖ у больных с ФП в процессе ант и аритмической терапии (СР — после восстановления синусового ритма, ФП1 — тахисистолическая ФП до начала лечения, ФП2 — ФП на фоне урежения ЧЖС амиодароном)
Корреляционная связь между среднесуточной ЧЖС на фоне тахисистолической ФП и показателем КЖ выявлялась исходно (г=0,61; р-0,005), но после урежения ЧЖС амиодароном нивелировалась (г=0,23; р=0,36). Возможно, это связано с известным фактом возникновения при тахисистолической ФП ошущений сердцебиения, слабости и одышки, которые уменьшаются при урежении ЧЖС.
Таким образом, восстановление синусового ритма у пациентов как с тахисистолической, так и с нормосистолической формой ФП обеспечивает улучшение КЖ. Такой же эффект наблюдается после перехода тахисистолической ФП в нормосистолическую форму.
Итак, ЖЭ не вызывают существенного снижения мозгового кровотока Исключение составляют лишь больные с ДДЛЖ и периодами бигеминии Количество экстрасистол не коррелирует с КЖ Наиболее близкие к нормальным показатели мозгового кровотока отмечаются у больных с ФП при ЧЖС в интервале 75-135 в минуту в случаях с нормальной ДФЛЖ и 75-110 — с ригидным типом ДДЛЖ Адекватный контроль ЧЖС в указанных пределах при сохранении ФП или восстановление синусового ритма улучшают КЖ пациентов
1 Экстрасистолические желудочковые сокращения сопровождаются снижением скорости мозгового кровотока в среднем на 26,5% по сравнению с синусовыми сокращениями Правожелудочковые экстрасисюлы в большей степени ухудшают мозговой кровоток, чем левожелудочковые, а экстрасистолы с более длинным интервалом ОТ — в большей степени, чем с укороченной электрической систолой Ригидный тип диастолической дисфункции левого желудочка является фактором, дополнительно усугубляющим редукцию мозгового кровотока при экстрасистолии
2 Редукция мозгового кровотока на 6,1% по сравнению с синусовым ритмом происходит при соотношении желудочковых экстрасистол и общего числа сердечных сокращений 1 5, а при бигеминии составляет 18,2% У больных с ДДЛЖ и бигеминией снижение мозгового кровотока достигает 20,2%
3 Максимальные значения скорости мозгового кровотока при фибрилляции предсердий регистрируются при частоте желудочковых сокращений в интервале 100-115 в минуту, а наибольшее ее снижение отмечается при брадисистолической форме Значения скорости мозгового кровотока, наиболее близкие к таковым при синусовом ритме с нормосистолией, отмечаются при фибрилляции предсердий с частотой желудочковых сокращений в интервале 75-135 в минуту при нормальной диастолической функции левого желудочка и 75-110 — при ригидном типе
диастолической дисфункции Паузы между желудочковыми активациями продолжительностью от 2 до 2,5 с на фоне фибрилляции предсердий сопровождаются снижением скорости церебрального кровотока на 41% по сравнению с нормосистолической фибрилляцией предсердий
4 Между суточным количеством желудочковых экстрасистол и качеством жизни отсутствует корреляционная связь Эффективная антиаритмическая терапия бетаксололом не приводит к улучшению качества жизни больных с желудочковой экстрасистолией без органической кардиальной патологии, но повышает его при желудочковой экстрасистолии на фоне гипертонической болезни II стадии
5 Улучшение качества жизни отмечается у больных с тахисистолической формой фибрилляции предсердий как при урежении частоты желудочковых сокращений до нормосистолии с помощью амиодарона, так и при восстановлении и поддержании синусового ритма
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1 Применение медикаментозной антиаритмической терапии при желудочковой экстрасистолии у больных без органических заболеваний сердечно-сосудистой системы, исходя из такого показания как «негативное влияние аритмии на гемодинамику», нецелесообразно Основанием для этого служит незначительная гемодинамическая роль желудочковых экстрасистол и отсутствие улучшения качества жизни под влиянием успешной антиаритмической терапии Антиаритмическая терапия показана больным с диастолической дисфункцией левого желудочка и периодами бигеминии
2 При проведении урежающей частоту желудочковых сокращений терапии при фибрилляции предсердий у больных с нормальной диастолической функцией левого желудочка целесообразно поддерживать частоту в интервале 75-135 в мин, а у больных с ригидным типом диастолической дисфункции — 75-110 в мин
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1 Зафираки В К Влияние желудочковой экстрасистолии на мозговой кровоток / В К Зафираки, С Г Канорский // Российская кардиология от центра к регионам материалы российского национального конгресса кардиологов — Томск, 2004 — С 175
2 Зафираки В К Диастолическая функция левого желудочка и мозговой кровоток у больных с желудочковой экстрасистолией / В К Зафираки, С Г Канорский//Там же — С 175-176
3. Зафираки В К Церебральная гемодинамика при различных вариантах желудочковой экстрасистолии / В К Зафираки, С Г Канорский // Перспективы российской кардиологии материалы российского национального конгресса кардиологов -М,2005 — С 123-124
4 Зафираки В К Влияние диастолической функции левого желудочка на церебральную гемодинамику у больных с фибрилляцией предсердий / В К Зафираки, С Г Канорский//Там же — С 124
5 Зафираки В К Влияние желудочковой экстрасистолии на церебральную гемодинамику / В К Зафираки, С Г. Канорский // Вестн аритмологии — 2005 — №37 — С 44-46
6 Зафираки В К. Влияние тахисистолической формы фибрилляции предсердий на мозговой кровоток / В К Зафираки, С Г Канорский // VII конгресс с международным участием «Паллиативная медицина и реабилитация» сб науч работ — Кемер, 2005 — С 39-40
7 Зафираки В.К Влияние нормосистолической формы фибрилляции предсердий на мозговой кровоток / В К Зафираки, С Г Канорский // Там же -С 40
8 Зафираки В К Гемодинамические эффекты желудочковых экстрасистол в зависимости от их локализации и продолжительности электрической систолы / В К Зафираки // Достижения отечественной кардиологии тезисы научной конференции РКНПК МЗ РФ и Всероссийской конференции молодых ученых-кардиологов — М. 2005 — С 31
9 Канорский С Г Предупреждение ишемического инсульта у больных фибрилляцией предсердий среднего возраста влияние поддержания синусового ритма, аспирина, варфарина и симвастатина / С Г Канорский, В И Шевелев, В К Зафираки//Кардиология -2007 -№1 -С 26-30
Формат А5
Подписано в печать 09 04 2007 г Набор компьютерный
__Гарнитура Times Упл 1,25 Тираж 100 экз Заказ №031-07___
Отпечатано в типографии ГОУ ВПО «Кубанский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
г Краснодар, ул Седина, 4
Лечение нарушений ритма сердца
Цель данной работы — отразить современные представления о лечении
наиболее распространенных нарушений ритма.
Общие принципы лечения аритмий.
- В большинстве случаев аритмия является следствием основного заболевания
(вторична) и, поэтому, лечение основного заболевания может способствовать
лечению нарушения ритма. Например: тиреотоксикоз при фибрилляции предсердий
или ишемическая болезнь сердца при желудочковой экстраситолии.
- Большинство аритмий сопровождается психосоматическими расстройствами,