Ишемический инсульт и транзиторная ишемическая атака
Выделяют инсульт в стадии прогрессирования (или инсульт в развитии), когда клинически регистрируется нарастание степени неврологических нарушений, и завершенный инсульт, когда неврологические нарушения стабильны или постепенно регрессируют. Причины ТИА и ишемического инсульта не имеют качественных различий. Клинический исход ишемического нарушения мозгового кровообращения определяется в основном калибром артерии, в которой нарушен кровоток, локализацией и скоростью развития закупорки мозговой артерии, состоянием коллатерального кровообращения и реологическими свойствами крови.
Этиология и патогенез
К основным факторам риска ишемических нарушений мозгового кровообращения относят пожилой и старческий возраст, артериальную гипертонию, гиперхолестеринемию, атеросклероз церебральных и прецеребральных (сонных и позвоночных) артерий, курение, заболевания сердца (мерцательная аритмия, инфаркт миокарда, аневризма левого желудочка, искусственный клапан сердца, ревматическое поражение клапанов сердца, миокардиопатии, бактериальный эндокардит), сахарный диабет.
Ишемические нарушения мозгового кровообращения примерно в 90-95 % случаев вызваны атеросклерозом церебральных и прецеребральных артерий, поражением мелких церебральных артерий вследствие артериальной гипертонии, сахарного диабета или кардиогенной эмболией. В более редких случаях они обусловлены васкулитом, гематологическими заболеваниями (эритремия, серповидно-клеточная анемия, тромбоцитоз, лейкемия), иммунологическими нарушениями (антифосфолипидный синдром), венозным тромбозом, расслоением прецеребральных или церебральных артерий, мигренью, у женщин — приемом оральных контрацептивов. Среди ишемических инсультов выделяют атеротромботический (включая артерио-артериальную эмболию), кардиоэмболический, гемодинамический, лакунарный и реологический.
Артериальная гипертония — один из главных факторов риска ишемических нарушений мозгового кровообращения. Установлена прямая связь между уровнем артериального давления и риском развития ишемического инсульта; увеличение диастолического артериального давления на 7,5 мм рт. ст. сочетается с увеличением риска инсульта почти в 2 раза. Артериальная гипертония приводит к развитию ишемических нарушений мозгового кровообращения напрямую, вызывая в перфорирующих артериях мозга липогиалиноз и фибриноидный некроз, а также опосредованно — через стимулирование атеросклероза прецеребральных, крупных и средних церебральных артерий и развитие сердечных заболеваний, например инфаркта миокарда и мерцательной аритмии, осложняющихся кардиогенной эмболией.
Атеросклероз — наиболее частое заболевание церебральных и прецеребральных артерий, вызывающее ишемические нарушения мозгового кровообращения. К основным факторам риска атеросклероза относят возраст, мужской пол, курение, артериальную гипертонию, сахарный диабет, повышение концентрации липидов (увеличение концентрации общего холестерина и липопротеидов низкой плотности при снижении липопротеидов высокой плотности) и фибриногена в плазме. Атероматозные бляшки поражают прецеребральные (сонные, позвоночные), крупные и средние церебральные артерии, преимущественно в местах их деления, извитости и слияния. В прецеребральных артериях они образуются главным образом в области проксимальных отделов внутренней сонной и позвоночной арте-рий. Церебральные артерии чаще поражаются в области артериального круга большого мозга. Образование атеросклеротической бляшки обусловлено отложением липидов в стенке артерий. Рост атеросклеротической бляшки осложняется ее изъязвлением и тромбообразованием вследствие адгезии тромбоцитов. Увеличение атеротромботической бляшки может привести к сужению просвета артерии и ее полной закупорке; снижение кровотока возникает при гемодинамически значимом стенозе (сужение 70-75 % площади просвета артерии) и далее нарастает пропорционально степени сужения. Фрагменты тромба и атеросклеротической бляшки могут быть источником эмболии более дистального отдела артерии (артерио-артериальная эмболия).
Исход атеросклеротического тромбоза или эмболии определяется скоростью его развития, локализацией закупорки, состоянием коллатерального кровообращения и активностью фибринолитической системы крови. При постепенном развитии атеротромбоза формируется коллатеральное кровоснабжение, поэтому закупорка одной или даже нескольких прецеребральных артерий может не привести к локальной ишемии мозга и протекать бессимптомно. В случаях быстрого развития тромботической окклюзии или эмболии прецеребральной либо церебральной артерии возможности коллатерального кровообращения ограничены, но иногда наблюдается лизис тромба или эмбола вследствие повышения фибринолитической активности крови. В тех случаях, когда защитные механизмы не могут компенсировать атеросклеротический стеноз или закупорку артерии, развивается клинически значимая локальная ишемия мозга. Атеротромбоз и эмболия (артерио-артериальная) составляют причину около 50 % ишемических нарушений мозгового кровообращения.
Кардиогенная эмболия является причиной приблизительно 20% ишемических инсультов и ТИА. Она обычно развивается вследствие формирования эмболических фрагментов на клапанах сердца или образования внутрисердечного тромба. К доказанным кардиогенным факторам риска эмболии мозга относят фибрилляцию предсердий (мерцательная аритмия), искусственный клапан сердца, ревматическое поражение клапанов сердца, недавний (до 1 мес) инфаркт миокарда, внутрисердечный тромб, внутрисердечное объемное образование (миксома). Возможными кардиогенными факторами риска эмболии мозга считают синдром слабости синусового узла, незаросшее овальное отверстие, атеросклеротические отложения в грудной части аорты, инфаркт миокарда давностью 2-6 мес, гипо- или акинетический сегмент левого желудочка, кальцификацию митрального или аортального клапана. Неревматическая мерцательная аритмия составляет большинство случаев кардиаль-ной эмболии в мозг; она обычно вызвана ишемической болезнью сердца на фоне атеросклероза венечных артерий и артериальной гипертонии. Риск развития инсульта при мерцательной аритмии достигает 4,5 % в год, если больной не принимает антикоагулянты и(или) антиагреганты.
Риск инсульта возрастает при увеличении возраста больного, предшествующей кардиальной эмболии, артериальной гипертонии, сахарном диабете, тромбах левого предсердия и дисфункции левого желудочка и предсердия по данным ЭхоКГ. Ревматическое поражение сердца может привести к эмболии мозга уже в острой стадии заболевания (вследствие отрыва вегетирующих образований на клапанах сердца), но чаще вызывает кардиоэмболический инсульт в хронической стадии после появления мерцания предсердий. У больных ревматическим эндокардитом с мерцательной аритмией инфаркт мозга развивается в 30 % случаев, по клиническим данным, и в 50 % случаев — по данным вскрытий.
При инфекционном эндокардите примерно у 20 % больных возникает эмболия сосудов мозга. Операции на сердце, особенно на клапанном аппарате, сопряжены с повышенным риском церебральной ишемии. Для всех искусственных клапанов сердца общий риск эмболии составляет около 2 % в год, если не применяются антикоагулянты.
Инфаркт миокарда примерно в 2 % случаев осложняется ишемическим инсультом; чаще это происходит в первые 2 нед после развития сердечного заболевания. Пролапс митрального клапана часто встречается у здоровых лиц и не рассматривается как причина кардиогенной эмболии в мозг, за исключением тех редких случаев, когда он осложняется грубой митральной регургитацией, тромбозом левого предсердия, инфекционным эндокардитом или мерцательной аритмией. Парадоксальная эмболия в мозг может возникнуть вследствие попадания эмболов из венозной системы или правого предсердия в случаях незаращенного овального отверстия, дефекта межпредсердной или межжелудочковой перегородки. Незаросшее овальное отверстие имеется у 15-25 % людей, из них почти у 15 % оно функционирует и может привести к попаданию венозных эмболов в церебральные артерии с развитием инфаркта мозга.
Лакунарный инфаркт составляет 15-30 % случаев ишемического инсульта. Лакунарные инфаркты представляют небольшие по величине (до 15 мм в диаметре) очаги ишемии, которые локализуются в белом веществе полушарий большого мозга, в мозговом стволе и мозжечке. В процессе организации этих инфарктов образуется маленькая киста — лакуна (франц. lacunarie — полость, лакуна). Около 80 % лакун обнаруживается в перивентрикулярной области, базальных узлах или таламусе, 20 % лакун — в мозговом стволе и мозжечке. Их развитие связывают с поражением мелких (40-80 мкм в диаметре) перфорирующих ветвей средней мозговой артерии, задней мозговой артерии и базилярной артерии. Коллатеральное кровообращение в бассейнах перфорирующих артерий слабо выражено, поэтому стеноз или закупорка этих артерий вследствие липогиалиноза, фибриноидного некроза, микроатеромы или тромбоза приводит к развитию локальной ишемии и небольшого инфаркта в бассейне пораженной артерии. В качестве основных причин поражения мелких перфорирующих артерий мозга считают возраст, артериальную гипертонию и сахарный диабет. Около 25 % ТИА связывают также с поражением мелких перфорирующих артерий мозга.
Гемодинамические ишемические нарушения мозгового кровообращения могут возникнуть при стенозе прецеребральных и(или) церебральных артерий, когда артериальное давление падает ниже нижней границы ауто-регуляции мозгового кровообращения, что вызывает гипоперфузию головного мозга. Значительное снижение артериального давления возможно вследствие различных причин: глубокий сон, резкий подъем из горизонтального положения или длительное пребывание в вертикальном положении (ортостатическая артериальная гипотензия), передозировка гипотензивных препаратов, инфаркт миокарда, нарушение сердечного ритма, кровотечение, гиповолемия и др. Локальная ишемия чаще отмечается в зонах смежного кровоснабжения передней, средней и задней мозговых артерий или в бассейне наиболее суженной прецеребральной либо церебральной артерии. В редких случаях гемодинамические ишемические нарушения мозгового кровообращения возникают по механизму "обкрадывания" — ишемии мозга вследствие отвлечения крови периферическую систему кровообращения или при перераспределении крови между разными сосудистыми системами. В части случаев (5-10 %) ишемические нарушения мозгового кровообращения вызваны относительно редкими заболеваниями, приводящими к поражению (закупорке или сужению) прецеребральных и церебральных артерий и вследствие этого к локальной ишемии мозга. Расслоение прецеребральных и реже церебральных артерий составляет причину около 2 % случаев ишемического инсульта, оно чаще встречается у молодых женщин. Расслоение внутренней сонной и позвоночной артерий может возникнуть вследствие травмы, неудачной манипуляции на шейном отделе позвоночника или аномалии развития. Образовавшаяся под внутренней оболочкой артерии гематома вызывает сужение ее просвета и может быть причиной тромбоза или эмболии.
Фиброзно-мышечная дисплазия может развиваться в одной или обеих внутренних сонных артериях и проявляется гиперплазией внутренней и средней оболочек артерии, что приводит к частичному или полному закрытию просвета артерии и иногда осложняется расслоением с последующим стенозом или образованием аневризмы.
Редкой причиной ишемического нарушения мозгового кровообращения может быть артериит мозговой артерии, который способен привести к стенозирванию артерии до полной ее окклюзии или быть источником артерио-артериальной тромбоэмболии. В качестве причин инфекционного артериита известны сифилис, малярия, риккетсиозные заболевания, туберкулез, аспергиллез, опоясывающий герпес, трихиноз, мансониевый шистосомоз, лаймская болезнь. Неинфекционный артериит церебральных артерий может возникнуть при СКВ, узелковом периартериите, гранулематозном ангиите, височном артериите, болезни Такаясу, болезни Бехчета, гранулематозе Вегенера, ревматоидном артрите, синдроме Шегрена, саркоидозе.
Гематологические нарушения могут привести к гиперкоагуляции и повышенной вязкости крови, предрасполагающими к развитию тромбозов в церебральных артериях (реологический инсульт). К этим нарушениям относятся полицитемии, тромбоцитопеническая пурпура, серповидно-клеточная анемия, диспротеинемии, антифосфолипидный синдром, ДВС-синдром и др.
Патогенез ишемии. Независимо от причины, вызвавшей локальную ишемию мозга, развивается каскад патобиохимических изменений, приводящих к необратимому повреждению нервной ткани по механизмам некроза и апоптоза.
Мозг получает необходимую энергию в результате окисления глюкозы и образования АТФ (окисление одной молекулы глюкозы дает 38 молекул АТФ). При ишемии мозга содержание кислорода в крови недостаточно для аэробного окисления глюкозы, поэтому возникает анаэробный путь расщепления глюкозы, который лишь частично компенсирует энергетические потребности мозга (анаэробное расщепление одной молекулы глюкозы дает лишь 2 молекулы АТФ).
Оптимальный объем мозгового кровотока составляет 50-60 мл на 100 г/мин. Падение мозгового кровотока ниже 20 мл на 100 г/мин вызывает нарушение функционального состояния нейронов коры большого мозга, а снижение до 10-15 мл на 100 г/мин приводит к быстрым в течение нескольких минут необратимым изменениям в нейронах. В течение 6-8 мин нейроны остаются жизнеспособными и могут восстановить свои функции при нормализации кровоснабжения. При локальной ишемии мозга вокруг участка с необратимыми изменениями формируется зона, кровоснабжение которой ниже уровня, необходимого для нормального функционирования, но выше 10-15 мл на 100 г/мин (критический порог необратимых изменений) — "ишемическая полутень". Гибель клеток в области "ишемической полутени" приводит к увеличению размеров инфаркта. Однако эти клетки в течение определенного времени могут сохранять свою жизнеспособность, поэтому развитие необратимых изменений в них можно предотвратить при восстановлении кровотока и использовании нейропротекторных препаратов. Продолжительность "терапевтического окна" — периода, в течение которого возможно восстановление функции нейронов в области "ишемической полутени" — точно не установлена. Хотя для большинства клеток это время ограничивается часами, не исключено, что способность к восстановлению сохраняется в течение нескольких суток. Анаэробный путь расщепления глюкозы вызывает повышенное образование молочной кислоты и ацидоз. Лактат-ацидоз в сочетании с гипоксией нарушает функцию ферментной системы, управляющей транспортом ионов, что приводит к выходу ионов К+ из клетки во внеклеточное пространство и перемещению ионов Na+ и Са2+ в клетку (нарушение ионного гомеостаза клетки). Важное значение имеет повышенный выброс во внеклеточное пространство возбуждающих нейромедиаторов — глутамата и аспартата, недостаточность их обратного захвата астроглией, перевозбуждение глутаматных НМДА-рецепторов и раскрытие контролируемых ими кальциевых каналов, что приводит к дополнительному притоку ионов Са2+ в нейроны. Избыточное накопление Са2+ внутри клетки активирует ферменты (липазы, протеазы, эндонук-леазы), вызывает перегрузку митохондрий с разобщением окислительного фосфорилирования и усиливает процессы катаболизма. Распад фосфо-липидов в мембранах внутриклеточных органелл и наружной клеточной мембране усиливает перекисное окисление липидов и образование свободных радикалов. Увеличение содержания внутриклеточного кальция, образование свободных кислородных радикалов и липидных перекисей оказывают нейротоксическое действие, что приводит к гибели (некрозу) нервной ткани.
Отек головного мозга возникает через несколько минут после развития локальной ишемии вследствие повреждения клеточной мембраны и накопления воды в клетке (цитотоксический отек) и нарастает спустя несколько дней из-за повреждения ГЭБ и попадания плазмы во внеклеточное пространство мозга (вазогенный отек). Выраженность отека мозга находится в прямой зависимости от размеров инфаркта мозга, поэтому он максимален при обширных атеротромботических и кардиоэмболических инсультах и практически отсутствует при лакунарном инсульте. Отек мозга вызывает повышение давления во внесосудистом пространстве и переполнение сосудов, что может привести к геморрагической трансформации инфаркта и дислокации мозгового ствола. Геморрагическая трансформация возникает примерно в 5 % случаев и чаще при обширных по размерам инфарктах мозга. Смещение промежуточного и среднего мозга в рострокаудальном направлении и их сдавление в тенториальном отверстии представляют наиболее частую причину смерти в 1-ю неделю обширного ишемического полушарного инсульта. Реже летальный исход возникает вследствие сдавления среднего мозга парагиппокампальной извилиной.
Если летального исхода не наступает, отек мозга достигает максимума на 2-4-й день заболевания, а затем постепенно спадает в течение 1-2 нед, некротизированная ткань мозга подвергается разжижению или резорбции. В дальнейшем на месте инфаркта формируется соединительная ткань (глиомезодермальный рубец), при этом может образоваться кистообразная полость.
Ишемический атеросклероз нижних конечностей — вопрос №2114
Здравствуйте. Моему дяде 50 лет, у него Ишемический атеросклероз нижних конечностей,на одной ноге началась гангрена, ногу чуть выше колена ампутировали. Тоже самое начинается с другой ногой, собираются ампутировать пока пальцы. Можно ли спасти эту ногу у Вас? И сколько это будет стоить?
Ишемический инсульт можно предупредить
Покровский А.В. Кияшко В.А.
РМАПО, Институт хирургии им. А.В. Вишневского, Москва
И нсульт является вторым по частоте «убийцей» людей во всем мире. В современной России среди причин смертности на втором месте после инфаркта миокарда стоит инсульт головного мозга. Ежегодно 450000 человек переносят инсульт . фактически это население большого города. Показатели смертности населения в России в 4 раза выше, чем в США и Канаде. Среди европейских стран показатель смертности от цереброваскулярных заболеваний в России самый высокий. По данным Всероссийского центра профилактической медицины, в нашей стране от цереброваскулярных заболеваний умирает 25% мужчин и 39% женщин.
Частота инсульта колеблется от 460 до 560 случаев на 100000 населения. В крупнейших городах страны ситуация с данным видом патологии крайне неблагоприятная. В Санкт–Петербурге, например, частота инсульта в 1997 году составила 528 случаев на 100000 населения (по данным Скоромца А.А.), при этом летальность при ишемическом инсульте в том же году равнялась 39%. В Москве количество больных с инсультом в течение уже длительного времени (почти 20 лет) не снижается меньше 36000 пациентов ежегодно. Следует подчеркнуть катастрофические последствия ишемического инсульта – до 84–87% больных умирают или остаются инвалидами и только 10–13% пациентов полностью выздоравливают. Но даже среди выживших больных у 50% наступают повторный инсульт в последующие 5 лет жизни.
Среди всех инсультов 80% составляют инсульты ишемического характера . Причем 95% ишемических инсультов и транзиторных ишемических атак (ТИА) связаны с осложнениями эмболического характера из бляшек, локализующихся в экстракраниальных отделах артериальной системы. Необходимо также подчеркнуть, что только 15% больных, перенесших инсульт, имели в анамнезе четкие указания на наличие неврологической симптоматики в виде ТИА.
В последние годы частота ишемических инсультов стала превышать в 2–3 раза количество инфарктов миокарда.
Выздоровление или положительная динамика неврологического статуса после перенесенного инсульта создает у врача и у самого больного иллюзию высокой эффективности медикаментозной терапии. В действительности судьба пациента зависит от локализации, размеров ишемического очага в головном мозге, а также вероятности развития повторного инсульта на ипси– или контрлатеральной стороне. madmax
Учитывая, что большинство инсультов носят эмболический характер, успешное лечение пациента является, по существу, «счастливой для него случайностью», а вовсе не результатом успешной терапии заранее спланированной врачом, так как медикаментозно предупредить эмболию и инсульт практически невозможно.
Этиология и патогенез
В последние годы отмечено значительное увеличение частоты атеросклероза в развитии стенозов и окклюзий брахиоцефальных артерий у лиц молодого и среднего возраста. Его доля среди всех других причин – более 80%.
Средний возраст больных составляет 50–60 лет, частота случаев у мужчин в 4 раза выше, чем у женщин. Более чем у 50% патология ветвей дуги аорты сочетается с артериальной гипертензией.
Атеросклероз в брахиоцефальных артериях чаще всего локализуется в бифуркации общей сонной артерии. Изолированные поражения артерий встречаются гораздо реже, чем множественные. Частота поражения брахиоцефальных артерий примерно такова: бифуркация сонной артерии 80%, подключичный сегмент 10–15%, брахиоцефальный ствол и устье левой сонной артерии 5–10%.
Другими причинами поражения артериальной системы могут быть:
- Патологическая извитость сонных и позвоночных артерий.
- Неспецифический аортоартериит, встречающийся преимущественно у женщин в возрасте 20–30 лет.
Нарушения мозгового кровообращения из–за поражения артерий в экстракраниальном отделе определяются в основном тремя факторами:
1. Наличием распадающейся атероматозной бляшки в бифуркации общей сонной артерии или устье позвоночной артерии, которая является источником микроэмболий в интракраниальные отделы артериальной системы. Морфологическим субстратом эмбола могут быть: тромбы, агрегаты тромбоцитов, эритроцитов, элементы кальция и ткань самой бляшки.
2. Гемодинамический фактор определяется степенью стеноза артерии и наличием множественных стенозов или окклюзий других брахиоцефальных артерий. Объемы кровотока по артерии начинают снижаться, если внутренний диаметр сосуда сужен более 60%.
3. Важное значение в компенсации кровообращения в зоне ишемического очага играет состояние Виллизиевого круга. Возможны врожденные аномалии его развития в виде аплазии или гипоплазии соединительных артерий, а также приобретенная патология (сужения, окклюзии).
Особое место в развитии хронической сосудисто–мозговой недостаточности занимают клинические ситуации, когда имеет место обратный кровоток по позвоночным артериям (при резком стенозе или окклюзии устья подключичной артерии) или по сонным артериям (при стенозе или окклюзии устья брахиоцефального ствола). Это становится необходимым для поддержания кровообращения в ишемизированной верхней конечности. При этом синдроме обкрадывания головной мозг теряет от 10 до 20% объема необходимого кровотока, что клинически проявляется в первую очередь вертебробазилярной недостаточностью.
Клиника
Клиническая симптоматика и степень ее выраженности в основном определяется вышеуказанными факторами хронической сосудистой мозговой недостаточности.
Мы выделяем 4 степени сосудистой мозговой недостаточности:
1 степень – асимптомная;
2 степень – преходящие нарушения мозгового кровообращения (ПНМК) или транзиторные ишемические атаки (ТИА) длительностью не более суток;
3 степень – хроническая мозговая недостаточность – дисциркуляторная энцефалопатия;
4 степень – ишемический инсульт и его последствия. Нарушения кровообращения могут быть в различных сосудистых бассейнах мозга: каротидном и вертебральном.
- Асимптомное течение – это те состояния, когда у больного полностью отсутствуют какие–либо жалобы, указывающие на недостаточность мозгового кровообращения, но при физикальном обследовании (аускультация) или по данным инструментальных методов диагностики есть указания на различную степень поражения артерий, кровоснабжающих головной мозг.
- Преходящие нарушения мозгового кровообращения – эта группа больных часто встречается в практике невролога, так как у больного появляется четкая неврологическая симптоматика, указывающая на ишемию каротидного или вертебрального бассейна. Частота эпизодов колеблется от 10–20 раз в день до 1–2 раз в месяц и даже реже. Пароксизмы провоцируются физической нагрузкой, сменой положения туловища. Кроме чисто неврологической симптоматики, у больных могут также выявляться нарушения функции зрения. Преходящая слепота на один глаз, то есть «amaurosis fugax» является одним из ведущих симптомов стеноза сонной артерии, но, к сожалению, врачи (включая окулистов) плохо знают об этом.
- Дискуляторная энцефалопатия – характеризуется постоянными головными болями, резким снижением работоспособности, расстройствами сна. При неврологическом обследовании обнаруживаются псевдобульбарные, пирамидные и экстрапирамидные симптомы различной степени выраженности.
- Ишемический инсульт в каротидном бассейне развивается значительно чаще, чем в вертебральном. Особо следует отметить, что почти в 70% случаев инсульт в каротидном бассейне развивается внезапно, без каких–либо предшествующих ишемических атак. При инсульте длительность сохранения симптомов составляет более 24 часов. Клиника тяжелых остаточных симптомов инсульта наблюдается у больных с окклюзией внутренней сонной артерии и продолженным тромбозом из бифуркации общей сонной артерии в интракраниальные ее отделы.
Диагностика
Особенности сбора анамнеза
Врач никогда не должен удовлетворяться отсутствием жалоб у пациента. Необходимо расспрашивать больного о наличии у него даже «микро»жалоб, типичных для поражения сонных артерий.
Наличие у пациента жалоб, касающихся поражений других артериальных бассейнов, также должно акцентировать внимание врача в плане выявления патологии брахиоцефальных артерий. Так, по данным литературы, среди больных с ишемией нижних конечностей скрининговое исследование с помощью ультразвуковой диагностики выявляет различные степени стеноза сонных артерий в 20–60% наблюдений.
Физикальные методы
Проводится аускультация в типичных точках. При этом больного просят сделать предварительно вдох и выдох, чтобы исключить наложение дыхательных шумов. Особо следует подчеркнуть необходимость аускультации брахиоцефальных артерий у лиц старше 40 лет, особенно при наличии у пациента жалоб, характерных для заболеваний артериальной системы (перемежающаяся хромота, артериальная гипертензия, ишемическая болезнь сердца). Выполняется сравнительное исследование пульсации височных, сонных, плечевых и лучевых артерий с двух сторон. При стенозе просвета артерии более 60% возникающая турбулентность потока крови вызывает появление грубого систолического шума. Если стеноз превышает 90% или имеется полная окклюзия артерии, то шум в проекции артерии исчезает. Важным моментом в обследовании больного является обязательное измерение АД на обеих верхних конечностях. Ассиметрия АД более 20 мм рт.ст. считается достоверным признаком уменьшения кровотока по подключичной артерии. В норме АД на ногах на 20–40 мм рт.ст. выше, чем на верхних конечностях. Поэтому если АД на ногах значительно превышает этот уровень, то это является косвенным признаком снижения кровотока по подключичным артериям.
Специальные методы диагностики
Необходимость применения специальных методов диагностики возникает в обязательном порядке у асимптомных пациентов с систолическим шумом над сосудами шеи, а также у больных с клиникой хронической сосудисто–мозговой недостаточности. Крайне желательно исследование брахиоцефальных артерий у пациентов с клиническими признаками поражения других артериальных бассейнов, так как степень ишемии разных органов и клиническое ее проявление может быть различной.
Ультразвуковая допплерография (УЗДГ) с компрессионными пробами позволяет с достаточной степенью точности обнаружить стеноз или окклюзию в бассейне внутренней или общей сонной артерии. Но УЗДГ в настоящее время может рассматриваться только как метод предварительного обследования больного с подозрением на хроническую сосудисто–мозговую недостаточность. Информативность этого метода значительно уступает дуплексному сканированию.
Основным методом диагностики является дуплексное сканирование – это неинвазивный метод исследования, позволяющий визуализировать бляшку в бифуркации общей сонной артерии, определить толщину стенки и интимы артерии, оценить характер бляшки: гомогенная (гладкая) – «хорошая» бляшка; гетерогенная (неровная, мягкая) – «плохая», эмбологенноопасная бляшка.
Интракраниальная допплерография фиксирует нарушения интракраниального кровотока, т.е. дает оценку функционального состояния Виллизиевого круга.
Компьютерная томография головного мозга способна выявить кисты даже у больных без клинических проявлений ишемического инсульта.
Магнитная компьютерная томография дает возможность выявить состояние сосудов и ткани головного мозга.
Аортография – показана лишь в случаях множественного поражения брахиоцефальных артерий, особенно при вовлечении в процесс артерий в месте отхождения их от дуги аорты.
Показания к оперативному лечению:
1. Стеноз артерии более 70% (даже при бессимтомном течении).
2. Гетерогенная, эмбологенноопасная бляшка в бифуркации сонной артерии при различных степенях стеноза, при любой степени хронической сосудисто–мозговой недостаточности.
3. Вертебробазилярная недостаточность, обусловленная синдромом обкрадывания головного мозга (ретроградный кровоток по позвоночной артерии при окклюзии или резком стенозе устья подключичной артерии).
Противопоказания:
1. «Свежий» инфаркт миокарда или инсульт. Вопрос об операции решается индивидуально через 3–6 мес в процессе реабилитации пациента.
2. Тяжелая сердечно–легочная недостаточность.
3. Выраженная почечная недостаточность.
4. Обширные постинсультные кисты головного мозга (свыше 30% полушария) или стойкая гемиплегия.
Возраст больных старше 70–75 лет и даже часто наблюдаемые у данной категории пациентов ишемическая болезнь сердца и артериальная гипертензия не являются абсолютным противопоказанием к хирургическому лечению.
Несмотря на то, что первая операция при стенозе сонной артерии была выполнена M. De Bakey в 1953 году, почти 40 лет понадобилось, чтобы доказать ее эффективность. В 1991 году были опубликованы данные многоцентрового исследования в США и Канаде по сравнительной оценке консервативного и оперативного лечения симптомных больных со стенозом сонной артерии более 70%. И хотя исследование планировалось сроком на 5 лет, оно было досрочно прекращено через 2 года. Основанием для этого послужили убедительные данные, полученные уже в первые 2 года. Оказалось, что при медикаментозном лечении подобных больных через 2 года у 24% наблюдается инсульт (смертельный или нет), в то время как у больных после каротидной эндартерэктомии инсульт возникает только у 7% (включая интраоперационные осложнения).
В сосудистом отделении Института хирургии им. А.В. Вишневского было произведено около 1500 реконструктивных операции на брахиоцефальных сосудах, включая 1057 операций при поражении сонных артерий. Возраст больных колебался от 37 лет до 81 года (средний возраст – 61,3±2,4 года). Если в первые годы работы основным методом, подтверждающим диагноз стеноза сонной артерии, была ангиография, то в последние 10 лет таким методом стало ультразвуковое исследование с помощью дуплексного сканирования. Данная методика позволяет оценить морфологическую характеристику состояния стенки сонной артерии и самой бляшки, наличие в зоне бляшки пристеночного тромбоза, атероматозного распада или кальциноза. В работе Lovelack T. с соавт. (2001) было показано, что даже при исходном стенозе сонной артерии меньше 60%, но при пиковой скорости кровотока во внутренней сонной артерии больше 175 см/с в течение 2 лет у 30% больных стеноз артерии увеличивается до 60–99%. Внедрение ультразвуковых методов исследования не только в практику нашего отделения, но и других учреждений, а главное – появление дуплексного сканирования изменило характер оперированных больных. Если в 80–е годы асимтомные больные (1 степени сосудисто–мозговой недостаточности) составляли всего 2%, то в настоящее время выявление подобных больных стало чаще и их число возросло до 35%.
Техника операций на бифуркации сонной артерии в настоящее время отработана ангиохирургами, и данные вмешательства успешно выполняются в большинстве отделений сосудистой хирургии.
Наиболее распространенным вариантом является операция каротидной эндартерэктомии . Суть этой операции заключается в следующем: после пережатия общей сонной артерии производится продольное рассечение стенки общей сонной артерии с переходом на внутреннюю сонную артерию. Длина разреза около 3–4 см. С помощью специальной лопаточки производится отслойка атеросклеротической бляшки от стенки артерии и полное ее удаление. В абсолютном большинстве наблюдений атеросклеротическая бляшка захватывает зону бифуркации общей сонной артерии в пределах 1,5–2 см и переходит на ствол внутренней сонной артерии также в пределах 1,5–2 см. Схема этой операции представлена на рисунке 1. Во избежание сужения артерии во время наложения швов в место разреза вшивается заплата из аутовены или специального синтетического материала. Имплантация синтетического протеза выполняется достаточно редко, только в тех случаях. когда кальциноз поражает все стенки, что делает невозможным удаление атеросклеротической бляшки и требуется полная резекция пораженного участка внутренней сонной артерии.
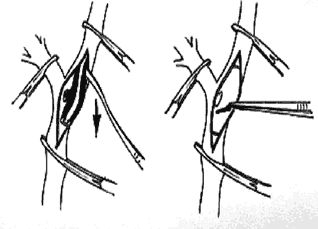
Рис. 1. Схема операции каротидной эндартерэктомии
При наличии у больного патологической извитости внутренней сонной артерии, особенно на фоне сопутствующей артериальной гипертензии происходят значительные морфологические изменения в стенке артерии, приводящие к развитию гемодинамически значимого стеноза. Поэтому данная патология также подлежит хирургической коррекции. Суть данной операции заключается в следующем. Производится выделение общей сонной артерии и внутренней сонной артерии на значительном протяжении, фактически до места входа артерии в череп. Такая мобилизация позволяет выполнить редрессацию (выпрямление) внутренней сонной артерии, резецировать патологически измененный участок и имплантировать ее в окно, выкроенное в стволе общей сонной артерии (рис. 2).

Рис. 2. Схема операции выпрямления внутренней сонной артерии и имплантации ее в общую сонную артерию
Все реконструктивные операции на сонных, подключичных, позвоночных артериях выполняются в условиях гепаринизации больного. Однократное внутривенное введение 5 тысяч ЕД гепарина является надежной профилактикой развития тромбоза в момент полного пережатия артериальных сосудов.
20 лет отработки этой операции позволили добиться результатов, которые соответствуют мировым стандартам. Начиная с 1998 года, послеоперационная летальность колеблется в пределах 0,9–1,2%. Основной причиной летальности остаются послеоперационные инфаркты. Среди осложнений следует отметить нелетальные инсульты, число которых варьирует от 1,1 до 1,4%. При этом еще раз следует отметить, что среди оперированных нами больных 44% уже перенесли инсульт до операции.
Особое внимание в нашей работе мы уделили изучению отдаленных результатов операции. Так, в группе 148 больных были изучены отдаленные результаты в сроки до 196 месяцев. При этом у половины больных срок превышал 5 лет, а у 13% больных после операции прошло 10 лет. Главное, что было доказано – это высокая эффективность каротидной эндартерэктомии: у 94,3% больных в отдаленные сроки не отмечено появления или возобновления неврологической симптоматики на стороне операции. Это при том, что больные в то время не принимали никаких противоатеросклеротических препаратов.
Наиболее благоприятное течение в отдаленном периоде отмечается у больных, оперированных с исходной асимптомной степенью сосудисто–мозговой недостаточности. Каротидная эндартерэктомия становится самой частой операцией в мире после аорто–коронарного шунтирования. По данным Takao Onki и Frank J. Veith, в США в год производится 150 тыс. каротидных эндартерэктомий и около 2 млн. людей имеют поражение сонных артерий. Возраст, как таковой, не является противопоказанием к операции. Так, по сводным данным 10 штатов США, 19% больных, оперированых по поводу стеноза сонной артерии, были старше 80 лет, вплоть до 95 лет (Kresowik T. et al, 2001).
Мировой опыт многих сотен тысяч операций каротидной эндартерэктомии, в том числе и наши данные, показали, что эта операция может спасти больного от ишемического инсульта. Даже при поражении интракраниальных артерий (что встречается не чаще, чем у 10–15% больных) эта операция улучшает и интракраниальный кровоток, исключает возможность развития инсульта из–за эмболии с атеросклеротической бляшки в бифуркации сонной артерии.
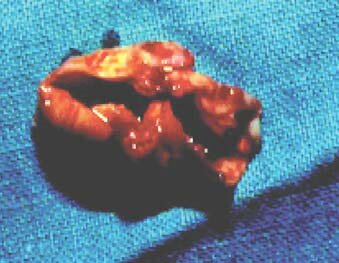
Атеросклеротическая бляшка
В 2000 году был опубликован мета–анализ 23 публикаций (Archie J. Edrington R.), который убедительно показывает, что эффективность каротидной эндартерэктомии у симптомных больных со стенозом 70% и больше очень высока . так как снижает риск смерти или инсульта на 48%. Важно подчеркнуть, что результаты рандомизированного многоцентрового исследования в течение 5 лет у асимптомных больных со стенозом внутренней сонной артерии 60–90% (ACAS ) показали, что каротидная эндартерэктомия уменьшает на 53% возможность развития инсульта или смерти по сравнению с медикаментозным лечением .
Особо следует подчеркнуть, что эта операция не требует больших материальных затрат. Правда, она может выполняться хирургом лишь в условиях специализированного сосудистого отделения. Если сравнить летальность при ишемическом инсульте в пределах 40% и послеоперационную летальность после каротидной эндартерэктомии в пределах 1%, то становится абсолютно ясно, что профилактическая операция может спасти жизнь многим тысячам больных.
В качестве альтернативы данной операции в последние годы начаты исследования по изучению возможности применения метода балонной ангиопластики зон стеноза во внутренней сонной артерии с последующей постановкой стента (спиральный каркас из нитинола) для предотвращения развития рестеноза в зоне дилатации. Но данная методика ввиду ее высокой стоимости, сложности, а главное – количества осложнений, в 2–3 раза превышающего риск стандартной операции, требует своей дальнейшей разработки и совершенствования.
C помощью артериальной реконструктивной операции ликвидируется непосредственная угроза полной облитерации артерий, питающих жизненно важные органы, ишемия которых может стать непосредственной причиной смерти пациента. В послеоперационном периоде важная роль отводится медикаментозной терапии, направленной на коррекцию липидного обмена (препараты статинового ряда и др.), контролю за уровнем артериального давления ( b -блокаторы, ингибиторы АПФ, антагонисты кальция), лечению ишемической болезни сердца.
Важное место в консервативном лечении ангиологических больных отводится применению дезагрегантов . среди которых наиболее доступным является ацетилсалициловая кислота в дозе 100–125 мг ежедневно.
В заключение следует подчеркнуть, что успех в лечении данного контингента больных определяется клиническим опытом врача, подкрепляемым возможностями современной диагностики, позволяющей выявить патологию сосудов, когда клинические симптомы заболевания еще не проявились.
Таким образом, операции на брахиоцефальных артериях являются надежным методом профилактики развития ишемических инсультов, приводящих часто к смертельному исходу и инвалидизации больных. Существующие и применяемые на практике медикаментозные средства не могут ликвидировать морфологический субстрат бляшки, а дезагрегантная терапия не устраняет угрозу эмболии головного мозга при наличии в сонной артерии гетерогенной бляшки с элементами кальциноза, кровоизлияния и распада.
Все вышеизложенное требует от врача пересмотра некогда традиционных методов лечения этого контингента больных.
Акцент должен быть сделан на более раннее выявление данной патологии – еще на асимптомном этапе течения облитерирующего процесса в артериальной системе пациента.
Литература:
1. Покровский А.В. Клиническая ангиология М.,Медицина 1979 г.
2. Джибладзе Д.Н. Патология сонных артерий и проблема ишемического инсульта. Москва 2002 г.
3. Archi J.P.Jr. Engrinton R.D. Carotid Surgery in book: Vascular Surgery Highligts 1999–2000.// Health press, Oxford,2000, p61–68.
4. Kresovic T.F. Blatzler D. Karp et al. Multistate utilization? Processes and outcomes of carotid endarterectomi.// J. Vascular Surgery – 2001 – Vol. 33,2 – p.227–235.
5. Lovelace T.D. et al. Optimizing duplex follow – up in patients with an asymtomatic internial carotid artery stenosis.// J. Vascular Surgery – 2001 – Vol. 33,1 – p.56–61.