Отеки при хронической сердечной недостаточности
О теки представляют избыточное накопление в организме внеклеточной жидкости и натрия.
На ранних стадиях сердечной недостаточности (СН) могут отмечаться так называемые скрытые отеки. Известно, что задержка в организме до 5 л жидкости может протекать практически незаметно.
При СН отеки вначале появляются на ногах, затем у лежачих пациентов — на пояснице, могут становиться распространенными (анасарка). Максимально выражены отеки на конечностях, половых органах, брюшной стенке, пояснице. Отечная жидкость в форме транссудата скапливается также и в серозных полостях (перикард, плевра, брюшная полость).
Отеки при преимущественно правожелудочковой СН и венозном застое отличаются массивностью, плотным характером, кожа над ними цианотична, истончена, на ней могут встречаться трофические расстройства.
Отеки при гипофункции левого желудочка (ЛЖ) появляются рано, предшествуют венозному стазу, не массивны, мягки, смещаемы, кожа над ними бледная, они локализуются на удаленных от сердца участках.
Причины появления и нарастания отеков многообразны.
При хронической СН (ХСН) в их формировании принимает участие несколько механизмов, реализующих свое действие на различных уровнях и приводящих к задержке натрия и воды.
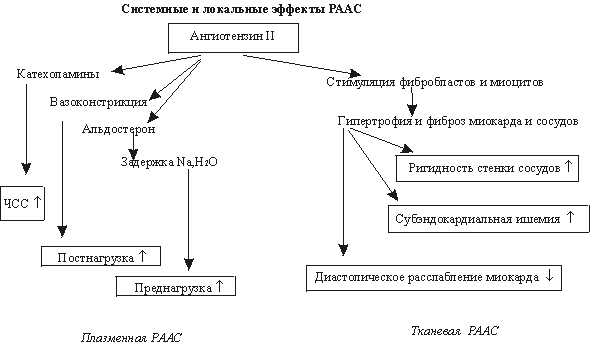
Закономерное снижение сердечного выброса приводит к уменьшению эффективного артериального кровотока в органах, в том числе и в почках. Снижение перфузионного давления почек сопровождается уменьшением клубочковой фильтрации, что является начальным фактором задержки натрия и воды. Почечный кроваток и плазмоток снижаются больше, чем фильтрация, что объясняется выраженным спастическим влиянием катехоламинов и ангиотензина II.
При ХСН катехоламины и ангиотензин II, оказывая спастическое действие на отводящий сосуд клубочка, приводят к увеличению гидравлического градиента в канальцевых капиллярах. Уменьшение почечного кровотока сопровождается активацией юкстагломерулярного аппарата и повышенной секреции ренина. Ренин превращает ангиотензиноген в неактивное соединение ангиотензин I, который под влиянием конвертирующего фермента превращается в вазоактивный ангиотензин II.
При СН замедляется инактивация ангиотензина II и альдостерона, повышается чувствительность дистальных канальцев к альдостерону. В результате возрастает дистальная реабсорбция натрия, развиваются гипокалиемия и метаболический алкалоз.
Патогенетические факторы образования отеков при ХСН представлены на схеме 1.
При СН происходят перерастяжение правого предсердия и рефлекторное повышение задержки натрия и ренина в организме. В итоге реабсорбция натрия значительно увеличивается, что стимулирует синтез АДГ и сопровождается значительной задержкой жидкости в организме. Механизмы задержки натрия и воды представлены на схеме 2.
Патогенетические факторы образования отеков при ХСН
Основными средствами лечения отеков являются диуретики.
Местом приложения диуретиков являются клубочек, проксимальный каналец, кортикальный сегмент восходящей части петли нефрона, восходящая часть петли нафрона (на всем протяжении) и дистальный каналец.
Преимущественно используются диуретики, действующие в трех последних локализациях.
Препараты, действующие на клубочек (гликозиды, эуфиллин), диуретиками не являются. Лекарства, влияющие на проксимальный каналец, — ингибиторы карбоангидразы (ацетазоламид) и осмотические диуретики (мочевина, маннитол), используются в неврологической, офтальмологической и нейрохирургической практике; диакарб добавляется для усиления эффекта к петлевым диуретикам.
В лечении отеков в настоящее время активно используются:
• тиазидные и тиазидоподобные диуретики: гидрохлортиазид, циклометиазид, оксодолин, клопамид, индапамид и др.
• сильнодействующие петлевые диуретики: фуросемид, буметанид, этакриновая кислота, торасемид, пиретанид и др.
• калийсберегающие диуретики с относительно слабым диуретическим действием: спиронолактоны, триамтерен, амилорид
• комбинированные диуретики: триампур (гидрохлортиазид + триамтерен).
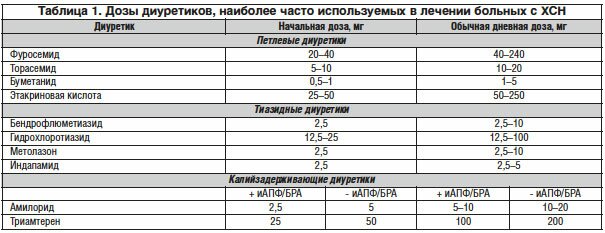
В таблице представлены основные мочегонные препараты для лечения ХСН.
Тиазидные и тиазидоподобные диуретики
Тиазидовые и тиазидоподобные диуретики оказывают диуретическое и натрийуретическое действие, подавляя реабсорбцию ионов натрия и воды в той части восходящего колена петли Генле, которая находится в корковом слое почек (кортикальный сегмент восходящей части петли нефрона). Они дают умеренный по сравнению с петлевыми средствами диуретический и натрийуретический эффект и неэффективны при почечной недостаточности. Усиление диуретического действия при увеличении дозы ограничено (доза гипотиазида -12,5 — 25 — 100 мг)
Гидрохлортиазид выпускается в таблетках по 25 и 100 мг. Суточная доза — от 12,5-25 до 200 мг. Диуретическое действие наступает через 1-2 ч после приема внутрь, наиболее выражено в течение 4-6 ч и заканчивается через 10-12 ч.
Индапамид — это сульфамидное нетиазидное производное, оказывает пролонгированное, антигипертензивное и относительно небольшое диуретическое действие в дозе 1,5-2,5 мг/сут. При приеме в более высоких дозах диуретический эффект нарастает. Механизм действия индапамида заключается в снижении сократительной способности гладких мышечных волокон сосудов, что связано с изменением трансмембранного переноса ионов, в основном кальция, в стимуляции синтеза простагландинов, главным образом Е2, обладающих сосудорасширяющим свойством; уменьшении общего периферического сосудистого сопротивления. При назначении препарата рекомендуется контролировать калиемию и урикемию, не следует сочетать индапамид с калийвыводящими диуретиками. Индапамид назначают по 1-2 таблетки (1,5-2,5-5 мг) в день.
При лечении индапамидом не требуется соблюдать строгой бессолевой диеты, необходимо динамическое наблюдение за интервалом QT, который может удлиняться и способствовать появлению жизнеопасных аритмий.
Тиазидовые диуретики могут вызывать водно-электролитные нарушения — гипокалиемию, гипомагнезиемию, реже — нарушения толерантности к глюкозе, гиперурикемию, метаболический алкалоз, гипонатриемию и дегидратацию; они влияют на липидный состав крови, несколько повышая концентрацию триглицеридов и снижая уровень антиатерогенных липопротеидов высокой плотности.
Петлевые диуретики
Петлевые диуретики оказывают выраженное диуретическое и натрийуретическое действие, подавляя реабсорбцию ионов натрия на всем протяжении восходящего сегмента петли Генле. Безусловно, это самые эффективные мочегонные препараты, остающиеся средством выбора в лечении тяжелых форм ХСН с отечным синдромом.
Петлевые диуретики занимают существенное и стабильное место в лечении отеков у больных ХСН. Эти виды диуретиков подразделяются на короткодействующие (фуросемид, этакриновая кислота, буметанид) и длительно действующие (торасемид, пиретанид).
В клинической практике для лечения ХСН преимущественно используют производные сульфамоилбензойной кислоты (фуросемид и др.), которые весьма успешно себя зарекомендовали благодаря активному диуретическому эффекту, высокой биодоступности, малой ототоксичности по сравнению с этакриновой кислотой.
Фуросемид выпускается в ампулах по 2 и 10 мг 1% раствора (10 мг/мл) и в таблетках по 20 и 40 мг.
Буметанид выпускается в ампулах по 2,4 и 10 мл 0,05% раствора (0,5% мг/мл) и в таблетках по 1 и 5 мг.
Этакриновая кислота выпускается в ампулах по 0,05 мг и в таблетках по 50 и 100 мг. Выраженность диуретического эффекта четко связана с дозой препарата.
После внутривенного введения диуретический эффект петлевых диуретиков развивается в течение 5-15 мин и сохраняется 2-3 ч. После приема внутрь эффект отмечается в течение 30-60 мин и продолжается до 4-9 ч.
Побочные явления при приеме петлевых диуретиков принципиально те же, что и при применении тиазидовых препаратов. Однако необходимо учитывать более частые водно-электролитные нарушения и развитие артериальной гипотензии, обусловленной уменьшением объема циркулирующей крови. Этакриновая кислота, назначаемая внутривенно и внутрь, способна проявлять ототоксичность вплоть до полной потери слуха.
Новые петлевые диуретики — торасемид, пиретанид — отличаются от фуросемида еще более высокой и стабильной биодоступностью (80-90%), что позволяет использовать их внутрь при тяжелой ХСН.
По-видимому, этим объясняется менее выраженное калийуретическое действие торасемида, чем у тиазидных диуретиков и фуросемида. Указывается на калийсберегающее (антиальдостероновое) действие торасемида, он вызывает меньшую потерю калия с мочой, чем фуросемид, ослабляет действие альдостерона. Доза торасемида 5-10 мг оказывает даже большее диуретическое действие, чем 40 мг фуросемида.
В ряде исследований убедительно показаны преимущества торасемида перед фуросемидом у пациентов ХСН II-IV функционального класса (ФК) по NYHA. Отмечено уменьшение частоты госпитализаций в связи с нарастанием декомпенсации при терапии торасемидом, подтверждена метаболическая нейтральность этого препарата.
При снижении эффективности петлевого диуретика можно добавить ацетазоламид по 250 мг перед завтраком и обедом 3-5 дней в неделю. Препарат в отличие от остальных диуретиков вызывает ацидоз и при его применении «сверху» петлевых и тиазидных мочегонных ослабляет вызванный ими алкалоз, что и приводит к усилению их действия. При развитии тяжелой резистентности к диуретической терапии приходится принимать более интенсивные меры: внутривенное введение больших доз диуретиков, допамина в «почечных» дозах (2-5 мкг/кг/мин), введение альбумина, применение ингибиторов ангиотензинпревращающего фермента (ИАПФ) и спиронолактона.
Схема лечения пациентов с ХВН мочегонными препаратами
Современная схема лечения пациентов с ХСН диуретиками включает две фазы.
Момент декомпенсации. Это активная фаза — период форсированного диуреза. Больному назначается доза препарата, обеспечивающая диурез, превышающий на 800-1000 мл количество введенной жидкости, и соответствующее снижение массы тела (например, 80 мг фуросемида внутривенно).
Поддерживающая фаза. С помощью ежедневного приема подобранной (оттитрованной) дозы мочегонного (например, 20 мг фуросемида в сутки) добиваются ежедневного диуреза.
Особенности тактики лечения диуретиками больных ХСН
(Рекомендации Европейского общества кардиологов — ЕОК, 2001)
Начальная терапия диуретиками:
• петлевые и тиазидные диуретики всегда назначаются в дополнение к ИАПФ;
• при скорости клубочковой фильтрации (СКФ) менее 30 мл/мин не следует использовать тиазидные диуретики, за исключением случаев их назначения совместно с петлевыми диуретиками.
Недостаточный эффект:
• увеличить дозу диуретика;
• комбинировать петлевые и тиазидные диуретики;
• при сохраняющейся задержке жидкости петлевые диуретики назначают два раза в день;
• при тяжелой ХСН добавляют метолазон и проводят частые определения креатинина и электролитов крови.
Калийсберегающие диуретики (спиронолактон, альдактон, верошпирон, триамтерен, амилорид):
• назначают, если гипокалиемия сохраняется после использования ИАПФ и петлевых (или тиазидных) диуретиков;
• в течение 1-й недели назначают низкие дозы калийсберегающих диуретиков под контролем сывороточных уровней калия и креатинина, после чего корректируют дозу. Анализы повторяют через 5-7 дней до стабилизации уровня калия.
Причины резистентности к высоким дозам диуретиков:
• потребление больным большого количества натрия с пищей;
• совместное назначение диуретиков и нестероидных противовоспалительных средств;
• значительное нарушение функции почек или снижение их перфузии.
Методы преодоления резистентности к диуретикам:
• внутривенное введение диуретиков (иногда в виде непрерывной инфузии);
• комбинированное применение двух или трех препаратов с разным механизмом действия.
Эксперты ЕОК (2001) рекомендуют регулярное измерение массы тела больному, получающему диуретики ежедневно или 2 раза в неделю. Масса тела в начале терапии диуретиками должна снижаться не более чем на 0,5-1 кг в день.
При увеличении массы тела больше чем на 2 кг за 1-3 дня больной должен самостоятельно принять диуретик или повысить его дозу.
Потребление поваренной соли с пищей необходимо ограничить до 5-6 г/сут, жидкости — до 1-1,5 л в день.
Осложнения и факторы, приводящие к развитию нарушений при использовании диуретиков
1. Нарушения обмена натрия и воды
Гипонатриемия, дегидратация
Чрезмерно активная диуретическая терапия, диета с малым содержанием поваренной соли, активная терапия мочегонными после субкомпенсации
2. Нарушение обмена калия
Гипокалиемия
Активная диуретическая терапия, форсированный диурез, отказ от применения калийсберегающих мочегонных, неадекватное введение калия с пищей и в виде препаратов (панангин, оротат калия)
Гиперкалиемия
Длительное применение больших доз калийсберегающих препаратов, сочетание этих средств с препаратами калия
3. Нарушения кислотно-основного состояния
Метаболический алкалоз
Длительное изолированное применение активных диуретиков при резком снижении содержания хлора
Метаболический ацидоз
Длительное изолированное применение калийсберегающих диуретиков
Провокация почечной колики
Исходная мочекаменная болезнь
Дизурические явления
Исходный цистит
Понос и тошнота
Триамтерен и этакриновая кислота
8. Индивидуальная непереносимость
Калийсберегающие диуретики
Калийсберегающие диуретики подавляют реабсорбцию ионов натрия и воды в дистальных извитых канальцах и собирательных трубочках, оказывают слабое диуретическое действие.
Положительный эффект спиронолактона, триамтерена и амилорида заключается в достоверном уменьшении экскреции ионов калия при слабом натрийуретическом действии. Калийсберегающие диуретики следует сочетать с более активными петлевыми или тиазидовыми препаратами. Спиронолактон является конкурентным антагонистом альдостерона, стимулирующим работу натриевого насоса в базально-латеральной мембране эпителиальных клеток дистальных почечных канальцев.
Таким образом, осуществляется реабсорбция ионов натрия и одновременно облегчается экскреция ионов калия. Калийсберегающее действие спиронолактона максимально выражено при первичном или вторичном гиперальдостеронизме.
Эффект спиронолактона заметно усиливается при сочетании с активными диуретиками. Антагонисты альдостерона вызывают электролитный дисбаланс и активацию ренин-ангиотензин-альдостероновой системы (РААС), играющих важнейшую роль в прогрессировании ХСН.
Хотя формально диуретики и не включаются в патогенетическое лечение ХСН, они практически необходимы для устранения симптомов, связанных с задержкой жидкости, являясь средствами первой необходимости в комплексном лечении ХСН. Активные мочегонные препараты следует употреблять в комбинации с антагонистами альдостерона, что позволяет снизить их дозы и блокировать негативное воздействие диуретиков на активность РААС.
Многочисленные исследования показали большую роль альдостерона в патогенезе отеков при ХСН.
Альдактон не только оказывает диуретическое действие и нормализует электролитный профиль, но и предотвращает развитие интерстициального фиброза миокарда и ремоделирование периферических сосудов.
Антагонисты альдостерона показаны при ХСН уже II ФК, когда 1/3 больных имеют повышенный уровень альдостерона плазмы. Оптимальная доза спиронолактона составляет 25-50 мг.
Естественно, при этом необходимы тщательный контроль за уровнем калия в плазме и своевременное использование активных мочегонных.
Триамтерен и амилорид являются блокаторами натриевых каналов люминальной мембраны эпителиальных клеток дистальных почечных канальцев, подавляют реабсорбцию ионов натрия. Выведение натрия с мочой увеличивается, а экскреция ионов калия уменьшается.
Триамтерен выпускается в таблетках по 50 мг, амилорид — в таблетках по 5 мг. Средние дозы триамтерена 50-200 мг/сут (в 2 приема), амилорида 5-20 мг/сут.
Комбинированные диуретики
Имеются комбинированные лекарственные средства, содержащие тиазидовый или петлевой диуретик с калийсберегающим препаратом. У нас в стране наиболее известен триампур (триампур композитум), в каждой таблетке которого содержится 12,5 мг гипотиазида и 25 мг триамтерена.
Следует подчеркнуть, что нередко назначают неработающие дозы триампура — 1-2 таблетки. Следует использовать 2-8 таблеток (всю дозу назначают утром натощак или в 2 приема в первой половине дня).
Возможными побочными эффектами спиронолактона могут быть гиперкалиемия и гипонатриемия. Кроме того, спиронолактон может вызвать головную боль, сонливость, диспепсические расстройства, снижение потенции и гинекомастию у мужчин, нарушения менструального цикла и гирсутизм у женщин.
Противопоказанием к использованию калийсберегающих диуретиков является гиперкалиемия, обусловленная почечной недостаточностью или одновременным назначением препаратов калия, ИАПФ или других калийсберегающих средств.
Осложнения диуретической терапии
Осложнения диуретической терапии чаще отмечаются при слишком активном лечении мочегонными средствами в сочетании с бессолевой диетой.
Динамическое наблюдение за адекватностью диуретической терапии, постепенное устранение отечного синдрома, контроль за уровнем электролитов в крови, комбинированное использование петлевых диуретиков и калийсберегающих препаратов, рациональная диета обеспечивают профилактику многочисленных побочных реакций при использовании мочегонных препаратов.
Мочегонные препараты следует назначать только при появлении начальных признаков отечного синдрома, активность диуретической терапии должна соответствовать выраженности отеков.
Неадекватная диуретическая терапия приводит к быстрому возникновению толерантности (рефрактерности) к мочегонным препаратам, способствует прогрессирующей активации вазоконстрикторных и антинатрийуретических нейрогуморальных систем.
При нарастании отечного синдрома дозы диуретиков приходится увеличивать: вместо тиазидовых препаратов назначают более активные петлевые диуретики, применяют различные комбинации двух-трех мочегонных средств с различным механизмом действия. Это обычно усиливает диуретический эффект.
В данной ситуации особенно важна коррекция неблагоприятных электролитных и метаболических расстройств, что предотвращает развитие резистентности к диуретикам.
Для предупреждения значительной потери калия при лечении тиазидовыми и петлевыми диуретиками ограничивают потребление поваренной соли (до 5 г/сут) и воды (до 1,5 л/сут). Гипокалиемии в большинстве случаев можно избежать, комбинируя тиазидовые и петлевые диуретики с калийсберегающими препаратами.
При лечении отеков диуретиками, не всегда адекватном, возникает ряд патологических синдромов. Рассмотрим важнейшие из них.
Гипокалиемия
Уменьшение концентрации К+ в плазме ниже 3,8 мэкв/л сопровождается апатией, мышечной слабостью, ухудшением аппетита, снижением диуреза. На ЭКГ гипокалиемия проявляется увеличением зубцов U, снижением амплитуды зубцов Т, смещением книзу сегментов ST, экстрасистолией. Устранение гипокалиемии достигается обогащением калием пищи больных и/или назначением им препаратов калия — калия хлорид 4-6 г, аспаркам по 1-2 таблетки 3-4 раза в день и др.
Внеклеточный гипохлоремический алкалоз
Он особенно сочетается с клеточным дефицитом К+ и увеличенным содержанием Na+. Эти сдвиги проявляются слабостью, тошнотой, судорогами, спазмами, парестезиями. Для устранения гипохлоремического алкалоза применяют внутривенное ведение калия хлорида. Обычно требуется 10-15 вливаний калия хлорида (0,8-1 г на вливание).
Гипонатриемия
Уровень ионов Na+ в плазме при этом ниже 135 мэкв/л. Подобная ситуация возникает под воздействием чрезмерно интенсивной диуретической терапии, когда больной в значительно большей мере ограничивает потребление поваренной соли, чем воды. Клиническая картина характеризуется нарастающими, распространенными отеками, жаждой, потерей аппетита, тошнотой, рвотой, общей слабостью, гипотензией, олигурией, азотемией, неэффективностью диуретиков. В подобных сложных случаях рекомендуются присаливание пищи или внутривенные вливания небольших количеств изотонического (гипертонического) раствора натрия хлорида, использование комбинации петлевого диуретика и ИАПФ, применение мочевины (по 30 г внутрь ежедневно совместно с петлевым диуретиком).
Несмотря на то что диуретики имеют множество негативных свойств, вызывают слабость и неудобства, связанные с усилением диуреза в утренние и дневные часы, их будут и в дальнейшем применять в лечении отечного синдрома при ХСН, особенно в комбинации с другими высокоактивными препаратами.
Объективное исследование больных — Сердечная недостаточность
Страница 5 из 12
ОБЪЕКТИВНОЕ ИССЛЕДОВАНИЕ БОЛЬНЫХ
Данные внешнего осмотра
Ранние стадии сердечной недостаточности могут не проявляться внешними признаками.
В типичных случаях обращает на себя внимание вынужденное положение больных. Они предпочитают вынужденное сидячее или полусидячее положение с опущенными вниз ногами или горизонтальное положение с высоко поднятым изголовьем, что уменьшает венозный возврат крови к сердцу и таким образом облегчает его работу. Больные с тяжело протекающей хронической сердечной недостаточности иногда всю ночь или даже целые сутки проводят в вынужденном сидячем или полусидячем положении (ортопноэ).
Характерным признаком хронической сердечной недостаточности является цианоз кожи и видимых слизистых оболочек. Цианоз обусловлен снижением перфузии периферических тканей, замедлением в них кровотока, усиленной экстракцией кислорода тканями и увеличением вследствие этого концентрации восстановленного гемоглобина. Цианоз имеет характерные особенности, он наиболее выражен в области дистальных отделов конечностей (ладоней, стоп), губ, кончика носа, ушных раковин, подногтевых пространств (акроцианоз) и сопровождается похолоданием кожи конечностей (холодный цианоз). Акроцианоз часто сочетается с трофическими нарушениями кожи (сухость, шелушение) и ногтей (ломкость, тусклость ногтей).
Отеки, появляющиеся при хронической сердечной недостаточности («сердечные» отеки) имеют весьма характерные особенности:
- раньше всего появляются в участках с наиболее высоким гидростатическим давлением в венах (в дистальных отделах нижних конечностей);
- отеки на ранних стадиях хронической сердечной недостаточности выражены незначительно, появляются к концу рабочего дня и за ночь исчезают;
- отеки располагаются симметрично;
- оставляют после надавливания пальцем глубокую ямку, которая затем постепенно сглаживается;
- кожа в области отеков гладкая, блестящая, вначале мягкая, при длительном существовании отеков кожа становится плотной, и ямка после надавливания образуется с трудом;
- массивные отеки в области нижних конечностей могут осложняться образованием пузырей, которые вскрываются и из них вытекает жидкость;
- отеки на ногах сочетаются с акроцианозом и похолоданием кожи;
- расположение отеков может меняться под влиянием силы тяжести — при положении на спине они локализуются преимущественно в области крестца, при положении на боку располагаются на той стороне, на которой лежит больной.
Патогенетическими факторами отеков являются:
- активация РААС и усиленная реабсорбция натрия и воды в почечных канальцах;
- прогрессивное увеличение гидростатического давления в венозном русле и капиллярах;
- снижение онкотического давления вследствие нарушения синтеза белка в печени и значительное повышение гидростатического давления над онкотическим, что сопровождается выходом жидкой части крови из сосудов в ткани;
- падение клубочковой фильтрации вследствие нарушения кровоснабжения почек;
- повышение проницаемости сосудистой стенки.
При тяжелой хронической сердечной недостаточности развивается анасарка — т. е. массивные, распространенные отеки, не только полностью захватывающие нижние конечности, пояснично-крестцовую область, переднюю стенку живота, но даже и область грудной клетки. Анасарка обычно сопровождается появлением асцита и гидроторакса.
Для суждения об уменьшении или увеличении отеков необходимо не только оценивать выраженность отеков при ежедневном врачебном осмотре, но и следить за диурезом, количеством выпитой за сутки жидкости, производить ежедневное взвешивание больных и отмечать динамику массы тела.
При осмотре больных с хронической сердечной недостаточностью можно видеть набухание шейных вен — важный клинический признак, обусловленный повышением центрального венозного давления, нарушением оттока крови из верхней полой вены в связи с высоким давлением в правом предсердии. Набухшие шейные вены могут пульсировать (венный пульс).
Положительный симптом Плеша (печеночно-югулярная проба) — характерен для выраженной БЗСН или ПЖСН, является показателем венозного застоя, высокого центрального венозного давления. При спокойном дыхании больного в течение 10 с производится надавливание ладонью на увеличенную печень, что вызывает возрастание центрального венозного давления и усиленное набухание шейных вен.
Атрофия скелетной мускулатуры, снижение массы тела — характерные признаки длительно существующей сердечной недостаточности. Дистрофические изменения и снижение мышечной силы наблюдаются практически во всех группах мышц, но наиболее выражена атрофия бицепсов, мышц тенара, гипотенара, межкостных мышц кистей, височных и жевательных мышц. Отмечается также резко выраженное уменьшение и даже полное исчезновение подкожно-жировой клетчатки — «сердечная кахексия». Как правило, она наблюдается в терминальной стадии хронической сердечной недостаточности. Вид больного становится весьма характерным: худое лицо, запавшие виски и щеки (иногда одутловатость лица), синюшные губы, ушные раковины, кончик носа, желтовато-бледный оттенок кожи лица, кахексия, особенно заметна при осмотре верхней половины тела (резко выраженные отеки нижних конечностей, передней стенки брюшной полости маскируют исчезновение подкожно-жировой клетчатки и мышечную атрофию в нижней половине тела). Кахексия и атрофия мускулатуры обусловлены гиперактивацией фактора некроза опухоли-a, САС, РААС, а также анорексией, недостаточным питанием, нередко — синдромом мальабсорбции, нарушением функциональной способности печени (в частности, снижением протеинсинтетической функции) и поджелудочной железы, у некоторых больных — рвотой. В развитии мышечной атрофии и кахексии имеет значение также нарушение перфузии мышц и периферических тканей.
Нередко при осмотре больных можно видеть геморрагии на коже (иногда это обширные геморрагические пятна, в некоторых случаях — петехиальная сыпь), обусловленные гипопротромбинемией, повышением проницаемости капилляров, у некоторых больных — тромбоцитопенией.
Исследование органов дыхания
При осмотре обращает на себя внимание тахипноэ — увеличение частоты дыхания. Одышка у большинства больных инспираторная, что обусловлено ригидностью легочной ткани и переполнением ее кровью (застой в легких). Наиболее выражена инспираторная одышка при тяжелой, прогрессирующей хронической сердечной недостаточности. При отсутствии выраженного венозного застоя в легких отмечается одышка без преимущественного затруднения вдоха или выдоха.
При тяжелой хронической сердечной недостаточности, обычно в терминальной стадии, появляются нарушения ритма дыхания в виде периодов апноэ (кратковременной остановки дыхания) или дыхания Чейн-Стокса. Для больных тяжелой хронической сердечной недостаточности характерен синдром ночных апноэ или чередования периодов апноэ и тахипноэ. Ночной сон беспокойный, сопровождается кошмарами, периодами апноэ, частыми пробуждениями; днем, напротив, наблюдается сонливость, разбитость, утомляемость. Синдром ночного апноэ способствует еще большему повышению активности САС, что усугубляет дисфункцию миокарда.
При перкуссии легких нередко обнаруживается притупление перкуторного звука сзади в нижних отделах легких. что может быть обусловлено застойными явлениями и некоторым уплотнением легочной ткани. При выявлении этого симптома целесообразно произвести рентгенографию легких для исключения пневмонии, которая часто осложняет течение хронической сердечной недостаточности.
При тяжелом течения БЗСН возможно появление транссудата в плевральных полостях (гидроторакса). Он может быть одно- или двусторонним. Характерной особенностью гидроторакса в отличие от экссудативного плеврита является то, что при перемене положения больного направление верхней границы тупости через 15—30 мин. изменяется.
При аускультации легких у больных с хронической ЛЖСН в нижних отделах часто прослушиваются крепитация и влажные мелкопузырчатые хрипы на фоне жесткого или ослабленного везикулярного дыхания. Крепитация обусловлена хроническим венозным застоем крови в легких, интерстициальным отеком и пропитыванием стенок альвеол жидкостью. Наряду с крепитацией могут прослушиваться влажные мелкопузырчатые хрипы в нижних отделах обоих легких, они обусловлены повышенным образованием жидкого бронхиального секрета в условиях венозного застоя в легких.
Иногда у больных в связи с венозным застоем в легких выслушиваются сухие хрипы вследствие отека и набухания слизистой оболочки бронхов, что ведет к их сужению.
Тяжелая хроническая ЛЖСН или БЗСН с преимущественным поражением ЛЖ может осложниться сердечной астмой с альвеолярным отеком легких. В этом случае происходит транссудация жидкой части крови в альвеолы, жидкость достигает уровня бронхов и появляется большое количество влажных мелкопузырчатых хрипов, прогрессивно усиливающихся. Затем быстро нарастает объем серозного секрета в крупных бронхах, трахее (в связи с пропотеванием в них из сосудов жидкой части крови) и начинают прослушиваться на большом протяжении средне- и крупнопузырчатые хрипы. При этом обычно дыхание становится клокочущим, хрипы слышны на расстоянии.
Исследование сердечно-сосудистой системы
Результаты физикального исследования ССС у больных с хронической сердечной недостаточностью во многом зависят от основного заболевания, которое обусловило ее развитие. В этом разделе приводятся данные, которые являются общими и характерными для систолической сердечной недостаточности в целом, независимо от ее этиологии.
Пульс при хронической сердечной недостаточности у большинства больных учащен, малой величины (наполнения) и напряжения. Последние два свойства пульса связаны со снижением ударного объема и скорости изгнания крови из ЛЖ. При крайне тяжелом течении сердечной недостаточности пульс может быть нитевидным, едва прощупывающимся. Очень часто при хронической сердечной недостаточности пульс аритмичный, что обусловлено экстрасистолией или мерцательной аритмией. Характерным признаком тяжелой сердечной недостаточности является альтернирующий пульс — то есть регулярное чередование пульсовых волн малой и нормальной амплитуды при синусовом ритме. Альтернирующий пульс сочетается с регулярным изменением громкости тонов сердца и величины ударного выброса и лучше выявляется в положении больного стоя на фоне задержки дыхания в середине выдоха. Механизм развития альтернирующего пульса окончательно не выяснен. Возможно, он обусловлен появлением в миокарде участков, находящихся в состоянии гибернации, что приводит к неоднородности миокарда ЛЖ и периодическим неполноценным сокращениям в ответ на электрический импульс. У некоторых больных развивается брадикардитическая форма ХСН, при которой наблюдается брадикардия и редкий пульс (при полной атриовентрикулярной блокаде, брадисистолической форме мерцательной аритмии.
Как правило, у больных с хронической сердечной недостаточностью артериальное давление снижено. причем значительно более выражено снижение систолического давления, что обусловлено падением сердечного выброса. Одновременно значительно снижается пульсовое давление. Если больной страдает артериальной гипертензией, то при развитии хронической сердечной недостаточности возможно снижение артериального давления, но в меньшей степени выраженное, хотя в терминальной стадии падение артериального давления может быть выражено значительно. Наличие артериальной гипертензии у больных сердечной недостаточностью в определенной мере можно считать благоприятным признаком (сохранность резервов миокарда).
Осмотр и пальпация области сердца. При хронической сердечной недостаточности имеются гипертрофия и дилатация ЛЖ, это приводит к смещению сердечного (и верхушечного) толчка влево. иногда одновременно и книзу; сердечный толчок становится разлитым. При значительной гипертрофии и дилатации сердца может быть заметна пульсация всей области сердца, при преимущественной или изолированной гипертрофии ПЖ (например, при хроническом легочном сердце) хорошо видна эпигастральная пульсация, которая может значительно усиливаться на высоте вдоха. При выраженной хронической сердечной недостаточности развивается также и гипертрофия левого предсердия, что обусловливает появление пульсации во II межреберье слева от грудины.
Перкуссия сердца. В связи с дилатацией ЛЖ обнаруживается смещение левой границы относительной тупости сердца. При резко выраженной хронической сердечной недостаточности при заболеваниях, приводящих к выраженной дилатации сердца, отмечается значительное смещение как левой, так и правой границ относительной тупости сердца. При дилатации сердца поперечник относительной тупости сердца увеличивается.
Аускультация сердца. Как правило, выявляются тахикардия и очень часто аритмия. Тахикардия и нарушения сердечного ритма способствуют усугублению гемодинамических расстройств и ухудшают прогноз больных с хронической сердечной недостаточностью. При тяжелом поражении миокарда можно выявить маятникообразный ритм сердца и эмбриокардию. При маятникообразном ритме диастола укорачивается настолько, что становится равной систоле, и аускультативная картина напоминает равномерное качание маятника. Если маятникообразный ритм сопровождается выраженной тахикардией, этот феномен называют эмбриокардией.
Нарушения сердечного ритма — чрезвычайно характерная особенность клинической картины сердечной недостаточности, особенно у больных с III и IV функциональными классами. Для пациентов с хронической сердечной недостаточностью характерен высокий риск смерти, особенно при ФК III, IV, у таких больных риск смерти колеблется от 10 до 50% в год, причем половина смертей происходит внезапно. Основными причинами внезапной смерти при хронической сердечной недостаточности фибрилляция желудочков, тромбоэмболии, развивающиеся на фоне мерцательной аритмии (в первую очередь, тромбоэмболия легочной артерии), брадиаритмии.
Около 80—90% нарушений сердечного ритма приходится на постоянную или пароксизмальную формы фибрилляции предсердий. второе место по частоте делят различные виды желудочковой экстрасистолии и желудочковая пароксизмальная тахикардия
Практически у всех больных с хронической сердечной недостаточностью определяется ослабление I и II тонов (они воспринимаются как глухие, особенно I тон), однако при развитии легочной гипертензии появляется акцент II тона на легочной артерии.
Характерным аускультативным проявлением тяжелой сердечной недостаточности является ритм галопа. Ритм галопа – патологический трехчленный ритм, состоящий из ослабленного I тона, II тона и патологического дополнительного тона (III или IV), появляющийся на фоне тахикардии и напоминающий галоп скачущей лошади. Наиболее часто прослушивается протодиастолический ритм галопа (патологический III тон возникает в конце диастолы и обусловлен потерей тонуса мускулатуры желудочков). Выслушивание III патологического тона имеет огромное диагностическое значение как признак поражения миокарда и выраженной дисфункции ЛЖ. В ряде случаев у больных хронической сердечной недостаточности прослушиваются патологический IV тон и, соответственно, пресистолический ритм галопа. Появление IV тона обусловлено ригидностью и резко выраженным снижением способности ЛЖ расслабляться в диастолу и вмещать объем крови, поступающей из левого предсердия. В этих условиях левое предсердие гипертрофируется и интенсивно сокращается, что приводит к появлению IV тона, а при наличии тахикардии, к пресистолическому ритму галопа. Пресистолический ритм галопа характерен, прежде всего, для диастолической дисфункции левого желудочка. При систолической сердечной недостаточности все же чаще прослушивается протодиастолический ритм галопа.
При выраженной дилатации ЛЖ развивается относительная митральная недостаточность и в области верхушки сердца прослушивается систолический шум митральной регургитации. При значительной дилатации ПЖ формируется относительная недостаточность трехстворчатого клапана, что обусловливает появление систолического шума трикуспидальной регургитации.
Исследование органов брюшной полости
У больных хронической сердечной недостаточностью нередко наблюдается вздутие живота (метеоризм ) вследствие снижения тонуса кишечника, болезненность в эпигастрии (она может быть обусловлена хроническим гастритом, язвой желудка или двенадцатиперстной кишки), в области правого подреберья (в связи с увеличением печени). Печень у больных хронической сердечной недостаточностью при развитии застоя в венозной системе большого круга кровообращения увеличена, болезненна при пальпации, поверхность ее гладкая, край закруглен. По мере дальнейшего прогрессирования хронической сердечной недостаточности может развиваться кардиальный цирроз печени. Для цирроза печени характерны значительная ее плотность и острый край.
При тяжелой ПЖСН или БЗСН наблюдается асцит. Характерными его признаками являются увеличение живота в размерах, выраженное притупление перкуторного звука в отлогих местах живота, положительный симптом флуктуации. Для выявления асцита применяется также прием, основанный на перемещении асцитической жидкости при перемене положения тела. Появление асцита у больного с хронической сердечной недостаточностью указывает на развитие выраженной надпеченочной портальной гипертензии.
Клинические проявления хронической левожелудочковой недостаточности
При хронической ЛЖСН преобладающей является симптоматика застоя крови в малом круге кровообращения и ярко выражены признаки поражения миокарда ЛЖ (гипертрофия, дилатация и др.) в зависимости от заболевания, обусловившего развитие сердечной недостаточности.
Основные клинические симптомы ЛЖСН:
- одышка (чаще инспираторная);
- сухой кашель, возникающий преимущественно в горизонтальном положении, а также после физической и эмоциональной нагрузки;
- приступы удушья (чаще ночью), т. е. сердечная астма
- положение ортопноэ;
- крепитация и мелкопузырчатые хрипы в нижних отделах обоих легких;
- дилатация ЛЖ;
- акцент II тона на легочной артерии;
- появление патологического Ш тона и протодиастолический ритм галопа (левожелудочковый, лучше прослушивающийся в области верхушки сердца);
- альтернирующий пульс;
• отсутствие периферических отеков, застойной гепатомегалии, асцита.
Клинические проявления хронической правожелудочковой недостаточности
При хронической ПЖСН в клинической картине доминирует симптоматика застоя крови в большом круге кровообращения:
• выраженный акроцианоз;
• набухшие вены шеи;
• периферические отеки;
• асцит;
- дилатация ПЖ;
- эпигастральная пульсация, синхронная с деятельностью сердца;
- систолический шум относительной недостаточности трикуспидального клапана;
- правожелудочковый протодиастолический ритм галопа (лучше выслушивается над мечевидным отростком и в V межреберье у левого края грудины).
Патогенез и возможности современного лечения отечного синдрома при хронической сердечной недостаточности
РЕКЛАМА
Хроническая сердечная недостаточность (ХСН) является конечным звеном сердечно-сосудистого континуума и одной из ведущих причин внезапной сердечной смерти (ВСС). В 2005 г. American Heart Association и American College of Cardiology (AHA/ACC) выпустили клинические рекомендации по лечению больных ХСН в зависимости от ее стадии. В новой классификации, представленной в табл. 1, традиционная градация по функциональному классу Нью-Йоркской ассоциации сердца (NYHA) была дополнена стадиями развития ХСН, вследствие чего произошло разделение на пациентов, имеющих риск возникновения ХСН (стадии А и В), и пациентов с клиническими проявлениями ХСН (стадии С и D).
Патофизиология отеков при ХСН
У здоровых людей объем циркулирующей крови (ОЦК) и межклеточное пространство, составляющие вместе объем внеклеточной жидкости (ОВЖ) в организме, являются величиной постоянной, несмотря на потребление и потерю натрия и воды. Поскольку среди всех катионов внеклеточной жидкости 90% представляют собой ионы натрия, то они фактически и контролируют ОВЖ. Контроль ОВЖ зависит от натриевого баланса, за который отвечают почки. Если ОВЖ увеличивается у здорового человека, то почки экскретируют избыточное количество натрия и воды. У пациентов с ХСН почки избыточно задерживают натрий даже при увеличении ОВЖ.
Задержка натрия и воды не обязательно может происходить вследствие снижения сердечного выброса, т. к. отечный синдром может возникать также при состояниях, при которых сердечный выброс повышен: при тяжелой анемии, тиреотоксикозе, хронической артериовенозной фистуле, болезни Педжета и квашиоркоре [1]. Кроме того, задержка натрия не связана со снижением ОЦК, поскольку при ХСН ОЦК увеличивается. Таким образом, очевидно, что задержка натрия и воды при ХСН является частью глобального механизма, который предпринимает организм для поддержания нормального артериального давления (АД).
Данные, полученные на пациентах с нелеченной тяжелой дисфункцией левого желудочка, позволили по-новому взглянуть на патофизиологию развития отеков при ХСН [2]. Несмотря на 50-процентное снижение сердечного выброса, АД у пациентов сохранялось нормальным благодаря повышенному общему периферическому сосудистому сопротивлению. Общий объем жидкости в организме был выше нормы на 16%, и большая его часть находилась в межклеточном пространстве, а ОЦК был увеличен на 34%. Эффективный почечный кровоток был снижен на 30% вследствие сильно выраженной вазоконстрикции почечных артерий. Скорость клубочковой фильтрации была снижена в меньшей степени, что свидетельствовало о том, что спазм эфферентных сосудов был выражен больше, чем афферентных. Концентрация норадреналина была в 6 раз, а активность ренина плазмы — в 9 раз выше верхних границ нормы, альдостерон был в 6 раз больше нормы, а предсердный натрийуретический пептид — в 15 раз. Поэтому оказалось, что натрийзадерживающее действие катехоламинов и ренин-ангиотензиновой системы превалировало над натрийуретическим эффектом предсердного натрийуретического пептида на поздних стадиях ХСН.
Считается, что снижение почечного кровотока активирует секрецию ренина при ХСН, вследствие чего происходит повышение продукции ангиотензина II и альдостерона. Они, в свою очередь, увеличивают реабсорбцию натрия и воды в почечных канальцах, а также приводят к развитию гипертрофии левого желудочка и фиброзу миокарда.
Хотя диуретики напрямую не влияют на патологические процессы, происходящие при ХСН, они остаются основой симптоматической терапии по уменьшению объема внеклеточной жидкости, уменьшая выраженность застойных явлений в легких и периферических отеков.
Петлевые диуретики
Наиболее часто при ХСН используются диуретики, влияющие на восходящую петлю Генле канальцевого аппарата почек. В большей степени натрий реабсорбируется в проксимальных канальцах (60–65%) и в петле Генле (20%). При использовании в максимальных дозах петлевые диуретики могут привести к экскреции 20–25% реабсорбированного натрия [3].
Короткодействующие диуретики, такие как фуросемид, приводят к выраженному натрийурезу в течение 6 часов после назначения. Тем не менее, экскреция натрия в остальные 18 часов дня снижается до очень низкого уровня, поскольку потеря жидкости, вызванная фуросемидом, приводит к активации натрийсберегающих механизмов, которые запускают ренин-ангиотензин-альдостероновую (РААС) и симпатическую нервную системы. Повышенные концентрации таких нейрогормонов, как ангиотензин II, альдостерон и норадреналин, вызывают усиление реабсорбции натрия в канальцах [4–6], приводя, таким образом, к еще большей задержке натрия в организме. Следовательно, если пациент не находится на гипосолевой диете, то, несмотря на проведение диуретической терапии, он практически не будет выделять из организма натрий. Возможные решения данной проблемы включают в себя жесткое соблюдение гипосолевой диеты (не более 2–3 г/сутки), прием диуретиков дважды в день или увеличение дозы диуретиков. Максимальный диурез в течение дня происходит после первой дозы диуретиков, но активация натрий-сберегающих механизмов может ограничить ответ на прием второй дозы. Совместное применение диуретиков и ингибиторов ангиотензин-превращающего фермента (ИАПФ), занимающих первую строчку препаратов, использующихся для лечения ХСН, позволяет уменьшить ответную активацию РААС и, как следствие, усилить диуретический эффект от второй дозы диуретика в течение дня.
У пациентов с поздними стадиями ХСН и гиперсекрецией ренина внутривенное введение петлевых диуретиков может привести к резкому возрастанию уровня ренина и норадреналина в плазме и, следовательно, к спазму артериол и подъему АД. Данное повышение постнагрузки может способствовать кратковременному снижению сердечного выброса и повышению давления заклинивания легочной артерии, что клинически может выражаться в усугублении одышки, которая продолжается в течение часа после начала диуретической терапии, после чего выброс вазоконстрикторов резко снижается [7].
Нарушения электролитного баланса, в частности гипокалиемия, являются наиболее частым побочным эффектом петлевых диуретиков. Из-за него на фоне терапии этим классом препаратов может увеличиваться смертность за счет жизнеопасных аритмий. Так, в исследовании SOLVD [8] лечение диуретиками сопровождалось повышением общей смертности, сердечно-сосудистой смертности и числа внезапных сердечных смертей. Другие побочные эффекты включают гиперурикемию, а также ототоксичность и нарушение толерантности к глюкозе (редко).
Биодоступность фуросемида, принятого перорально, составляет только 50%, при этом существует большая вариабельность данного показателя у разных пациентов [9]. В основном, доза перорально назначаемого фуросемида должна быть в два раза больше, чем назначавшаяся до этого внутривенная доза.
В этой связи особый интерес вызывают новые петлевые диуретики, такие как торасемид, которые имеют ряд преимуществ по сравнению с другими петлевыми диуретиками (табл. 2 ). В отличие от фуросемида, параметры, характеризующие распределение торасемида в организме, практически не изменяются в зависимости от приема пищи и уровня альбумина в плазме. Возможным дополнительным преимуществом фуросемида является его способность блокировать рецепторы альдостерона и препятствовать дальнейшему прогрессированию фиброза миокарда [10].
В постмаркетинговом исследовании TORIC (TOrasemide In Congestive Heart Failure) проводилось сравнение эффективности и безопасности торасемида (10 мг/сутки), фуросемида (40 мг/сутки) и других диуретиков у 1377 пациентов с ХСН II–III функционального класса по NYHA. Торасемид по эффективности превзошел фуросемид и другие диуретики. Так, уменьшение функционального класса ХСН произошло у 45,8% и 37,2% в группах торасемида и фуросемида соответственно (р = 0,00017). Кроме того, торасемид реже вызывал гипокалиемию, по сравнению с фуросемидом (у 12,9% и 17,9% соответственно; р = 0,013). Положительное влияние торасемида на прогноз у больных ХСН подтверждалось более чем в два раза меньшей смертностью по сравнению с группой, получавшей фуросемид и другие диуретики [11].
В крупном рандомизированном исследовании PEACH (PharmacoEconomic Assessment of torаsemide and furosemide in the treatment of patients with Congestive Нeart failure) сравнивали влияние торасемида и фуросемида на конечные точки и качество жизни у больных ХСН II–III функционального класса по NYHA [12]. Продолжительность лечения составляла 6 месяцев. Различий в эффективности двух препаратов в отношении функциональных классов, частоты госпитализаций и смертности обнаружено не было. Несмотря на большую стоимость лечения торасемидом, оно было не менее экономически эффективным, чем лечение фуросемидом. Причиной этого была большая стоимость госпитализаций и визитов к врачу больных, принимавших фуросемид. Торасемид оказывал более благоприятное влияние и на качество жизни у данной группы больных.
В ряде исследований была также продемонстрирована высокая эффективность торасемида при выраженной (клиренс эндогенного креатинина < 30 мл/мин) почечной недостаточности [13], отечно-асцитическом синдроме у больных циррозом печени, а также при рефрактерной к лечению ХСН. В этой связи в настоящее время торасемид следует рассматривать в качестве оптимальной альтернативы фуросемиду в более сложных клинических ситуациях, связанных с более тяжелым отечным синдромом или необходимостью избежать побочных эффектов, характерных для петлевых диуретиков.
Таким образом, применение торасемида позволяет преодолевать основные недостатки активной диуретической терапии. Усиливается не только собственно мочегонное действие, но и блокируются побочные эффекты (электролитные нарушения и активация РААС).
Пациенты с поздними стадиями ХСН менее чувствительны к традиционным дозам пероральных петлевых диуретиков вследствие снижения перфузии почек и повышения уровня натрийсберегающих гормонов — ангиотензина II и альдостерона [9]. Резистентность к диуретикам развивается при их постоянном применении. Пациентов можно назвать «резистентными к диуретикам», если у них прогрессируют отеки, несмотря на увеличение пероральных и внутривенных диуретиков. Такое состояние развивается у 20–30% пациентов с выраженной дисфункцией левого желудочка. Пути преодоления резистентности к диуретикам включают назначение диуретиков внутривенно (болюсно или в виде инфузии), оптимизацию дозы диуретиков или использования комбинации петлевых и тиазидных диуретиков для более полной блокады реабсорбции натрия. Кроме того, надо учитывать, что гиперсолевая диета и применение нестероидных противовоспалительных средств может усиливать резистентность к диуретической терапии.
По сравнению с болюсными инфузиями, продолжительные внутривенные инфузии фуросемида могут приводить к более эффективному натрийурезу [9, 14–15]. В этом случае рекомендуется использовать фуросемид в дозе 20–40 мг/ч или торасемид в дозе 10–20 мг/ч [9].
Известно, что перфузия почек улучшается в положении лежа, поэтому диуретический эффект у пациентов с ХСН в два раза сильнее, если после приема или инфузии диуретиков они в течение нескольких часов лежат в кровати [16].
Тиазидные диуретики
Когда пациент получает фуросемид в дозе 240 мг/сутки и более, то лучше добавить к терапии тиазидный диуретик или блокатор карбоангидразы (ацетазоламид), чем продолжать и дальше увеличивать дозу фуросемида. По одной из теорий параллельная блокада карбоангидразы в проксимальных канальцах сопровождается доставкой большого количества ионов натрия к петле Генле, что приводит к большему натрийуретическому эффекту, по сравнению с монотерапией петлевыми диуретиками [17–19]. Еще более важно, что использование тиазидных диуретиков позволяет блокировать компенсаторную реабсорбцию натрия в дистальных канальцах, увеличивающуюся на фоне лечения петлевыми диуретиками. При пероральном назначении петлевых диуретиков тиазидные могут назначаться также per os вместе с ними одномоментно. Когда тиазидные диуретики назначаются перорально на фоне внутривенной терапии петлевыми диуретиками, необходимо опережать инфузию петлевых приемом тиазидных на 30–60 минут. Пациентов на фоне подобной комбинированной диуретической терапии нужно отслеживать особо тщательно из-за возможности развития резко выраженного диуреза, электролитных нарушений и падения системного АД.
Антагонисты альдостерона
Длительное время считалось, что использование ИАПФ и блокаторов рецепторов ангиотензина II (БРА) приводит к клинически значимому снижению концентрации альдостерона в плазме. Однако известно, что при использовании стандартных доз ИАПФ продукция альдостерона полностью не угнетается: до 40% пациентов на ИАПФ имеют повышенные концентрации альдостерона в плазме [20]. В настоящее время альдостерон рассматривается как кардиотоксин, обладающий целым рядом неблагоприятных эффектов. Он приводит к прогрессированию фиброза сердечной мышцы, усиливает продукцию АПФ и катехоламинов, нарушает гемодинамику в связи с задержкой жидкости в кровеносном русле и способствует образованию свободных радикалов, усиливая оксидативный стресс. Именно ему отводится ключевая роль в прогрессировании ХСН [21]. Было показано, что, несмотря на применение препаратов, влияющих на РААС, уровень альдостерона сохраняется высоким у пациентов, перенесших инфаркт миокарда и с далеко зашедшими стадиями ХСН [22–23]. Данный феномен носит название «ускользания альдостерона», а его причинами могут быть [24]:
продукция ангиотензина II посредством метаболических путей, не связанных с АПФ;
неполная блокада РААС при помощи ИАПФ;
независимая от уровня ангиотензина II продукция альдостерона.
Данный феномен «ускользания альдостерона» приводит к ухудшению прогноза у пациентов с систолической дисфункцией левого желудочка (ЛЖ) [25]. Так, в субанализе исследования CONSENSUS было показано, что у пациентов с более высокими концентрациями альдостерона в плазме исходно через 6 месяцев с момента начала исследования отмечалась достоверно большая смертность: 55% против 32% (p < 0,01) [26].
В двух крупных клинических исследованиях изучалась эффективность применения антагонистов альдостерона у пациентов со сниженной систолической функцией ЛЖ. В исследовании RALES оценивались эффекты спиронолактона у больных тяжелой ХСН, симптомы которой сохраняются несмотря на проводимую стандартную терапию. В результате двух лет лечения было показано, что использование антагониста альдостерона приводило к снижению риска смерти от прогрессирования ХСН и внезапной сердечной смерти на 30% и улучшению клинической симптоматики [27]. Затем влияние антагонистов альдостерона на примере эплеренона изучалось в исследовании EPHESUS у пациентов, перенесших инфаркт миокарда, что привело к снижению систолической функции ЛЖ [28]. Добавление к терапии эплеренона приводило к снижению общей смертности на 15% (период наблюдения в среднем составил 16 месяцев).
До сих пор, наряду с целесообразностью применения комбинации ИАПФ+БРА у пациентов с ранними стадиями ХСН, обсуждается клинический смысл использования антагонистов альдостерона у данной группы больных. В рекомендациях отмечено, что пациентам с III–IV функциональным классом ХСН по NYHA и перенесшим инфаркт миокарда целесообразно назначать антагонисты альдостерона, в то время как пациенты с ХСН II функционального класса по NYHA не включены в целевую группу. В то же время эффективность назначения у пациентов с фракцией выброса более 40% практически не изучалась. Возникает вопрос: действительно ли нужно ждать, когда пациент со вторым функциональным классом сердечной недостаточности доживет до третьего, чтобы назначить ему антагонисты альдостерона?
Скорее всего, прояснить данную ситуацию смогут проводящиеся в настоящее время исследования. В исследование EMPHASIS-HF, начавшееся в 2006 г. и планирующееся к завершению к 2011 г. будет включено около 2500 пациентов с ХСН II функционального класса, которым будет назначаться эплеренон или плацебо. В другом исследовании — AREA-IN-CHF — будет анализироваться динамика ремоделирования левого желудочка. Тем не менее, по независимым опросам около 70% врачей признают, что они не в полной мере следуют клиническим рекомендациям по ведению пациентов с ХСН, а в большей степени опираются на данные научных статей и мнения экспертов.
Подводя итог, следует отметить, что петлевые диуретики (фуросемид, торасемид) являются ключевым инструментом в борьбе с отечным синдромом у пациентов с ХСН. Необходимо учитывать как пользу, так и потенциальный вред, которые могут нести в себе препараты данной группы. Если петлевые диуретики теряют эффективность и у пациента развивается рефрактерные к терапии отеки, то добавление тиазидного диуретика может помочь решить данную проблему за счет преодоления резистентности препаратами с разным механизмом действия. В последние годы было также показано, что антагонисты альдостерона улучшают выживаемость пациентов с умеренной и тяжелой ХСН. Вне зависимости от терапии всем пациентам с отечным синдромом в рамках ХСН следует настоятельно рекомендовать гипосолевую диету. Только сочетание медикаментозных и немедикаментозных методов лечения позволит наиболее эффективно справляться с отеками у пациентов с ХСН, не увеличивая при этом риск нежелательных, жизнеугрожающих осложнений.
Anand I. Pathogenesis of salt and water retention in the congestive heart failure syndrome. In: Poole-Wilson P. Colucci W. Massie B, et al. eds. Heart Failure: Scientific Principles and Clinical Practice. New York, NY: Churchill Livingstone; 1997: 155–171.
Anand I. Ferrari R. Kalra G. et al. Edema of cardiac origin. Studies of body water and sodium, renal function, hemodynamic indexes, and plasma hormones in untreated congestive cardiac failure // Circulation. 1989; 80: 299–305.
Stanton B. Kaissling B. Adaptation of distal tubule and collecting duct to increased sodium delivery, II. Sodium and potassium transport // Am J Physiol. 1988; 255: F1269-F1275; Rose B. Diuretics. Kidney Int. 1991; 39: 336–352.