Хроническая сердечная недостаточность. Федеральные клинические рекомендации
Федеральные клинические рекомендации по хронической сердечной недостаточности содержат современные сведения об этиологии, патогенезе, клинике, классификации, диагностике данного синдрома. Представлены общие (стратегические) принципы немедикаментозного, медикаментозного и хирургического лечения с учетом дифференцированного подхода к терапии. Рекомендации обобщают опыт ведущих специалистов Российской Федерации в области детской кардиологии, содержат научно-практические данные, соответствующие современным мировым тенденциям ведения пациентов с хронической сердечной недостаточностью.
Рекомендации предназначены для детских кардиологов, педиатров, студентов педиатрических факультетов медицинских вузов.
Торасемид: рекомендации для клинического применения при хронической сердечной недостаточности и артериальной гипертензии
Карпов Ю.А.
Диуретики являются одними из наиболее широко применяемых сердечно-сосудистых препаратов. Эта популярность связана с их высокой эффективностью в лечении артериальной гипертензии (АГ) и отечного синдрома, главным образом у больных с хронической сердечной недостаточностью (ХСН). Наибольшее распространение из тиазидных (или тиазидоподобных) диуретиков получили гидрохлоротиазид в Европе и хлорталидон в США, которые используются при лечении АГ с конца 50-х гг. прошлого века, а также присоединившийся к ним в последние годы индапамид. Согласно новым рекомендациям Европейского общества АГ/Европейского общества кардиологов 2013 г. диуретики наряду с препаратами, блокирующими ренин-ангиотензиновую систему (РАС), β-блокаторами (БАБ) и блокаторами кальциевых каналов (БКК), относятся к препаратам первой линии для лечения АГ [1].
В начале 60-х гг. прошлого века в клиническую практику вошли петлевые диуретики – фуросемид, а затем этакриновая кислота, получившие свое название по месту приложения действия – на протяжении толстой части восходящего колена петли Генле. В этом сегменте восходящего колена петли Генле реабсорбируется от 20 до 30% профильтровавшегося натрия хлорида, что в 2–3 раза больше, чем после приема тиазидных диуретиков. Эти препараты нашли широкое применение в лечении отечного синдрома при различных заболеваниях, особенно при ХСН [2, 3]. Фуросемид и этакриновая кислота вызывают более выраженный, чем тиазидные диуретики, мочегонный эффект, однако этот эффект более кратковременный. После введения или приема внутрь этих петлевых диуретиков (примерно в течение 2–6 ч после однократного приема) экскреция ионов натрия с мочой значительно возрастает, однако после прекращения диуретического эффекта препаратов скорость экскреции ионов натрия снижается до уровня ниже исходного. Описанный «феномен рикошета», обусловленный целым рядом внутри- и внепочечных механизмов поддержания водно-электролитного баланса в условиях недостаточного поступления натрия хлорида в организм, и в дальнейшем способствует активация РАС [2].
Выраженная экскреция ионов натрия (мочегонное действие короткодействующих петлевых диуретиков), происходящая в течение нескольких часов в сутки, компенсируется значительной задержкой ионов натрия по окончании их мочегонного действия (т. е. на протяжении большей части суток). «Феномен рикошета» является объяснением того факта, что при приеме 1 р./сут петлевые диуретики (фуросемид) обычно не увеличивают суточную экскрецию ионов натрия и не оказывают существенного антигипертензивного действия. Для выведения избытка ионов натрия из организма петлевые диуретики необходимо назначать 2–3 р./сут. В исследованиях было показано, что фуросемид и буметанид при одно- или двухкратном назначении в сутки, как правило, недостаточно эффективны как антигипертензивные препараты. Снижение АД при назначении фуросемида 2 р./сут меньше, чем гидрохлоротиазида при приеме 1 р./сут. Эти данные привели к тому, что петлевые диуретики короткого действия не рекомендовались для широкого использования у пациентов с АГ, а их применение ограничивалось случаями на фоне хронической почечной недостаточности .
В 80-е гг. XX в. в клинической практике появился новый петлевой диуретик – торасемид [4]. Торасемид характеризуется высокой биодоступностью и более длительным эффектом, что обусловливает ряд благоприятных фармакодинамических свойств препарата. В отличие от фуросемида, диуретика короткого действия, для торасемида не характерен «феномен рикошета», что связано не только с его большей продолжительностью действия, но и присущей ему антиальдостероновой активностью (блокада рецепторов альдостерона на мембранах эпителиальных клеток почечных канальцев) и снижением секреции альдостерона в надпочечниках (экспериментальные данные).
Как и другие петлевые диуретики, торасемид действует на внутренней поверхности толстого сегмента восходящего колена петли Генле, где он ингибирует транспортную систему Na+/K+/2Cl-. Препарат усиливает экскрецию натрия, хлора и воды, не оказывая заметного влияния на скорость клубочковой фильтрации, почечный кровоток или кислотно-щелочной баланс. Установлено, что фуросемид дополнительно влияет на проксимальные извитые канальцы нефрона, где происходит реабсорбция большей части фосфатов и бикарбонатов. Торасемид не оказывает влияния на проксимальные канальцы, вызывает меньшую потерю фосфатов и бикарбонатов, а также калия с мочой.
Торасемид после приема внутрь быстро всасывается с максимальной концентрацией через 1 ч. Биодоступность препарата выше, чем у фуросемида (80% против 53%), причем она остается высокой при наличии сопутствующих заболеваний и у лиц пожилого и старческого возраста. Период полувыведения торасемида у здоровых лиц составляет 4 ч; он практически не изменяется при ХСН и хронической почечной недостаточности. По сравнению с фуросемидом натрий- и диуретическое действие торасемида наступает позднее и продолжается значительно дольше. Длительность диуретического действия фуросемида при внутривенном введении составляет в среднем 2–2,5 ч и торасемида – около 6 ч; при приеме внутрь действие фуросемида продолжается около 4–6 ч, торасемида – более 12 ч. Торасемид удаляется из кровообращения, подвергаясь метаболизму в печени (около 80% общего количества), и выводится с мочой (около 20% от общего количества у пациентов с нормальной функцией почек).
Недавно в клинической практике в нашей стране появился оригинальный торасемид замедленного высвобождения – Бритомар [5]. Пролонгированная форма торасемида обеспечивает постепенное высвобождение активного вещества, снижая колебания концентрации препарата в крови, по сравнению с обычной формой выпуска препарата. Лекарственное вещество высвобождается более длительно, благодаря этому диурез начинается примерно через 1 ч после приема препарата, достигая максимума через 3–6 ч, длится эффект от 8 до 10 ч. Это позволяет добиться дополнительных клинических преимуществ в лечении. Торасемид с замедленным высвобождением при долгосрочном применении не вызывает изменений уровня калия крови, не оказывает заметного влияния на уровень кальция и магния, показатели гликемического и липидного профиля [5]. Препарат замедленного высвобождения не взаимодействует с антикоагулянтами (варфарином, фенпрокумоном), сердечными гликозидами или органическими нитратами, БАБ, ингибиторами АПФ (иАПФ), блокаторами рецептора ангиотензина (БРА)II, БКК и спиронолактоном. Следует отметить, что одновременное применение с диуретиками иАПФ, и особенно антагонистов минералокортикоидных рецепторов (МКР), предотвращает развитие электролитных нарушений в подавляющем большинстве случаев.
Пролонгированная форма торасемида рекомендуется при отечном синдроме вследствие ХСН, заболеваний почек и печени; при АГ – в качестве монотерапии или в комбинации с другими гипотензивными препаратами.
Хроническая сердечная недостаточность
В настоящее время диуретики занимают одно из ведущих мест в лечении ХСН [3]. Несмотря на то, что отсутствуют данные об их влиянии на прогноз у больных с ХСН, эффективность и клиническая необходимость данного класса препаратов для лечения больных с декомпенсацией сердечной деятельности вне всяких сомнений. Диуретики вызывают быстрое уменьшение симптомов ХСН, связанных с задержкой жидкости (периферические отеки, одышка, застой в легких), в отличие от других средств терапии ХСН. В соответствии с алгоритмом лечения систолической ХСН в рекомендациях Европейского общества кардиологов 2012 г. диуретики назначаются вне зависимости от функционального класса всем пациентам с имеющимся отечным синдромом. Рациональное применение диуретиков позволяет улучшить клиническую симптоматику и уменьшить число госпитализаций или достичь две важнейшие из шести целей при лечении ХСН [3].
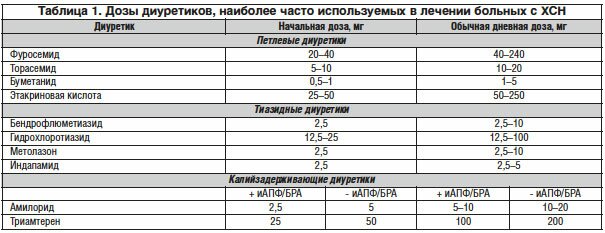
Только с помощью диуретиков можно адекватно контролировать водный статус у больных с ХСН. Адекватность контроля во многом обеспечивает успешность терапии БАБ, иАПФ, БРА и антагонистами МКР. В случае относительной гиповолемии значительно увеличивается риск развития снижения сердечного выброса, гипотонии, ухудшения функции почек. Для лечения ХСН диуретики должны применяться только в комбинации с другими препаратами (БАБ, блокаторы РАС, антагонисты МКР). В таблице 1 представлены диуретики и их дозы для лечения ХСН [6].
Согласно современным клиническим рекомендациям. применение торасемида по сравнению с другими диуретиками имеет целый ряд дополнительных преимуществ. Следует отметить лучшую безопасность и переносимость торасемида по сравнению с фуросемидом [6]. Торасемид – первый петлевой диуретик, который оказывает влияние на прогрессирование сердечной недостаточности и течение патологических процессов в миокарде. Эксперты выделяют антиальдостероновое и антифибротическое действие, доказанное в экспериментальных и клинических исследованиях. В исследовании B. Lopes и соавт. было показано, что торасемид в сравнении с фуросемидом приводит к снижению объемной фракции коллагена и уменьшает развитие фиброза [7]. В одном из российских исследований доказано влияние торасемида на ремоделирование левого желудочка и способность нормализовать соотношение показателей синтеза и распада коллагена [8].
В исследовании TORIC торасемид продемонстрировал способность лучше влиять на прогноз больных с ХСН [9]. В этом исследовании были проанализированы результаты 9-месячного сравнительного лечения торасемидом в суточной дозе 10 мг и фуросемидом 40 мг больных с ХСН. В группе больных, получавших терапию торасемидом, значительно чаще улучшался функциональный класс недостаточности кровообращения, достоверно снизилась сердечно-сосудистая и общая смертность. По результатам исследования американские эксперты пришли к выводу, что торасемид является препаратом выбора среди диуретиков в лечении застойной сердечной недостаточности. В российском многоцентровом исследовании ДУЭЛЬ торасемид по сравнению с фуросемидом быстрее приводил к компенсации, был более эффективен и вызывал меньше нежелательных эффектов (0,3% против 4,2% на фуросемиде), в т. ч. метаболических и электролитных [10].
Недавно И.В. Жиров и соавт. провели одноцентровое рандомизированное открытое исследование для определения сравнительной эффективности торасемида пролонгированного действия и фуросемида у пациентов с ХСН II–III ФК, отечным синдромом и повышенным уровнем натрийуретических пептидов (НП) на степень уменьшения концентрации NT-проМНП [11]. В исследование были включены 40 пациентов с ХСН II–III ФК ишемической этиологии с ФВ ЛЖ менее 40%, разделенных на две равные группы методом рандомизации в конвертах. Первая группа в качестве диуретика получала торасемид пролонгированного действия (Бритомар, фармацевтическая компания «Такеда»), вторая – фуросемид. Титрование дозы проводилось по стандартной схеме в зависимости от выраженности отечного синдрома. Лечение и наблюдение продолжались 3 мес. средняя доза торасемида замедленного высвобождения составила 12,4 мг, фуросемида – 54,2 мг. В обеих группах на фоне лечения наблюдали достоверное улучшение переносимости физической нагрузки, улучшение качества жизни больных, снижение концентрации натрийуретических гормонов. В группе торасемида замедленного высвобождения была тенденция к более значимому улучшению качества жизни (р=0,052) и достоверно более выраженное снижение уровней NT-проМНП (р<0,01). Таким образом, согласно данным этого исследования, торасемид замедленного высвобождения благоприятно влиял на течение и качество жизни пациентов с ХСН.
Схема применения торасемида при ХСН. У больных с ХСН обычная стартовая доза препарата – 2,5–5 мг 1 р./сут, которую при необходимости увеличивают до 20–40 мг до получения адекватного диуретического ответа.
Как уже отмечалось ранее, диуретики относятся к группам антигипертензивных препаратов первой линии в лечении пациентов с АГ [1]. Согласно новым американским рекомендациям. они остаются препаратом приоритетного назначения для контроля АД у всех больных, если у пациентов нет клинических ситуаций или состояний для преимущественного назначения какого-либо из классов антигипертензивных препаратов [12]. Все это указывает на значительные позиции диуретиков как в моно-, так и особенно в комбинированной терапии АГ. Диуретики как класс стали практически идеальными средствами при необходимости назначения второго препарата, поскольку они потенцируют действие препаратов всех других классов. Вместе с тем следует отметить, что речь идет в первую очередь о тиазидных и тиазидоподобных диуретиках (гидрохлоротиазид, бендрофлюметиазид, хлорталидон, индапамид и др.). Эти диуретики были изучены в крупномасштабных длительных клинических исследованиях, продемонстрировавших эффективность не только в контроле АД, но и снижении риска сердечно-сосудистых осложнений при использовании большинства из них. Во многих исследованиях последних лет эффективность диуретиков сравнивали с эффективностью более новых групп препаратов – БКК (исследования INSIGHT, STOP-2), иАПФ (CAPPP, STOP-2), БКК и иАПФ (ALLHAT). Критика в адрес тиазидных диуретиков сводится в основном к негативным метаболическим нарушениям (липидный и углеводный обмен), что наиболее ярко проявилось в исследовании ASCOT (при присоединении к БАБ атенололу), а также к возможным нарушениям электролитного обмена (гипокалиемия).
Другие диуретики (петлевые) обычно назначаются вместо тиазидных, если у больного АГ креатинин сыворотки достигает 1,5 мг/дл или скорость клубочковой фильтрации <30 мл/мин/1,73 м2 [1]. Эти ограничения связаны главным образом с их кратковременным и относительно слабым антигипертензивным эффектом, что требовало их приема несколько раз в сутки, более слабым вазодилатирующим эффектом, а также выраженной активацией контррегуляторных механизмов, направленных на задержку солей и жидкости в организме. Как показали многочисленные клинические исследования по изучению эффективности и безопасности нового петлевого диуретика торасемида, препарат может наряду с тиазидными диуретиками использоваться для регулярного контроля АД при АГ.
Антигипертензивная эффективность
и безопасность торасемида
Большинство исследований с оценкой эффективности торасемида были проведены еще в 90-х гг. ХХ в. В 12-недельном двойном слепом исследовании у 147 больных АГ торасемид в дозах 2,5–5 мг/сут по антигипертензивной активности достоверно превосходил плацебо [13]. Диастолическое АД нормализовалось у 46–50% больных, получавших торасемид, и 28% больных группы плацебо. Препарат сравнивали с различными тиазидными и тиазидоподобными диуретиками, в т. ч. в различных схемах комбинированной терапии. По данным одного из исследований, натрийуретический, диуретический и антигипертензивный эффекты торасемида в суточных дозах от 2,5 до 5 мг сравнимы с эффектами 25 мг гидрохлоротиазида, 25 мг хлорталидона и 2,5 мг индапамида в сутки и превосходили действие фуросемида, назначенного в дозе 40 мг 2 р./сут. Торасемид в значительно меньшей степени снижал концентрацию калия в сыворотке, чем гидрохлоротиазид и другие тиазидные диуретики, и практически не вызывал нарушений углеводного и липидного обмена [14].
В другом плацебо-контролируемом исследовании 2,5 мг торасемида и 25 мг хлорталидона в сутки по сравнению с плацебо на протяжении 8 нед. лечения вызывали одинаковое снижение систолического и диастолического АД. Не было выявлено заметного влияния торасемида на концентрации калия, магния, мочевой кислоты, глюкозы и холестерина в сыворотке. В этом исследовании в группе хлорталидона было отмечено значительное снижение уровня калия в крови и достоверное повышение уровней мочевой кислоты, глюкозы и холестерина [16].
В 12-недельном рандомизированном исследовании в условиях двойного слепого метода сравнивали эффекты 2,5 мг торасемида и 2,5 мг индапамида у 66 больных АГ с 1-й и 2-й степенью повышения АД. Дозы препаратов удваивали, если через 4 нед ДАД оставалось выше 100 мм рт. ст. Оба диуретика вызывали одинаковое и значительное снижение ДАД, причем максимальное снижение наблюдалось через 8–12 нед. после начала терапии. Удвоение дозы диуретика потребовалось 9 (28%) из 32 больных, получавших торасемид, и 10 (29%) из 32 больных, принимавших индапамид. ДАД снизилось <90 мм рт. ст. к концу исследования у 94% больных, получавших торасемид, и у 88% больных, принимавших индапамид [15].
Были проведены и более длительные наблюдения за эффективностью торасемида. В 24-недельном рандомизированном исследовании изучались эффекты 2,5 мг торасемида и 25 мг гидрохлоротиазида в комбинации с 50 мг триамтерена с удвоением доз через 10 нед. при недостаточном снижении ДАД у 81 больного с АГ. В обеих группах было получено одинаковое и значительное снижение АД, хотя антигипертензивный эффект комбинации диуретиков был несколько более выраженным. Аналогичные результаты были продемонстрированы в другом исследовании такой же продолжительности со сходным дизайном у 143 больных с АГ. При одинаковой антигипертензивной эффективности торасемида и комбинации гидрохлоротиазида с триамтереном (или амилоридом) оба вида терапии не вызывали существенных изменений ни концентрации электролитов в сыворотке крови, ни показателей углеводного и липидного обмена [16].
В работе О.Н. Ткачевой и соавт. изучили влияние торасемида 5–10 мг в комбинации с 10 мг эналаприла и 12–25 мг гидрохлоротиазида в комбинации с 10 мг эналаприла на электролитный баланс, углеводный, липидный и пуриновый виды обмена у женщин с неконтролируемой АГ в постменопаузальном периоде [17]. Было отмечено значительное снижение уровня калия и магния через 24 нед. терапии гидрохлоротиазидом на 11 и 24% соответственно (p<0,05), в то время как в группе торасемида статистически значимых изменений уровня калия и магния не было выявлено. Торасемид не оказывал влияния на углеводный, липидный и пуриновый обмен, тогда как в группе тиазидного диуретика было зарегистрировано достоверное повышение индекса инсулинорезистентности и уровня мочевой кислоты.
Следовательно, торасемид в дозах до 5 мг/сут, которые используются при лечении АГ, сравним по антигипертензивной эффективности с тиазидными диуретиками (гидрохлоротиазид, хлорталидон и индапамид), однако значительно реже вызывает гипокалиемию. В отличие от других петлевых и тиазидных диуретиков при длительном лечении торасемидом не требуется контроль за содержанием электролитов, мочевой кислоты, глюкозы и холестерина. Таким образом, торасемид в низких дозах является эффективным антигипертензивным препаратом, который при приеме 1 р./сут вызывает длительное и равномерное снижение АД на протяжении суток. В отличие от всех других петлевых и тиазидных диуретиков торасемид редко вызывает гипокалиемию и оказывает незначительное влияние на показатели пуринового, углеводного и липидного метаболизма. При лечении торасемидом реже требуется повторный лабораторный контроль за биохимическими показателями, что позволяет уменьшить общие расходы на лечение АГ.
Сравнение клинических эффектов обычного торасемида и формы препарата с пролонгированным высвобождением лекарственного вещества показало, что последний оказывал не меньший эффект на снижение ДАД, и степень снижения САД у обоих препаратов также была сходной.
Схема применения торасемида для лечения АГ. Препарат рекомендуется в начальной дозе 5 мг 1 р./сут. Если целевое АД (<140/90 мм рт. ст. для большинства больных) не было достигнуто за 4 нед. то в соответствии с рекомендациями врач может повысить дозу до 10 мг 1 р./сут или в схему лечения добавить гипотензивный препарат другой группы, лучше всего из группы препаратов, блокирующих РАС (иАПФ или БРА), или БКК. Таблетки пролонгированного действия назначают внутрь 1 р./сут, обычно утром, независимо от приема пищи.
В исследованиях у пациентов с АГ торасемид пролонгированного действия незначительно снижал уровень калия после 12 нед. лечения. Препарат практически не влиял на такие биохимические показатели, как мочевина, креатинин и мочевая кислота, а заболеваемость подагрой была аналогична в группе плацебо. В длительных исследованиях назначение торасемида пролонгированного действия в дозе 5 и 20 мг на протяжении года значительных изменений в уровнях липидов крови, по сравнению с исходными значениями, не вызывало.
Заключение
Торасемид – это петлевой диуретик, который рекомендуется больным с ХСН и АГ. При лечении больных с ХСН препарат не уступает по диуретическому эффекту фуросемиду, дополнительно оказывает антиальдостероновое и антифибротическое действие. Препарат может успешно применяться при нарушении функции почек и ухудшении всасывания фуросемида у больных с тяжелой сердечной недостаточностью. При АГ торасемид снижает АД при применении 1 р./сут в дозе 5–10 мг в течение 4 нед.; при необходимости может использоваться в комбинации с препаратами, блокирующими РАС. Имеются данные об эффективности в лечении женщин с АГ в постменопаузальном периоде в комбинации с иАПФ. Терапия торасемидом хорошо переносится и крайне редко приводит к метаболическим и электролитным нарушениям.
Литература
1. 2013 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. 2013. Vol. 31(7). P. 1281–1357.
2. Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств, 3-е изд. М. 2005. 1527 c.
3. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012 // Eur. Heart J. 2012. Vol. 33. P. 1787–1847.
4. Brater D.C. Leinfelder J. Anderson S.A. Clinical pharmacology of torasemide, a new loop diuretic // Clin. Pharmacol. Ther. 1987. Vol. 42. P. 187–192.
5. Бритомар. Монография. Феррер Интернасьональ, 2011. 26 с.
6. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр) // Сердечная недостаточность. 2013. Т. 14, № 7(81).
7. Lopez B. Querejeta R. Gonzales A. et al. Effects of loop diuretics on myocardial fibrosis and collage type I turnover in chronic heart failure // J. Am. Coll. Cardiol. 2004. Vol. 43 (11). P. 2028–2035.
8. Агеев Ф.Т. Жубрина Е.С. Гиляревский С.Р. и др. Сравнительная эффективность и безопасность длительного применения торасемида у больных с компенсированной сердечной недостаточностью. Влияние на маркеры фиброза миокарда // Сердечная недостаточность. 2013. № 14(2). С. 55–62.
9. Cosin J. Diez J. TORIC investigators. Torasemide in chronic heart failure: results of the TORIC study // Eur. J. Heart Fail. 2002.Vol. 4(4). P. 507–513.
10. Мареев В.Ю. Выгодин В.А. Беленков Ю.Н. Диуретическая терапия Эффективными дозами перорАльных диуретиков торасемида (диувера) и фуросемида в лечении больных с обострением Хронической Сердечной Недостаточности (ДУЭЛЬ-ХСН) // Сердечная недостаточность. 2011. № 12(3). С. 3–10.
11. Жиров И.В. Горюнова Т.В. Осмоловская Ю.Ф. и др. Место торасемида замедленного высвобождения в лечении ХСН // РМЖ. 2013.
12. Go A.S. Bauman M.A. Sallyann M. et al. AHA/ACC/CDC Science Advisory An Effective Approach to High Blood Pressure Control // Hypertension. 2013. Nov. 21.
13. Achhammer I. Metz P. Low dose loop diuretics in essential hypertension. Experience with torasemide // Drugs. 1991. Vol. 41(Suppl. 3). P. 80–91.
14. Baumgart P. Torasemide in comparison with thiazides in the treatment of hypertension // Cardiovasc. Drugs Ther. 1993. Vol. 7 (Suppl. 1). P. 63–68.
15. Spannbrucker N. Achhammer I. Metz P. Glocke M. Comparative study on the hypertensive efficacy of torasemide and indapamide in patients with essential hypertension // Drug. Res. 1988. Vol. 38 (1). P. 190–193.
16. Achhammer I. Eberhard R. Comparison of serum potassium levels during long-term treatment of hypertension patients with 2,5 mg torasemide o.d. or 50 mg triamterene/25 mg hydrochlorothiazide o.d.// Prog. Pharmacol. Clin. Pharmacol. 1990. Vol. 8. P. 211–220.
17. Ткачева О.Н. Шарашкина Н.В. Новикова И.М. и др. Применение петлевого диуретика торасемида в комбинированном лечении гипертонической болезни у женщин в период постменопаузы // Consilium Medicum. 2011.Т.13 (10). С. 54–59.
при Международной федерации клинической химии:
аналитические проблемы определения биохимических маркеров острых коронарных синдромов
“This document has been translated with permission of the National Academy of Clinical Biochemistry, Washington, DC, USA.
NACB is not responsible for the accuracy of the translation. Th e views presented are those of the authors and not necessarily those of the NACB.” Copyright © 2008 American Association for Clinical Chemistry and Terra Medica
Авторский коллектив:
У. Г. Уилсон Танг, Гэри С. Фрэнсиз, Дэвид А. Морроу, Л. Кристин Ньюби, Кристофер П. Кэннон, Роберт Л. Джесс, Алан Х. Б. Ву6, Алан Б. Сторроу, Роберт Г. Кристенсон
Члены комитета НАКБ
Председатель. Роберт Г. Кристенсон
Фред С. Эппл, Кристофер П. Кэннон и Гэри Фрэнсиз, Роберт Л. Джесс, Дэвид А. Морроу, Л. Кристин Ньюби, Ян Равкилд, Алан Б. Сторроу, У. Г. Уилсон Танг, Алан Х. Б. Ву
Все взаимоотношения членов Комитета с промышленностью можно выяснить на сайте http://www.aacc.org/AACC/members/nacb/ LMPG/OnlineGuide/PublishedGuidelines/ACSHeart/heartpdf.htm. Материалы этой публикации выражают мнение авторов и членов Комитета и не представляют официальную позицию Национальной академии клинической биохимии (НАКБ). Национальная академия клинической биохимии является академией Американской ассоциации клинической химии.
А. Условия определения маркеров при сердечной недостаточности.
Б. Предпосылки и определение терминов.
В. Превращения и определение натрийуретического пептида мозгового типа (НПМТ) и аминоконцевого предшественника натрийуретического пептида мозгового типа (про-НПМТ).
II. ИСПОЛЬЗОВАНИЕ ЛАБОРАТОРНЫХ МАРКЕРОВ
ДЛЯ ИСХОДНОЙ ОЦЕНКИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
А. Диагностика сердечной недостаточности.
1. НПМТ или про-НПМТ в диагнозе острой декомпенсированной сердечной недостаточности.
III. ИСПОЛЬЗОВАНИЕ ЛАБОРАТОРНЫХ МАРКЕРОВ В СКРИНИНГЕ ДИСФУНКЦИИ СЕРДЦА
А. НПМТ или про-НПМТ в скрининге сердечной недостаточности и дисфункции сердца.
Б. Подходы к скринингу дисфункции сердца.
IV. ИСПОЛЬЗОВАНИЕ ЛАБОРАТОРНЫХ МАРКЕРОВ В КОНТРОЛЕ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
А. Терапевтический мониторинг под контролем результатов определения НПМТ или про-НПМТ.
Литература
I. Общий обзор аналитических проблем определения лабораторных маркеров сердечной недостаточности
A. Условия определения лабораторных маркеров при сердечной недостаточности
В последнее десятилетие совершилась революция в определении ряда лабораторных маркеров и подходах к диагностике и лечению сердечной недостаточности. Медицинское сообщество надеется, что значительный прогресс в понимании доступных в настоящее время сердечных маркеров будет способствовать улучшению выделения вариантов сердечной недостаточности и индивидуализации лечения этих состояний, и не только их. Однако, как и у большинства новых диагностических методов, несморя на многообещающие результаты ключевых испытаний, в клинических условиях встречается множество проблем.
Материал, обсуждаемый в этом руководстве, относится к определению НПМТ, про-НПМТ и сердечного тропонина в связи с выявлением, стратификацией риска и лечениемсердечной недостаточности, включая лечебные показания для взрослых больных (старше 18 лет). Вместе с сопутствующим документом «Практические указания Национальной академии клинической биохимии и Комитета по стандартизации маркеров повреждения сердца при Международной федерации по клинической химии: аналитические проблемы определения биохимических сердечной недостаточности» данные рекомендации направлены на надлежащее использование результатов этих исследований врачами и лабораторным персоналом. Комитет считает, что распространение этих указаний среди клиницистов и сотрудников лабораторий должно улучшить их взаимопонимание и, в конечном счете, уход за больными и исходы лечения сердечной недостаточности. Хотя конкретизация в такой ситуации затруднена, руководство задумано как краткое пособие, которое может быть полезным в конкретных ситуациях. Комитет считает, что получение и распространение знаний об определении натрийуретических пептидов является основной проблемой на пути применения результатов таких анализов. По этой причине существуют планы по широкому распространению данных рекомендаций. Комитет считает, что это поможет ознакомить пользователей с преимуществами и недостатками определения НПМТ и про-НПМТ. Например, что касается стоимости, прямые затраты на анализ НПМТ или про-НПМТ составляют примерно 50 долларов США (по курсу 2007 г.). Получены свидетельства, хотя и несколько противоречивые, что использование определения НПМТ в целом снижает затраты на лечение сердечной недостаточности без повышения риска для больных [1, 2]. Затраты учитывались комитетом при разработке рекомендаций, однако сочтены умеренными в сравнении с общими затратами на лечение сердечной недостаточности, и эта точка зрения находит документальное подтверждение [1, 2].
Важно подчеркнуть, что ценность результатов анализа состоит в том, что они дополняют клинические наблюдения о ходе заболевания. Таким образом, определение биохимических маркеров (таких как НПМТ или про-НПМТ) важно не само по себе и должно использоваться и истолковываться в более широком клиническом контексте с учетом сопутствующих факторов. При правильном использовании выгоды тестирования для здоровья намного перевесят побочные эффекты и риски, связанные с получением информации об уровне НПМТ и про-НПМТ. Использование результатов определения сердечного тропонина в связи с популяционными исследованиями сердечной недостаточности также обсуждается, главным образом, в связи с их ролью в стратификации риска.
Б. Предпосылки и определение терминов
Сердечная недостаточность является комплексным клиническим синдромом, который может быть результатом любого структурного или функционального нарушения в сердце, приводящего к расстройству способности желудочков наполняться кровью или выталкивать кровь [3]. Значение этой проблемы, затрагивающей 2–3% населения США, непрерывно возрастает вместе со связанными с ней затратами. По оценкам ряда авторов, только 50% таких больных живут дольше 4 лет [4]. Возрастание распространенности сердечной недостаточности является следствием постарения населения, а также заметного увеличения числа людей, переживших инфаркт миокарда. По самым скромным оценкам, 50% случаев сердечной недостаточности имеют ишемическое происхождение, в 75% случаев главным этиологическим фактором является гипертензия. Затраты, связанные с сердечной недостаточностью, в Европе и США оцениваются в 100 млрд долларов, при этом в США 70% затрат приходится на госпитализацию [3–5].
Диагноз сердечной недостаточности у постели больного ставится на основании клинических признаков и симптомов, а не на основании результатов каких-либо анализов. Однако значительная часть больных обращаются к кардиологу после того, как врач общей практики ошибочно поставил иной диагноз, чем сердечная недостаточность. В связи с этим определение биомаркеров при сердечной недостаточности имеет три важные цели: 1) выяснить возможные (и, вероятно, обратимые) причины сердечной недостаточности; 2) подтвердить наличие или отсутствие синдрома сердечной недостаточности и 3) оценить тяжесть сердечной недостаточности и риск ее прогрессирования.
В последние десять лет показано, что натрийуретические пептиды, особенно НПМТ и его аминоконцевой пропетид про-НПМТ, высокоинформативны в подтверждении или опровержении диагноза сердечной недостаточности, а также в определении отсроченного риска. Кроме того, в литературе стали упоминаться несколько новых сердечных, воспалительных и метаболических биомаркеров, таких как натрийуретический пептид типа С [6], эндотелин-1 [7], С-реактивный белок [9, 10], сердечный тропонин [8], апелин [11, 12], миотрофин [13], уротензин-II [14–16], адреномедуллин [17, 18] и средний фрагмент проадреномедуллина [19], кардиотропин-1 [20, 21], урокортин [22], растворимый рецептор ST2 [23], миелопероксидаза (МПО) [24], копептин [19, 25], ростовой дифференцировочный фактор-15 (GDF-15) [26], лимфоцитарные киназы связанных с G-белками рецепторов (GRK-2) [27], галектин-3 [28], средний фрагмент и другие циркулирующие формы натрийуретического пропептида типа А [19, 29] и многие другие. Их клиническое значение предстоит установить и подтвердить (табл. 3.1).
Таблица 3.1. Некоторые лабораторные маркеры, известные или изучаемые в настоящее время для клинической диагностики, лечения и стратификации риска сердечной недостаточности
Стандартные лабораторные маркеры





