Н.В. Пизова, Ярославская государственная медицинская академия
Цереброваскулярные расстройства при системных васкулитах*
Сосудистые заболевания головного мозга являются одной из актуальных медицинских и социальных проблем современности. Клинические наблюдения и научные исследования последних лет дают основание считать, что к существенным факторам риска, играющим немаловажную роль в патогенезе цереброваскулярных нарушений, относятся: артериальная гипертензия, атеросклеротические окклюзирующие поражения магистральных артерий головы, нарушения сердечной деятельности, наследственные и приобретенные тромбофилии и другие, причем взаимодействие двух факторов и более является особенно неблагоприятным.
Ревматические болезни относятся к группе заболеваний, которые характеризуются развитием аутоиммунных процессов против антигенов почти всех органов и тканей организма, что нередко сочетается с образованием аутоантител с органонеспецифическими свойствами. Что касается патогенеза сосудистых поражений при ревматических заболеваниях, то в настоящее время эти болезни относят к группе аутоиммунных процессов. Генерализованное поражение сосудистого русла составляет основу патологического процесса при системных васкулитах, когда иммунное воспаление захватывает артерии и вены различного калибра, все звенья путей микроциркуляции. Развивающаяся в последующем деструкция сосудистой стенки, ее деформация и склероз вызывают выраженные гемодинамические расстройства в соответствующих сосудистых регионах. Аутоиммунные ревматические заболевания характеризуются вовлечением нервной системы в патологический процесс у большинства больных. Этиология подавляющего большинства первичных системных васкулитов неизвестна.
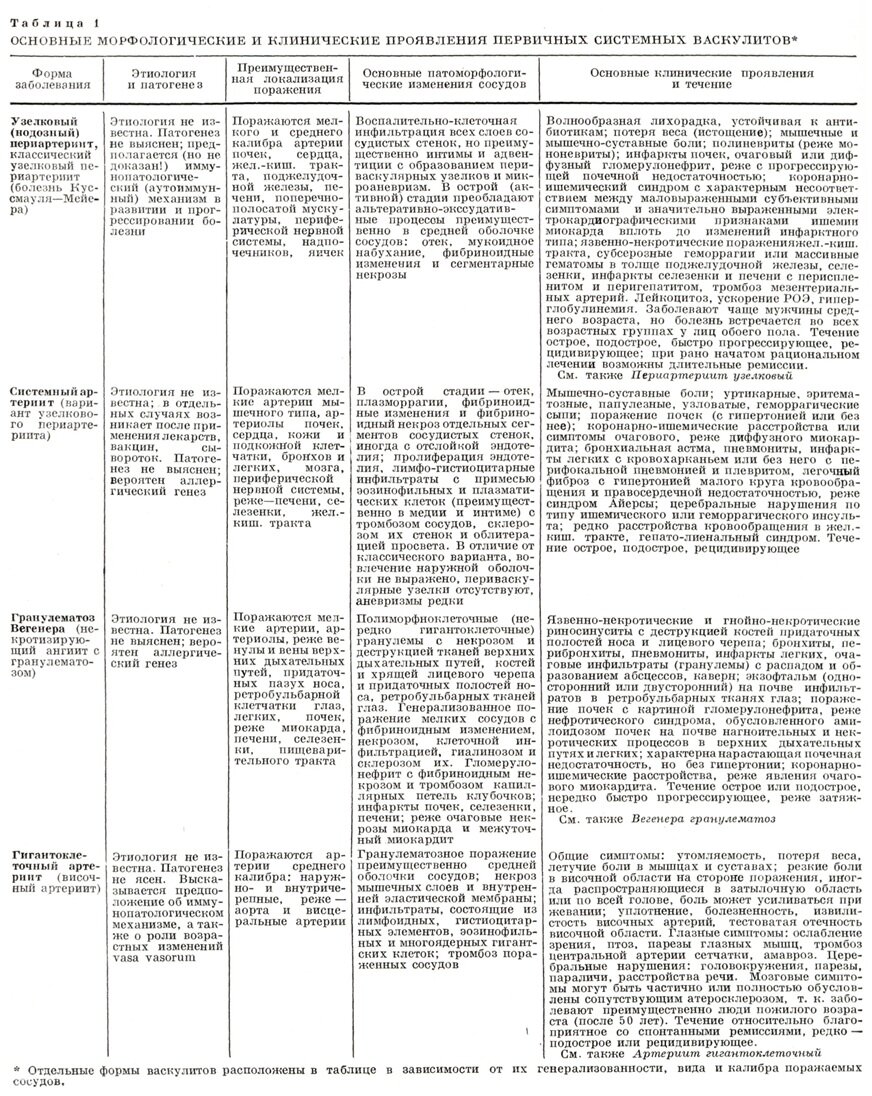
Системные васкулиты (СВ) – это гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки, а спектр клинических проявлений зависит от типа, размера и локализации пораженных сосудов и тяжести сопутствующих воспалительных нарушений (таб. 1 ). Несмотря на значительные успехи, достигнутые в изучении системных васкулитов, патогенетические механизмы, лежащие в основе поражения сосудистой стенки, расшифрованы далеко не полностью.
Механизм развития неврологических и психических расстройств у больных с СВ сложен и разнообразен. Можно выделить пять основных механизмов, вызывающих неврологические и психические расстройства: ишемия; кровоизлияния; поражение белого вещества; нейрональная дисфункция; особенности психологического реагирования.
Причинами развития ишемического повреждения ЦНС при СВ наряду с непосредственным поражением сосудов (васкулиты) являются: антифосфолипидные и другие антитела; атеросклероз; тромбозы артерий и/или вен; эмболии; диссекция сосудов; сосудистый спазм; другие причины, часто встречаемые в общей популяции.
Частота поражения ЦНС, по данным различных авторов, у больных системными васкулитами достигает 82%. Клинические проявления включают различные симптомы/синдромы (таб. 2. 3 ).
На базе Ярославской государственной медицинской академии проведено клинико-лабораторное обследование, в котором приняли участие 117 больных различными нозологическими формами СВ. Среди них было 70 (59,8%) женщин и 47 (40,2%) мужчин. Средний возраст участников составил 41,9 ± 11,6 года. Активность основного процесса в группе была минимальной в 62 пациентов (53%), умеренной – в 46 (39,3%), выраженной – в 9 (7,7% случаев). Основные формы сосудистых поражений головного мозга выделялись согласно принятой в России классификации Е.В. Шмидта (1985). При СВ наблюдалось прогредиентное нарастание признаков дисциркуляторной энцефалопатии (ДЭ), что отражало диффузность поражения головного мозга. В данной группе при нарастании активности от минимальной до умеренной степени наблюдался переход ДЭ I ст. в ДЭ II ст. и нарастала частота ДЭ III ст. (таб. 4 ). При переходе от умеренной степени к выраженной увеличивалось число случаев ДЭ I ст. за счет перехода пациентов с начальными проявлениями недостаточности мозгового кровоснабжения (НМК) и не имевших цереброваскулярной патологии.
При первичных СВ максимальная частота преходящих НМК и инсультов наблюдалась в первые 5 лет от клинического дебюта заболевания и в сроки более чем через 10 лет. Повторные эпизоды острых НМК в течение первых 5 лет от дебюта заболевания отмечались в 25% случаев, в сроки 6-10 лет – у 20% больных. У пациентов с СВ преходящие НМК и инсульты развивались при минимальной (12,9 и 12,9%), умеренной (19,6 и 30,6%) и выраженной (44,4%) активности ревматического процесса. При всех формах СВ с увеличением активности ревматического процесса отмечалось нарастание частоты ПНМК и инсультов. Клинические проявления у пациентов с различными формами СВ были многообразны. Основные синдромы и их частота представлены в таблице 5 .
Для диагностики структурных поражений головного мозга при СВ широко используют компьютерную и/или магнитно-резонансную томографию (МРТ) (таб. 6 ).
Среди обследованных пациентов 52 больным с различными формами системных васкулитов была выполнена МРТ головного мозга (таб. 7 ). У пациентов с СВ на фоне нарастания активности иммунопатологического процесса отмечалось увеличение количества кортикальных и перивентрикулярных очагов, которые чаще были «свежими».
При ангиографическом исследовании церебральных сосудов у пациентов с СВ наблюдаются множественные сегментарные неровности сосудистой стенки, локальные или диффузные, частичные или полные, циркулярные или эксцентричные стенозы и дилатации мелких и средних интракраниальных артерий с возможным формированием аневризм с выраженным или умеренным нарушением кровотока.
При морфологическом исследовании определяются локальные, сегментарные, некротизирующие или гранулематозные ангииты лептоменингеальных или паренхиматозных мелких сосудов, обычно чередующиеся, а также признаки острого, подострого и «отзвучавшего» процесса с фиброзом интимы. Гистологически при изолированном ангиите ЦНС может быть гранулематозное с наличием гигантских клеток, некротизирующее, лимфоцитарное или смешанное воспаление с развитием множественных церебральных инфарктов.
Лечение первичных церебральных васкулитов, подтвержденных данными ангиографии, предполагает использование иммуносупрессивной терапии и назначение нейропротективных, вазоактивных, дезагрегационных и других препаратов в зависмости от клинических проявлений.
* Труды І Национального конгресса «Кардионеврология», Москва, 2008.
Cписок литературы находится в редакции.
Васкулит
Васкулит (vasculitis; латинское Vasculum небольшой сосуд + -itis; синонимы ангиит) — воспаление стенок кровеносных сосудов различной этиологии. «Васкулит» — групповой термин и без соответствующей клинико-морфологической и (или) этиологической характеристики не может употребляться в качестве нозологического диагноза; к Васкулит не следует относить поражения сосудов не воспалительной или неясной природы — артериопатии, например фибро-мышечную дисплазию почечных артерий.
В зависимости от рода и калибра поражаемых сосудов выделяют следующие виды Васкулит: артерииты, артериолиты, капилляриты, флебиты; часто в патологический процесс одновременно или последовательно вовлекаются сосуды нескольких видов, разного калибра (в этих случаях говорят о генерализованных или системных Васкулит, в отличие от регионарных или сегментарных Васкулит, возникающих в виде ограниченного местного процесса в той или иной области сосудистой системы, иногда лишь в отдельных органах или тканях).
В соответствии с преимущественной локализацией воспалительных изменений во внутреннем, среднем или наружном (адвентиции) слое сосудистой стенки различают эндо-, мезо- и периваскулиты (если поражаются только артерии — соответственно эндо-, мезо- и периартерииты); поражение всех слоёв сосудистой стенки обозначают термином «панваскулит» (при изолированном поражении артерий—«панартериит»).
По происхождению Васкулит могут быть: а) первичными, при которых системное поражение сосудов является первичным самостоятельным заболеванием; б) вторичными, возникающими на почве какого-либо инфекционного, инфекционно-аллергического, токсико-аллергического, обменно-эндокринного или опухолевого заболевания и являющимися одним из компонентов (иногда весьма важным) этого заболевания.
Этиология.
Вторичные Васкулит этиологически связаны с основным заболеванием, на почве которого они возникают. Обычно это либо инфекционные заболевания (сыпной тиф, скарлатина, острые и подострые формы сепсиса, включая затяжной септический эндокардит), либо системные болезни соединительной ткани (ревматизм, ревматоидный артрит, системная красная волчанка, системная склеродермия, дерматомиозит), либо токсико-аллергические заболевания и состояния (наследственные аллергопатии, лекарственная непереносимость), либо обменно-эндокринные заболевания (диабетическая микроангиопатия).
Этиология первичных Васкулит в большинстве случаев остается неизвестной и рассматривается лишь в предположительном плане. В качестве возможных причинных факторов обсуждаются: а) острые и хронический инфекции, особенно хронический очаговая инфекция, в частности стрептококковая; б) воздействие химических и биологических агентов, в том числе лекарственных средств (пенициллина и других антибиотиков, сульфаниламидов, барбитуратов, производных пиразол она, ртутных мочегонных, йодистых препаратов, оральных контрацептивных средств, синтетических аналогов некоторых витаминов, ферментов, гормонов, препаратов витаминов В1 В2, В6, кокарбоксилазы, АКТГ, кортикостероидов), сывороток, вакцин, продуктов жизнедеятельности грибковой флоры; в) влияние физических факторов — охлаждения, ожогов, инсоляции, ионизирующей радиации, физических травмы; г) вегетативно-нейротрофические расстройства и эндокринные нарушения, в частности нарушение функций гипоталамо-гипофизарно-надпочечниковой системы в сочетании с физических или химических воздействиями; д) генетические факторы (например, артерииты мелких ветвей лёгочной артерии при врождённой первичной лёгочной гипертензии).
Многие из перечисленных факторов чаще выступают не в качестве вызывающей Васкулит причины, а скорее играют роль предрасполагающих, провоцирующих или выявляющих моментов.
Патогенез.
Наиболее аргументированной и пользующейся широким признанием является аллергическая концепция происхождения системных Васкулит, согласно которой морфологическая и клиническая картина заболевания обусловливается не действием какого-либо определённого и тем более специфического агента, а является выражением системной гиперергической реакции на самые разнообразные воздействия (смотри Аллергия).
Аллергическая теория патогенеза системных Васкулит имеет солидную экспериментальную базу. Клинические наблюдения также подтверждают аллергический (гиперсенситивный) генез некоторых форм системных сосудистых заболеваний (например, Васкулит, возникающих в связи с лекарственной непереносимостью, применением вакцин, сывороток). Большое значение в механизме развития системных Васкулит придаётся аутоиммунным нарушениям; при этом основываются на установленной рядом авторов возможности образования аутоантител (смотри) к клеточным и тканевым субстанциям сосудистой стенки [Штеффен (С. Steffen), 1955; Бернар (I. Bernard), 1957].
Методом иммунофлюоресценции показано отложение гамма-глобулинов, флюоресцирующих антител и иммунных комплексов в стенке сосудов при узелковом периартериите. В сыворотке больных артериитом выявлено присутствие антигамма-глобулинов. В развитии узелкового периартериита придают значение вирусным комплексам; указывается, например, на роль австралийского антигена и антител к нему (смотри Австралийский антиген). Ряд авторов, используя методику поглощения антиглобулина, обнаружил при геморрагическом Васкулит антитела к сосудистому эндотелию [Стефанини, Медников (М. Stefanini, J. Mednicoff), 1954; Паронетто, Штраусе (F. Paronetto, L. Strauss), 1962]. В свете приведённых концепций о генезе системных Васкулит патогенные агенты (бактерии, вирусы, эндо- и экзогенные токсины, патологические метаболиты, физ. и хим. воздействия) рассматриваются не как специфическая причина заболевания, а лишь как факторы, способные изменять антигенную структуру тканевых элементов сосудистой стенки, приобретающих свойства аутоантигенов и стимулирующих продукцию аутоантител. Образующиеся в результате аутоиммунных процессов иммунные комплексы (антиген — антитело — комплемент) фиксируются на элементах сосудистой стенки (мембраны, эндотелий, мышечные клетки), вызывая повреждение мембран, активацию лизосомальных ферментов, повышение проницаемости сосудов и другие.
Из других теорий патогенеза системных Васкулит заслуживают внимания неврогенная и эндокринная, опирающиеся не столько на твёрдые экспериментальные данные, сколько на клинически выявляемую связь между нейровегетативными и эндокринными нарушениями и развитием некоторых сосудистых заболеваний. Классическим примером нейровегетативных и нейротрофических сосудистых нарушений является синдром Рейно (смотри Рейно болезнь), нередко выступающий в качестве одного из первых проявлений первичных или вторичных (при коллагенозах) Васкулит. Роль эндокринных расстройств в патогенезе Васкулит демонстрируется в экспериментах Селье (Н. Selye) и его сотр. вызывавших изменения сосудов типа узелкового периартериита или облитерирующего тромбангиита у животных после нефрэктомии при даче им больших доз кортикостероидов на фоне диеты, богатой солью, или же при введении животным экстрактов передней доли гипофиза или соматогенного гормона, стимулирующего синтез минералокортикоидов надпочечниками; действие указанных гормонов усиливалось, если введение их сочеталось со стрессовыми воздействиями (холод, травма, перегревание, введение чужеродного белка). Участие эндокринного фактора в патогенезе некоторых форм Васкулит можно предполагать и на основании половых различий в частоте отдельных форм Васкулит: явное преобладание женщин среди лиц, страдающих болезнью Такаясу, и более частое развитие облитерирующего тромбангиита у мужчин, часто молодых, пубертатного возраста (ювенильная форма).
Патологическая анатомия.
В морфогенезе и гистологической картине поражения сосудов при разнообразных формах Васкулит имеются некоторые общие черты, по-видимому обусловленные близостью их патогенеза. При многих Васкулит в сосудистой стенке можно обнаружить альтеративные (дистрофические и некротические), экссудативные, пролиферативные и репаративно-склеротические процессы, степень выраженности которых зависит от общей и иммунологической реактивности организма больного, особенностей этиологического фактора, тяжести и стадии болезни. В ранних стадиях обычно преобладают альтеративно-экссудативные явления — отёк, фибринозная экссудация, мукоидное набухание и фибриноидные изменения основного вещества и волокнистых структур сосудистых стенок (смотри Слизистая дистрофия, Фибриноидное превращение), наиболее выраженные в средней оболочке. По мере развития процесса воспалительные изменения захватывают все слои сосудистой стенки, обнаруживается фибриноидный некроз средней оболочки и интимы, деструкция внутренней эластической мембраны; нарастает инфильтрация стенки сосудов лимфоидными, эпителиоидными, плазматическими клетками, нейтрофильными и эозинофильными лейкоцитами (клеточный состав инфильтратов в значительной степени зависит от патогенетической основы Васкулит). Распространение воспалительного процесса на интиму часто сопровождается тромбообразованием в просвете сосуда. В дальнейшем начинают преобладать пролиферативно-репаративные процессы, развивается грануляционная ткань, пронизываемая лимфоидными и гистиоцитарными клеточными элементами. В завершающей стадии происходит замена грануляционной ткани фиброзной соединительной тканью, наступает склероз сосудистой стенки с сужением или облитерацией просвета сосуда. При благоприятно текущих формах Васкулит наблюдается меньшая выраженность вышеописанных процессов и может наступить полное восстановление нормальной структуры сосудистых стенок. Важно отметить, что степень и последовательность изменений в разных областях сосудистой системы неодинаковы: в то время как в сосудах одной области (органа) могут выявляться ранние изменения, в других обнаруживается выраженный воспалительный процесс, в третьих находят репаративные явления в разных фазах развития. Все это создаёт многообразие и пестроту морфологической картины Васкулит. Кроме того, несмотря на некоторое сходство морфологических изменений, каждой клинико-патогенетической и этиологической форме Васкулит свойственны свои топографические, анатомические и гистоморфологические особенности. Так, для узелкового периартериита характерно распространённое поражение средних и малых артерий мышечного типа с вовлечением всех слоёв сосудистой стенки (панартериит), но с преимущественными изменениями средней и наружной (адвентиции) оболочек сосуда, причём наиболее типичным является деструктивно-пролиферативный процесс в стенке сосудов с сегментарными некрозами и развитием мелких аневризм, а также образование периваскулярных (видимых невооружённым глазом) узелков; наиболее часто вовлекаются висцеральные сосуды (почек, сердца, органов брюшной полости, лёгких). При облитерирующем брахио-цефальном артериите — болезни Такаясу — поражаются крупные артерии мышечно-эластического типа, отходящие от дуги аорты или её грудного и абдоминального отделок,— безымянная, общие и внутренние сонные, подключичные, реже межрёберные, почечные, подвздошные артерии; гистологически преобладает воспалительно-инфильтративный процесс во всех слоях сосудистой стенки, но преимущественно в интиме, с гигантоклеточным гранулематозом и тромбозом. При болезни Хортона — гигантоклеточном артериите — в патологически и процесс вовлекаются артерии среднего калибра — поверхностные височные, затылочные, внутричерепные, реже и висцеральные, причём наиболее характерными морфологическими изменениями являются гранулематоз средней оболочки и наличие гигантских клеток в гранулемах. При облитерирующем тромбангиите — болезни Винивартера — Бюргера — патологические изменения обнаруживаются преимущественно в периферических артериях мышечного типа, реже и в венах; в стенках сосудов, преимущественно в интиме, развивается ин фильтративно-пролиферативный процесс со склонностью к тромбообразованию и облитерации просвета сосуда; сравнительно редко поражаются сосуды внутренних органов. При геморрагическом васкулите — болезни Шенлейна — Геноха — в патологический процесс вовлекаются главным образом капилляры (отсюда устаревшее название болезни «геморрагический капилляротоксикоз»), артериолы, венулы, реже мелкие артерии, при этом отмечается резкое нарушение проницаемости сосудистых мембран, набухание и пролиферация эндотелия сосуда, инфильтрация сосудистых стенок лейкоцитами; реже обнаруживаются фибриноидные изме¬нения стенок мелких артерий.
Классификация васкулитов. Единой общепринятой классификации Васкулит нет, что отчасти можно объяснить отсутствием единых представлений об их сущности и трудностями их клинико-морфологической дифференциации. В классификациях, предлагаемых советскими авторами (Н. А. Куршаков, Е. М. Тареев, М. И. Теодори), в качестве главных форм системных Васкулит выделяются узелковый периартериит (смотри Периартериит узелковый), облитерирующий тромбангиит (смотри Тромбангиит облитерирующий), геморрагический Васкулит (смотри Шенлейна — Геноха болезнь), облитерирующий брахиоцефальный артериит (смотри Такаясу синдром); к более редким формам относят височный артериит (смотри Артериит гигантоклеточный), тромботическую тромбоцитопеническую пурпуру (смотри Мошкович болезнь). Особое место среди системных Васкулит занимает генерализованное поражение мелких артерий по типу некротизирующего артериита, сочетающееся с некротически-гранулематозным поражением верхних дыхательных путей, лёгких, костей лицевого черепа, ретробульбарных тканей глаз, описанное Вегенером и носящее его имя — гранулематоз Вегенера (смотри Вегенера гранулематоз). Многие авторы объединяют эту форму заболевания с узелковым периартериитом, хотя достаточно убедительных оснований для такого объединения ни с морфологической, ни с клинической точки зрения нет.
Из вторичных Васкулит наибольшее практическое значение имеют генерализованные поражения сосудов при сыпном тифе, скарлатине, затяжном септическом эндокардите, ревматизме, ревматоидном артрите, системной красной волчанке, системной склеродермии, а также изменения мелких сосудов при сахарном диабете — диабетическая микроангиопатия.
Клиническая картина. Несмотря на клинико-морфологическое разнообразие отдельных форм системных Васкулит, всем им свойственны некоторые общие клинические проявления и симптомы: лихорадка (нередко волнообразная, совпадающая со вспышкой свежих сосудистых поражений), кожно-геморрагический и мышечно-суставной синдромы, нередкое вовлечение в патологический процесс периферической нервной системы (моно- и полиневриты), нарастающее истощение, многоорганность висцеральных поражений: сердце — с коронарно-ишемическим синдромом или симптомами миокардита, почки — с гипертоническим синдромом и клиникой нефрита или инфарктов почек, желудочно-кишечного тракт, печень, поджелудочная железа, селезёнка — с абдоминальным и (или) гепато-лиенальным синдромами, бронхолёгочная система — с бронхоспастическим или лёгочно-плевральным синдромом, поражение серозных оболочек с явлениями полисерозита.
Течение в большинстве случаев прогрессирующее или рецидивирующее. Более подробно клинику отдельных форм Васкулит — смотри в соответствующих статьях и в таблица 1 и 2.
Диагностика и лечение поражений нервной системы при ревматических заболеваниях
РЕКЛАМА
Ревматические болезни относятся к группе заболеваний, которые характеризуются развитием аутоиммунных процессов против антигенов почти всех органов и тканей организма, что сочетается с образованием аутоантител с органонеспецифическими свойствами.
Аутоиммунные процессы осуществляют информационный обмен между нейроэндокринной и иммунной системами, при этом главную роль играют аутоантитела к гормонам, медиаторам и их рецепторам. Продемонстрирован синтез нейропептидов в иммунокомпетентных клетках, а в клетках нейроэндокринной системы доказана возможность синтеза лимфокинов и монокинов.
Получены данные о нейрогенной регуляции функций иммунитета и их нарушений, в то же время иммунокомпетентные клетки и их медиаторы могут влиять на функцию центральной нервной системы (ЦНС) по принципу нейроиммуномодуляции. Показано, что свойством нейросекреции обладает вся центральная и периферическая нервная система. Влияние иммунной и нервной систем друг на друга реализуется через рецепторные структуры клеток, взаимодействие которых создает связи «рецептор-рецептор» и таким образом организует молекулярный механизм совместной работы обеих систем.
Функционирование клеток и сигнальная информация обеспечиваются медиаторами и нейротрансмиттерами в обеих системах, между нервной и иммунной системой происходит взаимообмен информацией с помощью цитокинов, стероидов и нейропептидов [1, 2].
Таким образом, доказана общность и взаимосвязь нервной и иммунной систем, сходство между их структурами и функциями и развитие нового направления современной иммунологии — нейроиммунологии [3, 4]. Широкий диапазон неврологических синдромов при аутоиммунных системных заболеваниях позволяет рассматривать их как модельные системы для изучения патогенетической роли иммунных механизмов поражения центральной и периферической нервной системы [5].
Потенциальными мишенями для аутоиммунной агрессии могут быть различные антигены нервной ткани, включая миелин, в том числе ассоциированный с гликопротеином, и его основной белок, ганглиозиды, белок ядер нейрональных клеток и другие [6]. Так, мишеневидные антигены при нейролюпусе представлены антигенами нейрональной ткани, рибосомальным Р-белком, рДНК, малым ядерным рибонуклеопротеидом, а также анионными фосфолипидами при антифосфолипидном синдроме, что обуславливает широкий спектр неврологической симптоматики при данной патологии [7, 8].
По данным различных авторов, частота поражений нервной системы при ревматических заболеваниях (РЗ) колеблется от 40% до 70% и выше, если учитывать психические синдромы и головную боль. Неврологические синдромы включены в классификационные критерии системных васкулитов, опубликованные Американской коллегией ревматологии в 1990 году, в диагностические критерии и критерии активности системной красной волчанки (СКВ), а также в ряд других диагностических критериев, в частности узелкового полиартериита у детей. Неврологические нарушения при РЗ требуют проведения дифференциальной диагностики и назначения адекватного лечения совместно ревматологом и неврологом.
При СКВ в диагностические критерии неврологических поражений включены судороги или психозы. Поражение ЦНС обусловлено в основном сосудистой патологией, к которой относят васкулопатию, тромбозы, истинные васкулиты, инфаркты и геморрагии [7]. В цереброспинальной жидкости обнаруживаются антинейрональные антитела, определяется повышение уровня белка, увеличение клеточного состава. Описаны разные виды судорожных припадков: большие, малые, по типу височной эпилепсии, а также гиперкинезы. При ЦНС-люпусе имеет место головная боль типа мигрени, устойчивая к анальгетикам, но отвечающая на лечение глюкокортикостероидами. Параличи черепных нервов обычно сопровождаются офтальмоплегией, мозжечковыми и пирамидными симптомами и нистагмом. Имеют место зрительные нарушения, преходящие нарушения мозгового кровообращения. Острый поперечный миелит встречается редко и имеет неблагоприятный прогноз. Психические синдромы разнообразны и характеризуются аффективными, органическими мозговыми или шизофреноподобными проявлениями [9, 10].
В рамках СКВ был описан и антифосфолипидный синдром. Этот синдром включает: рецидивирующие артериальные или венозные тромбозы, привычное невынашивание беременности и тромбоцитопению и дополнительные признаки: сетчатое ливедо, неврологические проявления: хорею, эпилепсию, мигренеподобную головную боль, нарушения мозгового кровообращения и деменцию вследствие множественных инфарктов, хронические язвы голеней, Кумбс-положительную гемолитическую анемию, клапанные поражения сердца и серологические маркеры — антифосфолипидные антитела, к которым относятся антикардиолипиновые антитела IgG и IgM и волчаночный антикоагулянт [11].
При системной склеродермии (ССД) неврологический синдром представлен в основном полиневритическими проявлениями, связанными с сосудистыми изменениями и фиброзными процессами в соединительной ткани. Для узелкового полиартериита характерны множественные мононевриты, для гранулематоза Вегенера — асимметричная полинейропатия, для неспецифического аортоартериита — дисциркуляторная энцефалопатия и нарушения мозгового кровообращения.
Собственные данные включали обследование 229 больных различными формами РЗ, среди которых 110 больных страдали системными заболеваниями соединительной ткани: 88 больных СКВ, 22 — ССД и 119 больных — системными васкулитами: облитерирующий тромбангиит (ОТ) — 21, узелковый полиартериит (УП) — 27, неспецифический аортоартериит — (НАА) — 32, геморрагический васкулит (ГВ) — 15 и гранулематоз Вегенера (ГрВ) — 2, другие формы — 22. Проведено детальное неврологическое исследование, ультразвуковая транскраниальная допплерография сосудов мозга, реоэнцефалография, компьютерная (КТ) и магнитно-резонансная томография (МРТ) головного мозга, электроэнцефалография, исследование иммунного статуса.
У большинства больных заболевания дебютировали кожным (50,6%), суставно-мышечным (35,4%) и сосудистым (27,1%) синдромом. Органные поражения в дебюте регистрировались с частотой 7%, синдром артериальной гипертензии — у 5,2%, лихорадка — у 7,0%, гематологические нарушения — 7,9%. Неврологические расстройства в дебюте заболевания отмечены у 12,2% и проявлялись моно- и полиневропатией и синдромом энцефаломиелополирадикулоневрита (ЭМПРН). Поражение периферической нервной системы в дебюте заболевания было особенно характерно для УП и наблюдалось у 30% больных. Основными синдромами дебюта со стороны ЦНС был цефалгический (10,5%) и вестибулярный (6,3%), чаще они наблюдались при НАА. Вовлечение ЦНС имело место у 96 (41,9%) больных, являясь наиболее выраженным при СКВ, НАА, УП.
Цереброваскулярная патология была доминирующей в клинической картине болезни у 34,7% больных, а иногда разнообразные симптомы поражения ЦНС развивались задолго до появления полисиндромной картины заболевания. Основные клинические проявления цереброваскулярной патологии включали: цефалгический (82%), астенический (76%), вестибулярно-атактический (80%), пирамидный (74%) синдромы, синдром вегетативно-сосудистой недостаточности (69%), диссомнический (79%) и базально-оболочечный (37%), гипопоталамической дисфункции (34,7%).
Описанная неврологическая симптоматика часто сочеталась с симптомами сосудистой недостаточности головного мозга, которые объединялись синдромом дисциркуляторной энцефалопатии 1 (11%), 2 (26,4%) или 3 (8%) степени. У 7,8% больных имели место преходящие нарушения мозгового кровообращения.
Гипоталамическая дисфункция у больных РЗ проявлялась полиморфными нейроэндокринными расстройствами, нарушением терморегуляции, преимущественно по типу пароксизмальной центральной гипертермии, инсомнией, патологией психоэмоциональной сферы.
Установлено достоверное преобладание у больных пирамидной недостаточности слева (41%). Преобладание пирамидной недостаточности справа регистрировалось реже (23,7%). Дистонические феномены в форме вестибулярно-мозжечковой установки кисти и диссоциированная мышечная гипотония в ногах также были более выражены слева. Полученные данные свидетельствуют о преобладающем поражении пирамидной и сенсорной систем, а также неспецифических структур правого полушария, которое тесно связано с гипоталамической областью и обеспечивает адаптацию организма к воздействующим факторам внешней среды. Обнаруженная функциональная асимметрия свидетельствует о срыве адаптационных механизмов нервной системы и указывает на роль дисфункции правополушарно-гипоталамической системы.
При использовании методов МРТ и/или КТ было выявлено изменение желудочковой системы в виде ее расширения или деформации и/или расширения субарахноидального пространства, а также очаговые поражения различных структур головного мозга, атрофия вещества мозга и краниовертебральные аномалии. Признаки наружной, внутренней или сочетанной гидроцефалии отмечались при всех нозологических формах. Очаговые изменения вещества мозга включали гиперденситивные зоны, гиподенситивные зоны с отеком или без него, единичные или множественные.
При исследовании сосудистой системы и мозгового кровообращения достоверно наблюдалось повышение тонуса сосудов, гипертонический и дисциркуляторный тип кровообращения по данным реоэнцефалографии (РЭГ) и увеличение линейной скорости кровотока по средней мозговой артерии. Больные с вовлечением ЦНС отличались по электроэнцефалографии: им были свойственны диффузные патологические изменения, наличие дезорганизации альфа-ритма, дизритмий и пароксизмальной активности.
Корреляционный анализ цереброваскулярной патологии и результатов инструментальных исследований сосудов головного мозга показал, что при всех нозологических формах у пациентов имело место нарушение венозной гемоциркуляции. В последующем происходило сужение церебральных артерий, ликвородинамические нарушения с формированием внутричерепной гипертензии, нарушением системы микроциркуляции в головном мозге. Очаговые поражения головного мозга отличались локализацией процесса в зависимости от нозологической формы. В табл. представлены основные неврологические проявления РЗ.
У 39% больных СКВ молодого возраста с поражением ЦНС имели место нарушения мозгового кровообращения, причем у половины из них инсульт развился в начале заболевания. Одновременно с инсультом в дебюте СКВ у больных чаще выявлялась «сосудистая бабочка» и/или вазоспастический синдром, повышение артериального давления, чаще диастолического. У этих больных отмечались умеренные или высокие титры кардиолипинов IgG, антител к нативной ДНК и ревматоидного фактора (РФ) IgM, что могло свидетельствовать о наличии текущего церебрального васкулита. Эти данные подтверждались выявлением гипертонуса резистивных интракраниальных сосудов и патологией микроциркуляторного русла в виде увеличения количества функционирующих капилляров, их выраженной извитостью с замедлением кровотока в артериолах. Изменения в свертывающей системе характеризовались синдромом гиперкоагуляции. Выявлены основные факторы риска развития инсульта у больных РЗ: артериальная гипертензия, поражения сердца, гиперкоагуляция, иммунное воспаление сосудистой стенки, асимметрия мозгового кровотока.
Среди больных РЗ цереброваскулиты (ЦВ) имели место у 28,3% больных. Диагноз ЦВ ставился при обнаружении очаговой неврологической симптоматики, изменений на глазном дне, снижения зрения, наличии признаков нарушения мозгового кровообращения, а также по результатам КТ и ядерно-магнитно-резонансной томографии (ЯМРТ), при которых выявлялись наружная и внутренняя гидроцефалия, очаговые изменения в коре и субкортикальном веществе. При этом с течением времени число очагов любой локализации в головном мозге нарастало. При магнитно-резонансном ангиографическом (МРА) исследовании отмечались множественные сегментарные неровности сосудистой стенки, циркулярные или эксцентричные стенозы и дилятация мелких и средних интракраниальных артерий с формированием аневризм, нарушения кровотока. Выявленное снижение интенсивности МРА-сигнала на фоне повышения активности ревматического процесса свидетельствовало о наличии ЦВ.
Иммунологическими маркерами ЦВ считали антитела к нативной ДНК, IgG-антитела к кардиолипину (аКЛ) и IgM аКЛ, антинейтрофильные цитоплазматические антитела (АНЦА), в меньшей степени — РФ и волчаночный антикоагулянт (ВА). Имели место клинико-иммунологические корреляции с неврологическими проявлениями.
Изолированный (первичный) ЦВ характеризовался обнаружением симптомов вовлечения ЦНС и такими признаками, как головная боль, судороги, менингеальный синдром, острая прогрессирующая энцефалопатия без признаков экстракраниального или системного васкулита, психические синдромы, деменция, прогрессирующее снижение интеллекта, инсульты, нарушения зрения, нистагм. Чаще перивентрикулярные очаги выявлялись в первый год заболевания.
Ряд больных обращались на консультацию к окулисту в связи с ухудшением зрения, вплоть до амавроза, наличием увеита, ишемического неврита. Ангиопатия сетчатки имела место у 41% этих больных, флебопатия — у 14%, ретиноваскулит — у 6%, ангиоспазм — у 13%, ангиосклероз — у 18%.
Полиневритический синдром встречался у подавляющего большинства больных (96,7%) в виде сенсорной, чувствительно-двигательной полиневропатии или в сочетании с поражениями ЦНС, с синдромом ЭПН и ЭМПРН. При ССД, ОТ и ГВ преобладали формы в виде чувствительной или чувствительно-двигательной полиневропатии, а при СКВ и НАА — формы с сочетанным поражением периферической НС (ПНС) и ЦНС — синдромы ЭПН и ЭМПРН. При ОТ и НАА отмечалась отчетливая диссоциация степени выраженности полиневропатии по оси тела, причем при ОТ симптоматика была более отчетливой в ногах, при НАА — в руках. В целом асимметричная полиневропатия имела место у 19,2% больных, достигая максимума при УП (59,3%).
Патология НС при РЗ нередко определяет прогноз, клиническую картину заболевания и качество жизни больных, а также требует обязательного сочетанного применения базисной противовоспалительной терапии, ангио- и нейропротекторов. К группе нейропротекторов относят Актовегин, Инстенон. Используются препараты, улучшающие мозговое кровообращение, — Винпоцетин, Кавинтон, метаболические средства с антигипоксантным действием — Ноотропил, Пирацетам, Церебролизин, по показаниям седативные и противосудорожные средства, антидепрессанты.
При РЗ терапия включает глюкокортикостероиды, иммуносупрессанты, иммуноглобулин, плазмаферез, иммуномодуляторы, дезагреганты, нестероидные противовоспалительные препараты и симптоматические средства.
Лечение состоит из нескольких этапов: быстрое подавление иммунного ответа в дебюте заболевания и при его обострениях (индукция ремиссии); длительная поддерживающая терапия иммуносупрессантами, в дозах, достаточных для достижения клинической и лабораторной ремиссии заболевания; определение степени повреждения органов или систем организма и их коррекция, проведение последующих реабилитационных мероприятий.
Первый этап включает эффективное подавление иммунного воспаления на ранних стадиях болезни и предполагает использование глюкокортикостероидов, иммуносупрессантов цитостатического действия типа Циклофосфана и антиметаболитного действия типа Метотрексата, цитокинсупрессивного препарата Циклоспорина А, внутривенного иммуноглобулина, назначение повторных курсов пульс-терапии метилпреднизолоном и Циклофосфаном, в сочетании с экстракорпоральными методами лечения.
При острых церебральных нарушениях при высокой активности СКВ используется схема пульс-терапии с введением Метипреда 1 г внутривенно 1 раз в день в течение 3 дней и с добавлением 800 мг Циклофосфана во 2-й день. При хроническом течении СКВ суточная доза преднизолона составляла 15–20 мг с последующим постепенным снижением, Циклофосфан применяется внутримышечно в дозе 400 мг в неделю до 1600–2000 мг на курс, затем по 200 мг в неделю в течение года и более. Апробируются препараты мофетила микофенолат и лефлуномид.
При патологии органа зрения назначают нестероидные противовоспалительные препараты в виде инъекций диклофенака, а затем пероральные препараты этой группы, дезагреганты, при наличии признаков воспалительной активности добавляют умеренные дозы глюкокортикостероидов, а при резком снижении зрения и выраженных признаках активности используют пульс-терапию.
Проводится определение наиболее эффективных и менее токсичных схем применения иммуносупрессивных препаратов, путей их введения, и включение в комплексное лечение больных препаратов, улучшающих микроциркуляцию и/или влияющих на реологические свойства крови (Гепарин, Фраксипарин, Трентал, Ралофект, Тиклид).
В ряде случаев назначают препараты типа Реаферона, а при наличии инфицированных язв, некрозов кожи или конечностей применяют антибиотики. Ввиду многообразия нозологических форм на выбор лекарственных средств в дебюте заболевания оказывает влияние распространенность патологического процесса и наличие интеркуррентной инфекции. Показано назначение ангиопротекторов и посиндромная терапия.
Учитывая высокий удельный вес неврологической патологии, больные РЗ должны проходить комплексное клинико-инструментальное неврологическое исследование уже на ранней стадии патологического процесса. Постановка диагноза РЗ и комплексная терапия глюкокортикостероидами и иммуносупрессантами способствуют коррекции нарушений ЦНС и ПНС.
Марова Е. И. (ред.). Нейроэндокринология. Ярославль: Диа-пресс; 1999.
Stenberg E. M. Neuroendocrine regulation of autoimmune / inflammatory diseases // J. Endocrinol. 2001; 169 (3): 429–435.
Насонова В. А. Иванова М. М. Калашникова Е. А. и др. Актуальные проблемы нейроиммунологии // Вестн. РАМН. 1994;1: 4–7.