Лабораторная диагностика острого инфаркта миокарда
Лабораторное подтверждение острого инфаркта миокарда основано на выявлении.
• неспецифических показателей тканевого некроза и воспалительной реакции миокарда
• гиперферментемии (входит в классическую триаду признаков острого инфаркта миокарда: болевой синдром; типичные изменения ЭКГ; гиперферментемия)
НЕСПЕЦИФИЧЕСКИЕ ПОКАЗАТЕЛИ ТКАНЕВОГО НЕКРОЗА И ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ МИОКАРДА
Неспецифическая реакция организма на возникновение острого инфаркта миокарда связана прежде всего с.
•распадом мышечных волокон
•всасыванием продуктов расщепления белков в кровь
•местным асептическим воспалением сердечной мышцы, развивающимся преимущественно в периинфарктной зоне
Основными клинико-лабораторными признаками, отражающими эти процессы, являются (выраженность всех приведенных лабораторных признаков инфаркта миокарда прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать).
• повышение температуры тела от субфебрильных цифр до 38,5–39°С (выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели)
• лейкоцитоз. не превышающий обычно 12–15 х 109/л (выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели)
• анэозинофилия
• небольшой палочкоядерный сдвиг формулы крови влево
• увеличение СОЭ (увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2-3 недель и дольше даже при отсутствии осложнений инфаркта миокарда)
Правильная трактовка этих показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
. длительное сохранение — более 1 недели — лейкоцитоза или/и умеренной лихорадки у больных острым инфарктом миокарда свидетельствует о возможном развитии осложнений: пневмония, плеврит, перикардит, тромбоэмболия мелких ветвей легочной артерии и др.
ГИПЕРФЕРМЕНТЕМИИЯ
Основной причиной повышения активности и содержания ферментов в сыворотке крови у больных острым инфарктом миокарда является разрушение кардиомиоцитов и выход высвобождающихся клеточных ферментов в кровь.
Наиболее ценным для диагностики острого инфаркта миокарда является определение активности нескольких ферментов в сыворотке крови.
• креатинфосфокиназы (КФК) и особенно ее МВ-фракции (МВ-КФК)
• лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1)
• аспартатаминотранферазы (АсАТ)
• тропонина
• миоглобина
креатинфосфокиназа (КФК) (лабораторная норма 10—110 ME; в единицах Си: 0,60—66 ммоль неорганического фосфора/(ч•л); изоферменты КФК-MB 4—6 % общей КФК)
Специфичным лабораторным тестом острого инфаркта миокарда является определение МВ-фракции КФК (МВ-КФК).
КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром инфаркте миокарда, но и при целом ряде других клинических ситуаций: при внутримышечных инъекциях; при тяжелой физической нагрузке; после любого хирургического вмешательства; у больных мышечной дистрофией, полимиозитом, миопатией; при повреждениях скелетных мышц, при травмах, судорожном синдроме, длительной иммобилизации; при инсультах и других повреждениях ткани головного мозга; при гипотиреозе; при пароксизмальных тахиаритмиях; при миокардите; при тромбоэмболии легочной артерии; после проведения коронароангиографии; после электроимпульсной терапии (кардиоверсии) и т. д.
Повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для острого инфаркта миокарда. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы.
. следует помнить — любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК; в литературе имеются также указания на возможность повышения уровня МВ-КФК при тяжелой пароксизмальной тахиаритмии, миокардитах и длительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии
Динамика МВ-КФК при остром инфаркте миокарда :
•через 3–4 часа ее активность начинает возрастать
•через 10–12 часов достигает максимума
•через 48 часов от начала ангинозного приступа возвращается к исходным цифрам
Степень повышения активности МВ-КФК в крови в целом хорошо коррелирует с размером инфаркта миокарда — чем больше объем поражения сердечной мышцы, тем выше активность МВ-КФК.
Динамика КФК при остром инфаркте миокарда.
•к концу первых суток уровень фермента в 3–20 раз превышает норму
•через 3–4 суток от начала заболевания возвращается к исходным значениям
. следует помнить — в ряде случаев при обширных инфарктах миокарда вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активности МВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой «концентрация-время» остается одинаковой
лактатдегидрогеназа (ЛДГ) (лабораторная норма — оптический тест до 460 ME (37°) или до 7668 нмоль/(с.л); по реакции с 2,4-динитрофенилгидразином (метод Севела — Товарека) при 37° в норме составляет 220—1100 нмоль/(с.л), или 0.8—4,0 мкмоль/(ч.мл); относительное содержание изоферментов ЛДГ устанавливают методом электрофоретического разделения фермента на пленках из ацетата целлюлозы при рН 8,6; окраску производят формазаном. Изофермент ЛДГ1 обладает наибольшей электрофоретической подвижностью)
Активность ЛДГ при остром инфаркте миокарда нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной.
Динамика ЛДГ при остром инфаркте миокарда.
•через 2–3 суток от начала инфаркта наступает пик активности
•к 8–14 суткам возвращение к исходному уровню
. следует помнить — активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, тромбоэмболии легочной артерии, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
Иизофермент ЛДГ1 более специфичен для поражений сердца, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
аспартатаминотранфераза (АсАТ) (лабораторная норма 8—40 ед.; в единицах СИ: 0,1—0,45 ммоль/(ч•л))
Динамика АсАТ при остром инфаркте миокарда.
•через 24–36 часа от начала инфаркта относительно быстро наступает пик повышения активности
•через 4–7 суток концентрация АсАТ возвращается к исходному уровню
Изменение активности АсАТ неспецифично для острого инфаркта миокарда: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени.
•при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца в большей степени возрастает активность АсАТ
•при инфаркте миокарда отношение АсАТ/АлАТ (коэффициент Ритиса) больше 1,33, а при заболеваниях печени отношение АсАТ/АлАТ меньше 1,33
тропонин (в норме содержание Тропонина I менее 0,07 нг/мл; в крови здоровых людей даже после чрезмерной физической нагрузки уровень тропонина Т не превышает 0,2 – 0,5 нг/мл)
Тропонин представляет собой универсальную для поперечно-полосатой мускулатуры структуру белковой природы, локализующуюся на тонких миофиламентах сократительного аппарата миокардиоцита.
Сам тропониновый комплекс состоит из трех компонентов :
•тропонина С — ответственный за связывание кальция
•тропонина Т — предназначен для связывания тропомиозина
•тропонина I — предназначен для ингибирования этих процессов выше указанных двух процессов
. тропонин Т и I существуют в специфичных для миокарда изоформах, отличающихся от изоформ скелетных мышц, чем и обусловливается их абсолютная кардиоспецифичность
Динамика тропонинов при остром инфаркте миокарда :
•спустя 4 – 5 часов после гибели кардиомиоцитов вследствие развития необратимых некротических изменений тропонин поступает в периферический кровоток и определяются в венозной крови
•в первые 12 – 24 часа от момента возникновения острого инфаркта миокарда достигается пик концентрации
Кардиальные изоформы тропонина длительно сохраняют свое присутствие в периферической крови.
•тропонин I определяется на протяжении 5 – 7 дней
•тропонин Т определяется до 14 дней
Присутствие этих изоформ тропонина в крови больного обнаруживается при помощи иммуноферментного анализа с использованием специфических антител.
. следует помнить — тропонины не являются ранними биомаркерами острого инфаркта миокарда, поэтому у рано обратившихся больных с подозрением на острый коронарный синдром при отрицательном первичном результате необходимо повторное, по прошествии 6 – 12 часов после болевого приступа, определение содержания тропонинов в периферической крови; в этой ситуации даже незначительное повышение уровня тропонинов свидетельствует о дополнительном риске для больного, поскольку доказано существование четкой корреляции уровнем возрастания тропонина в крови и размером зоны поражения миокарда
Многочисленными наблюдениями было показано, что повышенный уровень тропонина в крови больных с острым коронарным синдромом может рассматриваться как достоверный показатель наличия у пациента острого инфаркта миокарда. В то же время низкий уровень тропонина у этой категории больных свидетельствует в пользу постановки более мягкого диагноза нестабильной стенокардии.
При нормальном состоянии сердечно-сосудистой системы тропонин не должен определяться в периферическом кровотоке. Его появление – тревожный сигнал о произошедшем некротическом повреждении ткани миокарда. В таком случае патологическим будет являться любой уровень тропонина, превышающий 99 перцентиль значений, полученных для нормальных показателей контрольной группы.
Таким образом, методика лабораторного определения уровня содержания тропонина в крови обеспечивает широкий спектр уникальных возможностей.
•для точной и достоверной диагностики острого инфаркта миокарда, в частности – для установления диагноза в поздние сроки (до двух недель от начала заболевания);
•для проведения достаточно надежной дифференциальной диагностики между такими проявлениями острого коронарного синдрома, как инфаркт миокарда и нестабильная стенокардия
•для ориентировочного суждения об объеме некротических изменений миокарда и обширности инфарктной зоны
•для предварительного распределения больных по группам кардиального риска, исходя из оценки ближайшего и отдаленного прогнозов заболевания
•для установления эффективности проводимой реперфузии в остром периоде инфаркта миокарда
Лабораторно-диагностический приоритет определения тропонина в крови не умаляет значимости исследования некоторых других биомаркеров. В частности, при недоступности исследования кардиальных изоформ тропонина лучшей альтернативой этому диагностическому методу является количественное определение изофермента МВ-КФК, а при необходимости ранней лабораторной диагностики острого инфаркта миокарда может также исследоваться динамика изменений уровня миоглобина.
На заметку. для диагностики острого инфаркта миокарда довольно широко использовалось определение в крови концентрации миоглобина. Миоглобин — это белок, осуществляющий внутриклеточный транспорт кислорода. Он содержится и в миокарде, и в скелетной мускулатуре, т.е. его специфичность для диагностики острого инфаркта примерно такая же, как КФК, но ниже, чем МВ-КФК. Также, как КФК, уровень миоглобина мо¬жет повышаться в 2 — 3 раза после внутримышечных инъекций, и диагно-стически значимым обычно считают повышение в 10 и более раз. Подъем уровня миоглобина в крови начинается даже раньше, чем повышение активности КФК. Диагностически значимый уровень зачастую достигается уже через 4 часа и в подавляющем большинстве случаев наблюдается че¬рез 6 часов после болевого приступа. Однако держится высокая концентрация миоглобина в крови очень недолго — всего несколько часов. Маленькая молекулярная масса, гораздо меньшая, чем у КФК и других ферментов, позволяет миоглобину легко проходить через клубочковую мембрану, что приводит к быстрому падению его концентрации в плазме. Поэтому нормальные результаты определения уровня миоглобина в крови отнюдь не исключают острого инфаркта миокарда. Достаточно просто, особенно если не повторять анализ каждые 2 — 3 часа, пропустить пик его концентрации. В этом диагностическая ценность определения миоглобина значительно уступает измерению активности КФК. Не удалось, в отличие от КФК, выявить и взаимосвязь между степенью повышения концентрации миоглобина и размерами инфаркта миокарда. Таким образом, определение уровня миоглобина в крови по своей диагностической значимости уступает анализам, выявляющим активность КФК, а тем более МВ-КФК. Единственно, когда можно отдать предпочтение измерению кон-центрации миоглобина, это случаи поступления больных в стационар менее чем через 6 — 8 часов после начала болевого приступа. Но и этот вопрос нуждается в дальнейшем изучении. Зато уже сейчас, вероятно, можно сделать заключение о нецелесообразности измерения концентрации миоглобина в моче, так как показано, что при высокой концентрационной способности почек его концентрация в моче может быть высокой и у абсолютно здоровых людей.
______________________________________________________________________________
ПРИНЦИПЫ ФЕРМЕНТАТИВНОЙ ДИАГНОСТИКИ ОСТРОГО ИНФАРКТА МИОКАРДА
•у пациентов, поступивших в течение первых 24 часов после ангинозного приступа, производится определение активности КФК в крови — это следует делать даже в тех случаях, когда по клиническим и электрокардиографическим данным диагноз инфаркта миокарда не вызывает сомнения, так как степень повышения активности КФК информирует врача о размерах инфаркта миокарда и прогнозе
•если активность КФК находится в пределах нормы или повышена незначительно (в 2 — 3 раза), либо у пациента имеются явные признаки поражения скелетной мускулатуры или головного мозга, то для уточнения диагноза показано определение активности МВ-КФК
•нормальные величины активности КФК и МВ-КФК, полученные при однократном заборе крови в момент поступления больного в клинику, недостаточны для исключения диагноза острого инфаркта миокарда. Анализ необходимо повторить хотя бы еще 2 раза через 12 и 24 часа.
•если больной поступил более чем через 24 часа после ангинозного приступа, но меньше чем через 2 недели, и уровень КФК и МВ-КФК нормальный, то целесообразно определить активность ЛДГ в крови, а еще лучше измерить отношение активности ЛДГ1 и ЛДГ 2, АсАТ вместе с АлАТ и расчетом коэффициента Ритиса
•если ангинозные боли повторяются у больного после госпитализации, то рекомендуется измерять КФК и МВ-КФК сразу после приступа и через 12 и 24 часа
•миоглобин в крови целесообразно определять только в первые часы после болевого приступа, повышение его уровня в 10 раз и больше указывает на некроз мышечных клеток, однако нормальный уровень миоглобина отнюдь не исключает инфаркта
•определение ферментов нецелесообразно у бессимптомных больных с нормальной ЭКГ; диагноз на основании одной только гиперферментемии ставить все равно нельзя — должны быть клинические и (или) электрокардиографические признаки, указывающие на возмож¬ность инфаркта миокарда
•контроль количества лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные осложнения острого инфаркта миокарда
•исследование уровня активности КФК и МВ-КФК целесообразно проводить только в течение 1–2 суток от предположительного начала заболевания
•исследование уровня активности АсАТ целесообразно проводить только в течение 4 -7 суток от предположительного начала заболевания
•повышение активности КФК, МВ-КФК, ЛДГ, ЛДГ1, АсАТ не является строго специфичным для острого инфаркта миокарда, хотя при прочих равных условиях активность МВ-КФК отличается более высокой информативностью
•отсутствие гиперферментемии не исключает развития острого инфаркта миокарда
 Комментарии
Комментарии
Диагностика острого инфаркта миокарда
Введение
Почти 100-летний исторический опыт свидетельствует, что диагностика ОИМ нередко представляла и продолжает представлять непростую проблему для клинициста. Появление новых технологических возможностей периодически заставляет переосмысливать диагностические критерии ОИМ. Концепция «любой очаг миокардиального некроза, развившийся вследствие ишемии, должен быть обозначен как ИМ» (рекомендации комитета Европейского общества кардиологов и Американской коллегии кардиологов — 1) отражает современное состояние проблемы. Существует ли грань, за которой патоморфологическое понятие «некроз» трансформируется в клинический диагноз «ИМ»? Современные технологии позволяют выявлять мелкие (менее 1 г.) очаги некроза в миокарде и теоретически можно предположить диагностику некроза в клинике до уровня единичных клеточных структур. По-видимому, грань различий между некрозом миокардиоцитов и ИМ, как клиническим диагнозом, должна находится не в технологической, а в медицинской и социальной плоскостях, указывая на развитие у больного качественно нового состояния, ассоциирующегося с дополнительным риском, необходимостью изменений определйнных стереотипов жизни и проводимого лечения.
В течение длительного периода диагностика ОИМ основывалась на критериях, предложенных в свой время Всемирной Организацией Здравоохранения (2). Первоначально чйтко определйнные, эти критерии претерпевали в последующем изменения, приспосабливаясь к расширяющимся с течением времени диагностическим возможностям. Для установления ИМ необходимым было присутствие (в любых сочетаниях) по меньшей мере двух из трйх ниже перечисленных признаков: 1) болевого приступа, заставляющего подозревать ОИМ, 2) изменений ЭКГ с их характерной для заболевания эволюцией, 3) динамических изменений в уровне ферментов, прежде всего (в последнее время) КК-МВ.
Повышение в системном кровотоке КК-МВ, как следствие гибели миокардиоцитов, имеет место лишь при сравнительно больших ИМ (смотри Рисунок 1) и не обнаруживается при развитии мелких очагов некроза (микроинфарктов). Использование количественного определения КК-МВ — КК-МВmass (необходимо отметить, что в отечественной практике практически всегда определяют активность изофермента), увеличивая чувствительность метода, не решает проблемы диагностики микроинфарктов. Все более широкое внедрение методов определения кардиоспецифических белков — ТнТ и ТнI не только существенно повысило значение «биохимического компонента» в диагностике ОИМ, увеличило возможности индикации мелких очагов некроза, но и послужило основой для текущего пересмотра критериев диагностики заболевания. Эта концепция была сформирована на состоявшейся в 1999 г. конференции экспертов Европейского общества кардиологов и Американской коллегии кардиологов, а в 2000 году документ был опубликован и представлен для обсуждения (1).
Цель настоящего пособия заключалась в донесении до широкого круга практических врачей новых сведений и рекомендаций по диагностике ОИМ в клинической практике.
Клиническая диагностика инфаркта миокарда
Несмотря на то, что исследование высокочувствительных и специфичных биомаркйров становится основой диагностики ОИМ, не менее, а в определйнных ситуациях (например, догоспитальная диагностика ОИМ, диагностика «поздних» ИМ) и более важны два других компонента классической диагностической триады – клиника, данные ЭКГ.
Чрезвычайно велико значение адекватной клинической оценки в догоспитальной диагностике ОИМ. Именно клиника является основным ориентиром в догоспитальной диагностике ОИМ. Больные с клиническими признаками ИМ должны доставляться в лечебные учреждения, имеющие необходимые условия для оказания неотложной помощи, даже при отсутствии характерных электрокардиографических изменений.
Ежегодный риск ИМ у больных стабильной стенокардией составляет 2-4%, что в 10-20 раз превышает его частоту среди сопоставимых по возрасту лиц без стенокардии (3,4). У значительной части больных ИМ является дебютом ИБС, нередко его развитию предшествует НС. У больных НС рецидивирующие ишемические эпизоды, независимо от других факторов, повышают вероятность ИМ (5), тем не менее, нередко ИМ развивается после кратковременного периода их отсутствия.
Притом, что хорошо известны случаи безболевых форм, атипичных вариантов течения заболевания, как правило, развитие болевого приступа в области сердца является основанием для последующей диагностики ОИМ. Диагностические (коронарная ангиография) и лечебные (ангиопластика, стентирование, атерэктомия) интракоронарные вмешательства также ассоциируются с возрастающим риском ОИМ (6).
Считается, что продолжительность ишемического эпизода около 20 минут может быть достаточной для развития необратимых изменений в миокарде. В то же время хорошо известны значительные индивидуальные вариации в продолжительности боли, приводящей к гибели миокардиоцитов. При НС ИМ может формироваться после обычных по продолжительности приступов стенокардии.
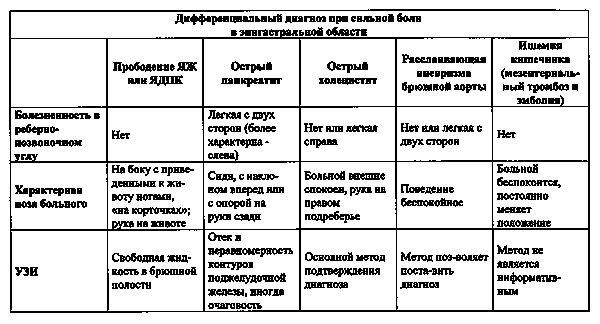
Дифференциальная диагностика болевого приступа, сопровождающегося типичными изменениями ЭКГ, чаще всего не представляет сложности. Затруднения в адекватной клинической оценке, как правило, возникают в случаях с исходно изменйнной ЭКГ (блокады ножек пучка Гиса, гипертрофия, ранее перенесенный ИМ, аневризма и т.д.), либо при заболеваниях, протекающих с инфарктоподобными изменениями ЭКГ. Перечень заболеваний (смотри Таблицу 1), чаще других требующих проведения дифференциальной диагностики, включает перикардиты, воспалительные заболевания лйгких и плевры, пневмоторакс, тромбоэмболию в легочную артерию, костно-мышечные заболевания грудной клетки, расслаивающую аневризму аорты, заболевания пищевода (разрыв, спазм, рефлюкс), пептическую язву, Herpes Zoster, иногда — психопатические состояния.
Электрокардиографическая диагностика инфаркта миокарда
Значение ЭКГ в диагностике ОИМ трудно переоценить. Это не только важнейший инструмент диагностики, но и первостепенный фактор в выборе стратегии начальной (прежде всего, реперфузионной) терапии.
Притом, что достаточно хорошо известно, что начальная ЭКГ редко бывает неизмененной при ОИМ, электрокардиографические данные достаточно условно могут быть отнесены к разряду «ранних диагностических критериев». Считается, что до 6% больных ОИМ не имеют изменений на начальной ЭКГ (7). Ранние изменения ЭКГ могут характеризоваться появлением высокоамплитудных зубцов Т. Опыт показывает, что ко времени обращения за медицинской помощью около 50% больных ИМ имеют подъем сегмента ST, либо уже сформировавшиеся патологические Q. В 40% случаев регистрируются либо смещение сегмента ST ниже изолинии, либо изменения, касающиеся только зубцов Т.
На Рисунке 2 в соответствии с рекомендациями комитета Европейского общества кардиологов и Американской коллегии кардиологов (1) дана характеристика ранних изменений ЭКГ, не исключающих развития ИМ. Следует отметить, что указанные изменения ЭКГ могут разрешаться без формирования некроза как вследствие проводимой, прежде всего реперфузионной терапии, так и спонтанно.
Диагностика острого инфаркта миокарда
Острый инфаркт миокарда диагностируется на основании 3-х основных критериев:
1. характерная клиническая картина – при инфаркте миокарда возникает сильная, часто раздирающая, боль в области сердца или за грудиной, отдающая в левую лопатку, руку, нижнюю челюсть. Боль продолжается более 30 минут, при приеме нитроглицерина полностью не проходит и лишь не надолго уменьшается.
Появляется чувство нехватки воздуха, может появиться холодный пот, резкая слабость, снижение артериального давления, тошнота, рвота, чувство страха. Длительные боли в области сердца, которые продолжаются свыше 20-30 минут и не проходят после приема нитроглицерина, могут быть признаком развития инфаркта миокарда. Обратитесь в “03”.
Информация, релевантная «Диагностика острого инфаркта миокарда»
Введение Причины инфаркта миокарда Симптомы инфаркта миокарда Формы инфаркта Факторы развития инфаркта миокарда Профилактика инфаркта миокарда Вероятность развития осложнения инфаркта миокарда Осложнения инфаркта миокарда Диагностика острого инфаркта миокарда Неотложная помощь при инфаркте миокарда Помощь до приезда «Скорой помощи» при инфаркте миокарда Реанимировать должен уметь
Одной из ключевых тем в электрокардиографии является диагностика инфаркта миокарда. Рассмотрим эту важнейшую тему в следующем порядке: 1. Электрокардиографические признаки инфаркта миокарда. 2. Локализация инфаркта. 3. Стадии инфаркта. 4. Разновидности инфарктов
По своей сути инфаркты миокарда делятся на две большие группы: крупноочаговые и мелкоочаговые. Это деление ориентировано не только на объем некротизированной мышечной массы, но и на особенности кровоснабжения миокарда. Рис. 96. Особенности кровоснабжения миокарда Питание мышцы сердца осуществляется по коронарным артериям, анатомически расположенным под эпикардом. По
Рис. 99. Интрамуральный инфаркт миокарда При этой разновидности инфаркта существенно не изменяется вектор возбуждения миокарда, излившийся из некротизированных клеток калий не достигает эндокарда или эпикарда и не формирует токов повреждения, способных отобразиться на ЭКГ ленте смещением сегмента S—Т. Следовательно, из известных нам ЭКГ признаков инфаркта миокарда остался
Приведенное выше перечисление ЭКГ признаков инфаркта миокарда позволяет уяснить принцип определения его локализации. Итак, инфаркт миокарда локализован в тех анатомических областях сердца, в отведениях от которых регистрируются 1, 2, 3 и 5-й признаки; 4-й признак играет роль
Инфаркт миокарда опасен во многом, своей непредсказуемостью и осложнениями. Развитие осложнений инфаркта миокарда зависит от нескольких важных факторов: 1. величины повреждения сердечной мышцы, чем больще по площади поражен миокард, тем выраженне осложнения; 2. локализации зоны повреждения миокарда (передняя, задняя, боковая стенка левого желудочка и др.), в большинстве случаев встречается
Рис. 97. Крупноочаговые инфаркты миокарда На приведенном рисунке видно, что регистрирующий электрод А, расположенный над областью трансмурального инфаркта, не запишет зубец R, поскольку вся толща миокарда погибла и вектора возбуждения здесь нет. Электрод А зарегистрирует только патологический зубец Q (отображение вектора противоположной стенки). В случае субэпикардиального
Факторами риска развития инфаркта миокарда являются: 1. возраст, чем старше становится человек, тем риск возникновения инфаркта у него увеличивается. 2. ранее перенесенный инфаркт миокарда, особенно мелкоочаговый, т.е. не-Q образующий. 3. сахарный диабет является фактором риска развития инфаркта миокарда, т.к. повышенный уровень оказывает дополнительное пагубное действие на сосуды сердца
Данные понятия относят соответственно к тем случаям, когда после первого перенесенного острого ИМ формируется второй и более. Причем сроки развития рецидива острого ИМ — от 3 до 28 сут с момента развития исходного инфаркта, а по истечении этого срока нужно говорить о повторном ИМ. Если ЭКГ-диагностика размеров и локализации очага поражения затруднена, в диагнозе ее указывать не
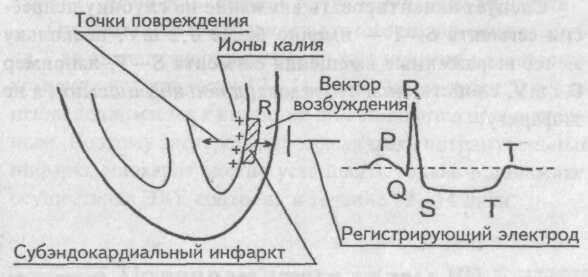
Рис. 98. Субэндокардиальный инфаркт миокарда При этом инфаркте величина вектора возбуждения миокарда не изменяется, поскольку он берет начало от проводящей системы желудочков, заложенной под эндокардом, и достигает неповрежденного эпикарда. Следовательно, первый и второй ЭКГ признаки инфаркта отсутствуют. Ионы калия при некрозе миокардиоцитов изливаются под эндокард, формируя
Инфаркт миокарда — неотложное состояние, чаще всего вызванное тромбозом коронарной артерии. Риск смерти особенно очень велик в первые 2 часа от его начала и очень быстро снижается когда пациент поступает в отделение реанимации и ему проводят растворение тромба, называемое тромболизисом или коронарную ангиопластику. Выделяют инфаркт миокарда с патологическим зубцом Q и без него. Как правило,
Общеизвестно, что острый инфаркт миокарда может сопровождаться как блокадой одной из ножек пучка Гиса, так и полной атриовентрикулярной диссоциацией. Прогностическая значимость этих симптомов зависит от локализации первичного очага инфаркта. При развитии блокады ножки пучка Гиса у больных с переднеперегородочным инфарктом прогноз весьма неблагоприятен, тогда как возникновение аналогичного
Помимо типичной, характерной для инфаркта резкой раздирающей боли за грудиной, выделяют еще несколько форм инфаркта, которая может маскироваться под другие заболевания внутренних органов или никак себя не проявлять. Такие формы называют атипичными. Давайте в них раберемся. Гастритический вариант инфаркта миокарда. Проявляется как выраженная боль в надчревной области и напоминает обострение
Осложнения инфаркта миокарда преимущественно возникают при обширном и глубоком (трансмуральном) повреждении сердечной мышцы. Известно, что инфаркт представляет собой некроз (омертвление) определенной зоны миокарда. При этом мышечная ткань, со всеми присущими ей свойствами (сократимость, возбудимость, проводимость и пр.), преобразуется в соединительную ткань, которая может выполнять только роль
Иногда при регистрации ЭКГ у пациентов во время ангинозного приступа или тотчас после него, на электрокардиограмме определяются признаки, свойственные острой или подострой стадии инфаркта миокарда, а именно — горизонтальный подъем сегмента S—Т выше изолинии. Однако этот подъем сегмента сохраняется секунды или минуты, электрокардиограмма быстро возвращается к нормальной в отличие от инфаркта