Острая дыхательная недостаточность. Принципы оказания неотложной помощи.
Похожие материалы:
Даралық психологиялық ерекшеліктерді зерттеу бағыттары
Адамның даралығы және қабілеттілік мәселесі Темперамент теориялар
Місцеве самоврядування в Україні
Місцеве самоврядування в Україні — це право територіальної громади — жителів села чи добровільного об’єднання у сільську громаду жителів кількох сіл, селища та міста — самостійно вирішувати питання місцевого значення в межах Конституції і законів України
"Ишемический и геморрагический инсульт, аневризмы сосудов мозга". Царенко С.В.
Сосудистые поражения головного мозга можно разделить на геморрагические и ишемические. Кровоизлияние в мозг может быть следствием как врожденной, так и приобретенной патологии. К врожденным заболеваниям относят пороки развития сосудов: артериальные церебральные аневризмы и артерио-венозные мальформации. Приобретенная патология, которая может приводить к кровоизлиянию в мозг, чаще всего представлена гипертонической болезнью, симптоматической артериальной гипертензией и атеросклерозом сосудов мозга. Реже встречается кровоизлияние в опухоль.
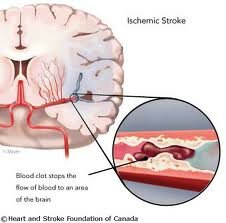
Ишемические поражения головного мозга возникают из-за нарушения проходимости сосуда. Проходимость может быть нарушена полностью из-за тромбоза или эмболии. Возможны также ишемические нарушения при резком сужении просвета сосуда. В такой ситуации причина ишемии – несоответствие доставки кислорода к мозгу и потребности в нем.
Дифференциальный диагноз геморрагии и ишемии мозга, наличия или отсутствия врожденных пороков сосудов имеет колоссальное значение для выбора лечебной тактики. Врожденная патология, как правило, нуждается в хирургическом лечении, приобретенная – только в отдельных случаях. Ранняя диагностика ишемии мозга позволяет применить тромболитические препараты, а наличие геморрагии делает их противопоказанными. Различаются и подходы к поддержанию оптимального артериального давления.
Для корректного проведения дифференциальной диагностики принципиальным является следующее положение: «Достоверный дифференциальный диагноз геморрагии и ишемии мозга, а также врожденной и приобретенной патологии без современных методов инструментальной диагностики невозможен!»
Информативность приводимых в различных руководствах дифференциально-диагностических таблиц, основанных на анализе клинической картины, результатах спинномозговой пункции, данных ультразвуковых методов крайне невысока. Выводы, которые могут быть сделаны на основе этих таблиц, носят только приблизительный характер.
Чаще всего внезапное начало характерно для геморрагии, но это также может дебютировать и церебральная ишемия. Кровь при люмбальной пункции характерна для геморрагических нарушений, но может быть случайно получена и при ишемическом инсульте вследствие ранения иглой сосуда. Верно и обратное. Отсутствие крови при поясничном проколе не исключает наличие геморрагии. Сообщение участка геморрагии с ликворными пространствами может быть нарушено или затруднено. В связи с этим от момента развития кровоизлияния должно пройти некоторое время, пока кровь появится в спинномозговой жидкости, полученной при проведении люмбальной пункции. Молодой возраст больного делает геморрагию «подозрительной» на наличие аневризмы или артерио-венозной мальформации. Но первое проявление этой врожденной патологии может быть и в пожилом возрасте.
Указанные обстоятельства делают незаменимыми методы нейровизуализации – компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ) головного мозга. Кроме того, для визуализации врожденной сосудистой патологии показано проведение трехмерной спиральной КТ и (или) так называемого сосудистого режима МРТ. Улучшить качество диагностики позволяют вводимые внутривенно рентген — или магнитоконтрастные препараты. В ряде случаев окончательный диагноз позволяет поставить только прямая церебральная ангиография, при которой рентгенконтрастное вещество вводят через специальный катетер, установленный непосредственно в церебральном сосуде.
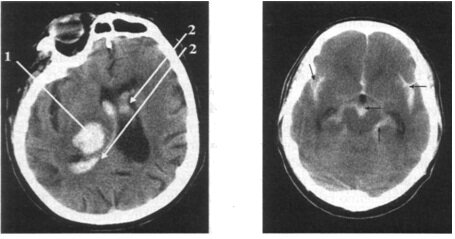
Без всяких сомнений, для диагностики геморрагических нарушений предпочтительной является КТ. При КТ геморрагические очаги выглядят в виде зон повышенной плотности (белого цвета). Эти зоны появляются уже в первые минуты кровоизлияния, что позволяет проводить раннюю дифференциацию геморрагических и ишемических нарушений. Ишемические очаги на КТ выглядят как зоны пониженной плотности (серого цвета). Они выявляются позже, чем геморрагия – через несколько часов, а иногда и суток от начала заболевания. Последнее обстоятельство объясняет тот факт, что рано проведенная КТ может не слишком отличаться от нормы при наличии типичной клинической картины ишемического инсульта.
МРТ позволяет диагностировать очаги ишемии уже в первые минуты. Однако диагностика геморрагии по данным МРТ является более сложной и требовательной к качеству томографа, а также к квалификации специалиста.
Неврологический осмотр, который позволяет осуществлять прикроватный мониторинг состояния больного, имеет важное, но все же вспомогательное значение. Динамика очаговых симптомов позволяет судить об эффективности лечебных мероприятий, направленных на купирование ишемии мозга. При супратенториальных поражениях очаговая симптоматика проявляется гемипарезом вплоть до плегии, поэтому уменьшение степени пареза говорит о положительной динамике. При субтенториальных поражениях очаговые неврологические симптомы выявляются в виде неравномерного выпадения сегментарных стволовых рефлексов или мозжечковых нарушений. При них также возможно развитие геми- или тетраплегии из-за поражения пирамидных путей, проходящих по транзитом через ствол головного мозга от коры к спинному мозгу. Общее правило следующее: чем меньше рефлексов, которые свидетельствуют о функционировании черепно-мозговых нервов и пирамидных путей, тем больше размер патологического очага.
В практической работе условно стволовые нарушения разделяются на диэнцефальные, мезэнцефальные, мостовые и бульбарные. Диэнцефальные нарушения характеризуются дисфункцией гипоталамуса. Поэтому их проявления – вегетативные нарушения: артериальная гипертензия, нарушения частоты сердечного ритма (тахи- или брадикардия), сердечные аритмии, нарушения терморегуляции и потоотделения. Перечисленные признаки являются очень неспецифичными и часто неверно трактуются в клинической практике. Самой распространенной ошибкой при диэнцефальной дисфункции являются неверная трактовка артериальной гипертензии. Артериальная гипертензия рассматривается как патологический фактор и повод для активной гипотензивной терапии. На самом деле в большинстве случаев повышение артериального давления – грозный симптом нарастающей ишемии мозга или его дислокации. Артериальная гипертензия в данной ситуации является компенсаторной реакцией организма, требующей не симптоматического снижения, а активных действий по купированию ишемии или дислокационных процессов. Эта проблема настолько важна, что мы остановимся на ней еще не раз в данном руководстве.
Мезэнцефальные нарушения проявляются поражением III и IV пар черпно-мозговых нервов. Дисфункцию III и IV пар оценивают по наличию глазодвигательных расстройств: расхождение глазных яблок по горизонтали и вертикали, расширение одного или обоих зрачков и угнетение их реакции на свет.
Приблизительно на уровне моста находятся ядра следующих пар черепно-мозговых нервов. Нарушение функции V и VII пар оценивают по одно- или двухстороннему выпадению роговичного рефлекса. Дополнительный симптом дисфункции V пары – снижение тонуса нижней челюсти. Дисфункция VII пары проявляется ассимметричностью лицевой мускулатуры. При поражении VI пары наблюдается резкое сужение зрачков с угнетением фотореакции, а также сходящееся косоглазие. Поражение VIII пары характеризует наличие окулоцефалических и окуловестибулярных нарушений.
Бульбарные расстройства проявляются дисфункцией IХ, Х и ХII пар в виде нарушений глотания и кашля в ответ на раздражение трахеи.
Яркий признак дисфункции ствола, не имеющий четкой «привязки» к определенному уровню его поражения – застой желудочного содержимого. К таким же признакам относится дисфункция пирамидных путей в виде патологических стопных знаков и познотонических реакций на болевые раздражители.
Мозжечковые расстройства проявляются нистагмоидными движениями глазных яблок различного характера: ротационного, поплавкового, хаотичного.
Положительные эффекты лечения проявляются в виде появления отсутствующих рефлексов, замене познотонических реакций на недифференцированные и дифференцированные реакции на болевые раздражители. Исчезновение имеющихся сегментарных стволовых рефлексов и постепенное угасание всяких реакций на боль свидетельствует об увеличении очага поражения мозга. Исключением из этого правила являются окулоцефалические и окуловестибулярные рефлексы, а также мозжечковые нарушения.
Если нарастает угнетение сознания, и при этом исчезают окулоцефалические и окуловестибулярные рефлексы, а также мозжечковые нарушения, то, очевидно, это отрицательная динамика. Повышение уровня бодрствования и исчезновение этих нарушений является положительной динамикой.
По степени выраженности дислокационной симптоматики можно предполагать нарастание или уменьшение внутричерепной гипертензии. Наиболее ярко дислокационная симптоматика «звучит» при субтенториальных поражениях. В этих случаях дислокация развивается в кранио-каудальном направлении, сверху вниз. При этом внимательный неврологический осмотр позволяет выявить последовательное выпадение функций черепно-мозговых нервов от III пары до IX-ХII пар, замену дифференцированных реакций на боль на недифференцированные, а затем познотонические с последующим их исчезновением. Нарастание дислокации проявляется возникновением желудочного застоя. В конечной ее стадии наступают гемодинамические расстройства в виде артериальной гипотонии из-за поражения сосудодвигательного центра. Очень важно рано выявить дислокационную симптоматику, не доводя ситуацию до поражения бульбарных структур и сосудодвигательного центра. Этот момент настолько серьезно определяется прогноз заболевания и настолько часто упускается в практической деятельности, что мы считаем необходимым остановиться на нем подробнее.
При дислокации сверху вниз последовательно страдают диэнцефальные, мезоэнцефальыне структуры, а затем мост и бульбарные отделы ствола. За исключением диэнцефальных структур, все остальные отделы ствола можно протестировать при неврологическом осмотре по дисфункции черепно-мозговых нервов, ядра которых располагаются на том или ином уровне. Дисфункция III – V пар соответствует мезэнцефальным структурам, VI – VIII – мосту, IХ — ХII – бульбарным отделам. А вот диэнцефальные структуры, с которых начинается дислокация, протестировать таким образом нельзя! Дисфункция диэнцефальных структур проявляется дисфункцией гипоталамуса в виде артериальной гипертензии и изменении частоты сердечных нарушений (чаще тахикардии, реже – брадикардии). Артериальная гипертензия обычно «пугает» реаниматолога и толкает его на использование гипотензивных препаратов для снижения АД. Это в корне неверная тактика! Артериальная гипертензия в данном случае является компенсаторной в ответ на нарастание ВЧД с целью поддержать перфузионное давление в мозге. Нужно предпринимать меры по лечению дислокации и ишемии мозга, а не симптоматически лечить повышенное АД, тем самым, купируя компенсаторную реакцию.
Намного более достоверную информацию о внутричерепном давлении дает его прямое измерение паренхиматозным или интравентрикулярным датчиком. Последний способ является предпочтительным, поскольку дозированное выведение цереброспинальной жидкости является также одним из методов коррекции повышенного ВЧД. Очевидно, что при пункции и катетеризации желудочков должны быть соблюдены ряд условий: достаточный их размер, отсутствие массивного внутрижелудочкового кровоизлияния с тампонадой желудочков, строгое соблюдение правил асептики. Мониторинг ВЧД более динамично отражает нарастание внутричерепной гипертензии, чем неврологический осмотр и данные КТ, что создает возможности для экстренной коррекции внутричерепной гипертензии. Нормальные величины ВЧД –15 мм рт. ст. и ниже.
Измерение ВЧД позволяет рассчитать такой важный показатель, как церебральное перфузионное давление (ЦПД). Формула расчета следующая:
ЦПД = АД ср – ВЧД
Напомним, что АД ср рассчитывается по формуле
АД ср = АД сист + 2 АД диаст /3
Согласно мнению большинства авторов ЦПД должно быть не менее 70 мм рт. ст.
Очень ценную информацию дает измерение оксигенации венозной крови, оттекающей от мозга. Можно пользоваться как неинвазивным методом церебральной оксиметрии (паринфракрасной спектрометрии), так и инвазивными способами. Среди последних чаще всего используют ретроградную катетеризацию яремной вены. Конец катетера располагают на уровне внутреннего слухового прохода, чтобы исключить подмешивание крови из системы наружной сонной артерии. Точность установки катетера контролируют при боковой рентгенографии черепа. Общепринято, что величина насыщения гемоглобина в смешанной венозной крови мозга (SjO2 ) должна составлять не менее 55%. Меньшие значения свидетельствуют о несоответствии доставки кислорода к мозгу и его потреблением, т.е. ишемии мозга. Учитывая тот факт, что изучаемый показатель отражает оксигенацию венозной крови, смешанной от разных отделов мозга, величина 55% не может гарантировать отсутствие ишемии в проблемных участках мозга. Для того чтобы повысить надежность терапии в клинической практике принято поддерживать бóльший уровень оксигенации в смешанной венозной крови: 70-80%. Величины более 80% не несут определенной диагностической информации. Ясно только одно: доставка кислорода для мозга в целом избыточная. Это не исключает наличия участков ишемии. Кроме того, неясно, что является причиной избытка доставки кислорода: его слишком много в артериальной крови или избыточен объем крови, поступающей к мозгу. Слишком большое количество кислорода в артериальной крови явление достаточно безобидное, явных отрицательных последствий на мозг не имеющее. Можно, конечно, порассуждать о перекисном окислении липидов, но на настоящем уровне знаний эти рассуждения будут носить умозрительно-спекулятивный характер. А вот избыточный объем крови в мозге – вещь опасная, т.к. повышенное кровенаполнение может приводить к нарастанию внутричерепной гипертензии в силу ограниченности пространства внутри черепа.
Широкое распространение получили также ультразвуковые методы диагностики. Основное их преимущество – это неинвазивность и возможность использования непосредственно в реанимационном отделении. Основные недостатки – высокая оператор-зависимость и ограничения для проникновения ультразвука через плотные кости черепа. В связи с этим для ультразвуковой диагностики используют так называемые «окна», располагающиеся в области чешуи височной кости и в глазнице. Через ограниченные размеры этих «окон» не удается «рассмотреть» (или вернее «озвучить») все структуры мозга.
Эхоэнцефалоскопию в настоящее время используют только при отсутствии КТ и МРТ. Основная информация, которую удается получить – это степень отклонения в сторону срединных структур. Такая информация косвенно свидетельствует о размерах супратенториального очага. Другая ультразвуковая методика, доплеровское исследование мозговых сосудов, позволяет по нарастанию линейной скорости кровотока судить о степени их сужения. Практическое значение имеет динамика этого показателя при развитии ангиоспазма вследствие разрыва артериальных церебральных аневризм. На деталях данного метода мы остановимся в соответствующем разделе книги. В настоящее время все шире применяется дуплексное исследование сосудов мозга и шеи, которое имеет значение для диагностики их окклюзии, сужения, патологической извитости. Методика требовательна к качеству аппаратуры и опыту врача функциональной диагностики.
Показания к диагностической люмбальной пункции в настоящее время значительно сужены. Подчеркнем очень важный факт: проведение поясничного прокола возможно только при отсутствии клинических и инструментальных признаков дислокации мозга. Следует помнить, что даже использование тонких игл для пункции не исключает последующего постепенного поступления спинномозговой жидкости из места прокола. Истечение жидкости может снижать давление в люмбальном мешке. Разница между давлением в полости черепа и люмбальном пространстве может привести к дислокации головного мозга. В связи с этим лучше люмбальную пункцию предварять проведением КТ или МРТ. Единственное абсолютное показание к выполнению поясничного прокола – это серьезные основания подозревать наличие у больного менингита. Как правило, это клинико-лабораторная картина инфекционного процесса при отсутствии признаков пневмонии, мочевой инфекции и других септических очагов. Широко распространенное выведение спинномозговой жидкости для ее санации от крови в настоящее время подвергается серьезной критике. Если учитывать тот факт, что в сутки у человека вырабатывается не менее 150-300 мл цереброспинальной жидкости, то трудно себе представить серьезный терапевтический эффект от однократного выведения 10-15 мл.
Кроме методов неврологической диагностики, при планировании интенсивной терапии сосудистых заболеваний головного мозга большое значение имеет диагностика сердечных нарушений. При обычной электрокардиографии (ЭКГ) можно выявить очаговые нарушения вследствие перенесенной ранее или имеющей место в настоящее время ишемии миокарда. Особое внимание должно быть уделено динамике изменений ЭКГ. Следует помнить, что лучшая динамика ЭКГ – это ее отсутствие. «Застывшие» изменения ЭКГ прогностически намного более благоприятны, чем положительная динамика, которая в ряде случаев может быть ложноположительной. Наиболее настораживающими врача являются изменения сегмента ST, особенно его элевация, а также изменения комплекса QRS. Изменения зубца Т намного менее специфичны и могут возникать из-за вегетативной дисфункции и электролитных расстройств. Тем не менее, любые изменения ЭКГ требуют дополнительной ферментной и ультразвуковой диагностики для исключения острых очаговых изменений в миокарде.
При прикроватном ЭКГ-мониторинге очаговые изменения выявить сложно из-за ограниченности отведений ЭКГ (как правило, не более трех). В то же время настораживающими являются значительные изменения желудочкового комплекса и нарушения сердечного ритма. В любом случае при их выявлении необходима дополнительная запись полноценной электрокардиограммы в 12 отведениях.
Нужно также использовать возможности современной эхокардиографии. После проведения эхокардиографии врач-реаниматолог должен получить информацию о допустимых границах лечебной агрессии: насколько скомпрометировано сердце пациента, чтобы перенести волемическую нагрузку и индуцированную артериальную гипертензию. Информация, которая позволяет приблизительно определить указанные границы, следующая: величина зон гипокинеза, акинеза и парадоксального движения стенок сердца, наличие и выраженность дилатации полостей сердца, степень поражения клапанного аппарата. Важной является также приблизительная оценка сократительной функции сердца. О ней судят по фракции выброса, которую определяют как величину ударного объема, соотнесенную с конечно-диастолическим объемом. Нормальная величина фракции выброса – 60-80%.
Еще более достоверную информацию об эффективности проводимой коррекции центральной гемодинамики можно получить на основе современных методов мониторинга. Очень привлекательной является технология транспульмональной термодилюции, представленная мониторами PiCCO. Холодовую метку вводят в центральную вену, а датчик, анализирующий кривую ее разведения и смешивания с кровью, располагается в бедренной артерии. Специальные расчеты позволяют мониторировать величину сердечного выброса и накопление воды в легочной ткани. Однако наибольшие возможности представляет наличие катетера в бедренной артерии. Технология позволяет мониторировать площадь под кривой артериального давления. Динамические изменения этой площади на вдохе и на выдохе в настоящий момент рассматриваются как наиболее точный критерий эффективности коррекции гиповолемии. Очевидно, что величина артериального давления (АД) является важным, но единственным показателем эффективности коррекции гемодинамики. Достаточное АД может поддерживаться как путем инфузионной терапии, так и введением сосудоактивных препаратов. В то же время недостаточно корригированная гиповолемия опасна для больного, поскольку любые изменения сосудистого тонуса, например, после введения жаропонижающих средств, седативных препаратов, при перекладывании больного могут вызывать падение АД. Кроме того, длительная гиповолемия – это прямой путь к органной дисфунции. Гиповолемия вызывает перераспределение кровотока в пользу мозга и сердца, приводя к нарушениям перфузии внутренних органов.
Для того чтобы оценить оптимальность волемической коррекции макроциркуляторных нарушений можно ориентироваться на темп инфузионной терапии, соотнесенный с темпом диуреза. Но данный подход дает только приблизительные результаты, поскольку вводимая жидкость может задерживаться в интерстициальном пространстве. Кроме того, использование симпатомиметиков, гиперосмоляльных препаратов, диуретиков, ксантинов, а также недостаточность андидиуретического гормона и церебральный соль-теряющий синдром могут влиять на диурез через иные механизмы.
Еще один широко используемый в клинической практике показатель – величина гематокрита. В короткие промежутки времени (часы), когда количество эритроцитов можно считать постоянным, динамические изменения гематокрита отражают величину объема циркулирующей крови. Снижение гематокрита означает увеличение жидкостной фракции крови и соответствующее снижение концентрации эритроцитов.
Часто используемый в клинической практике показатель центрального венозного давления (ЦВД) тоже является весьма приблизительным. Если ЦВД равно нулю или отрицательное, то гиповолемия не купирована. Если ЦВД положительное, то определенных выводов о наличии или отсутствии гиповолемии сделать нельзя.
Современные исследования показали, что наиболее информативными критериями купирования гиповолемии являются динамические показатели. К ним относятся изменения ударного объема под влиянием периодических возмущающих воздействий. В наибольшей степени клинической практике удовлетворяют такие возмущающие воздействия, как дыхательные движения грудной клетки. Если под влиянием дыхания имеются значительные изменения ударного объема, то гиповолемия не купирована. Если эти изменения составляют менее 10-15%, то темп инфузионной поддержки достаточен. Изменения величины площади под его кривой соответствуют динамике ударного объема сердца. Вместо площади под кривой артериального давления можно оценивать также дыхательную вариабельность величины пульсового давления. При оценке динамических параметров нужно строгое соблюдение методологии: отсутствие спонтанных вдохов больного (для чего вводят седативные препараты и миорелаксанты), достаточная величина дыхательного объема (не менее 7 мл/кг массы тела) и отсутствие сердечных аритмий.
Из других методов диагностики и мониторинга обязательной является динамическая оценка газового состава артериальной крови. Наиболее точная оценка возможна при инвазивном исследовании. Особенно это касается напряжения кислорода. Принятая в нейрореаниматологии тактика гипероксигенации не позволяет полноценно использовать неинвазивный метод пульсоксиметрии. Снижение показателей пульсоксиметрии при использовании высоких концентраций кислорода во вдыхаемой смеси является очень поздним симптомом нарушений оксигенации. А вот неинвазивная методика капнографии является незаменимой для нейрореаниматологии. Инвазивное определение парциального напряжения СО2 в артериальной крови (pа СО2 ) является дискретным методом. Учитывая ведущую роль этого показателя в регуляции тонуса церебральных сосудов и, соответственно, величины внутричерепного объема крови делает обязательным динамический контроль. Появление современных портативных микроструйных капнографов позволяет применять методику на всех этапах лечения больного, включая меж- и внутрибольничную транспортировку.
Респираторный мониторинг не ограничивается исследованием газообмена. Последние технологические достижения делают возможным также оценку механики дыхания. Наиболее важными для клинической практики является измерение давления в дыхательных путях (Paw )и пищеводного давления. Давление в дыхательных путях при проведении ИВЛ отражает податливость всей дыхательной системы, согласно формуле
где Сrs – податливость дыхательной системы (compliance of respiratory system), VT — дыхательный объем (volume tidal).
Дыхательная система состоит из собственно легких и окружающих их структур – грудной клетки и органов брюшной полости. В норме податливость внелегочных структур невысока, поэтому при расчете податливости их не учитывают. Однако при ряде клинических ситуаций, например при выраженном парезе кишечника, ожирении внелегочными структурами нельзя пренебречь. Для того чтобы дифференцировать причины ухудшения податливости дыхательной системы можно отдельно измерить податливость легких и внелегочных структур. С этой целью специальным датчиком измеряют давление в нижней трети пищевода (Pes ). Оно соответствует внутриплевральному давлению. Податливость легких (Сl ) рассчитывают по следующей формуле:
Общая податливость респираторной системы (Crs ) является результатом совместного влияния Сl и податливости внелегочных структур — грудной клетки (Ccw ):
Далее можно рассчитать податливость грудной клетки:
Раздельный учет податливости легких и внелегочных структур позволяет подбирать режимы оптимальные параметры ИВЛ без опасности нанесения баротравмы легких.
В заключение следует упомянуть об обязательных лабораторных исследованиях. Помимо стандартных клинических анализов крови и мочи, большое значение имеет динамический контроль креатинина и глюкозы в крови. У рассматриваемой группы пациентов страдают сосуды. И очень часто сосудистые нарушения приводят к почечной недостаточности и сахарному диабету, имевших до болезни латентное течение и манифестирующих во время сосудистой церебральной катастрофы. Большое внимание должны быть также уделено контролю над чувствительностью микрофлоры, высеваемой их мокроты, спинномозговой жидкости, крови, раненого содержимого. Получаемая при этом информация незаменима при подборе адекватной тактики антибактериальной терапии.
Инсульт
Острое нарушение мозгового кровообращения, которое приводит к развитию стойкого очагового неврологического дефицита. Различают инсульты геморрагические и ишемические. Мозговой инсульт у детей наблюдается редко.
Геморрагический нисульт — кровоизлияние в вещество головного мозга (паренхиматозные) или под оболочки мозга (субарахноидальные, субдуральные, эпидуральные) и его сочетанные формы — субарахноидально-паренхиматозное, паренхиматозно-вентрикулярное.
Ишемические инсульт подразделяют на тромботические, эмболические и нетромботические. При тромботическом и эмболическом инсульте инфаркт мозга развивается вследствие полной окклюзии мозгового сосуда тромбом или эмболом. Нетромботический инфаркт мозга возникает при отсутствии полной окклюзии в условиях длительного ангиоспазма. Имеются данные об определенной роли наследственных факторов в развитии инсульта, особенно при раннем его возникновении. Но генетически детерминированными являются лишь отдельные патогенетические механизмы заболевания — биохимические, цитологические, иммунологические и др. Самыми частыми причинами ишемических инсультов у детей являются врожденные пороки сердца, особенно тетрада Фалло, а также ревматические пороки, бактериальные эндокардиты. Возможны инсульты при протезированном клапанном аппарате сердца и сердечных аритмиях. В развитии заболевания имеют значение неспецифические церебральные васкулиты, наблюдаемые у детей, страдающих аутоиммунными заболеваниями, — системной красной волчанкой и узелковым периартериитом. Нарушения мозгового кровообращения при этом могут носить как ишемический, так и геморрагический характер. Предрасполагающим фактором ишемического инсульта нередко становится сахарный диабет, приводящий к диабетической ангиопатии.
Одной из наиболее частых причин инсульта являются аномалии сосудов (аневризмы и врожденные сосудистые мальформации). В зависимости от локализации этих аномалий (ангиодисплазий) выделяют: аневризмы артерий; аневризмы вен; артериовенозные аневризмы; капиллярные аневризмы. Аномалии сонных, позвоночных, подключичных артерий (перегиб, дисплазия, патологическая извитость) могут явиться причинами ишемического инсульта Нарушения мозгового кровообращения нередко развиваются при факоматозах — болезни Стерджа — Вебера, туберозном склерозе. Гнойные процессы в придаточных пазухах носа, среднем ухе, сосцевидном отростке представляют опасность инфекционного тромбоза венозных синусов и вен мозга. Нередко тромбоз сосудов мозга возникает при сепсисе, осложненном синдромом диссеминированного внутрисосудистого свертывания. Тромбозы церебральных артерий иногда наблюдаются при коклюше, кори, дизентерии, тифах, пневмонии.
Тромбоцитопеническая пурпура, гемофилия, фибриногенопеническая пурпура, фибриногенопения, гипопротеинемия, лейкозы также могут осложняться геморрагическим инсультом. При серповидно-клеточной анемии возможен как геморрагический, так и ишемический инсульт. Ишемическое нарушение мозгового кровообращения иногда возникает как осложнение полицитемии. При вторичной артериальной гипертензии (почечная, при патологии желез внутренней секреции, коарктации аорты) возможен как геморрагический, так и ишемический инсульт. Основными факторами развития инсульта являются органические изменения сосудов мозга и функциональные нарушения регуляции его кровоснабжения. При инсульте у детей имеют большое значение факторы, ведущие к нарушению целостности сосудистой системы, повышению их проницаемости, а также к изменению физико-химических свойств и состояния форменных элементов крови. Выход крови в вещество мозга происходит в результате нарушения проницаемости или целостности стенок сосудов. При этом кровоизлияния (образование гематом) происходят вследствие разрыва сосудов, в то время как кровоизлияния в виде геморрагического пропитывания протекают по типу диапедеза. Геморрагический инсульт у детей по механизму диапедезного кровоизлияния отмечается при болезнях крови, авитаминозах, интоксикациях, церебральных васкулитах, артериальной гипертензии. При аномалиях мозговых сосудов (мешотчатые аневризмы, мальформации) кровоизлияние развивается вследствие разрыва стенок аневризмы или сосудов мальформации. В патогенезе церебральной ишемии и геморрагии в последние годы придается значение наличию аутоимунных нарушений. Ведущая роль в ограничении притока крови к мозгу у детей отводится тромбозам и эмболиям, меньшее значение имеют стенозирующие изменения. При последних создаются благоприятные условия для замедления кровотока, что вызывает агрегацию форменных элементов крови.
Клиническая картина геморрагического инсульта, симптомы, течение
Кровоизлияние в мозг чаще развивается днем. Нередко ему предшествуют отрицательные эмоции, физическая нагрузка (занятия физкультурой, подъем тяжести), иногда лихорадочные состояния. Начало заболевания всегда внезапно: больной теряет сознание и падает. Иногда он успевает пожаловаться на ощущение «удара» в голову. Нередко наблюдаются общее психомоторное возбуждение и генерализованные судороги. У всех больных имеется разной степени нарушение сознания, от оглушения до комы. Глазные яблоки неподвижны или совершают «плавающие» движения, наблюдаются косоглазие, анизокория. Одним из основных признаков глубокой комы является нарушение жизненно важных функций — дыхания, сердечной деятельности, терморегуляции. Степень глубины комы определяют изменения в рефлекторной сфере. При неглубокой коме сохраняются реакция зрачков на свет, рефлексы (корнеальный, кашлевой, глоточный, сухожильные и периостальные, двусторонние патологические). Нередко отмечаются нарушения мышечного тонуса в виде двусторонней горметонии или стойкой децеребрационной ригидности. При глубокой коме исчезают зрачковый, корнеальный и глоточный рефлексы, отсутствуют сухожильные и периостальные рефлексы. Отмечается диффузная мышечная гипотония или атония (атоническая кома). В этой стадии комы большие трудности вызывает определение стороны поражения.
Развитие кровоизлияния в мозг нередко сопровождается менее глубоким нарушением сознания — сопором или оглушением. Постоянным симптомом кровоизлияния в мозг у детей является рвота, возникающая в первые минуты после инсульта. Также часто бывают вегетативно-сосудистые расстройства в виде гиперемии или бледности лица, гипергидроза, акроцианоза или диффузной «мраморности» кожных покровов, гипертермии. Отмечаются тахикардия, склонность к снижению АД; нарушение ритма дыхания. Ригидность мышц затылка, верхний и нижний симптомы Брудзинского, симптом Кернига, более отчетливо выраженный на непарализованной нижней конечности, часто выявляются через несколько часов после кровоизлияния. При кровоизлияниях в мозг у детей всегда превалируют общие симптомы над симптомами очагового поражения мозга.
Симптомы очагового поражения при кровоизлиянии в полушария большого мозга: гемипарез (гемиплегия), центральный парез VII и XII пар черепных нервов, иногда поворот головы и глаз в сторону очага, афазия — при локализации очага в доминантном полушарии. При прорыве крови в желудочки мозга состояние больных значительно ухудшается: углубляется степень нарушения сознания — вплоть до тяжелой комы, нарастают вегетативные расстройства, наблюдается гипертермия. Нарастают нарушения дыхания и сердечно-сосудистой деятельности.
Кровоизлияния в ствол мозга встречаются значительно реже. Как правило, при обширных кровоизлияниях в структуры задней черепной ямки отмечаются быстрое развитие общих симптомов поражения мозга, нарушение дыхания, иногда по типу Чейна — Стокса, развивается гипертермия. Часто появляются глазодвигательные нарушения: косоглазие, анизокория, миоз или мидриаз; нередки нистагм, расстройство глотания, ранняя мышечная гипотония. У детей крайне редко развиваются классические альтернирующие синдромы.
Для диагностики кровоизлияния в мозг имеют большое значение данные анализа периферической крови, выявляющие лейкоцитоз (со сдвигом до палочкоядерных клеток). Цереброспинальная жидкость бывает чаще кровянистой или ксантохромной и вытекает под повышенным давлением. При ЭХО-исследовании в случаях кровоизлияний в полушария большого мозга определяется смещение срединных структур мозга (М-эхо) в сторону контралатерального полушария. КТ-исследование при кровоизлиянии в мозг в первые дни О.н.м.к. выявляет наличие зоны повышенной плотности. При внутримозговых кровоизлияниях обнаруживается очаг повышенной плотности овально-круглой или неправильной формы, часто с неровными контурами.
Течение заболевания зависит от многих факторов: возраста ребенка, локализации кровоизлияния, его размеров, темпа развития, этиологии, осложнений. Обширные геморрагии, осложненные прорывом крови в желудочковую систему, имеют неблагоприятное течение. При ограниченных кровоизлияниях в полушария большого мозга, не сопровождающихся значительным отеком мозга, состояние больных улучшается, симптомы очагового поражения постепенно уменьшаются. Описаны случаи благоприятного течения ограниченного кровоизлияния в мозжечок и мозговой ствол.
Субарахноидальное кровоизлияние у детей наблюдается чаще, чем паренхиматозное, и обусловлено разрывом мешотчатых аневризм или сосудистой мальформации. Заболевание развивается внезапно после физического, эмоционального напряжения: появляются резкая головная боль, многократная рвота, брадикардия, нередко общие тонико-клонические судороги. Часто наступает утрата сознания, реже психомоторное возбуждение. Довольно быстро развивается менингеальный синдром. Симптомы очагового поражения непостоянны и выражены негрубо. При разрыве базальных аневризм часто бывает поражение черепных нервов. Нередко возникают застойные явления на глазном дне с кровоизлияниями в сетчатку. Повышается температура тела, изменяется картина периферической крови, что затрудняет дифференциальную диагностику субарахноидальных кровоизлияний от менингитов. Цереброспинальная жидкость содержит примесь свежей крови в течение 5-7 сут, в дальнейшем обнаруживается ксантохромия.
Диагноз субарахноидального кровоизлияния устанавливается по характерным клиническим проявлениям: острое развитие общемозговых и менингеальных симптомов, наличие примеси крови в цереброспинальной жидкости. Ангиография используется для уточнения характера сосудистого поражения, локализации, одиночности или множественности аневризм или сосудистой мальформации, как правило, перед оперативным вмешательством. Ангиографии предшествует КТ-исследование.
Течение субарахноидального кровоизлияния благоприятно при отсутствии подтекания крови или повторного кровоизлияния. Впоследствии развиваются нарушения ликвородинамики, эпилептический синдром, дисфункция гипоталамической области, астенический синдром.
Клиническая картина ишемического инсульта, симптомы, течение
Ишемический инсульт (инфаркт мозга) у детей встречается реже. Наиболее часто такие инфаркты обнаруживаются в бассейне средней мозговой артерии, реже в вертебробазилярной системе. Различают белые, красные (геморрагические) и смешанные инфаркты. Характерные для ишемического инсульта у взрослых предшествующие преходящие нарушения мозгового кровообращения у детей отсутствуют. Как правило, заболевание развивается остро, без предвестников, общие симптомы и симптомы очагового поражения мозга возникают одновременно и напоминают геморрагический инсульт. Такое развитие инсульта особенно характерно для эмболии. Чем младше ребенок, тем более выражены общие симптомы поражения мозга в виде нарушения сознания: чаще оглушение и сопор, реже — кома. Рвота, менингеальный симптомокомплекс наблюдаются и при эмболиях. Степень нарушения сознания зависит от наличия отека мозга и вторичного стволового синдрома, поэтому возможно прогрессирующее нарастание общих симптомов поражения мозга. Вегетативные нарушения В начальном периоде ишемического инсульта. у детей выражены слабее, чем при кровоизлияниях в мозг, хотя имеют генерализованный характер: резкое побледнение кожных покровов с акроцианозом, склонность к тахикардии, низкому АД. Нередко в начальном периоде ишемического инсульта, особенно при тромбоэмболиях (но реже, чем при геморрагическом инсульте), наблюдаются судорожные припадки с фокальным компонентом. В постановке диагноза ишемического инсульта у детей имеют значение наличие ревматического процесса с поражением клапанного аппарата сердца, с нарушением ритма, септические состояния, полицитемия.
В первые дни ишемического инсульта отсутствуют изменения периферической крови, однако всегда надо иметь в виду возможность воспалительных изменений крови, обусловленных основным заболеванием. Показатели гемокоагуляции также непатогномоничны как для ишемического, так и геморрагического инсульта. Отмечаются их многообразные колебания как в сторону гиперкоагуляции, так и гипокоагуляции. Цереброспинальная жидкость при ишемическом инсульте не изменена, иногда возможно некоторое увеличение в ней содержания белка.
КТ-исследование головного мозга при белом инфаркте выявляет снижение плотности (гиподенсивные зоны), при геморрагическом инфаркте зоны пониженной, повышенной и неизмененной плотности головного мозга в пределах этого очага. На ЭКГ нередко обнаруживаются нарушения ритма и проводимости.
Течение заболевания при ишемическом инсульте более благоприятно, чем при геморрагическом инсульте, хотя зависит от выраженности общемозговых проявлений и вторичного стволового синдрома. Непосредственно от инсульта смерть может наступить при обширных инфарктах, осложненных отеком и сдавлением ствола мозга. У большинства больных наибольшая тяжесть состояния отмечается в течение 3-5 дней, затем наступает период улучшения. Темп восстановления нарушенных функций вариабелен и зависит от многих причин.
Прогноз при ишемических инсультах у детей довольно серьезен и определяется размерами очага мозгового инфаркта, его локализацией, состоянием общей гемодинамики и соматическим статусом.
Диагностика О.н.м.к. в начале заболевания может быть затруднена. Его следует дифференцировать от нейроинфекционных процессов (менингит, энцефалит, менингоэнцефалит) и от опухоли головного мозга, имеющей острое течение. Острое развитие заболевания, выраженность общемозговых и менингеальных симптомов обусловливает сходство клинической картины субарахноидального кровоизлияния и менингита. Их основным дифференциально-диагностическим критерием являются данные спинномозговой пункции. Наличие примеси крови (эритроциты) в цереброспинальной жидкости и соответствующей клинической картины свидетельствует о кровоизлиянии. Особенно затруднена диагностика аневризм головного мозга в холодный период. Диагностика аневризм возможна с помощью ангиографии, компьютерной томографии, магнитно-резонансной томографии.
При паренхиматозном, паренхиматозно-субарахноидальном кровоизлиянии и ишемическом инсульте возникает необходимость в дифференциальной диагностике с энцефалитом (менингоэнцефалитом). Основными критериями в этих случаях являются данные спинномозговой пункции, поражение определенного сосудистого бассейна при ишемическом инсульте, многоочаговый процесс при энцефалите.
Для дифференциальной диагностики с опухолью, имеющей острое и подострое течение, большое значение имеют результаты исследования глазного дна. При опухолях головного мозга, как правило, наблюдаются застойные изменения глазного дна, в то же время при субарахноидальном кровоизлиянии могут отмечаться ангиодистонические проявления, иногда кровоизлияния в сетчатку. Большое значение приобретает компьютерная томография головного мозга.
Дифференциальный диагноз кровоизлияния в мозг и инфаркта мозга у детей представляет большие трудности. Следует учитывать сочетание многих признаков, так как для определения характера инсульта отдельные симптомы имеют относительную диагностическую ценность.
Лечение при О.н.м.к. у детей. Лечебные мероприятия в остром периоде инсульта зависят от его характера и бывают недифференцированными и дифференцированными. К недифференцированным мероприятиям относятся: восстановление функции дыхания, поддержание сердечной деятельности, профилактика аспирации и пневмонии, борьба с отеком мозга, коррекция нарушений электролитного баланса, купирование судорог и психомоторного возбуждения, профилактика восходящей инфекции, пролежней и контрактур.
Особую роль при лечении играют устранение отека головного мозга (см.) и снижение внутричерепного давления.
При повышенном АД назначают дибазол, ганглиоблокаторы (лучше в отделении интенсивной терапии), нейролептики (литические смеси).
В связи с тем что паренхиматозно-субарахноидальное и субарахноидально-паренхиматозное кровоизлияние у детей чаще всего обусловлены сосудистыми аномалиями, необходимо нейрохирургическое вмешательство. В остром периоде паренхиматозной геморрагии нейрохирургическое удаление гематомы абсолютно показано при кровоизлиянии в полушарие мозжечка.
Лечение при ишемическом инсульте
Терапия должна быть направлена на уменьшение аггрегации форменных элементов крови, в ряде случаев на понижение свертываемости крови и лизис тромба, угнетение перекисного окисления, улучшение кровоснабжения и метаболизма. Для улучшения микроциркуляции крови применяют так называемые дезагреганты. Внутривенно капельно вводят реополиглюкин, гемодез, декстрана полиглюкин (в дозе 300-600 мл 2 раза в сутки в зависимости от возраста ребенка). Гемодилюция показана в течение 5-7 дней после начала инсульта. Вводят внутривенно производные метилксантина (эуфиллин, трентал), внутривенно или внутримышечно водорастворимую камфору (сульфокамфокаин) 2 раза в сутки. Целесообразно распределить прием антиагрегантов в течение дня, учитывая быстроту их действия и скорость выведения из организма. После острого периода (по истечении 5- 6 дней) применяют внутрь антиагреганты (курантил, трентал, монобромистую камфору и т. д.).
Из средств антиоксидантной терапии наиболее эффективны кортикостероиды. Из средств антигипоксантной терапии применяют пирацетам, кокарбоксилазу, АТФ.
Применение антикоагулянтов показано в случаях угрожающего повторного тромбоза и эмболии сосудов мозга (например, при заболеваниях клапанного аппарата сердца).
Больным с ишемическим инсультом. показаны кардиотонические средства (коргликон и др.).
Для улучшения кровоснабжения мозга применяют вазоактивные средства.
После острой стадии ишемического инсульта показаны противоотечные средства, гормоны; сердечно-сосудистые препараты постепенно отменяют. В этом периоде необходимо обеспечить правильное положение парализованных конечностей для предупреждения образования патологических поз и контрактур.
В восстановительном периоде проводят ЛФК, массаж, назначают аминокислоты, биостимуляторы, вазоактивные препараты (аминалон, глутаминовая кислота, церебролизин, ноотропил, алоэ, теоникол, стугерон и т. д.), антихолинэстеразные средства (прозерин, галантамин). При спастичности мышц показаны миорелаксанты (баклофен, реланиум, мидокалм).
Восстановительное лечение проводят длительно, при наличии остаточных признаков очагового поражения — не менее 1 года.
Б. Лeбeдeв и др.