Синдром легочного сердца — Руководство по клинической электрокардиографии детского возраста
Страница 69 из 84
СИНДРОМ ЛЕГОЧНОГО СЕРДЦА
Под условным понятием «синдром легочного сердца» мы объединили изменения сердца у детей, первопричиной которых являются патологические процессы в легких речь идет об острых и хронических воспалительных заболеваниях в легких, бронхиальной астме, тромбоэмболиях легочной артерии, некоторых врожденных наследственных легочных заболеваниях и др. Классификация этих заболеваний — самостоятельный и большой вопрос. Частично мы его обсуждали в предыдущих работах (1977, 1976, 1979 и др.).
Здесь коснемся лишь диагностики легочного сердца с помощью электрокардиографии.
Классическое острое легочное сердце у детей развивается при ожоговой болезни генез его многофакторный, однако ведущая роль в его возникновении, как нам представляется, принадлежит эмболии легочной артерии. В результате разрушения жировой клетчатки, коагуляции белковых структур и других факторов в бассейн легочной артерии поступает множество эмболов, которые и ведут к развитию острого легочного сердца. Автору приходилось видеть, как в течение короткого времени меняется в этих случаях электрокардиограмма. Вначале (буквально в первые часы термического ожога) имеет место резчайшая перегрузка правых отделов сердца, которая в последующем (при благоприятном течении процесса) исчезает. Видимо, аналогичное явление может иметь место при остро развившейся эмфиземе легких, синдроме дыхательных расстройств у новорожденных и др. л в единичных случаях при острых пневмониях. При последних скорее развивается подострое легочное сердце. И наконец, хроническое легочное сердце у детей может развиться при длительно существующих заболеваниях легких.
Рис. 219. Электрокардиограмма Лили К. 3 лет (Диагноз см. рис. 218), тяжелое состояние.
3-й сутки заболевания. Объяснение в тексте.
Рис. 220. Электрокардиограмма Лили К. 3 лет, на 6-е сутки заболевания. Объяснение в тексте
Изменения на электрокардиограмме при остром, подостром и хроническом легочном сердце сводятся к появлению признаков, указывающих на перегрузку и гипертрофию правых отделов сердца. Выраженность этих признаков не всегда коррелирует с клиническими и рентгенологическими находками.
221. Электрокардиограмма Лили К. 3 лет, перед выпиской из стационара. Объяснение в тексте.
222. Электрокардиограмма Сережи Г. 1 года. Диагноз: двухсторонняя пневмония, тяжелая форма, 1-й день заболевания. Объяснение в тексте.
Нередко (особенно при ателектазах, плевральных выпотах, деформациях грудной l. гки и др.) признаки перегрузки (гипертрофии) перекрываются позиционными факторами. Трудности в диагностике перегрузки сердца возникают у детей периода гюрожденности, когда имеет место «физиологическая перегрузка правых отделов
Рис. 223. Электрокардиограмма Сережи Г. 1 года (диагноз см. рис. 222), на 4-е сутки заболевания. Объяснение в тексте.
признаки перегрузки отчетливые. Конечно, эти изменения имеют место у детей. выраженной дыхательной недостаточностью при тяжелых и среднстяжелых формах пневмоний. Обычно документируется перегрузка объемом. На электрокардиограмме регистрируются rSr’ или RSr’, или RSR’ комплексы в правых прекардиальных отведениях. Однократно записанные электрокардиограммы могут позволить трактовать эти находки как неполную или полную блокаду правой ветви предсердножелудочкового пучка (Гиса). Однако в большинстве случаев (если последней не было на исходной ЭКГ) эти явления преходящи и обусловлены перегрузкой выходного отдела правого желудочка (синдром правого наджелудочкового гребешка
Рис. 224. Электрокардиограмма Сережи Г. 1 года, в день выписки из стационара.
Рис. 225. Электрокардиограмма Оксаны О. 4 мес. Диагноз: двухсторонняя пневмония, разгар заболевания. Объяснение в тексте.
Приводим еще одно наблюдение.
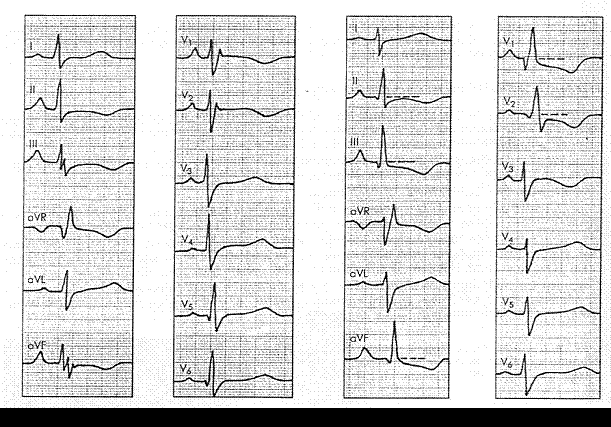
Мальчик Сережа Г. 1 года, двухсторонняя очаговая пневмония, тяжелая форма, дыхательная недостаточность. В первый день заболевания на электрокардиограмме (рис. 222) имеются признаки повышенной электрической активности правого желудочка. На 4-е сутки заболевания, в разгар его (рис. 223), определяется полифазный комплекс QRSHI v, (тип SiQii и RsrYyj) глубокий и симметричный Tv. Все это указывает на развившуюся объемную перегрузку правого желудочка, и одновременно имеются данные о повышении электрической
Рис. 226. Электрокардиограмма Оксаны О. 4 мес, выздоровление. Объяснение в тексте.
Рис. 227. Электрокардиограмма Ани С, 7 лет. Диагноз: хроническая пневмония.
Объяснение в тексте.
активности миокарда левого желудочка (высокие Rv56> а также блокада 2:1 в V2_- В день выписки из стационара на электрокардиограмме (рис. 224) документируется нормализация показателей..
При обследовании более 200 детей раннего возраста с острой пневмонией синдром перегрузки правого желудочка документировался в 45% наблюдений а случаях тяжелого и среднетяжелого течения заболевания.
Рис. 228. Электрокардиограмма Сережи К. 1 года. Диагноз: первичная легочная гипертензия. Объяснение в тексте.
При деструктивных формах пневмонии и септических состояниях с пневмониями синдром перегрузки правых отделов сердца, регистрируется только в 8 — 10% наблюдений, а преобладают признаки глубоких дистрофических изменений в миокарде л нарушения сердечного ритма.
Оксана О. 4 мес. Диагноз: тяжелая двухсторонняя пневмония.
На электрокардиограмме (рис. 225): на фоне синусовой аритмии глубокие дистрофические изменения в миокарде (сглаженные и отрицательные зубцы Т, особенно в прекардиальных отведениях). Признаки умеренной перегрузки правых отделов сердца (глубокие отрицательные TV[_, и смещение сегмента ST книзу). По выздоровлении перед выпиской
из стационара (рис. 226) морфология электрокардиографической кривой соответствует варианту нормы детей этого возраста, сохраняется синусовая тахикардия. Быстрая динамика электрокардиографических показателей утверждает дистрофический, а не воспалительный их характер.
При обследовании детей с хроническими неспецифическими заболеваниями легких выявлена легочная гипертензия в 34 —38 % случаев, подтвержденная зондированием.
Рис. 229. Вектор-электрокардиограмма ребенка M. 3 мес. Диагноз: синдром Wilson —Mikity. Объяснение в тексте.
Более выраженные изменения на электрокардиограмме встречаются приблизительно в 6 — 8% всех случаев. Кроме описанных, имеют место признаки увеличения правого предсердия, более отчетливый Sm ш тип кривой, сочетающийся с глубокими Sy5 .
R-тип гипертрофии миокарда правого желудочка нам не встретился. Отклонение AQRS вправо обычно выражено нерезко (до +90 — 95 ).
Более яркие электрокардиографические изменения имеют место при врожденных поражениях легких и легочных сосудов.
Ребенок Сережа К. 1 года. Диагноз: врожденная первичная легочная гипертензия, подтвержденная на аутопсии. При жизни давление в правом желудочке 115 55 мм рт. ст. з легочной артерии 110/45 мм рт. ст.
На векторкардиограмме (рис. 228) определяется выраженная гипертрофия миокарда правого желудочка. Петля QRS смещена в верхние октанты системы координат (больше и передневерхние), изменено направление записи петли QRS во II и III проекциях на ЭКГ: высокие зубцы R в отведениях III, aVR, W и V4R. Заключение: гипертрофия правого
желудочка. На аутопсии толщина свободной стенки правого желудочка 1 см; левого — 0,6 см. Порок сердца не обнаружен.
Ребенок М. 3 мес. Диагноз: интерстициальная мононуклеарная очаговая фиброзирующая пневмония (синдром Wilson — Mikity). На аутопсии обнаружены эмфизема легких и склероз сосудов, клеточная инфильтрация мононуклеарными клетками, резкая гипертрофия миокарда правого желудочка.
На векторэлектрокардиограмме (рис. 229) признаки гипертрофии миокарда правого желудочка (R-тип гипертрофии по ЭКГ и ВКГ ; z_a= +110°).
/ синдромы легких
1. Основные клинические синдромы при заболеваниях легких
Синдром легочного уплотнения:
1. Инфильтрат (пневмонический, туберкулезный, эозинофильный).
2. Инфаркт легкого (тромбоэмболия, тромбоз).
3. Ателектаз (обтурационный, компрессионный, синдром средней доли).
1. Жидкость в плевральной полости (транссудат, экссудативный плеврит).
2. Воздух в плевральной полости (пневмоторакс).
Синдром полости (распадающиеся абсцесс и опухоль, каверна).
Бронхообструктивный синдром:
1. Обтурация или сужение бронха.
2. Спазм бронха.
Синдром гипервоздушности легких (различные виды эмфиземы).
Пикквикский синдром и синдром апноэ во время сна (синдром ночного апноэ).
Синдром дыхательной недостаточности:
1. Острая дыхательная недостаточность (в том числе дистресс-синдром взрослых).
2. Хроническая дыхательная недостаточность.
Выделение указанных синдромов происходит прежде всего при использовании основных методов обследования больного — осмотра, пальпации, перкуссии, аускультации.
Синдром легочного уплотнения .
Синдром легочного уплотнения — одно из наиболее выраженных проявлений легочных заболеваний. Сущность его состоит в значительном уменьшении или полном исчезновении воздушности легочной ткани на более или менее распространенном участке (сегмент, доля, одновременно несколько долей). Очаги уплотнения различаются по локализации (нижние участки, верхушки легких, средняя доля и т.д.), что также имеет дифференциально-диагностическое значение; специально выделяют субплевральную локализацию очага уплотнения с вовлечением висцерального и содружественно париетального листков плевры, что сопровождается присоединением признаков плеврального синдрома. Развитие уплотнения может происходить достаточно быстро (острая пневмония, инфаркт легкого) или постепенно (опухоль, ателектаз).
Различают ряд разновидностей легочного уплотнения: инфильтрат (пневмонический очаг) с выделением склонного к казеозному распаду туберкулезного инфильтрата; инфаркт легкого в связи с тромбоэмболией или местным сосудистым тромбозом; обтурационный (сегментарный или долевой) и компрессионный ателектаз (спадение, коллапс легкого) и гиповентиляция; вариантом ателектаза является гиповентиляция средней доли вследствие обтурации среднедолевого бронха (бронхопульмональными лимфатическими узлами, фиброзной тканью), который, как известно, и в норме недостаточно полно вентилирует долю — синдром средней доли; опухоль легкого; застойная сердечная недостаточность.
Субъективные проявления синдрома легочного уплотнения различны в зависимости от природы уплотнения и рассматриваются при описании соответствующих заболеваний.
Общим объективным признаком развивающегося снижения воздушности соответствующего уплотнению участка легочной ткани является асимметрия грудной клетки, выявляемая при осмотре и пальпации.
Вне зависимости от природы данного синдрома при больших очагах уплотнения и их поверхностном расположении можно обнаружить выбухание и отставание при дыхании этого участка грудной клетки (и только при большом обтурационном ателектазе возможно втяжение ее), голосовое дрожание усилено. Перкуторно определяется притупление (или абсолютная тупость) в области уплотнения, а при наличии инфильтрата (пневмония), в начальной стадии и в период рассасывания, когда альвеолы частично свободны от экссудата, а дренирующие бронхи сохраняют полную проходимость (а значит, содержат воздух), притупление сочетается с тимпаническим оттенком перкуторного звука. Такой же притупленно-тимпанический оттенок при перкуссии отмечается в начальной стадии развития ателектаза, когда в альвеолах еще есть воздух и сохранено сообщение с приводящим бронхом. В дальнейшем при полном рассасывании воздуха появляется тупой перкуторный звук. Над опухолевым узлом также отмечается тупой перкуторный звук.
Аускультативно в зоне инфильтрата в начальной и конечной стадиях воспаления, когда в альвеолах экссудата мало и они расправляются при поступлении воздуха, выслушиваются ослабленное везикулярное дыхание и крепитация. В разгар пневмонии вследствие заполнения альвеол экссудатом везикулярное дыхание исчезает и заменяется бронхиальным. Такая же аускультативная картина отмечается при инфаркте легкого. При любом ателектазе в начальной стадии (гиповентиляция), когда в зоне спадения еще происходит небольшая вентиляция альвеол, отмечается ослабление везикулярного дыхания. Затем после рассасывания воздуха в случае компрессионного ателектаза (сдавление легкого извне жидкостью или газом плевральной полости, опухолью, при высоком стоянии диафрагмы) выслушивается бронхиальное дыхание: остающийся проходимым для воздуха бронх проводит бронхиальное дыхание, которое распространяется на периферию уплотненным поджатым участком легкого. При обтурационном ателектазе (уменьшение просвета приводящего бронха эндобронхиальной опухолью, инородным телом, сдавление его извне) в стадии полной закупорки бронха над безвоздушной зоной никакого дыхания выслушиваться не будет. Дыхание также не будет выслушиваться над участком опухоли. Бронхофония при всех видах уплотнений повторяет закономерности, выявленные с помощью определения голосового дрожания.
При аускультации над субплеврально расположенными инфильтратом и опухолью, а также при инфаркте легкого определяется шум трения плевры.
Поскольку нередко при различных вариантах уплотнения вовлекаются в процесс бронхи, можно обнаружить разнокалиберные (влажные хрипы. Особое диагностическое значение имеет выслушивание мелкопузырчатых звонких хрипов, свидетельствующих о наличии вокруг мелких бронхов зоны инфильтрации, усиливающей возникающие в бронхах звуковые колебания.
При сердечной недостаточности выявляется снижение воздушности легочной ткани, прежде всего в нижних отделах легких с обеих сторон, что связано с застоем крови в малом круге кровообращения. Это сопровождается укорочением перкуторного звука, иногда с тимпаническим оттенком, снижением экскурсии нижнего края легких, ослаблением везикулярного дыхания, появлением влажных мелкопузырчатых хрипов, иногда крепитации.
2. Плевральный синдром
Плевральный синдром — это совокупность симптомов, характерных для поражения плевральных листков (воспаление, опухоль) и (или) накопления в плевральной полости жидкости (экссудат, транссудат, кровь, гной) или газа; иногда воспаление листков плевры (сухой плеврит) предшествует появлению плевральной жидкости; кроме того, в плевральной полости могут одновременно выявляться жидкость и газ.
При сухом плеврите во время дыхания отмечается отставание пораженной половины грудной клетки, поскольку из-за выраженной болезненности больной щадит эту область. Аускультативно над пораженной половиной грудной клетки констатируется грубый шум трения плевры, одинаково громко звучащий на всем протяжении вдоха и выдоха, перекрывающий везикулярное дыхание; иногда трение плевры хорошо ощутимо при пальпации.
Скопление в плевральной полости жидкости (гидроторакс), которая может быть экссудатом, транссудатом, гноем (пиоторакс, эмпиема плевры), кровью (гемоторакс) или носить смешанный характер, сопровождается сглаженностью межреберных промежутков и даже выбуханием пораженной половины грудной клетки, отставанием при дыхании, голосовое дрожание на эту сторону не проводится. При сравнительной перкуссии определяется резкое притупление или абсолютная тупость перкуторного звука, над верхней границей которой плохо вентилируемое поджатое легкое придает ему притупленно-тимпанический оттенок. При топографической перкуссии выявляются особенности верхней границы притупления, которая, как уже говорилось, может иметь разное направление в зависимости от характера жидкости, а также значительное ограничение подвижности нижнего края поджатого легкого. Аускультативно над зоной тупости выявляется резкое ослабление везикулярного дыхания или чаще его отсутствие, выше этой зоны — ослабление везикулярного дыхания, а при косом направлении верхней линии зоны тупости (экссудативный плеврит) часть более поджатого легкого (ближе к позвоночнику) прилежит к крупным бронхам, поэтому образуется участок, где на фоне притупленно-тимпанического перкуторного звука выслушивается бронхиальное дыхание (треугольник Гарленда). При экссудативном плеврите иногда выделяют еще один небольшой участок, прилежащий к позвоночнику в нижней части зоны тупости и уже на здоровой стороне, где в результате некоторого смещения аорты определяются притупление перкуторного звука и отсутствие дыхания при аускультации (треугольник Раухфусса-Грокко).
О наличии в плевральной полости газа (пневмоторакс) свидетельствуют характерные симптомы, позволяющие диагностировать это состояние еще до рентгенографии. При осмотре и пальпации на пораженной половине грудной клетки выявляются сглаженность межреберий, отставание при дыхании, ослабление голосового дрожания. Перкуторный звук над этой зоной носит тимпа-нический характер, при большом пневмотораксе нижняя граница тимпанита опускается ниже обычной границы легких за свет расширения плевральных синусов.
При одновременном наличии газа и жидкости (гидропневмоторакс, пиопневмоторакс, гемопневмоторакс) перкуторно над пораженной половиной грудной клетки обнаруживается сочетание тупого (нижняя часть) и тимпанического (верхняя часть) оттенков звука.
Аускультация позволяет выявить отсутствие везикулярного дыхания (или его резкое ослабление), а при так называемом клапанном пневмотораксе, когда имеется сообщение плевральной полости и дыхательных путей, а с каждым вдохом в нее поступает новая порция воздуха, можно выслушать бронхиальное дыхание (также только на вдохе).
синдром бронхообструктивный легочный пикквикский
3. Синдром полости
Синдром полости включает признаки, появление которых связано с наличием каверны, абсцессов, кисты, т.е. образований, имеющих плотную, более или менее гладкую стенку, нередко окруженную инфильтративным или фиброзным валом. Полость может быть заполнена целиком только воздухом (пустая полость) или содержать, кроме воздуха, то или иное количество жидкости, оставаться закрытой или сообщаться с дренирующим бронхом. Все это, безусловно, отражается на особенностях симптоматики, которая зависит также от величины полости и глубины ее расположения.
При больших, поверхностно расположенных и изолированных полостях вне зависимости от их содержимого голосовое дрожание ослаблено. Если полость сообщается с бронхом и хотя бы частично содержит воздух, перкуторный звук будет иметь тимпанический оттенок; над полостью, заполненной жидкостью, отмечается притупление или абсолютная тупость. При аускультации над изолированной воздушной полостью дыхание не выслушивается; если воздушная полость имеет сообщение с дренирующим бронхом, будет выслушиваться бронхиальное дыхание, которое легко проводится от места образования (голосовая щель) по воздушному столбу и может приобрести в результате резонанса в гладкостенной полости металлический оттенок (амфорическое дыхание). Полость, частично содержащая жидкость, является источником образования влажных хрипов, которые, как правило, носят звонкий характер, так как их проведение усиливается окружающей уплотненной (инфильтрированной) тканью. Кроме того, аускультативно можно уловить самостоятельный стенотический шум, усиливающий бронхиальное дыхание, возникающий в месте сообщения полости (каверны) с дренирующим бронхом.
Следует отметить, что все указанные симптомы, характеризующие синдром полости, нередко весьма динамичны, поскольку отмечается стадийность в развитии полостного образования, особенно абсцесса легкого: частичное или полное опорожнение сменяется накоплением жидкости, что отражается на особенностях реречисленных выше симптомов наличия полости, содержащей роздух или жидкость.
4. Бронхообструктивный синдром
Бронхообструктивный синдром (синдром бронхиальной обструкции) проявляется тяжелым продуктивным, реже непродуктивным кашлем, а также симптомами закономерно развивающихся последствий длительного его существования — признаками эмфиземы легких. В основе клинических проявлений бронхообструктивного синдрома лежат нарушение бронхиальной проходимости, связанные с ним затрудненная и неравномерная вентиляция (преимущественно за счет ограничения скорости выдоха) и увеличение остаточного объема легких. При истинном синдроме бронхиальной обструкции речь идет об изменении проходимости мелких бронхов (их называют в связи с этим «ахиллесовой пятой» бронхов). Нарушение проходимости мелких бронхов возникает чаще всего в связи с воспалением и отеком слизистой оболочки бронхов (хронический бронхит, аллергический компонент), бронхоспазмом, обычно с отеком слизистой оболочки (бронхиальная астма), реже — при диффузном перибронхиальном фиброзе, сдавливающем бронхи извне.
Хронический бронхит наиболее часто приводит к развитию необратимых воспалительно-рубцовых изменений мелких бронхов и представляет основу хронической обструктивной болезни легких, главными клиническими признаками которой являются следующие:
1. кашель с густой и вязкой мокротой;
2. клинические и функциональные признаки обструкции дыхательных путей;
3. нарастающая одышка;
4. развитие «легочного сердца» (cor pulmonale), терминальной дыхательной и сердечной недостаточности.
Курение сигарет — наиболее частый этиологический и поддерживающий прогрессирование болезни фактор. Благодаря частоте цианоза и сердечной недостаточности больных с хроническим обструктивным бронхитом описывают как «синих отечников». При этом варианте обструктивного синдрома вслед за воспалительным отеком слизистой оболочки терминальных бронхиол, приводящим к гиповентиляции альвеол, снижению парциального давления кислорода и повышению парциального давления углекислого газа — гипоксемии и гиперкапнии, возникают спазм альвеолярных капилляров и гипертензия малого круга кровообращения. Формируется легочное сердце, декомпенсация которого проявляется периферическими отеками.
Другой распространенной причиной хронической обструктивной болезни легких является обструктивная эмфизема, при которой цианоз обычно не выражен, больных называют «розовыми пыхтельщиками». В этом случае также отмечается бронхиальная обструкция, но она особенно проявляется на выдохе, когда имеется спадение бронхиол при потере эластических свойств альвеол, с чем связаны увеличение объема альвеол, уменьшение числа альвеолярных капилляров, отсутствие шунтирования крови (в отличие от первого варианта сохранение вентиляционно-перфузионных отношений) и нормальный ее газовый состав. Курение при эмфиземе легких является основным этиологическим фактором, хотя у некоторых больных причиной болезни могут быть вдыхание загрязнителей воздуха и дефицит a-1-антитрипсина.
Чаще всего хроническая обструктивная болезнь легких — это сочетание указанных состояний, что делает бронхообструктивный; синдром очень распространенным, а, учитывая серьезность последствий, своевременное выявление синдрома и обусловливающих его болезней, их лечение, а главное — профилактиа представляют чрезвычайную важность.
Поскольку при бронхообструктивном синдроме объективных симптомов значительно меньше, чем при других больших легочных синдромах, следует отметить чрезвычайное клиническое значение кашля не только как жалобы больного и признака поражения бронхов, но и как фактора, усугубляющего изменения легочной паренхимы при синдроме бронхиальной обструкции. Основные признаки данного синдрома — это симптомы его осложнения, рсимптомы эмфиземы легких, которые описываются ниже. Но все же имеются признаки нарушенной бронхиальной проходимости как таковой. К ним в первую очередь относятся выявляемые с ьпомощью аускультации — жесткое везикулярное дыхание с удлинением выдоха, хрипы, причем по особенностям хрипов можно судить не только о степени сужения бронхов, но и об уровне обструкции. Важный аускультативный показатель бронхиальной обструкции — нарушение соотношения вдоха и выдоха, появление удлиненного грубого выдоха. Наконец, большое клиническое значение для обнаружения нарушенной бронхиальной проходимости имеют показатели функции внешнего дыхания, особенно скоростные, в частности с использованием формированного выдоха (упомянутая выше проба Тиффно и др.).
5. Синдром гипервоздушности легких
Синдром гипервоздушности легких чаще всего является следствием длительно существующего затрудненного выдоха (бронхиальная обструкция), что приводит к повышению остаточного объема легких, хроническому механическому воздействию на эластический аппарат альвеол, их растяжению, необратимой потере способности к спадению, увеличивающей величину остаточного объема. Типичный вариант этого синдрома — эмфизема легких, обычно развивающаяся постепенно. Острое вздутие легких встречается редко.
Таким образом, имеется тесная связь между бронхообструктивным синдромом и эмфиземой легких, которая поэтому чаще всего носит обтурационный (обструктивный) характер. Значительно реже встречается компенсаторная (в том числе викарная) эмфизема, развивающаяся в ответ на медленное нарастание диффузного фиброза легких. В связи с тем что бронхообструктивный синдром чаще имеет генерализованный характер, эмфизема легких — двусторонний процесс. Клиническими признаками ее являются бочкообразная грудная клетка со сниженной дыхательной подвижностью, слабое проведение голосового дрожания, наличие распространенного коробочного перкуторного звука, который может замещать зону абсолютной сердечной тупости, смещение нижнего края легких вниз, равномерное ослабление везикулярного дыхания, аускультативные признаки бронхообструктивного синдрома (хрипы, удлиненный выдох).
Следует подчеркнуть, что указанные признаки выявляются при далеко зашедшем эмфизематозном процессе; безусловно, имеет значение обнаружение более ранних симптомов, к которым относится по существу один — уменьшение дыхательной экскурсии нижнего легочного края, которое со временем постепенно нарастает, что обнаруживается задолго до появления признаков выраженного вздутия легких.
6. Пикквикский синдром и синдром апноэ во время сна
Представляют интерес пикквикский синдром и синдром апноэ во время сна (симптом ночного апноэ), которые обычно упоминаются в разделе болезней системы органов дыхания (хотя прямого отношения к заболеваниям легких они не имеют), так как их основное проявление — дыхательная недостаточность с гипоксией и гипоксемией — развивается при отсутствии первичной болезни легких.
Пикквикский синдром — это симптомокомплекс, включающий выраженную альвеолярную гиповентиляцию и обусловленные ею гипоксию и гиперкапнию (РСО2 выше 50 мм рт. ст.), дыхательный ацидоз, а также непреодолимую сонливость в дневное время, полицитемию, высокий уровень гемоглобина, эпизоды апноэ. Причиной такой гиповентиляции считают значительное ожирение с преимущественным отложением жира в области живота при небольшом росте; по-видимому, имеет значение генетическая чувствительность к такой гиповентиляции. Для этих пациентов характерны продолжительный период тяжелого (морбидного) ожирения с дополнительной резкой прибавкой массы тела, развитие легочного сердца, одышка при нагрузке, цианоз, отеки ног, утренние головные боли, но самым типичным симптомом является патологическая сонливость, в том числе во время разговора, за едой, чтением и в других ситуациях. Представляет интерес тот факт, что снижение массы тела приводит у части больных к обратному развитию основных признаков симптомокомплекса.
Хотя впервые на связь внезапно возникающей сонливости и периодического апноэ с массивным ожирением было указано в начале XIX века, термин «пикквикский синдром» стал употребляться после того, как У. Ослер обнаружил эти симптомы у героя «Посмертных записок Пикквикского клуба» Ч. Диккенса — тучного мальчика Джо: «…На козлах сидел жирный краснолицый парень, погруженный в дремоту… — Несносный мальчишка, — сказал пожилой джентльмен, — он опять уснул! — Удивительный мальчик — произнес мистер Пикквик. — Неужели он всегда так спит? — Спит! — подтвердил старый джентльмен. — Он всегда спит. Во сне исполняет приказания и храпит, прислуживая за столом».
Пикквикский синдром, как и вообще наличие избыточной массы тела, нередко сопровождается рецидивирующим ночным апноэ.
В настоящее время все больше внимания уделяется нарушениям дыхания во время сна, в частности обструктивному синдрому ночного апноэ. Считается, что подобными нарушениями страдает около 1% населения. Важнейший анамнестический признак этого синдрома — беспорядочный и громкий храп («богатырский» храп), прерывающийся длительными паузами, иногда достигающими 2 мин. Такие остановки дыхания приводят к гипоксии, которая обусловливает церебральные и сердечные нарушения. Кроме данного признака, у таких людей в течение дня, на первый взгляд, немотивированно значительно ограничена работоспособность.
Ночное апноэ — синдром, характеризующийся эпизодами превращения дыхания продолжительностью 10 с и более, периодически повторяющимися во время сна, гипоксемией, надрывным храпом. Патогенетически выделяют 2 типа ночного апноэ: центральный, причиной которого являются нарушения центральной регуляции дыхания, а также обструктивный, к которому приводят завладение мягкого неба, корня языка, гиперплазия небных миндалин, аденоидов, дефекты развития нижней челюсти, языка, вызывающие временные нарушения проходимости верхних дыхательных путей. С практических позиций важно выделять обструктивный механизм остановки дыхания во время сна, поскольку он значительно повышает риск внезапной смерти, особенно у лиц с избыточной массой тела, а также у злоупотребляющих алкоголем. Этот риск может быть уменьшен настойчиво проводимым лечением по снижению массы тела.
Клиническая картина синдрома ночного апноэ складывается из описанных эпизодов прекращения дыхания, громкого храпа, сонливости в дневное время, снижения памяти и способности концентрировать внимание, повышенной дневной усталости, а также артериальной гипертензией в утренние часы, не контролируемой обычным лечением. Чаще встречается у мужчин среднего возраста, как уже отмечалось, с избыточной массой тела, однако может проявляться и у детей. Следует отметить возможное сочетание гипотиреоза и обструктивного типа апноэ во время сна.
Для диагностики синдрома используют мониторное наблюдение во время сна с записью электроэнцефалограммы, характера дыхания, ЭКГ (для регистрации возможных аритмий), оксигенометрию для определения уровня гипоксемии.
Синдром ночного апноэ считают выраженным и потенциально опасным при частоте более 5 приступов в час и длительностью более 10 с каждый. Некоторые авторы считают, что затянувшийся приступ может привести к внезапной смерти во время сна. Снижение массы тела, отказ от алкоголя и седативных средств, но особенно постоянное дыхание во время сна с помощью специальной маски, обеспечивающей поступление воздуха через нос под давлением, считаются сейчас
наиболее эффективными методами лечения при обструктивном синдроме ночного апноэ. Подобранный с помощью мониторного наблюдения оптимальный уровень давления для вдоха позволяет потоку вдыхаемого воздуха преодолевать сопротивление, апноэ не возникает, уменьшается дневная сонливость, нормализуется артериальное давление.
7. Синдром дыхательной недостаточности
Синдром дыхательной недостаточности — один из самых больших и важных пульмонологических синдромов, поскольку его возникновение свидетельствует о появлении изменений основной функции органов дыхания — функции газообмена, включающей, как уже говорилось, легочную вентиляцию (поступление воздуха в альвеолы), диффузию (газообмен в альвеолах) и перфузию (транспорт кислорода), в результате чего нарушается поддержание нормального газового состава крови, что на первых этапах компенсируется более интенсивной работой системы внешнего дыхания и сердца. Обычно дыхательная недостаточность развивается у больных, страдающих хроническими заболеваниями легких, приводящими к появлению эмфиземы легких и пневмосклероза, но она может возникнуть и у больных с острыми заболеваниями, сопровождающимися выключением из дыхания большой массы легких (пневмония, плеврит). В последнее время специально выделяют острый дистресс-синдром взрослых.
Дыхательная недостаточность является прежде всего следствием нарушенной вентиляции легких (альвеол), поэтому выделяют два основных типа этого синдрома — обструктивный и рестриктивный.
В основе обструктивной дыхательной недостаточности лежит нарушение проходимости бронхов, поэтому наиболее частыми заболеваниями, приводящими к развитию обструктивного типа дыхательной недостаточности, являются хронический бронхит и бронхиальная астма. Важнейший клинический признак обструктивной дыхательной недостаточности — сухие хрипы на фоне удлиненности выдоха. Проба Тиффно и пневмотахометрия являются важными методами для подтверждения и оценки динамики бронхиальной обструкции, а также для уточнения степени выраженности бронхоспазма как причины обструкции, поскольку введение бронхорасширяющих средств в этих случаях улучшает показатели пробы Тиффно и пневмотахометрии.
Второй тип нарушения функции дыхания — рестриктивный — возникает из-за невозможности полноценного расправления альвеол при поступлении в них воздуха, свободно проходящего по дыхательным путям. Основными причинами рестриктивной дыхательной недостаточности являются диффузное поражение легочной паренхимы (альвеол и интерстиция), например фиброзирующий альвеолит, множественные легочные инфильтраты, трудно расправляющийся массивный компрессионный ателектаз легкого при плеврите, гидротораксе, пневмотораксе, опухоли, резкое ограничение подвижности легкого при распространенном спаечном процессе в плевре и выраженном ожирении (пикквикский синдром), а также параличе дыхательных мышц, в том числе нарушение функции диафрагмы (центральные нарушения дыхания, дерматомиозит, полиомиелит). При этом показатели пробы Тиффно и пневмотахометрии не изменены.
Следствием несоответствия вентиляции легких метаболизму тканей при дыхательной недостаточности является нарушение газового состава крови, проявляющееся гиперкапнией, когда РСО2 составляет больше 50 мм рт. ст. (норма — до 40 мм рт. ст.) и гипоксемией — снижение РО2 до 75 мм рт. ст. (норма — до 100 мм рт. ст.).
Наиболее часто гипоксемия (как правило, без гиперкапнии) возникает при рестриктивном типе дыхательной недостаточности в отличие от ситуаций, когда имеется выраженная гиповентиля-ция, вызывающая гипоксемию и гиперкапнию.
Гипоксемия и гиперкапния особенно опасны для тканей мозга и сердца, так как вызывают существенные и даже необратимые изменения функции этих органов — вплоть до глубокой мозговой комы, терминальных сердечных аритмий.
По выраженности основных клинических признаков, таких как одышка, цианоз, тахикардия, обычно судят о степени дыхательной недостаточности. Важным критерием степени дыхательной недостаточности является влияние на них физической нагрузки, что в первую очередь относится к одышке, возникающей вначале (I степень дыхательной недостаточности) только при физическом напряжении; II степень — появление одышки при незначительной физической нагрузке; при III степени одышка беспокоит больного и в состоянии покоя. Синхронно с одышкой нарастает тахикардия. Газовый состав крови меняется при II степени, но особенно при III степени дыхательной недостаточности, когда он остается измененным и в состоянии покоя.
Газета «Новости медицины и фармации» 10 (416) 2012
Вернуться к номеру
Хроническое легочное сердце в практике врача-терапевта и пульмонолога
Авторы: В.В. Косарев, д.м.н. профессор, С.А. Бабанов, д.м.н. профессор — Кафедра профессиональных болезней и клинической фармакологии ГОУ ВПО «Самарский государственный медицинский университет», Россия
Версия для печати
Хроническое легочное сердце (ХЛС) — это гипертрофия правого желудочка на почве заболеваний, нарушающих структуру или функцию легких, или и то и другое одновременно, за исключением случаев, когда изменения в легких сами являются результатом первичного поражения левых отделов сердца (например, стенозом левого атриовентрикулярного отверстия, постинфарктным кардиосклерозом и т.д.) или врожденных пороков сердца и крупных кровеносных сосудов [1–21]. При остром и подостром варианте легочного сердца (ЛС) гипертрофия правых отделов сердца, как правило, развиться не успевает.
Впервые этот термин предложен в 1935 г. (М. Джинн и Уайт). Из отечественных ученых в XIX в. проблему легочного сердца изучали Г.И. Сокольский (1838 г.), Э.И. Изаксон (1870 г.), С.П. Боткин (1886 г.), а в XX в. крупным вкладом в учение о легочном сердце стали труды Б.Е. Вотчала, определившие современные подходы к классификации, патогенезу, ранней диагностике и принципам лечения этого состояния [1–3].
Острое легочное сердце развивается при тромбоэмболии легочных артерий, спонтанном пневмотораксе, тяжелом приступе бронхиальной астмы, тяжелой пневмонии за несколько часов или дней. Проявляется внезапно возникающей давящей болью за грудиной, резкой одышкой, цианозом, артериальной гипотонией, тахикардией, усилением и акцентом II тона сердца над легочным стволом; отклонением электрической оси сердца вправо и электрокардиографическими признаками перегрузки правого предсердия (ПП); быстро нарастающими признаками правожелудочковой недостаточности — набуханием шейных вен, увеличением и болезненностью печени. Подострое легочное сердце возникает в течение нескольких недель, месяцев и наблюдается при повторных мелких тромбоэмболиях, узелковом периартериите, карциноматозе легких, повторных приступах тяжелой бронхиальной астмы, ботулизме, миастении. Хроническое легочное сердце характеризуется постепенным и медленным (в течение нескольких лет) формированием легочной артериальной гипертензии и развитием гипертрофии правого желудочка (ПЖ) (компенсированное хроническое легочное сердце). В дальнейшем по мере повышения давления в легочной артерии развивается систолическая дисфункция правого желудочка и появляются признаки правожелудочковой недостаточности (декомпенсированное хроническое легочное сердце) .
Этиология
По этиологической классификации, разработанной Комитетом экспертов ВОЗ (1961), выделяют 3 группы заболеваний, ведущих к формированию легочного сердца:
1. Заболевания, первично влияющие на прохождение воздуха в легких и альвеолах. К этой группе относится 21 нозология: хронический бронхит, бронхиальная астма, эмфизема легких, туберкулез, пневмокониозы, бронхоэктатическая болезнь, саркоидоз, эозинофильная гранулема, бериллиоз, хронический диффузный интерстициальный фиброз, системная красная волчанка и др.
2. Заболевания, первично влияющие на движения грудной клетки: кифосколиоз и другие деформации грудной клетки, плевральный фиброз, хронические нервно-мышечные заболевания (например, полиомиелит), альвеолярная гиповентиляция, в том числе идиопатическая, а также состояние после торакопластики.
3. Заболевания, первично поражающие легочные сосуды: первичная легочная гипертензия (ЛГ), узелковый полиартериит, другие артерииты, тромбозы и эмболии (в том числе паразитарные) сосудов легких, сдавление ствола легочной артерии и легочных вен опухолями средостения, аневризмой и др. [1, 2, 4, 5].
Факторы риска хронического легочного сердца соответствуют основному заболеванию, но физическая нагрузка и стресс могут вызвать острое, частично обратимое ухудшение процесса.
Патогенез
Основным звеном патогенеза хронического легочного сердца является уменьшение суммарного поперечного сечения сосудов легких. При этом у пациентов, относящихся к 1-й и 2-й группе заболеваний по классификации ВОЗ, это происходит вследствие спазма мелких легочных артерий в ответ на альвеолярную гипоксию. Этот феномен был описан впервые в 1946 г. Von Euler и Liliestrand (феномен Эйлера — Лильестранда). У больных, относящихся к 3-й группе, сужение легочных артерий возникает не только вследствие вазоспазма, которому не предшествует альвеолярная гипоксия, но также из-за сужения или закупорки их просвета в результате тромбозов и эмболий, некротизирующего артериита (первичная легочная гипертензия (ПЛГ), системные васкулиты) [5–8].
1.Гипоксическая легочная вазоконстрикция
Первичным звеном в развитии хронического легочного сердца является альвеолярная гипоксия, которой подвержены больные, страдающие хроническими обструктивными заболеваниями легких (хроническим обструктивным бронхитом, бронхиальной астмой) с преобладанием признаков обструктивной дыхательной недостаточности (bluebloaters — «синие одутловатые»). Именно эти больные отличаются выраженной неравномерностью легочной вентиляции, что обусловливает значительные нарушения вентиляционно-перфузионных соотношений, усугубляет альвеолярную гипоксию и приводит к генерализованному проявлению механизма гипоксической легочной вазоконстрикции. У пациентов с преобладанием рестриктивных нарушений и диффузными поражениями легких альвеолярная гипоксия выражена значительно меньше. Например, больные с выраженной диффузной эмфиземой легких (pinkpuffers — «розовые пыхтящие») гораздо меньше подвержены развитию легочной гипертензии и хронического легочного сердца [6]. Механизм гипоксической легочной вазоконстрикции до конца не ясен. Вероятно, он реализуется при участии симпатоадреналовой системы (САС), а также вазоконстрикторных эндотелиальных факторов. Эндотелины и ангиотензин II прямо стимулируют сокращение гладкой мускулатуры сосудистой стенки, тогда как снижение синтеза простагландина GI2, эндотелиального расслабляющего фактора (NО) еще больше усиливает эти вазоконстрикторные влияния. Увеличение ангиотензинпревращающего фермента (АПФ) вызывает повышение сосудистого тонуса и общего периферического сопротивления сосудов (ОПСС). АПФ одновременно участвует в инактивации NO в легких, что вызывает потерю легочными сосудами способности отвечать вазодилатацией на эндотелиозависимые субстанции [6–8, 21]. Кроме того, ангиотензин II оказывает как прямое, так и опосредованное действие (через активацию симпатоадреналовой системы) на миокард и сосуды, что вызывает повышение артериального давления (АД). Многочисленными исследованиями показано, что эндотелин-1 — мощный вазоконстриктор эндотелиального происхождения, обладающий пролиферативным и профибротическим эффектами, играет важную патогенетическую роль в развитии легочной гипертензии. Эндотелин — растворимый пептид, регулирующий кровоток на уровне микрососудов и микроциркуляторного русла. Эндотелин индуцирует увеличение содержания ионов кальция, ведущих к вазоконстрикции. Его уровень в крови повышен у больных при всех формах легочной гипертензии [17].
2. Влияние гиперкапнии
Гиперкапния (увеличение концентрации СО2 в крови) также способствует развитию легочной гипертензии. Однако высокая концентрация С2 действует не прямо на тонус легочных сосудов, а опосредованно — преимущественно через обусловленный ею ацидоз (снижение рН меньше 7,2). Кроме того, задержка двуокиси углерода способствует снижению чувствительности дыхательного центра к CO2, что еще больше уменьшает вентиляцию легких и способствует легочной вазоконстрикции.
3.Анатомические изменения легочного сосудистого русла
Большое значение в патогенезе легочной гипертензии имеют структурные изменения в сосудистом русле. к которым относятся: сдавление и запустевание артериол и капилляров вследствие постепенно прогрессирующих фиброза легочной ткани и эмфиземы легких; развитие утолщения сосудистой стенки за счет гипертрофии мышечных клеток медии и появления продольного слоя миоцитов в интиме, что сопровождается уменьшением просвета легочных артериол и способствует увеличению выраженности и длительности вазоконстрикторных реакций; множественные микротромбозы, возникающие в условиях хронического нарушения кровотока и повышенной агрегации тромбоцитов; рецидивирующие тромбоэмболии мелких ветвей легочной артерии; развитие бронхопульмональных анастомозов, т.е. анастомозов между ветвями бронхиальных артерий, относящихся к большому кругу кровообращения, и разветвлениями легочной артерии. Поскольку давление в бронхиальных артериях выше, чем в малом круге кровообращения, происходит перераспределение крови из системы бронхиальных артерий в систему ветвей легочной артерии, что существенно увеличивает легочное сосудистое сопротивление. Васкулиты (например, при системных заболеваниях соединительной ткани) также характеризуются пролиферацией интимы, сужением и облитерацией просвета сосудов. Все перечисленные патологические изменения сосудистого русла легких закономерно приводят к прогрессирующему увеличению легочного сосудистого сопротивления и развитию легочной гипертензии. Выраженный эритроцитоз и полицитемия. характерные для многих бронхолегочных заболеваний, сопровождаются увеличением агрегации эритроцитов и вязкости крови, что еще больше затрудняет кровоток по сосудистому руслу легких, увеличивая его сопротивление. Кроме того, повышение вязкости и замедление кровотока способствуют образованию пристеночных тромбов мелких ветвей легочной артерии. Увеличение сердечного выброса обусловлено тахикардией и гиперволемией, которые весьма характерны для больных хроническим легочным сердцем. Одной из возможных причин гиперволемии, по-видимому, является гиперкапния, способствующая увеличению концентрации альдостерона в крови и, соответственно, задержке Na+ и воды.
В сосудах легких также отмечаются два типа системных изменений. Для прекапиллярной (артериальной) гипертензии малого круга кровообращения характерен гипертрофически-гиперпластический тип перестройки сосудов, а при выраженном кардиопульмональном синдроме с легочно-сердечной недостаточностью преобладают процессы склерозирования и атрофии. Уменьшение суммарного поперечного сечения сосудов легких приводит к возрастанию общего легочного сосудистого сопротивления и давления в малом круге кровообращения. В этих условиях правые отделы сердца, и в первую очередь правый желудочек, испытывают перегрузку давлением, а в дальнейшем, при развитии недостаточности трехстворчатого клапана, — и объемом. Это приводит к гипертрофии и дилатации правого сердца. С течением болезни может произойти срыв компенсации — развивается правожелудочковая недостаточность, которая является терминальной стадией данного состояния. У больных хронической обструктивной болезнью легких (ХОБЛ) нередко развивается вторичная симптоматическая пульмогенная артериальная гипертензия, связанная с состоянием бронхиальной системы [9–12]. К пульмогенной гипертензии следует относить случаи повышения системного АД на фоне обострения легочного процесса, сопровождающиеся значительными изменениями функции внешнего дыхания и снижением парциального давления кислорода крови. Различают две фазы пульмогенной гипертензии — лабильную и стабильную, а также бронхообструктивный и бронхонагноительные ее типы [7, 8].
Патологическая анатомия
Патологоанатомическими признаками хронического легочного сердца являются толщина стенки правого желудочка более 5 мм, масса правого желудочка более 70 г у мужчин и более 60 г у женщин; желудочковый индекс более 0,6 (масса правого желудочка/масса левого желудочка (ЛЖ) = 0,4–0,6); гипертрофия капиллярных мышц правого желудочка, которая вызывает синдром относительной недостаточности трехстворчатого клапана, т.е. капиллярный порок. Хроническое легочное сердце может иметь различные анатомические характеристики в зависимости от особенностей основного заболевания, наличия и степени компенсаторных возможностей миокарда (компенсированное легочное сердце или в стадии декомпенсации). В одних случаях (чаще при необструктивных формах патологии легких) выявляются гипертрофия трабекулярного аппарата и расширение желудочка при некотором утолщении стенки, увеличение вначале приносящего, а позже и выносящего тракта, что в совокупности характерно для перегрузки правого желудочка как давлением, так и объемом. Такой тип гипертрофии определяется, например, при первичной легочной артериальной гипертензии. В других случаях преобладают признаки перегрузки желудочка давлением: гипертрофия самой стенки, иногда резко выраженная, при умеренной гипертрофии трабекулярного аппарата. Толщина стенки правого желудочка может превосходить толщину стенки левого. Верхушка сердца формируется за счет миокарда правого желудочка, а не левого, как в норме. В стадии компенсации мышца правого желудочка упругая, розового цвета; форма желудочка сохранена. При декомпенсированном легочном сердце мышца дряблая, желтоватого цвета, форма желудочка изменена; отмечаются признаки хронического застойного полнокровия в органах. Микроскопически при хроническом легочном сердце определяются гипертрофия мышечных волокон, огрубение стромы, утолщение эндокарда, дистрофические изменения кардиомиоцитов, нарастающие в период декомпенсации ХЛС.
Классификация
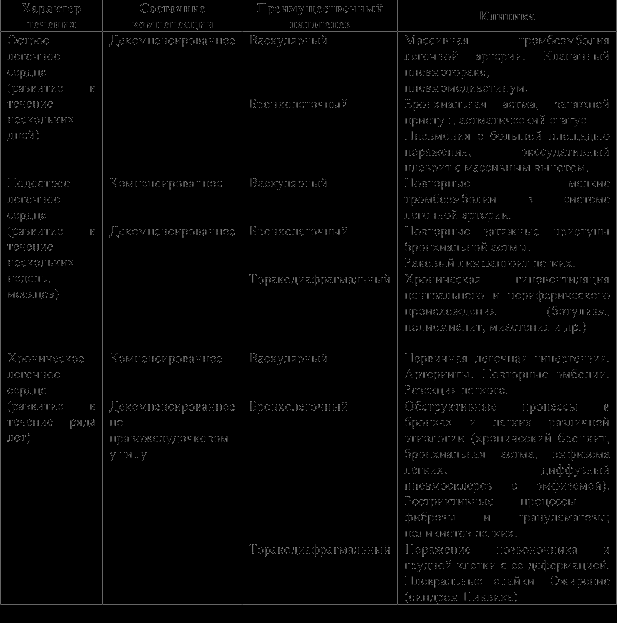
Хроническое легочное сердце по фазе течения может быть компенсированным и декомпенсированным [5, 6]. Согласно классификации, предложенной Б.Е. Вотчалом в 1964 г. выделяют три основные формы ХЛС: васкулярную, бронхолегочную и торакодиафрагмальную. Васкулярная форма легочного сердца развивается при легочных васкулитах, первичной легочной гипертензии, горной болезни, рецидивирующей тромбоэмболии легочных артерий, резекции легкого. Бронхолегочная форма наблюдается при диффузном поражении бронхов и легочной паренхимы [5] — при хронической обструктивной болезни легких, тяжелом течении бронхиальной астмы, бронхиолите, эмфиземе легких, диффузном пневмосклерозе и фиброзах легких в исходе неспецифических пневмоний, туберкулезе, пневмокониозе, саркоидозе, синдроме Хаммена — Рича (диффузный фиброзирующий альвеолит), рестриктивных процессах — фиброзы и гранулематозы. Торакодиафрагмальная форма легочного сердца развивается при значительных нарушениях вентиляции и кровотока в легких вследствие деформации грудной клетки (кифосколиозы и др.), патологии плевры, диафрагмы (при торакопластике, массивном фибротораксе, болезни Бехтерева), пиквикском синдроме, синдроме ночного апноэ.
Классификация легочной гипертензии при хронических неспецифических заболеваниях легких Н.Р. Палева дополняет классификацию Б.Е. Вотчала. В данной классификации выделяют три стадии развития хронического легочного сердца: I стадия (доклиническая) характеризуется транзиторной легочной гипертензией с признаками напряженной деятельности правого желудочка, которые выявляются только при инструментальном исследовании; II стадия определяется по наличию признаков гипертрофии правого желудочка и стабильной легочной гипертензии при отсутствии недостаточности кровообращения; III стадия, или стадия декомпенсированного легочного сердца (син. легочно-сердечная недостаточность), наступает со времени появления первых симптомов недостаточности правого желудочка.
Клиническая картина
Одышка является наиболее характерным субъективным проявлением легочной гипертензии. Однако на ранних стадиях развития заболевания ее трудно отличить от проявлений собственно дыхательной недостаточности (ДН), характерной для больных с хроническими воспалительными процессами в легких. Одышка при легочной гипертензии возникает в результате ограничения легочного кровотока, вызванного генерализованным спазмом артериол, уменьшением их просвета, микротромбозами и тромбоэмболиями мелких ветвей легочной артерии, а также запустевания легочного сосудистого русла. Это приводит к нарушению оксигенации крови в легких, артериальной гипоксемии и раздражению дыхательного центра. Следует, правда, иметь в виду, что ощущение одышки не всегда соответствует выраженности артериальной гипоксемии, гиперкапнии и уровню давления в легочной артерии.
Тахикардия является весьма характерным, хотя и неспецифичным, признаком легочной гипертензии. Нередко она может быть проявлением дыхательной недостаточности и рефлекторного повышения активности симпатоадреналовой системы у больных с артериальной гипоксемией.
Боли в области сердца
Хотя боли в области сердца и не носят характера типичной стенокардии, принято считать, что причиной их возникновения является относительная коронарная недостаточность. обусловленная значительным увеличением мышечной массы правого желудочка, относительно недостаточным развитием капиллярной сети, рефлекторным спазмом правой коронарной артерии, затруднением коронарного кровотока в правом желудочке в связи с повышением в нем конечно-диастолического давления. Вероятно, имеет также значение инфекционно-токсическое поражение миокарда, а также пульмонокардиальный рефлекс.
Слабость, повышенная утомляемость, тяжесть в нижних конечностях
Эти симптомы обусловлены преимущественно нарушением перфузии периферических органов и тканей. возникающим на определенной стадии болезни (уменьшение сердечного выброса, периферическая вазоконстрикция), а также в результате характерной для больных с дыхательной недостаточностью артериальной гипоксемии. Определенное значение имеют, вероятно, нарушения периферического кровотока, вызванные активацией САС и ренин-ангиотензин-альдостероновой системой.
Отеки на ногах
Отеки на ногах — одна из наиболее характерных жалоб больных с декомпенсированным легочным сердцем. Вначале отеки локализуются в области стоп и лодыжек, появляются у больных к вечеру, а к утру могут проходить. По мере прогрессирования правожелудочковой недостаточности отеки распространяются на область голеней и бедер и могут сохраняться в течение всего дня, усиливаясь к вечеру.
Абдоминальные расстройства
К проявлениям хронической правожелудочковой недостаточности у больных легочным сердцем относятся также жалобы на боли или чувство тяжести в правом подреберье. связанные с увеличением печени и растяжением глиссоновой капсулы. Нельзя исключать, что эти расстройства особенно часто возникают у пациентов с сопутствующим абдоминальным атеросклерозом. В тяжелых случаях правожелудочковой недостаточности отмечается быстрое увеличение живота в объеме за счет формирующегося асцита .
Церебральные расстройства
Церебральные расстройства чаще выявляются у больных с тяжелой дыхательной недостаточностью и декомпенсированным легочным сердцем. Выраженная энцефалопатия у этих больных возникает в результате хронической гиперкапнии и гипоксии головного мозга, а также нарушений сосудистой проницаемости и отека головного мозга. При этом у части больных наблюдаются повышенная возбудимость, агрессивность, эйфория и даже психозы. У других больных энцефалопатия проявляется вялостью, подавленностью, сонливостью днем и бессонницей ночью, головокружениями, мучительными головными болями. В тяжелых случаях могут возникать эпизоды потери сознания, сопровождающиеся судорогами. Возможен коллаптоидный вариант течения заболевания, характеризующийся эпизодами резкой слабости, головокружений, внезапным снижением артериального давления, профузным холодным потом и тахикардией.
Осмотр
Внешний вид больных с компенсированным легочным сердцем неспецифичен и отражает внешние проявления основного заболевания легких, дыхательной недостаточности. Возможен центральный цианоз, усиливающийся при наклоне больного вперед. У больных с выраженной гиперкапнией иногда появляется своеобразный болезненный румянец на щеках. обусловленный патологическим расширением периферических сосудов под действием СО2. Выявляются также расширение и увеличение количества сосудов на коже и конъюнктивах, что также связывают с действием хронической гиперкапнии. При тяжелой ДН даже у больных компенсированным легочным сердцем иногда можно обнаружить так называемые «кроличьи (или лягушачьи) глаза эмфизематика». обусловленные заметным расширением и увеличением количества сосудов конъюнктивы. У больных с хроническим легочным сердцем часто развивается булавовидная деформация концевых фаланг пальцев по типу барабанных палочек (finger clubbing), так называемые пальцы Гиппократа (digiti Hippocratici), что связано с нарушением трофики надкостницы и вегетативной иннервации на фоне длительной эндогенной интоксикации и гипоксемии.
Декомпенсированное легочное сердце
У больных с декомпенсированным легочным сердцем наряду с клиническими признаками, описанными выше, появляются некоторые симптомы, указывающие на наличие застоя крови в венозном русле большого круга кровообращения и значительное повышение центрального венозного давления.
Выраженный цианоз — один из важных внешних признаков декомпенсированного легочного сердца. При возникновении правожелудочковой недостаточности у больных легочным сердцем цианоз нередко приобретает смешанный характер: определяется выраженный цианоз губ, кончиков пальцев рук и ног, кончика носа, подбородка, ушей. Характерно, что даже на фоне хронического застоя крови в венозном русле большого круга кровообращения конечности в большинстве случаев остаются теплыми, возможно, в связи с периферической вазодилатацией, обусловленной гиперкапнией.
Отеки нижних конечностей у больных декомпенсированным легочным сердцем обусловлены преимущественно застоем крови в большом круге кровообращения и повышением гидростатического давления. Отеки локализуются на стопах, голенях, а у тяжелых больных, длительно сохраняющих постельный режим, — в области поясницы. Набухание шейных вен является важным клиническим признаком повышения центрального венозного давления и застоя крови в венах большого круга кровообращения. Набухание вен шеи вместе с центральным цианозом бывает особенно значительным при приступах мучительного малопродуктивного кашля у больных с обструктивным бронхитом или при приступах бронхиальной астмы.
Нередко набухание шейных вен у больных хроническим легочным сердцем больше выражено во время вдоха. что свидетельствует о значительном повышении центрального венозного давления и затруднении кровотока из крупных вен в правом предсердии и правом желудочке (симптом Куссмауля).
В тяжелых случаях можно выявить абдоминально-югулярный (гепатоюгулярный) рефлюкс — увеличение набухания шейных вен при надавливании рукой на переднюю брюшную стенку.
Лицо у больных с правожелудочковой недостаточностью нередко одутловато, кожа желтовато-бледная со значительным цианозом губ, кончика носа, ушей, рот полуоткрыт, глаза тусклые (так называемое лицо Корвизара ). В терминальной стадии хронической правожелудочковой недостаточности у больных хроническим легочным сердцем иногда развивается сердечная кахексия. причинами которой являются нарушения функции органов брюшной полости, вызванные застоем крови в системе воротной вены: ухудшение всасывания в кишечнике, снижение белково-синтетической функции печени, выраженная анорексия, тошнота, рвота и т.п.
Выявляются признаки эмфиземы легких. Грудная клетка приобретает бочкообразную форму, определяются развернутый (больше 90°) эпигастральный угол, увеличение межреберных промежутков, сглаженность или выбухание надключичных ямок. Перкуторный звук над легкими становится коробочным, верхние границы легких смещены вверх, нижние — вниз. Уменьшена дыхательная экскурсия нижнего края легких. В более редких случаях выявляется кифосколиотическая форма грудной клетки, которая также может явиться причиной вентиляционных расстройств и формирования хронического легочного сердца. При аускультации на фоне разнообразных изменений основных дыхательных шумов, как правило, выслушиваются сухие и/или влажные хрипы, крепитация, что в большинстве случаев позволяет уточнить характер основного патологического процесса в легких. Жидкость в плевральной полости (гидроторакс) — только при декомпенсированном легочном сердце и наличии застоя крови в венах большого круга кровообращения.
Осмотр, пальпация и перкуссия сердца
Наиболее характерно появление сердечного толчка — выраженной разлитой пульсации слева от грудины, в зоне абсолютной тупости сердца, а также в эпигастральной области, обусловленной гипертрофированным и дилатированным правым желудочком.
Аускультация сердца
Наиболее характерным аускультативным признаком легочной гипертензии является акцент II тона на легочной артерии. Расщепление II тона во II межреберье слева от грудины, также нередко выявляемое у больных с легочной гипертензией, обычно указывает на замедление изгнания крови из гипертрофированного правого желудочка, более позднее закрытие створок клапана легочной артерии и, соответственно, более позднее формирование пульмонального компонента II тона. I тон сердца может быть несколько ослаблен за счет более медленного сокращения гипертрофированного и дилатированного правого желудочка. Правожелудочковый IV тон сердца иногда выявляется при выраженной гипертрофии правого желудочка. Его появление у больных с легочным сердцем косвенно может указывать на наличие выраженной диастолической дисфункции правого желудочка и увеличение вклада ПП в его диастолическое наполнение. При возникновении систолической дисфункции правого желудочка и выраженной его объемной перегрузки иногда выявляется правожелудочковый патологический III тон сердца. В далеко зашедших случаях легочного сердца при выраженной дилатации правого желудочка может развиться относительная недостаточность трехстворчатого клапана. проявляющаяся аускультативно систолическим шумом, усиливающимся на высоте вдоха (симптом Риверо — Корвалло). Это объясняется увеличением объема регургитации и ускорением кровотока через правые отделы сердца.
Наконец, в редких случаях в месте аускультации легочной артерии (II межреберье слева от грудины) и вдоль левого края грудины выслушивается мягкий, дующий диастолический шум, начинающийся сразу после II тона. Шум обусловлен относительной недостаточностью клапана легочной артерии вследствие ее расширения, связанного с длительным существованием легочной гипертензии.
Гепатомегалия
Выявляется практически у всех больных декомпенсированным легочным сердцем. Печень увеличена в размерах, при пальпации уплотнена, болезненна, край печени закруглен. Выраженная правожелудочковая недостаточность сопровождается появлением свобод-ной жидкости в брюшной полости — асцитом.
Диагностика
Диагностика легочной артериальной гипертензии
Диагностика хронического легочного сердца до наступления его декомпенсации основывается на поисках симптомов легочной АГ и гипертрофии правых отделов сердца у угрожаемого контингента больных. Наиболее важными критериями диагноза легочной АГ являются: определяемые аускультативно акцент и расщепление II тона над легочной артерией; рентгенологические признаки: выбухание ствола легочной артерии; усиление сосудистого рисунка корней легкого при относительной светлой периферии; усиление пульсации в центральных полях легких и ослабление его в периферических отделах; увеличение диаметра правой нисходящей ветви легочной артерии; линии Керли (Kerley). Эти горизонтальные узкие затемнения над реберно-диафрагмальным синусом. Полагают, что они вызываются расширением лимфатических сосудов и утолщением заключающих их в себя межлобулярных щелей. При наличии линии Керли имеется легочное капиллярное давление, превышающее 20 мм рт.ст. (в норме 5–7 мм рт.ст.).
Диагностика гипертрофии и/или дилатации правого желудочка
Признаками гипертрофии ПЖ являются: систолическая перикардиальная и эпигастральная пульсация, расширение абсолютной и относительной сердечной тупости, перкуторный звук над рукояткой грудины с тимпаническим оттенком, а над мечевидным отростком становится притупленно-тимпаническим или совсем глухим; глухие тоны сердца, в проекции трехстворчатого клапана — усиление I тона. При возникновении относительной недостаточности трехстворчатого клапана может появиться систолический шум над мечевидным отростком или слева от грудины. Расщепление II тона. Оцениваются прямые и косвенные признаки гипертрофии правых отделов сердца по Widimsky. Наличие двух или более прямых признаков — достоверное, несомненное доказательство гипертрофии ПЖ, одного прямого и одного (или более) косвенного — вероятное, одного прямого или одного косвенного — сомнительное.
Динамический контроль центрального венозного давления
Является важным диагностическим критерием, особенно при состояниях, сопровождающихся острой дыхательной недостаточностью. В норме центральное венозное давление равно 5–12 см вод.ст.
Рентгенологическое исследование
Позволяет уточнить характер поражения легких. а также выявить несколько важных рентгенологических признаков, указывающих на увеличение размеров правого желудочка и наличие легочной гипертензии: выбухание ствола легочной артерии в правой передней косой проекции и реже в прямой проекции (расширение II дуги левого контура сердца), расширение корней легких, увеличение размеров правого желудочка в правой и левой передней, а также в левой боковой проекциях и уменьшение ретростернального пространства, значительное выбухание заднего контура тени сердца вплоть до сужения ретрокардиального пространства, что наблюдается при выраженной гипертрофии и дилатации правого желудочка, который смещает ЛЖ кзади, расширение ствола и центральных ветвей легочной артерии, которое сочетается с обеднением сосудистого рисунка на периферии легочных полей за счет сужения мелких легочных артерий. В последнее время доказана возможность использования магнитно-резонансной томографии и мультиспиральной компьютерной томографии в диагностике легочной гипертензии. Данные методы позволяют выявить расширение правых отделов сердца, дилатацию ствола и крупных ветвей легочной артерии [14].
Эхокардиографическое исследование
У больных с хроническим легочным сердцем проводится с целью объективного подтверждения наличия гипертрофии правого желудочка (при толщине передней стенки правого желудочка, превышающей 5 мм) и ПП (ПП и ЛП имеют примерно одинаковые размеры, дилатация ПП приводит к доминированию его изображения), оценки систолической функции правого желудочка. Эта оценка основана прежде всего на выявлении признаков дилатации (при дилатации диастолический размер правого желудочка из парастернального доступа по короткой оси сердца обычно превышает 30 мм). Сократимость правого желудочка чаще всего оценивается визуально — по характеру и амплитуде движения передней стенки правого желудочка и межжелудочковой перегородки (МЖП). Например, объемная перегрузка правого желудочка у больных с декомпенсированным легочным сердцем характеризуется не только расширением его полости, но также усиленной пульсацией его стенок и парадоксальными движениями МЖП: во время систолы МЖП прогибается в полость правого желудочка, а во время диастолы — в сторону ЛЖ. Систолическая дисфункция правого желудочка может быть оценена по степени коллабирования нижней полой вены во время вдоха. В норме на высоте глубокого вдоха коллабирование нижней полой вены составляет примерно 50 %. Недостаточное ее спадение на вдохе указывает на повышение давления в ПП и в венозном русле большого круга кровообращения — определение давления в легочной артерии. Диагностика легочной артериальной гипертензии необходима для оценки тяжести течения и прогноза хронического легочного сердца. С этой целью используется допплеровское исследование формы потока крови в выносящем тракте правого желудочка и в устье клапана легочной артерии. При нормальном давлении в легочной артерии форма потока крови приближается к куполообразной и симметричной, а при легочной гипертензии становится треугольной или двухпиковой. Количественное определение систолического давления в легочной артерии (СДЛА) возможно при использовании постоянно-волнового допплеровского исследования трикуспидальной регургитации, а диастолического давления — при оценке максимальной скорости диастолической регургитации крови из легочной артерии в правом желудочке.
Катетеризация правых отделов сердца
Является основным методом прямого измерения давления в легочной артерии. Исследование проводят в специализированных клиниках, используя плавающий катетер Свана — Ганца. Катетер вводится через внутреннюю яремную, наружную яремную, подключичную или бедренную вену в правое предсердие, затем в правый желудочек и легочную артерию, измеряя давление в этих камерах сердца. Когда катетер находится в одной из ветвей легочной артерии, баллончик, расположенный на конце катетера, раздувают. Кратковременная окклюзия сосуда позволяет измерять давление окклюзии легочной артерии (давление заклинивания — ДЗЛА), которое примерно соответствует давлению в легочных венах, ЛП и конечно-диастолическому давлению в ЛЖ. При катетеризации полостей сердца и легочной артерии у больных хроническим легочным сердцем выявляют достоверные признаки легочной гипертензии — значения давления в легочной артерии больше 25 мм рт.ст. в покое или больше 35 мм рт.ст. при нагрузке. При этом остается нормальным или даже пониженным давление заклинивания легочной артерии — не больше 10–12 мм рт.ст. Напомним, что для больных с левожелудочковой недостаточностью или пороками сердца, сопровождающимися венозным застоем крови в легких, повышенное давление в легочной артерии сочетается с повышением давления заклинивания в легочной артерии до 15–18 мм рт.ст. и выше.
Исследование функции внешнего дыхания
Как было показано выше, в основе возникновения легочной АГ и формирования хронического легочного сердца в большинстве случаев лежат нарушения функции внешнего дыхания, ведущие к развитию альвеолярной гипоксии и легочной артериальной гипоксемии. Поэтому тяжесть течения, прогноз и исходы хронического легочного сердца, а также выбор наиболее эффективных способов лечения этого заболевания во многом определяются характером и выраженностью нарушений функции легких.
Дифференциальная диагностика
Дифференциальная диагностика с гипертрофией правого желудочка при первичной патологии сердца — непременное условие диагноза легочного сердца. В редких случаях поздней диагностики ХЛС (в стадии декомпенсации с кардиомегалией) необходимо его дифференцировать с пороками сердца, дилатационной кардиомиопатией, кардиосклерозом в исходе ишемической болезни сердца. Клинически в пользу легочного сердца свидетельствует резко выраженный цианоз, поскольку декомпенсация легочного сердца наступает обычно при высокой степени дыхательной недостаточности с уровнем гипоксемии, который практически никогда не наблюдается при первичной патологии сердца. Исключением являются вено-артериальные шунты при врожденных дефектах перегородок сердца и патологических соустьях между аортой и легочным стволом. В этих случаях ингаляция больным 100% кислорода не приводит к уменьшению гипоксемии и цианоза, который при дыхательной недостаточности в тех же условиях резко уменьшается или исчезает. Тщательное рентгенологическое исследование и эхокардиография при всех вышеуказанных болезнях сердца позволяют выявить гипертрофию или дилатацию его левых отделов, при клапанных пороках на эхокардиограммах определяются изменения пораженных клапанов, а с помощью допплер-эхокардиографии могут быть установлены патологические потоки крови через дефекты перегородок. В процессе ведения пациентов с ХЛС раннее выявление декомпенсации правого желудочка сердца часто связано с дифференциальной диагностикой сердечной и дыхательной недостаточности, поскольку последняя (особенно при бронхиальной обструкции) проявляется рядом сходных симптомов вплоть до развития периферических отеков (вследствие гипоксии почек, надпочечников). При этом учитывают следующие основные различия: повышение венозного давления и набухание шейных вен при бронхиальной обструкции связаны с экспираторным повышением внутригрудного давления и исчезают на вдохе, в то время как при правожелудочковой недостаточности шейные вены в период вдоха не спадаются; преимущественное проявление диффузного цианоза на кистях, стопах может имитировать акроцианоз за счет сердечной недостаточности, но в отличие от последней при диффузном цианозе кисти рук остаются теплыми; опущение края печени на 2–5 см ниже края ребер за счет эмфиземы легких не сочетается с изменением ее размеров при перкуссии по Курлову, как это происходит у больных с увеличением печени вследствие недостаточности правого желудочка, при которой нередко определяется также гепатоюгулярный рефлюкс (давление на выступающий край печени ладонью приводит к набуханию шейных вен).
Отеки при сердечной недостаточности развиваются постепенно, им предшествует никтурия; введение строфантина приводит к увеличению диуреза, в то время как отеки, которые связывают только с дыхательной недостаточностью, появляются на фоне тяжелой гипоксии, не уменьшаются после применения сердечных гликозидов и исчезают после устранения гипоксии, например путем оксигенобаротерапии (однако это не исключает связи отеков с сердечной недостаточностью, возникающей вследствие гипоксии миокарда и исчезающей после ее устранения).
Диагностика торакодиафрагмального сердца часто сложна, надо всегда помнить о возможности его развития при кифосколиозе, болезни Бехтерева и др. Наиболее важные признаки — раннее появление цианоза и заметное усиление одышки без приступов удушья. Синдром Пиквика характеризуется триадой симптомов — ожирение, сонливость, выраженный цианоз. Впервые этот синдром описал Чарльз Диккенс в «Посмертных записках Пиквикского клуба», он часто связан с черепно-мозговой травмой, ожирение сопровождается жаждой, булимией, артериальной гипертензией. Нередко развивается сахарный диабет. Официально синдром Пиквика получил название только в 1956 году. До этого изображенный Диккенсом «слуга — жирный парень по имени Джо, который мог заснуть когда угодно и где угодно» просуществовал практически не замеченным медициной в течение 119 лет. Считается, что название синдрому дали доктор Баруелл и его коллеги, опубликовавшие в одном из медицинских журналов историю болезни больного с «синдромом Пиквика — чрезвычайным ожирением, ассоциированным с альвеолярной гиповентиляцией».
ХЛС при первичной легочной гипертензии называется болезнью Аерза (описан в 1901 г.). Полиэтиологическое заболевание неясного генеза, преимущественно болеют женщины от 20 до 40 лет. Патоморфологическими исследованиями установлено, что при первичной легочной гипертензии происходит утолщение интимы прекапиллярных артерий, т.е. в артериях мышечного типа отмечается утолщение медии, и развивается фибриноидный некроз с последующим склерозом и быстрым развитием легочной гипертензии. Симптомы разнообразны: обычно жалобы на слабость, утомляемость, боли в сердце или в суставах, у 1/3 больных могут появляться обмороки, головокружения, синдром Рейно. В дальнейшем нарастает одышка — признак, свидетельствующий, что первичная легочная гипертензия переходит в стабильную завершающую стадию. Быстро нарастает цианоз, который выражен до степени чугунного оттенка, становится постоянным, быстро нарастают отеки. Диагноз первичной легочной гипертензии устанавливается методом исключения. Наиболее часто этот диагноз патологоанатомический. У этих больных вся клиника прогрессирует без фона в виде обструктивного или рестриктивного нарушения дыхания. При эхокардиографии давление в легочной артерии достигает максимальных цифр. Лечение малоэффективно, смерть наступает от тромбоэмболии.
Лечение
Несмотря на достигнутые за последние десятилетия очевидные успехи в терапии хронического легочного сердца, смертность больных остается высокой. При наличии развернутой клинической картины ХЛС 2-летняя выживаемость больных составляет 45 %, а продолжительность жизни в среднем колеблется от 1,3 до 3,8 года, поэтому поиск новых средств, позволяющих ее увеличить, весьма актуален. Лечение легочной гипертензии (ЛГ) и ХЛС должно быть этиотропным [13–19].
Профилактические мероприятия должны быть направлены на соблюдение режима труда и отдыха. К общим рекомендациям для больных с ЛС можно отнести соблюдение режима труда и отдыха с исключением чрезмерных физических нагрузок, особенно у пациентов с признаками недостаточности кровообращения. Следует избегать простудных заболеваний и прежде всего гриппа, которые могут приводить к значительному ухудшению клинического состояния больных с хроническими бронхолегочными заболеваниями и ПЛГ. Пребывание в условиях высокогорья также может привести к ухудшению состояния, так как усиливает вазоконстрикцию в ответ на альвеолярную гипоксию, развивающуюся в горах. Женщинам с ПЛГ при выборе метода контрацепции следует иметь в виду, что противозачаточные таблетки могут вызвать прокоагуляционные изменения в свертывающей системе крови и вследствие этого приводить к утяжелению состояния.
Необходим полный отказ от курения (в том числе и пассивного), по возможности — избегание переохлаждения и профилактика острых респираторных вирусных инфекций, так как у многих больных ведущей причиной в развитии и прогрессировании ХЛС является инфекционно-воспалительный процесс, что требует назначения антибактериальных средств в период его обострения. Показано применение бронхолитической, муколитической и отхаркивающей терапии по показаниям при бронхиальной астме и хронической обструктивной болезни легких [7, 9, 13, 14]. Применяются стимуляторы b-адренергических рецепторов короткого (сальбутамол, фенотерол) и длительного действия (сальметерол, форматерол), холинолитики короткого (ипратропиум бромид) и длительного действия (тиотропиум, метилксантины — теофиллин, теопэк, теодур и др.). Применяются также муколитики и мукорегуляторы.
При туберкулезе легких — противотуберкулезные средства, при необходимости — хирургическое лечение. При профессиональных заболеваниях легких (пневмокониозы, хронический пылевой бронхит, экзогенный аллергический альвеолит) — прекращение контакта с профессиональными вредностями. При интерстициальных заболеваниях легких — глюкокортикоиды, цитостатические средства, интерферон, при сдавлении извне легочной артерии и вен — хирургическое лечение, при деформации грудной клетки — хирургическая и ортопедическая коррекция, при синдроме ночного апноэ — диета, специальные методики (SIPAP-терапия).
На всех этапах течения ХЛС патогенетическим средством является оксигенотерапия — единственный метод, способный увеличить продолжительность жизни больных. Вследствие повышения парциального давления кислорода в альвеолах и увеличения его диффузии через альвеолярно-капиллярную мембрану достигается уменьшение гипоксемии, что нормализует легочную и системную гемодинамику, восстанавливает чувствительность рецепторов клеток к лекарственным веществам. Показаниями для назначения кислородотерапии являются следующие клинические симптомы, возникающие у больного с дыхательной недостаточностью (А.П. Зильбер): выраженный цианоз; тахипноэ; тахикардия или брадикардия; системная артериальная гипотензия или гипертензия; признаки метаболического ацидоза; признаки артериальной гипоксемии (парциальное давление кислорода в артериальной крови — РаО2 — ниже 65 мм рт.ст.).
Кислород ингалируют через носовые канюли, лицевую маску. Очень редко у взрослых используются кислородные палатки. Лечение SPO2 имеет свои ограничения: при передозировке есть опасность гипероксического поражения ткани легкого. Наиболее приемлемым методом контроля оксигенотерапии является пульсоксиметрия, определяющая степень насыщения гемоглобина крови SPO2. Нормальная величина SPO2 находится в диапазоне 94–98 %. Снижение данного показателя до 90–94 % рассматривается как умеренная гипоксемия, до 85–90 % — как выраженная.
В стационарах для ингаляции кислорода обычно используют носовой катетер, что создает меньше дискомфорта для пациента, позволяя ему говорить, принимать пищу, кашлять и т.д. При этом во вдыхаемой смеси создается достаточно безопасная концентрация кислорода, не превышающая 40 %. Это позволяет длительно, на протяжении нескольких дней или даже недель, осуществлять оксигенотерапию, не опасаясь развития ее осложнений. В некоторых случаях оксигенотерапию проводят с помощью лицевой маски, которая обеспечивает более высокую концентрацию кислорода. Нельзя использовать для оксигенотерапии вдыхание 100% кислорода, так как это способствует угнетению дыхательного центра и развитию гиперкапнической комы. Следует также помнить, что при ингаляции кислорода требуется обязательное увлажнение вдыхаемой кислородной смеси. Продолжительность оксигенотерапии зависит от тяжести состояния больного и колеблется от 60 мин 3–4 раза в день до 14–16 ч в сутки. В некоторых случаях эффект может быть получен только через 3–4 недели ежедневной оксигенотерапии. Для получения кислорода могут использоваться так называемые концентраторы (пермеаторы), выделяющие кислород из воздуха. Они позволяют добиться концентрации кислорода во вдыхаемой смеси около 40–50 % и могут использоваться в домашних условиях при необходимости длительной (в течение нескольких месяцев) оксигенотерапии. При неэффективности самостоятельного дыхания кислородом и парциальном давлении СО2 в артериальной крови (РСО2) более 60 мм рт.ст. целесообразно использовать методы искусственной вспомогательной вентиляции легких.
Коррекция легочного сосудистого сопротивления
Вторым направлением лечения больных с хроническим легочным сердцем является применение некоторых медикаментозных средств, снижающих повышенное легочное сосудистое сопротивление (величину постнагрузки на правый желудочек), приток крови к правым отделам сердца (уменьшение преднагрузки), объем циркулирующей крови и давление в легочной артерии. С этой целью используют следующие препараты: блокаторы медленных кальциевых каналов; ингибиторы АПФ; нитраты; альфа-адреноблокаторы и некоторые другие лекарственные средства [13–21].
Антагонисты кальция. Эта группа лекарственных средств является одной из главных в лечении пациентов с легочной гипертензией и хроническим легочным сердцем. В этом плане достаточно эффективны антагонисты кальция из группы дигидропиридинов, снижающие давление в большей степени в малом круге кровообращения, чем в большом. Помимо антагонистов кальция дигидропиридинового ряда, к которым относится нифедипин, для лечения больных с ЛС могут применяться бензодиазепины (дилтиазем). К преимуществам препаратов относится отсутствие тахикардии при их применении, к недостаткам — более слабое по сравнению с дигидропиридинами сосудорасширяющее действие. В последние годы в клиническую практику внедрены новые антагонисты кальция — амлодипин и исрадипин.
Применяются при хроническом легочном сердце и нитраты пролонгированного действия, чаще всего у больных хроническими обструктивными заболеваниями легких и с сопутствующей ИБС. Механизм действия нитратов пролонгированного действия связан с дилатацией артерий малого круга кровообращения; уменьшением постнагрузки на правый желудочек вследствие венулодилатации; снижением постнагрузки на ПЖ вследствие уменьшения гипоксической вазоконстрикции ЛА; снижением давления в ЛП и уменьшением посткапиллярной легочной гипертензии за счет уменьшения конечно-диастолического давления в ЛЖ. Среднетерапевтическая дозировка: нитросорбит 20 мг 4 раза в день, сустак форте 6,4 мг 4 раза в день. К недостаткам препаратов, помимо часто возникающей головной боли, можно отнести быстро развивающуюся к ним толерантность.
Этого нежелательного эффекта лишен препарат молсидомин, который может с успехом применяться у данной группы пациентов. Доза препарата для лечения больных с ЛС составляет 8–16 мг/сут. Молсидомин можно применять в качестве вазодилататора, который метаболизируется в печени в соединение SIN-IA, содержащее свободную NO-группу. Это соединение самопроизвольно выделяет NO, стимулирующий гуанилатциклазу, что ведет к образованию циклического гуанозинмонофосфата в гладкомышечной клетке и расширению сосудов. В отличие от нитратов при лечении молсидомином не развивается толерантность.
Альфа-1-адреноблокаторы. Действие этих веществ заключается в селективной блокаде альфа-1-адренорецепторов гладкомышечных клеток сосудов, что способствует значительной артериолярной и венозной вазодилатации, снижению ОПСС и легочного сосудистого сопротивления. Кроме того, дилатация вен сопровождается депонированием крови в емкостных сосудах, уменьшением притока крови к сердцу и величины преднагрузки на правый желудочек. Учитывая возможность тяжелых гипотензивных (в том числе ортостатических) реакций при приеме альфа-1-адреноблокаторов, для лечения больных хроническим легочным сердцем рекомендуют использовать минимальные суточные дозы этих препаратов. С этой целью лучше использовать новый высокоспецифичный альфа-1-адреноблокатор доксазозин. который в отличие от празозина может приниматься 1 раз в сутки в дозе 0,5–2 мг. Помимо выраженного вазодилатирующего действия, доксазозин снижает агрегацию тромбоцитов и повышает фибринолитическую активность крови, а также благоприятно действует на липидный профиль, повышая содержание липопротеинов высокой плотности и снижая холестерин липопротеинов низкой плотности и триглицериды.
Простагландины. Предпосылкой к их внедрению в клиническую практику послужили исследования, выполненные в 70-х годах, в которых было показано, что простагландины играют важную роль в поддержании сосудистого тонуса как в нормальных условиях, так и при различных формах ЛГ. Первым простагландином, предложенным для лечения ЛГ, был простагландин Е1. являющийся вазодилатирующим агентом короткого действия. С середины 80-х годов простагландин Е1 стал применяться уже и для лечения пациентов с ЛГ. Положительным качеством препарата являлось то, что 70 % его инактивируется в легких и при внутривенном введении препарат поступает в большой круг кровообращения в ничтожно малом количестве, не вызывая заметной системной гипотонии. Кроме того, препарат обладает выраженным антиагрегантным действием, что делает его еще более эффективным при терапии больных с ЛС и ЛГ. многие из которых имеют склонность к тромбозам. В то же время значительным недостатком простагландина Е1 является необходимость его постоянного внутривенного введения для поддержания вазодилатации. Поэтому для длительной инфузии применяют специальный портативный насос, соединенный с катетером Хикмана, который находится в яремной или подключичной вене. Осложнения при длительном введении простагландина Е1 связаны, как правило, с нарушением работы инфузионной системы (например, тромбозом или инфекцией катетера), повреждением насоса или прекращением инфузии вследствие самых различных причин. Дозы препарата. применяющиеся у больных с ЛГ, варьируют от 5 до 100 нг/кг/мин.
Побочные системные реакции: наиболее часто — повышение АД, головокружение, головная боль, боль в спине, инфекции верхних дыхательных путей, гриппоподобный синдром, синусит, заложенность носа, кашель, простатит, болевой синдром. Менее 1 % — боль в яичках, отек яичек, ощущение тепла в яичках, утолщение яичек, покраснение мошонки, боль в мошонке, сперматоцеле, отек мошонки, гематурия, нарушение мочеиспускания, учащение мочеиспускания, императивные позывы к мочеиспусканию, боль в области таза, снижение АД, тахикардия, вазодилатация, периферические сосудистые нарушения, суправентрикулярная экстрасистолия, вазовагальные реакции, гипестезия, мышечная слабость, гипергидроз, сыпь, кожный зуд, тошнота, сухость во рту, увеличение уровня креатинина в сыворотке крови, судороги икроножных мышц, расширение зрачков.
В последнее время применяется и другой препарат из группы простагландинов — простациклин. Рекомендуемые дозы составляют 2–24 нг/кг/мин. Он является несколько более активным вазодилататором, чем простагландин Е1, обладая практически теми же достоинствами и недостатками, что и последний. Сдерживает его применение высокая стоимость.
Оксид азота (II). Его вазодилатирующее действие основано на активации гуанилатциклазы в гладкомышечных клетках легочных сосудов, которое приводит к повышению уровня цикло-ГМФ и снижению внутриклеточного содержания кальция. NO применяется в виде ингаляций. При таком способе введения происходит быстрое соединение данного вещества с гемоглобином, что предотвращает попадание NO в системный кровоток и развитие артериальной гипотонии. Он выгодно отличается от простагландинов более коротким периодом действия, простотой назначения (ингаляция через лицевую маску или назальный катетер), практически полным отсутствием побочных эффектов, низкой стоимостью. Для проведения острой пробы используют ингаляцию NO в возрастающей концентрации. Как правило, максимальное снижение давления в ЛА отмечается уже после применения начальной дозы через 2 мин. Внедряется в клиническую практику и длительное назначение NO. Для этого созданы специальные портативные ингаляционные системы. Лечение проводится в течение нескольких недель, но имеются сообщения о более длительном назначении препарата — до 1–2 лет. Следует отметить, что лишь 25–50 % больных с ЛГ отвечают на терапию вазодилататорами, то есть у них можно добиться снижения давления в ЛА и повышения сердечного выброса без значимой системной гипотонии.
Антагонисты рецепторов эндотелина. Важную роль в терапии ЛГ приобрели в настоящее время антагонисты рецепторов эндотелина. Это относительно новое направление в лечении ЛГ. Синтезирован препарат бозентан (траклер) — антагонист рецепторов эндотелина в клетках сосудов. Наиболее часто встречающимся симптомом передозировки была головная боль легкой или умеренной степени интенсивности. Передозировка может привести к выраженному снижению АД, что может потребовать медикаментозного лечения. Также побочное действие препаратов данной группы — увеличение печеночных ферментов.
Ингибиторы фосфодиэстеразы 5-го типа. Сильденафил эффективен за счет увеличения цГМФ в клетке. Рекомендуемая доза — 20–80 мг 3 раза в день с постепенной титрацией дозы до максимальной. Тадалафил — 5–40 мг 1 раз в день. В проведенных исследованиях доказано положительное влияние на толерантность к физической нагрузке, выраженность симптомов и улучшение показателей гемодинамики у больных с рецидивирующими тромбоэмболией легочной артерии и ХЛС. Побочное действие. Со стороны центральной нервной системы (ЦНС) возможны головная боль, приливы, головокружение, бессонница. Со стороны пищеварительной системы возможны диспепсия, астения, диарея, боли в животе, тошнота. Со стороны костно-мышечной системы: артралгии, миалгии, повышение мышечного тонуса. Со стороны дыхательной системы: заложенность носа, фарингит, ринит, синусит, инфекции дыхательных путей, нарушение дыхания. Со стороны органа зрения: изменение зрения (легкое и преходящее; главным образом изменение цвета объектов, а также усиленное восприятие света и нарушение четкости зрения), конъюнктивит. Возможны гриппоподобный синдром, развитие инфекционных заболеваний, симптомы вазодилатации, боли в спине, сыпь, инфекции мочевыводящих путей, нарушения функции предстательной железы; в единичных случаях — приапизм.
Диуретики. Диуретическая терапия правожелудочковой недостаточности кровообращения делится: на активную с целью достижения оптимального темпа уменьшения отеков, с одновременным сведением до минимума опасности развития нарушений водно-электролитного и кислотно-щелочного равновесия, обусловленных чрезмерно энергичной диуретической терапией (следует стремиться к увеличению суточного диуреза до 2 литров в условиях ограничения потребляемой жидкости и соли и к ежедневному уменьшению массы тела на 500–750 г), применяются различные диуретики и их комбинации, и поддерживающую, целью которой является предотвращение повторного образования отеков. При наличии артериальной гиперкапнии и ацидоза целесообразно назначение диуретиков-ингибиторов карбоангидразы (диакарб, снижающих уровень СО2 в крови и уменьшающих ацидоз). При отсутствии возможности контролировать кислотно-щелочное равновесие необходимо осторожное применение диакарба с назначением его в дозе 250 мг утром в течение 4 дней. Перерыв между курсами — не менее 7 дней.
Диуретические средства, показанные при наличии признаков застойной сердечной недостаточности, следует назначать осторожно из-за вероятности возникновения метаболического алкалоза, который усиливает дыхательную недостаточность за счет уменьшения стимулирующего действия СО2 на дыхательный центр. Кроме того, диуретики способны вызывать сухость слизистой бронхов, снижать мукозный индекс легких и ухудшать реологические свойства крови.
Сердечные гликозиды. Показаниями к применению данной группы препаратов являются выраженная правожелудочковая недостаточность; одновременное наличие левожелудочковой недостаточности; гипокинетический тип центральной гемодинамики. Следует стремиться к достижению индивидуальной дозы, составляющей 70–75 % средней полной дозы. Суточная доза дигоксина составляет 0,125–0,375 мг.
Вопрос о целесообразности применения сердечных гликозидов в лечении больных ХЛС остается спорным. Считается, что сердечные гликозиды, обладая положительным инотропным действием, приводят к более полному опорожнению желудочков, увеличивают сердечный выброс. Однако у больных ХОБЛ с недостаточностью ПЖ, без сопутствующей патологии сердца, сердечные гликозиды существенно не улучшают показатели гемодинамики. На фоне приема сердечных гликозидов у больных ХЛС чаще встречаются симптомы дигиталисной интоксикации, возникают практически все виды аритмий и нарушений проводимости сердца. В единичных случаях возможен тромбоз мезентериальных сосудов. Со стороны пищеварительной системы: анорексия, тошнота, рвота, диарея. Со стороны ЦНС и периферической нервной системы: головная боль, чувство усталости, головокружение; редко — ксантопсия, мелькание мушек перед глазами, снижение остроты зрения, скотомы, макро- и микропсия; в единичных случаях — спутанность сознания, депрессия, нарушения сна, эйфория, делириозное состояние, синкопальное состояние. Со стороны эндокринной системы: при длительном применении возможно развитие гинекомастии.
Коррекция гемореологических нарушений и агрегации тромбоцитов
Повышение вязкости крови, агрегации тромбоцитов и свертываемости крови, характерное для больных хроническим легочным сердцем, оказывает существенное влияние на легочное сосудистое сопротивление и прогноз. Кроме того, в тяжелых случаях эти нарушения ведут к развитию вторичных тромбозов мелких ветвей легочной артерии, что также способствует прогрессированию легочной гипертензии. Это оправдывает использование некоторых способов коррекции гемореологических нарушений и повышенной агрегации тромбоцитов, особенно у пациентов с высокими цифрами давления в легочной артерии. К числу таких методов относятся:
Ø Кровопускание по 200–300 мл крови. Оно показано при увеличении гематокрита больше 55–60 % и высоком давлении в легочной артерии. Хотя однократное кровопускание на время улучшает состояние больного, повторные процедуры редко приводят к стабилизации уровня давления в легочной артерии.
Ø Низкомолекулярные гепарины. Лечение низкомолекулярными гепаринами (например, фраксипарином по 0,6 мл 2 раза в сутки подкожно) в первую очередь показано больным с легочным сердцем, развившимся на фоне рецидивирующей тромбоэмболии мелких ветвей легочной артерии. В поддерживающих дозах фраксипарин может использоваться у больных легочным сердцем до 3–6 месяцев. При применении фраксипарина возможны следующие побочные эффекты. Со стороны свертывающей системы крови: очень часто — кровотечения различных локализаций, чаще у пациентов с другими факторами риска. Со стороны системы кроветворения: редко — тромбоцитопения; очень редко — эозинофилия, обратимая после отмены препарата. Со стороны пищеварительной системы: часто — повышение активности печеночных трансаминаз (обычно транзиторного характера). Аллергические реакции: очень редко — отек Квинке, кожные реакции. Местные реакции: очень часто — образование маленькой подкожной гематомы в месте инъекции; в некоторых случаях наблюдается появление плотных узелков (не означающих инкапсулирование гепарина), которые исчезают через несколько дней; очень редко — некроз кожи, обычно в месте введения. Развитию некроза обычно предшествует пурпура или инфильтрированное или болезненное эритематозное пятно, которые могут сопровождаться или не сопровождаться общими симптомами (в таких случаях лечение фраксипарином следует немедленно прекратить). Прочие: очень редко — приапизм, обратимая гиперкалиемия (связанная со способностью гепаринов подавлять секрецию альдостерона, особенно у пациентов из группы риска).
Ø Пентоксифиллин внутрь по 100–400 мг 2–3 раза в день. Его назначение при хроническом легочном сердце также проводят с учетом возможных побочных эффектов. Так, со стороны ЦНС: головная боль, головокружение, тревожность, нарушения сна, судороги; очень редко — асептический менингит. Дерматологические реакции: гиперемия кожи лица, приливы крови к коже лица и верхней части грудной клетки, отеки, повышенная ломкость ногтей. Со стороны пищеварительной системы: ксеростомия, анорексия, атония кишечника; в отдельных случаях — внутрипеченочный холестаз и повышение активности печеночных трансаминаз, щелочной фосфатазы. Со стороны сердечно-сосудистой системы: тахикардия, аритмия, кардиалгия, прогрессирование стенокардии, снижение АД. Со стороны системы кроветворения: лейкопения, тромбоцитопения, панцитопения, кровотечения из сосудов кожи, слизистых оболочек, желудка, кишечника, гипофибриногенемия. Со стороны органа зрения: нарушение зрения, скотома. Аллергические реакции: зуд, гиперемия кожи, крапивница, ангионевротический отек, анафилактический шок.
Прогноз
Прогноз в большинстве случаев зависит от характера и тяжести основного заболевания бронхолегочной системы. Наиболее серьезный прогноз имеют пациенты с первичной легочной гипертензией и рецидивирующими тромбоэмболиями мелких ветвей легочной артерии. Продолжительность жизни больных декомпенсированным легочным сердцем с признаками прогрессирующей правожелудочковой недостаточности и отечным синдромом обычно не превышает 2,5–5 лет. В последнее время при терминальных стадиях ХЛС используется изолированная трансплантация легких. Двухлетняя выживаемость при этом виде операции превышает 60 %.