Парадигма подавления симпатической системы при хронической сердечной недостаточности В начало
Айрин Гаврас, Атанасиос Дж. Манолис, Хараламбос Гаврас
Отдел гипертонии и атеросклероза, факультет терапии, Медицинская школа Университета Бостона, Бостон, Массачусетс, США
Значение какого-либо нового, внедряемого в практику терапевтического подхода определяется, главным образом, двумя факторами: 1) направлен ли он на лечение распространенной патологии, которая поражает многих людей и определяет их работоспособность и качество жизни в течение длительного времени; и 2) является ли эта методика лечения достаточно дешевой и легкодоступной для пациентов не только в индустриально развитых, но и в развивающихся странах, где живет большинство населения Земли. В последние годы растет смертность от сердечной недостаточности, в то время как смертность от других сердечно-сосудистых заболеваний снижается. В основе этой тенденции лежит несколько факторов, включая, как ни странно, успехи в лечении воспалительных и ишемических заболеваний сердца, гипертонии и других состояний, ведущих к сердечной недостаточности, а также увеличение продолжительности жизни. Действительно, в настоящее время от сердечной недостаточности в США страдает 5 млн. человек, из которых более 75% старше 65 лет [I]. Аналогичные тенденции наблюдаются во всем мире, частично в результате успешного осуществления различных программ здравоохранения, а также повышения жизненного уровня. Это означает, что в стареющем населении будет продолжать расти заболеваемость сердечно-сосудистой патологией и ее распространенность.
Как хроническое, неизбежно прогрессирующее заболевание, сердечная недостаточность требует пожизненного поддерживающего лечения несколькими лекарственными средствами. Даже при самой эффективной терапии, которая в настоящее время включает ингибиторы ангиотензин-превращающе го фермента (АПФ) со стандартными диуретиками и инотропными препаратами прошлого поколения или без них, от сердечной недостаточности умирает от 10 до 20% больных в первый год после постановки диагноза и 50% в течение 5 лет. Более того, оставшиеся годы жизни таких больных омрачаются изнуряющими проявлениями заболевания и побочными эффектами лекарственных препаратов. Разумеется, здесь имеется большое поле для деятельности по улучшению схем лечения, что стало очевидным как для ученых-исследователей, так и для фармацевтических фирм.
Интенсивные исследования, проведенные за последние несколько десятилетий по патогенезу сердечной недостаточности, постепенно изменили наши представления об этом патологическом состоянии. Прошлое поколение врачей рассматривало его, главным образом, как недостаточность насосной функции, ведущее к объемной перегрузке жидкостью, для лечения применяли дигиталис и диуретики. Kelly и соавт. [2] выдвинули несколько иную концепцию: для уменьшения недостаточности насосной функции и повышения перфузии тканей они предлагали снижать постнагрузку (afterload), a не преднагрузку (preload); в последующем Cohn [3] пропагандировал эту концепцию; однако, несмотря на это, сердечную недостаточность продолжали лечить преимущественно диуретиками и препаратами, стимулирующими инотропную функцию. Нет данных о том, что любая из этих двух методик терапии продлевает жизнь, но клинический опыт показывает, что такое лечение обеспечивает непосредственное облегчение симптомов. За несколько лет было испытано несколько вазодилататоров, но от их применения по различным причинам отказывались.
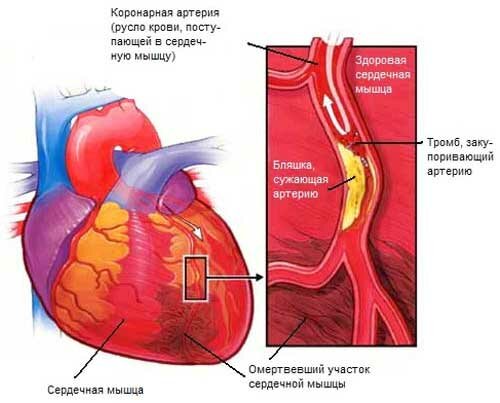
В настоящее время признано, что прогрессирующее ухудшение функции миокарда и его способности к восстановлению объясняется в значительной степени не гемодинамической перегрузкой самой по себе, а нейрогормональной активацией, сопровождающей гемодинамическую декомпенсацию. Показано, что влияние на миокард высоких уровней ангиотензина II и норадреналина вызывает обширные некрозы [4, 5], а активация симпатической системы представляется как причиной, так и маркером утяжеляющейся сердечной недостаточности [6, 7]. Как уже известно, в развитии так называемой нейрогормональной активации участвует много гуморальных факторов, например, такие физиологически активные вещества, как цитокины и фактор некроза опухолей. Однако клинически значимые результаты приносит обуздание двух главных прессорных систем, а именно — системы ренина-ангиотензина и симпатической нервной системы (СНС). Исследования последних лет показали, что их повреждающее влияние обусловлено не только системным прессорным эффектом, но также и их местным аутокринным/паракринным/интракринным действием (autocrine/paracrine/intracrine effect) на кардиомиоциты и окружающие ткани [8, 9].
В 1977 году [10] был впервые предложен метод лечения застойной сердечной недостаточности, заключающийся в подавлении ренин-ангиотензиновой системы с помощью саралазина ацетата (saralasin acetate) — антагониста рецепторов к ангиотензину II. Ценность такого подхода была затем убедительно подтверждена в клинических работах по применению парентеральных и оральных ингибиторов АПФ. Эти первые исследования носили преимущественно описательных характер, они включали регистрацию гемодинамических, электрокардиографических и других клинических параметров до и во время лечения ингибиторами АПФ. Результаты были неизменно положительными и поэтому привлекли внимание фармацевтических фирм, несколько из которых предложили свои собственные ингибиторы АПФ, при этом все компании были заинтересованы в использовании своих антигипертензивных препаратов в данной новой области. Это побудило их организовать для обмена информацией многочисленные конгрессы, специализированные симпозиумы, а также национальные и международные конференции и другие мероприятия. Они также были очень заинтересованы в организации и финансировании крупных конролированных многоцентровых исследований, чтобы подтвердить, что их продукция улучшает прогноз у больных с сердечной недостаточностью. Первая подобная работа — Северо-скандинавское кооперативное исследование влияния эналаприла на выживание [11] показала, что такое лечение способно уменьшить выраженность сердечной недостаточности и смертность от нее. Другие сравнительные исследования по лечению разнообразными ингибиторами АПФ в сравнении с инотропными, диуретическими и сосудорасширяющими препаратами привели к тому, что применение ингибиторов АПФ стало стандартной терапией дисфункции левого желудочка, особенно после инфаркта миокарда, причем их рекомендуют начинать принимать до наступления явной систолической недостаточности. Недавнее внедрение в практику оральных антагонистов рецепторов к ангиотензину II показало, что эти препараты могут быть, по крайней мере, столь же эффективными в улучшении гемодинамики, и даже, возможно, более действенными в предотвращении внезапной смерти [12] у таких больных. Это открытие вновь стимулировало интерес со стороны фармацевтической промышленности, организовавшей многочисленные конгрессы, симпозиумы и многоцентровые контролированные работы для изучения и распространения этого нового подхода к лечению. Несомненно, такая активная научная работа и распространение ее результатов помогли улучшить и продлить жизнь многих больных с сердечной недостаточностью.
Лечение сердечной недостаточности с помощью подавления СНС прошло несколько другой путь. Вначале с этой целью пытались применять ганглиоблокаторы [2] или альфа-адреноблокаторы [13]; обе эти группы препаратов рассматривались преимущественно как сосудорасширяющие средства. Но вскоре от такого лечения отказались по различным причинам, включая отсутствие длительного положительного эффекта. Затем попытались применять клонидин (clonidine) [14, 15], который также рассматривали как вазодилататор, но и от него отказались из-за опасений подавления сократимости миокарда, в то время как позитивные инотропные препараты все еще оставались стандартными средствами лечения недостаточности насосной функции миокарда. От применения бета-адреноблокаторов воздерживались многие годы из-за непосредственного подавления ими сократимости миокарда, хотя в некоторых работах была показано, что они положительно сказываются на экономии энергии миокарда в отдаленные сроки [16,17]. Тем не менее, накопление данных клинических и фундаментальных исследований постепенно привели к осознанию того, что осуществление бета-адреноблокады, на самом деле, может в большинстве случаев давать положительный эффект в отдаленные сроки, несмотря на риск раннего усиления гемодинамических нарушений. Как и в случае ингибиторов АПФ, эти обнадеживающие результаты привлекли внимание фармацевтических фирм, особенно тех, которые в 1990-х годах выпускали бета-адреноблокады 2 и 3 поколения — такие, как бисопролол (bisoprolol), буциндолола гидрохлорид (bucindolol hydrochloride) и карведилол (carvedilol). Эти фармацевтические компании финансировали крупные многоцентровые контролированные исследования [18, 19], организовали многочисленные научные конференции и специализированные симпозиумы, а также содействовали публикации достижений научных работ по данной проблематике в приложениях к журналам и в информационных письмах, обеспечивая широкое распространение этой информации. Хотя данные об исходах не всегда были положительными (например, результаты исследования в Австралии и в Новой Зеландии не выявили уменьшения смертности, как и более ранние работы по бисопрололу), эта деятельность вызвала большой энтузиазм, который в значительной степени представляется обоснованным. Однако некоторые опытные исследователи-клиницисты отмечают, что следует проявлять осторожность, особенно в отношении подбора больных, которым это лечение действительно показано [20].
Тем не менее, существует другой способ подавления СНС при сердечной недостаточности — центральное подавление СНС клонидином, которое позволяет восстановить анатомическое равновесие, и. возможно не представляет непосредственного риска подавления функции левого желудочка, наблюдаемого при бета-блокаде. За последние 3-4 года по инициативе самих клиницистов была проведена серия работ (среди них — и наше исследование) [21-26], причем некоторые из них носили только описательный характер, другие были контролированы по плацебо, в ряде из них применялись и ингибиторы АПФ; длительность данных работ составляла до нескольких месяцев. Результаты этих исследований были неизменно положительными: они показали, что клонидин улучшает функциональные возможности (на что указывает повышение толерантности к нагрузке), при этом различные другие гемодинамические показатели либо улучшаются, либо не изменяются. Что более важно, клонидин коррегирует анатомический дисбаланс и смягчает большинство индексов аритмогенного потенциала (например, изменчивость частоты сердечных сокращений и связанные с ней параметры при Холтеровском [Holter] мониторировании), и он действительно уменьшает частоту и тяжесть желудочковой эктопии, представляющей собой главную причину внезапной смерти при сердечной недостаточности. Все же, несмотря на многочисленные усилия, ни одна компания пока не проявила интерес в финансировании крупных контролированных исследований, направленных на то, чтобы показать значение таких изменений на исходы у больных в отделенные сроки [27]. Выявленное при клинических работах благоприятное действие клонидина при сердечной недостаточности известно узкому кругу ученых-кардиологов, но врачи общей практики, которые лечат 90% больных с хронической сердечной недостаточностью совсем не знают об этих достижениях.
20 или 30 лет назад журналы, предназначенные для широких кругов врачей-клиницистов, принимали рукописи от исследователей о результатах даже небольших клинических испытаний в том случае, если эти работы были правильно построены и отвечали строгим научным принципам. Сегодня эти журналы принимают только результаты крупных, двойных-слепых, конролированных по плацебо исследований, проведение которых требует больших финансовых затрат, возможных только при поддержке фармацевтических компаний. Но, естественно, компании финансируют только исследования по своей собственной запатентованной продукции, в результате которых они могут получить большие доходы. Партнерство между промышленностью и учеными стимулируется ожиданием прибыли. У клонидина же коммерческие перспективы невелики: это старый и дешевый препарат, срок его патента давно истек, но для него в настоящее время открывается новая область применения, которая, возможно, позволит облегчить и продлить жизнь многим больным. Это может представлять особый интерес для врачей в тех странах, где для широких слоев населения недоступны препараты, уже доказавшие свою эффективность у больных с сердечной недостаточностью: новейшие ингибиторы АПФ, антагонисты рецепторов к ангиотензину II и (бета-блокаторы. Однако не проводилось симпозиумов, не выпускались дополнительные номера журналов или информационные письма, которые бы позволили распространить эту информацию, и данное открытие не обладает столь броским, привлекательным для издателей образом достижения науки, как генная инженерия.
Как же разрешить эту проблему? История аспирина в роли антитромботического препарата или "возрождение" спиронолактона в качестве вспомогательного средства при подавлении АПФ у больных с сердечной недостаточностью показывают, что старый, недорогой, широкодоступный препарат, у которого открывается новая область применения, может все же вызывать достаточный интерес — если не у предпринимателей, то у людей, определяющих политику в здравоохранении, чтобы получить разрешение на его формальное испытание. С другой стороны, фармацевтические компании могут финансировать исследования по применению аналогичных лекарственных средств, патент на которые еще не истек, например, альфа2-агонистов, оказывающих центральное действие, подавляющее СНС -таких, как моксонидин (moxonidine) или рилменидин (rilmenidine), конечно, если они окажутся столь же эффективными, как и клонидин. По крайней мере, такие исследования позволят распространить касающуюся этого вопроса информацию, которую можно будет экстраполировать на все члены этого класса препаратов. Для страховых компаний или правительственных структур может представить интерес также финансирование исследований, предназначенных для оценки не только клинической эффективности, но и соотношения "стоимость-эффективность". Структуры, управляющие здравоохранением, обычно находятся под двойным давлением — с одной стороны, необходимости внедрения дорогих новых методик, с другой стороны — ограниченности бюджета [28].
Фармакоэкономическая оценка старого препарата с известной безопасностью и весьма вероятной способностью улучшить результаты лечения должна представлять особый интерес для таких организаций, поскольку как на непосредственную фазу клинического применения, так и на последующее наблюдение за больными затраты ниже, чем на испытание новых препаратов. В начало
Продукция
Хроническая сердечнососудистая недостаточность
Хроническая сердечнососудистая недостаточность.
Сердечнососудистая недостаточность – это недостаточность кровообращения. Это одно из самых частых осложнений болезней сердечнососудистой системы.
Острая сердечно — сосудистая недостаточность является неотложным состоянием и требует срочной госпитализации пациента.
Хроническая сердечнососудистая недостаточность развивается постепенно.
Любая болезнь сердца приводит к снижению способности сердца обеспечивать организм достаточным притоком крови. т.е. к уменьшению его насосной функции. Чаще хроническую сердечнососудистую недостаточность вызывают ишемическая болезнь сердца, инфаркт миокарда, артериальная гипертензия, кардиомиопатии, пороки клапанов сердца.
К основным и наиболее заметным проявлениям синдрома сердечнососудистой недостаточности относится одышка, возникающая иногда даже в состоянии покоя или при минимальной физической нагрузке. Кроме того, на возможность наличия сердечной недостаточности указывает усиленное сердцебиение, повышенная утомляемость, ограничение физической активности и избыточная задержка жидкости в организме, вызывающая отеки. Недостаточное кровоснабжение организма лежит и в основе такого яркого признака сердечной недостаточности как посинение ногтей или носогубного треугольника при обычной плюсовой температуре воздуха, что может свидетельствовать о поражении правого желудочка.
При сердечно-сосудистой недостаточности затрудняется и мозговое кровообращение, появляются головокружения, потемнения в глазах, обмороки.
При далеко зашедшей сердечно-сосудистой недостаточности кожа становится истонченной, дряблой, ненормально блестящей, «сглаживается рисунок», отеки покрывают все тело, происходит истощение.
Обычно сердечно-сосудистая недостаточность развивается медленно. Механизм ее развития включает много этапов. Имеющиеся у пациента заболевания сердца приводят к увеличению нагрузки на левый желудочек. Чтобы справиться с повышенной нагрузкой мышца сердца гипертрофируется (увеличивается в объеме, утолщается) и некоторое время поддерживает нормальное кровообращение. Однако в самой гипертрофированной сердечной мышце нарушается питание и доставка кислорода, потому что сосудистая система сердца не рассчитана на его увеличивающийся объем. Происходит склероз мышечной ткани и целый каскад других изменений, которые, в конце концов, приводят к нарушению функции мышца сердца, в первую очередь к нарушению его сокращения, что вызывает недостаточность выброса крови в сосуды, и расслабления, что вызывает ухудшение питания самого сердца. Какое-то время организм пытается помочь сердцу: изменяется количество гормонов в крови, сжимаются мелкие артерии, изменяется работа почек, легких и мышц.
При дальнейшем течении болезни запас компенсаторных возможностей организма истощается. Сердце начинает биться чаще. Оно не успевает перекачивать всю кровь сначала из большого круга кровообращения (потому что более нагруженный левый желудочек страдает первым), а затем из малого.
Появляются одышка, особенно ночью в положении лежа. Это следствие застоя крови в легких.
Из-за застоя крови в большом круге кровообращения у больного мерзнут руки и ноги, появляются отеки. Сначала они бывают только на ногах, к вечеру могут стать общими. Увеличивается печень и появляются боли в правом подреберье. При осмотре у пациента выявляют цианоз – голубой оттенок окраски кистей и стоп.
На электрокардиограмме наблюдаются признаки заболевания, которое привело к хронической сердечной недостаточности: инфаркт миокарда, нарушение ритма или признаки увеличения левых отделов сердца. На рентгенограмме выявляют увеличение размеров сердца, отек легких.
На эхокардиограмме находят перенесенный инфаркт миокарда, пороки сердца, кардиомиопатии, поражение наружной оболочки сердца (перикардит). Эхокардиограмма позволяет оценить степень нарушения работы сердца, недостаточность клапанного аппарата сердца.
В коррекции хронической сердечно-сосудистой недостаточности важно. расширение мелких сосудов; улучшение микроциркуляции, укрепление сосудистой стенки (вазопротекция), уменьшение объема циркулирующей крови. улучшение свойств крови (повышение текучести, профилактика тромбооброзования).
Очень важно, что бы больной вовремя обращался к врачу, постоянно находился под наблюдением.
Прием парафармацевтиков линейки Диэнай рекомендуется при хронической сердечно-сосудистой недостаточности.
Можно рекомендовать Диэнай, Веномакс, Мидивирин, Ге-Па, ВитакинВ, Апимал, Хондромарин.
Диэнай и биомодуль «Диэная» в других препаратах:
• улучшает тканевое дыхание, то есть помогает клеткам миокарда работать в условиях повышенной нагрузки;
• нормализация обмена веществ;
• улучшение свойств крови.
• легкий мочегонный эффект.
Дозировки подбираются индивидуально в зависимости от возраста, выраженности сердечно-сосудтистой недостаточности, исходного состояния.
Иногда коррекция начинается с очень малых доз – ½ или ¼ капсулы. Затем постепенно медленно увеличивается, учитывается переносимость и эффекты действия.
Веномакс: вазопротекторное действие + действие Биомодуля Диэная (см. выше). Дозировка также набирается медленно и постепенно. Начальная дозировка определяется переносимостью Диэная.
Мидивирин – чрезвычайно полезен. Выводит лишнюю жидкость из организма (при сохранности работы почек), укрепляет сердечную мышцу. Улучшает работу печени и головного мозга.
Курсы Диэная, Вазомакса, Мидивирина рекомендуется повторять.
Парафармацевтики «второго» ряда:
Ге-Па показан как гепатопротектор.
ВитакинВ – Диэнай «усиленный» витаминами группы В – можно принимать вместо Диэная.
Хондромарин — укрепляет все соединительно-тканные структуры в организме, то есть укрепляет клапанный аппарат сердца, около сосудистое пространство и межклеточной пространство миокарда.
/ ЛЕКЦИИ (Серов, Пальцев) / ЛЕКЦИИ Патологическая анатомия (Серов, Пальцев) / Лекция №10 МОРФОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ НЕДОСТАТОЧНОСТИ
Лекция 10
МОРФОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ НЕДОСТАТОЧНОСТИ
• Сердечно-сосудистая недостаточность (ССН) — патологическое состояние, в основе которого лежит сочетание сердечной и сосудистой недостаточности, объединенных общностью этиологии или патогенеза.
Сердечная недостаточность — патологическое состояние, обусловленное неспособностью сердца обеспечить адекватное кровоснабжение органов и тканей.
Сосудистая недостаточность — патологическое состояние, характеризующееся снижением тонуса гладкой мускулатуры сосудистых стенок, что приводит к развитию артериальной гипо-тензии, нарушению венозного возврата и поступлению крови из депо.
В большинстве случаев развитие сердечно-сосудистой недостаточности обусловлено первичным поражением сердца с развитием его недостаточности, которая неизбежно сопровождается реакцией сосудов. Эта реакция носит компенсаторный характер и при острой сердечной недостаточности проявляется вазоконст-рикцией в ответ на прессорные механизмы, что приводит к временному повышению сосудистого сопротивления, некоторому подъему уровня артериального давления и нормализации кровоснабжения жизненно важных органов. При хронической сердечной недостаточности вазоконстрикция сменяется гипертрофией гладких мышечных клеток сосудистой стенки. В случае истощения компенсаторных сосудистых механизмов к сердечной недостаточности присоединяется сосудистая, сопровождающаяся снижением общего периферического сопротивления, резким расширением мелких вен, венул и капилляров — венозным полнокро-вием, т.е. развивается сердечно-сосудистая недостаточность. Как синоним сердечно-сосудистой недостаточности часто использует-ся термин «недостаточность кровообращения».
Почти любой процесс, который заставляет сердце усиленно работать в течение длительного времени или вызывает структурные повреждения миокарда, приводит к сердечно-сосудистой не-достаточности. Чаще всего она встречается при следующих заболеваниях и состояниях:
ишемической болезни сердца;
пороках сердца — врожденных и приобретенных (ревматических, атеросклеротических, после перенесенного бактериально-го эндокардита и др.);
109
гипертензивных состояниях;
миокардитах;
— кардиомиопатиях;
— болезнях недостаточного питания, эндокринных и метаболических поражениях, в том числе при тиреотоксикозе, микседеме, бери-бери, карциноидном синдроме, болезнях накопления (жировых, углеводных), амилоидозе и пр. Наиболее частым из перечисленных заболеваний является ишемическая болезнь сердца (ИБС), на которую приходится более 80 % случаев смерти от сердечно-сосудистой недостаточности.
Сердечно-сосудистая недостаточность может развиваться остро или иметь хроническое течение. Наиболее частыми причинами острой сердечно-сосудистой недостаточности являются крупноочаговый инфаркт миокарда, тромбоэмболия крупных ветвей легочной артерии, острые миокардиты, инфекционные заболевания с выраженной интоксикацией, тампонада сердца и пр.
Хроническая сердечно-сосудистая недостаточность возникает при многих заболеваниях сердца — пороках, ишемической болезни сердца, хронических миокардитах, кардиомиопатиях и др.
Сердечная недостаточность может быть левожелудоч-к о в о й (при ИБС, гипертонической болезни или симптоматических гипертензиях, при ревматических и врожденных пороках сердца, коарктации аорты, кардиомиопатиях, миокардитах, состояниях, сопровождающихся повышением сердечного выброса — токсикозах беременных (гестозы), тяжелых анемиях, гипоксии и гиперкапнии, лихорадочных состояниях, тиреотоксикозе, печеночной недостаточности, бери-бери и др.), правожелу-дочковой (при легочной гипертензии, эмболии легочной артерии, при некоторых врожденных пороках: дефектах межпред-сер дной перегородки, стенозе легочной артерии, пороках трехстворчатого клапана, некоторых миокардитах, изредка — при инфаркте миокарда с вовлечением правого желудочка) и т о -тальной — на поздних стадиях большинства перечисленных заболеваний, а также при тампонаде сердца.
Этиология. Среди многообразия причин, приводящих к сердечно-сосудистой недостаточности, выделяют три основные группы:
-. оказывающие прямое повреждающее действие на миокард; — вызывающие функциональную перегрузку миокарда; — нарушающие диастолическое наполнение желудочков.
Прямое повреждающее действие на миокард могут оказывать различные факторы: физические (травма, действие электрического тока и др.), химические (высокое содержание некоторых биологически активных веществ: адренали-
на, тироксина; гипоксия; недостаток витаминов, других субстратов метаболизма; большие дозы некоторых лекарственных препаратов); биологические (инфекционные агенты, токсины, паразиты).
Функциональная перегрузка сердца может быть вызвана следующими факторами:
чрезмерным увеличением количества притекающей к сердцу крови — «перегрузка объемом» (при гиперволемии, недостаточности клапанов сердца, наличии артериовенозных вне- и внутри-сердечных шунтов и пр.);
увеличением сопротивления, которое оказывается при выбросе крови из сердечных полостей — «перегрузка давлением» (стенозы правого и левого предсердно-желудочкового отверстия, устья аорты и легочной артерии, гипертензия в большом и малом круге кровообращения. Развитию сердечно-сосудистой недостаточности при этом предшествует гипертрофия миокарда (гипертрофируется тот отдел сердца, которому приходится выполнять усиленную работу) и длительный период компенсации с включением как кардиальных, так и сосудистых механизмов, только при срыве которых появляются первые клинические признаки сердечно-сосудистой недостаточности.
Нарушение диастолического наполнения желудочков может быть обусловлено значительным снижением массы циркулирующей крови (при массивных кровопоте-рях, шоке) или нарушением диастолического расслабления сердца при его сдавлении жидкостью, накапливающейся в полости перикарда (транссудат, кровь, экссудат), при слипчивых перикардитах, рестриктивных кардиомиопатиях и др.
Как правило, сердечно-сосудистая недостаточность является результатом сочетанного действия факторов разных групп, чаще первых двух.
Патогенез. Основным пусковым механизмом сердечно-сосудистой недостаточности является снижение сердечного выброса. Один или оба желудочка теряют способность нормально выбрасывать в кровеносное русло содержащуюся в них кровь. Это ведет, с одной стороны, к увеличению конечного диастолического объема желудочка, повышению давления и объема в предсердии и венозной системе выше него, т.е. развивается венозный застой, который сопровождается повышением системного венозного и капиллярного давления, гипоксией и повышенной транссудацией жидкости в ткани. В случае левожелудочковой недостаточности венозный застой развивается в малом круге кровообращения. Напротив, при правожелудочковой недостаточности венозное полнокровие в основном развивается в большом круге кровообращения. Однако, если сердечно-сосудистая недостаточность сохраняется в течение нескольких месяцев или лет, то венозный застой распространяется на оба круга кровообращения.
110
111
С другой стороны, снижение сердечного выброса сопровождается неадекватным поступлением крови в артериальную систему. Для поддержания на нормальном уровне артериального давления при исходно сниженном сердечном выбросе усиливается активность симпатико-адреналовой системы. Гиперкатехолами-немия (в основном за счет содержания адреналина) приводит к сужению артериол и венул и повышению периферического сосудистого сопротивления. Ухудшение кровоснабжения почек вызывает включение почечного звена патогенеза сердечно-сосудистой недостаточности: активируется ренин-ангиотензин-альдо-стероновая система, что в конечном итоге приводит к задержке в организме натрия и воды, увеличению объема циркулирующей крови и еще большему повышению венозного давления, т.е. возникает порочный круг.
Сердечно-сосудистая недостаточность в результате перегрузки миокарда формируется на фоне более или менее длительной его гиперфункции, что сопровождается гипертрофией, т.е. увеличением мышечной массы сердца за счет увеличения количества и объема внутриклеточных структур кардиомиоцитов. Процесс не сопровождается адекватным энергообеспечением, что в конце концов также приводит к снижению силы и скорости сокращения и расслабления сердца. В обоих случаях — и при перегрузке, и при повреждении сердца снижение его сократительной функции сопровождается включением интракардиальных и сосудистых механизмов компенсации этого сдвига.
Интракардиальные компенсаторные механизмы. Среди них наиболее важными являются:* увеличение развиваемого сердцем напряжения в ответ на растяжение его полостей (механизм Франка — Стерлинга); — увеличение силы сокращения в ответ на повышенную нагрузку при неизмененной длине мышечных волокон; — увеличение частоты сердечных сокращений в результате повышения давления в полых венах, правом предсердии и растяжении их (рефлекс Бейнбриджа); — усиление симпатоадреналовых влияний на миокард в связи со снижением сердечного выброса, что увеличивает как силу, так и скорость сердечных сокращений.
Включение названных механизмов обеспечивает экстренную компенсацию снижения сократимости миокарда. Однако это приводит к значительному увеличению интенсивности функционирования сердца, что не сопровождается адекватным энергообеспечением. Следствием этого является структурный полом митохондрий, сопровождающийся нарушением окисления свободных жирных кислот и снижением ресинтеза АТФ. Основным источником АТФ при этом становится гликолитический путь расщепления глюкозы, который в 18 раз менее эффективен, чем аэробный путь, и не может в достаточной мере компенсировать
дефицит макроэргических фосфатов. В кардиомиоцитах при этом возникает жировая дистрофия — морфологический субстрат сердечной недостаточности. Тоногенная дилатация полостей сердца сменяется миогенной, что приводит к еще большему снижению сократительной функции сердца. Нарушения метаболизма кардиомиоцитов, лежащие в основе сердечной недостаточности, нельзя свести только к снижению продукции АТФ. Они более сложны и не до конца выяснены. По-видимому, играют роль повреждение мембранного аппарата и ферментных систем кардиомиоцитов, а также нарушение сопряжения процессов возбуждения и сокращения, в результате чего снижается доставка ионов кальция к контрактильным элементам. В развитии сердечной декомпенсации большое значение придают истощению симпатоадреналовых механизмов: подавляется биосинтез норадрена-лина в миокарде, содержание его в ряде случаев составляет лишь 10 % от нормальных значений, снижается количество бета-адре-норецепторов. Существует мнение, что на более поздних стадиях сердечной недостаточности, когда содержание норадреналина в миокарде понижено, миокард становится во многом зависимым от внекардиальной адренергической стимуляции, главным образом надпочечниковой.
Сосудистые компенсаторные механизмы. Важным компенсаторным механизмом при снижении кровотока служит перераспределение сердечного выброса: доставка кислорода к жизненно важным органам — мозгу и сердцу, поддерживается на нормальном или субнормальном уровне, в то время как менее важные органы — кожный покров, скелетная мускулатура, органы брюшной полости, снабжаются кровью недостаточно. Основным механизмом перераспределения сердечного выброса является вазоконстрикция, опосредованная через активацию симпатико-адреналовой системы (в основном за счет адреналина), что приводит к сужению артериол и венул. Этот механизм, с одной стороны, способствует поддержанию артериального давления, а с другой — препятствует распространению венозного застоя на капиллярное русло. Вазоконстрикция в свою очередь служит причиной многих клинических признаков сердечно-сосудистой недостаточности: задержки жидкости вследствие уменьшения почечного кровотока; субфебрильной лихорадки, вызванной снижением кожного кровотока; усталости, обсловленной уменьшением кровоснабжения мышц. Спазм венул и вен при длительно протекающем венозном застое сменяется выраженной гипертрофией мышечной оболочки. Так, в системе верхней полой вены человека при пороках сердца наступает десятикратное уве-личение числа мышечных слоев. Гипертрофия мышечной обо-лочки возникает при забросе крови в обратном направлении (ре-гургитации). Это связано, по-видимому, с сокращением стенок
112
113
диапедезные кровоизлияния; в паренхиматозных органах появляются дистрофические и некротические изменения.
Схема 12. Морфогенез острой сердечно-сосудистой недостаточности
вен в ответ на растяжение их просвета (реакция Бейлиса — Остроумова). Длительно протекающая регургитация может сопровождаться не только гипертрофией мышечной оболочки, но и врастанием мышечных клеток во внутреннюю оболочку и парадоксальным сужением просвета сосудов. В стадии сосудистой компенсации сужение мелких вен предохраняет капилляры от полнокровия.Стадия декомпенсации сосудистой недостаточ ности возникает при развитии фиброза гипертрофированной мышечной оболочки, сопровождающегося расширением просвета вен и развитием застоя в капиллярах.
Венозное полнокровие не ограничивается перестройкой венозного русла, оно включает веноартериальную реакцию. Последняя заключается в рефлекторном спазме артериол и мелких артерий и сопровождается гипертрофией их стенок. Впервые эта реакция описана в легких при сужении левого предсердно-желу-дочкового отверстия (митральный стеноз), позже была обнаружена и в других органах. Наиболее интенсивно она выражена в тех органах, где нет других возможностей адаптации — депонирования или коллатерального венозного полнокровия. Сущность этой реакции заключается в предохранении капилляров от полнокровия и предупреждении обратного кровотока из венозной системы в артериальную.
МОРФОГЕНЕЗ И МОРФОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ НЕДОСТАТОЧНОСТИ
Основным проявлением сердечно-сосудистой недостаточности является общее венозное полнокровие: острое — при острой и хроническое — при хронической сердечно-сосудистой недостаточности.
Венозное полнокровие служит инициальным моментом для развития всех других изменений в органах при сердечной недостаточности. Ведущим патогенетическим фактором при этом является гипоксия.
Острая сердечно-сосудистая недостаточность
Острая сердечно-сосудистая недостаточность (схема 12) проявляется острым общим венозным полнокровием, при котором в результате гипоксического повреждения гистогематических барьеров и резкого повышения капиллярной проницаемости, а также увеличения гидростатического давления в капиллярах в тканях наблюдаются плазматическое пропитывание (плазморрагия) и отек, стазы в капиллярах и множественные
114
Структурно-функциональные особенности органа, в котором развивается острый венозный застой, определяют преобладание отечно-плазморрагических, геморрагических либо дистрофических и некротических изменений.
В легких гистофизиологические особенности аэрогема-тического барьера объясняют развитие при остром венозном полнокровии преимущественно отека и геморрагии. Характерными клиническими проявлениями при этом является пароксизмальная одышка с развитием тяжелого приступа сердечной астмы, сопровождающейся резкой нехваткой воздуха, многочисленными влажными хрипами над всеми легкими, откашливанием кровянистой пенистой жидкости. Острый отек легких — одна из основных причин смерти больных с острой сердечно-сосудистой недостаточностью.
В почках вследствие особенностей структуры нефрона и кровообращения возникают в основном дистрофические и некротические изменения эпителия канальцев. Почки при остром венозном полнокровии увеличены в объеме, плотны, их масса достигает 400—500 г. Наиболее полнокровны мозговое вещество и пирамиды; в последних наблюдается радиарная исчерченность, сосочки могут набухать и
115
Схема 13. Морфогенез хронической сердечно-сосудистой недостаточности
ущемляться в почечных чашечках. Неравномерность гиперемии объясняется частичным сбросом крови по юкстамедуллярному шунту (по многочисленным анастомозам на границе коркового и мозгового вещества), который возникает при вазоконстрикции артерий и артериол коркового вещества в ответ на снижение сердечного выброса. Тяжесть дистрофических изменений эпителия канальцев нарастает по мере повышения внутрипочечного давления, связанного с отеком паренхимы и нарушением лимфообращения.
В печени в связи с особенностями архитектоники и кровообращения печеночной дольки при остром полнокровии появляются центролобулярные кровоизлияния и некрозы, которые изредка могут сопровождаться развитием острой печеночной недостаточности.
Селезенка при остром венозном полнокровии увеличена, масса ее достигает 300 г. Капсула селезенки напряжена, с поверхности ее разреза обильно стекает кровь. Микроскопически определяются расширенные синусы, заполненные кровью.
Хроническая сердечно-сосудистая недостаточность
Хроническая сердечно-сосудистая недостаточность (схема 13) сопровождается развитием хронического общего венозного полнокровия, при котором гипоксия приобретает хронический характер. Хроническое венозное полнокровие приводит к тяжелым, нередко необратимым изменениям органов и тканей. Длительно поддерживая состояние тканевой гипоксии, оно определяет развитие не только плазморрагии, отека, стаза и кровоизлияний, дистрофии и некроза, но и атрофических, и склеротических процессов. Склеротические изменения, т.е. разрастание соединительной ткани, обсловлены тем, что хроническая гипоксия стимулирует синтез коллагена фибробластами и фибробластопо-добными клетками. Соединительная ткань вытесняет паренхиматозные элементы, развивается застойное уплотнение (индурация) органов и тканей. Порочный круг при хроническом венозном полнокровии замыкается развитием капиллярно-паренхиматозного блока в связи с «утолщением» базальных мембран эндотелия и эпителия за счет повышенной продукции коллагена фибробластами, гладкими мышечными клетками и липофибробластами.
Для хронического венозного полнокровия характерны распространенные отеки подкожной основы (жировой клетчатки) — анасарка и скопление жидкости в серозных полостях;
116
в плевральной — гидроторакс, в полости перикарда — гидроперикард,в брюшной — асцит (обычно при наличии застойного мускатного фиброза печени).
Органы при хроническом венозном полнокровии увеличиваются в объеме, становятся синюшными вследствие повышенного содержания восстановленного гемоглобина, плотными из-за сопутствующего нарушения лимфообращения и отека, а позже в связи с разрастанием соединительной ткани.
Изменения в органах при хроническом венозном полнокровии, несмотря на ряд общих черт (застойная индурация), имеют ряд особенностей.
Кожа, особенно нижних конечностей, становится холодной и приобретает синюшную окраску (цианоз). Вены кожи и подкожной основы расширены, переполнены кровью; также расширены и переполнены лимфой лимфатические сосуды. Выражены отек дермы и подкожной основы, разрастание в коже соединительной ткани. В связи с венозным застоем, отеком и склерозом и коже легко возникают воспалительные процессы и изъязвления, которые длительное время не заживают.
В слизистых оболочках венозная гиперемия сопровождается цианозом, а также повышенной продукцией слизи с развитием катарального воспаления (застойный катар).
117
Печень при хроническом венозном застое увеличена, плотная, ее края закруглены, поверхность разреза пестрая, серо-желтая с темно-красным крапом и напоминает мускатный орех, поэтому такую печень называютмускатной. При микроскопическом исследовании видно, что полнокровны лишь центральные отделы долек, где отмечаются кровоизлияния, дискомплексация печеночных балок и гибель гепатоцитов; эти отделы на разрезе печени выглядят темно-красными. На периферии долек гепато-циты находятся в состоянии жировой дистрофии, чем объясняется серо-желтый цвет печеночной ткани.
Хроническое венозное полнокровие печени сопровождается веноартериальной реакцией — гипертрофией мелких ветвей печеночных артерий, имеющих узкий просвет вследствие гипертрофии циркулярного и продольного внутреннего мышечных слоев. В дальнейшем стенки сосудов склерозируются.
Морфогенез изменений печени при длительном венозном застое сложен. Избирательное полнокровие центра долек обусловлено тем, что застой печени охватывает прежде всего печеночные вены, распространяясь на собирательные и центральные вены, а затем и на синусоиды. Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды капиллярных разветвлений печеночной артерии, давление в которых выше, чем в синусоидах. По мере нарастания полнокровия в центре долек появляются кровоизлияния, гепатоциты здесь подвергаются дистрофии, некрозу и атрофии. Гепатоциты периферии долек компенсаторно гипертрофируются и приобретают сходство с центролобулярными. Разрастание соединительной ткани в зоне кровоизлияний и гибели гепатоцитов связано с пролиферацией клеток синусоидов — липоцитов, которые могут выступать в роли фибробластов, а вблизи центральных и собирательных вен — с пролиферацией фибробластов адвентиции этих вен. В результате разрастания соединительной ткани в синусоидах появляется непрерывная базальная мембрана (в нормальной печени она отсутствует), т.е. происходит капилляризация синусо идов, возникаеткапиллярно-паренхиматозный блок, который, усугубляя гипоксию, ведет к прогрессированию атрофических и склеротических изменений в печени. Этому способствует также шунтирование крови, развивающееся при склерозе стенок и об-турации просветов многих центральных и собирательных вен, а также нарастающий застой лимфы. В финале развиваетсяза стойный фиброз (склероз) печени, который называют такжему скатным, иликардиальным, поскольку развивается он при хронической сердечно-сосудистой недостаточности. При прогрессирующем разрастании соединительной ткани в редких случаях возникает перестройка и деформация органа — развиваетсяза-
стойный (мускатный) цирроз печени, который называют такжесердечным.
Почки при хроническом общем венозном застое становятся большими, плотными и цианотичными —цианотическая ин- дурация почек. Особенно полнокровны вены мозгового веществаи юкстамедуллярной зоны. При хроническом венозном полнокровии почек рано набухает основное вещество мозгового слоя вследствие реакции полисахаридов, содержащихся здесь в большом количестве. Полнокровие почечных клубочков развивается позже, чем наступают изменения в мозговом веществе, так как вступает в силу веноартериальная реакция, сопровождающаяся при длительной гиперемии гипертрофией артерий коркового вещества. Лишь развитие склероза мышечной оболочки этих артерий сопровождается расширением их просвета и капилляров почечных клубочков. На этой стадии возможны огрубение базаль-ной мембраны капилляров и их склероз, приводящие к умеренной протеинурии. На фоне венозного застоя развивается лимфо-стаз. В условиях нарастающей гипоксии возникает дистрофия нефроцитов главных отделов нсфрона и склероз стромы, который, однако, не бывает резко выраженным. Снижение сердечного выброса (ударного объема) приводит к уменьшению почечного кровотока, к спазму сосудов коркового вещества, что, с ОДНОЙ стороны, стимулирует ренин-ангиотензиновую систему, а с другой, усиливает ишемические повреждения канальцевого эпителия.
В селезенке хронический венозный застой также ведет к еецианотической индурации. Селезенка увеличена, плотна, темно-вишневого цвета; отмечаются атрофия фолликулов и склероз пульпы. При хроническом венозном полнокровии в условиях портальной гипертензии (при развитии мускатного фиброза печени) масса селезенки может превышать 500 г (спленомега-лия). До развития асцита, т.е. в стадии компенсации, строма пульпы аргирофильна, выражена гипертрофия мышечной оболочки селезеночных и трабекулярных артерий. В фазе декомпенсации отмечается фиброз стромы пульпы и стенок указанных сосудов, особенно кисточковых артерий, который следует дифференцировать от возрастного гиалиноза.
В легких при хроническом венозном полнокровии разви-ваются два вида изменений — множественные диапедезные кро-воизлияния, обусловливающиегемосидероз легких, иразрастание соединительной ткани, т.е.склероз. Легкие становятся большими, бурыми и плотными —бурая индурация (уплотнение) легких.
В морфогенезе бурого уплотнения легких основную роль играют застойное полнокровие и гипертензия в малом кру-ге с кровообращения. Бурая индурация легких развивается лишь в
118
119
исходе сосудистой декомпенсации нарушенного оттока по легочным венам. Ей предшествует длительная стадия адаптивной перестройки мелких ветвей легочной артерии и вен, выражающаяся в картине посткапиллярной гипертензии в малом круге. При этом развивается резкая гипертрофия мышечной оболочки внутри-дольковых вен, просвет их суживается, что предохраняет капилляры легких от регургитации крови. Гипертрофия мелких ветвей легочной артерии достигает максимума лишь при давлении в системе легочной артерии, в 3 раза превышающем нормальное. В этот период происходит перестройка по типу замыкающих сосудов, что приводит к еще большему сужению просвета. Со временем адаптивные изменения сосудов легких сменяются склеротическими, развивается декомпенсация легочного кровообращения, капилляры межальвеолярных перегородок переполняются кровью. Нарастает гипоксия ткани, в связи с чем повышается сосудистая проницаемость, возникают множественные диапедез-ные кровоизлияния. В альвеолах, бронхах, межальвеолярных перегородках, лимфатических сосудах и узлах легких появляются скопления нагруженных гемосидерином клеток — сидеробластов и сидерофагов, и свободнолежащего гемосидерина. Возникает диффузный гемосидероз легких. Гемосидерин и белки плазмы «засоряют» строму и лимфатические дренажи легких, что ведет к резорбционной недостаточности их лимфатической системы, которая сменяется механической. Склероз кровеносных сосудов и недостаточность лимфатической системы усиливают легочную гипоксию, которая становится причиной пролиферации фиброб-ластов, утолщения межальвеолярных перегородок. Возникаеткапиллярно-паренхиматозный блок, замыкающий порочный круг в морфогенезе индурации легких, развиваетсязастойный фиброз легких. Он более значителен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений кровяных пигментов (гемосидерина), фибрина. Пневмосклероз, как и гемосидероз, при буром уплотнении легких имеет каудоани-кальное распространение и зависит от степени и длительности венозного застоя в легких.