Кардиомиопатия такоцубо у подростков – новый
клинический вариант неклассифицируемых
кардиомиопатий
Сенаторова А.С. Стенковая И.А. Страшок А.И.*, Хаин М.А.*, Вергелис Н.В.*
Харьковский национальный медицинский университет, Областная детская клиническая больница*, г. Харьков.
Стресс-индуцированная кардиомиопатия, более известная в мировой литературе как кардиомиопатия (КМП) такоцубо, представляет собой транзиторную дисфункцию левого желудочка, имитирующую острый коронарный синдром, инфаркт миокарда с элевацией сегмента SТ без поражения коронарных артерий и возникающую, как правило, на фоне острого эмоционального или физического стресса.
Термин «такоцубо» впервые был введен японскими учеными Н.Sато и соавт. в 1990 году, так как при проведении больным с клиникой острого коронарного синдрома ангиографии левый желудочек по форме был похож на «керамический горшок с круглым основанием и узким горлышком для ловли осьминогов в море». Максимальное число наблюдений КМП такоцубо (88 пациентов) представлено K.Tsushikashi et al. [1, 2] и относится к женщинам в постменопаузе без признаков ишемической болезни сердца. В европейской популяции первое описание КМП такоцубо у 13 пациентов сделано W.J.Desmet et al. (Бельгия, 2003) [3]. Имеются также единичные публикации о КМП такоцубо у подростков [4] и двухлетней девочки [5]. В отечественной литературе КМП такоцубо у детей не описана, что, скорее всего, свидетельствует о неосведомленности врачей, чем об истинной ее распространенности. По данным японских исследователей у 1,7-2,2% пациентов, которые поступали с коронарным синдромом, впоследствии была диагностирована стресс-индуцированная КМП [6].
На данный момент в современной кардиологической науке используется ряд синонимов КМП такоцубо: стресс-индуцированная КМП, ампулоподобная КМП, синдром транзиторного расширения верхушки левого желудочка (ЛЖ), нейрогенный инфаркт, катехоламиновая КМП, Broken heart синдром, КМП напряжения.
В 2006 г. была опубликована новая классификация КМП Американской ассоциации сердца, которая основана на разделении по «причинно-следственному» принципу: выделены первичные и вторичные КМП.
I. Первичные КМП: изолированное (или превалирующее) повреждение миокарда.
К ним относятся:
1) Генетические: гипертрофическая КМП; аритмогенная дисплазия левого желудочка; некомпактный миокард левого желудочка; нарушения депонирования гликогена; дефекты проведения; митохондриальные миопатии; нарушения ионных каналов (синдром удлиненного интервала Q-T ; синдром Бругада; синдром укороченного интервала Q-T; синдром Ленегре; катехоламинэргическая полиморфная желудочковая тахикардия; синдром необъяснимой внезапной ночной смерти);
2) Смешанные: дилатационная КМП и рестриктивная КМП;
3) Приобретенные: воспалительная (миокардит); стресс-индуцированная (takоtsubo); перипартальная; тахикардие-индуцированная; у детей, рожденных матерями с инсулинзависимым сахарным диабетом.
II. Вторичные КМП: миокардиальное повреждение является частью генерализованных системных (мультиорганных) заболеваний [7].
Этиология. Этиологическим фактором КМП такоцубо является физический или эмоциональный стресс. По данным клинических наблюдений КМП также могут предшествовать травмы, острые неврологические заболевания, ургентные состояния, хирургические процедуры, инвазивные вмешательства, гиперергическая реакция (бронхиальная астма), прекращение употребления алкоголя, отмена опиатов, беременность, прием некоторых антибиотиков (левофлоксацин) [8, 9]. Существует гипотеза о наследственной предрасположенности к возникновению КМП такоцубо [10] и ее взаимосвязи с анатомическими особенностями левой передней нисходящей коронарной артерии, спазм которой может приводить к дисфункции соответствующих отделов ЛЖ, т.к. удлиненная артерия участвует в кровоснабжении не только передней стенки, но и верхушки с переходом на нижний отдел ЛЖ [11, 12].
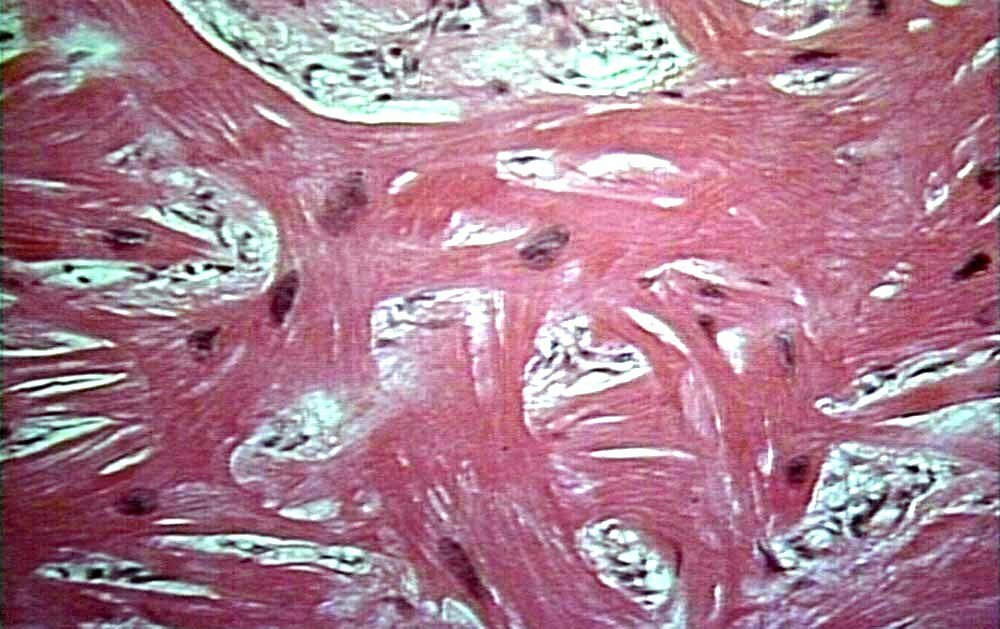
Еще одним патогенетическим вариантом развития заболевания рассматривается воспалительный процесс в миокарде [13]. Гистологическая картина миокардита — фокальный миоцитолиз, участки инфильтрации моноцитами и интерстициальный фиброз [14, 15]. Имеются данные о связи КМП такоцубо с S-образным строением межжелудочковой перегородки, обструкцией выходного тракта ЛЖ и меньшим объемом ЛЖ [16].
Патогенез. На данный момент патогенетические основы возникновения КМП такоцубо не изучены. Существует несколько возможных теорий патогенеза КМП такоцубо: увеличенная симпатоадреналовая активность, катехоламин-индуцированный множественный коронароспазм, коронарная микроваскулярная дисфункция, прямое кардиотоксическое действие катехоламинов и катехоламиновое оглушение (станнирование) миокарда [17]. Ряд исследователей считают, что КМП такоцубо представляет собой абортивную (прерванную) форму острого инфаркта миокарда [18].
Обобщая различные патогенетические теории КМП такоцубо, можно заключить, что в основе ее развития лежит прямое воздействие высоких концентраций адреналина на миокард желудочков при стрессе различного генеза. По сравнению с нормой концентрация катехоламинов может быть повышена в 34 раза, значительно превышая таковую у больных с острым инфарктом миокарда или сердечной недостаточностью [19]. Однако такие показатели регистрируются не всегда. Период полураспада адреналина составляет 3 минуты, а больные могут поступать в клинику через сутки, двое.
При физиологических и надфизиологических концентрациях норадреналин, высвобождаемый из симпатических нервных окончаний, действует на кардиомиоциты желудочков в основном через 1-АР, оказывая положительное инотропное и хронотропное действие. Данный эффект возникает в результате каскада биохимических реакций, запускаемых вследствие изменения конформации белка Gs за счет образования комплекса гормон-рецептор, что приводит к активации аденилатциклазы и, как следствие, к увеличению концентрации цАМФ. Последний активирует протеинкиназу А, которая фосфорилирует несколько участвующих в этой цепи внутриклеточных мишеней, изменяя скорость регулируемых ими процессов и приводя к увеличению сократительной способности кардиомиоцитов («оглушение» миокарда). При этом происходит спазм коронарных артерий, нарушение функции микрососудистого русла сердца. При электронной микроскопии обнаруживается повреждение базальной мембраны митохондрий, фиброз, некроз, отек и гибель клетки. При снижении концентрации адреналина функция миокарда восстанавливается [20].
Клиника и диагностика. Больные предъявляют жалобы на приступ острой загрудинной боли, боли в левой половине грудной клетки, одышку, сердцебиение, симптомы расстройства мозгового кровообращения (тошнота, рвота, головокружение, эпилептиформный припадок, синкопэ), возникшие, как правило, после стресса [21, 22, 23, 24]. При этом на ЭКГ регистрируется подъем сегмента ST в грудных отведениях, максимально в V2-3, с последующим удлинением интервала QT, инверсия и увеличение амплитуды зубца Т [21, 25]. Изменения на ЭКГ могут сопровождаться повышением уровней маркеров некроза миокарда [21, 26]. Уровни катехоламинов повышаются редко. По данным ЭхоКГ определяется дисфункция и дискинезия ЛЖ, затрагивающие верхушку и часто межжелудочковую перегородку, не вовлекая в процесс базальный миокард [21, 25]. При вентрикулографии, магнитно-резонансной томографии выявляются изменения полости ЛЖ, которые по форме напоминают такоцубо. При аортокоронарографии окклюзии, аномалии сосудов не определяются.
Дифференциальный диагноз. Так как КМП такоцубо имитирует приступ острого коронарного синдрома, в первую очередь необходимо исключить последний. При стресс-индуцированной КМП отсутствуют поражения коронарных артерий. Также необходимо провести дифференциальный диагноз между кардиальными (перикардит, КМП, патология клапанов, расслаивающаяся аневризма аорты, коарктация аорты, цереброваскулярная недостаточность) и внекардиальными состояниями (инфаркт легких, тромбоэмболия легочной артерии, пневмония, плеврит, пневмоторакс, эзофагоспазм, холецистит, патология позвоночных дисков, воспаление межреберных мышц, остеохондроз, грыжи межпозвоночных дисков, серповидноклеточная анемия), при которых может наблюдаться подобная симптоматика.
Течение, осложнения, прогноз. Несмотря на яркую клиническую и электрокардиографичекую симптоматику, прогноз заболевания благоприятный: у 95% пациентов наблюдается полное восстановление функции ЛЖ в течение 4-8 недель, риск рецидивов составляет 1-10% [27]. Однако по данным литературы у 20% пациентов наблюдаются осложнения, такие как сердечная недостаточность, перикардит, нарушение ритма и проводимости, кардиогенный шок, остановка сердца и внезапная смерть [17]. Смертность составляет от 1 до 3,2% [21].
Лечение не разработано. Терапия симптоматическая, в первую очередь – устранение причины, вызвавшую стресс (психический, физический, эмоциональный, эндогенный и др.). Поскольку симпатоадреналовая активация является основной в патогенезе КМП такоцубо, для лечения и профилактики рецидивов предпочтительна длительная терапия -адреноблокаторами с -адренергической активностью (например, карведилол). До восстановления сократительной функции ЛЖ рекомендуют ингибиторы АПФ. Учитывая риск развития тромбообразования используют также антикоагулянты.
Собственные наблюдения. Под наблюдением находилось 3 подростка 14, 16, 17 лет, которые поступали в кардиологический центр Областной детской клинической больницы г.Харькова за период 2008-2009 гг. с жалобами на загрудинные боли, сердцебиение, одышку.
Заболевание дебютировало после психоэмоционального стресса (конфликт со сверстниками, сдача вступительных экзаменов, сельхозработы). Все дети поступали в клинику на 1- 3 сутки с диагнозом острый коронарный синдром.
В анамнезе жизни обращала на себя внимание отягощенная наследственность по сердечно-сосудистым заболеваниям (гипертоническая болезнь, инфаркт миокарда, ишемическая болезнь сердца). При объективном исследовании отмечались тахикардия до 120 за 1 мин. повышение АД до 150/90 мм рт.ст. других изменений со стороны ССС выявлено не было. Уровни маркеров повреждения миокарда – тропонина І и КФК-МВ – не повышались – 0,03 нг/мл и 8,0 ед/л соответственно (норма КФК-МВ до 25, тропонина І 0-0,5); уровень адреналина – в норме.
По данным ЭхоКГ определялась дисфункция, дискинезия левого желудочка, затрагивающие верхушку и межжелудочковую перегородку. При аортокоронарографии – окклюзии, аномалий сосудов не выявлено.
Р ис. 1
ис. 1
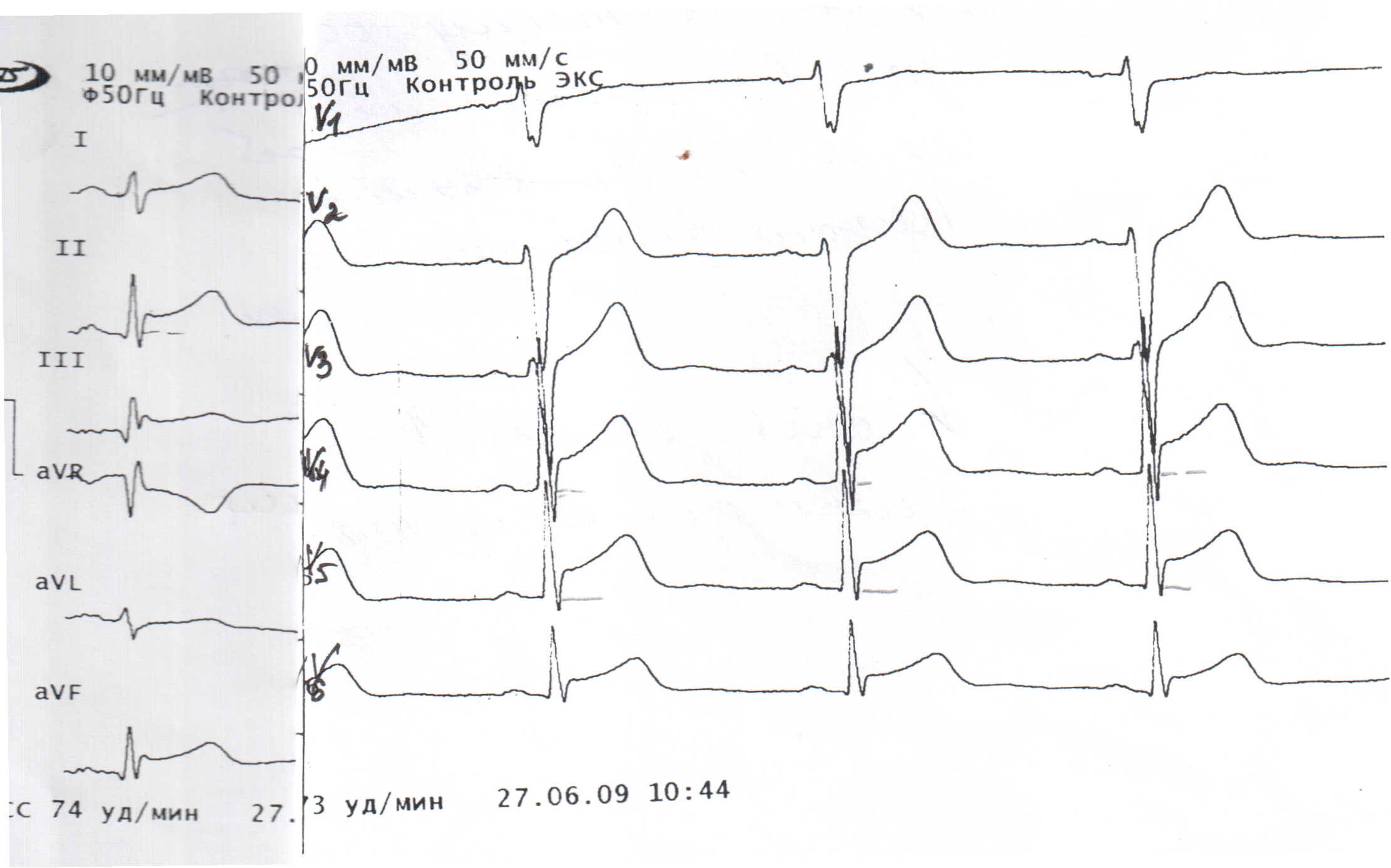
На рис. 1 представлена ЭКГ подростка А. 16 лет. Диагноз: КМП такоцубо. Первые сутки заболевания. Ритм синусовый. Нарушение реполяризации: в отведениях II, III, VF, V4-5 отмечается элевация сегмента ST до 3 мм в области нижней стенки, боковой стенки и верхушки ЛЖ. Низкий вольтаж в стандартных отведениях
Рис. 2
В динамике на ЭКГ (рис. 2) через 10 дней от начала заболевания: ритм синусовый, вольтаж в стандартных отведениях снижен. Выраженные нарушения реполяризации области верхушки, боковой стенки и нижней стенки ЛЖ (в динамике в отведениях II, III, VF, V4-5
– инверсия зубца Т – отрицательные, глубокие, симметричные).
Рис. 3
Через 1,5 мес. от начала заболевания ребенок поступил на контрольное обследование. ЭКГ в пределах нормы (рис. 3), новые эпизоды КМП такоцубо не отмечались.
Таким образом, клинические проявления и данные ЭКГ у подростков были сходные с острым коронарным синдромом. Последний был исключен после проведения аортокоронарографии.
Список литературы.
Dote K. Satoh H. Tateishi H. et al. Myocardial stunning due to simultaneous multivessel coronary spasm : a review of 5 cases // Cardiol. – 1991. — №21. – с. 203-214.
Tsushikashi K. Ueshima K. Uchida T. Transient left ventricular apical ballooning syndrome without coronary artery stenosis: a novel heart syndrome mimicking acute myocardial infarction // J Amer Coll Cardiology 2001; 38(1): 11-18.
Desmet W.J. Adriaenssens B.F. Dens J.A. Apical ballooning of the left ventricle: rst series in white patients // Heart 2003; 89: 1027-1031.
Biteker M. Duran N.E. Civan H.A. et al. Broken heart syndrome in a 17-year-old girl // European Journal of Pediatrics. – 2009. – Vol. 168. – № 10. – p.1273-1275.
Maruyama S. Nomura Y. Fukushige T. et al. Suspected takotsubo cardiomyopathy caused by withdrawal of bupirenorphine in a child // Circ J. 2006; 70(4): 509-511.
Ito K. Sugihara H. Katoh S. et al. Assessment of Takotsubo (ampulla) cardiomyopathy using 99mTc-tetrofosmin myocardial SPECT-comparison with acute coronary syndrome // Ann Nucl Med 2003; 17: 115-122.
Maron B.J. Towbin J.A. Thiene G. et al. American Heart Association; Councilon Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; Council on Epidemiology and Prevention. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention // Circulation. – 2006. – Vol. 113. – P.1807-1816.
Osuorji I. Williams C. Hessney J. et al. Acute stress cardiomyopathy following treatment of status asthmaticus // South Med J 2009; 102(3): 301-303.
Arora S. Alfayoumi F. Srinivasan V. Transient left ventricular apical ballooning after cocaine use: is catecholamine cardiotoxicity the pathologic link? // Mayo Clin Proc. 2006; 81(6): 829-832.
Kumar G. Holmes DR Jr. Prasad A. “Familial” apical ballooning syndrome (Takotsubo cardiomyopathy) // Int J Cardiol. 2009 Apr 16.
Akashi Y.J. et al. Left Ventricular Rupture Associated With Takotsubo Cardiomyopathy. Mayo Clin Proc 2004; 79: 821—824.
Ibanez B. et al. Tako-tsubo transient left ventricular apical ballooning: is intravascular ultrasound the key to resolve the enigma? // Heart 2005; 91: 102—104.
Mori H. et al. Increased responsiveness of left ventricular apical myocardium to adrenergic stimuli // Cardiovasc Res 1993; 27: 192—198.
Kawano H. et al. Histological study on the distribution of autonomic nerves in the human heart // Heart Vessels 2003; 18: 32—39.
Kneale B.J. et al. Gender differences in sensitivity to adrenergic agonists of forearm resistance vasculature // J Am Coll Cardiol 2000; 36: 1233—1238.
Vizzardi E. et al. A case report of «Tako-tsubo-like» syndrome // The Internet Journal of Cardiology 2007; 4: 2.
И.Н.Лиманкина. Кардиомиопатия такотсубо // Вестник аритмологии. – 2009. — № 56. – с. 48-58.
Borja Ibanez, Brian G. Choi, Felipe Navarro, Jeronimo Farre. Tako-tsubo sy ndrome: a form of spontaneous aborted myocardial infarction? // European Heart Journal 2006 27(12):1509-1510.
Gong H. et al. The specific 2AR blocker, ICI 118,551, actively decreases contraction through a Gicoupled form of the 2AR in myocytes from failing human heart // Circulation 2002; 105: 2497—2503.
М. Ю. Гиляров М. С. Сафарова А. Л. Сыркин. Стресс-индуцированная кардиомиопатия (синдром тако-цубо) // Кардиология и сердечно-сосудистая хирургия. – 2008. — №2.
Gianni M. Dentali F. Grandi A.M. et al. Apical ballooning syndrome or takotsubo cardiomyopathy: a systematic review // Eur. Heart J 2006; 27: 1523-1529.
Pezzo S.P. Hartlage G. Edwards C.M. Takotsubo cardiomyopathy presenting with dyspnea // J Hosp Med. 2009; 4(3): 200-202.
Sasaki. Nishioka T. Akima T. et al. Association of takotsubo cardiomyopathy and long QT syndrome // Circ J. 2006; 70(9): 1220-1222.
Legriel S. Bruneel F. Dalle L. et al. Recurrent takotsubo cardiomyopathy triggered by convulsive status epilepticus // Neurocrit Care. 2008; 9(1): 118-121.
Salim S. Virani, A. Nasser Khan, Cesar E. Mendoza, Alexandre C. Ferreira and Eduardo de Marchena // Takotsubo Cardiomyopathy, or Broken-Heart Syndrome. — Texas Heart Institute Jornal. – 2007. — №34(1). – p.76-79.
Ramaraj R. Sorrell V.L. Movahed M.R. Levels of troponin release can aid in the early exclusion of stressinduced (takotsubo) cardiomyopathy // Exp Clin Cardiol. 2009; 14(1):6-8.
Bybee K.A. Prasad A. Stress-related cardiomyopathy syndromes // Circulation. 2008; 118: 397-409.
Журнал «Здоровье ребенка» 6(21) 2009
Вернуться к номеру
Провоспалительные цитокины в формировании аритмогенной кардиомиопатии у подростков
Авторы: Богмат Л.Ф. Михальчук О.Я. Молева В.И. ГУ «Институт охраны здоровья детей и подростков АМНУ», г. Харьков
Версия для печати
Резюме / Abstract
В работе проанализированы результаты изучения уровня провоспалительных цитокинов, индукторов апоптоза и показателей воспаления у подростков с различными вариантами нарушений сердечного ритма и проводимости. Установлено повышение уровня провоспалительных цитокинов и активация процессов апоптоза различной степени выраженности при отсутствии увеличения факторов системного воспаления.
Ключевые слова / Key words
нарушения ритма, провоспалительные цитокины, подростки, аритмогенная кардиомиопатия.
В педиатрической практике нарушения сердечного ритма нередко возникают без наличия органической патологии и предшествующего воспалительного фона. В ряде случаев эти изменения приводят к нарушению архитектоники сердечной мышцы и снижают ее насосную и сократительную функцию, что в дальнейшем приводит к формированию аритмогенной кардиомиопатии. Одной из причин гибели кардиомиоцитов и ремоделирования интерстициального пространства является активация процессов апоптоза [1, 2, 4]. Ускорение физиологической гибели клетки в определенной степени поддерживается цитокинассоциированными механизмами [7]. В настоящее время активно изучаются различные пути индукции апоптоза, в том числе через рецептор для Fas-опосредованного апоптоза (CD95) [6]. Повышенный синтез провоспалительных цитокинов, в частности фактора некроза опухоли a (ФНО-a), интерлейкина-1b (ИЛ-1b), интерлейкина-6 (ИЛ-6), а также нарастание количества CD95 могут инициировать процессы фиброза или тканевой регенерации [3, 5, 7, 8].
В связи с этим изучение уровня провоспалительных цитокинов и их взаимосвязи с начальными проявлениями ремоделирования миокарда у подростков с нарушениями ритма и проводимости представляет интерес для понимания патогенетических аспектов формирования аритмогенной кардиомиопатии у этой категории больных.
Это и явилось целью данного исследования.
Материалы и методы исследования
Обследовано 64 подростка 13–18 лет с различными вариантами нарушений ритма и проводимости. Группу контроля составили 22 практически здоровых их сверстника.
В комплекс исследований входило изучение уровня провоспалительных цитокинов IL-1b, IL-6 и ФНО-a в сыворотке крови твердофазным иммуноферментным методом с использованием тест-систем ЗАО «Вектор-Бест» (Россия) на иммуноферментном анализаторе Humareader (Германия). Исследовались также экспрессия CD95/Fas антигена лимфоцитов периферической крови как маркера апоптоза, уровень С-реактивного белка (СРБ) и антистрептолизин-О (АСЛ-О) как показателей системного воспаления.
Для оценки морфофункциональных характеристик сердца использовалось ультразвуковое исследование в М- и В-режимах на аппарате цифровой системы ультразвуковой диагностики SА-8000 Live (Madison, Корея) по стандартной методике, рекомендованной Американской ассоциацией ультразвуковой диагностики (1991). Определялись фракция выброса (ФВ), ударный объем (УО), показатель изоволюметрического сокращения миокарда левого желудочка (%DS), минутный объем крови (МОК), конечный диастолический объем (КДО), конечный диастолический размер (КДР), конечный систолический объем (КСО), конечный систолический размер (КСР), толщина миокарда левого желудочка (ТМЛЖ), толщина миокарда межжелудочковой перегородки (ТММЖП), индекс массы миокарда левого желудочка (ИММЛЖ), частота сердечных сокращений (ЧСС), общее периферическое сосудистое сопротивление (ОПСС).
Всем подросткам проведено холтеровское мониторирование ЭКГ в течение суток (24 часа) на аппарате 3СН-РМ-АВРМ с программным обеспечением CARDIOSPY (LABTECH, Венгрия) для бифункционального мониторирования АД и ЭКГ.
Статистическая обработка полученных результатов проведена с помощью программы Statgraphics 5.0 с использованием пара- и непараметрических методов и корреляционного анализа.
Результаты исследования и их обсуждение
Проведение суточного мониторирования ЭКГ у подростков позволило установить различные нарушения ритма и проводимости и на основе этого разделить пациентов на пять подгрупп. Первую составили 7 (10,9 %) детей с умеренными нарушениями ритма и проводимости, у которых регистрировались суправентрикулярные и желудочковые экстрасистолы с частотой не более 30 за один час, и тахикардия, которая регистрировалась менее 45 % времени суток; во вторую подгруппу были включены 13 (20,31 %) подростков, у которых тахикардия превышала 100 ударов в минуту, регистрировалась более 45 % времени и не была связана с физическим и психоэмоциональным напряжением; в третью подгруппу вошло 12 (18,75 %) пациентов, имеющих желудочковые экстрасистолы высоких градаций (более 10 000 в течение суток); в четвертую были включены 15 (23,43 %) подростков с удлиненным корригированным интервалом QT (более 450 мс), а в пятую подгруппу отобрано 17 (26,56 %) пациентов с нарушениями проводимости (феномен или синдром WPW, синоаурикулярные (СА) и атриовентрикулярные (АВ) блокады).
Анализ морфофункциональных характеристик сердца показал, что у подростков с аритмиями происходит достоверное увеличение систолических размера и объема левого желудочка (p
Исследование содержания провоспалительных цитокинов выявило (табл. 2), что у подростков с аритмиями отмечается повышение уровня таких цитокинов, как ФНО-a (р
В результате изучения уровня провоспалительных цитокинов у подростков в выделенных подгруппах с различными видами нарушений ритма и проводимости установлены некоторые различия в показателях цитокинового профиля (табл. 3).
Так, у подростков первой подгруппы (с умеренными нарушениями ритма и проводимости) достоверное увеличение уровня ФНО-a (р
У исследуемых пациентов второй (с тахикардиями), третьей (с желудочковыми экстрасистолами высоких градаций) и пятой подгрупп (с феноменом или синдромом WPW, СА- и АВ-блокадами) установлено повышение ФНО-a (р
Следует отметить, что показатели системного воспаления во всех подгруппах или не определялись, или были очень низкими (у 4 больных СРБ был не выше 6 г/л, а АСЛ-О у 9 подростков не превышал 500 МЕ/мл).
На основе полученных результатов исследований проведен корреляционный анализ между уровнем цитокинов, содержанием СD95+-лимфоцитов и функциональными параметрами сердца по группе в целом и в отдельных изучаемых подгруппах. Так, в первой из них (с умеренными нарушениями ритма и проводимости) установлено наличие обратных корреляционных связей ФНО-a и КДО (r = –0,89; р
Таким образом, у подростков с аритмиями, в отсутствие каких-либо клинических и лабораторных признаков воспалительных процессов, выявлено повышение уровня провоспалительных цитокинов и индукторов апоптоза. Установленные корреляционные взаимодействия изучаемых цитокинов с морфофункциональными характеристиками сердца свидетельствуют об активном их влиянии на процессы ремоделирования миокарда с нарушением его насосной функции.
Выводы
1. У подростков с нарушениями ритма и проводимости установлено повышение уровня провоспалительных цитокинов и индукторов апоптоза при отсутствии активации факторов системного воспаления.
2. Наличие прямых корреляционных взаимосвязей СD95 с ИММЛЖ, а также обратных связей ФНО-a с КДО, ТМ, ФВ и %DS свидетельствует о непосредственном их влиянии на процессы ремоделирования сердца с нарушением сократительной функции миокарда.
Список литературы / References
1. Антонов А.Р. Васькина Е.А. Чернякин Ю.Д. Цитокины и биометаллы при артериальной гипертензии // Современные проблемы науки и образования. — 2007. — № 3. — С. 23-28.
2. Визир А.А. Березин А.Е. Иммуновоспалительная активация как концептуальная модель формирования и прогрессирования сердечной недостаточности // Тер. архив. — 2000. — № 4. — С.77-80.
3. Иммунохимические медиаторы повреждения миокарда у детей с хронической сердечной недостаточностью / Ю.В. Шматкова, Т.В. Бершова, Е.Н. Басаргина и др. // Педиатрия. — 2008. — № 2. — С. 6-9.
4. Роль фактора некроза опухоли a и интерлейкина 6 в патогенезе недостаточности кровообращения у детей с кардиомиопатиями / Т.В. Бершова, М.И. Баканов, И.В. Чибисов и др. // Педиатрия. — 2005. — № 2. — С. 8-13.
5. Сєркова В.К. Майко О.В. Вміст цитокінів і С-реактивного протеїну у хворих з хронічною серцевою недостатністю // Укр. кардіол. журн. — 2006. — № 3. — С. 64-66.
6. Ушкварок Л.Б. Влияние ингибиторов ангиотензинпревращающего фермента и бета-адреноблокаторов на механизмы развития апоптоза при хронической сердечной недостаточности // Укр. тер. журн. — 2006. — № 1. — С.43-47.
7. Цитокины: общебиологические и кардиальные эффекты / О.Н. Ковалева, Т.Н. Амбросова, Т.В. Ащеулова, С.В. Демьянец. — Харьков, 2007. — 226 с.
8. Li Y. Takemura G. Kosai K. et al. Critical roles for the Fas/Fas ligand system in postinfarction ventricular remodeling and heart failure // Circ. Res. — 2004. — Vol. 95. — P. 627-636.
Кардиопатии в практике педиатра
Все больше и больше детей с врожденными или приобретенными пороками сердца, еще несколько лет назад считавшимися фатальными, выживает благодаря прогрессу медикаментозного и хирургического лечения. Хотя эти дети по своим проблемам со стороны сердца лечатся специалистами, практикующими обычно в центрах четвертой степени оказания помощи или университетских клиниках, но на педиатра общей практики ложится обязанность тщательного наблюдения и не специализированного лечения. Педиатр должен наблюдать за детьми с тяжелыми заболеваниями сердца, состояние здоровья которых может быстро измениться в худшую сторону. Кроме того, методы лечения меняются и быстро развиваются и иногда не соответствуют уже тем знаниям, которые получил педиатр во время своего становления. Чтобы оптимальным образом лечить своих пациентов первейшее значение имеет достижение сотрудничества между педиатром общей практики и кардиологом-педиатром.
Эта статья не дает подробный обзор всей кардиопатологии и ее последствий, но ставит своей целью определить роль, которую может и должен играть педиатр в лечении таких пациентов. Как и каждый ребенок с хроническим заболеванием, ребенок в кардиопатологией нуждается в трех различных видах ухода: основное педиатрическое ведение; ведение специфическое сердечной патологии; ведение связанное с наличием хронического заболевания включающие психо-социальные аспекты и аспекты развития ребенка и его семейное окружение.
ОСНОВНЫЕ ПЕДИАТРИЧЕСКИЕ ПОДХОДЫ
Дети с хроническими заболеваниями часто не получают пользы от основных педиатрических мероприятий. Лечащий врач общей практики или специалист всегда склонен концентрироваться на основной патологии и забывать о других медицинских потребностях. Эта проблема является первым камнем преткновения, которой надо избежать и доказать необходимость правильного лечения педиатром общей практики.
Общая педиатрия играет основную роль в отношении соблюдения сроков прививок, вакцинация не только позволительна, но и рекомендуется детям кардиопатам. При последовательных консультациях он должен наблюдать за ростом и психомоторным развитием ребенка. Он также должен лечить болезни и интеркуррентные травмы, которые могут появиться. Заболевания ЛОР-органов и респираторные заболевания наиболее часто встречаются у маленьких детей. Амигдалиты, отиты и мастоидиты должны лечиться антистрептококковыми антибиотиками с целью перекрытия входных ворот для эндокардита. То же касается и инфицированных кожных поражений таких, как панариций и импетиго. Но в то же время не следует излишне оберегать ребенка кардиопата назначая ненужное лечение и вполне достаточно, чтобы антибиотики применялись для лечения бактериальных инфекций, а не при всех фебрильных состояниях, большинство из которых вызывается вирусами. Педиатр общей практики имеет идеальные возможности давать советы по профилактике и по поведению пациента и членов его семьи, в частности, о гигиене зубов. Это последнее имеет особое значение, так как ротовая полость часто является входными воротами бактериемий.
СПЕЦИФИЧЕСКОЕ ЛЕЧЕНИЕ ПРИ ЗАБОЛЕВАНИИ СЕРДЦА
При обращении к медицинской литературе можно увидеть, что существует гораздо больше материала в отношении диагностики кардиопатий у ребенка, как и по ведению ее, в частности, для неспециалиста в области кардиологии.
Медицинское лечение и/или хирургическое на практике определяется специалистом. Хотя, терапевтические подходы похожи в отношении каждой большой группы кардиопатий, каждому пациенту необходим отдельный подход и специалист должен в отношении правильности выбора сотрудничать с педиатром.
Необходимо дифференцировать различные группы пациентов: пациенты, которым операция не нужна (небольшая межжелудочковая коммуникация), где необходимо в основном уделять внимание профилактике эндокардита; пациенты в ожидании операции со значительным лево-правосторонним шунтом с риском развития респираторных инфекций, или носители тетрады Фалло с риском развития аноксических кризов; дети успешно прооперированные с остаточными нарушениями или без них и, наконец, пациенты которые могут получить бенефит только от проведения паллиативной операции.
Признаки и симптомы, требующие наблюдения
Кардиолог должен также ознакомить педиатра с тем, какие признаки и симптомы требуется наблюдать у каждого отдельного пациента. Они зависят от возраста и типа кардиопати. Эти симптомы фактически идентичны таковым позволяющим выявить и диагносцировать врожденные или приобретенные пороки. Они связаны с оксигенацией (цианоз), с сердечным дебитом (сердечная недостаточность) и легочным (цианоз при небольшом дебите, или сердечная недостаточность по повышенном дебите), или с сердечным ритмом (тахи- или брадиаритмия, сердцебиения, торакальные боли) и являются общими для больших групп врожденной или приобретенной кардиопатии. Наличие сердечных шумов или, тем более, изменение их тональности, интенсивности или продолжительности должны вызывать изменения на уровне сердца. Признаки и симптомы имеющие большое значение для выявления потенциальной проблемы или ухудшения заболевания представлены на таблице 1.