Эксимерная лазерная коронарная ангиопластика в комбинированном интервенционном лечении пациентов с острым коронарным синдромом
Рентгенохирургический центр интервенционной кардиологии, Москва; Главный военный клинический госпиталь им. акад. Н.Н. Бурденко, 105229 Москва, Госпитальная площадь, 3
Представлен первый отечественный опыт применения эксимерной лазерной коронарной ангиопластики. В статье рассматриваются потенциальные пре имущества использования энергии эксимерного лазера при эндоваскулярных вмешательствах на коронарных артериях, приводятся показания и противопоказания к применению данной интервенционной процедуры. Обсуждаются результаты клинических исследований, анализирующих эффективность и безопасность эксимерной лазерной коронарной ангиопластики у пациентов с острым коронарным синдромом, сниженной фракцией выброса.
История может показаться довольно банальной, но для меня это жизнь и качество жизни.
После развода начались проблемы гинекологического характера. Не сразу, конечно, прошло лет 5, но они, к сожалению, начались.
Раздражительность, усталость, нарушение цикла, боли в пояснице. Посетила своего гинеколога, сказал, что это миома. Пока небольших размеров, можно особо не беспокоиться, будем ждать и наблюдать.
Донаблюдались мы до очень приличных размеров и полного эмоционального психоза с моей стороны. И тут врач предложил удалить миому вместе с маткой. Но это же НЕПРАВИЛЬНО. Короче, расстроилась я просто ужасно, начиталась разных статей, что можно и не удалять матку, я еще молодая, мне жалко…
От растройства и отчаяния написала на адреса разных клиник в Германию, в Израиль. Написала просто так, хотела услышать успокоение и подтверждение моих мыслей относительно дальнейшего лечения.
Со мной связались несколько представителей из клиник Израиля и Германии, и решила я съездить за дополнительным мнением.
Решение приняла сразу после разговора с Татьяной из Медис Клиник. Замечательный человек! Все спокойно рассказала, успокоила, связала с врачом, помогла советами, как и что делать. Просто пошагово мне все разъяснила, такая молодец! Спасибо ей большое.
Ехала я в Израиль, как к подружке своей уже.
Организация, конечно, просто КЛАСС! Встретили, поселили, сразу позвонили сообщить, что будет завтра, все расписание. Водитель показал, где магазины, дал все телефоны, с кем я буду общаться, вобщем было просто здорово!
И в своем мнении относительно миомы я оказалась права. Израильский гинеколог, профессор, удивился, что мне хотели удалить матку, сказал, что это самый крайний вариант и посоветовал сделать эмболизацию артерий.
Лечение по нашим меркам дорогое, но мне было так спокойно было в Израиле, что я решила все сделать там. И согласилась! И не жалею!
Сделали мне все в Ассуте, к вечеру отпустили "домой", то есть в отель.
В этот вечер мне позвонили все! И доктор Лена, которая курировала весь этот процесс, и Алиса, которая занималась моими бытовыми вопросами, и Элла, и Таня и даже водитель, который меня утром в больницу отвозил.
Потом я уехала домой, но эти люди остаются со мной на связи. Спрашивают, как дела, как жизнь, здоровье, если мне нужны какие-то лекарства, поздравили недавно с днем рождения.
Рада, что познакомилась с ними и с Израилем! Спасибо, ребята!
Простите за не скорое письмо по поводу результатов лечения после нашего посещения Вашей компании с нашей дочерью Кристиной в Тель-Авиве в мае месяце.
Применение эксимерного лазера и надувного баллона для ангиопластики по поводу окклюзии коронарных артерий: рандомизированное сравнительное исследование
YEA Appelman, J.J. Piek, S. Strikwerda, J.G.P. Tijssen, PJ. de Feyter, O.K. David, P.W. Sermys, J.R. Margolis, MJ. Koelemay, E. W.J. Montauban van Swijndregt, J.J. Koolen
University of Amsterdam Department of Cardiology (Y.E.A.Appelman MD, J.J. Piek MD, G.K. David MD) and Department of Clinical Epidemiology and Biostatistics (ProfJ.G.P. Tijssen PhD, M.J. Koelemay MD) Academic Medical Center, Meibergdreef 9, 1105AZ Amsterdam, Netherlands; Thoraxcenter, Rotterdam, Netherlands (S. Strikwerda MD, P.J. de Feyter MD, P. W. Serruys MD, R. W.J. Montauban van Swijndregt); the Miami Heart Institite, Miami USA ( J.R. Margolis MD); and Catharina Hospital, Eindhoven, Netherlands ( J.J. Koolen MD) Correspondence to: Dr Jan J. Piek
Краткое содержание
Обоснование. Имеются сообщения, что ангиопластика коронарных сосудов с помощью эксимерного лазера дает отличные результаты при лечении сложных поражений коронарных сосудов, однако этот метод не сравнивали с ангиопластикой с применением надувного баллона в рандомизированном исследовании.
Методы. В испытание было включено 308 пациентов с устойчивой стенокардией и поражением коронарных сосудов на участке длиной более 10 мм при визуальном определении. 151 пациенту (158 поражений) была произвольно назначена лазерная ангиопластика, а 157 пациентам (167 поражений) — ангиопластика с применением надувного баллона. Первичными клиническими конечными точками были смерть, инфаркт миокарда, операция шунтирования коронарных сосудов или повторная ангиопластика коронарных сосудов рандомизированного сегмента в течение 6 мес наблюдения. Первичной ангиографической конечной точкой был минимальный диаметр просвета сосуда в сравнении с исходной величиной (чистая прибавка), что определялось с помощью количественной коронарной ангиографии.
Результаты. После лазерной ангиопластики в 98% операций проводили ангиопластику с применением надувного баллона. По данным ангиографии, успех был достигнут у 80"о пациентов, пролеченных с помощью лазерной ангиопластики, против 79% пациентов, которым проводили ангиопластику с помощью надувного баллона. Ни один из пациентов не умер. Инфаркт миокарда, операция коронарного шунтирования и повторная ангиопластика имели место соответственно у 4,6, 10,6 и 21,2 % пациентов в группе, подвергшейся лазерной терапии, по сравнению с 5,7, 10,8 и 18,5% в группе, которой проводили ангиопластику с помощью надувного баллона. Чистая прибавка в минимальном диаметре просвета сосуда составила в среднем 0,40 мм (+/-0,69 мм) у пациентов, леченных с помощью лазерной ангиопластики, и 0,48 мм (+/-0,66 мм) у тех, кого лечили с помощью баллонной ангиопластики (р = 0,34). Уровень рестеноза (диаметр стеноза более 50%) составил 51,6% в группе лазерной ангиопластики, а в группе баллонной ангиопластики -41,3% (р= 0,13).
Интерпретация. Ангиопластика с применением эксимерного лазера с последующей баллонной ангиопластикой не имеет дополнительных преимуществ по сравнению только с баллонной ангиопластикой в отношении начального и долгосрочного клинического и ангиографического исхода при лечении окклюзии коронарной артерии.
Введение
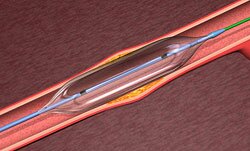
Эксимерная лазерная коронарная ангиопластика (ЭЛКА) — метод, применяемый для лечения окклюзии коронарных артерий. Эксимерная лазерная система хорошо зарекомендовала себя при удалении атеросклеротической ткани по сравнению с другими лазерными разработками, поскольку излучение проникает неглубоко и наносит стенкам сосудов лишь ограниченные повреждения [1-4]. Проспективные нерандомизированные исследования (ЭЛКА) [6-8] показали значительное повышение уровня первичного успеха и уменьшение процедурных осложнений у пациентов со сложными коронарными поражениями по сравнению с результатами баллонной ангиопластики [5]. Эти обнадеживающие результаты послужили основанием для проведения рандомизированного испытания, целью которого было определить ценность лазерной ангиопластики как альтернативного подхода к лечению окклюзии коронарных артерий. Большинство пациентов считались подходящими для коронарной ангиопластики при наличии длинного (> 10 мм) участка поражения коронарного сосуда. Учитывая этот факт, мы предприняли рандомизированное испытание, чтобы оценить начальный и долгосрочный клинический и ангиографический исход ЭЛКА по сравнению с таковым после баллонной ангиопластики у пациентов с длинными участками поражения сосудов.
Методы
Отбор пациентов
После завершения экспериментальной фазы, включающей 71 пациента [9], в сентябре 1991 г. было начато многоцентровое амстердамское-роттердамское (АМРО) испытание, которое было закончено в ноябре 1993 г. На основании результатов нерандомизированных испытаний ЭЛКА мы ожидали, что уровень первичного операционного успеха после ЭЛКА составит более 85%, а после баллонной ангиопластики — менее 70%. Таким образом, при альфа-ошибке 0,05 и бетаошибке 0,20 потребовалось включить в каждую группу лечения по 120 пациентов при условии полного наблюдения. Сочли необходимым отобрать 300 пациентов. принимая во внимание, что 20% из них не смогут проходить ангиографическое наблюдение. Все пациенты (с поражением одного или нескольких сосудов) со стабильной стенокардией, с участком поврежде ний коронарных сосудов длиной более 10 мм при визуальной оценке и общей или функциональной окклюзией (тромболизис при инфаркте миокарда ТПИМ, кровоток степени 0 или 1) [10], которые подходили для коронарной ангиопластики, были отобраны для включения в испытание. Клиническими критериями исключения из испытания были: нестабильная стенокардия, инфаркт миокарда в течение предшествующих 2 нед, предполагаемая продолжительность жизни менее 1 года, наличие факторов, затрудняющих клиническое и ангиографическое наблюдение. Ангиографическими критериями исключения были: планирование ангиопластики по пересадке венозного обходного шунта, открытое основное левостороннее заболевание, сильное искривление сосудов, высокоэксцентричные поражения, сосуды с поражениями устья, поражения с угловыми искривлениями более чем в 45°, раздвоенные поражения, поражения аортального устья, поражения с ангиографически доказанным тромбом или расслоением, а также полные окклюзии с малой вероятностью прохождения проволочного направления (II]. Протокол был одобрен институтскими научными советами центров, участвующих в исследовании.
Рандомизация
Пациентам произвольно назначали по телефону из центрального офиса лазерную ангиопластику или баллонную ангиопластику после того, как было установлено что они подходят для участия в испытании и получено их письменное согласие. Поражения, при которых показана только баллонная ангиопластика, были указаны по рандомизации у пациентов с множественными поражениями. Все поражения коронарных сосудов у пациента, который соответствовал критериям отбора, были пролечены согласно назначению.
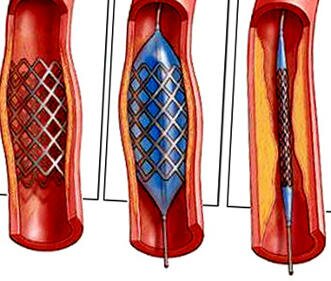
Лазерная ангиопластика и баллонная ангиопластика Медикаментозная противостенокардическая терапия продолжалась вплоть до операции. Антагонист кальция (нифедипин, по 20 мг 3 раза в день) пациенты получали в течение всего времени пребывания в госпитале. Ацетилсалициловую кислоту (по 250-500 мг в день) давали за день до операции и в течение 6 мес после операции. Применялись следующие системы эксимерных лазеров (длина волны 308 нм): Dymer 200+ (Advanced Interventional Systems Inc. lrvine, CA, USA) с длительностью импульса 210 нс и частотой пульсации 20 Гц, импульс передается с помощью многожильных световодных катетеров диаметром 1,3, 1,6 или 2 мм при плотности потока 45-65 мДж/мм 2 CVX-300 (Spectranetics, Colorado Springs, CO, USA), импульсы длительностью 135 нс и частотой пульсации 25 Гц, передаваемые по лазерным катетерам диаметром 1,4, 1,7 или 2 мм с той же плотностью. Лазерный катетер размером 1,3 мм стал применяться после его внедрения в 1992 г. Лазерный катетер диаметром 1,3 мм (1,4 мм) применяли для сосудов диаметром 1,8-2,3 мм, лазерный катетер диаметром 1,6-1,7 мм — для сосудов диаметром 2,3-3,0 мм, 2 мм — для сосудов диаметром 3 мм и более.
Катетеризацию сердца у всех пациентов выполняли посредством чрескожного бедренного подхода. Внутривенно вводили гепарин, чтобы поддерживать время свертывания крови на уровне более 400 с, введение гепарина продолжали не менее 12 ч после процедуры. После пересечения поражения с помощью проволочного направителя лазерный катетер продвигали со скоростью около 1 мм/с. Если ангиографический результат был неудовлетворительным после одного прохождения лазерного катетера, применяли лазерный катетер большего размера. Проводили дополнительную баллонную ангиопластику, чтобы получить оптимальный ангиографический результат. Концентрацию креатинкиназы в сыворотке в области миокарда обычно измеряли в течение 12 ч после начала процедуры.
Количественная ангиография коронарных сосудов
Количественную ангиографию коронарных сосудов до и после процедуры и в течение 6-месячного наблюдения проводили после введения 0,1-0,3 мг нитроглицерина или 1-3 мг нитросорбида по внутрикоронарному пути. Ангиограммы анализировали в центральной лаборатории с помощью компьютеризированной системы сердечно-сосудистого ангиографического анализа (CAAS) для определения интерполированного исходного диаметра, минимального диаметра просвета и процента диаметра стеноза [12]. Длину участка поражения определяли по максимальной длине поражения между точкой пересечения компьютеризированной линии обнаружения контура и линии интерполированного исходного диаметра. Если процедура реваскуляризации, затрагивающая сегмент, который подвергли лечению, проводилась за 6 мес до ангиографии, как ангиограмма наблюдения использовалась наиболее свежая ангиограмма, полученная до этого вмешательства (реваскуляризации), несмотря на время второго вмешательства. Если время с момента вмешательства до ангиографии наблюдения составляло менее 3 мес и повторного вмешательства не проводили, пациента просили снова пройти ангиографию через 6 мес.
При отсутствии второй ангиограммы через 6 мес использовали самую недавнюю ангиограмму, полученную в течение 3 мес.
Клиническое и ангиографическое наблюдение
Пациентов приглашали через 1 и 6 мес для беседы, физического обследования и снятия электрокардиограммы (ЭКТ). Ангиографию коронарных сосудов в процессе наблюдения поводили через 6 мес. Основанием для повторного вмешательства было наличие повторяющихся симптомов стенокардии и/или объективных признаков ишемии миокарда и стеноза сосудов при уменьшении просвета более чем на 50% при визуальной оценке.
Конечные точки
Первичными клиническими конечными точками являлись какие-либо из следующих событий в течение 6-месячного (+/- 1 мес) наблюдения: смерть от болезни сердца: инфаркт миокарда, диагностируемый при наличии по меньшей мере двух из перечисленных ниже признаков: типичная боль в груди и/или повышение активности креатинкиназы в сыворотке на уровне миокарда более чем в 2 раза по сравнению с верхней границей нормы и/или новое патологическое образование зубца Q на ЭКГ; операция шунтирования коронарных сосудов или вторая ангиопластика из-за повторяющихся симптомов стенокардии и/или объективных признаков ишемии миокарда (положительный) результат физического тестирования), связанных с рандомизированным сегментом. Шунтирование коронарных сосудов проводилось в качестве экстренной меры (в течение 12 ч после процедуры). Все клинические события обсуждались в комитете по критическим событиям, который не был поставлен в известность о назначенном лечении.
В качестве первичной ангиографической конечной точки был принят минимальный диаметр просвета сосуда в месте лечения в течение 6 мес наблюдения в сравнении с величиной до процедур (чистая прибавка). Вторичными конечными точками были: успешное вмешательство с помощью лазера, определяемое как уменьшение величины стеноза после лазерной ангиопластики только по визуальной оценке более чем на 20% ( 1 ); успешное лечение по данным ангиографии, определяемое как остаточный стеноз в конце процедуры менее 50% при визуальной оценке (2); значительное улучшение — минимальный диаметр просвета сосуда в месте лечения з конце процедуры относительно исходной величины (3); функциональный класс через 6 мес согласно классификации Канадского общества по сердечно-сосудистым заболеваниям (4); процент диаметра стеноза в месте лечения сосуда через 6 мес наблюдения относительно исходной величины — чистая прибавка процента диаметра стеноза (5); уровень рестеноза — более чем 50% стеноза диаметра в месте лечения сосуда за 6-месячный период ангиографического наблюдения по данным автоматизированного анализа контурного обнаружения (6); поздняя потеря, определенная как минимальный диаметр просвета в месте лечения сосуда в течение 6-месячного наблюдения относительно минимального диаметра просвета после процедуры (7).
Статистический анализ
Постоянные варианты (возраст, исходный диаметр, длина пораженного участка, процент диаметра стеноза и минимальный диаметр просвета) выражали в виде средних (СО — стандартное отклонение) и сравнивали с данными непарного t -теста. Анализ Chisquare и точный тест Фишера для парных таблиц использовали для сравнения делящихся вариант. Рассчитывали и сравнивали относительный риск (ОР) с интервалом достоверности (ИД) клинических событий и ангиографических осложнений.
Результаты
Характеристика пациентов и рандомизация
313 пациентам (330 поражений) без выбора назначили ЭЛКА (155 пациентам со 162 поражениями) или баллонную ангиопластику. У 5 пациентов (4 назначили лазерную ангиопластику, 1 — баллонную) рандомизированный сегмент не подвергли лечению. Из этих 5 пациентов один отказался от лазерной процедуры, ему выполнили баллонную ангиопластику.
Двум пациентам не провели коронарного вмешательства, так как на предоперационной ангиограмме стеноз рандомизированного сегмента показался незначительным. Одного пациента рандомизировали дважды. Рандомизированный сегмент у одного пациента не подвергли лечению из-за срочной операции шунтирования коронарного сосуда после лечения нерандомизированного сегмента. Эти 5 пациентов не были включены в окончательный анализ, так как не было намерения проводить лечение согласно рандомизации.
Основные клинические и ангиографические характеристики остальных 308 пациентов были сопоставимы (табл. 1 ) .
Примерно у половины пациентов было поражено несколько сосудов и 50% ранее перенесли инфаркт миокарда. Одну треть рандомизированных коронарных сегментов составляли общие или функциональные окклюзии коронарных сосудов (Т1М1 0 или 1).
Для лечения 158 поражений (у 151 пациента) была без выбора назначена ЭЛКА. ЭЛКА не удалось выполнить 25 пациентам из-за невозможности пересечь коронарное поражение ни одним из проволочных направлений (16 поражений) или перейти к баллонной ангиопластике (всего 9 поражений: 5 — из-за невозможности прохождения проволочного направителя, 3 — из-за технических неполадок лазерной системы и 1 — из-за предполагаемого риска перфорации).
Из остальных 133 поражений 130 были пролечены с помощью дополнительной баллонной ангиопластики, чтобы получить оптимальный ангиографический результат. 3(2%) поражения были пролечены с помощью только лазера. В 89 (67%) из 133 леченых поражений применяли лазерный катетер диаметром не более 1,3 (1,4) мм. Для пластики 19 поражений использовали несколько лазерных катетеров.
157 пациентам со 167 поражениями была произвольно назначена баллонная ангиопластика. Баллонную ангиопластику не удалось выполнить в 22 случаях изза того, что поражение нельзя было пересечь с помощью баллона: одно из этих поражений успешно лечили с помощью только лазерной ангиопластики, а еще одно — с помощью лазерной ангиопластики с последующей баллонной. Остальные 143 поражения лечили посредством только баллонной ангиопластики.
Таблица 1. Основные клинические и ангиографические характеристики 308 пациентов, включенных в анализ принципу "намерение излечить"