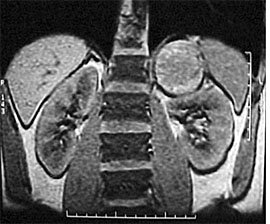
Лечение больных артериальной гипертензией при альдостероме и гиперплазии коры надпочечников
Чихладзе Н.М.
Отдел системных гипертензий Института кардиологии им. А.Л. Мясникова ФГБУ РКНПК МЗ РФ, Москва
Артериальная гипертензия (АГ) на фоне гиперальдостеронемии и супрессии активности ренина в плазме крови (АРП) этиологически связана с широким спектром опухолевых и неопухолевых изменений в коре надпочечников. Выбор тактики лечения больных АГ при низкорениновом гиперальдостеронизме зависит от диагностированной формы заболевания. При выявлении альдостеромы или односторонней (первичной) гиперплазии коры надпочечника показано хирургическое лечение. При идиопатическом альдостеронизме проводится медикаментозная антигипертензивная терапия с применением антагонистов минералокортикоидных рецепторов (спиронолактон, эплеренон). Пациентам с редкой семейной формой гиперальдостеронизма 1-го типа использование глюкокортикоидов в небольших дозах обеспечивает коррекцию клинических проявлений заболевания. Дифференциальная диагностика формы гиперальдостеронизма позволяет обосновать адекватный метод лечения и преодолеть рефрактерное течение АГ.
В последние годы возрос интерес к проблеме диагностики и лечения артериальной гипертензии (АГ) у лиц с гиперсекрецией альдостерона. Экспериментальные и клинические исследования свидетельствуют о не зависимом от других факторов неблагоприятном влиянии альдостерона на развитие и прогрессирование АГ, сердечной недостаточности, патологии почек [1, 2].
Особого внимание с клинической точки зрения заслуживают формы АГ, при которых гиперсекреция альдостерона сопровождается супрессией ренин-ангиотензин-альдостероновой системы (РААС), – низкорениновые формы гиперальдостеронизма (НРГА), которые неоднородны по своей этиологии, структуре гистоморфологических изменений в коре надпочечников, что и определяет различные подходы к их лечению. В последнее десятилетие получены данные, свидетельствующие о высокой распространенности первичного гиперальдостеронизма (от 5 до 15 %) среди всех форм АГ [3–6]. Однако судить об истинной распространенности этой гетерогенной патологии сложно, т. к. нередко отсутствуют сведения о том, какие формы НРГА подлежали анализу.
У большинства больных опухолевыми и неопухолевыми формами гиперальдостеронизма наблюдается тяжелая АГ [7–9]. В 20 % случаев при рефрактерном течении АГ диагностируются различные формы гиперальдостеронизма [10].
Впервые АГ, обусловленная гиперсекрецией альдостерона аденомой коры надпочечника, была описана чуть менее шести десятилетий назад – в 1955 г. Синдром, описанный американским хирургом Д. Конном под названием “первичный альдостеронизм”, включал АГ, выраженную гипокалиемию и умеренную гипернатриемию. Удаление аденомы, обладающей минералокортикоидной активностью (альдостеромы), привело к нормализации уровня артериального давления (АД) и устранению электролитных нарушений, что подтвердило вторичную (симптоматическую) этиологию этой формы АГ. В большинстве случаев альдостеромы являются доброкачественными опухолями; реже (не более 1 % случаев) синдром Конна наблюдается при карциноме коры надпочечника, продуцирующей альдостерон. В единичных случаях синдром первичного гиперальдостеронизма бывает связан с вненадпочечниковой локализацией опухоли.
У части (30–50 %) больных с клиническими проявлениями синдрома Конна выявляется диффузная или диффузно-узелковая гиперплазия коры надпочечников – часто двусторонней локализации. Для этой патологии предложено определение “идиопатический”, или “псевдопервичный”, гиперальдостеронизм. Хирургическое лечение (даже тотальная адреналэктомия) не приводит к нормализации АД у этой категории больных. Среди неопухолевых форм гиперальдостеронизма выделяют также первичную, преимущественно одностороннюю, форму гиперплазии коры надпочечников. Первичный генез этой формы заболевания обосновывается ремиссией АГ и нормализацией секреции альдостерона после односторонней адреналэктомии.
С клиническими проявлениями синдрома Конна протекает также редкая моногенная форма – семейный гиперальдостеронизм 1-го типа. Характерной особенностью заболевания является нормализация АД и секреции альдостерона на фоне терапии глюкокортикоидами (эта форма заболевания известна также под названием “гиперальдостеронизм”, корригируемый глюкокортикоидами). Для контроля АД и секреции альдостерона должна применяться минимальная доза глюкокортикоидов (дексаметазона или преднизолона), оказывающая корригирующие эффекты [11, 12]. При недостаточном гипотензивном эффекте применяются антагонисты минералокортикоидных рецепторов, а также препараты других классов антигипертензивной терапии.
В большинстве случаев при всех рассмотренных формах НРГА наблюдается тяжелая АГ, лечение которой дифференцируется в зависимости от диагностированной формы гиперальдостеронизма.
Односторонняя адреналэктомия является оптимальным методом лечения больных односторонней альдостеромой или первичной гиперплазией коры надпочечника [11]. После удаления альдостеромы у 50–70 % больных наблюдается нормализация или значительное снижение АД. Практически во всех случаях нормализуется концентрация альдостерона в плазме крови, исчезают гипокалиемия и связанные с ней нейромышечные симптомы, возрастает активность ренина в плазме крови (АРП). В последние годы предпочтение отдается эндоскопической адреналэктомии. По сравнению с открытой адреналэктомией применение эндоскопической техники связано с уменьшением продолжительности госпитализации, более быстрой послеоперационной реабилитацией [13, 14]. Открытая адреналэктомия проводится при выявлении опухолей более 5 см в диаметре, когда не исключено наличие карциномы [15].
В 30–50 % случаев удаление альдостеромы не приводит к должному снижению АД, несмотря на нормализацию секреции альдостерона, что связано с длительным анамнезом АГ, степенью тяжести АГ до операции, выраженными органными поражениями и рядом других причин. У этой категории больных резидуальной АГ для достижения целевых уровней АД необходимо использовать антигипертензивные препараты из рекомендованных основных и дополнительных классов в виде моно- или комбинированной терапии в зависимости от степени тяжести АГ, поражения органов-мишеней и ассоциированных клинических состояний [16].
Возможности медикаментозной коррекции АГ рассматриваются и в случаях первичного альдостеронизма с установленным диагнозом опухоли надпочечника, когда пациенты отказываются от хирургического лечения или когда сопутствующая патология делает маловероятным его применение [17, 18]. Для этой категории больных, как и для больных идиопатическим альдостеронизмом, медикаментозная терапия должна быть нацелена не только на снижение АД, но и на устранение неблагоприятных эффектов альдостерона: формирование эндотелиальной дисфункции, развитие сердечно-сосудистых осложнений. В первую очередь фармакотерапия включает применение антагонистов минералокортикоидных рецепторов – спиронолактона или эплеренона.
Антагонисты минералокортикоидных рецепторов не только эффективно снижают АД, но и обеспечивают не зависимую от АГ органопротекцию от избытка альдостерона [19]. Спиронолактон блокирует физиологические и фармакологические эффекты альдостерона при гиперальдостеронизме любой этиологии и применяется в предоперационном периоде больными альдостеромой для коррекции гипокалиемии, а также больными гиперпластическими формами гиперальдостеронизма, которым хирургическое лечение не показано [7, 8, 11, 20, 21].
При первичном и идиопатическом гиперальдостеронизме спиронолактон в виде монотерапии принимают внутрь в дозе 50–400 мг/сут в 1–2 приема. По представленным в литературе данным, включившим 122 наблюдения за больными идиопатическим альдостеронизмом, применение спиронолактона на протяжении 1–96 месяцев способствовало снижению систолического АД на 25 %, а диастолического – на 22 % [22, 23].
По нашим данным, при лечении спиронолактоном в дозе 200 мг/сут в течение 1-й недели и в дозе 250 мг/сут в течение 2-й недели у больных альдостеромой надпочечников наблюдалось достоверное снижение систолического и диастолического АД на 24 ± 5/7 ± 2 мм рт. ст. а у больных идиопатическим гиперальдостеронизмом – на 18 ± 4/14 ± 2 мм рт. ст. [7]. Уровень альдостерона у больных альдостеромой несколько снижался (в большей мере в 1-ю неделю лечения), тогда как АРП возрастала. У больных идиопатическим альдостеронизмом концентрация альдостерона достоверно не изменялась, но в отдельных случаях через 2 недели лечения этот показатель превышал исходный уровень в 2–3 раза. На основании наблюдаемого первоначального снижения концентрации альдостерона в плазме крови (длительностью от 4–6 недель до нескольких месяцев) с последующим ее повышением некоторые авторы выделяют две фазы действия спиронолактона на РААС [24]. В первую фазу выявляют ингибирующее действие спиронолактона на биосинтез альдостерона в клетках коры надпочечников с опухолевыми или гиперпластическими изменениями, во вторую фазу происходит “ускользание” от этого воздействия и по мере проявления периферического действия спиронолактона под влиянием усиленного натрийуреза, уменьшения внутрисосудистого объема активируется РААС.
В настоящее время не рекомендуется применять спиронолактон больными АГ на фоне гиперальдостеронизма в виде монотерапии в больших дозах. Длительное применение требует подбора минимальной эффективной дозы – до 25–50 мг/сут. [6, 8]. Во всех случаях терапия спиронолактоном проводится под контролем электрокардиограммы (метаболические изменения) и уровня калия в плазме крови с учетом возможной гиперкалиемии. Среди нежелательных реакций спиронолактона отмечают гинекомастию, возможны также менструальные расстройства у женщин в пременопаузе. Гинекомастия при лечении спиронолактоном является дозозависимым эффектом. Приводятся данные о наличии гинекомастии у 6,9 % пациентов после 6 месяцев лечения в дозе менее 50 мг/сут и у 52 % пациентов при лечении в дозе более 150 мг/сут [25].
Эплеренон – новый селективный антагонист минералокортикоидных рецепторов, который в настоящее время находит применение в клинической практике среди больных АГ [26]. Эплеренон связывает минералокортикоидные рецепторы более длительно и сильно, чем альдостерон, и блокирует их. При этом наблюдается увеличение плазменной концентрации альдостерона, особенно в начале применения препарата, впоследствии секреция альдостерона по механизму отрицательной обратной связи подавляется. Сродство эплеренона к минералокортикоидным рецепторам несколько меньше, чем у спиронолактона. Преимуществом эплеренона является его высокая селективность в отношении рецепторов альдостерона. Эплеренон не имеет анти-андрогенного эффекта, в связи с чем число неблагоприятных эндокринных побочных эффектов у него меньше, чем у спиронолактона. Этот препарат имеет сопоставимую со спиронолактоном гипотензивную эффективность и успешно может применяться больными идиопатическим гиперальдостеронизмом, особенно в тех случаях, когда применение спиронолактона приводит к нежелательным эндокринным эффектам [21].
В проспективном рандомизированном исследовании больных идиопатическим гиперальдостеронизмом сопоставление гипотензивной эффективности спиронолактона и эплеренона на протяжении 24 недель терапии продемонстрировало достижение целевого АД (менее 140/90 мм рт. ст.) через 16 недель лечения в 76,5 % случаев на терапии спиронолактоном и в 82,4 % случаев на терапии эплереноном [27].
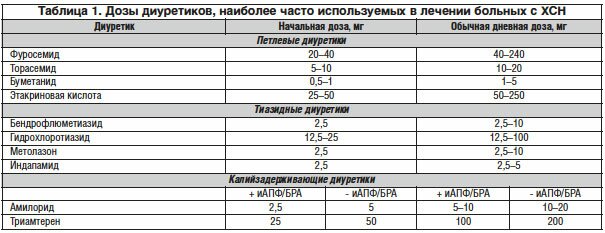
Медикаментозная терапия АГ у больных НРГА включает также применение калийсберегающих диуретиков – блокаторов эпителиальных натриевых каналов – амилорида, триамтерена [28]. Применение амилорида способствует снижению АД, нормализует калиевый баланс, кроме того, этот препарат лишен побочных стероидных эффектов спиронолактона, но не оказывает благоприятного воздействия на функцию эндотелия [29].
Применение диуретиков, не обладающих калийсберегающими свойствами, от больных НРГА требует осторожности из-за возможности усугубления гипокалиемии на фоне гиперальдостеронемии. Вместе с тем рефрактерное течение АГ, проявления сердечной недостаточности диктуют необходимость включения в терапию диуретика. В связи с этим привлекает внимание петлевой диуретик торасемид, который в меньшей мере, чем фуросемид, усиливает экскрецию калия, что объясняют его способностью блокировать эффекты альдостерона [30]. Клинические исследования в этом направлении представляются перспективными.
Пациенты с АГ на фоне различных форм гиперальдостеронизма в большинстве случаев относятся к категории высокого сердечно-сосудистого риска. У этой категории больных часто наблюдается тяжелое течение АГ. По нашим данным, в 75 % случаев среди больных первичным гиперальдостеронизмом выявляют АГ III степени тяжести, а синдром злокачественного течения АГ – в 7,8 % случаев [31].
Для достижения адекватного гипотензивного эффекта у этой части больных необходима комбинированная, часто многокомпонентная медикаментозная терапия, включающая помимо антагонистов минералокортикоидных рецепторов препараты из класса блокаторов кальциевых каналов (БКК), ингибиторов ангиотензинпревращающего фермента (АПФ) или антагонистов рецепторов ангиотензина II (АТ1-подтип).
Эффективность применения БКК и препаратов, блокирующих эффекты ангиотензина II у больных низкорениновыми формами АГ, до настоящего времени мало изучена. В единичных наблюдениях продемонстрирована способность никардипина замедленного высвобождения (SR – Sustained Release) нормализовывать АД, уровень калия и концентрацию альдостерона в плазме крови больных идиопатическим альдостеронизмом [32]. Приводятся немногочисленные наблюдения, свидетельствующие о различиях во влиянии отдельных представителей класса БКК на секрецию альдостерона [33, 34]. В последние годы в экспериментальных исследованиях показано, что некоторые дигидропиридиновые БКК обладают свойствами антагонистов минералокортикоидных рецепторов [35]. Эти свойства могут быть выражены в разной степени: в бoльшей мере они представлены у нимодипина и фелодипина, в меньшей мере – у амлодипина. Данные японских исследователей свидетельствуют о высоком потенциале антиминералокортикоидной активности блокатора кальциевых каналов L-, N- и Т-типов бенидипина [36]. Для подтверждения эффективности рассматриваемых препаратов в клинической практике для пациентов с различными формами гиперальдостеронизма необходимо проведение дальнейших исследований.
Ингибиторы АПФ и антагонисты АТ1-ангиотензиновых рецепторов не нашли широкого применения среди больных АГ при НРГА [37]. Приводятся единичные наблюдения эффективности контроля АД у больных идиопатическим гиперальдостеронизмом, что объясняется повышенной чувствительностью адреналовой ткани к ангиотензину II у этой категории больных [38]. Применение препаратов этих антигипертензивных классов может быть рекомендовано при подборе рациональной комбинированной терапии, особенно при рефрактерном течении АГ. При нормокалиемии комбинация этих препаратов с антагонистами минералокортикоидных рецепторов требует осторожности (возможна гиперкалиемия).
Недигидропиридиновые БКК (дилтиазем и верапамил) не обладают свойствами антагонистов минералокортикоидных рецепторов. В связи с тем что дилтиазем и верапамил не влияют на секрецию альдостерона, их применение допустимо для обеспечения адекватного контроля АД в период исследования концентрации альдостерона в плазме крови с диагностической целью, когда необходимо исключить прием антигипертензивных препаратов, влияющих на уровень концентрации альдостерона в плазме крови [11].
В последние годы проводятся исследования, в которых разрабатываются возможности применения ингибитора альдостеронсинтазы при гиперальдостеронизме. Данные экспериментальных исследований свидетельствуют об органопротективной эффективности исследуемого препарата [39]. Крупные исследования больных АГ с гиперальдостеронизмом в этом направлении до настоящего времени не проводились. Представлены результаты клинического исследования ингибитора альдостеронсинтазы LCI699 с участием 14 больных первичным альдостеронизмом, которые через 4 недели терапии продемонстрировали снижение концентрации альдостерона в плазме крови на 70–80 % от исходного уровня, нормализацию уровня калия в плазме крови, умеренное снижение преимущественно систолического АД [40]. Несмотря на непродолжительный период лечения и малочисленность группы пациентов, полученные в этом исследовании результаты интересны и представляются перспективными в плане снижения секреции альдостерона у пациентов с выраженной гиперальдостеронемией. Возможность применения этого препарата в клинической практике при НРГА требует дальнейших исследований.
Таким образом, тактика лечения больных АГ с опухолевыми и неопухолевыми формами гиперальдостеронизма предусматривает дифференцированный подход, который базируется на правильной своевременной диагностике различных форм гиперальдостеронизма. Выявление альдостеромы при односторонней (первичной) гиперплазии коры надпочечника определяет необходимость хирургического лечения. Своевременное устранение причины гиперальдостеронизма способствует нормализации или значительному снижению АД. При идиопатическом гиперальдостеронизме показана фармакотерапия, включающая в первую очередь антагонисты минералокортикоидов, при рефрактерном течении АГ – присоединение препаратов класса БКК и других антигипертензивных классов. При семейной форме гиперальдостеронизма 1-го типа применяют глюкокортикоиды в небольших дозах.
Адекватное целенаправленное лечение АГ при различных формах гиперальдостеронизма – путь к преодолению рефрактерности АГ и уменьшению сердечно-сосудистых осложнений на фоне неконтролируемой гиперальдостеронемии.
Лечение артериальной гипертонии у больных с патологией печени
Л.Б. Лазебник, И.А. Комиссаренко, О.М. Михеева, С.С. Давыдова
1 МГМСУ им. А.И. Евдокимова, Москва 2 ЦНИИГ, Москва 3 ГКУБ № 47, Москва Автор для связи: И.А. Комиссаренко – д.м.н. проф. с.н.с. Отделения апитерапии ЦНИИГ, проф. кафедры терапии, гериатрии и апитерапии ФПДО МГМСУ им. А.И. Евдокимова; e-mail: [email protected]
Для коррекции артериального давления у больных артериальной гипертензии (АГ) с сочетанной патологией органов пищеварения применяются антигипертензивные средства различных фармакологических групп. При лечении больных АГ с патологией печени необходимо использовать гидрофильные антигипертензивные препараты, которые не метаболизируются в печени. Некоторые антигипертензивные препараты оказывают положительное действие на состояние желудочно-кишечного тракта больных АГ, повышая тонус нижнего сфинктера пищевода, предотвращают гастро-эзофагеальный рефлюкс, улучшая кровоток в желудке, оказывают протективное действие на слизистую оболочку желудка при язвенной болезни, уменьшают давление в портальной системе при циррозе печени.
Артериальная гипертензия (АГ) в Российской Феде-рации (РФ), как и во всех странах с развитой экономикой, является одной из актуальных медико-социальных проблем. Это обусловлено широкой распространенностью, высоким риском развития осложнений и недостаточным контролем в масштабе популяции. Распространенность АГ среди взрослого населения составляет примерно 40 %, что предопределяет высокую частоту возникновения сердечно-сосудистых осложнений (ССО), в т. ч. с летальным исходом [1, 2]. Артериальная гипертензия является ведущим фактором высокой смертности населения от заболеваний сердечно-сосудистой системы, в 3–4 раза увеличивая риск развития ишемической болезни сердца (ИБС) и инсульта [3, 4].
По результатам исследования, проведенного в рамках целевой федеральной программы “Профилактика и лечение артериальной гипертонии в Российской Федерации”, распространенность АГ среди населения в 2009 г. составила 40,8 % (у мужчин – 36,6 %, у женщин – 42,9 %). Осведомленность больных АГ о наличии у них заболевания составляет 83,9–87,1%. Принимают антигипертензивные препараты (АГП) 69,5 % больных АГ, из них эффективно лечатся 27,3 %, а контролируют артериальное давление (АД) на целевом уровне 23,2 % [5].
Основной целью лечения больных АГ является максимальное снижение риска развития ССО и смерти от них. Для достижения этой цели требуются снижение АД до целевого уровня, коррекция всех модифицируемых факторов риска (курение, нарушение липидного обмена, гипергликемия, ожирение), предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней, а также лечение ассоциированных и сопутствующих заболеваний (ИБС, сахарного диабета – СД и др.).
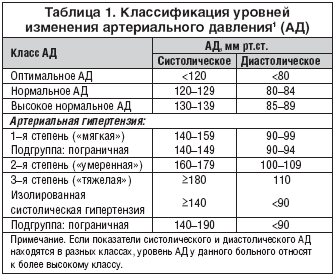
В рекомендациях Всероссийского научного общества кардиологов [6] отмечено, что целевой уровень АД должен быть менее 140/90 мм рт. ст. а при хорошей переносимости назначенной терапии целесообразно снижение АД до более низких значений.
Пациентам с высоким и очень высоким риском ССО необходимо снижать АД до 140/90 мм рт. ст. и менее в течение 4 недель. При условии хорошей переносимости рекомендуется дальнейшее снижение АД до 130–139/80–89 мм рт. ст. При проведении антигипертензивной терапии следует иметь в виду, что пациентам с СД, пожилым больным и лицам, уже имеющим ССО, бывает трудно достичь уровня систолического АД
Таким образом, снижение АД до целевого уровня происходит в несколько этапов, число которых индивидуально и зависит как от исходного уровня АД, так и от переносимости антигипертензивной терапии. Использование такой этапной схемы снижения АД с учетом индивидуальной переносимости, особенно пациентами с высоким и очень высоким риском ССО, позволяет достигать целевого уровня АД и избегать эпизодов гипотонии, с которыми связано увеличение риска развития инфаркта миокарда и мозгового инсульта. При достижении целевого уровня АД необходимо учитывать нижнюю границу снижения САД до 110–115 и ДАД до 70–75 мм рт. ст. а также следить за тем, чтобы в процессе лечения не происходило увеличения пульсового АД у пожилых пациентов, что возникает главным образом за счет снижения ДАД [6].
В настоящее время для лечения АГ рекомендовано пять основных классов АГП: ингибиторы ангиотензинпревращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина II (АРА), блокаторы кальциевых каналов (БКК), β-адреноблокаторы (β-АБ), диуретики (см. таблицу). В качестве дополнительных классов для комбинированной терапии могут использоваться α-АБ, агонисты имидазолиновых рецепторов и прямые ингибиторы ренина.
При выборе препарата врач должен учитывать многие факторы, наиболее важными из которых являются наличие у больного факторов риска; поражение органов-мишеней; ассоциированные клинические состояния, поражения почек, МС, СД и другие сопутствующие заболевания, ограничивающие применение АГП:
- предыдущие индивидуальные реакции больного на препараты различных классов;
- вероятность взаимодействия с лекарствами, которые пациенту назначены по другим поводам;
- социально-экономические факторы, включая стоимость лечения.
При выборе АГП в первую очередь необходимо оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации. Из результатов многоцентровых рандомизированных исследований следует, что ни один из основных классов АГП не имеет существенного преимущества в плане как снижения АД, так и эффективности снижения риска ССО и смерти от них. При назначении любого из основных классов АГП есть свои «за» и «против».
В каждой конкретной клинической ситуации необходимо учитывать особенности действия АГП различных классов, обнаруженные при проведении рандомизированных исследований. Выбор того или иного АГП должен основываться на результатах больших клинических исследований, в которых доказана высокая эффективность и безопасность применения пациентами именно этого препарата в подобной клинической ситуации.
Однако рекомендуемые стандарты и программы лечения АГ не всегда учитывают состояние органов пищеварения, хотя метаболизм многих лекарственных средств начинается и осуществляется именно там. По данным ЦНИИГ за три года (1999–2001), в гепатологических отделениях были обследованы и пролечены 1200 больных циррозом печени (ЦП), среди них гипертоническая болезнь I–III стадий встречалась среди 18,4 % больных (практически у каждого 5-го больного ЦП имелась АГ).
Все группы лекарственных препаратов, применяющихся в лечении АГ, оказывают различное влияние на органы пищеварения. Это могут быть положительные эффекты. Например, использование β-АБ для профилактики кровотечения из варикозно-расширенных вен пищевода при ЦП, БКК при ахалазии кардии. Известно и отрицательное действие кардиологических препаратов: эрозивно-язвенное поражение желудка при применении ацетилсалициловой кислоты, усиление проявлений гастроэзофагеальной рефлюксной болезни на фоне приема БКК (группы дигидропиридинов). В связи с этим необходима рациональная фармако-, а иногда и многоцелевая монотерапия (возможность использовать системные эффекты одного лекарства для одновременной коррекции нарушенных функций нескольких органов или систем).
У больных хроническими заболеваниями печени жирорастворимые препараты могут кумулироваться, вызывая нежелательные эффекты, тогда как концентрация водорастворимых средств у пациентов без гепаторенального синдрома остается близкой к стандартной [7–9]. При заболеваниях печени пролекарства в рекомендуемых дозах не могут оказывать достаточного гипотензивного эффекта больным АГ, и для достижения целевого уровня АД требуется увеличение разовых и суточных доз препарата. Поэтому при лечении АГ у лиц с патологией органов пищеварения необходимо учитывать все фармакологические особенности антигипертензивных препаратов различных групп.
Тиазидные и тиазидоподобные диуретики подразделяются на два поколения. Первое включает производные бензотиадиазина (гидрохлоротиазид) и хлорталидон, второе поколение – производные хлорбензамида (индапамид). Тиазидные диуретики слабо метаболизируются в печени и почти полностью выводятся почками в неизменном виде. В отличие от тиазидных диуретиков индапамид подвергается метаболизму в печени, поэтому с осторожностью должен применяться при лечении больных АГ с патологией печени. Строгий контроль показан больным ЦП, особенно с отеками или асцитом, т. к. повышается риск развития метаболического алкалоза и возможно усиление проявлений печеночной энцефалопатии.
С другой стороны, длительный прием диуретиков пациентами с дефицитом магния из-за нарушения его всасывания (рвоты, диареи, алкогольного поражения печени, резекции кишечника) может приводить к гипомагниемии, при которой уровень магния в сыворотке крови опускается ниже 0,75 ммоль/л. В связи с этим при лечении диуретиками необходим контроль уровня магния в крови при данных сопутствующих заболеваниях.
Ко второй группе АГП относятся БКК, которые являются вазодилататорами непрямого действия. Общее свойство БКК – липофильность, объясняющая их хорошую всасываемость (90–100 %) в желудочно-кишечном тракте (ЖКТ), и единственный путь элиминации из организма – метаболизм в печени. В печени БКК полностью метаболизируются до неактивных метаболитов, которые выводятся через почки и ЖКТ. Этими общими фармакокинетическими свойствами БКК объясняется замедление их выведения из организма с возрастом, при дисфункции печени, но практически не изменяется при почечной недостаточности. Поэтому лицам старше 60–65 лет и больным ЦП разовую дозу или кратность приема БКК рекомендуется уменьшать.
С другой стороны, БКК снижают тонус нижнего пищеводного сфинктера [10, 11]. При нарушении функции нижнего пищеводного сфинктера отсутствует полноценный барьер для рефлюкса кислого содержимого желудка в пищевод, что может обусловливать развитие эзофагита. Так как заброс кислого желудочного содержимого в пищевод может вызывать кровотечение из варикозно-расширенных вен (желудочно-пищеводный рефлюкс особенно опасен для больных ЦП), применение дигидропиридинов нежелательно при ЦП, осложненном варикозным расширением вен пищевода [12].
К третьей группе АГП относятся β-АБ, которые в зависимости от их растворимости в жирах и воде подразделяются на жирорастворимые (или липофильные), водорастворимые (гидрофильные) и жироводорастворимые. Липофильные β-АБ (бетаксолол, карведилол, метопролол, пропранолол, тимолол, небиволол и др.) быстро и полностью (более 90 %) всасываются в ЖКТ, обычно метаболизируются в печени (80–100 %) [13–15].
В печени они подвергаются метаболизму путем гидроксилирования и конъюгирования, превращаясь в метаболиты, которые эскретируются почками после превращения в водорастворимые вещества. У больных ЦП со сниженным печеночным кровотоком и печеночно-клеточной недостаточностью данные препараты способны к кумуляции в организме, т. к. они находятся в крови более продолжительное время из-за уменьшения активности печеночных ферментов, обусловливая большую частоту побочных эффектов [16–20]. По этой причине разовые дозы или кратность приема липофильных β-АБ необходимо уменьшать для лиц со сниженным печеночным кровотоком (т. е. для пожилых лиц, больных сердечной недостаточностью или ЦП).
Гидрофильные β-АБ (атенолол, надолол, соталол и др.) неполностью (30–70 %) и неравномерно всасываются в ЖКТ и обычно незначительно (0–20 %) метаболизируются в печени, а следовательно, не требуют изменения дозы и поэтому могут использоваться для лечения больных АГ с патологией печени. При применении метопролола больным ЦП необходимо снижать дозу препарата во избежание кумулятивных эффектов и связанных с ним побочных эффектов. Использование гидрофильного атенолола коррекции дозы не требует [21].
Некоторые препараты растворяются как в жирах, так и в воде (ацебутолол, бисопролол, пиндолол) и имеют два пути элиминации – печеночный метаболизм и почечную экскрецию. Такой сбалансированный клиренс данных β-АБ обусловливает безопасность при лечении больных АГ с сопутствующей патологией печени и низкую вероятность их взаимодействия с препаратами, тормозящими активность микросомальных ферментов печени.
С другой стороны, β-АБ способны оказывать многообразное воздействие на функции органов пищеварения.
В частности, они уменьшают кровоток по печеночной и мезентериальным артериям, повышают тонус нижнего сфинктера пищевода, усиливают перистальтику пищевода, желудка и кишечника. Основанием к применению β-АБ при гастроэзофагеальном рефлюксе и грыже пищеводного отверстия диафрагмы является их способность повышать тонус нижнего сфинктера пищевода и тем самым предотвращать гастроэзофагеальный рефлюкс, а также стимулировать моторику пищевода и снижать частоту развития рефлюкс-эзофагитов. Еще в 1980 г.
D. Lebrec и соавт. сообщили, что длительное применение пропранолола в дозе, которая уменьшает частоту сердечных сокращений на 25 %, снижает риск развития повторного кровотечения из варикозно-расширенных вен пищевода у больных портальной гипертензией. По сводным данным различных исследований, длительное применение β-АБ больными ЦП приводит к снижению числа эпизодов первого или повторного кровотечения в среднем на 44 % (по сравнению с контрольной группой), уменьшению смертности от кровотечения – на 42 % и общей смертности – на 24 %.
Профилактическая эффективность (в частности, пропранолола и надолола) не зависит от этиологии и тяжести ЦП. Одним из предполагаемых механизмов снижения давления в системе воротной вены, возможно, является уменьшение кровотока по печеночной и мезентериальной артериям в результате снижения сердечного выброса (β1-адреноблокада) и вазоконстрикции (β2-адреноблокада).
Среди других возможных механизмов называют следующие:
- повышение тонуса нижнего сфинктера пищевода, что приводит, с одной стороны, к уменьшению желудочно-пищеводного рефлюкса, с другой – к сдавлению коллатеральных сосудов, кровоснабжающих варикозные узлы;
- подавление активности ренин-ангиотензиновой системы и связанной с ней секреции альдостерона, обычно повышенной при ЦП, особенно при наличии асцита [22].
Поэтому β-АБ могут применяться для профилактики кровотечений из варикозно-расширенных вен пищевода. При давлении в воротной вене более 12 мм рт. ст. следует начинать терапию β-АБ независимо от степени расширения вен, стремясь поддерживать давление на уровне не выше 12 мм рт. ст. [23].
На основании вышеперечисленного можно сделать следующее заключение: гидрофильные β-АБ являются препаратами выбора для больных АГ с патологией печени.
К четверной группе АГП относятся ИАПФ. Несмотря на общий механизм действия, ИАПФ различаются по химической структуре, наличию в молекуле дополнительных функциональных групп, природе пролекарства, активности и фармакинетическому профилю, что очень важно учитывать при лечении пациентов с различной патологией органов пищеварения [24].
В настоящее время наиболее известны следующие ИАПФ: каптоприл, эналаприл, беназеприл, фозиноприл, лизиноприл, моэксиприл, периндоприл, квинаприл, рамиприл и трандолаприл [25, 26]. В гастроэнтерологической практике наибольший интерес представляет классификация, которая учитывает данные о физико-химических свойствах и фармакокинетических особенностях ИАПФ. Печень – основное место биотрансформации неактивных ИАПФ в активные диацидные метаболиты. Поэтому тяжелые заболевания печени могут оказывать существенное влияние на фармакокинетику неактивных ингибиторов. Например, у больных ЦП максимальная концентрация квинаприла уменьшается на 70 %. Теоретически при ЦП наиболее безопасны квинаприл и лизиноприл, которые не метаболизируются в печени. В связи с этим становится особенно актуальным использование АГП, не метаболизирующихся в печени, способных обеспечить больным АГ с патологией ЖКТ адекватный контроль АД в течение 24 часов [27].
При тяжелых заболеваниях печени уменьшается не только биотрансформация неактивных ИАПФ, но и превращение их активных диацидных метаболитов в неактивные соединения. Поэтому трудно предсказать изменения плазменных концентраций активных диацидных метаболитов различных неактивных ИАПФ у больных ЦП. Например, в отличие от квинаприла плазменные концентрации диацидного метаболита трандолаприла – трандолаприлата – у пациентов с патологией печени выше, чем у здоровых лиц. Поэтому больным ЦП рекомендуется увеличивать дозу квинаприла, но уменьшать дозу трандолаприла.
Липофильные ИАПФ (каптоприл) обладают самостоятельной фармакологической активностью, но в печени подвергаются дальнейшим превращениям с образованием фармакологически активных дисульфидов, которые выводятся путем почечной экскреции. Липофильные пролекарства (фармакологически неактивные) становятся активными диацидными метаболитами после метаболизма в печени, затем трансформируются в неактивные соединения [28]. У лиц с патологией печени оба этих процесса нарушены, а при снижении кровотока в печени отмечается задержка конверсии пролекарства в его активную форму при первом прохождении через нее [29]. Соответственно, при заболеваниях печени препараты, нуждающиеся в трансформации для приобретения активности, действуют слабее [30].
Ингибиторы АПФ этого класса разделяются на три подгруппы в зависимости от преимущественного пути элиминации их активных диацидных метаболитов:
- подкласс А – препараты с преимущественно почечной элиминацией;
- подкласс В – препараты с двумя основными путями элиминации;
- подкласс С – препараты с преимущественно печеночной элиминацией.
Гидрофильные препараты (лизиноприл) не подвергаются метаболизму в организме больного, циркулируют в крови в форме, не связанной с белками плазмы, и подвергаются элиминации через почки в неизмененном виде. Концентрацию их в плазме крови определяют величина принятой дозы, а также скорость абсорбции и скорость экскреции через почки [31–33]. Лизиноприл, представляя собой активное вещество, не требующее биотрансформации в печени, является препаратом выбора для больных патологией печени (что нередко встречается и при МС) и не требует коррекции дозы. Он оказывает пролонгированное антигипертензивное действие. Начало антигипертензивного эффекта наблюдается через 1–3 часа после приема внутрь, пик действия – через 6 часов, продолжительность действия – 24 часа со стабильным действием через 2–4 недели лечения. Показатели фармакокинетики после приема лизиноприла больными ЦП и без патологии печени достоверно не различаются. Таким образом, ЦП меняет фармакокинетику эналаприла и не влияет не фармакокинетические параметры лизиноприла [34, 35].
Некоторые ИАПФ (каптоприл, лизиноприл) непосредственно обладают биологической активностью. Все другие ИАПФ сами по себе являются неактивными веществами, или пролекарствами, т. е. свое действие проявляют после биотрансформации в печени и образования активных метаболитов.
К следующей группе АГП относятся антагонисты рецепторов ангиотензина II (АРА). В зависимости от наличия активного метаболита АРА разделяются на пролекарства (лосартан, кандесартан, тазосартан), которые становятся активными после метаболических превращений в печени, и активные лекарственные вещества (валсартан, ирбесартан, телмисартан и эпросартан), обладающие фармакологической активностью. Соответственно, при лечении АГ лицами с патологией печени предпочтение отдается активным АРА, которые выводятся в неизмененном виде. Данные препараты также не влияют на активность печеночного цитохрома Р450, что определяет низкий риск взаимодействия их с другими препаратами (например, ранитидином).
Таким образом, при патологии органов пищеварения лечение больных АГ препаратами, подвергающимися печеночному метаболизму, следует проводить с осторожностью. Это связано с тем, что данные препараты могут находиться в крови больных более продолжительное время, что может способствовать развитию нежелательных явлений [36, 37]. При лечении больных АГ с патологией печени важно использовать АГП, не метаболизирующиеся в печени и не ухудшающие ее функциональное состояние [38]. Важнейшей задачей лечения больных АГ с патологией органов пищеварения считается выбор наиболее эффективного АГП с учетом функционального состояния ЖКТ.
Таким образом, согласно принципам рациональной фармакотерапии (по Д.Р. Лоуренсу), врач должен среди многих других ставить перед собой и такие вопросы:
- Какой должна быть схема медикаментозного лечения с учетом функционального состояния организма (в первую очередь почек, печени)?
- Превосходит ли возможность предполагаемого улучшения вероятность ущерба и опасность возникновения побочного действия лекарственного средства?
Журнал «Медицина неотложных состояний» 3(10) 2007
Вернуться к номеру
Современная неотложная фармакотерапия артериальной гипертензии (практические рекомендации)
Версия для печати
Подобно использованию каптоприла сублингвально в/в введение эналаприлата успешно применяется уже около 20 лет для лечения гипертонических кризов. В ряде исследований было отмечено, что его эффективность (выраженность снижения АД) коррелирует с концентрацией ангиотензина II и активностью ренина в плазме крови. Внутривенное введение эналаприлата не дает серьезных побочных реакций. Однако применение его, как и других ингибиторов ангиотензинпревращающего фермента, противопоказано у беременных. Он не должен использоваться и в остром периоде ИМ.
Фармакологические свойства эсмолола делают его идеальным b-адреноблокатором для использования в экстренных ситуациях, потому что он обладает быстрым (в течение 60–120 секунд) и непродолжительным (10–20 минут) действием. Эсмолол рекомендуется для снижения высокого артериального давления у больных с острой ишемией миокарда, расслаивающей аневризмой аорты и при артериальной гипертензии, возникшей во время операции, при выходе из наркоза и в послеоперационном периоде.