Специфические кардиомиопатии
Специфические кардиомиопатии — это заболевания миокарда с известной этиологией и патогенезом или являющиеся составной частью клинической картины системных заболеваний.
Перечень специфических кардиомиопатий представлен в табл. 1 согласно классификации ВОЗ/МОФК (1995).
Ишемическая кардиомиопатия
Описана в разделе «Дилатационная кардиомиопатия» как синдром дилатационной кардиомиопатий или форма дилата-ционной болезни сердца, обусловленная ишемической болезнью сердца.
Клапанная кардиомиопатия
Клапанная кардиомиопатия — специфическая кардиомиопатия, обусловленная клапанным стенозом и/или регургитацией, характеризующаяся значительно выраженной дисфункцией желудочков.
Она рассматривается в главе «Пороки сердца».
Гипертензивная кардиомиопатия
Гипертензивная кардиомиопатия — это гипертрофия левого желудочка с развитием сердечной недостаточности, обусловленной вначале диастолической, а затем систоло-диастолической дисфункцией левого желудочка.
Гипертензивная кардиомиопатия (гипертоническое сердце) подробно изложена в главе «Артериальная гипертензия» руководства «Диагностика болезней внутренних органов».
Воспалительная кардиомиопатия
Воспалительная кардиомиопатия — это поражение миокарда и нарушение его функции, обусловленные воспалительным процессом в миокарде, т. е. миокардитом.
Эта проблема обсуждается в главе «Миокардиты».
Метаболическая кардиомиопатия
Метаболическая кардиомиопатия — это поражение миокарда и нарушение его функции при заболеваниях эндокринной системы, нарушениях обмена веществ, электролитов, питания. Метаболическая кардиомиопатия фактически соответствует применявшемуся ранее термину «миокардиодистрофия», о чем см. соответствующую главу.
Кардиомиопатий при системных заболеваниях
Кардиомиопатий при системных заболеваниях — поражение
миокарда при системных заболеваниях соединительной ткани, ге-
мобластозах описаны в соответствующих главах; кардиомиопатий
при болезнях и саркоидозе — в главе
кардиомиопатий».
Кардиомиопатии при мышечных дистрофиях
Мышечные дистрофии (миопатии) — группа наследственных заболеваний, характеризующихся прогрессирующими дегенеративными изменениями в мышечных волокнах и нарастающей мышечной слабостью.
Поражение сердца наиболее выражено при миопатии Дюшена и миопатии Беккера.
Миопатия Дюшена
Миопатия Дюшена — рецессивно наследуемая
прогрессирующая миопатия, развивающаяся у мальчиков и обусловленная мутацией гена белка дистрофина.
Дистрофии является основной составной частью большого ди-строфин-гликопротеинового комплекса, состоящего из многих белков и связывающего внутриклеточный актин с ламинином внеклеточного матрикса. В целом, роль дистрофин-гликопротеинового комплекса заключается в укреплении сарколеммы. Отсутствие ди-строфина в миофибриллах приводит к нарушению функции и дезинтеграции дистрофин-гликопротеинового комплекса, нарушению устойчивости миофибрилл к циклическим актам сокращения-расслабления, что приводит к их разрывам. Кроме того, дестабилизация саркоплазматических мембран приводит к нарушению функции ионных каналов, что в свою очередь ведет к повышению содержания свободного внутриклеточного кальция (ионизированного), избыток которого оказывает на мышечные волокна некротизирую-щее, лизирующее действие.
Заболевание встречается с частотой 30 на 100 ООО новорожденных мальчиков и обычно проявляется в возрасте 3—5 лет, однако клиническая симптоматика появляется в возрасте 9—10 лет.
Основными клиническими симптомами болезни Дюшена являются:
прогрессирующая слабость мышц тазового и плечевого пояса, сгибательных мышц шеи, постепенное формирование контрактур и ограничение движений в тазобедренных, коленных, локтевых, лучезапястных суставах;
постепенное прогрессирующее нарушение способности ходить и полная утрата ходьбы к 12 годам;
формирование кифосколиоза;
деформация грудной клетки, прогрессирующее нарушение функции дыхания и развитие выраженной дыхательной недостаточности на 2—3-м десятилетии жизни;
снижение интеллекта;
псевдогипертрофия мышц (они замещаются жировой и соединительной тканью и кажутся утолщенными). Кардиомиопатия развивается практически у всех больных. Она
характеризуется расширением границ сердца и дилатацией его по
при исследовании, т. е. у больных
развивается дилатационная кардиомиопатия. В последующем ди-латационная кардиомиопатия приводит к развитию систолической застойной сердечной недостаточности.
Диагностика синдрома дилатационной кардиомиопатии при миопатии Дюшена осуществляется так же, как дилатационной кар-диомиопатии идиопатической. Следует учесть, однако, особенности физикального исследования сердца. У больных миопатией Дю-шена имеются деформация грудной клетки, уменьшение ее пере-днезаднего размера, высокое стояние диафрагмы, вследствие чего сердечный толчок иногда определяется у левого края грудины. В области И-го межреберья слева могут выслушиваться короткий мезосистолический шум митральной регургитации и усиление II тона. Митральная регургитация обусловлена дисфункцией задней папиллярной мышцы.
Для кардиомиопатии при болезни Дюшена характерны также нарушения сердечного ритма и проводимости. Характерны замедление атриовентрикулярной проводимости (интервал PQ на ЭКГ > 0.20 с приблизительно у 10—15 % больных) или, напротив, укорочение интервала PQ до величины < 0.12 с наблюдается также в 10% случаев.
Желудочковые аритмии (пароксизмальная желудочковая тахикардия, политопная желудочковая экстрасистолия) регистрируются у 30% больных.
Типичными ЭКГ-изменениями при миопатии Дюшена считаются также узкий, глубокий зубец Q в левых грудных отведениях, зазубренность зубца Ryj или конфигурация желудочкового комплекса в V, типа RSR, а также отношение RVI/RV2 > 1.
Диагностика миопатии Дюшена осуществляется на основании вышеизложенных клинических данных, а также на основании высокого уровня креатинфосфокиназы в крови (в 20—100 раз выше нормы) и результатов биопсии мышц. В биоптатах видны разнокалиберные мышечные волокна, небольшие группы некротизирован-ных и регенерирующих волокон, замещение мышечных волокон жировой и соединительной тканью.
В настоящее время разработаны методы определения в биопта-тах мышц дистрофина (метод иммуноблоттинга), уровень которого резко снижен или не определяется вовсе.
Определенное значение имеет также электромиографическое исследование, оно выявляет миопатическую триаду: снижение амплитуды, длительности и полифазные (более чем из 4-х фаз) потенциалы действия двигательных единиц.
Смерть больных миопатией Дюшена наступает обычно в возрасте 20—25 лет. Основные причины летального исхода — тяжелая дыхательная недостаточность, возможна внезапная смерть из-за фибрилляции желудочков.
Миопатия Беккера
Миопатия Беккера — менее тяжелая Х-сцепленная миопатия. В связи с более благоприятным течением по сравнению с миопа-тией Дюшена, ее называют доброкачественной псевдогипертрофической миопатией.
В настоящее время установлена генетическая общность миопа-тии Дюшена и Беккера. Оба эти заболевания вызываются аллель-ными мутациями одного и того же гена.
Патогенез миопатии Беккера полностью аналогичен патогенезу миопатии Дюшена. Миопатия Беккера встречается с частотой 3. 100 000 новорожденных мальчиков.
Клиническая картина миопатии Беккера в целом аналогична миопатии Дюшена. Отличия заключаются в следующем:
жалобы и объективные клинические проявления при миопатии Беккера появляются несколько позже (в возрасте 5—15 лет, иногда позже);
больные могут самостоятельно ходить не менее чем до 15 лет (иногда даже позже);
средняя продолжительность жизни больных с миопатией Бек-кера больше, чем при миопатии Дюшена и может составить 40 лет и даже больше;
• снижение интеллекта при миопатии Беккера бывает редко.
В развернутой стадии заболевания у всех больных развивается
синдром дилатационной кардиомиопатии. Клиническая картина и
данные исследования соответствуют, в це-
лом, таковым при идиопатической кардиомиопатии.
Нарушения сердечного ритма и проводимости и данные ЭКГ-исследования являются сходными с таковыми при мио-патии Дюшена.
Диагностика заболевания производится так же, как при миопа-тии Дюшена.
Миотоническая мышечная дистрофия
Миотоническая мышечная дистрофия или болезнь Згетеп) — семейно-наследственное заболевание, передающееся аутосомно-доминантным путем, характеризующееся атрофией дистальной скелетной мускулатуры, мышечной слабостью и системными проявлениями (облысением, атрофией гонад, кардиомиопатией, катарактой).
Заболевание развивается у мужчин и женщин в равной степени. Это самая частая миопатия у взрослых. Ее частота составляет 13.5 на 100 ООО живых новорожденных.
Генетический дефект при миотонической мышечной дистрофии локализуется в области 19-й хромосомы (ген заболевания локализован в сегменте 19ql3.2—ц13.3.) и заключается в мутации, приводящей к увеличению числа тринуклеотидных повторов (цитозин-тимин-гуанин). Вследствие этого генетического дефекта нарушаются синтез и активность миотонической проте-инкиназы, что приводит к нарушению функции ионных каналов в мышечной ткани.
У взрослых отчетливая клиническая симптоматика появляется в возрасте 20—25 лет. Наиболее ранним признаком болезни является слабость мышц лица, шеи, дистальных мышц конечностей (кистей, стоп). В последующем развивается атрофия мускулатуры лица, височных, жевательных мышц и дистальных мышц конечностей.
Лицо больных приобретает характерный вид: продолговатая форма, выступающие скулы, резко очерченный нос, глубокие за-падения в височных областях. Нарушается жевание пищи, развиваются выраженные атрофия и слабость кистей, стоп, характерно отвисание стопы. В связи с поражением мышц глотки, гортани нарушаются речь, глотание.
Для миотонической мышечной дистрофии характерны также снижение интеллекта, сонливость, атрофия гонад, инсулинорезис-тентность, кардиомиопатия.
Поражение сердца имеется у большинства больных, но клиническая кардиальная симптоматика обычно развивается после появления симптоматики поражения мускулатуры.
В основе поражения сердца лежит фиброзная и жировая дегенерация в миокарде предсердий, желудочков, а также в синусовом и атриовентрикулярном узле, в проводящей системе, в том числе волокнах Пуркинье.
Нарушения сердечного ритма и проводимости являются наиболее ранним проявлением кардиомиопатии при миотонической мы-щечной дистрофии. Мерцательная аритмия наблюдается у 6—11% больных, атриовентрикулярная блокада I ст. — у 20—60% больных, блокада правой ножки пучка Гиса в 2—11%, а левой ножки — в 5— 13% всех случаев. По мере прогрессирования болезни развивается полная атриовентрикулярная блокада. Характерны также пароксиз-мальная желудочковая тахикардия, желудочковая экстрасистолия.
При эхокардиографии выявляется пролапс митрального клапана в связи с дисфункцией папиллярных мышц. Постепенно развивается кардиомиопатия с нарушением ранней диастолической релаксации левого желудочка, что позволяет считать, что речь идет о рестриктивной кардиомиопатии.
Диагноз заболевания ставится на основании изложенных выше основных клинических проявлений. Активность креатинфосфоки-назы в крови при миотонической мышечной дистрофии нормальная или слегка повышена.
Большое диагностическое значение имеет биопсия скелетной мышцы, которая характеризуется атрофией мышц. Некроз мышечных волокон и разрастание соединительной ткани нехарактерны.
При электромиографическом исследовании выявляются тонические разряды.
Смерть больных чаще всего наступает от прогрессирующей дыхательной недостаточности, асистолии сердца при полной атрио-вентрикулярной блокаде, иногда от фибрилляции желудочков. Описаны случаи течения заболевания с минимальной клинической симптоматикой и продолжительностью жизни больных до 60—70 лет (Harper и соавт. 1989).
Кардиомиопатии при нейромышечных нарушениях
Кардиомиопатия при атаксии Фридрейха
Атаксия Фридрейха — наследственное спиноцеребеллярное дегенеративное заболевание, наследуемое аутосомно-рецессив-ным путем, характеризующееся дегенерацией задних и боковых столбов и задних корешков спинного мозга, а также мозжечка.
Ген атаксии Фридрейха расположен в 9-й хромосоме, он отвечает за синтез белка фратаксина, расположенного на внутренней поверхности мембраны митохондрий и регулирующего трансмембранный транспорт железа и тканевое дыхание. При атаксии Фридрейха происходит мутация гена фратакси-на, заключающаяся в патологическом увеличении числа копий внутригенных тринуклеотидных повторов «гуанин-аденин-аденин». Вследствие указанной мутации нарушается синтез в тканях фратаксина, что приводит к повреждению митохондрий, нарушению их функций, нарушению процессов окислительного фосфорилирования, тканевого дыхания, дегенерации и гибели наиболее энергозависимых клеток спинного мозга, мозжечка, миокарда.
Атаксией Фридрейха одинаково часто болеют мужчины и жен-шины. Клинические симптомы заболевания обычно появляются в препубертатном периоде, в 1—2-м десятилетии жизни. Основные клинические проявления болезни следующие:
атаксия (нарушение координации, неустойчивость, пошатывание в положении стоя и при ходьбе);
дизартрия;
нарушения почерка;
мышечная гипотония;
исчезновение сухожильных и надкостничных рефлексов (в первую очередь ахилловых и коленных);
нарушение глубокой (суставно-мышечной и вибрационной) чувствительности;
слабость и атрофия мышц ног и рук;
тазовые расстройства (нарушения мочеиспускания, дефекации);
поражение миокарда.
Поражение мышцы сердца обнаруживается более чем у 80% больных и характеризуется развитием концентрической гипертрофической кардиомиопатии, однако может наблюдаться и асимметричная гипертрофия межжелудочковой перегородки с развитием в отдельных случаях градиента давления в выносящем тракте левого желудочка.
В редких случаях развивается дилатационная кардиомиопатия, но остается неясным, возникает ли она изначально или является результатом трансформации гипертрофической кардиомиопатии.
Клиническая картина, а также данные ЭКГ, эхокардиографии кардиомиопатии при атаксии Фридрейха соответствуют описанию гипертрофической кардиомиопатии, сделанному ранее в разделе «Гипертрофическая кардиомиопатия».
Следует отметить, что нарушения сердечного ритма, в частности, мерцательная аритмия, желудочковые тахиаритмии и нарушения атриовентрикулярной проводимости наблюдаются чаще при развитии дилатационной кардиомиопатии.
Важно также подчеркнуть, что иногда клинические, электрокардиографические и эхокардиографические признаки поражения миокарда могут появиться значительно раньше, чем неврологические нарушения.
В эндомиокардиальных биоптатах при атаксии Фридрейха обнаруживаются гипертрофия кардиомиоцитов и интерстициаль-ный фиброз.
Диагностика заболевания осуществляется на основании наличия клиники вышеописанных неврологических, мышечных нарушений в сочетании с синдромом гипертрофической кардиомиопатии.
Кроме того, учитываются результаты электронейромиографи-ческого исследования. Для атаксии Фридрейха характерно значительное снижение амплитуды потенциалов действия чувствительных нервов при относительной сохранности проведения импульсов по двигательным нервам.
Рекомендуется также магнитно-резонансная томография спинного мозга, она выявляет диффузную его атрофию уже в ранней стадии заболевания.
Прогноз плохой, заболевание неуклонно прогрессирует, больные умирают от дыхательной недостаточности, пневмоний, застойной сердечной недостаточности обычно в возрасте 40—50 лет. Возможна внезапная смерть (обычно при развитии дилатационной кардиомиопатии).
Синдром Нунан
Синдром Нунан — врожденное нарушение половой дифферен-цировки у лиц мужского и женского пола при сохранении у них нормального кариотипа, характеризующееся первичным гипогона-дизмом и фенотипом синдрома Тернера-Шерешевского.
Синдром Нунан встречается с частотой 1. 8000 в общей популяции, наследуется аутосомно-доминантно. Ген синдрома Нунан локализуется на длинном плече хромосомы 12 (12д24), он кодирует синтез нерецепторного белка тирозин-2-фосфатазы. В результате мутаций этого гена развивается заболевание, при котором в первую очередь поражаются гонады и сердечно-сосудистая система.
Синдром Нунан характеризуется низкорослостью, укорочением конечностей, наличием крыловидных складок по бокам шеи, низким расположением ушных раковин, антимонголоидным разрезом глаз, птозом, наличием третьего века, недоразвитием нижней челюсти, низко расположенной линией роста волос на затылке, высоким готическим небом, бочкообразной грудной клеткой, снижением умственного развития, лимфедемой кистей и стоп (все эти признаки характерны для синдрома Тернера у женщин с кари-отипом 45X0), гипогонадизмом у мужчин (гипоплазированные яички, иногда крипторхизм, недостаточное развитие полового члена) и женщин (позднее появление менструаций, иногда дисфункция яичников). Однако следует отметить, что у многих мужчин с синдромом Нунан тестикулярная функция (при отсутствии крип-торхизма) может оказаться нормальной. У женщин также может быть нормальная половая функция.
Большинство больных с синдромом Нунан имеют патологию сердечно-сосудистой системы. У 50-60% больных наблюдается стеноз клапана легочной артерии, у 10% больных — дефект меж-предсердной перегородки, в 10% случаев — коарктация или стеноз аорты.
У 20—30% больных выявляется гипертрофическая кардиомио-патия, клиническая картина и эхокардиографические проявления которой соответствуют описанию в разделе «Гипертрофическая кардиомиопатия».
Диагноз синдрома Нунан ставится на основании наличия характерных вышеописанных фенотипических признаков (аналогичных синдрому Тернера) при нормальном кариотипе, низкорослое-ти, гипогонадизма (чаще у мужчин), вышеописанной патологии сердечно-сосудистой системы.
Кардиомиопатии при гиперчувствительности и токсических реакциях
К этой группе кардиомиопатий относят поражения миокарда, возникающие под влиянием алкоголя, радиационного воздействия (они описаны ранее), а также под влиянием различных лекарственных и токсических веществ.
Лекарственные кардиомиопатий
Лекарственные средства могут вызывать различные формы сердечно-сосудистых нарушений: аритмии сердца, нарушения проводимости, артериальную гипертензию или гипотензию, стенокардию, перикардит, тромбоэмболии, поражения миокарда.
В этом разделе будут рассмотрены кардиопатии, обусловленные лекарственными препаратами.
Wood (1998) приводит следующий список лекарственных препаратов, вызывающих развитие дилатационной кардиомиопатии: адреностимуляторы и симпатомиметики, даунорубицин, доксору-бицин, литий, сульфаниламиды, фенотиазины, эметина гидрохлорид. К этим веществам следует также добавить кокаин.
Поражение сердца при употреблении кокаина
При употреблении кокаина развивается ряд опасных сердечнососудистых осложнений. К ним относятся: миокардиальная ишемия и инфаркт миокарда (в ‘/3 случаев не связанный с обструкцией коронарных артерий); нарушения сердечного ритма и внезапная смерть; ускоренное развитие атеросклероза; острая, тяжело протекающая артериальная гипертензия; острый разрыв аорты, инсульт.
Кокаин оказывает непосредственное влияние на миокард в виде преходящего нарушения сократительной функции желудочков (острого или хронического в зависимости от длительности приема кокаина) (Mitleman и соавт. 1999); рассеянных очагов некроза в миокарде, миокардита и фиброза (Kloner, Hale, 1993). В отдельных случаях может развиваться дилатационная кардио-миопатия (Kloner, Hale, 1993).
Кардиоваскулярные эффекты кокаина обусловлены следующими механизмами его действия:
блокада обратного захвата катехоламинов в пресинаптических нейронах и избыточное влияние катехоламинов на миокард;
перегрузка кардиомиоцитов ионами кальция;
резкое повышение потребности миокарда в кислороде под влиянием избытка катехоламинов;
выраженное спазмирование коронарных артерий в связи с возбуждением их а-адренорецепторов.
При употреблении кокаина значительно изменяется электрокардиограмма: регистрируются синусовая тахикардия, желудочковая эк-страсистолия, пароксизмальная тахикардия, мерцание и трепетание предсердий, удлинение интервала QT, смещение интервала ST книзу от изолинии, возможно развитие фибрилляции желудочков.
Смерть больных может наступить от инфаркта миокарда, фибрилляции желудочков, прогрессирующей сердечной недостаточности при развитии дилатационной кардиомиопатии.
Поражение сердца при лечении а-интерфероном
Кардиотоксичность а-интерферона выражается в развитии артериальной гипотензии, тахикардии, транзиторных аритмий. Эти проявления наблюдаются приблизительно в 10% случаев.
У отдельных больных наблюдается развитие дилатационной кар-диомиопатии и застойной сердечной недостаточности. После прекращения лечения а-интерфероном кардиомиопатия медленно подвергается обратному развитию (Реешгха и соавт. 1999).
Поражение сердца при лечении интерлейкином-2
Лимфокин интерлейкин-2, применяемый для лечения злокачественных новообразований, может вызывать нарушения сердечного ритма, обратимую дисфункцию левого желудочка, ишемию и даже инфаркт миокарда, эозинофильный миокардит.
Поражение сердца при лечении антидепрессантами
Поражение миокарда может наблюдаться при злоупотреблении большими дозами трициклических антидепрессантов при тяжелой депрессии, при этом могут развиваться синусовая тахикардия, нарушения сердечного ритма и атриовентрикулярной проводимости. Возможна внезапная сердечная смерть. Имеются данные о том, что трициклические антидепрессанты обладают свойствами антиаритмических препаратов I класса и при назначении их одновременно с антиаритмическими средствами, особенно у больных инфарктом миокарда, возможно удлинение интервала Р(2 и развитие проарит-могенного эффекта. •
Характерно, что кардиотоксическое действие трициклических антидепрессантов обычно не сопровождается развитием недостаточности кровообращения.
Поражение миокарда при лечении фенотиазинами
Лечение препаратами фенотиазинового ряда вызывает значительные изменения в миокарде при приеме больших доз препаратов. Установлено, что под влиянием фенотиазиновых соединений в миокарде происходит отложение мукополисахаридов в межмышечных соединениях, в периартериолярных зонах, в проводящей системе, наблюдаются также дегенерация миофибрилл и пролиферация гладкомышечных клеток кровеносных сосудов. Фенотиази-новые соединения оказывают прямое кардиотоксическое действие, стимулируют высшие автономные центры и вызывают изменение уровня циркулирующих катехоламинов.
Наиболее характерными проявлениями кардиотоксического эффекта фенотиазиновых соединений являются нарушения сердечного ритма, ЭКГ-изменения, постуральная артериальная ги-потензия, внезапная смерть. Нарушения сердечного ритма разнообразны: суправентрикулярная экстрасистолия и тахикардия, мерцание и трепетание предсердий, желудочковая пароксизмаль-ная тахикардия, экстрасистолия, возможно развитие фибрилляции желудочков.
ЭКГ-изменения обычно выражаются в удлинении интервала QT, что предрасполагает к развитию желудочковой тахикардии, особенно полиформной, рецидивирующей; в изменении зубца Т (высокие дозы фенотиазиновых соединений вызывают значительное снижение амплитуды зубца Т); в увеличении амплитуды зубца U.
Поражение миокарда при лечении эметином
Эметин применяется для лечения амебиаза, шистосомиаза. Поражение миокарда наблюдается при длительном лечении эметином. Под влиянием эметина развиваются дегенерация и некроз, интерстициальная инфильтрация миокарда мононуклеарными клетками и гистиоцитами.
У 50% больных, которые длительно лечатся эметином, наблюдаются изменения ЭКГ, наиболее характерны уменьшение амплитуды или инверсия зубца Т, могут также наблюдаться удлинение интервала QT и снижение интервала ST. Патология зубца и интервала PQ встречается редко. У некоторых больных значительно снижается артериальное давление, появляется синусовая тахикардия.
Описана также транзиторная или постоянная левожелудочко-вая дисфункция при лечении эметином (Но и соавт. 1998). Следует отметить, что эметиновая кардиомиопатия претерпевает обратное развитие после прекращения лечения.
Поражение сердца при лечении эрготамином и метилсергидом
Структура эрготамина и метилсергида сходна. При длительном применении этих препаратов могут развиваться пороки митрального клапана, перикардиальный, плевральный или ретроперитоне-альный фиброз. Необходимо прекратить лечение этими препаратами, если появился систолический шум в области верхушки сердца (митральная регургитация).
Под влиянием эрготамина может развиться выраженный спазм коронарных артерий, что проявляется приступами стенокардии.
Поражение сердца при лечении хлорохином
Как известно, лечение хлорохином проводится длительно (месяцы и даже годы). Под влиянием хлорохина возможно развитие рестриктивной кардиомиопатии. Высокие дозы препарата могут снизить сердечный выброс, вызвать развитие аритмий, атриовент-рикулярной блокады, брадикардию и даже внезапную смерть.
Поражение сердца при лечении препаратами лития
Препараты лития, применяемые в больших дозах, могут вызывать желудочковые аритмии, нарушение функции синусового узла, нарушение атриовентрикулярной проводимости, в редких случаях — внезапную смерть.
Описаны также дилатация полостей сердца и развитие застойной сердечной недостаточности при лечении препаратами лития.
Кардиопатия вследствие избыточного воздействия катехоламинов, симпатомиметиков
Известен кардиотоксический эффект избытка катехоламинов. В ряде случаев у больных феохромоцитомой развивается дилатаци-онная кардиомиопатия.
Избыток катехоламинов может вызывать острый миокардит, фокальный некроз кардиомиоцитов, эпикардиальные геморрагии, тахикардию, аритмии. Указанные кардиотоксические эффекты симпатомиметиков наблюдаются при лечении больных, страдающих нарушением бронхиальной проходимости, большими дозами этих препаратов.
Кардиотоксический эффект катехоламинов и симпатомиметиков обусловлен следующими механизмами:
прямой токсический эффект накардиомиоциты;
увеличение потребности миокарда в кислороде, усугубление ишемии миокарда;
перегрузка миокарда кальцием;
повышение активности свободнорадикального окисления липи-дов и токсическое влияние на миокард свободных радикалов;
катехоламининдуцированный вазоспазм (в том числе корона-роспазм вследствие стимуляции а-адренорецепторов).
Поражение миокарда лекарственными средствами, в основе кар-диотоксического действия которых лежит гиперчувствительность, обсуждается в главе «Миокардиты».
Антрациклининдуцированная кардиомиопатия
препараты широко применяются в качестве химиотерапевтических препаратов для лечения острого лейкоза, лимфомы, лимфогранулематоза, рака яичников, молочной железы, легких, саркомы. Основными антрациклиновыми препаратами являются даунорубицин (рубомицин), доксорубицин (адриаблас-тин, адриамицин), идарубицин, митоксантрон.
Антрациклиновые препараты обладают кардиотоксическим эффектом, который обусловлен следующими факторами:
нарушение белкового обмена миокардиоцитов вследствие связывания препаратов с ДНК;
образование свободных радикалов вследствие усиления процессов перекисного окисления липидов;
нарушение калиевого обмена и транспорта электронов в митохондриях;
образование комплекса антрациклин-железо, усиливающего повреждающее действие свободных радикалов на миокард;
перегрузка миокарда кальцием;
повышенная продукция цитокинов: фактора некроза опухоли и интерлейкина-2, способствующих повреждению миокарда;
усиление апоптоза (запрограммированной клеточной смерти) в миокарде.
Патоморфологические изменения в миокарде при антрацик-линовой кардиомиопатии заключаются в вакуолизации, отеке, некрозе миофибрилл, интерстициальном фиброзе. При электронной микроскопии миокарда обнаруживаются выраженные изменения в митохондриях, саркоплазматическом ретикулуме, миофибриллах.
Выраженность кардиотоксического эффекта антрациклинов зависит от дозы препарата, длительности лечения и вида препарата. Наиболее токсичным является адриабластин, менее токсичны ида-рубицин и митоксантрон.
При суммарной дозе адриабластина 500—600 мг/м2 сердечная недостаточность развивается в 11% случаев, при дозе выше 600 мг/м2 — в 30% случаев (Robert и соавт. 1982).
При лечении рубомицином при суммарной его дозе 950 мг/м2 сердечная недостаточность отмечается в 10% случаев, при суммарной дозе больше 950 мг/м2 — в 30% случаев.
Антрациклиновые препараты могут вызывать ранний (острый) и поздний (хронический) кардиотоксический эффект.
Ранняя антрациклининдуцированная кардиомиопатия характеризуется суправентрикулярными (мерцание, трепетание предсердий, суправентрикулярная пароксизмальная тахикардия) и вентри-кулярными нарушениями сердечного ритма (желудочковые экстрасистолы, пароксизмы желудочковой тахикардии), возможна внезапная смерть вследствие фибрилляции желудочков. При ранней антрациклининдуцированной кардиомиопатии возможно также одновременное поражение миокарда и перикарда (миоперикар-диальный синдром или синдром миокардита-перикардита), развитие инфаркта миокарда. Bristow и соавт. (1978) описали редкие случаи внезапной сердечной смерти вследствие острого перикардита-миокардита и сердечной недостаточности через 2 недели от начала лечения антрациклинами.
ЭКГ обычно характеризуется нарушениями сердечного ритма, снижением или даже инверсией зубца Т, смещением книзу от изолинии интервала ST, удлинением интервала QT, развитием атрио-вентрикулярной блокады или блокады ножки пучка Гиса.
Гораздо более характерным проявлением кардиотоксичности антрациклина является хроническая кардиомиопатия, развивающа-яся вследствие кумуляции препарата в миокарде при длительном лечении. Факторами риска развития хронической антрациклинин-дуцированной кардиомиопатии являются пожилой или очень молодой возраст, большие дозы препаратов; предшествующие сердечно-сосудистые заболевания, одновременное применение других цитостатических препаратов.
Типичной клинической формой антрациклининдуцированной кардиомиопатии является дилатационная кардиомиопатия, субъективные и объективные проявления которой очень сходны с идио-патической дилатационной кардиомиопатией. Больные жалуются на выраженную одышку как днем, так и ночью (по ночам больных беспокоят пароксизмы одышки), общую слабость, сердцебиения, ощущение перебоев в области сердца, отеки в области голеней и стоп. При объективном исследовании обнаруживаются характерные симптомы застойной сердечной недостаточности: периферические отеки, акроцианоз, влажные хрипы и крепитация в нижних отделах легких, увеличенная, болезненная печень, возможен асцит. При физикальном исследовании сердца выявляются ослабленный и распространенный (разлитой) сердечный толчок, смещенный влево; расширение левой границы относительной тупости сердца; тахикардия; глухость сердечных тонов; патологический III тон и протодиастолический ритм галопа.
При рентгеноскопии органов грудной клетки обнаруживаются значительное увеличение размеров сердца и признаки венозного застоя в легких, довольно часто — одно- или двусторонний плевральный выпот.
Эхокардиография и вентрикулография выявляют дилатацию полостей желудочков при отсутствии гипертрофии миокарда и значительное снижение сократительной функции миокарда левого желудочка (фракция выброса значительно снижена).
Антрациклининдуцированная дилатационная кардиомиопатия может стать значительно менее выраженной, а систолическая функция левого желудочка улучшиться после прекращения лечения антрациклинами.
Прогноз при дилатационной кардиомиопатии
может быть неудовлетворительным. Felker и соавт. (2000) проанализировали исходы антрациклиновой кардиомиопатии у 1230 пациентов и установили, что их средняя продолжительность жизни после развития симптоматики поражения сердца составила 4.4 года, что ниже средней продолжительности жизни при идиопатической кардиомиопатии.
Причиной смерти больных чаще всего являются прогрессирующая сердечная недостаточность, фибрилляция желудочков.
Поражение сердца при лечении другими противоопухолевыми средствами
5-Фторурацил
применяется для лечения солидных опухолей (ко-лоректальный рак, рак молочной железы и др.). Этот противоопухолевый препарат может вызвать поражение миокарда, причем вероятность развития кардиотоксического эффекта возрастает при сочетанной терапии 5-фторурацилом и облучением, а также при наличии предшествующих заболеваний сердца.
5-Фторурацил ингибирует фермент тимидилатсинтазу, который участвует в метаболизме ДНК и РНК.
Поражение сердца при лечении 5-фторурацилом характеризуется следующими проявлениями:
вазоокклюзивные поражения, прежде всего окклюзия коронарных артерий и развитие острого инфаркта миокарда;
вазоспастическая ишемия миокарда, вазоспастическая стенокардия; в основе вазоспастических реакций лежит повреждение эндотелия;
различные нарушения сердечного ритма;
• нарушение сократительной функции миокарда, развитие сердечной недостаточности.
Указанные кардиотоксические эффекты развиваются приблизительно у 2% больных, получавших лечение 5-фторурацилом. После отмены 5-фторурацила проявления поражения миокарда значительно уменьшаются.
Циклофосфамид
применяемый для лечения лейкемий и других злокачественных новообразований, может вызвать тяжелую кардио-миопатию при применении его в высоких дозах. Goldberg и соавт. (1986), Ayash и соавт. (1992) описали развитие тяжелой сердечной недостаточности у больных лейкемией, получавших Циклофосфамид в больших дозах — до 180 мг/кг в течение 4-х дней при подготовке к трансплантации костного мозга. Предрасполагающими факторами к развитию циклофосфамидной кардиомиопатии являются предшествующие заболевания сердечно-сосудистой системы.
Основные клинические проявления циклофосфамидной кардиомиопатии — острая сердечная недостаточность, острый мио-перикардит.
На аутопсии больных, погибших от острого циклофосфамидно-го миоперикардита, обнаруживаются фибринозный перикардит, выраженный интерстициальный отек миокарда, очаговые кровоизлияния в нем, лизис миофибрилл, микротромбы в микроцирку-ляторной системе миокарда.
Перипартальная кардиомиопатия
кардиомиопатия — это форма дилатационной кардиомиопатии с левожелудочковой систолической дисфункцией и клиническими признаками застойной сердечной недостаточности, развивающимися у ранее здоровых женщин в последнем триместре беременности или в послеродовом периоде.
8 За к. 2905
Заболевание является достаточно распространенным в Африке — 1 случай на 1000 родов, особенно высокая заболеваемость в Нигерии (13% среди всех поступивших в клинику женщин). В США заболевание встречается с частотой 1 случай на 15 000 родов.
Этиология перипартальной кардиомиопатии неизвестна. Предполагается возможная связь заболевания с перенесенным миокардитом, потому что в эндомиокардиальных биоптатах нередко выявляются признаки миокардита, однако эта точка зрения не считается доказанной. Lang и соавт. (1998) считают, что развитие перипартальной дилатационной кардиомиопатии связано, прежде всего, с беременностью, с присущими ей особенностями, вероятно, не до конца выясненными, а не с какими-либо другими этиологическими факторами. В пользу этой точки зрения свидетельствуют следующие факты:
значительное уменьшение и даже полное исчезновение клинических проявлений у большого числа женщин в послеродовом периоде;
рецидив дилатационной кардиомиопатии при повторной беременности у женщин, которые имели кардиомиопатию во время предыдущей беременности.
К факторам повышенного риска развития перипартальной ди-латационной кардиомиопатии относятся принадлежность к негроидной расе, возраст-старше 30 лет, наличие более чем 3 родов в анамнезе, многоплодная беременность, поздний гестоз (Lampert и соавт. 1995).
Клиническая картина
Клиническая симптоматика перипартальной кардиомиопатии аналогична симптоматике идиопатической кардиомиопатии, однако, в отличие от нее, имеется четкая связь заболевания с беременностью.
Перипартальная дилатационная кардиомиопатия развивается в III триместре беременности или в первые 6 месяцев послеродового периода. Больных беспокоят общая слабость, одышка, боли в области сердца (больше постоянного характера), сердцебиения и ощущения перебоев в области сердца, отеки в области голеней и стоп. При осмотре наблюдаются акроцианоз, периферические отеки, положение ортопноэ. Пульс частый, нередко аритмичен, сниженного наполнения. Артериальное давление обычно нормальное, однако у некоторых больных отмечается артериальная гипертензия.
Отмечается увеличение левой границы относительной тупости сердца при перкуссии, тоны сердца глухие, часто аритмичны, прослушиваются патологический III тон, протодиастолический ритм галопа, систолический шум митральной или трикуспидальной ре-гургитации. В легких в нижних отделах прослушивается крепитаимя. Возможно увеличение печени — как отражение застойной сердечной недостаточности.
Заболевание часто осложняется различными видами аритмий, нарушениями атриовентрикулярной проводимости, тромбоэмболи-ями различной локализации.
Инструментальные исследования
Электрокардиография
Характерны синусовая тахикардия, частые нарушения сердечного ритма (мерцание, трепетание предсердий, политопные супра-вентрикулярные и желудочковые экстрасистолы, пароксизмы суп-равентрикулярной или желудочковой тахикардии); различные степени нарушения атриовентрикулярной или внутрижелудочковой проводимости; неспецифические изменения интервала ST и зубца Т, преимущественно в левых грудных отведениях.
Эхокардиография
Характерными признаками ной дилатационной кардиомиопатии являются дилатация всех четырех полостей сердца, умеренное накопление жидкости в полости перикарда. При доплерэхокардиографии выявляются митральная или трикуспидальная регургитация и значительное снижение фракции выброса (как отражение систолической дисфункции левого желудочка). Развитие гипертрофии миокарда желудочков нехарактерно.
Рентгенография сердца и легких
Рентгенография сердца и легких выявляет легочный венозный застой, иногда выпот в полости плевры.
Диагноз
Диагностика перипартальной кардиомиопатии осуществляется на основании следующих критериев:
наличие синдрома дилатационной кардиомиопатии, доказанной прежде всего с помощью эхокардиографии, развившейся во время беременности (обычно в III триместре) или после родов (не позже 6 месяцев);
наличие клинических иэхокардиографических признаков систолической дисфункции левого желудочка;
• отсутствие каких-либо других причин и заболеваний, которые могли бы привести к развитию синдрома дилатационной кар-диомиопатии.
Течение и прогноз
В случаев в послеродовом периоде симптоматика ди-
латационной кардиомиопатии уменьшается и может наступить даже полное выздоровление. Если спустя 6 месяцев после родов сохраняется симптоматика поражения миокарда и недостаточности кровообращения, то это является фактором риска развития хронического течения заболевания и хронической сердечной недостаточности.
Тахиаритмическая дилатационная кардиомиопатия
В настоящее время признается существование тахиаритмичес-кой дилатационной кардиомиопатии. Принято считать, что тахиа-ритмическая дилатационная кардиомиопатия или тахикардиомио-патия — это дилатация миокарда и нарушение его сократительной способности, обусловленные длительной тахикардией (суправентрикулярная или желудочковая тахикардия, мерцательная аритмия) при отсутствии каких-либо заболеваний сердца (первичных или возникающих на фоне других заболеваний). Таким образом, можно считать, что Тахиаритмическая дилатационная кардиомиопатия возникает на фоне длительно существующей идиопатической тахикардии (тахиаритмии).
Поставить диагноз тахиаритмической дилатационной кардио-миопатии можно на основании следующих критериев:
констатация синдрома дилатационной кардиомиопатии (клинические и эхокардиографические признаки, систолическая дисфункция левого желудочка);
наличие длительной тахикардии (тахиаритмии);
отсутствие других первичных заболеваний сердца или поражений миокарда вторичного генеза.
Содержание
Читать: Аннотация
Читать: Список сокращений
Читать: Кардиомиопатии
Читать: Дилатационная кардиомиопатия
Читать: Примечания к критериям
Читать: Аритмогенная правожелудочковая кардиомиопатия
Читать: Гипертрофическая кардиомиопатия
 Читать: Патоморфология
Читать: Патоморфология
 Читать: Данные объективного исследования
Читать: Данные объективного исследования
 Читать: Малосимптомный вариант
Читать: Малосимптомный вариант
Читать: Рестриктивная кардиомиопатия
 Читать: Клинические критерии
Читать: Клинические критерии
 Читать: Электрокардиография
Читать: Электрокардиография
Читать: Специфические кардиомиопатии
Читать: Примеры формулировки диагноза кардиомиопатии
Читать: Программа обследования больных с кардиомиопатиями
Читать: Миокардиты
 Читать: Патогенез
Читать: Патогенез
Читать: Метаболическая кардиомиопатия
Читать: Хроническая сердечная недостаточность
 Читать: Этиология
Читать: Этиология
 Читать: Патогенез
Читать: Патогенез
Кардиомиопатии
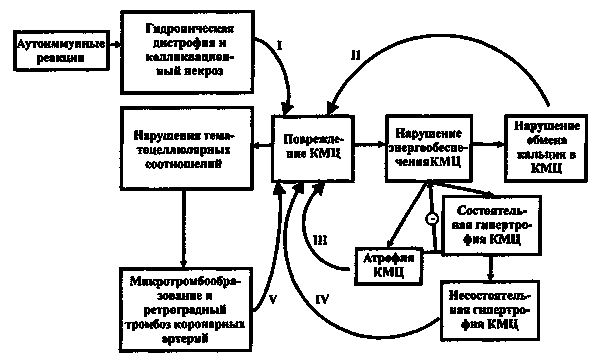
Под термином «кардиомиопатия » понимают болезни миокарда, характеризующиеся нарушениями функций сердца. В этом смысле можно говорить о поражениях миокарда при ИБС (ишемическая кардиомиопатия), при артериальной гипертензии (гипертензивная кардиомиопатия), при пороках сердца (клапанная кардиомиопатия).
Ранее под термином «кардиомиопатия» понимали первичные заболевания миокарда неизвестной этиологии. Заболевания миокарда известной этиологии или связанные с поражением других систем определялись как специфические (вторичные) заболевания миокарда. Из этой группы болезней миокарда исключались поражения миокарда при ИБС, артериальной гипертензии, пороках сердца и заболеваниях перикарда.
В клинической практике под кардиомиопатиями понимают группу заболеваний, в основе которых лежит генетическая предрасположенность к поражению миокарда с явлениями его дилатации, гипертрофии или рестрикции. В соответствии с этим различают следующие варианты кардиомиопатий:
• дилатационная кардиомиопатия;
• гипертрофическая кардиомиопатия;
• рестриктивная кардиомиопатия;
• аритмогенная правожелудочковая кардиомиопатия.
СЛУЧАЙ ГИПЕРТОНИЧЕСКОЙ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ ОБСТРУКТИВНОГО ТИПА Текст научной статьи по специальности « Медицина и здравоохранение »
Новости науки
В США собрали самую легкую винтовку AR-15
Специалисты американского оружейного магазина Guns & Tactics сумели собрать самую легкую версию самозарядной винтовки AR-15. Масса получившегося оружия составляет всего 4,5 фунта (2,04 килограмма). Для сравнения, масса стандартной серийной AR-15 составляет в среднем 3,1 килограмма в зависимости от производителя и версии.
Читать полностью
-
Созданы робопальцы c изменяемой жесткостью
Исследователи из Берлинского технического университета разработали актуатор с изменяемой жесткостью. Результаты работы продемонстрированы на конференции ICRA 2015, текст доклада опубликован на сайте университета.
Ученые из норвежской частной исследовательской организации SINTEF создали технологию для проверки качества сырого мяса при помощи слабого рентгеновского излучения. Пресс-релиз новой методики опубликован на сайте gemini.no.
Читать полностью