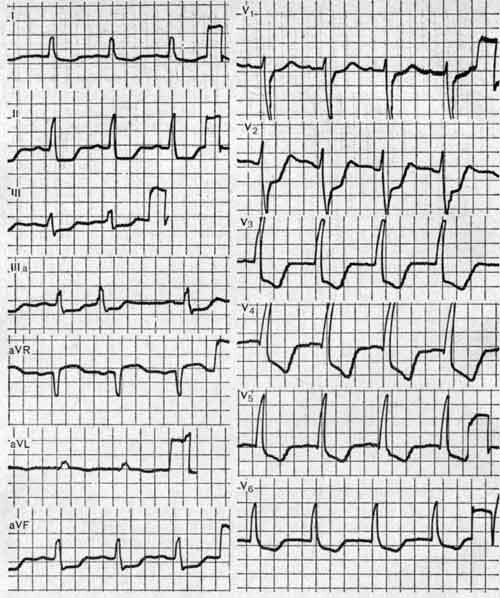
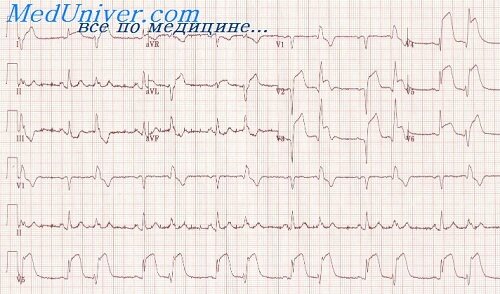
Периоды инфаркта миокарда
Лечим сердце
Клиническая картина инфаркта миокарда существенно меняется в зависимости от периода заболевания, каждому из которых присущи определенная симптоматика, особенности течения, ве роятность возникновения тех или иных осложнений, что необходимо учитывать при оказании неотложной помощи. Различают четыре периода инфаркта миокарда:
— продромальный;
— острый;
— подострый;
— постинфарктный.
Потребность в оказании неотложной помощи может возникнуть в любое время, но чаще всего в продромальном и в начале острого периода заболевания, описания которых приведены ниже.
Продромальный период.
Продромальный период инфаркта миокарда (острый коронарный синдром или нестабильная стенокардия) продолжается от нескольких минут до 30 сут (по мнению некоторых авторов, до 60 сут) и характеризуется появлением впервые или учащением
Привычных ангинозных болей, увеличением их интенсивности, изменением характера, локализации или иррадиации и реакции на нитроглицерин. В этом периоде заболевания могут отмечаться динамические изменения ЭКГ, свидетельствующие об ишемии или повреждении сердечной мышцы (глава 7), однако примерно у 30 % больных патологические признаки на ЭКГ отсутствуют.
Главными особенностями продромального периода являются рецидивирующий ангинозный болевой синдром и электрическая нестабильность миокарда, проявляющаяся острыми нарушениями сердечного ритма и проводимости.
Ввиду угрозы возникновения инфаркта миокарда и внезапной смерти все больные с клиническими признаками продромального периода инфаркта миокарда, независимо от наличия изменений на ЭКГ (!), должны быть незамедлительно госпитализированы. Неотложная помощь и лечение осуществляются так же, как и при нестабильной стенокардии (глава 5).
Острый период.
В первые часы заболевания (иногда их называют острейшим периодом инфаркта миокарда) состояние пациента отличается нестабильностью. Чем меньше времени прошло от начала ин фаркта миокарда, тем выше вероятность аритмий, и прежде всего фибрилляции желудочков. Артериальное давление неустойчиво, чаще на фоне болей отмечается гипертензия, реже — снижение артериального давления вплоть до шока. По основным клиническим проявлениям в этом периоде различают следующие варианты дебюта инфаркта миокарда:
— ангинозный;
— аритмический;
— цереброваскулярпый;
— астматический;
— абдоминальный;
— малосимитомный (безболевой).
Самый распространенный вариант — ангинозный — проявляется тяжелым болевым синдромом (подробно он описан в разделе "Диагностика") и электрической нестабильностью миокарда.
К Аритмическому Варианту заболевания относят лишь те случаи, когда инфаркт миокарда начинается с острых нарушений ритма или проводимости сердца при отсутствии болей. Чаще аритмический вариант проявляется фибрилляцией желудочков,
Реже — аритмическим шоком, обусловленным пароксизмом тахикардии (тахиаритмии) или острой брадикардией (брадиарит-мией). Нередко аритмический вариант клинически дает о себе знать обмороком, развившимся вследствие преходящих наруше ний сердечного ритма и проводимости (эпизодами фибрилляции желудочков, желудочковой тахикардии, СЛ — или ЛВ-блокад).
Цереброваскулярный вариант наблюдается у больных с отягощенным неврологическим анамнезом, В первые часы заболевания он связан с повышением артериального давления, когда инфаркт миокарда развивается на фоне или вследствие гипер-тензивного криза. Позже мозговая симптоматика может возникнуть в результате снижения артериального (а значит, и перфузи-ониого)давления.
Неврологическая симптоматика зависит от тяжести нарушений системного и регионарного (мозгового) кровообращения и может быть представлена головной болью, головокружением, тошнотой, рвотой, расстройством зрения, помрачением сознания (от легкой заторможенности до комы) и очаговыми неврологическими симптомами. У больных старческого возраста нарушение мозгового кровотока вследствие ухудшения кровообращения и снижения артериального давления может проявляться психозом, протекающим по типу делирия.
К цереброваскулярному варианту иногда относят сиикопаль-ные состояния в дебюте заболевания, однако они, как правило, обусловлены кратковременными эпизодами аритмий и значительно реже (на высоте боли) — начинающимся разрывом (надрывом) миокарда.
Астматический Вариант инфаркта миокарда встречается у больных с исходной недостаточностью кровообращения, с постинфарктным или выраженным атеросклеротическим кардиосклерозом, длительной артериальной гипертензией. Возникновение отека легких в дебюте инфаркта миокарда может быть связано с вовлечением в патологический процесс сосочковых мышц, а появление внезапной одышки без выраженного застоя в легких — с поражением правого желудочка. Астматический вариант инфаркта миокарда предполагают в случаях, когда веду щим симптомом заболевания является внезапный, часто немотивированный приступ одышки или отека легких.
Абдоминальный вариант инфаркта миокарда чаще наблюда ется при локализации некроза на нижней стенке левого желудоч-
Ка. Кроме смещения эпицентра болевых ощущений в надчрев ную область, реже — в область правого подреберья, при нем могут возникать тошнота, рвота, метеоризм, расстройство стула, явления пареза кишечника, повышение температуры тела. Нередко отмечаются цианоз, одышка, аритмии, в то время как живот, напротив, остается мягким, а симптомы раздражения брюшины отсутствуют. Диагностика инфаркта миокарда при этой форме дебюта заболевания даже при динамическом стационарном наблюдении вызывает серьезные затруднения. Отличить инфаркт миокарда от острых заболеваний органов брюшной полости (прежде всего панкреатита) или пищевой токсикоинфек-ции бывает чрезвычайно сложно.
Малосимптомная (безболевая) форма инфаркта миокарда проявляется такой неспецифической симптоматикой, как слабость, ухудшение сна или настроения, ощущение дискомфорта в грудной клетке. Обычно малосимптомная форма инфаркта миокарда наблюдается у пациентов пожилого и старческого возраста, особенно — страдающих сахарным диабетом, и вовсе не является свидетельством благоприятного течения заболевания.
В остром периоде инфаркта миокарда окончательно формируется очаг некроза, происходят резорбция некротических масс, асептическое воспаление в окружающих тканях и начинается формирование рубца.
Ангинозная боль с окончанием некротизации стихает, и если возникает вновь, то лишь в случаях рецидива инфаркта миокарда или ранней постинфарктной стенокардии. На 2-4-е сутки воз можно появление перикардиальной боли, связанной с развитием реактивного асептического воспаления перикарда — эпистено-кардического перикардита.
Вероятность острых нарушений сердечного ритма с каждым днем заболевания уменьшается.
Со 2-х суток инфаркта миокарда появляются признаки резорб-ционно-некротического синдрома (повышение температуры тела в вечерние часы, потливость, лейкоцитоз, увеличение СОЭ).
С 3-х суток в связи с некрозом миокарда и уменьшением стрессорной активации кровообращения ухудшается гемодинамика. Степень нарушения гемодинамики может быть различной — от умеренного снижения артериального давления (в основном систолического) до отека легких или кардиогенного шока. Ухудшение системной гемодинамики может приводить
К снижению кровоснабжения головного мозга, что проявляется разнообразной неврологической симптоматикой, а у больных старческого возраста — и нарушениями психики.
На высоте миомаляции в 1-ю неделю трансмурального инфаркта миокарда наиболее высока опасность разрывов сердечной мышцы.
У больных со стенозирующим поражением нескольких коронарных артерий, особенно при субэндокардиальном инфаркте миокарда, возможно развитие ранней постинфарктной стенокардии.
Диагностика»
Запомнить информацию? Сохраняйте — » Периоды инфаркта миокарда. И все в закладках.
Острый инфаркт миокарда
05 Апреля в 15:45 10658 0
Определение острого инфаркта миокарда
Острый ИМ определяют, пользуясь клиническими, электрокардио графическими, биохимическими и патоморфологическими характеристиками.
Признано, что термин «острый инфаркт миокарда» отображает смерть кардиомиоцитов, вызванную длительной ишемией. На ЭКГ можно выявить признаки ишемии миокарда — изменения ST и T, а также признаки некроза миокарда, в частности конфигурации комплекса QRS.
Рабочее определение острого прогрессирующего ИМ (с элевацией сегмента ST) сформулировано следующим образом: пациенты с наличием болевого синдрома (боль за грудиной, которая может иррадиировать в руки, под левую лопатку, в нижнюю челюсть, шею, спину, длится более 20 мин, не купируется нитроглицерином), повышением сегмента ST (в точке J) >0,2 мВ в двух или более смежных прекордиальных отведениях и >0,1 мВ в одном или более дистантных отведениях.
Также к признакам острого ИМ можно отнести блокаду левой ножки пучка Гиса на ЭКГ при данных, свидетельствующих, что она возникла впервые и в период накануне обследования. Другие варианты острого ИМ будут рассмотрены далее.
Дополнительную информацию для уточнения диагноза острого ИМ на фоне клинических симптомов острой ишемии миокарда (сроки развития, объем поврежденного миокарда) можно получить с помощью анализа биомаркеров, о которых более детально будет сказано далее.
Диагноз устанавливают с указанием даты возникновения (до 28 сут), локализации (передняя стенка, передневерхушечный, переднебоковой, переднеперегородочный, диафрагмальный, нижнебоковой, нижнезадний, нижнебазальный, верхушечнобоковой, базальнолатеральный, верхнебоковой, боковой, задний, заднебазальный, заднебоковой, заднеперегородочный, перегородочный, ПЖ).
Следует указать тип острого ИМ: первичный, рецидивирующий или повторный (в этом случае указывать размеры и локализацию необязательно).
При наличии различных осложнений острого ИМ их необходимо включать в формулировку диагноза с указанием даты развития (отдельно не шифруют). Также в диагнозе указывают такие лечебные вмешательства, как АКШ (с указанием количества шунтов), транслюминальная ангио-пластика и стентирование с указанием сосудов, баллонная контрапульсация, электроимпульсная терапия, временная (указать сроки) или постоянная электрокардиостимуляция (ЭКС), абляция.
Для каждой лечебной процедуры необходимо указывать дату (сроки) проведения.
Формулировать диагноз следует в такой последовательности: причина развития острого ИМ (например ИБС); внезапная коронарная смерть с оживлением; острый ИМ (с соответствующими уточнениями); осложнения ИМ (с соответствующими уточнениями); наличие различных форм кардиосклероза (при постинфарктном кардиосклерозе по возможности указывать дату, глубину и локализацию всех предшествовавших ИМ); СН (с указанием степени).
Классификация острого инфаркта миокарда
Согласно МКБ-10 среди разновидностей острого ИМ выделяют:
• острый ИМ с наличием патологического зубца Q (I21.0–I21.3);
• острый ИМ без патологического зубца Q (I21.4);
• острый ИМ (неуточненный — в случае затрудненной диагностики I21.9);
• рецидивирующий ИМ (I22);
• повторный ИМ (I22);
• острую коронарную недостаточность (промежуточный I24.8).
Осложнения острого инфаркта классифицируют следующим образом:
• ОСН (классы I–IV по Killip, I50.1);
• нарушения сердечного ритма и проводимости (желудочковая тахикардия, фибрилляция желудочков, ускоренный идиовентрикулярный ритм, фибрилляция и трепетание предсердий, суправентрикулярная аритмия, суправентрикулярная и желудочковая экстрасистолия, атрио-вентрикулярная блокада I–III степени, отказ синусового узла, асистолия I44–I49);
• наружный разрыв сердца (острый и подострый — с формированием псевдоаневризмы) с гемоперикардом (I23.0) и без гемоперикарда (I23.3);
• внутренний разрыв сердца (с формированием дефекта межпредсердной перегородки I23.1, дефекта межжелудочковой перегородки I23.2, разрыв сухожильной хорды I23.4, надрыв и отрыв папиллярной мышцы I23.5);
• тромбообразование в полостях сердца (I23.6);
• тромбоэмболия малого и большого круга кровообращения (I23.8);
• ранняя постинфарктная дилатация с формированием острой аневризмы сердца (I23.7);
• эпистенокардитический перикардит (Pericarditis epistenocardica);
• синдром Дресслера (I24.1);
• ранняя (от 72 ч до 28 сут) постинфарктная стенокардия (I20.0).
Эпидемиология
Несмотря на определенные успехи в лечении острого ИМ в большинстве индустриальных стран, эта патология остается в списке лидирующих причин заболеваемости и смертности. Согласно статистическим данным, частота острого ИМ среди мужского населения в возрасте старше 40 лет колеблется в разных регионах мира от 2 до6 на 1000. Заболеваемость острым ИМ в США составляет 1,5 млн человек/год, дестабилизация ИБС становится причиной ежегодной смерти приблизительно 500 000 человек.
Показатель смертности вследствие дестабилизации ИБС в Украине за 2005 г. составляет 707 на 100 000 населения. Среди женщин острый ИМ отмечают приблизительно в 2 раза реже. Согласно официальной статистике, городское население болеет чаще, чем сельские жители, но эти данные следует оценивать осторожно, с учетом возможных различий в выявляемости заболевания.
Информация о догоспитальной летальности неоднородна (в частности, в США данный показатель составляет приблизительно 50% всех случаев острого ИМ; по данным регистра MONICA — приблизительно 30%, причем отношение количества случаев догоспитальной смерти к случаям госпитальной снижается с возрастом, составляя от 15,6% у лиц моложе 50 лет до 2,0% у пациентов старше 70 лет). Наибольшее количество случаев догоспитальной смерти у больных с острым ИМ составляет внезапная смерть в первый час заболевания.
Более половины пациентов с установленным диагнозом ИБС умирают внезапно. Примерно в 30% случаев внезапная смерть является первым проявлением ИБС и чаще всего связана со злокачественными желудочковыми аритмиями (желудочковая тахикардия или фиб рилляция желудочков).
Практически все случаи первичной фибрилляции желудочков происходят в первые 4 ч острой ишемии миокарда. Стойкую желудочковую тахикардию с переходом в фибрилляцию желудочков отмечают несколько позже, она достигает максимальной частоты развития через 24 ч и более после развития острого ИМ.
Значительно реже первичным нарушением ритма является асистолия. Внутрибольничная летальность в наиболее квалифицированных лечебных учреждениях составляла в 1960 г. 20—25%, а к концу 80-х гг. снизилась до 10—15%.
Согласно итальянскому регистру BLITZ, в настоящее время этот показатель составляет 7,4% (7,5% для острого ИМ с элевацией сегмента ST, 5,2% для острого коронарного синдрома (ОКС) без элевации сегмента ST). Частота регистрации острого ИМ с элевацией сегмента ST на момент госпитализации составила 65% всех ОКС.
К факторам, определяющим успешность борьбы с данной патологией, можно с уверенностью отнести профилактическую стратегию, поддерживаемую государством, и улучшение стандартов лечения. К социально-профилактическим программам относят профилактику факторов риска ИБС и ее осложнений — рекомендации относительно отказа от курения и чрезмерного употребления алкоголя (более 40 г чистого алкоголя в сутки); борьбу с избыточной массой тела путем рационального питания и физической активности; контроль уровня АД и глюкозы крови; исключение хронических стрессов.
Разумеется, данные программы применимы в первую очередь к группам населения, у которых кроме указанных (модифицируемых) факторов риска существуют также немодифицируемые, такие как мужской пол, пожилой возраст, семейный анамнез ИБС.
Также большое значение имеет широкое оповещение населения (особенно групп риска острого ИМ) о специфических симптомах заболевания, что позволяет уменьшить временной промежуток от развития симптомов до обращения за квалифицированной медицинской помощью. Значительный вклад в осуществление выше указанных программ вносит кардиологическая диспансеризация, при помощи которой также производят отбор пациентов с показаниями к фармакологической и/или хирургической модификации течения ИБС.
Клиника и клинические дефиниции
Острый ИМ с зубцом Q
В отечественных классификациях данный термин ранее подразделяли на крупноочаговый и трансмуральный острый ИМ, что являлось одним из основных расхождений с международной классификацией.
В соответствии с глубиной расположения очага поражения в толще сердечной мышцы крупноочаговый ИМ может преимущественно занимать субэпикардиальный, субэндокардиальный или интрамуральный слои миокарда, что будет отображаться в специфической графике ЭКГ (если в очаг поражения вовлечен субэпикардиальный слой, на ЭКГ превалируют элевации сегмента ST, интрамуральное и субэндокардиальное поражение сопровождаются формированием выраженных депрессий ST с глубокими отрицательными зубцами Т).
Общей чертой этих подвариантов является формирование патологического зубца Q и в большинстве случаев — снижение амплитуды зубца R в отведениях, соответствующих локализации поражения, тогда как мелкоочаговые субэпикардиальный, субэндокардиальный или интрамуральный ИМ протекают без формирования зубца Q и выраженного снижения амплитуды зубца R.
Дополнительную информацию для уточнения глубины поражения могут дать уровень ферментемии и степень нарушений регионарной сократимости по данным двухмерной эхоКГ.
Электрокардиографически острый ИМ с зубцом Q может быть определен при наличии патологического зубца Q в отведениях V 1 – V 3 или при наличии зубца Q длительностью >0,03 с в отведениях I, II, аVL, aVF, V 4. V или V 6. Патологическим считается зубец Q, составляющий 0,25 и более амплитуды зубца R в том же отведении.
С осторожностью нужно относиться к трактовке подобных изменений в отведении III (особенно не подтвержденных в отведении aVF), поскольку они могут быть вызваны особенностями расположения сердца в грудной клетке (в этом случае обязательно нужно зарегистрировать отведение III на вдохе, дополнительные отведения). В ряде случаев можно наблюдать комплексы (q)rS, когда «рудиментарный» зубец R не принимают во внимание, а зубец S расценивают как патологический комплекс QS.
Особенно затруднена верификация патологических зубцов Q в случае гипертрофии миокарда и/или нарушений внутрижелудочковой проводимости. В таком случае более информативна электрокардиотопограмма.
Патогенетически острый ИМ с зубцом Q является этапом развития острого ИМ, когда объем пораженного (некротизированного) миокарда уже значителен, причем по амплитуде и длительности зубца Q можно косвенно судить о глубине поражения миокарда, а по количеству отведений с наличием патологического зубца Q — о его распространенности. Чаще всего острый ИМ с зубцом Q диагностируют при переходе острого ИМ из острейшей фазы в острую и затем в под острую.
При поздней установке диагноза в случаях, когда к моменту первой записи ЭКГ изменения сегмента ST отсутствуют, следует помнить, что сами по себе зубцы Q могут быть признаком перенесенного ранее инфаркта. В этом случае, при отсутствии архивных ЭКГ и других медицинских записей, данные анамнеза могут быть подтверждены выявлением участков истончения сердечной стенки на эхоКГ.
Острый ИМ без патологического зубца Q
Этот термин соответствует понятию «мелкоочаговый ИМ» и подразумевает ОКС, завершившийся формированием очага поражения (некроза) миокарда, но все же недостаточно большого (по глубине), чтобы привести к формированию патологических зубцов Q на ЭКГ.
Неточность данного соответствия заключается в том, что из-за отсуствия патологических зубцов Q можно говорить не о незначительном распространении инфаркта, а только о незначительной глубине поражения миокарда.
В качестве примера приводят случаи, когда стойкие изменения на ЭКГ в виде отрицательных зубцов Т отмечены во всех грудных отведениях, и при соответствующей клинике и высоком уровне ферментемии очаг поражения можно расценивать как распространенный интрамуральный, тогда как отсутствие патологических зубцов Q относит его к «острому ИМ без зубца Q».
Топически можно выделить изолированные субэпикардиальный (диагностируют редко ввиду специфической анатомии коронарного дерева), субэндокардиальный и интрамуральный подвариан ты мелкоочагового ИМ, которые различаются по ЭКГ-графике.
В частности, одним из типичных ЭКГ-проявлений интрамурального острого ИМ является наличие стойких отрицательных зубцов Т. Тем не менее этот признак не-достаточно специфичен и может выявляться при нестабильной стенокардии, гипертрофии миокарда, метаболических нарушениях и быть следствием ранее перенесенного структурного поражения миокарда (коронарной или некоронарной природы) и перикарда.
Субэндокардиальный вариант инфаркта может протекать как по типу «острый ИМ без зубца Q», так и по типу «острый ИМ с зубцом Q» (относительно редко).
Он характеризуется поражением преимущественно субэндокардиальных отделов миокарда, тогда как интрамуральные и субэпикардиальные отделы миокарда могут сохранять свою жизнеспособность. Чаще всего является следствием дистального поражения коронарных артерий, микроэмболизации коронарного русла.
ЭКГ-картина имеет ряд особенностей: величина вектора возбуждения миокарда не изменяется, так как он берет начало от проводящей системы желудочков, заложенной под эндокардом, и достигает неповрежденного эпикарда. На ЭКГ могут быть отмечены неглубокий патологический зубец Q (необязательно), небольшое снижение зубца R, депрессия сегмента ST, возможна инверсия или двухфазность зубца Т в отведениях I, V 1 –V 4 при передней локализации инфаркта, в отведениях III и aVF — при нижней (задней) и в отведениях aVL, V 5 –V 6 — при боковой локализации.
По мере развития ИМ происходит частичная или полная нивелировка депрессии сегмента ST с формированием устойчивых отрицательных зубцов Т.
Следует акцентировать внимание на глубину депрессии сегмента ST в отведениях, расположенных над областью инфаркта более 0,2 мВ, поскольку менее выраженные смещения сегмента ST, например 0,1 мВ, свойственны субэндокардиальной ишемии, а не инфаркту. Кроме того, к признакам ишемии следует отнести ее неустойчивость: изменения, как правило, возникают на фоне стресса или физической нагрузки, часто нивелируются спустя несколько минут после устранения провоцирующего фактора, приема нитроглицерина.
Депрессию же при субэндокардиальном инфаркте могут отмечать до 3 дней. Так или иначе, для уточнения диагноза необходимы динамическая регистрация ЭКГ по возможности с анализом архивных записей, сопоставление биохимических и других клинических и инструментальных критериев.
Рецидивирующий и повторный ИМ
Данные понятия относят соответственно к тем случаям, когда после первого перенесенного острого ИМ формируется второй и более.
Причем сроки развития рецидива острого ИМ — от 3 до 28 сут с момента развития исходного инфаркта, а по истечении этого срока нужно говорить о повторном ИМ. Если ЭКГ-диагностика размеров и локализации очага поражения затруднена, в диагнозе ее указывать не обязательно.
Острая коронарная недостаточность
Данное понятие приблизительно соответствует международному термину «острый коронарный синдром» и используется как промежуточный диагноз в ранние сроки заболевания. Постановка такого диагноза основана на выявлении элевации или депрессии сегмента ST в сочетании с длительной (более 20 мин) ангинозной болью.
Характерно, что за рубежом широко используют классификацию, согласно которой все случаи дестабилизации ИБС объединены в понятие «острый коронарный синдром» и в зависимости от наличия или отсутствия элевации сегмента ST в первые часы заболевания подразделены на ОКС с элевацией сегмента ST (к нему относят понятие «инфаркт миокарда с элевацией сегмента ST» — ST elevation miocardial infarction, STEMI, а также случаи, соответствующие часто встречающемуся в отечественной литературе термину «острое нарушение коронарного кровообращения», которые в дальнейшем не заканчиваются формированием некроза миокарда) и на ОКС без элевации сегмента ST (к которому можно отнести случаи нестабильной стенокардии, мелкоочагового острого ИМ с депрессией или без депрессии сегмента ST).
Особенность такой классификации состоит в том, что она построена на степени проявления миокардиальной ишемии, в то время как классификация, учитывающая наличие или отсутствие патологического зубца Q, предусматривает градацию по глубине повреждения сердечной мышцы и соответственно относится к более позднему периоду заболевания.
Целесообразность такой «ранней», рабочей классификации обусловлена тем, что современные подходы к лечению раннего периода острого ИМ дифференцированы в первую очередь по степени проявления ишемии и существенно влияют на течение подострого периода заболевания.
В частности, в эру реперфузионной терапии распространенная тотальная ишемия миокарда с элевацией ST на ЭКГ далеко не во всех случаях приводит к формированию ИМ с зубцом Q. С другой стороны, динамичность процессов, происходящих в рамках дестабилизации ИБС, предполагает возможность перехода заболевания из одного клинического варианта в другой.
С учетом вышеизложенного, при использовании термина «острая коронарная недостаточность» целесообразно уточнение характера и степени ишемических изменений на ЭКГ, сопровождающих заболевание (с указанием наличия или отсутствия элевации сегмента ST на ЭКГ), что может в дальнейшем способствовать выбору адекватной тактики лечения.
Этиология и патогенез острого ИМ
В настоящее время является общепризнанным предположение о патофизиологической роли коронаротромбоза в развитии острого ИМ, выдвинутое в 1909 г. Н.Д. Стражеско и В.П. Образцовым, а в 1912 г. J.B. Herrick. Причиной ОИМ, как и других форм ОКС, более чем в 90% случаев является внезапное уменьшение коронарного кровотока, вызванное атеросклерозом в сочетании с тромбозом, с наличием или без сопутствующей вазоконстрикции.
Редко отмечают острый ИМ как следствие септической (тромбо-)эмболии коронарной артерии или внутрикоронарный тромбоз как следствие воспалительного процесса в эндотелии сосуда при коронаритах различного генеза. Также описаны случаи острого ИМ, развившиеся на фоне изолированного коронароспазма интактных артерий (чаще интоксикационной природы).
Среди этиологических факторов, способствующих развитию острого ИМ, первое место занимает атеросклероз.
Другие факторы риска ИМ являются также факторами риска развития атеросклероза.
К «большим» факторам риска относят некоторые формы гипер- и дислипопротеинемии, АГ, курение табака, низкую физическую активность, нарушения углеводного обмена (особенно сахарный диабет II типа), ожирение, возраст пациента старше 50 лет (средний возраст госпитализированных больных с острым ИМ в Италии составляет 67 лет).
Действительно, нарушения липидного обмена диагностируют у больных с ИМ значительно чаще, чем у здоровых людей (особенно дислипопротеинемии IIб и III типов). В то время как АГ является доказанным фактором риска ИМ, симп томатические формы АГ не сопряжены с высоким риском ИМ. Это можно объяснить особенностями патогенеза АГ, которая, с одной стороны, способствует развитию атеросклероза, а с другой — предрасполагает к локальным спазмам артерий.
Результаты обширных исследований свидетельствуют о повышении частоты ИМ у курящих. Объясняют это тем, что вещества, образующиеся при сгорании табака (в первую очередь никотин), повреждают эндотелий сосудов и способствуют вазоспазму, а высокое содержание карбоксигемоглобина в крови курящих снижает способность крови к переносу кислорода.
Избыточная масса тела (ИМТ 30 и более) является фактором риска прогрессирования атеросклероза и ИМ, если протекает по типу абдоминального ожирения. У больных со сниженной физической активностью на фоне развития атеросклероза недостаточно эффективно происходит адаптивное развитие коллатералей в миокарде и толерантности кардиомиоцита к ишемии (феномен прекондиции).
Кроме того, вследствие гиподинамии происходит неадекватное повышение тонуса САС в случае нерегулярных значительных физических и психоэмоциональных нагрузок. Хроническое повышение уровня глюкозы и продуктов незавершенного углеводного обмена в крови при сахарном диабете приводит к повреждению эндотелия и развитию полиангиопатии.
При сочетании двух и более указанных факторов степень риска повышается пропорционально. Кроме перечисленных, существует еще множество так называемых «малых» факторов риска (подагра, псориаз, дефицит фолиевой кислоты и др.), удельный вес которых в общей структуре заболевания относительно невелик.
Клинические проявления и исходы зависят от локализации обструкции, степени и длительности ишемии миокарда. В частности, существуют отличия в степени проявления болевого синдрома и стрессовой активации РААС, обусловливающей наличие гипертензии, тахикардии, гипергликемии, лейкоцитоза с анэозинофилией в первые часы заболевания.
Характерно, что во время развития острого ИМ со стойкой элевацией сегмента ST формируется так называемый «красный» тромб, который содержит значительно большее количество эритроцитов.
Такое отличие от «тромбоцитарного», или «белого», тромба, связанного с развитием ОКС без стойкой элевации сегмента ST, свидетельствует о более глубоком и длительном нарушении реологических и коагуляционных свойств крови и о более значительных стойких тромбогенных изменениях в эндотелии поврежденного участка коронарной артерии.
Следовательно, при остром ИМ с элевацией сегмента ST развивается преимущественно окклюзивный и персистирующий тромбоз. Приблизительно в ⅔–¾ случаев формированию коронарного тромба предшествует внезапный разрыв уязвимой бляшки (воспаленной, богатой липидами бляшки, покрытой тонкой фиброзной оболочкой). Другие случаи связывают с механизмами, не определенными до конца, такими как эрозия бляшки.
В ¾ случаев бляшки, которые становились базисом для окклюзивного тромбообразования во время острого ИМ, вызывали лишь незначительный или умеренный стеноз, что предшествовало развитию инфаркта (понятно, что именно в этих случаях тромболитическая терапия является максимально эффективной). Впрочем, на фоне выраженного стеноза разрывы бляшек приводят к более частому развитию острого ИМ (по сравнению с незначительными стенозами).
ИМ, вызванный полной окклюзией коронарной артерии, развивается через 20–30 мин после начала выраженной ишемии (отсутствие кровотока по артерии или оллатералям) и прогрессирует со временем от суб эндокардиального к субэпикардиальному участку (феномен фронта волны).
Реперфузия и вовлечение коллатералей могут предотвращать возникновение некроза или способствуют уменьшению его размера (сохраняя в среднем до 70% ишемизированного миокарда периинфарктной зоны). Наличие же длительной стенокардии перед острым ИМ может способствовать формированию развитых коллатералей, что обусловливает сохранение или длительное поддержание жизнеспособности зоны ишемии (при коронарной ангиографии развитые коллатерали определяют в 30% случаев острого ИМ).
У таких больных отмечена тенденция к менее выраженному повреждению миокарда, более редкому развитию СН и меньшей летальности; в отдаленном периоде после острого ИМ насосная функция сердца у них сохраняется в большей степени. При длительности коронарной окклюзии более 6 ч лишь небольшая часть (10–15%) ишемизированного миокарда остается жизнеспособной.
Наличие субкритического, но стойкого кровотока может расширить временнóе окно для спасения миокарда путем полной реперфузии (рис. 1.1)
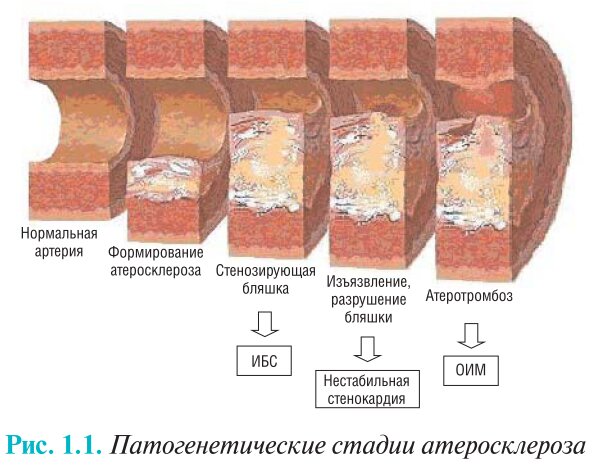
Рис. 1.1. Патогенетические стадии атеросклероза
Ответ на разрыв бляшки является динамическим: аутогенные тромбоз и тромболизис, часто ассоциируемые с вазоспазмом, развиваются одновременно, вызывая преходящую обструкцию кровотока.
В небольшом проценте случаев тромб, вызвавший развитие острого ИМ, может быть разрушен в первые часы с начала заболевания собственной фибринолитической системой организма при содействии эндогенных вазодилататоров, устраняющих коронароспазм.
В таком случае говорят о спонтанном (или аутогенном) лизисе тромба и реканализации инфарктобусловившей коронарной артерии. Клинически данный вариант течения острого ИМ характеризуется ранним (до проведения реперфузионной терапии) регрессом симптоматики и ЭКГ-признаков, уровень ферментемии и объем пораженного миокарда по данным исследований в подострой фазе заболевания оказывается меньше, чем в случае несостоятельности аутогенной фибринолитической системы.
Основными модуляторами активации главного фибринолитического профермента плазминогена и двухцепочечной урокиназы, также принимающей участие в каскаде фибринолиза, являются вырабатываемые эндотелием tPA и его антагонист —быстро реагирующий ингибитор активатора плазминогена PAI-1.
Их соотношение в плазме определяет фибринолитический потенциал крови. Нарушение баланса между этими двумя пептидами (повышение уровня PAI-1 при нормальном или сниженном уровне tPA) в плазме крови зафиксировано в острый инфаркта, 30-дневной смерти после перенесенного ИМ. Также известно, что ангиотензин II и его метаболит ангиотензин IV вызывают повышение выработки PAI-1 клетками эндотелия.
С другой стороны, РААС тесно связана с калликреинкининовой системой таким образом, что АПФ обеспечивает деградацию брадикинина (рис. 1.2).
Рис. 1.2. Механизм спонтанной реканализации инфарктобусловившей коронарной артерии период ИМ и связано с риском развития повторного
Еще одной причиной неэффективности аутогенной реперфузии является недостаточное действие вазорелаксирующих агентов, и как следствие этого — продолжающийся вазоспазм. Брадикинин является стимулятором выработки эндогенного эндотелиального фактора расслабления (NO).
Поскольку продукты деградации брадикинина этими свойствами не обладают, очевидно, что гиперфункция эндокринной, внутрисосудистой или РААС, кроме снижения фибринолитической активности, приводит также к нарушению сосудорасширяющего потенциала крови.
В свою очередь РААС приводит к инактивации NO путем превращения его супероксианиона в неактивный пероксинитрит. Супероксид-анион образуется при участии мембранной NдAD(P)H оксидазы и эндотелиальной NO-синтетазы.
При этом подавляются и другие краткосрочные системные эффекты NO — ингибирование АДФ- зависимой адгезии и агрегации тромбоцитов, ингибирование адгезии тромбоцитов к эндотелию путем блокады дегрануляции тромбоцитов. Вследствие этого возникает повышение проагрегационного потенциала крови, стимулирующее начальные этапы образования коронарного тромбоза и ретромбоза.
При коронарном тромбозе начальная обструкция кровотока, как правило, начинается с агрегации тромбоцитов при участии фибрина (рис. 1.3).
Рис. 1.3. Стенозирующая атеросклеротическая бляшка
Еще одним неблагоприятным последствием разрушения атеросклеротической бляшки и коронарного тромбоза является дистальная эмболизация тромботическими и атероматозными массами, которая ведет к микрососудистой обструкции и может препятствовать успешной реперфузии миокарда на тканевом уровне, неcмотря на восстановление адекватной проходимости инфарктобусловившей артерии (рис. 1.4).
Рис. 1.4. Развитие острого коронарного синдрома
Развитие окклюзии коронарного сосуда ведет к гибели кардиомиоцитов.
От уровня и длительности окклюзии сосуда зависит величина очага некроза миокарда. Нарушение коронарного кровотока и развитие некроза миокарда запускают каскад нейрогуморальных реакций, воспалительного и пролиферативного процесса.
Все эти структурно-функциональные и метаболические перестройки миокарда ведут к ремоделированию полости ЛЖ: дилатации полости ЛЖ, изменению его геометрии и развитию гипертрофии, что может вести к появлению СН и определяет отдаленный прогноз у пациентов, перенесших острый ИМ (рис. 1.5).
Рис. 1.5. Патогенез постинфарктного ремоделирования полости ЛЖ (адаптировано по St. John Sutton, 2000). ПНУП — предсердный натрийуретический пептид; МНУП — мозговой натрийуретический пептид; ММР — матриксные металлопротеазы
В течении острого ИМ можно выделить несколько патогенетических периодов.
Продромальный период, или так называемое прединфарктное состояние, отмечают по разным данным в 30–60% случаев. Средняя длительность этого периода 7 дней, часто его начало сопряжено с физической или психоэмоциональной нагрузкой, причем наиболее неблагоприятными являются «малые», но регулярные стрессы, постоянное стрессовое состояние.
Клинически его характеризуют возникновение или значительное учащение и усиление тяжести приступов стенокардии (так называемая нестабильная стенокардия), а также изменения общего состояния (слабость, утомляемость, снижение настроения, тревога, нарушение сна). Действие антиангинальных средств становится, как правило, менее эффективным.
Отмечают, что нестабильная стенокардия даже в случае необращения за медицинской помощью может разрешиться самостоятельно без развития острого ИМ, чему способствуют описанные выше механизмы.
Однако оценить тяжесть и объем возможного поражения миокарда по клинической картине пред инфарктного состояния крайне трудно, поэтому ко всем больным, поступившим в стационар с клиникой нестабильной стенокардии, должна применяться та же лечебно-диагностическая тактика, что и к больным с острым ИМ, исключая проведение тромболизиса (см. ниже).
При отсутствии признаков стабилизации состояния больного, которому проводят интенсивную терапию, показана коронарография с решением вопроса о целесообразности и объеме инвазивных вмешательств.
Острейший период (время от возникновения ишемии миокарда до первых проявлений его некроза) продолжается обычно от 30 мин до 2 ч. Начало этого периода, как правило, соответствует моменту максимальной ангинозной боли, к которой может присоединяться характерная иррадиация (в руку, плечо, надплечье, ключицу, шею, нижнюю челюсть, межлопаточное пространство).
В ряде случаев боль носит затяжной или волнообразный характер, что при сохранении «острофазовой» графики ЭКГ без формирования отрицательных зубцов Т может свидетельствовать об интермиттирующей коронарной обструкции (флотирующий тромб, активация спонтанного фибринолиза) или присоединенииновых участков поражения сердечной мышцы.
Безболевую форму острого ИМ диагностируют редко, чаще всего такой диагноз устанавливают post factum.
Другие клинические проявления связаны с гиперактивацией вегетативной (как симпатической, так и парасимпатической) нервной системы и в ряде случаев выраженным рефлекторным снижением насосной функции сердца (резкая слабость, ощущение нехватки воздуха, страх смерти, профузный пот, одышка в покое, тошнота и рвота). СН в этот период заболевания развивается прежде всего как левожелудочковая, наиболее ранние ее проявления — одышка и снижение пульсового давления, в тяжелых случаях — сердечная астма или отек легких, который нередко сочетается с развитием кардиогенного шока. Различные нарушения сердечного ритма и проводимости отмечают практически у всех больных.
Острый период наступает по окончании острейшего периода и продолжается около 2 сут — до окончательного отграничения очага некроза. При рецидивирующем течении острого ИМ продолжительность острого периода может увеличиваться до 10 и более дней; часто осложняется выраженным резорбционным синдромом.
В течение этого периода происходит вымывание в периферическую кровь кардиоспецифичных ферментов; по динамике их вымывания можно также судить о размерах поражения.
Подострый период, соответствующий интервалу времени от полного отграничения очага некроза до замещения его первичной соединительной тканью, продолжается примерно 28 дней. В это время у некоторых больных проявляются клинические симптомы, связанные с уменьшением массы функционирующего миокарда (СН) и его электрической нестабильностью (аритмии сердца).
Проявления резорбционного синдрома постепенно уменьшаются, осложнения острого периода в эти сроки обычно разрешаются; если же выявляют усугубление СН, аритмии сердца, постинфарктной стенокардии, это требует медикаментозной и в ряде случаев инвазивной коррекции. Обычно в этот период больные проходят реабилитационное лечение в стационаре.
Особенности ведения больного с инфарктом в реабилитационном отделении определяются размером некроза миокарда, демографическими характеристиками пациента и наличием или отсутствием сопутствующих заболеваний. После исчезновения симптомов и при минимальном повреждении миокарда пациент может быть переведен в реабилитационное отделение уже через несколько дней. В случаях выраженной дисфункции ЛЖ или при высокой степени риска новых событий требуется более длительная госпитализация.
Постинфарктный период завершает течение острого ИМ, поскольку на исходе этого периода предполагается окончательное формирование плотного рубца в зоне инфаркта.
Считают, что при типичном течении крупноочагового ИМ послеинфарктный период длится примерно 6 мес. В это время постепенно развивается компенсаторная гипертрофия сохранившегося миокарда, благодаря которой СН, возникшая в более ранний период ИМ, у некоторых больных может быть ликвидирована.
Однако при больших размерах поражения миокарда полная компенсация не всегда возможна и признаки СН сохраняются или нарастают. Процессы рубцевания также могут сопровождаться формированием стойкого аритмогенного субстрата и хронической аневризмы сердца, дилатацией полостей сердца с развитием вторичной клапанной недостаточности, что, как и стойкая постинфарктная стенокардия, может потребовать хирургической коррекции.
Факторы риска неблагоприятного течения острого ИМ
Ранее к неблагоприятным факторам, усугубляющим течение острого ИМ, помимо размеров и локализации инфаркта, традиционно относили пожилой возраст, женский пол, наличие сопутствующего сахарного диабета, АГ, другие социальные, наследственные факторы и сопутствующие заболевания.
Теперь же с появлением новых медицинских технологий структура факторов риска изменилась: значительный вклад как в ранний, так и отдаленный прогноз у больных, перенесших острый ИМ, вносят терапия острой фазы заболевания, сроки обращения за медицинской помощью.
Наибольший положительный эффект на результаты лечения острого ИМ в последние годы оказало совершенствование алгоритмов лечения, направленных на восстановление проходимости инфаркт обусловившей коронарной артерии (ИОКА). В обширных рандомизированных исследованиях у больных с острым ИМ с применением тромболитической терапии 30-дневная летальность отмечена в пределах 6–10%, тогда как в исследованиях с применением ЧТКА выявлена летальность 2,5% за тот же период.
Однако следует отметить, что в хирургические исследования включали в основном тщательно отобранный контингент больных (в частности, исключали пациентов пожилого возраста или имеющих выраженный системный атеросклероз, который, с одной стороны, создает трудности при проведении пункций крупных артерий, а с другой — является достаточно надежной «гарантией» многососудистого поражения коронарного русла и соответственно фактором, усугубляющим прогноз).
Кроме того, анализ реальной ситуации в кардиологической практике свидетельствует, что много пациентов не получают оптимальной (в соответствии с современными алгоритмами) терапии, включающей тромболизис.
В частности, серийные наблюдения в Северной Америке и Европе позволяют предполагать, что частота тромболитической терапии при остром ИМ в этих регионах в среднем составляет до 40%.
В Италии частота тромболитической терапии составляет 50% общего числа случаев госпитализации больных с ОКС. Кроме того, некоторые из пациентов проходят лечение не в кардиореанимационных отделениях, а в возрастной структуре больных лица пожилого возраста имеют больший удельный вес, чем в когортах многоцентровых исследований. Таким образом, можно ожидать, что госпитальная летальность среди реальных больных с острым ИМ будет выше, чем по результатам исследований с применением тромболизиса и ангиопластики.
По результатам наблюдения случаев лечения острого ИМ в реальной клинической практике сформирован список предикторов ранней (30-дневной) смертности у больных с острым ИМ (табл.1.1).
Таблица 1.1
*n — количество пациентов, умерших в стационаре, с наличием или без наличия признака; % — процент пациентов, умерших в стационаре, среди пациентов с наличием и без наличия признака; — отношение шансов; ОКП — отделение коронарной патологии; ЛЖН — левожелудочковая недостаточность; НД — недостоверно.
По данным таблицы к независимым предикторам ранней смерти после перенесенного острого ИМ можно отнести лечение острой фазы ИМ вне отделения коронарной патологии (кардиореанимации), наличие острой левожелудочковой недостаточности (ОЛЖН) и кардио-генного шока, развитие желудочковых аритмий и рецидива острого ИМ в течение госпитального периода.
Также в данном анализе независимым предиктором раннего летального исхода после острого ИМ являлся пожилой возраст.
При анализе факторов риска неблагоприятного исхода в отдаленный постинфарктный период (5-летнее наблюдение) были выделены такие предикторы, как постинфарктный кардиосклероз (после анализируемого ИМ), отсутствие реперфузионной терапии в острой фазе заболевания, наличие в семейном анамнезе ИБС, сердечная блокада, отсутствие ацетилсалициловой кислоты в терапии постинфарктного периода и пожилой возраст.
Тем не менее к независимым предикторам неблагоприятного исхода отнесены пожилой возраст и наличие левожелудочковой недостаточности в стационаре (табл. 1.2).
Таблица 1.2
*n — количество пациентов, умерших в течение отдаленного наблюдения, с наличием или без наличия признака; % — процент пациентов, умерших в течение отдаленного наблюдения, среди пациентов с наличием и без наличия признака; — отношение шансов; ОЛЖН — острая левожелудочковая недостаточность.
На основании полученных данных построены как общая кривая выживаемости после перенесенного острого ИМ (рис. 1.6), так и кривые выживаемости при наличии и отсутствии левожелудочковой недостаточности в острый период ИМ (рис. 1.7).
Рис. 1.6. Выживаемость после перенесенного острого ИМ (McGovern P.G. 1996)
Рис. 1.7. Выживаемость после перенесенного ИМ в зависимости от наличия ОЛЖН (McGovern P.G. 1996)
Как видно из рисунков, наибольшее количество больных, перенесших острый ИМ, умирает в раннем (до 2 мес) постинфарктном периоде, наличие признаков ОЛЖН в стационаре оказывает на это существенное влияние.
Другой обширный регистр CENIC (Mattoset al. 2004), включающий данные о 9371 пациенте с острым ИМ и элевацией сегмента ST, прошедших реперфузионную терапию в виде первичной ангиопластики или тромболизиса с последующей «ЧТКА спасения» в течение 24 ч от начала острого ИМ, как основной фактор риска госпитальной летальности также выделил наличие ОЛЖН в стационаре; кроме этого, такими факторами были многососудистое поражение коронарного дерева и неэффективность тромболизиса и/или ЧТКА по данным коронаровентрикулографии.
Анализ данных о более чем 10 тыс. больных с острым ИМ в исследовании GISSI-3 также показал отрицательное прогностическое влияние дилатации полости ЛЖ >60 мл/м 2 на летальность и развитие СН после острого ИМ. Анализируя факторы, способствующие развитию дилатации полости ЛЖ, большинство авторов доказали значение величины зоны некроза и передней локализации поражения. Имеются различные данные о взаимосвязи анамнестических характеристик, течении первых суток инфаркта и влиянии лечения.
Еще одним фактором, определяющим отдаленный прогноз у пациентов, перенесших ИМ и развитие застойной СН, является постинфарктное ремоделирование полости ЛЖ.
К ремоделированию полости ЛЖ сердца приводят структурно-функциональные повреждения миокарда. Это общеизвестный факт, доказанный во многих исследованиях как на экспериментальной модели, так и в клинической практике
Профилактика ИМ
Первичная профилактика
Первичная профилактика острого ИМ совпадает с мерами первичной профилактики других форм ИБС, а у больных с установленным атеросклерозом венечных артерий сердца включает также устранение или уменьшение влияния факторов риска развития острого ИМ, что актуально и при вторичной профилактике (предупреждение повторного ИМ).
К главным факторам риска относят АГ, гипер- и дислипопротеинемию, нарушения углеводного обмена (особенно сахарный диабет), курение, недостаточную физическую активность, ожирение. Больным с ИБС необходимо постоянное активное лечение, предупреждающее приступы стенокардии и способствующее развитию коллатералей в системе венечных артерий.
Больные с АГ подлежат диспансерному наблюдению.
Им проводят патогенетическую и антигипертензивную терапию, обеспечивающую оптимальный для каждого пациента уровень АД и направленную на предупреждение гипертонических кризов. При наличии гиперхолестеринемии большое значение имеет диета, применяемая для лечения и профилактики атеросклероза.
Целесообразно использовать статины, фибраты, омега-3-полиненасыщенные жирные кислоты, растворимую пищевую клетчатку. Длительное применение витаминов, в частности А, С, Е и никотиновой кислоты, не влияло на риск развития острого ИМ и других сердечных событий. Диета с пониженным содержанием углеводов, а при необходимости и медикаментозная терапия показаны больным с пониженной толерантностью к глюкозе и явным сахарным диабетом, а также больным с ожирением.
Кардиологическая диспансеризация должна обязательно включать популяризацию среди населения здорового образа жизни с исключением курения, занятиями физической культурой и спортом. Достаточная физическая активность препятствует возникновению и развитию ИБС, способствует развитию коллатералей в системе венечных артерий сердца, снижает склонность к тромбообразованию и развитию ожирения. Особое значение занятия физкультурой имеют для пациентов, двигательная активность которых недостаточна по условиям трудовой деятельности или иным причинам.
Одна из важных составляющих профилактики острого ИМ — квалифицированное лечение больных с установленным диагнозом стенокардии и коронарного атеросклероза. Профилактические меры, применяемые у пациентов этой категории, существенно не отличаются от вторичной профилактики у больных, перенесших ИМ.
Вторичная профилактика
Курение
Опыт длительных наблюдений свидетельствует о том, что прекращение курения позволяет снизить смертность в течение следующих нескольких лет более чем вдвое. Потенциально это наиболее эффективное мероприятие из вторичной профилактики; следует приложить значительные усилия для отказа от курения.
В острой фазе заболевания большинство пациентов не курят, в течение периода восстановления им нужно помочь преодолеть вредную привычку. Возобновление курения нередко отмечают по возвращении больного домой, поэтому во время периода реабилитации он нуждается в поддержке и советах.
Диета и пищевые добавки
Лионское исследование влияния диеты на сердце доказало, что средиземноморская диета понижает частоту рецидивов у пациентов, которые перенесли первый ИМ, по крайней мере в течение 4 лет. Всем пациентам следует советовать средиземноморскую диету, которая характеризуется малым количеством насыщенных жиров, богата полиненасыщенными жирами, фруктами и овощами. Считают, что употребление в пищу жирной рыбы по крайней мере дважды в неделю уменьшает риск реинфаркта и смерти.
Добавление к диете омега-3-полиненасыщенных жирных кислот из рыбьего жира (1 г в сутки), но не витамина Е ассоциировалось с достоверным снижением смертности от всех причин и вероятности внезапной смерти.
Нет доказательств целесообразности применения после перенесенного инфаркта пищевых добавок, которые содержат антиоксиданты, однако добавление в рацион добавок, содержащих пищевую клетчатку (более 4,0 г растворимой клетчатки на 1,735 ккал рациона), снижало сердечно-сосудистую смертность. Назначение фолиевой кислоты целесообразно в случае повышения содержания в крови гомоцистеина.
Антитромбоцитарная и антикоагулянтная терапия
По результатам метаанализа Antiplatelet Trialists Collaboration выявлено снижение приблизительно на 25% вероятности реинфаркта и смерти после перенесенного ИМ. В проанализированных исследованиях доза ацетилсалициловой кислоты колебалась в пределах 75–325 мг/сут. Есть свидетельства того, что более низкие дозы обеспечивают достижение эффекта с меньшим количеством побочных проявлений.
Исследования, выполненные в период до широкого применения ацетилсалициловой кислоты, доказали эффективность пероральных антикоагулянтов в предотвращении реинфаркта и смерти после перенесенного ИМ. В этих исследованиях пациентов рандомизировали не позднее чем через 2 нед после инфаркта.
Эффективность рутинного применения пероральных антикоагулянтов в противовес ацетилсалициловой кислоте у больных в постинфарктный период оценивали в исследовании АFTER. При лечении этих пациентов не было получено четких преимуществ по сравнению с применением ацетилсалициловой кислоты.
Возможно, пероральное применение антикоагулянтов оказалось бы полезным для отдельных категорий пациентов, в частности для больных с большой зоной акинезии передней локализации, фибрилляцией предсердий или наличием эхокардиогафически доказанного тромба в ЛЖ, но больших рандомизированных исследований в этом направлении не проводили.
Ацетилсалициловая кислота в сочетании с фиксированной низкой дозой пероральных антикоагулянтов не является более эффективной для предотвращения новых ишемических событий, чем ацетилсалициловая кислота в качестве монотерапии. Умеренно и высокоинтенсивная пероральная терапия антикоагулянтными средствами (МНО>2,0) в сочетании с ацетилсалициловой кислотой обеспечила уменьшение количества реокклюзий после успешного лизиса по сравнению с монотерапией ацетилсалициловой кислотой.
В двух исследованиях (ASPECT-2, 2002 и WARIS-2, 2002) такое сочетание препаратов позволило также уменьшить общее количество случаев смерти, реинфаркта и инсульта у пациентов в постинфарктный период, но отмечено достоверное увеличение количества нефатальных осложнений, обусловленных кровотечениями.
Результаты исследования CLARITY TIMI 28 показали эффективность комбинированного применения клопидогрела и ацетилсалициловой кислоты у больных с острым ИМ после реперфузионной терапии. И хотя особо отмечают, что преимущество в группе клопидогрела было получено лишь по показателю возобновления кровотока в ИОКА, результаты исследования COMMIT с использованием клопидогрела как дополнительной к ацетилсалициловой кислоте терапии при остром ИМ у 46 000 пациентов продемонстрировали достоверное снижение общей смертности на 7%.
Кроме того, уже доказана эффективность клопидогрела для вторичной профилактики после перенесенного ОКС без стойкой элевации сегмента ST (CURE, 2001). Возможность назначения пероральных антикоагулянтов нужно рассматривать у пациентов, которые не переносят ацетилсалициловую кислоту. Так, у таких больных клопидогрел является хорошим альтернативным средством антитромбоцитарной терапии.
Блокаторы β-адренорецепторов
В нескольких исследованиях и метаанализах показано, что средства, блокирующие β-адренорецепторы, уменьшают летальность и вероятность реинфаркта после перенесенного острого ИМ на 20–25%. Положительные результаты получены в исследованиях с пропранололом, метопрололом, тимололом, ацебутололом и карведилолом.
Впрочем, в меньших по объему исследованиях с применением других блокаторов β-адренорецепторов получен похожий результат. Метаанализ 82 рандомизированных исследований свидетельствует в пользу длительного при менения блокаторов β-адренорецепторов с целью уменьшения заболеваемости и летальности после острого ИМ, даже если были применены фибринолитические средства и одновременно назначены ингибиторы АПФ. Выраженное снижение летальности у больных СН на фоне применения блокаторов β-адренорецепторов дает основания для применения этих препаратов у больных в постинфарктный период.
Анализ данных проведенных исследований свидетельствует о том, что блокаторы β-адренорецепторов без внутренней симпатомиметической активности должны быть назначены всем пациентам после перенесенного ИМ при отсутствии противопоказаний.
Антагонисты кальция
Доказательства возможного благоприятного влияния антагонистов кальция значительно более слабые, чем блокаторов β-адренорецепторов. Результаты ранних исследований с применением верапамила и дилтиазема позволили допустить, что эти препараты могут предотвращать реинфаркт и смерть.
В исследовании INTERCEPT с участием 874 пациентов с острым ИМ без застойной СН, у которых проводили терапию фибринолитическими средствами, 6-месячное применение дилтиазема в дозе 300 мг/сут уменьшило количество коронарных вмешательств.
Использование верапамила и дилтиазема может быть целесообразным при противопоказаниях к назначению блокаторов β-адренорецепторов, особенно при обструктивных заболеваниях дыхательных путей. Следует быть осторожным при назначении этих препаратов пациентам с нарушенной функцией желудочков. Дигидропиридиновые антагонисты кальция в качестве монотерапии приводят к увеличению летальности больных с острым ИМ [7], поэтому такое лечение должны назначать только при наличии четких клинических показаний.
И хотя результаты субанализа исследования ASCOT [3] дают основания полагать, что комбинированная терапия аторвастатином, амлодипином и периндоприлом у больных с риском развития ИБС снижает общую смертность на 11% (p
Ингибиторы АПФ
По результатам нескольких исследований установлено, что ингибиторы АПФ уменьшают летальность после перенесенного острого ИМ со сниженной остаточной функцией ЛЖ. В исследования SAVE (1992) включали пациентов в среднем через 11 дней после острого события. У всех их ФВ была менее 40% при радиоизотопной вентрикулографии и не было признаков манифестной ишемии при нагрузочном тесте.
В течение первого года не отмечено благоприятного влияния на смертность, но в следующие 3–5 лет смертность уменьшилась на 19% (с 24,6 до 20,4%). В то же время даже в течение первого года замечали уменьшение реинфарктов и случаев возникновения СН.
В исследовании AIRE (1993) пациентов, у которых появились клинические или рентгенологические признаки СН, рандомизировали для терапии рамиприлом в среднем через 5 дней после начала ИМ. Через 15 мес смертность уменьшилась с 22,6 до 16,9% (относительное уменьшение на 27%).
В исследовании TRACE (1995) лечение трандолаприлом или плацебо начиналось в среднем через 4 дня после инфаркта, осложненного дисфункцией ЛЖ. Индекс подвижности стенки у всех пациентов составлял 1,2 и меньше. В среднем через 108 нед наблюдения смертность составляла 34,7% в группе активного лечения и 42,3% в группе плацебо.
Авторы этого исследования в дальнейшем наблюдали пациентов в течение минимум 6 лет и доказали увеличение ожидаемой продолжительности жизни на 15,3 мес (27%). С учетом результатов трех исследований целесообразно назначать ингибиторы АПФ пациентам, у которых после острого события возникала СН с ФВ менее 40% или индексом подвижности стенки 1,2 и меньше, при условии отсутствия противопоказаний.
Следует отметить, что доказательства эффективности терапии ингибиторами АПФ получены преимущественно у больных с передней локализацией ИМ.
Данные длительного исследования эффективности ингибиторов АПФ у пациентов в постинфарктный период, а также данные исследования HOPE [20] свидетельствуют о пользе назначения этих препаратов по крайней мере в течение 4–5 лет, даже при отсутствии дисфункции ЛЖ. Достигнутый эффект может быть даже большим у пациентов с сахарным диабетом, которые перенесли ИМ. Длительное назначение ингибитора АПФ после перенесенного ИМ, подобно ацетилсалициловой кислоте и блокаторам β-адренорецепторов оправдано, если пациенты хорошо переносят эти препараты.
Результаты исследования EUROPA подтвердили эффективность применения периндоприла у больных после перенесенного ИМ [14]. Назначение периндоприла пациентам с низкой степенью риска независимо от наличия СН, АГ, сахарного диабета приводило к снижению вероятности повторных ИМ на 24%, развития СН — на 39%. В другом большом исследовании с рамиприлом отмечена его способность уменьшать частоту кардиоваскулярных событий в качестве профилактической терапии у больных с высоким риском сердечнососудистых осложнений (HOPE).
Липидоснижающая терапия
Скандинавское исследование влияния симвастатина на выживание (4S, 1994) доказало пользу снижения уровня липидов в популяции 4444 пациентов со стенокардией и/или после ИМ с уровнями ХC в сыворотке крови 212–308 мг/дл (5,5–8,0 ммоль/л) после применения диетических мероприятий. Пациентов не включали в исследование до 6 мес после острого инфаркта, была отобрана группа больных с относительно низкой степенью риска.
В среднем через 5,4 года общая смертность в группе лечения симвастатином снизилась на 30% (12% в группе плацебо и 8% в группе симвастатина), что при пересчете результатов означает 33 спасенные жизни на 1000 леченых пациентов в течение этого периода. Были отмечены существенное снижение смертности вследствие коронарных причин, а также потребности в выполнении шунтирующих хирургических вмешательств. Польза применения симвастатина у пациентов в возрасте старше 60 лет была такой же, как и у больных младшей возрастной группы.
В исследовании CARE (1996) 4159 пациентов после ИМ со «средними» уровнями ХС (в среднем 209 мг/дл) получали правастатин 40 мг или плацебо в течение 3–20 мес после острого события. Правастатин обеспечил относительное снижение риска фатальных коронарных событий или реинфаркта на 24%. Подобные благоприятные эффекты отмечены в подгруппе пациентов, которым выполнили реваскуляризацию миокарда.
Исследование LIPID (1998) объединило около 9 тыс. пациентов с перенесенным ранее ИМ или нестабильной стенокардией и уровнем ХС в широком диапазоне: 42% — ≤213 мг/дл (5,5 ммоль/л), 44% — в пределах 213–250 мг/дл (5,5–6,4 ммоль/л) и 13% — 251 мг/дл (6,5 ммоль/л). Больные были рандомизированы, чтобы получать терапию 40 мг правастатина или плацебо в течение 6 лет. Лечение правастатином позволило снизить вероятность коронарной смерти на 24%, риск (ре-) ИМ — на 29% [8].
Результаты исследования ASCOT подтвердили эффективность терапии аторвастатином у пациентов с нарушением обмена липидов относительно развития коронарных событий (в том числе фатальных).
Вторым препаратом из группы липидоснижающих средств является никотиновая кислота. До недавнего времени применение ее с этой целью было ограничено в связи с коротким периодом действия, необходимостью инъекционного введения и выраженными побочными эффектами (гиперемия). Однако в последние годы появились сообщения, что новая пероральная пролонгированная форма никотиновой кислоты была успешно использована в лечении дислипидемии у пациентов с сахарным диабетом.
Более того, сравнение эффективности пролонгированной формы никотиновой кислоты и гемфиброзила доказало преимущество первого средства в лечении дислипидемии. Тем не менее для оценки возможности включения данного препарата в терапию постинфарктных больных необходимо проведение специальных исследований. В целом, влияние липидоснижающей терапии на госпитальную летальность у больных с ОКС оценено в исследовании PURSUIT (рис. 1.8).
Рис. 1.8. Влияние липидоснижающей терапии на летальность после ОКС
В целом, липидоснижающие средства следует назначать пациентам, которые соответствуют критериям включения в упомянутые выше исследования. Статины назначают, если несмотря на соблюдение диеты на диетические мероприятия, содержание уровня общего ХС >190 мг/ дл (4,9 ммоль/л) и/или ХС ЛПНП >115 мг/ дл (2,97 ммоль/л).
Результаты исследования HPS (2001) позволяют допустить, что рекомендации относительно применения статинов должны распространяться и на пациентов с более низким уровнем липидов, включая больных пожилого возраста (рис. 1.9).
Рис. 1.9. Влияние применения симвастатина на летальность у больных с гиперхолестеринемией и факторами риска кардиальной смерти (адаптировано по HPS Group, 2000)
У пациентов с низким уровнем ХС ЛПВП следует оценить необходимость назначения статинов. Сохраняются противоречия относительно сроков начала терапии. Данные недавно опубликованного исследования свидетельствуют, что преимущество может быть у раннего и агрессивного лечения липидоснижающими средствами, независимо от уровня ХС (рис. 1.10).
Рис 1.10. Сравнение влияния агрессивной (80 мг аторвастатина) и традиционной (40 мг правастатина) липидоснижающей терапии на летальность у больных с ОКС (адаптировано по PROVE-IT TIMI 22 Investigators Group, 2004)
Итак, подводя итог, представляем перечень профилактических мер, применяемых у пациентов после перенесенного острого ИМ с элевацией сегмента ST (табл. 1.4).
М.И. Лутай, А.Н. Пархоменко, В.А. Шумаков, И.К. Следзевская,
Ишемическая болезнь сердца
«Июль – макушка лета», – говорят в народе. Все наполнилось силой и расцвело – и у природы, и у человека наступает самая благоприятная пора. Солнце дарит свет и тепло, растения набирают силы и идут в рост, дарят нам энергию и несут пользу. Очень рекомендую купаться в открытых водоемах, ходить босиком по траве (это закаливает организм, повышает иммунитет), зарываться в прогретый солнцем песок (особенно это полезно при больных суставах).
Не забывайте регулярно проводить разгрузочные дни – они дают отдых организму и очищают его от вредных веществ.
Июль – месяц очищения почек, главных фильтров человеческого тела. Почки выводят из организма продукты азотистого обмена – мочевину, креатинин, мочевую кислоту и др. избыток солей и воды, чужеродные вещества. Загрязнению почек, накоплению в нем шлаков, песка, камней способствуют нарушения питания (особенно потребление мяса), нарушения обмена веществ, недостаток витамина А, переохлаждение, а также инфекционное заражение. Очищение почек – процедура, направленная прежде всего на предупреждение образования камней в почках. При наличии в почках песка и камней небольшого размера очищение нужно проводить с большой осторожностью.
Существует большое количество очисток: с помощью пихтового масла, растительных отваров, арбуза, корней шиповника, сока смородины и т. д.
Очистка селезенки
Селезенка – самый крупный лимфоидный орган. Находится в левой верхней части брюшной полости, позади желудка, имеет овальную уплощенную форму, внешне напоминает железу. Селезенка соприкасается с диафрагмой, поджелудочной железой, толстой кишкой и левой почкой. Селезенка не относится к жизненно важным органам, и ее врожденное отсутствие или хирургическое удаление не оказывает глубокого влияния на жизнеспособность и рост организма. Селезенка непосредственно связана с системой воротной вены, несущей обогащенную питательными веществами кровь от желудочно-кишечного тракта к печени, и большим кругом кровообращения. Селезенка состоит из нескольких типов ткани.
У взрослого человека селезенка выполняет несколько функций: разрушает отжившие кровяные клетки и тромбоциты, а также превращает гемоглобин в билирубин и гемосидерин. Поскольку гемоглобин содержит железо, в селезенке его тоже довольно много. Как лимфоидный орган, селезенка является главным источником циркулирующих лимфоцитов. Кроме того, она действует как фильтр для бактерий, простейших и инородных частиц, а также вырабатывает антитела. Люди, лишенные селезенки, особенно маленькие дети, очень чувствительны ко многим бактериальным инфекциям. Наконец, как орган, участвующий в кровообращении, она служит резервуаром эритроцитов, которые в критической ситуации вновь выходят в кровь.
При зашлаковке селезенки ее деятельность нарушается. Для ее очищения можно воспользоваться следующими рецептами.
* Заварить 1 ст. ложку корня цикория 1 стаканом кипятка, подержать на медленном огне 10 минут, настаивать 30 минут и процедить. Пить по 2—3 глотка 3 раза в день
* Заварить 1 ст. ложку измельченных шишек хмеля 1 стаканом кипятка, настаивать, укутав, 40 минут и процедить. Пить по 2 ст. ложки 3 раза в день перед едой.
* При увеличении селезенки: смешать в равных количествах траву и цветы тысячелистника и цветы календулы. Заварить 2 ст. ложки смеси 0,5 л кипятка, настаивать, укутав, 1 час и процедить. Пить по 1/3 стакана 2 раза в день.
* Заварить 1 ч. ложку полыни горькой 2 стаканами кипятка, настаивать, укутав, 30 минут и процедить. Пить как чай с медом или сахаром по 1/4 стакана 3 раза в день за 30 минут до еды.
* Заварить 1 ст. ложку травы репешка 1 стаканом кипятка, настаивать, укутав, 1 час и процедить. Пить по 1/3 стакана 3 раза в день за 30 минут до еды.
* Смешать по 20 г тщательно измельченных корней мыльнянки и коры дуба, залить 1 л холодной воды, кипятить 15 минут и настаивать, укутав, 1 час. Пить по 1 стакану 3 раза в день.
* Пить в теплом виде свежий сок белокочанной капусты по 1/2 стакана 3 раза в день за 1 час до еды.
* Смешать в равных количествах крапиву глухую, фиалку трехцветную, череду, листья земляники. Заварить 2 ст. ложки смеси 0,5 л кипятка, настаивать, укутав, 1 час и процедить. Пить как чай по 3 стакана в день.
* Продолжительное время ежедневно пить свежий сок граната по полстакана 3 раза в день.
* При болезнях селезенки или ее затвердении можно применять каперсы колючие в виде настоя, настойки или отвара или в виде лекарственной повязки с ячменной мукой на больное место.
* При увеличенной селезенке заварить стаканом кипятка 50 г травы тысячелистника с цветами, добавить 50 г цветов календулы, довести объем до 0,5 л и принимать по 1 стакану 2 раза в день.
Инфаркт миокарда
Инфаркт миокарда (от лат. infarcire – «начинать», «набивать»; mio – «мышца»; card – «сердце») – это острая фаза ишемической болезни сердца, завершающаяся омертвением части сердечной мышцы вследствие прекращения притока крови по одной из ветвей коронарных артерий или в результате поступления ее в количестве, не обеспечивающем сердце кислородом. В результате прогрессирующего атеросклероза у человека постепенно суживается просвет питающих сердце коронарных сосудов, а со временем происходит либо острая закупорка просвета артерии тромбом (кровяным сгустком), либо его сужение набухшей атеросклеротической бляшкой. «Отключается» более или менее обширный участок сердца, в зависимости от того, какую часть миокарда снабжал кровью закупоренный сосуд. В первом случае просвет артерии блокируется более плотно, что, как правило, приводит к крупноочаговому некрозу (или омертвению) сердечной мышцы; по второму сценарию – к так называемым мелкоочаговым инфарктам миокарда. Последняя категория инфарктов отнюдь не является «мелкой» по своему значению, частоте осложнений и последствиям для больного. Смертность при них не ниже, чем при крупноочаговых инфарктах.
Причины
К причинам развития инфаркта миокарда, помимо атеросклероза, гипертонической болезни, курения и злоупотребления алкоголем, сахарного диабета и других обменных заболеваний, гиподинамии, ожирения и генетической предрасположенности к сердечным патологиям, стоит добавить еще и возникающие изменения в механизме свертывания крови, сверхэмоциональный, физически напряженный образ жизни с частыми спазмами сосудов от стрессов, подагру, влияние экологических факторов.
Как и во всякой болезни, в течении инфаркта миокарда есть тяжелые и более-менее стабильные периоды. Врачи считают, что в развитии острого инфаркта миокарда допустимо выделить несколько периодов, каждый из которых несет характерные только для него черты. Всего их четыре: предынфарктный, острый, подострый и период восстановления сердечной мышцы. Давайте чуть подробнее поговорим о том, чем они отличаются и что с ними делать, если не дай бог придется познакомиться.
Острый период инфаркта миокарда
У кардиологов приято выделять две фазы этого периода – острую и лихорадочную. Первая отличается приступом очень резких болей за грудиной. Боль появляется в груди, в области сердца, может отдавать в левую руку, плечо, ключицу, шею, нижнюю челюсть, пространство между лопатками. Она носит сжимающий, давящий, распирающий или жгучий характер. Болевой приступ сопровождается обильным потоотделением, иногда рвотой и ощущением полного бессилия, упадка духовных и физических сил. Часто возникает обморочное состояние. Больной бледнеет, ощущает слабость и чувство нехватки воздуха. Может нарушаться и сердечный ритм, больной ощущает перебои и говорит, что у него «замирает», «останавливается» сердце. Иногда инфаркт вообще начинается с обморока, и, только придя в сознание, больной впервые ощущает загрудинную боль. Продолжительность начальной фазы может длиться от нескольких часов до нескольких суток, сменяясь лихорадочной фазой. Обычно с наступлением второй фазы больной испытывает облегчение, его самочувствие улучшается. Однако радоваться ему рано: к концу первых-вторых суток проявляется лихорадка, которая длится 3—6 дней, но может продолжаться до 10 и более суток. Температура тела больного не превышает 38,5 °С, изредка поднимаясь до 39,0—39,5 °С. Подъем температуры говорит лечащему врачу, что у больного развивается воспаление сердечной мышцы. Оно характеризуется появлением в его крови большого количества лейкоцитов, призванных поглощать и выводить из организма токсические вещества, образующиеся при разрушении сердечной ткани. Увеличение числа лейкоцитов именуется лейкоцитозом. Процесс, названный лейкоцитозом, поддерживает лихорадочный период в течение 2—10 дней. Спустя положенное время острый период закономерно сменяется подострым.
Он длится от 2 до 4 недель. У некоторых больных подострый период протекает очень благоприятно, без приступов измучивших человека болей, симптомов сердечной недостаточности и других осложнений. Других, не попавших в число «везунчиков», на протяжении немалого времени продолжают донимать приступы загрудинных болей различной интенсивности и протяженности, от кратковременных до продолжительных. В последнем случае боли могут говорить о прогрессировании стенокардии, что вынуждает опасаться повторного инфаркта. Если в этот период больной уже выписан из лечебного учреждения и находится дома, то ему следует незамедлительно обратиться к врачу.
Лечение инфаркта
Боль – это страж нашего здоровья и благополучия, поэтому при возникновении сердечных болей, прежде всего необходимо обратиться к врачу. Даже устранив боль лекарственными средствами, нужно понимать простую вещь: вы отключили звонок, но не устранили причину. Если боль держится дольше обычного или проявляется резко, необходимо вызвать «неотложку». До прибытия врача для облегчения болей целесообразно поставить горчичник на то место, где ощущаются самые сильные боли; принять под язык таблетку валидола или нитроглицерина. Если это не помогло, то можно применять анальгетики: баралгин, спазган, триган Е, анальгин. Рекомендованы и успокаивающие препараты: корвалол, валокордин (30—40—50—60 капель). При приеме прописанных вам врачом лекарств необходимо четко следовать его инструкциям. То же самое касается выполнения других предписаний врача и соблюдения режима. Самостоятельно законченное лечение может оказаться преждевременным и привести к печальным и уже необратимым последствиям.
Больным с острым инфарктом миокарда показана госпитализация в реанимационное отделение, где он при «простом» инфаркте проводит около недели. После стабилизации состояния его переводят в обычную палату кардиологического отделения – «на долечивание».
При лечении инфаркта важно соблюдение строгого постельного режима. Но появились нюансы. Если всего несколько лет назад пребывание в постели и строжайший запрет любых активных движений было абсолютным условием лечения и никакие возражения не принимались, то в последние годы наметилась тенденция к его смягчению. Сейчас на строгом постельном режиме настаивают только для больных с обширными и повторными инфарктами, требующих курса терапии до полугода, из которых один месяц – строго на койке. Обычно же больные проводят в стационаре неделю-две. Особенно важно обеспечение режима (как в больнице, так и дома) в первые 15—20 дней: именно в этот период могут наступить различные осложнения. Сроки режима может устанавливать только лечащий врач, а дело больного – внимательно следить за своим самочувствием.
Фитотерапия при инфаркте миокарда
* Плоды боярышника, корневище валерианы, травы донника и лабазника, цветы клевера, листья мелиссы и кипрея, лепестки цветов розы – всего поровну. Взять 10 г измельченного в порошок сбора на 500 мл воды, нагревать на водяной бане в закрытой посуде 10 минут, настоять в тепле 2 часа, процедить и употребить по четверти стакана четыре раза в день в промежутках между едой.
* Цветы боярышника, листья вахты, трава донника, земляники – по 2 части; цветы календулы, листья мяты перечной и сныти, плоды укропа – в два раза меньше, по 1 части каждого. Затем взять 10 г сбора, залить 500 мл кипятка, нагревать в течение 10 минут на водяной бане, настоять в теплом месте около часа, процедить и принимать теплым по трети стакана три раза в день за полчаса до еды.
* Цветы боярышника и клевера, листья вахты и мяты перечной, корневище девясила, корень одуванчика, трава душицы, лабазника, сушеницы болотной, чистотела и шалфея – поровну. Взять 10 г измельченного до порошкоообразного вида сбора на 500 мл кипятка, кипятить около 2 минут, настаивать в теплом месте не менее 2 часов, затем процедить. Принимать после еды по 1/3 стакана в теплом виде.
* Трава пустырника, астрагала и сушеницы болотной, корневище валерианы, побеги багульника, цветы календулы, клевера и бессмертника, лепестки цветов розы, плоды фенхеля, кора ивы белой – поровну. Взять 10 г сбора, залить 500 мл кипятка, настаивать в термосе в течение 6 часов, процедить. Принимать в теплом виде по четверти стакана 5 раз в день.
* Соцветия арники, цветы каштана конского, листья манжетки, мать-и-мачехи и сныти, травы пустырника и лаванды, плоды фенхеля, кукурузные рыльца взять поровну. Затем 10 г измельченного до порошка сбора залить 500 мл кипятка, настоять в термосе не менее 4 часов, обязательно процедить. Принимать следует по четверти стакана 4 раза в день за час до еды.
Продолжительность употребления травяных сборов не должна превышать шести месяцев после инфаркта миокарда, причем врачи советуют менять их каждые два месяца. Спустя полгода, если все идет благополучно, и после консультации со своим лечащим врачом можно чередовать или сочетать «главные» пять сборов со следующими пятью, которые способны поддержать сердечно-сосудистую систему в целом.
* Плоды шиповника и укропа, соцветия арники, листья вахты и мяты перечной, трава донника и полыни обыкновенной, цветы ландыша – поровну. Взять 10 г сбора, залить 0,5 л кипятка и поместить в термос на 6 часов, потом процедить. Принимать в теплом виде по 1/4 стакана 5 раз в день.
* Плоды боярышника и фенхеля, цветы клевера, кора ивы белой, трава зверобоя – поровну. На 250 мл кипятка взять 5 г сбора, нагревать на водяной бане 15 минут, настаивать в тепле один час, процедить. Выпить в три приема, последний – не позднее чем за час до отхода ко сну.
* Плоды боярышника, все растение земляники, трава лабазника, чистотела и руты, листья сныти и кипрея, цветы калины – всего поровну. Взять 10 г измельченного в порошок сбора на 400 мл кипятка, кипятить 2 минуты, настаивать 2 часа, процедить и принимать по 1/4 стакана в теплом виде после еды.
* Цветы боярышника, календулы и липы, плоды укропа, солома овса – поровну. Взять 5 г измельченного до порошка сбора на 200 мл кипятка, настаивать в термосе 2,5 часа, процедить. Принимать теплым по 40 мл 4 раза в день за полчаса до еды.
* Плоды рябины обыкновенной, листья вахты, мелиссы и сныти – в равных частях. Взять 6 г сбора на 300 мл кипятка, кипятить 2 минуты, настаивать в термосе до 2 часов, процедить. Принять все количество настоя за 3 раза независимо от приема пищи.
Эти сборы советуют применять двухмесячными курсами без перерывов, чередуя между собой и со сборами, рекомендованными в острый период инфаркта. Только через 1,5 года после перенесенного инфаркта допустимы короткие, до 6—8 дней, перерывы, но только при смене состава сбора. Для укрепления сердечной мышцы у больного, перенесшего инфаркт миокарда, эффективен следующий рецепт. Надо разрезать пополам крупный лимон, из каждой его половины чайной ложкой выбрать съедобную часть на глубину до 1 см. Половинки лимона поставить в рюмки или стопки, в них доверху налить раствор люголя и, накрыв пергаментной бумагой, поместить в холодильник на 14 дней. После этого сок из половинок лимона отжать и хранить в холодильнике. Использовать следующим образом: в половину стакана некрепкого чая, который надо пить 3 раза в день за 20 минут до еды, добавляете полученный сок, начиная с 14 капель, каждый день прибавляя по 1 капле. На 14-й день приема вы дойдете до 28 капель. После этого сделайте двухнедельный перерыв и повторите курс сначала. Во время этого лечения целесообразно употреблять в пищу курагу, изюм, урюк.
Искусство уверенности в себе
Уверенность в себе во все времена была синонимом успешности, лидерства, полноты бытия. Что значит быть уверенным в себе человеком?
Такой человек прежде всего всегда высоко оценивает свои возможности. Он считает, что у него достанет сил для выполнения практически любой поставленной перед собой задачи. Он не боится ставить перед собой новые цели и с энтузиазмом принимается их реализовывать. Уверенный в себе человек всегда открыто говорит о своих чувствах, желаниях и требованиях, умеет отказывать, способен устанавливать контакты, начинать и заканчивать разговор.
Неуверенные в себе люди в отношениях с окружающими страшатся высказывать свое мнение, говорить о своих желаниях и потребностях. В конце концов они теряют веру в себя и отказываются не только от достижения целей, но и от постановки перед собой какой-либо цели вообще.
Если вы считаете, что вам не хватает уверенности в себе, если вы не в силах побороть собственную робость, не огорчайтесь. Немного усилий с вашей стороны, и вы справитесь с этой проблемой. Главный навык, который вам следует приобрести, – это умение активно преодолевать собственные страхи. Как это сделать?
Несколько способов обретения уверенности
Заведите дневник. В те дни, когда вы почувствовали страх перед тем или иным жизненным явлением, вписывайте в него все, так или иначе связанное с вашим испугом. Что вы сделали не так, как отреагировали окружающие, совпала ли их реакция на случившееся с вашей собственной и т. п.
Ваша задача – понять, что вы не являетесь настолько интересной личностью, чтобы привлекать к себе постоянное внимание со стороны окружающих. Не бойтесь совершать ошибки! Люди, не делающие ошибок, производят на других довольно удручающее впечатление. Научитесь смеяться над собой – и к вам потянутся!
Если предстоит событие, которого вы боитесь, распишите себе по пунктам возможное развитие ситуации. Попробуйте смоделировать все так, чтобы бояться было нечего. Продумайте все возможные пути выхода из заведомо неприятных для вас ситуаций.
Иногда бывает очень полезно понаблюдать за человеком, которого вы считаете образцом уверенности в себе. Попробуйте в порядке упражнения скопировать его манеру общения. Даже если вам удастся хотя бы внешне продемонстрировать уверенность в себе – поведением, голосом, внешним видом, – это будет очень важный шаг к обретению истинной внутренней уверенности.
Живите здесь и сейчас, не пропуская ни единого мгновения. Именно в каждом отдельно взятом мгновении и заключается настоящая жизнь, где нет места страху, тревоге, беспокойству или сожалению, ведь повод для них уже остался в прошлом или с какой-то степенью вероятности возникнет в неопределенном будущем.
Откажитесь от самокритики. Если трудно удержаться, старайтесь заменять негативные мысли позитивными, повышающими уверенность в себе. Например, если ваш внутренний голос говорит вам: «Снова ты все провалил, безнадежный неудачник», напомните себе, что на ошибках учатся, и в следующий раз вы все сделаете правильно.
Если нужно, всегда настаивайте на своем, не боясь прослыть эгоистом. Ложная деликатность – оборотная сторона неуверенности в себе. Открыто выражайте свои эмоции – и положительные, и отрицательные, не опасаясь, что это кому-то не понравится.
Жизнь обретает смысл лишь в достижении целей. Так что ставьте перед собой цели – разные, ближние и дальние, и, достигая их, вы будете чувствовать все большую уверенность в своих силах.
Свекольный сок
Имеющиеся в соке железо и фолиевая кислота стимулируют образование эритроцитов и поступление кислорода к мышцам. Высокое содержание магния способствует нормализации деятельности нервной системы при стрессах и перегрузках, бессоннице, неврозах. Сок хорошо расширяет кровеносные сосуды, поэтому показан при гипертонической болезни. Свекольный сок содержит около 14% углеводов, витамины С, Р, В1. В2. РР, а также йод.
Яблочная диета
Яблоки – очень ценный фрукт, в котором присутствуют почти все необходимые организму витамины и минеральные вещества, а также фолиевая кислота, сахар, пектины. Чтобы снизить вес, «яблочный день» желательно проводить 1—2 раза в неделю.
Существуют несколько вариантов яблочной диеты.
1. В течение дня нужно есть только яблоки. Причем столько, сколько влезет. Но при этом обязательно пить много жидкости. Самое оптимальное – успокоительные настои трав и зеленый чай.
2. Более жесткий вариант яблочной диеты: полтора килограмма свежих яблок на день, старайтесь употреблять их равномерно в течение дня. И вообще ничего не пить! Достаточно той жидкости, которая в яблоках. Яблоки можно запечь в духовке – разницы с точки зрения диеты почти нет.
Упражнения, укрепляющие кости и суставы
Упражнение 1. Лежа на полу, на спине, ноги вместе, колени согнуты. Одна рука лежит на животе, другая рука вытянута вдоль туловища ладонью вниз. Это исходное положение. Поднимите ягодицы на высоту спичечного коробка, задержитесь на несколько секунд (почувствуйте, как сокращаются мышцы живота) и вернитесь в исходное положение. Повторите 8 раз, отдохните несколько минут и снова сделайте 8 повторов.
Упражнение 2. Для этого упражнения понадобится отягощение для ног. Это могут быть любые грузы, которые привязываются к голеностопным суставам. Лягте на пол на левый бок, ноги лежат вместе одна на другой. Нижнюю ногу согните в колене, голову придерживайте левой рукой (обопритесь головой на левую руку, согнутую в локте), а правую положите перед собой (для баланса). Это исходное положение.
Поднимите правую ногу (нога прямая), задержитесь на несколько секунд и вернитесь в исходное положение. Повторите 8 раз, отдохните, повернитесь на правый бок и выполните упражнение 8 раз. Это полный цикл. Отдохните и сделайте еще один цикл. Идеальное выполнение – подъем ноги под углом в 45°.
Упражнение 3. Встаньте рядом со столом (на расстоянии 15—30 см от любой опоры), ноги расставьте на ширину плеч, спина прямая. Слегка опираясь о край опоры, медленно поднимитесь на носки (как можно выше), задержитесь на несколько секунд и так же медленно опуститесь на всю стопу. Повторите 8 раз, отдохните, не отходя от опоры, и снова сделайте упражнение 8 раз.
Упражнение 4. Для этого упражнения понадобятся стул с глубоким сиденьем (бедра должны располагаться на сиденье стула) и два отягощения, которые закрепляются поверх шнуровки кроссовок. Сядьте на стул, прислонившись к его спинке спиной, закрепите грузы, ладони положите на бедра. Выпрямляйте колени так, чтобы пятки были от пола на высоту спичечного коробка, а носки вытянуты. Задержитесь в этом положении на одно дыхание, а затем потяните пальцы ног на себя. И так 8 раз – стопы от себя и на себя. Затем опустите ноги на пол, отдохните и снова выполните упражнение 8 раз.
Упражнение 5. Положите гантели на пол так, чтобы вы могли между ними лечь. Лягте на спину, колени согните, ступни поставьте на пол на ширину плеч. Возьмите гантели так, чтобы локти были согнуты, предплечья оставались на полу параллельно друг другу. Ладони должны быть направлены в сторону ног, запястья на одной линии с предплечьем и локтем. Гантели находятся на середине груди. Вытолкните гантели вверх на вытянутых руках, задержитесь на несколько секунд и медленно опустите гантели в исходное положение. Сделав 8 раз, отдохните и снова повторите упражнение 8 раз.
Упражнение 6. Сядьте на стул, стопы на полу на ширине плеч. Возьмите в каждую руку по гантели (руки с гантелями опущены вниз). Поднимите одну гантель до уровня плеча (согните руку в локте), разворачивая запястье во время подъема так, чтобы большой палец оказался у вашего плеча (плечо не выдвигайте вперед). Задержитесь на мгновение, а затем опустите руку вниз. Повторите 8 раз и отдохните, затем перемените руку и снова сделайте упражнение 8 раз.
Тибетский молочный гриб
Тибетский молочный гриб обладает следующими свойствами:
* лечит аллергические заболевание, болезни печени, желчного пузыря, растворяет камни желчного пузыря, исцеляет болезни сердца, язву желудка и двенадцатиперстной кишки;
* приостанавливает кальцинирование кровеносных сосудов,
*выделяет ряд противовоспалительных антибиотиков при болезнях внутренних органов;
* снижает артериальное давление;
* останавливает рост раковых клеток;
* регулирует состояние усталости и износ организма;
* приостанавливает старение клеток организма;
* лечит пародонтоз;
* полностью очищает организм от шлаков, выводит продукты обмена, холестерин, соли тяжелых металлов, радионуклиды и продукты обмена алкоголя;
* повышает тонус и внутренние резервы организма, улучшает память, внимание.
На вид здоровый молочный гриб белого цвета, напоминает разваренный рис, размер от 5—6 мм вначале до 50 мм в период деления. Живет и размножается в молоке. Применяется для сквашивания молока в кефир, обладающий лечебными свойствами.
Для его приготовления нужно 2 ч. ложки грибка залить 250 г молока комнатной температуры и оставить на сутки. При полном сквашивании сверху появляется густой слой – это и есть грибок. На дне банки образуется кефир. Его надо отцедить через мелкое ситечко. Грибок после процеживания промывают под струей чистой холодной воды, снова кладут в чистую банку и заливают очередной порцией молока. Хранят гриб при комнатной температуре.
В первые дни лечения резко повышается активность желудка: появляется усиленное газообразование, возможен жидкий стул. При наличии заболеваний почек и печени могут появиться неприятные ощущения в области больных органов. Это, утверждают инструкции, нормально. Лечение прерывать нельзя. Через 10—12 дней бурная реакция организма прекращается, наступает улучшение общего состояния.
При лечении молочным грибом категорически запрещается употреблять спиртные напитки. Следует ограничить в рационе жирные и острые продукты.
* Для профилактического приема ежедневный объем выпиваемого кефира должен составлять 800 мл. Разделите его на четыре равные порции и пейте перед каждым приемом пищи. Для детей доза кефира несколько меньше – до 300 мл. Курс приема от 21 дня до 3 месяцев. После месячного перерыва курс можно повторить.
*Для лечения дисбактериоза сквашенное молоко пьют один-два раза в день по стакану за полчаса до еды или за час-полтора до сна на ночь. Курс лечения – 20 дней, затем перерыв 10 дней и так в течение года.
* Для лечения колитов утром и днем нужно принимать по 20 капель 30%-ного спиртового настоя прополиса. На ночь выпивать по стакану кефира тибетского грибка. Через пять недель перейти сначала на двух-, а затем на трехразовый прием кефира. В течение шестой недели пить два раза в день, утром и вечером перед сном по 1/2 стакана «грибного» кефира.
* Для лечения язвы желудка и двенадцатиперстной кишки следует сразу после сна выпить стакан воды с растворенной в нем 1/2 ст. ложки меда. Перед едой выпивать полстакана сока белокочанной капусты, после еды – 1/2 стакана «грибного» кефира. Перед сном можно съедать пол чайной ложки оливкового масла.
* При болезнях печени. Перед каждым приемом пищи выпивать по полстакана свежеотжатого огуречного сока, а перед сном – полстакана «грибного» кефира.