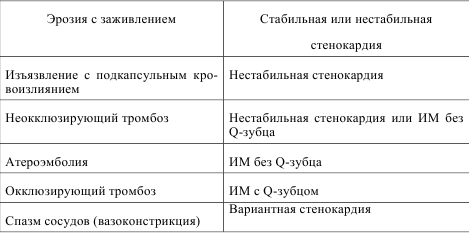
Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ
Применение ингибиторов ангиотензинпревращающего фермента у больных острым инфарктом миокарда
Терещенко Сергей Николаевич, Проф. д. м. н. заведующий кафедрой скорой помощи, председатель секции ВНОК «Неотложная кардиология»
Рабочая группа по подготовке текста рекомендаций:
проф. Руда М. Я. (председатель), проф. Голицын С. П. проф. Грацианский Н. А. к. м. н. Комаров А. Л. проф. Панченко Е. П. д. м. н. Староверов И. И. проф. Терещенко С. Н. д. м. н. Явелов И. С.
В настоящее время применение ингибиторов ангиотензинпревращающего фермента (АПФ) у больных острым инфарктом миокарда (ОИМ) не вызывает сомнений. Общеизвестен тот факт, что у данной категории пациентов риск летального исхода, развития повторного ИМ и сердечной недостаточности довольно высок. Прогноз ОИМ, прежде всего, определяется размерами некроза и осложнениями. Особое место в терапии ОИМ в отношении влияния на ближайший и отдаленный прогноз занимают ингибиторы АПФ.
Ингибиторы АПФ тормозят процессы ремоделирования миокарда, запущенные в результате инфарктного повреждения сердечной мышцы. Ремоделирование левого желудочка подразумевает истончение стенки в зоне некроза, гипертрофию непораженного миокарда, дилатацию камер сердца. В развитии этого процесса важную роль играет местная тканевая ренин-ангиотензин-альдостероновая система (РААС) сердца, активизирующаяся в первые дни инфаркта миокарда. Следует отметить, что активация РААС и симпатической системы имеет большое значение в приспособлении миокарда к новым условиям функционирования, стимулируя раннюю гипертрофию кардиомиоцитов и замещение зоны инфаркта рубцовой тканью. Изменение структуры и формы левого желудочка, нейрогормональная активность способствуют нормализации сердечного выброса в первые недели. Однако конечным результатом постинфарктного ремоделирования является прогрессирующая дилатация левого желудочка. Активация РААС обусловливает не только гипертрофию кардиомиоцитов, но и вазоконстрикцию и задержку жидкости, что играет важную роль в развитии хронической сердечной недостаточности (ХСН).
Применение ингибиторов АПФ приводит к снижению общего периферического сосудистого сопротивления за счет снижения активности ангиотензина II на рецепторы сосудов и увеличения содержания брадикинина, оказывающего сосудорасширяющее действие. Ингибиторы АПФ, воздействуя на локальные РААС, препятствуют прогрессированию дилатации левого желудочка и вызывают регресс его гипертрофии. Результатом этого является уменьшение ремоделирования миокарда. Влияя на тканевые РААС в миокарде, ингибиторы АПФ оказывают также и антиаритмическое действие.
Ингибиторы АПФ наряду со способностью улучшать эндотелиальную функцию, тормозить рост и пролиферацию гладкомышечных клеток, обладают свойством тормозить миграцию и функцию макрофагов, снижать тромботическую активность посредством предотвращения агрегации тромбоцитов и усиления эндогенного фибринолиза.
Снижая синтез ангиотензина II и регулируя артериальное давление, которое является важным компонентом, влияющим на потребление миокардом кислорода, а также, обладая антиадренергическим действием и стимулируя синтез брадикинина — одного из мощных вазодилататоров, ингибиторы АПФ оказывают антиишемический эффект на миокард. Стимуляция брадикинина также приводит к уменьшению зоны некроза.
Таким образом, эффект ингибиторов АПФ у больных ОИМ проявляется:
- Влиянием на процессы ремоделирования миокарда.
- Влиянием на ремоделирование сосудов (антиангинальный, антиишемический эффект).
- Снижением тромбообразования.
- Профилактикой развития сердечной недостаточности.
- Антиаритмическим действием.
По данным ACC/AHA Guidelines for the Management of Patients With STEMI — Executive Summary, эффективность терапии ингибиторами АПФ высока в группах пациентов с высоким риском, т. е. у больных с повторным инфарктом миокарда, признаками сердечной недостаточности, левожелудочковой дисфункцией и тахикардией.
Целесообразность применения ингибиторов АПФ у больных, перенесших инфаркт миокарда, показана в целом ряде рандомизированных многоцентровых клинических исследований (см. таблицу 1).
Таблица 1. Применение ингибиторов АПФ у больных инфарктом миокарда: результаты рандомизированных исследований
Критерии включения
СОВРЕМЕННЫЕ ПОДХОДЫ К РАННЕМУ ЛЕЧЕНИЮ ОСТРОГО ИНФАРКТА МИОКАРДА
Явелов И.С.
Статья знакомит с рекомендациями Европейского кардиологического общества и Американской коллегии кардиологов/Американской ассоциации сердца по лечению острого инфаркта миокарда, сформированных на основании анамнеза эффективности и безопасности использования диагностических и терапевтических методов.
The paper outlines the guidelines of the European Society of Cardiology and the American College of Cardiology/American Heart Association for the management of patients with acute myocardial infarction, which have been made on the basis of analysis of the efficiency and safety of diagnostic techniques and treatments.
Городская клиническая больница N 29, Москва
I.S. Yavelov, Candidate of Medical Sciences,
City Clinical Hospital No. 29, Moscow
В январе 1996 г. опубликованы рекомендации Европейского кардиологического общества (ЕКО) по лечению острого инфаркта миокарда [1]. В ноябре того же года появилась вторая редакция рекомендаций Американской коллегии кардиологов/Американской ассоциации сердца (АКК/ААС) [2]. При составлении подобных рекомендаций группа экспертов на основании анализа и оценки накопленных фактов (evidence) об эффективности и безопасности различных вмешательств или диагностических процедур формирует суждение (opinion) о целесообразности их использования. Однако поскольку наряду с общепризнанными положениями существуют случаи, когда свидетельств эффективности и безопасности недостаточно или они противоречивы, прийти к однозначному заключению удается далеко не всегда. Подобная неопределенность всегда обсуждается и имеющиеся факты критически анализирутся в тексте рекомендаций, отражая современное состояние проблемы. В документах АКК/ААС показания формулируются следующим образом.
Класс I: целесообразность использования/эффективность вмешательства или диагностической процедуры подтверждается фактами и/или мнением экспертов. Очевидно, что вмешательства класса I являются методом выбора.
Класс II: существуют неоднозначные данные и/или различные мнения экспертов о целесообразности использования/эффективности вмешательства или диагностической процедуры.
Класс IIа: преобладают данные и/или мнения экспертов о нужности/эффективности вмешательства или диагностической процедуры.
Класс IIb: нужность/эффективность вмешательства или диагностической процедуры установлена в меньшей степени.
Класс III: существуют факты и/или согласие экспертов о том, что вмешательство или диагностическая процедура бесполезна/неэффективна и в некоторых случаях может быть опасна. Очевидно, что вмешательства класса III противопоказаны.
В данном сообщении обсуждаются рекомендации экспертов ЕКК и АКК/ААС, касающиеся лечения острого инфаркта миокарда в первые 24 – 48 ч после начала заболевания.
I. Неотложные мероприятия
1. Постановка диагноза и первоначальные мероприятия.
Подозревать инфаркт миокарда можно на основании приступа боли в грудной клетке, характер которой предполагает наличие ишемии миокарда, длительностью 15 мин и более. У подобных больных следует учитывать наличие ишемической болезни средца (ИБС) в анамнезе и иррадиацию боли в шею, нижнюю челюсть и левую руку. Вместе с тем подчеркивается, что у лиц пожилого возраста заболевание может проявляться одышкой или потерей сознания. При наличии этих симптомов необходимо как можно быстрее зарегистрировать электрокардиограмму (ЭКГ). Согласно рекомендациям экспертов АКК/ААС оценка клинических данных и регистрация ЭКГ в 12 отведениях у больного с подозрением на острый инфаркт миокарда должны быть проведены по возможности в первые 10 мин (но не позднее 20 мин) после поступления в стационар. В случае отсутствия на ЭКГ изменений, характерных для острого инфаркта миокарда (подъем сегмента ST, образование зубцов Q), рекомендуются частая повторная регистрация ЭКГ, а также ее сравнение с предшествующими записями. В качестве дополнительных мер в случаях, когда диагноз остается неясным, рекомендуется быстрое определение маркеров некроза миокарда в сыворотке крови, а в сложных случаях – эхокардиографическое исследование и коронарография. Необходимо проведение дифференциального диагноза с другими причинами боли в грудной клетке: расслаивающая аневризма аорты, острый перикардит, острый миокардит, спонтанный пневмоторакс и эмболия легочной артерии.
Подчеркивается необходимость немедленного начала мониторного наблюдения за ритмом сердца для выявления угрожающих жизни аритмий, а также обеспечения вдыхания кислорода через носовые катетеры и венозного доступа (вмешательства класса I по классификации АКК/ААС). Указывают также на целесообразность назначения нитроглицерина под язык (в отсутствие гипотонии, выраженных тахикардии или брадикардии) и важность скорейшего приема первой дозы аспирина. Эксперты АКК/ААС рекомендуют также проводить оценку риска неблагоприятных исходов заболевания уже на догоспитальном этапе и транспортировать больных высокого риска в медицинское учреждение, где есть возможность немедленно выполнить коронарографию и реваскуляризацию миокарда. Об особой тяжести состояния свидетельствуют тахикардия (частота сердчных сокращений – ЧСС более 100 в минуту), гипотония (систолическое артериальное давление (АД) менее 100 мм рт.ст.), шок или отек легких.
2. Обезболивание.
Препаратом выбора являются наркотические анальгетики, а из них – морфин (или диаморфин). Особо подчеркивается необходимость внутривенного введения препарата, внутримышечные инъекции должны быть исключены. Возникающие у некоторых больных артериальная гипотония и брадикардия обычно устраняются атропином, угнетение дыхания – налоксоном. Максимальное облегчение боли эксперты АКК/ААС относят к мероприятиям класса I. В качестве дополнительных мер в случае недостаточной эффективности повторного введения опиатов рассматривается внутривенное введение бета-блокаторов или использование нитратов. Для уменьшения беспокойства больного предлагается создать спокойную обстановку, а в случае недостаточной эффективности опиатов дополнительно назначить транквилизатор. Применение препаратов, уменьшающих тревогу, у всех больных относят к мероприятиям класса IIb.
3. Лечение остановки сердца.
Рекомендуется стандартный набор мероприятий, относящихся к сердечно-легочной реанимации.
II. Раннее лечение острого инфаркта миокарда
Ряд вмешательств направлен на предупреждение осложнений и уменьшение вероятности неблагоприятных исходов заболевания. Очевидно, что они должны проводиться у всех больных с острым инфарктом миокарда, не имеющих противопоказаний (“по диагнозу”).
1. Восстановление кровотока по инфаркт-связанной артерии.
В настоящее время общепризнано, что наиболее важным в лечении острого инфаркта миокарда является быстрое полное восстановление и поддержание кровотока по инфаркт-связанной коронарной артерии. Для решения этой задачи разрабатываются более эффективные тромболитические агенты и режимы введения уже известных препаратов, совершенствуются внутрисосудистые методы реваскуляризации миокарда и сопутствующее лечение, однако основное место отводится времени, прошедшему после появления симптомов заболевания, до начала вмешательства.
В рекомендациях ЕКО отмечено, что время после обращения за помощью до начала тромболитической терапии (“от звонка до иглы”) должно составлять не более 90 мин. Время после поступления больного в стационар до начала лечения (“от двери до иглы”) не должно превышать 20 мин согласно предписаниям ЕКО или 30 мин по рекомендациям АКК/ААС и является важнейшим показателем организации работы медицинского учреждения.
Решение о необходимости применения ряда методов лечения при обострениях ИБС должно быть принято в кратчайшие сроки, в то время как сразу поставить точный диагноз возможно далеко не всегда. Поэтому с практической точки зрения при поступлении в стационар больного с затяжным приступом боли за грудиной, похожей по характеру на возникающую при ишемии миокарда, эксперты АКК/ААС предлагают выделять наличие острого коронарного синдрома с подъемом сегмента ST на ЭКГ или острого коронарного синдрома без подъема сегмента ST. Первое подразумевает сохранение окклюзии эпикардиальной коронарной артерии и необходимость мероприятий по восстановлению ее проходимости, второе – отсутствие показаний для подобных вмешательств. У больного с сохраняющимся болевым синдромом рекомендуется проводить частую повторную регистрацию ЭКГ (вплоть до ее мониторирования) для своевременного выявления показаний к применению вмешательств, способных обеспечить коронарную реперфузию.
1А. Тромболитическая терапия.
Эксперты ЕКО подчеркивают, что к настоящему времени убедительно продемонстрировано преобладание благоприятного влияния тромболитической терапии у больных с острым инфарктом миокарда над возможными побочными проявлениями. В первые 6 ч после начала заболевания это вмешательство позволяет предотвратить около 30 смертей на 1000 пациентов с признаками окклюзии коронарной артерии и превосходит по эффективности все другие известные способы медикаментозного лечения. Наибольшее уменьшение числа умерших отмечено среди больных с высоким риском неблагоприятного исхода (в возрасте старше 65 лет, при гипотонии, тахикардии, передней локализации инфаркта, повторном инфаркте, сахарном диабете и др.). Эффективность тромболитической терапии зависит, в первую очередь, от времени начала лечения и максимальна в ранние сроки заболевания.
Согласно рекомендациям ЕКО, показанием к тромболитической терапии является наличие на ЭКГ подъмов сегмента ST или блокады ножки пучка Гиса у больных, поступивших в первые 12 ч после появления симптомов. Однако при сохранении боли и указанных выше изменений на ЭКГ полагают, что тромболитическая терапия может быть проведена и в более поздние сроки (до 24 ч после появления симптомов – вмешательство класса IIb). В рекомендациях АКК/ААС отмечено, что подъем сегмента ST должен превышать 0,1 мВ и необходимо присутствие этих изменений не менее, чем в двух смежных отведениях ЭКГ. Под блокадой ножки пучка Гиса чаще подразумевают вновь возникшую или предположительно вновь возникшую полную блокаду левой ножки пучка Гиса, затрудняющую интерпретацию ЭКГ. Поскольку данные об эффективности тромболитической терапии у больных старше 75 лет ограничены, для них это вмешательство отнесено к классу Ia. Кроме того, в рекомендациях АКК/ААС подчеркнуто, что при регистрации систолического АД выше 180 мм рт.ст. и/или диастолического АД выше 110 мм рт.ст. у больных с высоким риском неблагоприятного исхода заболевания тромболитическая терапия является вмешательством класса IIb, в то время как у больных с низким риском ее следует считать абсолютно противопоказанной. До начала лечения необходимо снизить АД, однако нет доказательств, что вероятность геморрагического инсульта от этого уменьшается. При отсутствии указанных изменений на ЭКГ и в случаях, когда после появления симптомов заболевания прошло более суток, тромболитическая терапия в настоящее время не считается целесообразной.
К абсолютным противопоказаниям эксперты ЕКО относят тяжелую травму, хирургическое вмешательство или травму головы в предшествующие 3 мес, желудочно-кишечное кровотечение в предшествующий месяц, инсульт, склонность к кровотечениям и расслаивающую аневризму аорты. К относительным противопоказаниям относят преходящее нарушение мозгового кровообращения в предшествующие 6 мес, лечение непрямыми антикоагулянтами, беременность, пункцию сосудов, не поддающихся прижатию, травматичную реанимацию, рефрактерную гипертензию (систолическое АД более 180 мм рт.ст.) и недавнее лечение сетчатки лазером. Подчеркивается, что сахарный диабет не является противопоказанием к тромболитической терапии, даже при наличии ретинопатии. В рекомендациях АКК/ААС абсолютно противопоказанной тромболитическая терапия считается при геморрагическом инсульте в анамнезе, любом другом инсульте в предшествующий год, внутричерепном новообразовании, активном внутреннем кровотечении (за исключением менструального), подозрении на расслаивающую аневризму аорты. Относительными противопоказаниями считаются травма (включая травму головы), крупное хирургическое вмешательство или внутреннее кровотечение в предшествующие 3 нед, тяжелая неконтролируемая артериальная гипертензия при поступлении (более 180/110 мм рт.ст.), любая внутричерепная патология, не являющаяся абсолютным противопоказанием, травматичная или длительная (более 10 мин) сердечно-легочная реанимация, склонность к кровотечениям, использование непрямых антикоагулянтов в терапевтической дозе (международное нормализованное отношение равно или превышает 2), пункция сосудов, не поддающихся прижатию, беременность, активная пептическая язва, хроническая тяжелая гипертензия в анамнезе.
Наиболее опасным осложнением тромболитической терапии является геморрагический инсульт, развивающийся обычно в первый день после лечения (примерно 4 дополнительных инсульта на 1000 леченных стрептокиназой, причем 2 из них фатальные и 1 с выраженным неврологическим дефицитом). К факторам риска относят возраст старше 75 лет и наличие систолической гипертензии. Увеличивается также частота тяжелых кровотечений (дополнительно у 7 на 1000 леченных при применении стрептокиназы). Есть основания полагать, что одним из основных факторов риска является пункция вен и особенно артерий в присутствии фибринолитического агента. Применение стрептокиназы и анизолированного активаторного комплекса стрептокиназы с плазминогеном может быть связано с развитием артериальной гипотонии. Эксперты ЕКО подчеркивают, что профилактическое введение стероидных гормонов всем больным для предупреждения гипотонии и аллергических реакций не показано. При появлении гипотонии рекомендуют временно прекратить инфузию тромболитика, поднять ноги больного. Редко требуется применение атропина или восполнение внутрисосудистого объема.
В рекомендациях ЕКО отмечено, что применение анизолированного активаторного комплекса стрептокиназы с плазминогеном или тканевого активатора плазминогена, вводимого за 3 ч, не имело преимущества перед стрептокиназой, но сопровождалось увеличением числа инсультов. Вместе с тем подчеркнуто, что есть указания на большую эффективность тканевого активатора плазминогена, вводимого в ускоренном режиме (за 90 мин), в сочетании с инфузией гепарина в течение 24 – 48 ч, особенно в ранние сроки заболевания у больных с обширным поражением миокарда и низким риском геморрагического инсульта. Однако не все эксперты считают преимущество этого режима клинически значимым, поскольку некоторое уменьшение числа умерших от инфаркта миокарда в сравнении с таковым при использовании стрептокиназы сопровождалось отчетливым увеличением числа внутричерепных кровотечений. При рецидиве инфаркта миокарда с появлением подъемов сегмента ST или блокады ножки пучка Гиса на ЭКГ показано повторное проведение тромболитической терапии или прямая ангиопластика. Вместе с тем подчеркивается, что стрептокиназа или анизолированный активаторный комплекс стрептокиназы с плазминогеном не должны назначаться в период от 5 дней до 2 лет после их первоначального введения. Это ограничение не распространяется на тканевой активатор плазминогена и урокиназу.
1Б. Внутрисосудистые и хирургические методы.
Внутрисосудистый метод основан на механическом восстановлении просвета сосуда с помощью раздувающегося баллона (чрескожная чреспросветная коронарная ангиопластика). В зависимости от ситуации, в которых он применяется при остром инфаркте миокарда, выделяют несколько видов вмешательства.
1. “Прямая” ангиопластика проводится как первичное вмешательство, без предшествующей или сопутствующей тромболитической терапии. Эксперты ЕКО подчеркивают, что проведение ангиопластики вместо тромболитической терапии оправдано только в случаях, когда ее выполнение возможно в пределах 1 ч после поступления больного в стационар. Полагают, что особо показана прямая ангиопластика при наличии кардиогенного шока, при высоком ожидаемом успехе от реканализации инфаркт-связанной артерии и при наличии противопоказаний к тромболитической терапии (при противопоказаниях, связанных с риском кровотечений – класс IIa, при иных противопоказаниях – класс IIb). Также полагают, что эффективность прямой ангиопластики может во многом зависеть от опытности персонала и организации работы учреждения. В связи с этим эксперты АКК/ААС рекомендуют рассматривать прямую ангиопластику в качестве альтернативы тромболитической терапии (вмешательство класса I) лишь в случаях, когда процедура проводится оператором, выполняющим более 75 ангиопластик в год, в учреждении, где количество вмешательств превышает 200 в год и результаты лечения соответствуют определенным стандартам (“коридору исходов”). Подчеркивается неполнота имеющихся данных о сравнительной эффективности прямой ангиопластики с более простой по выполнению тромболитической терапии и необходимость проведения крупных рандомизированных исследований.
2. Ангиопластика после успешного проведения тромболитической терапии (приведшей к восстановлению проходимости инфаркт-связанной артерии) у всех больных не рекомендуется (вмешательство класса III). В настоящее время предпочтение инвазивному лечению отдается только при возобновлении ишемии миокарда (в покое или при физической нагрузке), а также при сохраняющейся нестабильности гемодинамики – “отсроченно и выборочно” (вмешательство класса I).
3. “Спасительная” ангиопластика выполняется в случаях, когда несмотря на проведение тромболитической терапии сохраняется окклюзия инфаркт-связанной артерии. Вместе с тем экспертами ЕКО подчеркивается ограниченность данных о ее эффективности, а также ненадежность неинвазивных методов определения восстановления проходимости коронарной артерии. Предлагается обсуждать вопрос о целесообразности этого вмешательства, если через 90 мин после начала тромболитической терапии сохраняются болевой синдром и подъемы сегмента ST на ЭКГ [3].
Необходимо учитывать, что внутрисосудистое лечение больных с различными формами ИБС – быстро развивающаяся область и обсуждаемые рекомендации отражают состояние проблемы на 1996 г. Ожидается, что широкое применение внутрисосудистых протезов и усовершенствование антитромботического лечения смогут существенно повысить эффективность вмешательства.
В рекомендациях ЕКО отмечено, что хирургическая реваскуляризация (операция аортокоронарного шунтирования) в остром периоде инфаркта миокарда имеет ограниченное значение и может использоваться при невозможности выполнения или неудаче ангиопластики, а также у больных, нуждающихся в срочной хирургической коррекции дефекта межжелудочковой перегородки или митральной регургитации.
2. Аспирин.
В рекомендациях ЕКО подчеркивается, что аспирин необходимо назначать всем больным с острым коронарным синдромом, не имеющим противопоказаний, независимо от проведения тромболитической терапии. Рекомендуется суточная доза 150 – 160 мг (ЕКО) или 160 – 325 мг (АКК/ААС), причем при первом приеме таблетка перед проглатыванием должна быть разжевана. Применение аспирина позволяет предотвратить в целом 24 смерти на 1000 леченных, причем при сочетании с тромболитической терапией эффективность обоих вмешательств возрастает. Хотя для аспирина в отличие от тромболитической терапии нет определенных свидетельств зависимости эффекта от времени начала лечения, предлагается принимать препарат как можно раньше после выявления острого коронарного синдрома (вмешательство класса I при назначении с первых суток острого инфаркта миокарда). К противопоказаниям относят повышенную чувствительность, кровоточащую пептическую язву, тяжелое заболевание печени. Указывают на возможность бронхостазма у астматиков.
3. Гепарин.
Эксперты ЕКО подчеркивают, что накопленные к настоящему времени данные не свидетельствуют о необходимости применения гепарина у всех больных, подвергшихся тромболитической терапии и одновременно получающих аспирин (с возможным исключением для тканевого активатора плазминогена, вводимого в ускоренном режиме). Указывается на ограниченность сведений об эффективности гепарина при широком применении аспирина, бета-блокаторов и ингибиторов ангиотензинпреврашающего фермента (АПФ) при остром коронарном синдроме с подъемами сегмента ST, когда вмешательства, направленные на реперфузию инфаркт-связанной артерии, по каким-либо причинам не проводились. В рекомендациях АКК/ААС применение гепарина рекомендуется при внутрисосудистой реваскуляризации миокарда (класс I), а также повышенном риске артериальных эмболий из левых отделов сердца (обширный или передний инфаркт миокарда, мерцательная аритмия, предшествующие эмболии или тромб в полости левого желудочка – класс IIa).
3. Антиаритмические препараты.
Профилактическое применение лидокаина не рекомендуется (уменьшая вероятность легко устранимой фибрилляции желудочков, препарат повышает риск развития асистолии, так что в целом отмечена тенденция к увеличению числа умерших). Применение антиаритмических препаратов для предупреждения реперфузионных аритмий при проведении тромболитической терапии также не рекомендуется. Эксперты АКК/ААС указывают, что уменьшения частоты фибрилляции желудочков можно достигнуть при более широком использовании бета-блокаторов.
Применение нитратов у всех больных с первых суток острого инфаркта миокарда в крупных рандомизированных исследованиях не сопровождалось снижением летальности. Вместе с тем их результаты критикуются, поскольку во многих случаях инфузия нитроглицерина проводилась также в группе плацебо. Эксперты ЕКО полагают, что несмотря на существующую неоднозначность накопленные данные свидетельствуют о нецелесообразности использования нитратов у всех больных в остром периоде инфаркта.
В рекомендациях АКК/ААС внутривенная инфузия нитроглицерина в первые 2 4 – 48 ч после начала заболевания у больных с наличием сердечной недостаточности, большого переднего инфаркта миокарда, сохраняющейся ишемии миокарда или гипертензией отнесена к классу I, в первые 24 – 48 ч при неосложненном течении заболевания – к классу IIb. Более длительное применение нитратов у пациентов с сохраняющейся стенокардией или застоем в легких отнесено к классу I, при обширном инфаркте в отсутствие осложнений — к классу IIb. При систолическом АД менее 90 мм рт.ст. или выраженной брадикардии (ЧСС менее 50 ударов в минуту) введение нитроглицерина считается противопоказанным (класс III).
6. Антагонисты кальция.
Поскольку отмечена тенденция к увеличению числа неблагоприятных исходов при назначении антагонистов кальция в ранние сроки инфаркта миокарда, эксперты ЕКО полагают, что в остром периоде заболевания нет оснований рекомендовать их к широкому применению.
7. Ингибиторы ангиотензинпревращающего фермента.
В ряде исследований продемонстрировано небольшое снижение летальности при назначении ингибиторов АПФ с первых суток инфаркта миокарда всем больным, не имеющим противопоказаний (гипотония, почечная недостаточность) – около 5 предотвращенных смертей на 1000 леченных. Не исключено, что вмешательство более эффективно у больных с высоким риском неблагоприятного течения заболевания (наличие сердечной недостаточности, предшествующий инфаркт миокарда). С другой стороны, существуют свидетельства большей эффективности препаратов этой группы при начале лечения в последующие несколько дней только в случаях, когда в остром периоде заболевания отмечались проявления левожелудочковой недостаточности. Эксперты ЕКО поддерживают оба этих подхода и полагают, что ингибиторы АПФ в ранние сроки заболевания целесообразно назначать больным, у которых сердечная недостаточность не исчезает быстро после проведения стандартных мероприятий. В рекомендациях АКК/ААС применение ингибиторов АПФ при подозрении на острый инфаркт миокарда в сочетании с подъемами сегмента ST в двух и более передних грудных отведениях ЭКГ или наличие сердечной недостаточности в первые 24 ч после начала заболевания отнесено к классу I. У других больных с подозрением на острый инфаркт миокарда использование ингибиторов АПФ в те же сроки отнесено к классу IIa. В крупных исследованиях при раннем начале лечения продемонстрирована эффективность каптоприла, лизиноприла и зофеноприла, однако эксперты ЕКО подчеркивают, что положительное влияние на клиническое течение заболевания можно считать свойством всех препаратов этой группы. Особое значение придают началу лечения, которое заключается в приеме внутрь малых разовых доз с постепенным их увеличением до полной рекомендуемой дозы в течение 24 – 48 ч.
8. Магний.
Эксперты ЕКО полагают, что в настоящее время нет достаточных доказательств эффективности внутривенной инфузии солей магния в остром периоде инфаркта миокарда и применение этого вмешательства у всех больных не может быть рекомендовано.
III. Лечение инфаркта миокарда без зубца Q
У больных с подозрением на острый инфаркт миокарда, не имеющих изменений на ЭКГ, которые являются основанием для вмешательств, направленных на восстановление проходимости окклюзированной коронарной артерии (острый коронарный синдром без подъема сегмента ST или блокады ножки пучка Гиса), диагноз может быть установлен только ретроспективно, после нескольких дней наблюдения. У части из них возможно формирование зубца Q, в то время как в других случаях диагностируется инфаркт миокарда без зубца Q, а в отсутствие доказательств возникновения некроза в миокарде (повышения кардиоспецифических ферментов в сыворотке крови выше определенного уровня) выставляется диагноз нестабильной стенокардии. Кроме того, у ряда больных причина ухудшения может оказаться не связанной с обострением ИБС.
Лечение этой достаточно разнородной группы больных еще не разработано. Эксперты ЕКО и АКК/ААС подчеркивают, что в настоящее время для них нет доказательств эффективности тромболитической терапии. Рекомендуется назначение аспирина в сочетании с внутривенной инфузией гепарина. Для подавления ишемии миокарда предлагают назначать бета-блокаторы, при их недостаточной эффективности – нитраты, однако сведения о влиянии этих вмешательств на прогноз заболевания либо отсутствуют, либо недостаточны. При инфаркте миокарда без зубца Q применение бета-блокаторов, а также антагониста кальция дилтиазема (в отсутствие дисфункции левого желудочка и после первых суток заболевания) отнесены к классу IIb. Место внутрисосудистых методов в лечении больных с нестабильной стенокардией или инфарктом миокарда без зубца Q также еще окончательно не определено. В сравнительно небольшом исследовании (TIMI IIIB) отмечена эквивалентность “раннего инвазивного” (коронарная ангиография и реваскуляризация в первые 48 ч после поступления у всех больных) и “раннего консервативного” (инвазивное вмешательство только при сохраняющейся ишемии миокарда) подходов.
В настоящее время у этой группы больных проводится интенсивное изучение новых способов антитромботического лечения и их сочетания с внутрисосудистыми вмешательствами.
IV. Лечение осложнений острого периода инфаркта миокарда
Подход к лечению осложнений острого инфаркта миокарда является симптоматическим.
1. Сердечная недостаточность.
Для ее своевременного выявления в остром периоде инфаркта миокарда указывают на необходимость повторной аускультации сердца (для выявления III тона) и легких, а также проведение рентгенографии грудной клетки. Для определения механизмов развития сердечной недостаточности рекомендуется проведение эхокардиографии.
Рекомендуется вдыхание кислорода через маску или носовые катетеры. В более легких случаях показано внутривенное введение фуросемида (10 – 40 мг), которое при необходимости повторяется с интервалами в 1 – 4 ч. Если адекватный ответ не был достигнут, применяется нитроглицерин (в виде внутривенной инфузии или перорально). Следует обсудить также целесообразность назначения ингибитора АПФ в ближайшие 24 – 48 ч.
В более тяжелых случаях нитроглицерин вводится внутривенно и рекомендуется предусмотреть возможность проведения инвазивного мониторирования давления заклинивания в легочной артерии и сердечного выброса. При наличии гипотонии рекомендуется инфузия допамина (особенно при наличии признаков плохой перфузии почек) или добутамина (в случаях, когда преобладает застой в легких). Возможно обсудить целесообразность назначения ангибиторов АПФ и ингибиторов фосфодиэстеразы. Необходимо определять газы крови и в случаях, когда артериальная гипоксемия (напряжение кислорода менее 60 мм рт.ст.) не исчезает при дыхании 100% кислородом, подаваемым через маску со скоростью 8 – 10 л/мин, а также адекватном использовании бронходилататоров, необходимо создание постоянного положительного давления в дыхательных путях.
2. Кардиогенный шок.
Диагноз основывается на выявлении снижения систолического АД менее 90 мм рт.ст. в сочетании с нарушениями гемодинамики, которые проявляются в виде периферической вазоконстрикции, малого отделения мочи (менее 20 мл/час), спутанности сознания и вялости. До установления диагноза кардиогенного шока необходимо исключить наличие гиповолемии, вазовагальных реакций, нарушения баланса электролитов, побочные действия лекарственных препаратов или аритмии в качестве причины гипотонии. Указывают также на необходимость проведения эокардиографии, мониторирования АД непосредственно в артерии и определения состояния гемодинамики при катетеризации легочной артерии с помощью плавающего катетера.
Из медикаментозных способов лечения кардиогенного шока рекомендуются проведение инфузии прессорных аминов и коррекция ацидоза. Согласно рекомендациям АКК/ААС допамин является препаратом выбора при снижении систолического АД менее 90 мм рт. ст. или на 30 мм рт.ст. ниже обычного. В случаях, когда АД не нормализуется при скорости инфузии допамина 20 мкг/кг/мин, необходимо введение норадреналина. В остальных случаях предпочтение следует отдать добутамину.
Причиной кардиогенного шока может быть инфаркт миокарда правого желудочка, заподозрить который можно при сочетании гипотонии с отсутствием застоя в легких и повышением давления в шейных венах у больных с нижним инфарктом миокарда. Эксперты ЕКО предлагают проводить регистрацию отведения V4R во всех случаях шока (или даже у всех больных с острым инфарктом миокарда), поскольку наличие в нем подъема сегмента ST достаточно характерно для инфаркта указанной локализации. При вовлечении в зону некроза правого желудочка по возможности следует исключить применение вазодилататоров (наркотические анальгетики, нитраты, мочегонные и ингибиторы АПФ). Во многих случаях повышению АД способствует увеличение преднагрузки для правого желудочка с помощью быстрого внутривенного введения жидкости (например, 200 мл физиологического раствора в течение 10 мин, далее инфузия 1 – 2 л за несколько часов, в дальнейшем 200 мл/ч). Подобное лечение требует тщательного наблюдения за состоянием гемодинамики и в случае недостаточной его эффективности рекомендуют начать инфузию добутамина. Необходимо также пытаться сохранить полноценную систолу правого предсердия (устранять пароксизмы мерцательной аритмии, проводить двухкамерную стимуляцию сердца при наличии атриовентрикулярных блокад высокой степени).
Увеличить число выживших больных могут, как полагают, прямая ангиопластика или оперативное вмешательство, предпринятые в ранние сроки заболевания (класс IIa). В качестве временной меры при ожидании этих вмешательств рассматривается проведение внутриаортальной баллонной контрапульсации.
3. Разрыв миокарда.
В случаях, когда разрыв свободной стенки сердца не приводит к немедленной смерти от электромеханической диссоциации (сохраняющаяся электрическая активность сердца в отсутствие пульса) единственным мероприятием по спасению жизни больного является немедленное оперативное вмешательство.
При появлении дефекта межжелудочковой перегородки указывается на возможность применения вазодилататоров (в частности, инфузии нитроглицерина) в отсутствие шока, однако, наиболее эффективным мероприятием является внутриаортальная баллонная контрапульсация. Подчеркивается, что при наличии кардиогенного шока только немедленная операция дает больному шанс на выживание.
4. Регургитация в митральном клапане.
При наличии кардиогенного шока, отека легких в сочетании с тяжелой митральной регургитацией показано немедленное оперативное вмешательство, при подготовке к которому целесообразно проводить внутриаортальную баллонную контрапульсацию. В менее тяжелых случаях при наличии застоя в легких экспертами ЕКО наибольшее значение придается восстановлению проходимости инфаркт-связанной артерии (при помощи тромболитической терапии или прямой ангиопластики).
5. Нарушения ритма.
Желудочковые экстрасистолы и короткие пароксизмы желудочковой тахикардии, которые хорошо переносятся, специального лечения не требуют. Для лечения более длительных пароксизмов, способных вызвать снижение АД и сердечную недостаточность, препаратом выбора является лидокаин. Первым мероприятием для устранения желудочковой тахикардии с выраженным нарушением гемодинамики (гипотония, отек легких) или стенокардией, так же как и фибрилляции желудочков, является нанесение электрического разряда. В рекомендациях АКК/ААС отмечено, что данных для определения оптимального способа предупреждения повторного возникновения этих угрожающих жизни аритмий недостаточно. Указывают на целесообразность коррекции содержания электролитов в крови, кислотно-щелочного баланса и применения бета-блокаторов. В случаях, когда начата инфузия лидокаина, следует рассмотреть возможность ее прекращения через 6 – 24 ч (вмешательства класса IIa).
От желудочковой тахикардии следует отличать ускоренный идиовентрикулярный ритм, являющийся бе
Современная стратегия лечения нестабильной стенокардии и острого инфаркта миокарда
5 февраля 2003 года в Главном военном клиническом госпитале состоялась научно-практическая конференция, посвященная современному состоянию лечения острых коронарных синдромов. Конференция прошла при поддержке компании «Авентис Фарма», на ней прозвучали доклады ведущих отечественных специалистов в области интенсивной кардиологии. Вниманию присутствующих были представлены последние рекомендации Европейского общества кардиологов по лечению острых каронарных синдромов (ОКС) со стойкой элевацией сегмента ST. Программа конференции была построена таким образом, что последовательно освещала все аспекты терапии ОКС, которые мы и представляем вашему вниманию.
 С докладом «Современные программы лечения острого коронарного синдрома» выступил доктор медицинских наук, профессор Института кардиологии АМН Украины им. Н. Д. Стражеско Валентин Александрович Шумаков. Он обратил внимание на несоответствие украинской и международной статистики уровней заболеваемости и смертности от ИБС. Так, в США заболеваемость острым инфарктом миокарда (ОИМ) составляет 440 на 100 тыс. населения, в Украине — только 115. Смертность от ОИМ в Украине — 19 на 100 тыс. населения, в то время как в Англии этот показатель — 127, в Швеции — 154. Такое положение объясняется недостаточной выявляемостью острой ИБС во всех регионах Украины. Поэтому ранняя диагностика ОКС и их своевременное грамотное лечение имеют первостепенное значение для снижения смертности от ОИМ и ИБС в целом. Кроме того, финансовые средства для лечения этих больных планируются, исходя из имеющихся заниженных статистических данных.
С докладом «Современные программы лечения острого коронарного синдрома» выступил доктор медицинских наук, профессор Института кардиологии АМН Украины им. Н. Д. Стражеско Валентин Александрович Шумаков. Он обратил внимание на несоответствие украинской и международной статистики уровней заболеваемости и смертности от ИБС. Так, в США заболеваемость острым инфарктом миокарда (ОИМ) составляет 440 на 100 тыс. населения, в Украине — только 115. Смертность от ОИМ в Украине — 19 на 100 тыс. населения, в то время как в Англии этот показатель — 127, в Швеции — 154. Такое положение объясняется недостаточной выявляемостью острой ИБС во всех регионах Украины. Поэтому ранняя диагностика ОКС и их своевременное грамотное лечение имеют первостепенное значение для снижения смертности от ОИМ и ИБС в целом. Кроме того, финансовые средства для лечения этих больных планируются, исходя из имеющихся заниженных статистических данных.
В. А. Шумаков коротко осветил основные этапы патогенеза ОКС. Не вдаваясь в подробности, напомним, что основными последствиями разрыва атеросклеротической бляшки являются выделение тканевого фактора, образование тромбина, агрегация тромбоцитов с последующим формированием фибринового сгустка, что приводит к тромбозу венечных артерий и ишемическим осложнениям. Поэтому основными медикаментозными и интервенционными вмешательствами считаются воздействия на три вышеназванных патологических процесса. Основной метод воздействия на процесс образования тромба — блокирование синтеза тромбина и подавление агрегации тромбоцитов. Основными средствами антитромбиновой терапии являются нефракционированный гепарин (НФГ) и низкомолекулярные гепарины (НМГ). О фибринолитической терапии речь пойдет ниже. Говоря о патофизиологии, дестабилизации атеросклеротической бляшки, докладчик обратил особое внимание на роль воспаления как системного, так и местного, которому придается очень большое значение. Наиболее доступный маркер, характеризующий острую фазу воспаления, — С-реактивный белок (СРБ). В ряде крупных исследований последнего десятилетия обнаружено, что повышение СРБ у больных с ОКС сопряжено с увеличением риска развития осложнений, повторных сосудистых катастроф и летальности.
Прежде чем перейти к характеристике отдельных групп лекарственных препаратов, используемых для лечения больных с ОКС без элевации сегмента ST, профессор остановился на стратегии ведения пациентов с ОКС, которая изображена на рисунке.
Характеризуя рекомендации по лечению нестабильной стенокардии и инфаркта миокарда без зубца Q (мелкоочаговый), то есть острого коронарного синдрома без подъема сегмента ST, наибольшее внимание докладчик уделил антитромбиновой терапии. Он проанализировал результаты нескольких крупных исследований последних лет (FRIC, ESSENCE, TIMI 11B, FRAX.I.S), в которых сопоставлялась эффективность инфузии НФГ и подкожного введения НМГ на фоне лечения аспирином. В этих исследованиях сравнивали такие НМГ, как дальтепарин, эноксапарин и надропарин. В проведенных исследованиях только при использовании эноксапарина (Клексана) получен позитивный результат, свидетельствующий о преимуществах НМГ (Клексана) по сравнению с НФГ. Так, в исследовании ESSENCE (1997) авторы обнаружили снижение «тройной конечной точки» (суммация частоты развития смерти, ОИМ и рецидивирующая стенокардия) на 14-30-е сутки наблюдения в группе пациентов, которым применяли НМГ, — в 19,8% случаев, в группе применения НФГ — в 23,3% (p<0,02) с сохранением различий вплоть до года наблюдения. В исследовании TIMI 11B (1998), где использовали эноксапарин по модифицированной схеме введения, также получены доказательства преимущества этого препарата перед НФГ. Таким образом, из всех НМГ доказанными преимуществами перед использованием НФГ в лечении ОКС без элевации сегмента ST обладает только эноксапарин (Клексан), что делает его препаратом выбора у этой группы больных.
 Тему лечения острых коронарных синдромов с элевацией сегмента ST продолжил член-корреспондент АМН Украины, доктор медицинских наук, заведующий кафедрой пропедевтики внутренних болезней № 1 НМУ им. А. А. Богомольца, профессор Василий Захарович Нетяженко. Его доклад «Тромболитическая терапия острого Q-инфаркта миокарда: современный взгляд на проблему» базировался на самых последних рекомендациях Европейского общества кардиологов (2003) по лечению острого инфаркта миокарда с элевацией сегмента ST. Особая актуальность этого доклада была подкреплена планами компании «Авентис» обеспечить украинский рынок препаратом Стрептаза в конце февраля текущего года, так как ситуация с тромболитиками в нашей стране общеизвестна, и появление относительно дешевого качественного препарата смогло бы в корне изменить положение. Василий Захарович заметил, что реперфузионная терапия (фармакологическая или механическая) показана всем пациентам с клиническими симптомами инфаркта миокарда и стойкой элевацией сегмента ST или вновь возникшей блокадой левой ножки пучка Гиса (ЛНПГ) при длительности болевого синдрома меньше 12 часов и при отсутствии абсолютных противопоказаний к ее проведению. Фибринолитические средства подразделяются на фибринспецифические: t-PA — альтеплаза, r-PA — ретеплаза, n-PA — ланотеплаза, TNK-tPA — тенектеплаза и фибриннеспецифические: стрептокиназа (Стрептаза), анистреплаза (APSAC), урокиназа. Фармакологические свойства наиболее часто используемых фибринолитических средств представлены в таблице 1.
Тему лечения острых коронарных синдромов с элевацией сегмента ST продолжил член-корреспондент АМН Украины, доктор медицинских наук, заведующий кафедрой пропедевтики внутренних болезней № 1 НМУ им. А. А. Богомольца, профессор Василий Захарович Нетяженко. Его доклад «Тромболитическая терапия острого Q-инфаркта миокарда: современный взгляд на проблему» базировался на самых последних рекомендациях Европейского общества кардиологов (2003) по лечению острого инфаркта миокарда с элевацией сегмента ST. Особая актуальность этого доклада была подкреплена планами компании «Авентис» обеспечить украинский рынок препаратом Стрептаза в конце февраля текущего года, так как ситуация с тромболитиками в нашей стране общеизвестна, и появление относительно дешевого качественного препарата смогло бы в корне изменить положение. Василий Захарович заметил, что реперфузионная терапия (фармакологическая или механическая) показана всем пациентам с клиническими симптомами инфаркта миокарда и стойкой элевацией сегмента ST или вновь возникшей блокадой левой ножки пучка Гиса (ЛНПГ) при длительности болевого синдрома меньше 12 часов и при отсутствии абсолютных противопоказаний к ее проведению. Фибринолитические средства подразделяются на фибринспецифические: t-PA — альтеплаза, r-PA — ретеплаза, n-PA — ланотеплаза, TNK-tPA — тенектеплаза и фибриннеспецифические: стрептокиназа (Стрептаза), анистреплаза (APSAC), урокиназа. Фармакологические свойства наиболее часто используемых фибринолитических средств представлены в таблице 1.
В. З. Нетяженко привел факты о преимуществах фибринолитической терапии (ФЛТ): при ее проведении в первые 6 часов удается избежать 30 летальных исходов дополнительно на 1000 тромболизисов; в первые 7-12 часов — дополнительно 20 летальных исходов. Несмотря на противоречивые данные об эффективности ФЛТ у пациентов старше 75 лет, согласно результатам последнего метаанализа, она достоверно снижает смертность с 29,4 до 26% (р=0,03).
Относительно сроков проведения ФЛТ профессор привел следующие факты: каждый час промедления ФЛТ увеличивает вероятность летального исхода на 1,6 смертей на 1000 тромболизисов; начало тромболизиса на протяжении часа позволяет сохранить 80 жизней дополнительно на каждые 1000 тромболизисов; в метаанализе H. Boersma показано, что раннее (до 2 часов) проведение ФЛТ снижает риск смерти на 44%, в то время как проведение ФЛТ в первые 3-12 часов только на 20%.
Аспирин следует назначать всем пациентам при отсутствии противопоказаний.
Основные режимы проведения ФЛТ приведены в таблице 2.
Сравнивая фибринолитические средства, изучавшиеся в трех крупных многоцентровых исследованиях, профессор отметил следуещее.
- В исследованиях GISSI-2 и ISIS-3 не выявлено каких-либо различий в эффективности стрептокиназы, t-PA и анистреплазы.
- В исследовании GUSTO-1 установлено, что ускоренный режим введения t-PA обусловливает лучший клинический результат, восстанавливая перфузию коронарных артерий, однако он сопровождается достоверно большим количеством геморрагических инсультов в сравнении с использованием стрептокиназы.
- Выбор фибринолитического агента необходимо проводить с учетом степени индивидуального риска, доступности препарата и его стоимости.
- По результатам метаанализа трех вышеназванных исследований (R. Collins et al. 1997) обнаружена статистически эквивалентная клиническая эффективность стрептокиназы, t-PA и r-PA.
В то же время стоимость проведения тромболизиса с использованием Стрептазы в 4 раза ниже, чем при использовании t-PA.
Абсолютными противопоказаниями для проведения ФЛТ являются:
- геморрагический инсульт или инсульт неизвестной этиологии;
- ишемический инсульт в предыдущие 6 месяцев;
- повреждения или опухоли ЦНС;
- недавние травмы/операции в области головы (в предыдущие 3 недели);
- гастроинтестинальные кровотечения за последний месяц;
- нарушения, приводящие к кровотечениям;
- диссекция аорты.
Относительные противопоказания для проведения ФЛТ следующие:
- транзиторная ишемическая атака в предыдущие 6 месяцев;
- применение пероральных антикоагулянтов;
- беременность или первая неделя послеродового периода;
- пункция сосудов без компрессии;
- травматические реанимационные мероприятия;
- неконтролированная артериальная гипертензия (САД > 180 мм рт. ст.);
- прогрессирующие заболевания печени;
- инфекционный эндокардит;
- язва желудка в активной фазе.
В заключение В. З. Нетяженко обратил внимание на интересный факт: тромболитическая терапия и первичная транслюминальная ангиопластика (ТЛАП) согласно рекомендациям ESC 2003 имеют уровень доказательств А (данные, полученные во многих рандомизированных клинических испытаниях или с использованием метаанализа) и относятся к I классу, поэтому абсолютно показаны пациентам с симптомами ОИМ до 12 часов и сопровождаются элевацией сегмента ST или блокадой ЛНПГ, то есть эти методы реперфузии находятся на одном уровне.
 Тему лечения Q-инфаркта миокарда продолжила член-корреспондент АМН Украины, доктор медицинских наук, заведующая кафедрой госпитальной терапии № 1 НМУ им. А. А. Богомольца, профессор Екатерина Николаевна Амосова. В докладе «Современная стратегия антитромботической терапии при Q-инфаркте миокарда» она подчеркнула значимость реканализации коронарной артерии для повышения выживаемости больных. Так, в гипотезе «открытой артерии», которую сформулировал E. Braunwald в 1989 году, подчеркивается важное значение реканализации артерии не только в ранний, но и в поздний (от 6 до 12 часов) период заболевания, так как выживаемость больных увеличивается благодаря некрозонезависимым механизмам (уменьшение ремоделирования ЛЖ). Положительное влияние на показатели выживаемости «открытой» артерии сохраняется не только в госпитальный период (30 дней), но и в более отдаленный период, поэтому значение тромболизиса в лечении больных Q-инфарктом миокарда трудно переоценить, что подчеркивал J. Trent (1995): «После дефибриллятора тромболизис является самым крупным достижением в лечении ОИМ». Оптимальной реперфузии после тромболизиса препятствуют: остаточный тромбоз коронарной артерии (КА), остаточный стеноз КА, феномен отсутствия реперфузии на уровне тканей при «открытой» КА и ретромбоз. Первые два фактора можно уменьшить, если использовать первичную ТЛАП. Методов воздействия на тканевую реперфузию на сегодняшний день не существует, поэтому наиболее важным направлением терапии, цель которой — предотвращение реокклюзии КА — профилактика ретромбоза, и поэтому очень важной частью современного лечения ОИМ является антитромботическая терапия. Необходимо также учесть, что ретромбоз очень часто протекает бессимптомно. В ряде исследований (TAMI-5, 1991; GAUS, 1989) показано, что именно фибринспецифические тромболитики приводили к увеличению частоты ретромбоза. В настоящее время дополнительная (адъювантная) антитромботическая терапия при тромболизисе включает следующие препараты.
Тему лечения Q-инфаркта миокарда продолжила член-корреспондент АМН Украины, доктор медицинских наук, заведующая кафедрой госпитальной терапии № 1 НМУ им. А. А. Богомольца, профессор Екатерина Николаевна Амосова. В докладе «Современная стратегия антитромботической терапии при Q-инфаркте миокарда» она подчеркнула значимость реканализации коронарной артерии для повышения выживаемости больных. Так, в гипотезе «открытой артерии», которую сформулировал E. Braunwald в 1989 году, подчеркивается важное значение реканализации артерии не только в ранний, но и в поздний (от 6 до 12 часов) период заболевания, так как выживаемость больных увеличивается благодаря некрозонезависимым механизмам (уменьшение ремоделирования ЛЖ). Положительное влияние на показатели выживаемости «открытой» артерии сохраняется не только в госпитальный период (30 дней), но и в более отдаленный период, поэтому значение тромболизиса в лечении больных Q-инфарктом миокарда трудно переоценить, что подчеркивал J. Trent (1995): «После дефибриллятора тромболизис является самым крупным достижением в лечении ОИМ». Оптимальной реперфузии после тромболизиса препятствуют: остаточный тромбоз коронарной артерии (КА), остаточный стеноз КА, феномен отсутствия реперфузии на уровне тканей при «открытой» КА и ретромбоз. Первые два фактора можно уменьшить, если использовать первичную ТЛАП. Методов воздействия на тканевую реперфузию на сегодняшний день не существует, поэтому наиболее важным направлением терапии, цель которой — предотвращение реокклюзии КА — профилактика ретромбоза, и поэтому очень важной частью современного лечения ОИМ является антитромботическая терапия. Необходимо также учесть, что ретромбоз очень часто протекает бессимптомно. В ряде исследований (TAMI-5, 1991; GAUS, 1989) показано, что именно фибринспецифические тромболитики приводили к увеличению частоты ретромбоза. В настоящее время дополнительная (адъювантная) антитромботическая терапия при тромболизисе включает следующие препараты.
- Антитромбиновые — гепарин, низкомолекулярные гепарины, прямые ингибиторы тромбина, непрямые антикоагулянты.
- Антитромбоцитарные — ингибиторы ТхА2 -агрегации, блокаторы GP IIb/IIIa-рецепторов.
Анализ различных средств адъювантной антитромботической терапии Е. Н. Амосова начала с гепарина. Опираясь на данные некоторых крупномасштабных клинических исследований, она привела рекомендации по назначению гепарина у больных с Q-инфарктом миокарда (АНА/АСС, 1999).
- ТЛАП.
- Тромболизис тканевым активатором плазминогена (ТАП). Внутривенно 60 ЕД/кг (макс. 4000 ЕД) одновременно с ТАП, затем 12 ЕД/кг/час (макс. 1000 ЕД/час), АЧТВ 50-70 с, в течение 48 часов.
- Тромболизис фибриннеспецифическими препаратами у больных с повышенным риском артериальной и венозной тромбоэмболии. Внутривенно капельно, начиная с 4-6 часов после начала тромболизиса, при АЧТВ < 70 с, минимум 48 часов (IIа класс).
- Во всех остальных случаях ИМ у больных с повышенным риском тромбоэмболии внутривенно, у остальных — подкожно 7500 ЕД 2 раза в сутки (IIв класс).
Говоря о недостатках НФГ, особое внимание Е. Н. Амосова обратила на узость терапевтического окна при использовании гепарина (АЧТВ 50-70 с), выходя за пределы которого увеличивается летальность. Второй проблемой при использовании НФГ является отсутствие лабораторного показателя, который бы четко коррелировал с его клинической эффективностью и риском геморрагических осложнений, АЧТВ — только первое приближение к такому показателю. В свете вышесказанного напомним о преимуществах низкомолекулярных гепаринов.
- Лучше действует на тромбин, связанный с фибрином.
- Лучше тормозит гемостаз на уровне фактора Ха.
- Практически не связывается с белками плазмы и ТР4.
- Предсказуемый и стойкий гипокоагуляционный эффект.
- П/к введение в фиксированных дозах 1-2 раза в сутки.
- Не требует лабораторного контроля.
- Практически не вызывает активацию тромбоцитов, меньший риск развития тромбоцитопении и тромбозов.
К настоящему времени накоплено множество данных об использовании эноксапарина (ЭН) в качестве адъювантной терапии при тромболизисе. Обобщенно они представлены ниже (> — более эффективен, = — равноэффективен).
- Проходимость КА TIMI-3, 90 мин — ранняя проходимость КА: ЭН=НФГ (HART-2, ENTIRE-TIMI).
- Проходимость КА TIMI-3, 7-е сутки — поздняя проходимость КА: ЭН>НФГ (HART-2).
- Рецидив ИМ и рефрактерная ишемия: ЭН>НФГ (AMI-SK, ASSENT-3).
- Летальность: ЭН=НФГ (все исследования).
- Тяжелые кровотечения (в том числе внутричерепные): ЭН=НФГ (все исследования).
Из вышеизложенного видно, что, помимо преимуществ, присущих низкомолекулярным гепаринам, эноксапарин (Клексан) эффективнее в отношении проходимости коронарной артерии в поздние сроки, рецидива ИМ и рефрактерной ишемии у больных, которым проводился тромболизис как фибринспецифическими, так и фибриннеспецифическими тромболитиками. Это позволяет считать его препаратом выбора в качестве адъювантной терапии при тромболизисе. Проведенное пилотное исследование S. Baird et al. (2002), в котором сравнивали эноксапарин (Клексан) с гепарином во время тромболизиса, показало достоверное снижение частоты смерти+нефатального ре-ИМ+нефатальной нестабильной стенокардии (НС) в группе Клексана (25% против 36% в группе гепарина).
В исследовании AMI-SK (2002) было доказано, что совместное применение Стрептазы и Клексана при остром инфаркте миокарда позволяет на 36% снизить частоту смерти, реинфаркта и рефрактерной стенокардии в сравнении с группой, получавшей терапию только Стрептазой. В частности, показано, что дополнительная терапия эноксапарином приводит к достоверно лучшему восстановлению проходимости коронарной артерии на 5-10-е сутки и достоверно более быстрой резолюции сегмента ST на ЭКГ.
В исследовании ASSENT-3, где эноксапарин комбинировался с фибринспецифическим тромболитиком — тенектеплазой, на большом числе пациентов (более 6000) было доказано, что частота возникновения «тройной конечной точки» (смерть, реинфаркт и рефрактерная стенокардия) была статистически достоверно меньше (на 26%) в группе эноксапарина, в сравнении с гепарином.
Интересным направлением с точки зрения патофизиологии Е. Н. Амосова назвала использование прямых ингибиторов тромбина. Теоретически их преимущества следующие: они ингибируют тромбин, независимо от антитромбина III, частично инактивируют тромбин, не инактивируются белками плазмы и ТФ-4.
В клиническом испытании TIMI-5 (1994) гирудин показал преимущество перед гепарином только в отношении снижения частоты летальных исходов или рецидива ИМ в госпитальном периоде.
Очень впечатляющие данные получены при использовании непрямых антикоагулянтов для предотвращения реокклюзии после тромболизиса. Так, в исследовании APRICOT-2 (2000) показано повышение показателей выживаемости без коронарных событий в группе, которая, помимо аспирина, получала кумадин. В исследовании ASPECT-2 (2000) показано достоверное уменьшение общей летальности не только при комбинации аспирина и кумадина (3,8% против 4,5%), но и при использовании только одного кумадина (1,2% против 4,5% в группе аспирина). Несмотря на некоторые преимущества непрямых антикоагулянтов, они пока не вошли в рекомендации для долговременного применения после ОКС.
Из антитромботических препаратов в клинической практике довольно широко применяются ингибиторы GP IIb/IIIa-рецепторов тромбоцитов. Теоретической предпосылкой к их назначению является то, что именно эти рецепторы обеспечивают агрегацию тромбоцитов между собой при помощи фибриногеновых мостиков. Об этом свидетельствуют данные ряда исследований, в которых показаны преимущества в отношении влияния на коронарную проходимость при использовании эптифибатида. В исследовании ASSENT-3 (2001) не было получено данных о снижении показателей летального исхода, повторного ИМ или рефрактерной ишемии в группе больных, которым назначали четырехкомпонентную схему антитромботической терапии с добавлением абсиксимаба по сравнению с группой больных, получавших полную дозу тенектеплазы и Клексан, особенно, если учитывать процент больных, у которых не было геморрагических осложнений. Таким образом, несмотря на теоретические предпосылки, эти препараты пока не используют в клинической практике для профилактики реокклюзии КА. Перспективным в этом отношении должен стать синтез ингибиторов Ib-рецепторов тромбоцитов.
На сегодняшний день в лечении ОИМ имеются огромные достижения, однако каждый последующий шаг на пути понимания патогенеза развития ОКС и совершенствования методов терапии дается все большими усилиями и сопровождается снижением выживаемости больных.