Ведение больных с острым инфарктом миокарда
При остром инфаркте миокарда можно выделить два основных типа осложнений — это осложнения, обусловленные электрической нестабильностью (аритмии) и механические (насосная недостаточность). Наиболее частой причиной аритмической смерти при остром инфаркте миокарда служит фибрилляция желудочков. Большинство больных с фибрилляцией желудочков умирают в первые 24 ч после появления симптомов, а более половины из них — в течение первого часа. Хотя желудочковая экстрасистолия или желудочковая тахикардия нередко предшествуют фибрилляции желудочков. последняя может развиваться и без предшествующих аритмий. Это наблюдение дало повод использовать лидокаин для профилактики .спонтанной фибрилляции желудочков при остром инфаркте миокарда. Поэтому акцент лечебной тактики сместился от реанимационных мероприятий к предупреждению ситуаций, при которых возникает необходимость в подобных мероприятиях. Это привело к тому, что за последние два десятилетия частота первичной фибрилляции желудочков понизилась. Снижение смертности в больничных-условиях при остром инфаркте миокарда с 30 % до 10 % в значительной степени было результатом таких организационных мер, как быстрая доставка больных с острым инфарктом миокарда в лечебные учреждения, оборудованные устройствами для мониторирования ЭКГ и укомплектованные персоналом (не обязательно с высшим медицинским образованием), способным быстро распознать опасные для жизни желудочковые аритмии и сразу же назначить соответствующее лечение.
Авторы: Целуйко В.И. Харьковская медицинская академия последипломного образования МЗ Украины
Версия для печати
Развитие фарминдустрии, проведение огромного количества клинических исследований лежат в основе тенденции, наметившейся в последние годы, — более частого пересмотра рекомендаций. При этом иногда изменения бывают незначительны и касаются какого-то одного раздела. Такой подход не распространяется на рекомендации по ведению больных с инфарктом миокарда, принятые Европейским обществом кардиологов в 2007–2008 годах, так как в них действительно очень много нового и коррекция касается не только медикаментозных подходов.
На наш взгляд, следует остановиться на нескольких направлениях, которые претерпели существенные изменения:
— новые диагностические критерии;
— новая классификация;
— новые рекомендации по медикаментозной терапии (антитромбоцитарной, антитромбиновой, гиполипидемической).
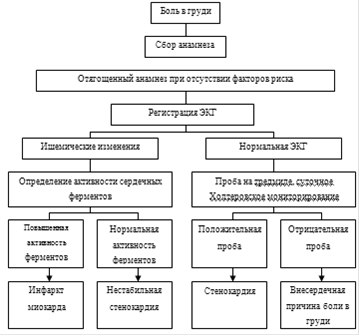
В основу определения положен главный признак, который отличает ишемию от инфаркта, — наличие некроза миокарда: «Инфаркт миокарда (ИМ) — смерть кардиомиоцитов, обусловленная длительно сохраняющейся ишемией». В связи с этим выдвинут тезис, что диагноз ИМ правомерен только в случае, если на фоне острой ишемии повышается уровень биомаркеров гибели кардиомиоцитов. И если раньше, согласно рекомендациям ВОЗ, подтверждением диагноза ИМ было наличие 2 из 3 диагностических критериев (характерная клиника, ЭКГ-критерии, маркеры повреждения), то согласно новым рекомендациям ключевыми являются маркеры повреждения. «Диагноз ИМ рекомендовано использовать только в тех случаях, когда имеются свидетельства некроза миокарда (прежде всего серологические), который однозначно связан с ишемией миокарда, с характерными клиническими проявлениями, либо имеются признаки ИМ при аутопсии».
Золотым стандартом диагностики некроза миокарда сегодня является тропонин, а ИМ устанавливается при повышении уровня биомаркеров (тропонина) в сочетании как минимум с одним критерием:
— клинические признаки ишемии;
— ЭКГ (новая ишемия, новая блокада ЛНПГ, появление/увеличение патологического Q);
— инструментальные подтверждения утраты участка жизнеспособного миокарда или новых нарушений локальной сократимости миокарда.
В качестве инструментальных методов, подтверждающих инфаркт миокарда, могут быть использованы: эхокардиография, радионуклидная вентрикулография, сцинтиграфия миокарда, магнитно-резонансная томография, компьютерная томография, позитронно-эмиссионная томография.
Тропонины следует определять минимум 2 раза — при поступлении и через 6–9 часов. Необходимость в повторном исследовании обусловлена, с одной стороны, низкой информативностью показателя в случае раннего определения — до 6 часов после начала болевого синдрома, с другой — возможностью наличия ложноположительного результата. Ложноположительный тропониновый тест возможен при различных заболеваниях миокарда, если наблюдается гибель кардиомиоцитов (гипертрофическая кардиомиопатия, миокардит, застойная сердечная недостаточность), при расслоении аорты, тромбоэмболии легочной артерии, тяжелой легочной гипертензии, острой цереброваскулярной патологии, критических состояниях (сепсис, ожоги, хроническая почечная недостаточность, травма и т.д). В случае наличия хронического заболевания повышение тропонина носит более стабильный характер.
Вторым биохимическим маркером, который может быть использован для верификации ИМ, является креатинфосфокиназа (КФК) и ее МВ-фракция. Тест проводят минимум 2 раза (при поступлении и через 6–9 часов), если уровень не повышен, при наличии клинических признаков контроль МВ-КФК проводят через 12 и 24 часа.
МВ-КФК можно использовать для диагностики рецидива ИМ, признаком которого является увеличение показателя в 2 раза по сравнению с нормой или на 20 % по сравнению с первым анализом.
В последних рекомендациях снижено значение изменений на ЭКГ как метода верификации ИМ. Подчеркивается, что «ЭКГ-критерии не рассматриваются как базисные для диагностики ИМ, они не специфичны и дают ценную диагностическую информацию только в сочетании с клиническими, лабораторными и инструментальными признаками». При этом приведены половые отличия в ЭКГ-критериях инфаркта миокарда (табл. 1).

В рекомендациях также приведены ЭКГ-признаки ИМ, перенесенного ранее:
— любой зубец Q в отведениях V2–V3 і 0,02 с;
— комплекс QS в отведениях V2–V3;
— зубец Q продолжительностью ≥ 0,03 с и глубиной ≥ 0,1 mV;
— комплекс QS в отведениях I, II, aVL, aVF или V4–V6 в любых двух из смежных отведений (I, aVL, V6; V4–V6; II, III, aVF);
— зубец R продолжительностью ≥ 0,04 с в отведениях V1–V2 и с соотношением R/S ≥ 1 в сочетании с конкордантным позитивным зубцом Т при отсутствии нарушения проводимости.
Принципиально новой является клиническая характеристика. согласно которой выделяют следующие типы ИМ.
Тип 1. Спонтанный ИМ, обусловленный ишемией вследствие первичного коронарного события (эрозия, разрыв, трещина или расслоение бляшки).
Тип 2. ИМ, развившийся вторично на фоне признаков коронарной недостаточности (несоответствие потребности и доставки): спазм, эмболия, аритмия, анемия, АГ или гипотензия.
Тип 3. Внезапная сердечная смерть, в том числе остановка сердца.
Критерии диагностики
Внезапная смерть, которой предшествовали:
1. Симптомы, свидетельствующие об ишемии миокарда.
2. Предположительно новый подъем сегмента ST.
3. Новая блокада левой ножки пучка Гиса.
4. Признаки свежего тромба в коронарной артерии (КА) по данным ангиографии (и/или аутопсии).
Если смерть наступила либо до того, как мог быть произведен забор крови, либо до того, как имело место возрастание уровня кардиальных биомаркеров в крови.
Тип 4а и 4б. ИМ, связанный с инвазивными вмешательствами.
4а — инфаркт миокарда, ассоциированный с чрескожными вмешательствами (ЧКВ).
В случае выполнения ЧКВ у больного с нормальным исходным уровнем тропонинов и повышением биомаркеров более чем в 3 раза после вмешательства.
При исходно высоком уровне тропонинов ориентируются на клинику, ЭКГ и визуализирующие методы.
4б — инфаркт миокарда, ассоциированный с тромбозом стента.
Аналогично 4а, но на фоне ранее выполненного ЧКВ при условии тромбоза стента, документированного результатами ангиографии или аутопсии.
Тип 5. ИМ, ассоциированный с выполненным аортокоронарным шунтированием (АКШ).
В случае проведения АКШ у больных с нормальными исходными уровнями тропонинов повышение сердечных биомаркеров более чем в 5 раз в сочетании с одним из критериев:
1. Новые патологические зубцы Q.
2. Новая блокада ЛНПГ.
3. Ангиографически документированная новая окклюзия шунта или КА.
4. Визуализирующие свидетельства утраты жизнеспособного миокарда.
Контроль уровня биомаркеров при неинвазивных и инвазивных вмешательствах необходимо проводить: непосредственно перед процедурой или сразу после нее, через 6–12 и 18–24 часа.
Новое в рекомендациях по инфаркту миокарда без элевации сегмента ST
Принципиальные изменения, которые послужили поводом для пересмотра рекомендаций по NSTEMI в 2007 году, касались подходов к антитромбиновой и антитромбоцитарной терапии.
Антитромбиновая терапия
1. Рекомендована всем пациентам дополнительно к антитромбоцитарной (I-А).
2. Антикоагулянты должны назначаться с учетом риска ишемии/кровотечения (I-В).
3. Фондапаринукс (арикстра) рассматривается как базисная терапия NSTEMI (I-A).
4. Больным высокого риска (планируемая РСI) — НФГ, эноксапарин или бивалирудин.
Обращает на себя внимание, что среди антитромбиновых препаратов появился фондапаринукс (арикстра) (назначается в дозе 2,5 мг п/к 1 раз в день), и выбор средства зависит от степени риска больного (у больных высокого риска предпочтение следует отдавать эноксапарину).
Пациенты высокого риска:
3) стеноз при ангиографии;
4) динамика сегмента ST;
5) более 2 приступов стенокардии за сутки;
6) использование аспирина в пределах 7 дней;
7) повышение маркеров повреждения.
Рекомендации по антитромбоцитарной терапии
1. Аспирин 160–325 мг (незащищенный), поддерживающая 75–100 мг.
2. Нагрузочная доза клопидогреля 300–600 мг, поддерживающая — 75 мг.
3. Аспирин (защищенный) + клопидогрель 12 месяцев.
Если сравнивать данные рекомендации с предыдущей версией, обращает на себя внимание, что при назначении нагрузочной дозы аспирина должны быть использованы незащищенные формы, а для длительного приема следует рекомендовать защищенные. Кроме того, увеличена продолжительность приема двойной антитромбоцитарной терапии (аспирин + клопидогрель) до года после перенесенного ИМ.
В новых рекомендациях расширены показания для ИАПФ (или сартанов в случае непереносимости ИАПФ): передний инфаркт миокарда, артериальная гипертензия, сахарный диабет и сердечная недостаточность дополнены заболеваниями почек.
Включение липидоснижающей терапии (статинов) в схему лечения ИМ стало обязательным:
— рекомендовано всем больным с NSTEMI (при отсутствии противопоказаний), независимо от уровня ХС на 1–4-й день с целью снижения ХС ЛПНП ниже 100 мг/дл (I-В);
— интенсивная липидоснижающая терапия (ХС ЛПНП ниже 70 мг/дл) в течение 10 дней (IIа-В).
Новое в рекомендациях по инфаркту миокарда с элевацией сегмента ST
Как и в прежних рекомендациях по инфаркту миокарда с элевацией сегмента ST, ключевым моментом является восстановление кровотока в инфарктзависимой коронарной артерии в наиболее короткие сроки. Поэтому как оптимальные рассматриваются догоспитальный тромболизис или перкутанные вмешательства, если их проведение возможно в период до 90 минут с момента первого контакта с медицинским персоналом. Если нет возможности проведения инвазивного вмешательства или специалистов, которые способны выполнить вмешательство в период до 90 минут, или их квалификация недостаточна, целесообразно проведение фибринолитической терапии в стационаре. Показания к тромболитической терапии не изменились, а противопоказания несколько пересмотрены.
Абсолютные противопоказания:
1. Геморрагический инсульт.
2. Ишемический инсульт в течение последних 6 месяцев.
3. Повреждения или новообразования нервной системы.
4. Значительные травмы, операции, повреждения головы за последние 3 недели.
5. Желудочно-кишечные кровотечения за последний месяц.
6. Доказанные нарушения, сопровождающиеся кровотечением.
7. Расслоение аорты.
Относительные противопоказания:
1. Транзиторные ишемические атаки.
2. Лечение пероральными антикоагулянтами.
3. Беременность или первая неделя после родов.
4. Пункция сосудов, которые не сжимаются.
5. Травматичная реанимация.
6. Рефрактерная гипертензия (САД более 180 мм рт.ст.).
7. Значительные нарушения функции печени.
8. Инфекционный эндокардит.
9. Активная язва.
При выборе фибринолитика преимущество следует отдавать тенектеплазе, использование которой возможно на догоспитальном этапе. Что касается стрептокиназы, то подчеркнуто, что препарат противопоказан в течение 2 лет после предыдущего введения (риск анафилаксии), а в течение 10 лет наблюдается снижение эффекта от повторного введения.
В рекомендациях очень четко высказано отрицательное отношение к нестероидным противовоспалительным препаратам, так как они способны ухудшать прогноз.
Класс 1-А
«Пациенты, постоянно принимающие ЦОГ-2, селективные или неселективные НПВП (кроме аспирина), при развитии ИМ должны немедленно прекратить прием этих препаратов в связи с повышением риска смерти, повторного ИМ, гипертензии, СН и разрыва миокарда, ассоциированных с приемом препарата».
«Стратегией выбора при обезболивании пациентов с ИМ с элевацией является назначение морфина сульфата внутривенно (2–4 мг в качестве первой дозы и по 2–8 мг каждые 5–15 мин (уровень С)»
Пересмотрены подходы к назначению антикоагулянтной терапии при STEMI.
Класс 1
«Пациенты, которым проведен тромболизис, должны получать антикоагулянтную терапию на протяжении как минимум 48 часов (уровень С) и желательно до 8 суток стационарного лечения… При этом рекомендованы режимы антикоагулянтной терапии без нефракционированного гепарина в связи с тем, что применение гепарина более 48 часов повышает риск гепарин-индуцированной тромбоцитопении (уровень А)».
Дозы низкомолекулярных гепаринов не фиксированы, а зависят от возраста больного и состояния выделительной функции почек.
При условии уровня креатинина ниже 2,5 мг/дл у мужчин и 2,0 мг/дл у женщин.
Пациентам до 75 лет — начальная доза 30 мг болюсом в/в, через 15 мин п/к 1 мг/кг, повторно каждые 12 часов.
Пациентам 75 лет и старше — без болюса, 0,75 мг/кг каждые 12 часов.
При условии клиренса креатинина (по формуле Кокрофт — Голта) ниже 30 мл/мин независимо от возраста 1 мг/кг каждые 24 часа.
Введение эноксапарина показано до 8 сут. стационарного лечения.
(Уровень А)
Фондапаринукс
При условии уровня креатинина ниже 3,0 мг/дл.
Начальная доза 2,5 мг внутривенно, в дальнейшем — та же доза в подкожных инъекциях 1 раз в день.
Введение фондапаринукса показано до 8 сут. стационарного лечения.
(Уровень В)
НФГ — болюс 60 МЕ/кг (макс. 4000 ЕД), внутривенная инфузия из расчета 12 МЕ/кг/час (макс. 1000 МЕ/ч), под контролем АЧТВ в пределах 1,5–2 нормы (50–70 с) (уровень С).
Следует отметить, что в новых рекомендациях появился фондапаринукс и исчезли все, кроме эноксапарина, низкомолекулярные гепарины.
В новой редакции акцентируется внимание на необходимости более продолжительного приема комбинированной антитромбоцитарной терапии (аспирин + клопидогрель).
Что касается антиишемической терапии при ИМ, то принципиальных изменений нет. Несколько ограничена группа больных, которые нуждаются в начале терапии с внутривенного введения бета-блокаторов (следует использовать у пациентов с тахикардией и гипертензией).
В разделе, посвященном ведению больных после перенесенного инфаркта миокарда, приведен алгоритм, позволяющий определить тактику лечения больных в зависимости от степени риска. Пациенты высокого риска нуждаются в проведении коронарографии (если она не была проведена в остром периоде) и при необходимости — в реваскуляризации.
Кроме традиционных рекомендаций по модификации образа жизни (отказ от курения, диета с включением 1 г омега-полиненасыщенных жирных кислот, контроль массы тела), в новых рекомендациях есть пункт о необходимости ежегодной вакцинации против гриппа.
В заключение хотелось бы отметить, что пересказывать рекомендации — неблагодарный труд, так как это достаточно субъективно. Более правильно и эффективно познакомиться с ними самостоятельно, согласно ссылкам, приведенным в списке литературы.
Список литературы / References
1. Довженко М.Н. Диагностика и лечение острого коронарного синдрома // Мистецтво лікування. — 2008. — № 6 (52). — С. 12-22.
2. Лікування гострого інфаркту міокарда у пацієнтів з елевацією сегмента ST // Укр. кардіологічний журнал. — 2008. — Додаток 3. — 41 с.
3. Guidelines for the diagnosis and treatment of Non-ST-segment Elevation Acute Coronary Syndromes. The task forces for the diagnosis and treatment non-ST-segment elevation acute coronary syndromes of European Society of Cardiology // EHJ. — 2007. — V. 28. — Р. 1598-1660.
4. Thygesen K. Alpert J.S. White H.D. On behalf of the Joint ESC/ACCF/AHA WHF The task forces for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction // EHJ. — 2007. — V. 28, № 20. — P. 2525-2538.
Рекомендации ESC по ведению больных с инфарктом миокарда с подъемом сегмента ST (2008)
В ноябре 2008 г. было опубликовано долгожданное руководство Европейского общества кардиологов (European Society of Cardiology, ESC) по ведению больных с инфарктом миокарда (ИМ) с подъемом сегмента ST (ST -segment elevation acute myocardial infarction, STEMI) [1]. В общих чертах грядущие обновления были представлены разработчиками на конгрессе ESC (Мюнхен, Германия, 31 августа – 2 сентября) для открытого обсуждения ведущими кардиологами мира еще до официальной публикации в European Heart Journal.
Новое руководство заменяет документ 2003 г. [2], с момента публикации которого произошли существенные перемены в доказательно обоснованных подходах к лечению острого коронарного синдрома (ОКС), в том числе ИМ. Пять лет – немалый срок для современной кардиологии; за это время появились результаты множества новых крупных клинических исследований и метаанализов, а также международных регистров с участием инфарктных больных. Отсюда очевидна необходимость обновления клинических рекомендаций по профилактике и лечению STEMI. Американская ассоциация сердца (American Heart Association, AHA) и Американское общество кардиологов (American College of Cardiology, ACC) также пересмотрели соответствующие рекомендации и опубликовали обновление своего руководства по ведению больных со STEMI в конце 2007 г. [4]. А сегодня мы имеем возможность ознакомиться с обновленным руководством их европейских коллег.
Многие из приведенных рекомендаций ESC по ведению больных со STEMI существенно не изменились с 2003 г. однако новое руководство отличается усиленным акцентированием внимания на скорости оказания квалифицированной неотложной помощи пациенту с ОКС и необходимости организации хорошо налаженной сети служб для оказания такой помощи в как можно более ранние сроки. Наибольшее внимание уделено вопросам реперфузионной терапии – как единственного эффективного способа победить инфаркт еще до развития необратимых изменений в сердечной мышце. Сегодня можно и нужно приложить все усилия для того, чтобы реперфузия проводилась у большинства пациентов со STEMI, стала частью рутинной медицинской помощи, – таков основной посыл документа к практическим врачам и организаторам здравоохранения. При этом беспрецедентно значительное место в реперфузии занимают методики ранних малоинвазивных вмешательств, прежде всего стентирование коронарных артерий. Чрескожные коронарные вмешательства (ЧКВ) названы предпочтительным методом реперфузии в первые 2 ч после первичного контакта медиков с больным со STEMI. Если же проведение ЧКВ в эти сроки недоступно, то необходимо выполнение тромболизиса (либо в стационаре, либо еще на догоспитальном этапе), причем тромболитическая терапия должна быть начата в еще более сжатые сроки – в рамках 30 минут после первичного контакта медиков с больным со STEMI.
Такие рекомендации предъявляют очень высокие требования к организации службы здравоохранения в целом, однако авторы руководства уверены, что внедрение приведенных рекомендаций в клиническую практику станет причиной огромного прорыва в увеличении уровня выживаемости больных с ОКС. В нашем обзоре представлены наиболее важные положения обновленного руководства.
Актуальность
Ишемическая болезнь сердца (ИБС) является самой частой причиной смерти в Европе, обусловливая почти 2 млн смертей ее жителей ежегодно. У половины всех умерших от сердечно-сосудистых заболеваний причиной смерти становится ИБС (на втором месте находится инсульт, который обусловливает треть всех случаев кардиоваскулярной смерти). От ИБС ежегодно погибают 21% мужчин и 22% женщин. Патология коронарных артерий является причиной смерти приблизительно 17% мужчин в возрасте до 65 лет и 12% женщин того же возраста. Такие данные содержатся в отчете европейских специалистов о заболеваемости и смертности от сердечно-сосудистых заболеваний 2008 г. [5]. По сравнению со статистическими данными 2005 г. [6] к настоящему времени в западно-, северо- и южноевропейском регионах отмечено некоторое снижение уровня летальности от ИБС, однако в восточно- и центральноевропейских странах этот показатель, наоборот, существенно возрос.
Около трети всех острых коронарных событий – это инфаркт миокарда с подъемом сегмента ST. 30-50% лиц с ОКС погибают еще на догоспитальном этапе – как правило, в первые минуты после появления симптомов. Причем уровень догоспитальной летальности таких больных за последние несколько лет существенно не изменялся. Напротив, внутрибольничная летальность при ОКС в развитых странах мира значительно уменьшилась за последние десятилетия, и выживаемость больных в стационаре возросла с 75% в 1960-е гг. и 85% в 1980-е гг. до 94-96% в настоящее время. Это произошло благодаря целому ряду достижений интенсивной кардиологии, таких как внедрение в практику специальных отделений для интенсивного лечения ОКС, развитие малоинвазивных технологий, появление и успешное применение современных тромболитиков.
Вместе с тем в настоящее время данные, полученные в крупных регистрах больных с острой коронарной патологией, указывают, что около 20-30% всех лиц со STEMI в Европе все еще не получают реперфузионной терапии ни в каком виде, а для многих из тех, у кого реперфузия проводится, она выходит за границы рекомендуемого «терапевтического окна». Новое руководство ESC призывает активизировать усилия по борьбе с этими проблемами, подчеркивая, что внедрение рекомендуемой стратегии ранней реперфузии в рутинную медицинскую практику даст возможность достичь значительного увеличения выживаемости больных. В нашей стране, к сожалению, ситуация с реперфузионной терапией еще хуже, и тем актуальнее для Украины новые рекомендации ESC, отстаивающие жесткую стратегию своевременного проведения реперфузии у большинства больных со STEMI.
Особенности патогенеза в клиническом контексте
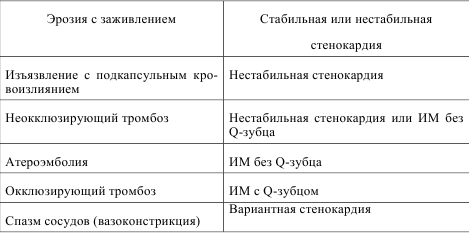
В большинстве случаев причиной STEMI является окклюзия одного из крупных венечных сосудов. Обычно это результат разрыва атеросклеротической бляшки и последующей закупорки артерии тромботическими массами, образовавшимися на поверхности такой бляшки. При этом имеют значение не столько размеры бляшки и степень стеноза сосуда, сколько уязвимость этой бляшки, ее тип, определяющий, стабильна бляшка или подвержена разрыву. Около 3/4 всех случаев ОКС обусловлены разрывом бляшек, которые сами по себе приводили к небольшому или умеренному стенозу коронарных сосудов. В связи с этим отсутствие значительного стеноза венечных артерий по результатам коронароангиографии не может считаться достаточным подтверждением низкого риска развития ОКС.
В дестабилизации атеросклеротических бляшек основное значение имеет активность воспалительного процесса, поэтому определение уровня С-реактивного протеина и интерлейкина-6 – одних из важнейших маркеров воспаления – все более актуально для современной кардиологии. Содержание этих веществ непосредственно коррелирует с клиническими исходами и выживаемостью больных ОКС.
При отсутствии какого-либо, в том числе коллатерального, кровообращения в миокарде необратимые (некротические) изменения в ткани происходят через 15-30 минут. Этим определяются требования к срокам проведения реперфузии.
Кроме атеротромботической окклюзии одной из магистральных артерий, в патогенезе могут играть роль микроэмболизация более дистальных ветвей и сопутствующая вазоконстрикция. Они усугубляют ишемию и ухудшают результаты лечения.
При развитии тромбоза артерии активируются эндогенные фибринолитические механизмы, и вероятность спонтанной реперфузии при инфаркте достаточно высока. По данным систематического обзора рандомизированных исследований E.C. Keeley et al. (2006) у 25-30% пациентов, которые готовились к проведению ЧКВ, во время ангиографического обследования была обнаружена проходимая инфарктобусловившая артерия, что указывало на успешный спонтанный тромболизис еще до проведения ангиографии.
Однако в большинстве случаев окклюзия артерии сохраняется, приводя к гибели около 50% всех больных в течение 1 месяца (причем половина из них умирают в первые 2 ч от начала заболевания).
Согласно результатам крупных клинических исследований и регистров (GRACE, GUSTO, TIMI) наиболее важными предикторами ранней смерти при STEMI признаны пожилой возраст, высокий класс по Killip, тахикардия, низкое систолическое артериальное давление (АД), локализация инфаркта в передней стенке левого желудочка. Менее значимыми, однако также независимыми предикторами худшего прогноза являются перенесенный ранее инфаркт, наличие сахарного диабета (СД), избыточный вес, курение и др.
Особенности организации помощи при ИМ
Авторы руководства акцентируют внимание на предпочтительности проведения ЧКВ. В следующем алгоритме показаны оптимальный (рекомендуемый), приемлемый (но не приоритетный) и нежелательный варианты развития событий при подозрении на ИМ.
Машина скорой помощи (вертолет) должна быть у больного с подозрением на ОКС в течение 15 мин после вызова. Для уменьшения возможных задержек на этапе вызова «скорой помощи» диспетчеры и бригада должны использовать специальные протоколы, оптимальным является внедрение принципов телемедицины. Отдельная глава нового руководства ESC [1] посвящена логистике системы оказания неотложной помощи инфарктным больным, то есть принципам организации ее работы с целью максимальной рационализации и минимизации возможных задержек времени.
Современные подходы к неотложной помощи при STEMI обусловливают очень высокие требования к оснащению машин скорой помощи и опытности бригады, прибывшей к больному. Так, эксперты ESC подчеркивают, что каждая такая машина (вертолет) должна содержать, по крайней мере, портативный электрокардиограф на 12 отведений и дефибриллятор; желательно также иметь возможность проведения тромболизиса уже на догоспитальном этапе.
Огромное значение имеет сеть стационаров с отделениями интенсивной кардиологической помощи, в которых работает квалифицированный персонал и круглосуточно доступны все необходимые методы обследования и лечения, постоянный мониторинг ключевых показателей. Согласно новому руководству ESC основное значение в принятии решения о тактике лечения имеет доступность стационаров, в которых возможно немедленное выполнение ЧКВ.
Авторы руководства признают, что соблюдение этих рекомендаций по-прежнему остается сложной задачей даже в развитых странах мира. Несмотря на разветвленную сеть стационаров, в которых ЧКВ и/или тромболизис доступны 24 ч в сутки и 7 дней в неделю, множество пациентов на сегодняшний день получают реперфузионное лечение за рамками рекомендованного «терапевтического окна». Однако очень важно, чтобы врачи и организаторы здравоохранения прилагали все усилия для преодоления этой проблемы.
Диагностика
Для диагностики инфаркта авторы руководства [1] рекомендуют использовать новое всемирное определение инфаркта миокарда (ESC/ACC/AHA/WHF, 2007) [7].
Первичный («рабочий») диагноз STEMI устанавливается на основе следующих данных:
– наличие боли (дискомфорта) в области грудной клетки (часто с характерной локализацией и иррадиацией, на протяжении 10-20 мин или более, без адекватного ответа на нитроглицерин);
– по данным электрокардиографии (ЭКГ) отмечается стойкая элевация сегмента ST или (предположительно) новая блокада левой ножки пучка Гиса (часто необходимы повторные ЭКГ);
– повышенный уровень маркеров некроза миокарда, таких как КФК-МВ, тропонины (однако в руководстве подчеркивается, что не следует терять время на ожидание результатов этих анализов, для того чтобы принять решение о необходимости реперфузии);
– двухмерная эхокардиография (ЭхоКГ) позволяет исключить некоторые другие причины появления болей (дискомфорта) в области грудной клетки (таких как острое расслоение стенки аорты, перикардиальный выпот, тромбоэмболия легочной артерии и др.).
В руководстве подчеркивается приоритетная роль ЭКГ на первых этапах диагностики STEMI: даже на ранней стадии инфаркта электрокардиограмма редко остается нормальной, поэтому при подозрении на ИМ необходимо провести этот метод обследования как можно раньше.
Появление устойчивой элевации ST или (предположительно) новой блокады левой ножки пучка Гиса на фоне характерной клинической симптоматики должно быть поводом для того, чтобы рассмотреть целесообразность и возможность проведения реперфузии. Однако вероятно и получение сомнительных результатов ЭКГ, особенно на ранних стадиях инфаркта, поэтому нередко приходится прибегать к повторным обследованиям, к регистрации ЭКГ-сигнала в дополнительных отведениях (V 7. V 8. V 4R ), а также к подтверждению диагноза другими методами (измерение уровня кардиальных биомаркеров). Но даже при ЭКГ-подтверждении диагноза с первого раза всем пациентам рекомендуется по возможности раньше начать ЭКГ-мониторинг – прежде всего для того, чтобы своевременно заметить развитие жизнеугрожающих аритмий.
Определение уровня кардиальных биомаркеров и проведение ЭхоКГ важны в первичной диагностике ИМ, однако они не должны быть причиной задержки начала реперфузионного лечения, если диагноз подтверждается данными ЭКГ.
Лечение
Неотложная помощь
Важными составляющими неотложной медицинской помощи являются обезболивание, борьба с гипоксией и уменьшение возбуждения больного, если это необходимо.
Обезболивание способствует снижению активности симпатической нервной системы и обусловленных ею вазоконстрикции и перегрузки сердца. С этой целью руководство рекомендует использовать опиоиды, в частности морфин 4-8 мг внутривенно; при необходимости каждые 5-15 мин повторяется введение 2 мг препарата (класс рекомендаций I, уровень доказательности С). При этом следует избегать внутримышечных инъекций, поскольку в дальнейшем места внутримышечных инъекций могут стать источником кровотечения или кровоизлияния, если пациенту будет назначен тромболизис. В руководство 2008 г. [1] по сравнению с предыдущей версией документа 2003 г. [2] добавлено указание о том, что для обезболивания при ИМ не рекомендуется использовать нестероидные противовоспалительные препараты (НПВП), учитывая их протромботические эффекты.
В случае одышки, при развитии сердечной недостаточности (СН), а также шока необходима борьба с гипоксемией. ESC рекомендует оксигенотерапию с помощью маски или носовых катетеров (в тяжелых случаях в ходе искусственной вентиляции легких (ИВЛ)) со скоростью 2-4 л О2 /мин (I, С). Для контроля эффективности рекомендуется неинвазивный мониторинг сатурации кислорода в крови.
В случае развития значительного возбуждения может быть показано введение транквилизаторов (IIa, C), однако в руководстве отмечается, что в большинстве случаев возбуждение снимается самостоятельно сразу после адекватного обезболивания.
Кроме того, на догоспитальном этапе ведения больного с ОКС особенно актуален вопрос реанимации пациента в случае остановки сердца. С этой целью проводятся базовые мероприятия сердечно-легочной реанимации, дефибрилляция и другие необходимые меры.
Реперфузия
Ключевой задачей в лечении пациента с подтвержденным STEMI является своевременное проведение реперфузионного вмешательства.
Рекомендуемые сроки реперфузии
У пациента со STEMI реперфузия (механическая или фармакологическая) должна быть проведена в первые 12 ч от появления симптомов (I, A). Следует рассмотреть целесообразность/возможность проведения реперфузии и в том случае, если с момента начала симптомов прошло более 12 ч (по утверждению пациента), но имеются клинические и/или электрокардиографические подтверждения продолжающейся ишемизации миокарда (IIa, C).
Кроме того, ЧКВ может быть выполнено у стабильных пациентов в рамках 12-24 ч от появления первых симптомов (IIb, B), однако относительно этой рекомендации четкого консенсуса экспертов не существует, поскольку на сегодняшний день эта возможность изучалась в ограниченном числе рандомизированных исследований и пока не доказала однозначного положительного влияния на клинические исходы.
ЧКВ на полностью окклюзированной инфарктобусловившей артерии по прошествии 24 ч от начала ИМ у стабильных пациентов не рекомендовано (III, B).
ЧКВ
Главным отличием нового руководства ESC от предыдущей версии (2003) является приоритетность ЧКВ над стратегией фармакологического тромболизиса. Рекомендация «ЧКВ является предпочтительным методом реперфузионного лечения, если оно проводится в надлежащих условиях (квалифицированным и опытным персоналом, в самые короткие сроки от начала инфаркта)» получила высший уровень рекомендаций и класс доказательности – I, A.
ЧКВ надо проводить только в стационарах, где внедрена программа круглосуточной доступности интервенционных кардиологических вмешательств (24 ч в сутки, 7 дней в неделю). Под «опытным персоналом» подразумевают не только интервенционных кардиологов, которые непосредственно проводят вмешательство, но и весь медицинский персонал, поскольку для своевременной и эффективной реперфузии крайне важна слаженность действий всей бригады, оказывающей помощь в стационаре. Это позволяет минимизировать время от госпитализации больного до начала реперфузии, предотвратить ошибки в диагностике и принятии клинических решений. Рандомизированные исследования четко указывают на то, что именно эта практика стала одной из важнейших причин существенного (до 4-6% в настоящее время vs 25% около 50 лет назад) снижения внутрибольничной смертности больных с ИМ в большинстве европейских стран.
Время от первого контакта бригады «скорой помощи» с пациентом до раздувания баллона в венечной артерии должно составлять менее 2 ч, однако в случае обширного инфаркта желательно, чтобы это время было еще меньше и не превышало 90 мин (I, B). Кроме того, ЧКВ предпочтительно для реперфузии независимо от времени от начала ИМ (в оговоренных рамках) у больных с шоком и у тех, кому противопоказан тромболизис (I, B).
Что касается выбора различных вариантов ЧКВ (ангиопластики со стентированием, установки обычных металлических стентов или стентов с лекарственным покрытием), то доказательные данные в этом отношении продолжают изучаться. Существуют исследования, подтверждающие преимущества той или иной методики, хотя многие авторы не обнаруживают значительных различий. Поэтому доказательная база относительно предпочтительных подходов к ЧКВ требует новых крупных исследований и метаанализов, особенно в плане долгосрочных влияний этих подходов на прогноз пациентов.
При необходимости в ходе ЧКВ может быть проведена аспирация тромба (IIb, B).
Тромболизис
Если ЧКВ не может быть проведено в рекомендуемые сроки, при отсутствии противопоказаний должна быть выполнена фармакологическая реперфузия с помощью фибринолиза (I, A). Предпочтителен фибринспецифический фибринолитик (I, B). Рекомендуется начинать тромболизис уже на догоспитальном этапе (IIa, A), при этом следует стремиться ввести тромболитик в течение 30 мин после момента первого контакта бригады «скорой помощи» с пациентом. Если догоспитальный тромболизис невозможен, фибринолитик рекомендуется ввести в течение 30 мин после госпитализации (время «дверь–игла»).
В руководстве [1] приводятся следующие возможные режимы тромболитической терапии:
1) стрептокиназа – 1,5 млн ЕД внутривенно на протяжении 30-60 мин (препарат противопоказан, если когда-либо ранее этот больной получал стрептокиназу или анистреплазу);
2) альтеплаза (tPA) – 15 мг внутривенно болюсно → 0,75 мг/кг массы тела на протяжении 30 мин → 0,5 мг/кг массы тела на протяжении следующих 60 мин; общая доза не должна превысить 100 мг;
3) ретеплаза (rPA) – 10 ЕД + 10 ЕД внутривенно болюсно с промежутком в 30 мин;
4) тенектеплаза (TNK-tPA) – однократный внутривенный болюс:
– 30 мг, если масса тела пациента
– 35 мг, если масса тела пациента 60-69 кг;
– 40 мг, если масса тела пациента 70-79 кг;
– 45 мг, если масса тела пациента 80-89 кг;
– 50 мг, если масса тела пациента ≥90 кг.
Противопоказания к тромболизису
– перенесенное в ближайший месяц желудочно-кишечное кровотечение;
– проблемы геморрагического характера;
– расслоение аорты;
– пункции, выполненные без компрессии сосудов (например, биопсия печени, люмбальная пункция).
Относительные:
– перенесенная в ближайшие 6 мес транзиторная ишемическая атака;
– прием пероральных антикоагулянтов;
– беременность или первая неделя послеродового периода;
– рефрактерная артериальная гипертензия (систолическое АД >180 мм рт. ст. и/или диастолическое АД >110 мм рт. ст.);
– активная патология печени;
– инфекционный эндокардит;
– пептическая язва;
– травматичная/длительная реанимация.
Другие методы реперфузии
Если у пациента с обширным инфарктом тромболизис оказался неэффективным, ему может быть проведено «спасительное» ЧКВ. однако не позже чем в первые 12 ч от начала заболевания (IIa, A).
Тромболизис можно считать неуспешным, если по истечении 60-90 мин от начала введения фибринолитика элевация сегмента ST уменьшилась менее чем на 50%. Это не самый показательный ориентир, однако он может быть использован как приемлемый суррогатный критерий неэффективности реперфузии. Более точным методом оценки эффективности реперфузии является ангиографическое обследование, которое может быть проведено немедленно в любое время, если есть подозрение на неуспех тромболизиса (IIa, B), но не желательно в течение как минимум 3 ч от начала тромболизиса, если пациент положительно реагирует на реперфузию (IIa, A).
В исследовании REACT (2005) и метаанализе H.C. Wijeysundera et al. (2007) были показаны существенные преимущества «спасительного» ЧКВ по сравнению с консервативной стратегией ведения больных, у которых тромболизис оказался неэффективным: «спасительное» ЧКВ позволило увеличить выживаемость больных, а также риск развития СН и повторного ИМ, хотя и ценой несколько более высокого риска геморрагических осложнений и инсультов.
Проведение так называемого облегченного ЧКВ. то есть ЧКВ на фоне начатого активного фармакологического вмешательства (полная доза тромболитика, или ингибитор IIb/IIIa гликопротеиновых (ГП) рецепторов тромбоцитов, или 50% дозы тромболитика + ингибитор IIb/IIIa ГП рецепторов тромбоцитов), не может быть рекомендовано. Различные клинические исследования либо не продемонстрировали преимуществ этой стратегии, либо обнаружили повышенный риск (прежде всего, со стороны геморрагических осложнений).
Аортокоронарное шунтирование не рекомендуется в качестве неотложной стратегии реперфузии, однако нередко выполняется позже в случае неэффективного ЧКВ, может быть выполнено также при необходимости хирургического вмешательства на сердечной мышце или клапанах или в некоторых других клинических ситуациях.
Вспомогательная фармакологическая терапия при STEMI
У пациента, которому показано ЧКВ. могут использоваться:
- антитромбоцитарные препараты:
– ацетилсалициловая кислота (АСК) – I, B;
– клопидогрель (с использованием нагрузочной дозы) – I, C;
абсиксимаб – IIa, A;
эптифибатид – IIb, C;
Dr.Zaur Mamedov
Междисциплинарный подход к ведению больных с синдромом диабетической стопы в амбулаторной практике