Послеоперационный период
После завершения основного этапа операции в грудной клетке устанавливаются дренажные трубки для эвакуации жидкости. Проводится гемостаз, после чего ушивается грудина и кожа. После того, как стабилизируется центральная гемодинамика, больной переводится в реанимационное отделение.
В этом отделении больной находится до полной стабилизации состояния (1-3 дня). Периодически берется кровь на анализы, постоянно мониторируются все жизненно важные показатели, осуществляется постоянный контроль со стороны квалифицированного медицинского персонала а так же периодически проводятся такие обследования как: электрокардиография, эхокардиография, рентгенография грудной клетки, клинический и биохимический анализ крови, клинический анализ мочи. Вполне понятно, что продолжительность пребывания пациента в отделении реанимации зависит от объема оперативного вмешательства и от индивидуальных особенностей.
На второй-третий послеоперационный день после перевода больного из реанимации в отделение начинается его интенсивная реабилитация: дыхательная и физическая гимнастика, массаж, прописывается необходимая послеоперационная терапия и питание. Дренажные трубки удаляются. Состояние пациента улучшается, снимаются швы. С помощью медицинского персонала (родственников) больной начинает вставать с постели, ходить по палате и по коридору.
Проводятся инструктаж по обработке послеоперационного участка, все разъяснительные беседы, и определяются необходимые мероприятия, которые готовят пациента к выписке. Затем постепенно сокращается список принимаемых лекарств, больной уже вполне самостоятельно перемещается по отделению, самочувствие улучшается и его состояние приближается к обычному для здоровых людей..
Реабилитация после выписки
Реабилитация не заканчивается выпиской из стационара. Очень важно вести правильный образ жизни и придерживаться рекомендаций, которые даются врачом. В процессе реабилитации после АКШ очень важно постепенное, изо дня в день, восстановление физической активности. Это не просто важный, а необходимый фактор для быстрого возвращения к полноценной жизни. Здесь особое место занимает ходьба, проводимая в соответствии с медицинскими рекомендациями. Являясь наиболее привычным и физиологичным способом тренировки, ходьба существенно улучшает функции всего кровообращения, сердца, повышает его резервные возможности и укрепляет сердечную мышцу. Безусловно, физические упражнения ни в кой мере не заменяют лекарств или других лечебных процедур, но являются непреложным дополнением.
Мы настоятельно рекомендуем продолжать физические тренировки после выписки, придерживаясь предложенной врачом схемы. Полностью процесс реабилитации завершается примерно к шестому месяцу после операции.
Наиболее удобно провести первые недели реабилитации в специализированном санаториях, куда по возможности и направляются больные, перенёсшие операцию АКШ. Но при выполнении всех рекомендаций врача, полноценной заменой санаторных условий могут быть и домашние условия. В любом случае всё зависит от самого больного, его желания поднять свою физическую и психологическую форму до уровня абсолютно здорового человека.
Как правило, шунтирование коронарных артерий позволяет больным успешно вернуться к нормальному образу жизни и работе. Крайне желателен отказ от курения, здоровая пища с ограничением калорий при избыточном весе, соли.
Нормлизация артериального давления — также обязательное условие успешности реабилитации и долгого сохранения здоровья без риска развития сердечного приступа.
Профессиональный хостинг для всех
Ошибка доступа 404 к указанной странице
Данная страница не имеет отношения к запрашиваемому сайту.
Новые возможности фармакотерапии при операциях аортокоронарного шунтирования
Акчурин Ренат Сулейманович, академик РАМН
Скридлевская Елена Анатольевна, кандидат медицинских наук
ФГУ Российский кардиологический научно-производственный комплекс Росмедтехнологий, Научно-исследовательский институт клинической кардиологии им. А.Л.Мясникова, Москва
Современные лекарственные доступы в хирургическом лечении ишемической болезни сердца (ИБС) можно разделить на следующие основные этапы применения, в зависимости от периода лечения: дооперационный, периоперационный, ранний послеоперационный и послеоперационный периоды.
Направления медикаментозной терапии в предоперационном периоде
Основные направления медикаментозной терапии в этот период включают проведение плановой терапии у больных со стабильной стенокардией, максимально возможное достижение стабилизации состояния при остром коронарном синдроме, максимально возможную компенсацию недостаточности кровообращения, профилактику возможных послеоперационных осложнений.
Принципы терапии больных в дооперационном периоде. Современная медикаментозная терапия, направленная на стабилизацию состояния больного, компенсацию недостаточности кровообращения, включает антитромботическую терапию, нитраты, бета-адреноблокаторы, статины, ингибиторы ангиотензинпревращающего фермента (АПФ), мочегонные и др. Применяется весь арсенал современных медикаментозных средств, позволяющих адекватно подготовить больного к операции коронарного шунтирования (КШ). Применение статинов в период подготовки больного к оперативному лечению снижает, по данным различных авторов, риск развития острого коронарного синдрома и уровень периоперационной летальности на 30-42% по сравнению с пациентами, не принимавшими статины. В этой связи терапия дислипидемии продолжается до момента вмешательства. Кроме того, в период подготовки больного к операции проводится активная терапия сопутствующих заболеваний.
Предоперационный период также включает в себя профилактику возможных послеоперационных осложнений. в том числе периоперационной инфекции, периоперационных кровотечений и гемотрансфузий, тромбоэмболических осложнений.
Всем больным перед операцией с целью профилактики послеоперационных инфекций необходимо назначить антибиотики. Кожные и носоглоточные грамположительные штаммы микроорганизмов — это ведущие причины наиболее опасных осложнений, таких как инфицирование рассеченной грудины или передний медиастинит. Кроме того, переливание одногруппной крови после КШ также связано с повышенным риском вирусной и бактериальной инфекции и необходимостью применения антибактериальных препаратов. Предоперационное назначение антибиотиков снижает риск развития инфекции в 5 раз. Антимикробная активность зависит от адекватной концентрации препарата в тканях до начала контакта с бактериями.
Препаратами выбора для профилактики инфекционных осложнений КШ являются антибиотики класса цефалоспоринов, обладающие низкой токсичностью. Используются цефалоспорины III генерации для парентерального применения, в частности цефотаксим. На фармацевтическом рынке представлен целый ряд его торговых наименований. Цефотаксим действует бактерицидно, он также устойчив к действию большинства β-лактамаз.
На основании фармакокинетики цефотаксима и большого опыта его использования установлено, что проведение короткого курса (менее 24 ч, в/м, 1 г за 3 ч до операции, далее в пределах 30 мин до разреза) обладает достаточной безопасностью и эффективностью.
Факторы риска операционных кровотечений. Несмотря на то, что в последнее время переливание одногруппной крови становится менее опасным, сохраняется корреляция с повышенным риском присоединения после КШ вирусной и бактериальной инфекции. К возникновению показаний к гемотрансфузии после КШ предрасполагают следующие факторы риска: пожилой возраст, низкий гематокрит в предоперационном периоде, предоперационная терапия антитромбоцитарными препаратами, характер операции, длительность искусственного кровообращения (ИК), предшествующая тромболитическая терапия, повторное КШ, нестандартные режимы назначения гепарина.
Антитромботическая терапия. Антитромботические препараты, к которым относятся антитромбоцитарные средства, прямые и непрямые антикоагулянты, тромболитики, а в последнее время и блокаторы гликопротеиновых IIb/IIIa рецепторов тромбоцитов, являются неотъемлемой частью терапии пациентов кардиологических стационаров. Однако при подготовке пациента к операции КШ необходимо строго учитывать фармакокинетику этих препаратов для обеспечения минимального риска больших и малых кровотечений во время операции (рис. 1).
Рис. 1. Сроки отмены антиагрегантов и антикоагулянтов перед оперативным вмешательством.
Антитромбоцитарные средства
Ацетилсалициловая кислота (аспирин) чрезвычайно широко используется в лечении кардиологических больных, которым предстоит операция. Аспирин ингибирует циклооксигеназу-1 и блокирует образование тромбоксана А2, что приводит к подавлению агрегации тромбоцитов, индуцируемой через этот путь, в течение всего срока жизни тромбоцитов (7-10 дней). Вследствие этого аспирин способен увеличить послеоперационную кровопотерю, что подтверждено в проспективном плацебо-контролируемом исследовании. Поэтому, при подготовке к плановой операции КШ, которая выполняется по поводу стабильной стенокардии, прием аспирина прекращается за 5-7 дней до операции, что снижает риск послеоперационных кровотечений и трансфузий.
Тиенопиридины. Тот факт, что аспирин действует только на один путь активации тромбоцита (образование тромбоксана А2), привело к необходимости его комбинирования со средствами, влияющими на другие механизмы возбуждения кровяных пластинок. Среди таких средств наиболее эффективным, безопасным и удобным для длительного применения оказался представитель группы тиенопиридинов — клопидогрел. В настоящее время на фармацевтическом рынке РФ представлены такие его препараты, как плавикс и зилт. Другое лекарственное средство группы тиенопиридинов — тиклопидин (тиклид) — из-за выраженных побочных эффектов, наиболее серьезным из которых является развитие нейтропении, постепенно уходит из клинической практики. В настоящее время клопидогрел применяется у больных ИБС при аллергии на аспирин, остром коронарном синдроме, при стентировании коронарных артерий.
Тиенопиридины действуют на путь активации тромбоцитов, блокируя рецепторы (Р2) к аденозиндифосфату (АДФ) мембраны тромбоцитов. Обусловленное клопидогрелом торможение АДФ-индуцированной агрегации достигает 40-60% и стабилизируется на этом уровне через 3-7 дней его применения в дозе 75 мг/сут, тогда же происходит удлинение времени кровотечения в 1.5-2 раза по сравнению с исходным. Восстановление функции тромбоцитов после прекращения приема клопидогрела происходит довольно медленно (примерно за 5-7 дней), так как ее частичное подавление сохраняется в течение оставшейся жизни пластинок, находившихся в кровотоке во время применения клопидогрела. В этой связи прием клопидогрела рекомендуется прекратить за 5-7 дней до операции, во избежание риска послеоперационного кровотечения и необходимости гемотрансфузии.
Прямые антикоагулянты
Нефракционированный гепарин (НФГ). В связи с появлением низкомолекулярного гепарина НФГ постепенно отходит на второй план, что обусловлено рядом факторов. Во-первых, антикоагуляционный эффект НФГ является труднопредсказуемым и зависит от целого ряда факторов, таких как количество антитромбина III, возраст, пол, масса тела пациента, функциональное состояние почек и др. Подобная вариабельность обусловлена тем, что гепарин способен связываться с различными белками плазмы, уровень продукции которых может варьировать в широких пределах как у здоровых людей, так и при различных заболеваниях. Во-вторых, НФГ должен назначаться в дозах, обеспечивающих достижение терапевтического уровня активированного частичного тромбопластинового времени (АЧТВ), по меньшей мере, его увеличение в 1,5 раза от контрольного уровня, который необходимо контролировать. Все это делает применение НФГ менее привлекательным по сравнению с другими препаратами. Однако, на фоне его применения риск интраоперационных больших и малых кровотечений невысок. Поэтому отмена НФГ перед операцией КШ необязательна.
Низкомолекулярные гепарины (НМГ). В настоящее время их применение в кардиологической практике является более привлекательным. На мировом фармацевтическом рынке присутствует около десятка различных НМГ. Все они являются производными стандартного гепарина и обладают сходным антикоагулянтным действием, хотя и имеют значительные индивидуальные различия на молекулярном уровне. НМГ, также как и НФГ, являются катализаторами антитромбина III. Однако, благодаря уменьшению количества мукополисахаридных цепей и, соответственно, уменьшению молекулярной массы молекул, их антитромботическое действие более селективно и потому более предсказуемо, чем у НФГ. В меньшей степени НМГ влияют на фактор IIa, что уменьшает риск выраженных кровотечений.
НМГ не связываются с эндотелием и обладают меньшей способностью связываться белками плазмы. Это обусловливает большую биодоступность, значительное увеличение времени полувыведения и стабильный дозозависимый ответ при их подкожном введении. Таким образом, НМГ характеризуются более предсказуемым антикоагулянтным ответом по сравнению с НФГ и не требуют проведения строго лабораторного мониторинга при назначении в терапевтических дозах, что объясняет их широкое применение для лечения и профилактики тромбоэмболических осложнений.
Однако, при подготовке больных к операции КШ необходимо учитывать высокий риск малых и больших кровотечений. В этой связи показана отмена НМГ за 1-2 суток до вмешательства с переходом на подкожное введение НФГ в дозе 5000 ЕД каждые 6 ч под контролем АЧТВ. Последняя инъекция гепарина осуществляется в дозе 2500 ЕД подкожно.
Непрямые антикоагулянты
Нередко в предоперационном периоде больные с постоянной формой мерцательной аритмии получают непрямые антикоагулянты. Отмена непрямых антикоагулянтов необходима за 3 суток до операции КШ во избежание угрожающих жизни пациента периоперационных кровотечений. В этих случаях показан перевод больного на НФГ по стандартной схеме.
Блокаторы гликопротеиновых IIb/IIIa рецепторов тромбоцитов
Появление таких препаратов, как блокаторы IIb/IIIa рецепторов, предотвращающих образование соединений между активированными тромбоцитами, делает их эффективным в антитромботической терапии, особенно острого коронарного синдрома. Однако, при подготовке больного к операции КШ, учитывая фармакокинетику этих препаратов, необходима отмена эптифибатида и тирофибата за несколько часов до вмешательства, а абциксимаба и монофарма — за 8-15 суток до КШ.
Тромболитическая терапия
В том случае, если операции КШ предшествовала тромболитическая терапия, проведение операции возможно через 48-72 ч после тромболизиса.
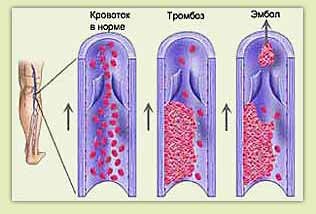
Профилактика тромбоэмболических осложнений. В практике сердечно-сосудистой хирургии немаловажное значение имеют и такие грозные осложнения, как тромбоэмболические. Это понятие включает в себя тромбозы вен нижних конечностей и тромбоэмболии легочной артерии. По сути, больной, перенесший крупную операцию, имеет полностью сформированную триаду Вирхова (застой крови, повышение активности свертывающей системы и повреждение стенки сосудов), что и обусловливает необходимость наиболее агрессивного профилактического подхода (рис. 2).
#image.jpg
Рис. 2. Тактика профилактики тромбоэмболических осложнений.
Особую группу составляют пациенты с наследственной предрасположенностью к тромбозу (тромбофилии). Больных с врожденной тромбофилией необходимо относить к группе высокого риска тромбозов и эмболий, им показана адекватная профилактика с учетом клинической ситуации. У пациентов с генетической предрасположенностью явный тромбоз обычно развивается под влиянием стрессовых факторов, и одним из таких факторов риска является оперативное вмешательство — КШ.
Доказано, что НФГ в дозе 5000 ЕД каждые 6-8 ч подкожно снижает частоту как тромбоза глубоких вен, так и смертельной тромбоэмболии.
В многоцентровом исследовании НМГ достоверно снижали частоту смертельных тромбоэмболий. НМГ являются современными эффективными лекарственными средствами профилактики различных тромбоэмболических осложнений.
На основании этих данных показано применение следующей схемы медикаментозной профилактики тромбоэмболических осложнений: в период обследования пациента и выявления факторов риска начинается терапия НМГ в профилактической дозе с последующим переходом за 1-2 суток до вмешательства на НФГ в дозе 20 тыс. ЕД/сут.
Тактика предоперационной подготовки больных с наследственной тромбофилией, а также при выявленном повышении уровня D-димера является аналогичной.
Дооперационный период организационно завершается принятием решения о дате операции и начинается следующий период.
Периоперационный период
Обсуждение особенностей хирургической техники непосредственно не относится к задачам данного сообщения, но необходимо отметить, что:
- прежде всего, нежное и тонкое обращение с артериальными и венозными кондуитами является залогом успешного раннего и отдаленного послеоперационного периода;
- применение микроскопа и атравматичное оперирование, а также быстрые, стандартные решения для всех ситуаций в операционной — залог короткого времени операции и успешного послеоперационного периода.
Профилактика и лечение возможных проблем раннего послеоперационного периода
Стремление к быстрому восстановлению и ранней выписке после КШ является стандартной целью госпитального этапа лечения. Профилактика и активное лечение таких возможных проблем раннего послеоперационного периода, как раневые осложнения, нарушения ритма сердца, тромбоэмболические осложнения, ранняя окклюзия шунтов и аутоиммунные процессы (постперикардиотомный синдром), а также терапия сопутствующих заболеваний способствует быстрому восстановлению после операций КШ. Основные компоненты системы восстановления пациента в раннем послеоперационном периоде представлены на рис. 3.
#image.jpg
Рис.3. Основные компоненты системы восстановления пациента в раннем послеоперационном периоде.
Профилактика периоперационной инфекции. В раннем послеоперационном периоде продолжается антибактериальная терапия цефотаксимом. При неосложенном течении — до 7 суток после операции в суточной дозе 4 г в/в с интервалом введения 6 ч (рис. 4).
#image.jpg
Рис. 4. Профилактика послеоперационной инфекции.
При наличии у больного почечной недостаточности проведение терапии цефотаксимом регламентируется клиренсом креатинина. В случаях, когда уровень креатинина менее 10 мл/мин, используется половина разовой дозы, интервал между введениями остается неизменным. Необходимо отметить, что в ряде случаев при применении цефотаксима отмечается реакция со стороны печени — повышение уровня печеночных ферментов (АЛТ, АСТ, ЛДГ, ГГТ, ЩФ) или билирубина. Кроме того, необходимо строго контролировать скорость в/в введения препарата (инъекция раствора должна проводиться медленно в течение 3-5 мин), так как болюсное введение цефотаксима в центральный венозный катетер может спровоцировать угрожающие жизни аритмии.
В случае повышения или поддержания температуры на фебрильных цифрах, сохраняющегося лейкоцитоза и изменений со стороны послеоперационной раны для профилактики развития медиастинита проводится 2-й курс антибиотиков — в зависимости от клинической ситуации с 5-7 суток после вмешательства. Препаратом выбора в данном случае является также цефалоспорин III поколения, но в комбинации с ингибитором β-лактамаз — сульперазон. Суточная доза препарата (4 г: 2 г цефоперазона+ 2 г сульбактама) делится на равные части и вводится каждые 12 ч. У больных с почечной недостаточностью доза сульперазона изменяется, чтобы компенсировать снижение клиренса сульбактама. Необходимо отметить, что сульперазон обычно хорошо переносится больными. Однако иногда отмечается повышение показателей функции печени (АСТ, АЛТ, ЛДГ, ЩФ, ГГТ, билирубина), которое носит обратимый характер.
При неэффективности цефалоспоринов проводится курс антибактериальной терапии антибиотиком из группы гликопептидов — ванкомицином. Ванкомицин вводится в/в капельно по 1 г каждые 12 ч, продолжительность инфузии — не менее 60 мин, во избежание коллаптоидных реакций. У больных с нарушением выделительной функции почек доза уменьшается с учетом клиренса креатинина. К препаратам резерва относятся антибиотики группы карбопенемов — меропенем (меронем) и тиенам.
Осложнения антибиотикотерапии. При проведении активной антибактериальной терапии всегда существует риск развития дисбактериоза и такого грозного осложнения, как псевдомембранозный колит.
Профилактика дисбактериоза и псевдомембранозного колита. С целью профилактики дисбактериоза антибактериальную терапию всегда сопровождают противогрибковые препараты. Применяются препараты флуконазола в дозе 100 мг/сут, которые назначают начиная с первых суток после операции. Однако в ряде случае, несмотря на проводимую профилактику, возникают проявления дисбактериоза легкой, средней степени тяжести, вплоть до развития псевдомембранозного колита. В первых двух случаях купировать проявления дисбактериоза удается на фоне приема пробиотиков. На основе пробиотиков создан целый ряд эффективных лекарств и биологически активных добавок к пище. Прием средств на основе пробиотиков способствует нормализации микрофлоры кишечника. Чаще всего применяются такие препараты, как бифиформ и линекс. Бифиформ назначается в суточной дозе 3-4 капсулы в сутки в 3-4 приема. Комбинированный препарат линекс, содержащий 3 компонента естественной микрофлоры из разных отделов кишечника, назначается по 2 капсулы 3 раза/сут. Антидиарейный эффект достигается, как правило, в первые сутки применения этих препаратов. В большинстве случаев нужный эффект достигается через 2-3 дня. В остальных случаях курс лечения составляет от 10 до 21 дня. Нежелательные лекарственные взаимодействия препаратов данной группы не отмечены.
Лечение псевдомембранозного колита. При развитии псевдомембранозного колита показано проведение курса специфической терапии, включающего возмещение воды и электролитов, проведение специфической терапии ванкомицином внутрь, прием про- и пребиотиков.
Профилактика послеоперационных аритмий. Проведение терапии бета-адреноблокаторами при отсутствии противопоказаний считается стандартом терапии, направленной на ограничение частоты и/или тяжести фибрилляции предсердий после КШ. Назначение бета-адреноблокаторов снижает частоту фибрилляции предсердий в раннем послеоперационном периоде в 5 раз (рис. 5).
#image.jpg
Рис.5. Тактика профилактики послеоперационных аритмий после аортокоронарного шунтирования.
Доказано, что пропранолол (неселективный β1- и β2-адреноблокатор) снижает частоту фибрилляции предсердий в послеоперационном периоде на 43%. Препараты пропранолола являются быстродействующими, легкоуправляемыми и недорогими, однако кратность приема должна составлять не менее 4 раз/сут. В этой связи на первое место вышли бета-адреноблокаторы пролонгированного действия. Наибольшее распространение в каждодневной практике отделений сердечно-сосудистой хирургии получили препараты атенолола — селективного β1-адреноблокатора с доказанным защитным действием на сердечно-сосудистую систему. Обычно мы применяем атенолол в дозе 25 мг с интервалом приема в 12 ч, реже — в дозе 12,5 мг с тем же интервалом.
На сегодняшний день раннее послеоперационное назначение бета-адреноблокаторов считается стандартным методом профилактики фибрилляции предсердий после КШ, за исключением больных с активным бронхоспазмом или с выраженной брадикардией в покое. Если бета-адреноблокаторы противопоказаны для профилактики пароксизмов фибрилляции предсердий после КШ или неэффективны, можно рассмотреть возможность применения небольших доз соталола — неселективного блокатора β1- и β2-адренорецепторов, объединяющего свойства антиаритмических препаратов II и III групп, проявляющего антиаритмическую и антифибрилляторную активность. Препараты соталола обладают хорошим фармакологическим профилем. Действие таблетки соталола наступает через 1 ч после приема, максимум концентрации определяется через 2-4 ч, период полувыведения 7-15 ч, а длительность действия 24 ч. Небольшие дозы соталола могут успешно купировать и профилактировать фибрилляцию предсердий после КШ: стартовая доза — 80 или 160 мг/сут. При неэффективности соталола в купировании пароксизма фибрилляции предсердий или его непереносимости можно перейти к альтернативным средствам лечения и профилактики. К ним можно отнести:
- Дигоксин и антагонисты кальция негидропиридинового ряда (наиболее изучен верапамил) полезны для контроля за ритмом желудочков, но не обладают устойчивым эффектом в плане профилактики послеоперационной фибрилляции предсердий.
- Препараты амиодарона, относящегося к атиаритмическим средствам III класса и обладающего высокой эффективностью в купировании и профилактике послеоперационной фибрилляции предсердий, снижении риска смерти у больных после инфаркта миокарда, с сердечной недостаточностью, переживших остановку сердца. Однако частота побочных эффектов, прежде всего со стороны эндокринной системы и органов зрения, требует его применения только в случае неэффективности всей проводимой ранее антиаритмической терапии.
- Препараты пропафенона, относящиеся к антиаритмическим средствам Iс класса являются высокоактивными антиаритмиками, однако их применение в практике сердечно-сосудистой хирургии ограничено достоверным повышением вероятности внезапной смерти у больных высокого риска, к которым относятся пациенты, перенесшие КШ, в особенности после инфаркта миокарда.
Вследствие того, что после ИК происходит снижение уровня сывороточного калия и магния, большую роль в профилактике и нередко в купировании пароксизма фибрилляции предсердий в раннем послеоперационном периоде играют препараты калия (в/в инфузия калия хлорида с целью нормализации сывороточного калия на уровне > 4,5 ммоль/л и постоянный прием препаратов калия per os в течение всего раннего послеоперационного периода) и магния (в/в инфузия магния сульфата с целью нормализации сывороточного магния на уровне >1 ммоль/л).
Профилактика тромбоэмболических осложнений. В раннем послеоперационном периоде всем больным проводится профилактика венозно-тромбоэмболических осложнений назначением НМГ в профилактической дозе до 5-х суток после операции с одновременным присоединением с 1-х суток после операции антитромбоцитарной терапии (рис. 6).
Рис.6. Профилактика тромбоэмболических осложнений после аортокоронарного шунтирования.
У пациентов с генетической предрасположенностью к тромбозам, а также при выполнении эндартерэктомии из коронарной артерии в раннем послеоперационном периоде проводится гепаринопрофилактика возможных осложнений назначением НФГ с последующим переходом на прием непрямых антикоагулянтов.
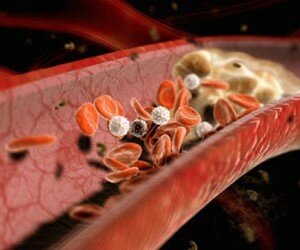
Факторы риска окклюзии шунтов. В раннем послеоперационном периоде одним из основных осложнений является окклюзия шунтов. К факторам риска развития окклюзии шунтов относятся время после операции, вид и форма шунта, снижение кровотока в шунте, узкий просвет шунтированной артерии, эндартерэктомия из коронарной артерии, наличие атером в месте пришивания шунта, повышенный уровень липидов.
Причины ранних окклюзий (тромбозов) шунтов. Раннюю окклюзию связывают с изменением реологических свойств крови, а также с повреждением сосудистой стенки, которое происходит во время забора аутовены. В этой связи на первое место выходит высокий риск тромбоза шунтов.
В случае выполнения эндартерэктомии из коронарной артерии в течение ближайших 7 дней наблюдается образование связи фибрина со стенкой тромба на оголенной артериальной поверхности с минимальной воспалительной реакцией и последующей организацией тромба.
Медикаментозные профилактические мероприятия, направленные на предупреждение раннего тромбоза шунтов состоят из своевременной и адекватной антитромбоцитарной терапии (рис. 7).
#image.jpg
Рис.7. Медикаментозные профилактические мероприятия, направленные на предупреждение раннего тромбоза шунтов.
Среди антитромбоцитарных средств безусловно эффективен и наибольшее распространение получил аспирин. В целом ряде исследований не отмечено различий в частоте окклюзий шунтов при применении больших и малых доз аспирина. В клинической практике с энтузиазмом относятся к применению минимально возможных доз аспирина. Однако, еще не проведено исследований, сравнивающих эффект низких (50-100 мг/сут) и высоких (325 мг/сут) доз аспирина. Продолжительный прием аспирина позволяет получить отдаленный положительный профилактический эффект. При использовании указанных доз побочные эффекты со стороны желудочно-кишечного тракта относительно редки. В исследованиях, в которых продемонстрировано положительное действие аспирина, использовались простые формы препарата.
Начало терапии аспирином непосредственно перед операцией КШ с целью профилактики окклюзии шунтов не является более эффективным, чем возобновление данной терапии в день операции, но приводит к увеличению риска кровотечений. В этой связи после отмены препарата перед операцией необходимо возобновление терапии аспирином в дозе 75-325 мг/сут через 6 ч после операции.
Одним из основных побочных эффектов аспирина является воздействие на желудочно-кишечный тракт с развитием диспепсических явлений и желудочно-кишечных кровотечений. Это так называемое ульцерогенное действие объясняется влиянием на гипофиз и кору надпочечников, на факторы свертываемости крови и непосредственным раздражением слизистой оболочки желудка.
В кардиохирургических клиниках в последние годы применяются лекарственные формы аспирина, покрытые кишечнорастворимой оболочкой (аспирин кардио и тромбо АСС), и комбинированные препараты (кардиомагнил). Аспирин-кардио и тромбо АСС — таблетки, покрытые пленочной кишечнорастворимой оболочкой, устойчивой к действию желудочного сока, за счет чего уменьшается риск развития побочных эффектов со стороны желудка. Кишечнорастворимая оболочка не допускает абсорбции ацетилсалициловой кислоты в желудке. Кардиомагнил — комбинированный препарат, в состав которого входят ацетилсалициловая кислота и магния гидроксид. Магния гидроксид уменьшает раздражающее действие препарата на слизистую оболочку желудка.
Сравнительных исследований разных форм аспирина с клиническими конечными точками не проводилось. Антитромбоцитарные эффекты аспирина, покрытого оболочкой, и простого аспирина в дозах, превышающих 300 мг, признаются одинаковыми. Еще в 1996 г. опубликовано сообщение о сравнительном риске кровотечений при использовании разных форм аспирина, которое существенно поколебало веру в безопасность аспирина, покрытого оболочкой. Эксперты 6-й Конференции по антитромботической терапии Коллегии врачей-специалистов по заболеваниям грудной клетки включили в раздел, посвященный антитромбоцитарной терапии, следующую фразу: «Врачи, рекомендующие покрытый оболочкой или буферный аспирин, не должны предполагать, что эти формы менее вероятно вызовут кровотечения из желудочно-кишечного тракта, чем простой аспирин».
Необходимо отметить и тот факт, что у 35% людей имеется сниженный антиагрегационный ответ на применение аспирина, а у 19% вообще не отмечается какого-либо влияния аспирина на агрегацию тромбоцитов. Этот феномен, получивший название аспиринрезистентности, диктует необходимость внедрения в клиническую практику других атитромбоцитарных препаратов. Кроме того, как уже говорилось ранее, тот факт, что аспирин действует только на один путь активации тромбоцита, делает целесообразным его комбинирование со средствам, влияющими на другие механизмы возбуждения кровяных пластинок.
Тиенопиридины. В настоящее время прием клопидогрела в дозе 75 мг/сут после операции КШ рекомендуется пациентам, имеющим аллергию на аспирин, оперированным по поводу острого коронарного синдрома, а также пациентам с предварительным стентированием коронарных артерий, если стент не прикрывается шунтом.
В эксперименте на различных моделях тромбоза у животных продемонстрировано, что клопидогрел и аспирин потенцируют антитромботическое действие друг друга и уменьшают пролиферацию интимы. Это подтверждает правильность предположения о целесообразности комбинирования антитромбоцитарных агентов с разными механизмами действия. После завершения исследования CASCADE будут приняты обоснованные рекомендации по использованию клопидогрела после операций КШ.
Профилактика ранних окклюзий шунтов у пациентов с тромбофилией, а также после эндартерэктомии из коронарных артерий
Отдельную группу составляют пациенты с наследственной предрасположенностью к тромбозу (тромбофилии), с высоким риском окклюзии шунтов на ранних сроках после оперативного вмешательства, а также случаи проведения эндартерэктомии из коронарных артерий. В этих ситуациях показано применение НФГ с последующим переходом (с 3-х суток после операции) на прием пероральных антикоагулянтов (рис. 8).
#image.jpg
Рис.8. Профилактика ранних окклюзий шунтов у пациентов с тромбофилией, а также после эндартерэктомии из коронарных артерий.
МНО — международное нормализованное отношение
Непрямые антикоагулянты. В зависимости от химической структуры антикоагулянты подразделяются на производные моно- и дикумарина, циклокумарины и индандионы. Наиболее широко в мире применяются производные монокумарина — варфарин и аценокумарол (синкумар), что обусловлено их оптимальной продолжительностью действия и хорошей переносимостью. Варфарин обеспечивает более стабильное воздействие на процесс гемокоагуляции, чем аценокумарол, так как время его нахождения в организме больного составляет 36 ч. Назначение фенилина и пелентана ограничивается токсичностью первого и неустойчивым антикоагулянтным эффектом второго.
Необходимо отметить, что терапия непрямыми антикоагулянтами должна осуществляться под строгим контролем показателя МНО, который необходимо осуществлять через 8-10 ч после приема препарата. На протяжении первой недели определение МНО производится ежедневно, затем 1 раз в неделю.
Профилактика и лечение постперикардиотомного синдрома. В раннем послеоперационном периоде нередки и аутоиммунные процессы, такие как постперикардиотомный синдром. В этом случае показано назначение нестероидных противовоспалительных препаратов, нередко еще на фоне продолжающейся антибактеральной терапии. При их неэффективности необходимо проведение короткого курса гормональной терапии.
Симптоматическая терапия в раннем послеоперационном периоде включает комплекс мер, направленных на профилактику и в ряде случаев лечение сердечной недостаточности, коррекцию гипотензивной терапии у больных с артериальной гипертонией, профилактику осложнений со стороны желудочно-кишечного тракта, коррекцию уровня сахара крови у больных с сахарным диабетом, профилактику осложнений со стороны органов дыхания, профилактику и лечение осложнений со стороны мочевыводящих путей, а также в ряде случаев гепатопротекторную терапию. Кроме того, при выполнении шунтирования лучевой артерией с целью предупреждения риска возникновения спазма шунта лучевой артерии проводится специфическая терапия антагонистами кальция.
Послеоперационный период
Послеоперационный период включает в себя реабилитационные мероприятия, направленные на адаптацию пациента и восстановление его трудоспособности, и состоит из 4 аспектов: фармакотерапевтического, физического, психологического и социального. Стремление к укорочению госпитального периода и ранней выписке после успешной операции на сердце обусловливает необходимость создания полноценной и эффективной реабилитации.
Преемственность между специалистами. В большинстве кардиохирургических клиник длительность послеоперационного госпитального периода не превышает 7 суток, поэтому этап активизации и перехода к привычной жизни целесообразно переносить на специализированный реабилитационный стационар. В этой связи большую роль играет преемственность между специалистами. Врач, лечивший больного в стационаре, обеспечивает врача реабилитационного стационара или врача общей практики письменными рекомендациями по мерам вторичной профилактики, уже начатым на госпитальном этапе. Большинство из этих мероприятий включает изменение стиля жизни и фармакотерапию на длительный период времени.
Фармакотерапия в послеоперационном периоде включают в себя профилактику окклюзии шунтов и симптоматическую терапию.
Профилактика окклюзии шунтов. Поздняя окклюзия (в течение года) связана с изменениями, происходящими как в пересаженных участках вен и анастамозах, так и в собственных коронарных артериях. Эти изменения обусловлены усилением пролиферации гладкомышечных клеток (ГМК) в пересаженных участках вен и тромбоообразованием, связанным с повреждением эндотелия. Практически во всех венах, внедренных в артериальное кровообращение, через 4-6 недель после операции происходит диффузное утолщение интимы. Гиперплазия интимы представляет основу для более позднего развития атеросклеротической бляшки аутовенозного трансплантата. В отличие от аутоартериальных шунтов, в аутовенозных трансплантатах процесс гиперплазии интимы начинается после регенерации эндотелия, которая и является пусковым механизмом. Факторами, стимулирующими гиперплазию интимы шунтов, являются гиперхолестеринемия и артериальная гипертония. При выполнении эндартерэктомии из коронарных артерий в течение 6 месяцев пролиферация миофибробластов сопровождается отложением коллагеновых и эластических волокон, приводящим к разглаживанию и выравниванию поверхности артерии. После этого постепенно происходит существенное уменьшение клеточных элементов и выпячивание стенки артерии за счет соединительной ткани, что может через 5 лет привести к возникновению стеноза. Атеросклеротические изменения очень незначительны и мало влияют на утолщение стенки артерии.
На основании вышесказанного ясно, что продолжение медикаментозной терапии, направленной на факторы тромбообразования, а также терапия дислипидемий оказывают существенное влияние на проходимость шунтов в послеоперационном периоде (рис. 9). На протяжении всей жизни пациент, перенесший операцию КШ, должен принимать антитромбоцитарные средства, а в ряде случаев и прямые антикоагулянты.
#image.jpg
Рис.9. Профилактика окклюзии шунтов после аортокоронарного шунтирования.
Коррекция нарушений липидного обмена. Коррекция факторов риска и терапия дислипидемии включают мероприятия по профилактике атеросклероза и медикаментозную терапию. К медикаментозным средствам, влияющим на липидный обмен, как известно, относятся: ингибиторы 3-гидрокси-3-метилглутарил-коэнзима А-редуктазы (ГМГ-КоА-редуктазы) (статины), ингибиторы абсорбции холестерина (ХС) в кишечнике (эзетимиб), секвестранты желчных кислот, производные фиброевой кислоты, никотиновая кислота и омега-3 полиненасыщенные жирные кислоты (ПНЖК).
Ингибиторы ГМГ-КоА-редуктазы (статины). В настоящее время статины являются наиболее распространенными препаратами для лечения дислипидемии. В рандомизированных клинических исследованиях показана их высокая эффективность в снижении общего холестерина (ОХС) и ХС липопротеидов низкой плотности (ЛНП). Наряду с гиполипидемическим действием статины обладают и нелипидными эффектами, которые реализуются в улучшении функции эндотелия, подавлении воспаления в сосудистой стенке, снижении агрегации тромбоцитов и пролиферативной активности ГМК. В связи с этим применение препаратов данной группы является наиболее предпочтительным у больных, перенесших операцию КШ.
Сегодня на фармацевтическом рынке РФ имеются все препараты группы статинов: ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин. Кроме того, зарегистрированы более 30 статинов-генериков. Как правило, по своей гиполипидемической активности они не уступают оригинальным препаратам, но являются менее дорогостоящими, что в какой-то мере помогает решить проблему их доступности более широкому кругу пациентов. Однако в ряде случаев не наблюдается полной эквивалентности генериков с оригинальными препаратами по степени изменений показателей липидного спектра, а также отсутствуют крайне важные плейотропные (нелипидные) эффекты (улучшение функции эндотелия, подавление воспаления в сосудистой стенке, снижение агрегации тромбоцитов и пролиферативной активности ГМК). Все эти вопросы врачи должны обсудить с пациентом при назначении лечения для того, чтобы найти оптимальный вариант гиполипидемической терапии.
При наличии показаний и отсутствии противопоказаний к терапии статинами препараты данной группы назначаются уже на ранних сроках после операции КШ.
Ингибитор абсорбции ХС в кишечнике (эзетимиб) зарегистрирован в РФ в 2004 г. Препарат относится к новому классу гиполипидемических средств, блокирующих абсорбцию ХС в эпителии тонкого кишечника. Эзетимиб не влияет на абсорбцию жирных кислот, триглицеридов и жирорастворимых витаминов. При его применении снижается уровень ХС ЛНП и повышается содержание ХС липопротеидов высокой плотности (ЛВП). Однако оптимальным является применение эзетимиба с невысокими дозами статинов.
Производные фиброевой кислоты (фибраты). В РФ на настоящее время зарегистрированы следующие фибраты: ципрофибрат (липанор) и фенофибрат (трайкор и липантил). Терапия фибратами сопровождается значимым снижением уровня триглицеридов, ХС ЛНП (на 10-15%) и достоверным повышением концентрации ХС ЛВП. Существуют данные, что фибраты проявляют и плейотропные свойства. Основным показанием для назначения фибратов является изолированная гипертриглицеридемия в сочетании с низким уровнем ХС ЛВП.
Комбинированная терапия нарушений липидного обмена позволяет решить задачи, которые не под силу монотерапии, так как каждое из гиполипидемических средств влияет на определенное звено метаболизма липидов и липопротеидов. В этой связи в настоящее время наметилась тенденция к назначению комбинированной гиполипидемической терапии.
При затруднениях в достижении целевого уровня показателей липидного обмена, при появлении побочных эффектов на высоких дозах к терапии статинами рекомендуется добавить эзетимиб в дозе 10 мг/сут, а в ряде случаев и 20 мг/сут, дозу статина при этом не следует увеличивать выше 20 мг/сут. Положительный опыт накоплен при применении комбинации эзетимиба с симвастатином и аторвастатином. Созданы и комбинированные препараты, в том числе препарат, содержащий фиксированные дозы симвастатина (10, 20, 40 и 80 мг) и эзетимиба (10 мг).
Отдельную группу составляют больные с сахарным диабетом 2 типа. У данной категории больных чаще прибегают к комбинации статинов (флувастатина, симвастатина) с фибратами. Основная идея такой комбинации состоит в том, что статины более эффективно предупреждают развитие макрососудистых осложнений, а фибраты — развитие диабетической микроангиопатии. При этом обеспечивается эффективное снижение ХС ЛНП, триглицеридов и более выраженное повышение ХС ЛВП (синергический эффект фибратов и статинов). Однако необходимо помнить, что комбинация статинов с фибратами повышает риск миопатии. При необходимости такого сочетания нужно контролировать показатели печеночных ферментов и креатинфосфокиназу (КФК) не реже 1 раза в месяц.
Никотиновая кислота и омега-3 ПНЖК. Больные, перенесшие реконструктивную операцию на сосудах сердца, относятся к категории очень высокого 10-летнего риска смерти. Соотношение эффективности лечения и частоты побочных явлений при монотерапии никотиновой кислотой и омега-3 ПНЖК не является оптимальным для данной категории пациентов. Прием препаратов омега-3 ПНЖК можно рекомендовать в качестве дополнения к стандартной терапии. Но и в этом случае необходимо помнить, что длительная терапия препаратами омега-3 ПНЖК чревата повышенным риском диареи и желудочных кровотечений. В практике сердечно-сосудистой хирургии препараты данных групп не имеют широкого применения.
Симптоматическая терапия в послеоперационном периоде
Нередко после выписки из стационара пациенту рекомендуется продолжение медикаментозной терапии, направленной на профилактику и в ряде случаев лечение постперикардиотомного синдрома, сердечной недостаточности, профилактику нарушений ритма сердца, коррекцию артериального давления у больных с артериальной гипертонией, профилактику осложнений со стороны желудочно-кишечного тракта, коррекцию уровня сахара крови у больных с сахарным диабетом, профилактику осложнений со стороны органов дыхания, профилактику и лечение осложнений со стороны мочевыводящих путей, а также в ряде случаев проведение терапии гепатопротекторами. Кроме того, при выполнении шунтирования лучевой артерией с целью предупреждения риска возникновения спазма шунта лучевой артерии до 3-х месяцев продолжают специфическую терапию антагонистами кальция.
К важнейшим аспектам реабилитационного периода относятся также физическое и психосоциальное восстановление пациента.
Физическая реабилитация в послеоперационном периоде — это комплекс физических упражнений, с помощью которых наилучшим образом достигается адаптация сердечно-сосудистой системы к привычной двигательной активности больного (рис. 10).
#image.jpg
Рис. 10. Реабилитация в послеоперационном периоде.
Смысл физической реабилитации — вернуть оперированного пациента к обычной для него жизни, лишить чувства физической ущербности, позволить заняться прежним хобби. Физическая реабилитация является и частью психологической, т.к. у пациента после операции на сердце существует страх физической нагрузки, а когда он занимается под контролем профессионала, то успешно преодолевает этот страх. Лечебная физкультура, проводимая в послеоперационном периоде, должна включать в себя индивидуальные и групповые занятия с методистом, пешеходные прогулки, плавание в бассейне, тренажеры.
К наиболее приемлемым видам физических тренировок относятся ходьба, подъем по лестнице, велосипед. Ходьба является наиболее предпочтительным видом физических упражнений. Для восстановления механики дыхания важны дыхательные упражнения: тренировка диафрагмального дыхания, занятия с помощью спирометра, дыхание с сопротивлением выдоху.
К физической реабилитации можно отнести и физиотерапевтические процедуры, полезные на реабилитационном этапе: ингаляции, массаж, ванны.
Эмоциональная дисфункция и психосоциальное восстановление. Тревога и депрессия часто сопровождают операции КШ. Тревога может осложнять уход за больным. Настроение больного в течение первого года после КШ, как правило, совпадает с его настроением до операции. Даже после успешной операции примеры чужой смерти, ограничения физической и сексуальной активности могут породить нигилизм в отношении воздействия на факторы риска, играющих роль в выздоровлении пациента.
Курс 3-месячной реабилитации приводит к достоверному улучшению следующих показателей: степени депрессии, тревоги, враждебности, соматизации, умственных способностей, энергичности, общего самочувствия, болевых синдромов, функционального статуса, благополучия и общего уровня качества жизни.
Социально-трудовая реабилитация. При максимальном стремлении к «возвращению в строй» необходимо понимать, что в течение 4 месяцев после стернотомии (срок срастания шва грудины) больному противопоказано поднимать и носить груз более 5 кг, проводить ремонтные работы и работы, связанные с наклонами и разведением рук в стороны, делать резкие движения. В течение нескольких недель не показано вождение автомобиля.
Пациентам, перенесшим КШ, в течение всей жизни противопоказана работа, связанная с периодическим значительным физическим напряжением и умеренным, но постоянным физическим напряжением (например, ходьба в течение всего рабочего дня), работа, связанная с гипоксией, а также работа, связанная с вождением транспорта. Пациентам, перенесшим до или после операции крупноочаговый инфаркт миокарда, в течение всей жизни противопоказана работа с нагрузками «рывкового» типа.
В исследованиях, посвященных эффективности кардиологической реабилитации, сравнивались группы стандартного послеоперационного наблюдения и наблюдения в сочетании с реабилитацией по программе. Показано, что пациенты, прошедшие реабилитацию, отличались большей физической мобильностью и чаще приступали к работе в течение первых 3 лет после операции. В США проведено исследование, показавшее, что включение реабилитации в полный лечебный цикл является экономически выгодным: в течение 3 лет наблюдения после коронарных событий общая стоимость стационарного лечения в группе без реабилитации превосходила таковую в группе реабилитации более чем в полтора раза.
Основные принципы физической, психологической и социальной реабилитации пациента после аортокоронарного шунтирования. Грамотно организованный реабилитационный этап у больных, перенесших КШ, становится началом вторичной профилактики атеросклероза и важной частью кардиопротективной стратегии (рис. 11).
#image.jpg
Рис.11. Основные принципы физической, психологической и социальной реабилитации пациента после аортокоронарного шунтирования.
Только обеспечение преемственности между специалистами: врачом стационара и врачами реабилитационного стационара, врачами общей практики позволяет продолжить адекватную вторичную медикаментозную профилактику. Кроме того, это позволяет адекватно продолжить физическую, психологическую и социальную реабилитацию, начатую уже на госпитальном этапе.
Однако, процесс лечения больных, перенесших КШ, не заканчивается на периоде восстановления и адаптации к повседневной жизни, так как мы выходим уже на следующий этап — отдаленный послеоперационный период. Нельзя забывать о том факте, что ИБС — это хроническое заболевание, кроме того, происходит постепенное естественное старение организма оперированного человека. Все это требует пожизненного мониторинга данной категории пациентов и обязательного проведения адекватной медикаментозной поддержки с использованием всех новых возможностей фармакотерапии.
© Отделение сердечно-сосудистой хирургии, 2009