Рецидив инфаркта миокарда. Повторный инфаркт миокарда
Рецидивом инфаркта миокарда называют повтор острого инфаркта в течение всего острого периода предшествующего инфаркта, т. е. рецидив возникает в периоде от 3 дней до 2 месяцев от начала первого инфаркта. В большинстве случаев такой рецидив локализуется в области первого инфаркта или по его периферии, как бы увеличивая его размеры. Иногда он имеет локализацию и в отдалении от первого инфаркта. Повторным инфарктом миокарда называют острый инфаркт развившийся на фоне постинфарктного кардиосклероза, т.е. позже чем через 2 месяца от начала первого инфаркта.
Он может развиться как в той же стенке сердца. что и первый, так и в другой стенке, в том числе и в области, диаметрально противоположной расположению первого инфаркта по их отношению к «электрическому центру» сердца. В зависимости от взаиморасположения инфарктов и их размеров существенно зависит электрокардиографическая картина и трудности диагностики как в остром периоде повторного инфаркта, так и в периоде его рубцевания.
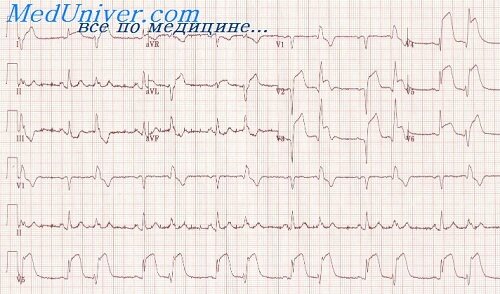
Рецидив инфаркта миокарда развивается в течение острого инфаркта, т.е. от 3 дней до 2 месяцев от начала первого инфаркта. В остром периоде рецидива или повторного инфаркта могут наблюдаться изменения всех зубцов и сегментов ЭКГ. Комплекс QRS деформируется вследствие изменения направления уже отклоненного ранее патологического вектора ЭДС в зависимости от взаиморасположения первичного и повторного инфарктов.
При повторном инфаркте. развившемся на противоположной первому инфаркту стороне левого желудочка, начальный вектор QRS отклоняется в сторону, противоположную исходному его направлению, определенному первым инфарктом. Вследствие этого зубец Q, отражающий первый инфаркт, уменьшается или исчезает в зависимости от величины повторного инфаркта. Эти же соотношения размеров противолежащих инфарктов обусловливают появление или отсутствие патологического зубца Q в отведениях, соответствующих локализации повторного инфаркта (или в отведениях противоположных ему увеличение реципрокного зубца R).
Если повторный инфаркт больше первого, то старый зубец Q исчезает, новый патологический Q появляется в отведениях, соответствующих повторному инфаркту, или увеличивается R в отведениях, противоположных повторному инфаркту. В этом случае диагностируется один инфаркт. А при равных размерах инфарктов в рубцовой стадии могут отсутствовать признаки обоих инфарктов. Однако даже в таких случаях в острейшем периоде повторного инфаркта зарегистрируется подъем сегмента RS — Т или его реципрокное смещение вниз в отведениях с противоположной стороны.
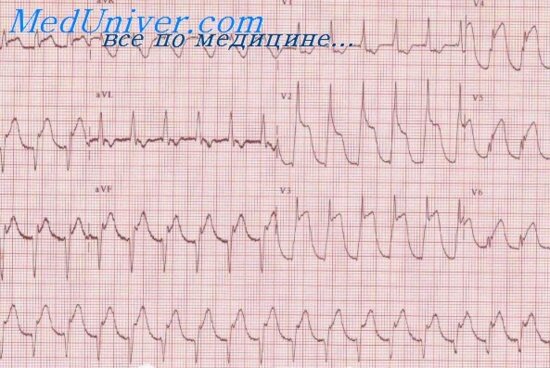
Повторный инфаркт миокарда нередко локализуется на той же стороне сердца, что и первичный, как бы увеличивая его. В таких случаях появляется патологический зубец Q или снижается зубец R в отведениях, расположенных рядом с отведениями, где ЭКГ была ранее изменена и смещается вверх сегмент RS — Т. Если рецидив не увеличивает размеры инфаркта, то останутся прежние изменения QRS (QS или Or) и выявится подъем RS — Т, затем инверсия Т. При одностороннем расположении обоих инфарктов на ЭКГ в рубцовой стадии наблюдается картина одного обширного инфаркта.
В случаях расположения инфаркта первичного и повторного в разных стенках (но не диаметрально противоположных друг другу) на ЭКГ могут быть изменения комплекса QRS, сегмента RS -Т и зубца Т, характерные для обоих инфарктов.
Конечная часть желудочкового комплекса. как правило, существенно изменяется в острой стадии повторного инфаркта. Однако эти изменения сегмента RS — Т и зубца Т могут быть непродолжительными, особенно смещения RS — Т. поэтому необходима ежедневная ЭКГ динамика.
При повторных инфарктах часто наблюдаются изменения зубца Р. указывающие на перегрузку левого предсердия.
Для диагностики на ЭКГ повторного инфаркта, определения его размеров и диагностики старого рубца огромное значение имеет сопоставление последних ЭКГ со старыми ЭКГ.
Оглавление темы «ЭКГ при инфаркте миокарда»:
Повторный инфаркт миокарда
О повторном ИМ говорят в том случае, если он развивается через несколько месяцев (обычно не менее 2) или лет после перенесенного ранее инфаркта, т. е. после полного завершения рубцевания предыдущего очага. Наиболее часто он возникает в течение 1-го года.
Отмечается тенденция к росту числа больных повторным инфарктом, что объясняется улучшением ранней диагностики и терапии ИМ, а также увеличением числа больных хронической ИБС. Чаще повторный ИМ развивается у мужчин. Среди больных преобладают лица пожилого возраста. Развитию повторного ИМ способствует гипертоническая болезнь, особенно гипертонические кризы.
На клиническую картину повторного ИМ влияет ряд факторов: длительность межинфарктного периода, размеры вновь возникающего инфаркта, исходное состояние сердечной мышцы [Попов В. Г. 1971, и др.]. Повторный ИМ протекает более тяжело, с частым развитием острой, а затем и хронической сердечной недостаточности. Нередки астматический вариант инфаркта, атипичное течение заболевания, склонность к различным аритмиям. Летальность при повторном ИМ, как и при затяжном течении инфаркта, значительно выше, чем при первичном.
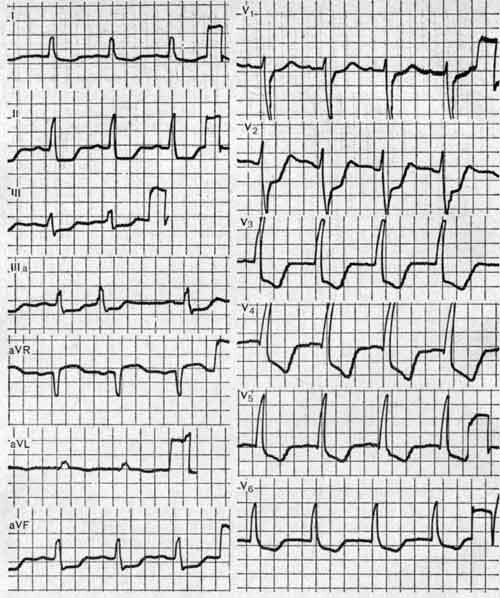
Электрокардиографическая диагностика повторного ИМ во многих случаях затруднительна. Изменения ЭКГ могут быть самыми разнообразными. Они зависят от локализации рубцовых и свежих очаговых изменений миокарда, их величины, периода, прошедшего от предыдущего инфаркта до последнего, количества перенесенных инфарктов.
Может наблюдаться так называемая псевдонормализация ЭКГ, например появление положительного зубца Т вместо негативного или повышение сниженного ранее интервала S — Т до изоэлектрической линии. Поэтому для выявления повторных очаговых изменений и уточнения локализации их важны сравнение ЭКГ с предыдущими и динамическое наблюдение за ЭКГ.
Если на основании ЭКГ трудно сделать заключение о наличии повторных свежих очаговых изменений миокарда, следует особенно тщательно проанализировать клинику заболевания, динамику изменения состава крови, температуры, ферментов, провести сцинтиграфию миокарда с пирофосфатом. В таких случаях подтвердить или отвергнуть диагноз повторного ИМ можно лишь при достаточно продолжительном (не менее 5 — 7 дней) наблюдении.
«Инфаркт миокарда», М.Я.Руда
Читайте далее:
Затяжное и рецидивирующее течение инфаркта миокарда
Осложнения инфаркта миокарда
Осложнения инфаркта миокарда могут быть ранними, возникающими в острый период заболевания, и поздними, формирующимися в подостром периоде.
Кардиогенный шок
является одним из самых тяжелых ранних осложнений острого инфаркта миокарда .
Патогенез
В патогенезе кардиогенного шока выделяют несколько звеньев: снижение насосной функции миокарда, снижение сосудистого тонуса, а при наличии аритмии (особенно при желудочковой пароксизмальной тахикардии) — дополнительное снижение сердечного выброса.
Тяжесть кардиогенного шока коррелирует с площадью очага некроза при инфаркте, т. е. зависит от уменьшения массы функционирующего миокарда левого желудочка. У больных повторным инфарктом миокарда на фоне уже имеющихся постинфарктных рубцов кардиогенный шок может возникать и при мелкоочаговой форме инфаркта.
В результате перечисленных патогенетических изменений возникают тяжелые нарушения микроциркуляции органов и тканей с формированием эритроцитарного стаза, повышением проницаемости стенок капилляров и развитием метаболического ацидоза.
В развитии кардиогенного шока имеет значение и исходное состояние больного, так как у лиц, страдающих гипертонической болезнью. кардиогенный шок может развиться при умеренном снижении артериального давления (до 130/80 мм рт. ст.).
Тяжесть кардиогенного шока зависит от:
1) его длительности;
2) реакции на прессорные амины;
3) выраженности олигурии;
4) степени выраженности ацидоза;
5) показателей артериального и пульсового давления. Наиболее тяжело протекает так называемый ареактивный шок. устойчивый к противошоковой терапии.
Клиника
Кадиогенный шок проявляется резким снижением артериального (особенно пульсового) давления, что сопровождается симптомами шока. бледностью, иногда цианозом кожи, холодным, липким потом. При этом черты лица заострены, пульс нитевидный, систолическое артериальное давление ниже 70 мм рт. ст. отмечаются нарушение сознания в различной степени, олигурия вплоть до анурии.
Сердечная астма. Отек легких
Развитие этих осложнений связано со слабостью сократительной функции миокарда левого желудочка при массивном некротическом поражении миокарда и резком повышении диастолического давления в левом желудочке. Левожелудочковая недостаточность возникает во время болевого приступа или сразу после его окончания.
Патогенез
В патогенезе левожелудочковой недостаточности имеют значение не только снижение насосной функции сердца. но и рефлекторный спазм легочных сосудов (рефлекс Катаева), повышение проницаемости капиллярной стенки в результате гипоксии и активизации симпатоадреналовой системы. В результате резко повышается давление в легочных венах и капиллярах, происходит выход жидкой части крови из их просвета вначале в ткань легких (интерстициальный отек), а затем в альвеолы (альвеолярный отек).
Клиника
Сердечная астма клинически проявляется в виде приступа удушья, который сопровождается бледностью кожных покровов, акроцианозом и появлением холодного пота.
Больной возбужден, чувствует страх смерти, принимает вынужденное положение-ортопноэ.
Аускультативно в легких (вначале только в нижних отделах, а затем над всей поверхностью) определяются влажные хрипы, нередко сочетающиеся с сухими свистящими хрипами, вызванными сопутствующим бронхоспазмом. При прогрессировании отека влажные хрипы усиливаются, дыхание становится клокочущим, появляется пенистая мокрота, часто с примесью крови .
Рентгенологически определяется картина «застойного легкого» с облаковидным прикорневым сгущением легочного рисунка, постепенно просветляющимся к периферии.
Нарушения ритма и проводимости
Нарушения ритма и проводимости возникают у подавляющего большинства больных инфарктом миокарда .
В связи с образованием очага некроза снижается порог возбудимости миокарда, возникают очаги патологической импульсации, создаются условия для механизма « re-entry », замедляется внутрисердечная проводимость. Нарушения ритма и проводимости при инфаркте миокарда часто носят транзиторный характер. Возникновение аритмии значительно изменяет гемодинамику.
Нарушения ритма, сопровождающиеся тахикардией со значительным снижением ударного и минутного выброса (тахисистолическая форма мерцательной аритмии. пароксизмальная желудочковая тахикардия), являются прогностически неблагоприятными. Они могут вызвать в дальнейшем развитие аритмогенного шока или острой сердечной недостаточности. Некоторые аритмии могут предшествовать или провоцировать другие более тяжелые и прогностически неблагоприятные нарушения ритма. Полная атриовентрикулярная блокада может сопровождаться приступами Морганьи-Адамса-Стокса в виде кратковременной потери сознания с судорогами и вызывать развитие сердечной недостаточности .
Разрыв сердца
Разрыв сердца является редким осложнением инфаркта миокарда. но приводит к почти 100%-ной летальности. Чаще возникает на 5—6 -й день от начала инфаркта, но может наступить и в первые дни заболевания. Разрыв миокарда клинически проявляется резкой болью, которая не купируется приемом анальгетиков. При разрыве стенки миокарда быстро развиваются картина кардиогенного шока и остановка сердца. вызванная тампонадой сердца .
При обширном разрыве смерть наступает мгновенно, при небольшом — в течение нескольких минут или даже часов.
При маленьком («прикрытом») разрыве может формироваться ложная аневризма. что продлевает жизнь больных на несколько месяцев.
Разрыв межжелудочковой перегородки проявляется аускультативно грубым систолическим шумом в области нижней трети грудины и быстрым развитием тотальной недостаточности кровообращения .
Абдоминальный синдром
Абдоминальный синдром развивается в остром периоде инфаркта миокарда и может протекать в различных клинических формах: образования острых эрозий и язв слизистой оболочки желудочно-кишечного тракта, развития пареза желудка, кишечника, атонии мочевого пузыря.
Образование язв и эрозий связано с гипоксией слизистой оболочки на фоне гемодинамических нарушений, тромбозом мелких сосудов, действием медикаментозных препаратов (аспирина).
Формирование язв сопровождается болями, неустойчивым стулом, иногда кровотечением (возникают рвота кофейной гущей, мелена).
Парез кишечника проявляет себя вздутием живота, распирающими болями, задержкой отхождения стула и газов и может быть следствием повторного введения морфина и атропина, как и атония мочевого пузыря.
Эпистенокардический перикардит
Асептический воспалительный процесс, который проявляется ограниченным и кратковременным шумом трения перикарда.
Раздражение субэпикардиальных аритмогенных зон может вызывать суправентрикулярные аритмии .
У некоторых больных выпот в полости перикарда может организовываться с образованием спаек.
Аневризма сердца
Это ограниченное выпячивание стенки миокарда, обычно левого желудочка. Чаще аневризма формируется в острый, реже в подострый период инфаркта миокарда. Ее образование связано с давлением, которое оказывает кровь на поврежденный участок сердечной мышцы.
Чаще аневризма формируется в области передней стенки миокарда, реже — верхушки, задней стенки или межжелудочковой перегородки.
При пальпации больного определяется прекардиальная пульсация в области III-IV ребер слева от грудины. Левая граница сердца смещается влево до среднеаксиллярной линии. Аускультативно определяются глухость сердечных тонов, систолический, реже диастолический шум.
На ЭКГ длительное время сохраняется типичная для острого периода инфаркта монофазная кривая. Диагноз подтверждается данными эхокардиографии.
Аневризма может быть источником тромбоэмболии, разрываться на ранних стадиях формирования. Нередко у больных аневризмой развиваются нарушения ритма и проводимости.
Тромбоэндокардит
Это асептическое воспаление, развивающееся в тромботических массах на поверхности эндокарда в зоне инфаркта
Чаще тромбоэндокардит осложняет течение крупноочаговых и трансмуральных инфарктов, особенно с формированием постинфарктной аневризмы сердца .
Отмечаются субфебрильная температура тела, слабость, тахикардия, повышенная потливость. У некоторых больных тромбоэндокардит никак себя не проявляет.
При эхокардиографии и вентрикулографии определяется внутрисердечный тромб.
Тромбоэмболические осложнения
Тромбоэмболические осложнения возникают при инфаркте миокарда из-за нарушения гемодинамики и реологических свойств крови .
Тромбоэмболии возникают при отрыве кусочков пристеночных тромбов в месте очага некроза или рыхлых тромбов вен нижних конечностей и малого таза. Поражаются преимущественно ветви легочной артерии.
Клиническая картина различна и зависит от диаметра сосуда. При тромбоэмболии сосуда крупного калибра, как правило, наступает быстрая смерть, иногда после приступа резчайших загрудинных болей и удушья. Тромбоэмболия мелких сосудов проявляется клиникой инфарктной пневмонии .
Психические нарушения
Психические нарушения могут возникнуть на любой стадии заболевания. Они связаны с гипоксией, тромбозом или тромбоэмболией мелких сосудов мозга, чаще возникают у людей пожилого возраста.
В первые дни заболевания чаще регистрируется депрессивный или тревожно-депрессивный синдром, чередующийся с периодами эйфории.
Могут возникать кратковременные психотические состояния и даже делирий.
Истинные реактивные состояния возникают в течение первых 2 недель. В более поздние сроки могут сформироваться астенический синдром. ипохондрия.
При отсутствии адекватного лечения этих расстройств у больного могут на длительное время остаться астенизация, нарушение сна, тяжелые невротические реакции и фобии.
Постинфарктный синдром
Постинфарктный синдром (синдром Дресслера) развивается на 2—6 -й неделе инфаркта миокарда .
Развитие постинфарктного синдрома связано с образованием в некротизированном участке миокарда тканевых аутоантигенов, на которые в организме вырабатываются аутоантитела.
Клиническая картина синдрома Дресслера включает триаду признаков: перикардит. плеврит и пневмонии (синдром трех «П»).
Компоненты триады могут отмечаться у больного в виде монопоражения или сочетаться.
Кроме того, при постинфарктном синдроме могут развиться синовит, периартрит, нефрит, васкулит.
Это осложнение сопровождается повышением температуры тела, ускорением СОЭ и лейкоцитозом с сдвигом формулы влево, а также эозинофилией.
Поражение серозных оболочек носит фибринозный, серозный или геморрагический характер и часто характеризуется упорным рецидивирующим течением. В лечении эффективны глюкокортикоиды.
Рецидивирующий и повторный инфаркт миокарда
При выраженном атеросклерозе коронарных артерий. тенденции к стенозированию или активному тромбообразованию больной может переносить несколько инфарктов миокарда. Если новый инфаркт возникает в период, когда формирование рубца еще не закончилось (в течение 2—2,5 месяцев после острого приступа), говорят о рецидивирующем инфаркте, если в более поздние сроки — о повторном инфаркте миокарда .
Рецидивирующий инфаркт обычно проявляется типичным болевым приступом, воспалительно-резорбтивным синдромом (наблюдаются субфебрилитет, лейкоцитоз, ускорение СОЭ, повышение активности в крови ферментов — маркеров) и характерными изменениями ЭКГ.
Рецидивирующий инфаркт миокарда часто сопровождается развитием сердечной недостаточности. нарушениями ритма и проводимости, кардиогенным шоком .
Повторный инфаркт миокарда чаще возникает у лиц пожилого возраста. При этом болевой синдром может быть выражен незначительно или отсутствовать.
Иногда повторный инфаркт протекает по типу приступа сердечной астмы или эпизода острой аритмии. После него нередко развивается недостаточность кровообращения .
Диагностика повторного инфаркта осложняется наличием на ЭКГ постинфарктных изменений от предыдущих инфарктов.
Летальность при повторном инфаркте значительно выше, чем при первичном.
Лечение осложнений
Лечение нарушений возбудимости и автоматизма
(таких как предсердная и желудочковая экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия ) проводится антиаритмиками IА группы (хинидином, новокаинамидом 10%-ным 5 мл внутримышечно каждые 6 ч), 1В группы (лидокаином и дифенином), блокаторами кальциевых каналов, реже блокаторами β-адренергических рецепторов. Все эти группы препаратов удлиняют фазу реполяризации и в меньшей степени деполяризации, подавляют автоматизм эктопических очагов возбуждения, но оказывают также ряд побочных эффектов при их нерациональном применении.
В этом случае могут наблюдаться аритмогенные побочные эффекты (аритмии типа «torsade de pointes», желудочковая тахикардия, фибрилляция желудочков, блокада), волчаночно-подобный синдром, гипотензия, обморок. головокружение, горький вкус во рту, диарея, потеря аппетита, тошнота. рвота. гастралгия, гепатит. анемия. тромбо-цитопения, аллергические реакции.
Лечение суправентрикулярных экстрасистол и пароксизмов, а также пароксизмов мерцательной аритмии
необходимо начинать с новокаинамида, изоптина по 0,04 г 3—4 раза в сутки, кордарона 5%-ного по 6—9 г внутривенно и сердечных гликозидов. При неэффективности такой терапии можно применять β-адреноблокаторы (обзидан в таблетках по 0,04 г 3—4 раза в сутки). Если же и они не приносят ожидаемого эффекта, прибегают к электроимпульсной терапии (ЭИТ).
При желудочковых пароксизмах и частых желудочковых экстрасистолах
в первую очередь назначается лидокаин 1%-ный 10 мл внутривенно, при отсутствии эффекта — новокаинамид или обзидан 0,1%-ный 5 мл, а при сохранении аритмии — электроимпульсная терапия.
После восстановления синусового ритма проводится длительное (в течение недель или месяцев) антиаритмическое лечение поддерживающими дозами.
Блокады ножек пучка Гиса и неполная атриовентрикулярная блокада I степени
при инфаркте миокарда часто являются преходящими и не требуют специального лечения, если не вызывают ухудшения состояния больного.
Лечение кардиогенного шока
в первую очередь направлено на купирование болевого синдрома. Одновременно необходимо повысить артериальное давление и пропульсивную способность миокарда.
С этой целью назначают допамин (допмин) 4%-ный 5 мл внутривенно капельно, который усиливает и ускоряет сокращения миокарда, повышает сердечный выброс и артериальное давление, не вызывая резкого нарастания периферического сопротивления. Вводится допамин внутривенно медленно. При отсутствии допамина применяют норадреналин или мезатон, которые вводят также внутривенно медленно в комбинации с дроперидолом для профилактики спазма периферических сосудов .
Эффективно сочетанное введение допамина и раствора нитроглицерина внутривенно, которое дает сочетание стимулирующего кардиотропного действия и снижение пред-и постнагрузки на миокард.
Для повышения артериального давления применяются глюкокортикоиды (преднизолон 20—30 мг), низкомолекулярные декстраны.
При сочетании кардиогенного шока с нарушениями сердечного ритма проводится антиаритмическая терапия по принятым схемам в сочетании с вазопрессивными средствами. Ограничение тромбообразования (как коронарного, так и периферического) достигается применением гепарина.
Для борьбы с ацидозом внутривенно капельно вводят щелочные растворы (лактат натрия, гидрокарбонат натрия 5%-ный 200 мл внутривенно капельно).
Лечение кардиогенного шока должно быть длительным и не заканчиваться в момент стабилизации артериального давления и улучшения самочувствия больного, так как его рецидивы являются неблагоприятным прогностическим признаком.
Сердечная астма. Отек легких
Лечение этих осложнений направлено на снижение давления в левом желудочке и малом круге кровообращения в фазу диастолы путем повышения сократительной функции миокарда, снижения притока к сердцу крови из полых вен и уменьшения общего периферического сосудистого сопротивления. С этой целью широко применяются периферические вазодилататоры, в первую очередь нитраты.
Нитраты расширяют венозные сосуды малого калибра, уменьшая приток крови к правому предсердию, а также снижают тонус артериол, уменьшая общее периферическое сопротивление.
Больным с высокой артериальной гипертензией назначают апрессин. Возможно очень медленное капельное введение сердечных гликозидов в сочетании с поляризующей смесью, что снижает риск развития аритмий .
Давление в сосудах легких снижается после внутривенного введения эуфиллина. Преднагрузку на сердце быстро и эффективно снижают ганглиоблокаторы (арфонад, пентамин), но они должны применяться только при нормальном систолическом давлении.
Появление симптомов отека легких требует назначения пеногасителей (антифомсилана — 10%-ного спиртового раствора), введения атропина, хлористого кальция и быстродействующих диуретиков (лазикса) 40—80 мг внутривенно.
При необходимости назначают седативные препараты (седуксен).
Тромбоэмболические осложнения
лечат применением антикоагулянтов и фибринолитиков.
Гепарин вводится в суточной дозе 40 000—60 000 ЕД, стрептаза — 1 000 000 ЕД. Эти препараты назначают в сочетании с сосудорасширяющими средствами (папаверином). Применяют также реополиглюкин. Лечение проводится под регулярным контролем времени свертывания крови .
Постинфарктный синдром Дресслера
лечится патогенетически назначением малых и средних доз стероидных гормонов (преднизолона 30—60 мг в сутки). Кроме того, по показаниям назначаются симптоматические средства: анальгетики, антигистаминные средства.
Хроническая сердечно-сосудистая недостаточность
лечится назначением сердечных гликозидов и мочегонных средств, в том числе салуретиков.
Наиболее эффективен фуросемид (лазикс), а при отсутствии достаточного диуреза назначаются гипотиазид, этакриновая кислота (урегит).
Назначение тиазидовых препаратов вызывает значительный калийурез, поэтому необходимо одновременное применение препаратов калия или антагонистов альдостерона, обладающих калийсберегающим действием (верошпирона, триамтерена). На ранних стадиях эффективно действуют ингибиторы аденозинпревращающего фермента (каптоприл, эналаприл).
При недостаточном эффекте добавляют периферические вазодилататоры. Обязательным является назначение средств метаболического действия (фолиевой кислоты, рибоксина, ретаболила).
Все больные инфарктом миокарда должны пройти полный курс восстановительной терапии, в которую входят:
1) медикаментозное лечение;
2) физическая реабилитация;
3) психическая реабилитация;
4) социальная реабилитация.
Целями восстановительного лечения являются максимально возможное восстановление соматического и психологического состояния больного и настрой его на возвращение к социально полезному труду. Реабилитация проводится на стационарном этапе лечения (помещение в палату интенсивного наблюдения, отделение кардиологии и отделение реабилитации), на этапе санаторно-курортного лечения и в поликлинике.
Санаторно-курортное лечение является одним из этапов реабилитации больных, благоприятными сторонами которого являются:
1) правильный режим для данного больного с дальнейшим последовательным расширением физических нагрузок под врачебным контролем;
2) благоприятное воздействие природных факторов санаторно-курортной зоны;
3) создание оптимальных условий для хорошего психологического настроя больных.
Больные направляются на санаторно-курортное лечение через 4—6 месяцев после острого инфаркта миокарда при отсутствии у них частых приступов стенокардии и признаков застойной сердечной недостаточности .
Основным принципом восстановительной терапии после перенесенного инфаркта миокарда является постепенное повышение интенсивности физических нагрузок на фоне адекватной и эффективной медикаментозной терапии. При этом необходим постоянный врачебный контроль и мониторинг динамики клинических данных и нагрузочных проб.
Вопрос о трудоспособности больного, перенесшего инфаркт миокарда. решается в зависимости от результатов восстановительного лечения, у большинства больных — через 3—4 месяца после начала заболевания.
Решающее значение при этом играют следующие моменты:
1) площадь и глубина инфаркта, наличие или отсутствие тяжелых осложнений в остром периоде заболевания;
2) наличие или отсутствие сердечно-сосудистой недостаточности;
3) выраженность постинфарктного стенокардического синдрома;
4) состояние резервов сердечно-сосудистой системы, выявленное в процессе восстановительного лечения;
5) психологический настрой больного на возвращение к труду (или отсутствие этого настроя).
Все больные, перенесшие инфаркт миокарда. должны находиться под диспансерным наблюдением с целью сохранения оптимального физического и психологического состояния больного, профилактики возможных осложнений заболевания, решения вопросов его трудоустройства и трудоспособности.
Лекарственная терапия, которую получают больные инфарктом миокарда в период реабилитации, назначается индивидуально с учетом степени хронической коронарной недостаточности. наличия или отсутствия нарушений ритма и кардиальной недостаточности. При благоприятном течении заболевания поддерживающая терапия включает блокаторы β-адренорецепторов и небольшие дозы аспирина.
Ссылка на данную страницу для форума: