Ишемический инсульт
Что такое Ишемический инсульт —
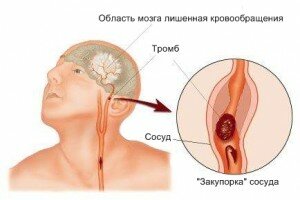
Ишемический инсульт — это клинический синдром, проявляющийся острым нарушением локальных функций мозга, которое продолжается более 24 часов, или приводящий к смерти, может быть вызван либо недостаточностью кровоснабжения в определенной зоне мозга в результате снижения мозгового кровотока, тромбоза или эмболии, связанных с заболеваниями сосудов, сердца или крови.
Что провоцирует / Причины Ишемического инсульта:
Среди основных этиологических факторов, приводящих к развитию ишемического инсульта (ИИ), следует отметить атеросклероз, артериальную гипертензию и их сочетание. Исключительно важна также роль факторов, способствующих повышению свертывающих свойств крови и увеличению агрегации ее форменных элементов. Риск возникновения ИИ возрастает при наличии сахарного диабета, заболеваний миокарда, особенно сопровождающихся расстройствами сердечного ритма.
Патогенез (что происходит?) во время Ишемического инсульта:
Одним из важнейших патогенетических механизмов развития нетромботического ИИ является сужение просвета магистральных артерий головы или интракраниальных сосудов вследствие атеросклероза. Отложение липидных комплексов в интиме артерии приводит к поражению эндотелия с последующим формированием в этой зоне атероматозной бляшки. В процессе ее эволюции размеры бляшки увеличиваются за счет оседания на ней форменных элементов, просвет сосуда при этом сужается, нередко достигая уровня критического стеноза или полной окклюзии. Наиболее часто формирование атеросклеротических бляшек наблюдается в зонах бифуркации крупных сосудов, в частности сонных артерий, вблизи устья позвоночных артерий. Сужение просвета церебральных артерий наблюдается при воспалительных заболеваниях – артериитах. В значительном числе случаев наблюдаются врожденные аномалии строения сосудистой системы мозга в виде гипоили аплазии сосудов, их патологической извитости. В развитии ИИ определенное значение имеет экстравазальная компрессия позвоночных артерий на фоне патологически измененных позвонков. Поражение артерий мелкого калибра и артериол наблюдается при сахарном диабете и артериальной гипертензии.
Существование мощной системы коллатерального кровообращения позволяет поддерживать достаточный уровень мозгового кровотока даже в условиях тяжелого поражения одной или двух магистральных артерий. В случае множественного поражения сосудов компенсаторные возможности оказываются недостаточными, создаются предпосылки для развития ИИ. Риск возникновения ИИ возрастает при нарушении ауторегуляции мозгового кровообращения. В этой ситуации важным фактором, приводящим к возникновению острой церебральной ишемии, является нестабильность артериального давления с его колебаниями как в сторону значительного повышения, так и снижения. В условиях выраженного стенозирующего поражения церебральных артерий артериальная гипотензия, как физиологическая (во время сна), так и развивающаяся на фоне патологических состояний (острый инфаркт миокарда, кровопотеря), является патогенетически более значимой, чем умеренная артериальная гиперт
Симптомы Ишемического инсульта:
Клиническая картина ишемического инсульта представлена симптомами внезапного выпадения функции определенного отдела головного мозга. Они определяются тем отделом головного мозга, который поражен ишемией, объемом повреждения. В большинстве случаев симптомами, которые возникают у пациентов, являются нарушения речи, двигательных и чувствительных функций, зрения на одной стороне.
-
Двигательные нарушения
Cлабость или неловкость движений на одной стороне тела, полные или частичные (гемипарез). Одновременное двустороннее развитие слабости в конечностях (парапарез, тетрапарез). Нарушения глотания (дисфагия). Нарушения координации (атаксия).
-
Нарушения речи
Нарушения понимания или использования речи (афазия). Нарушения чтения (алексия) и письма (аграфия). Нарушения счета (акалькулия). Смазанность речи (дизартрия).
-
Чувствительные нарушения
Соматосенсорные изменения чувствительности на одной стороне тела, полное или частичное (гемигипестезия). Зрительные — снижение зрения на один глаз, полное или частичное (преходящая монокулярная слепота). Выпадения правой или левой половины (или квадранта) поля зрения (гемианопсия, квадрантная гемианопсия). Двусторонняя слепота. Двоение перед глазами (диплопия).
-
Вестибулярные
Ощущение вращения предметов (системное головокружение).
-
Нарушения поведения и познавательных функций
Трудно одеваться, причесываться, чистить зубы и т.д.; нарушение ориентации в пространстве; нарушения копирования рисунков, например, часов, цветка или пересекающихся кубиков (нарушения зрительно-пространственного восприятия). Нарушения памяти (амнезия).
Диагностика Ишемического инсульта:
Решение о необходимости обследования и выбор методов зависят от симптомов у пациента, его возраста, а также заболеваний, которыми пациент страдал до и после инсульта; готовности пациента к риску, расходам и неудобствам; целей обследования и соотношения его стоимости и эффективности. Однако всем больным инсультом, кому проводится интенсивная терапия, необходимо провести перечень обследований первой необходимо-сти, даже если осмотр однозначно указывает на причину болезни.
Исследования, которые нужно проводить всем больным с инсультом:
-
Клинический анализ крови Глюкоза крови, мочевина и электролиты крови Уровень холестерина плазмы крови 12-канальная электрокардиография Экстренная бесконтрастная компьютерная томография (КТ) головного мозга для: — для дифференциальной диагностики геморрагического инсульта и инфаркта мозга (КТ должна быть проведена в течение нескольких часов после инсульта)
Больным, у которых этиология инсульта остается не ясна или у которых по данным осмотра или простых методов обследования можно заподозрить причину, проводятся более специализированные исследования.
-
Ультразвуковое дуплексное сканирование Церебральная ангиография Магнитно-разонансная ангиография (МРА) и внутриартериальная цифровая субтракционная ангиография (ВАЦСА) Трансторакальная эхо-кардиография (ТТ-ЭХО-КГ) Магнитно-резонансная томография
Лечение Ишемического инсульта:
В лечении инсульта принято выделять базисную и дифференцированную терапию. Базисная терапия не зависит от характера инсульта (ишемический или геморрагический). Дифференцированная терапия, напротив, определяется характером инсульта.
Базисная терапия ишемического инсульта
Базисная терапия инсульта направлена, по сути, на поддержание основных жизненно-важных функций организма. Базисная терапия включает в себя обеспечение адекватного дыхания, поддержание кровообращения, контроль и коррекцию водно-электролитных нарушений, уменьшение отека мозга, профилактику и лечение пневмонии.
Дифференцированная терапия в остром периоде
Эпидемиологические исследования свидетельствуют, что не менее 70% ишемических инсультов связаны с тромбозом или тромбоэмболией церебральных артерий. В этих случаях наиболее современным методом лечения является так называемый тромболизис, который достигается внутривенным или внутриартериальным введением активатора тканевого плазминогена.
К настоящему времени благоприятное влияние тромболизиса на исход ишемического инсульта доказан как в рамках контролируемых исследований, так и в повседневной клинической практике.
С целью улучшения реологических свойств крови в остром периоде широко применяется гемодилюция в виде внутривенных вливаний. Эмпирически широко применяют так называемые вазоактивные препараты (пентоксифиллин, инстенон, винпоцетин, блокаторы кальциевых каналов), хотя подтверждения их клинической эффективности в настоящее время не имеется.
Ведение пациентов в восстановительном периоде ишемического инсульта
Как правило, при благоприятном течении ишемического инсульта, вслед за острым возникновением неврологической симптоматики, наступает ее стабилизация и постепенный регресс. Предполагается, что в основе уменьшения выраженности неврологической симптоматики лежит процесс "переобучения" нейронов, в результате которого интактные отделы головного мозга берут на себя функции пострадавших отделов.
Не вызывает сомнений, что активная двигательная, речевая и когнитивная реабилитация в восстановительном периоде ишемического инсульта благоприятно влияет на процесс "переобучения" нейронов и улучшает исход. Реабилитационные мероприятия следует начинать как можно раньше и систематически проводить, как минимум, в течение первых 6-12 месяцев после ишемического инсульта. В эти сроки темп восстановления утраченных функций максимален. Однако показано, что реабилитационные мероприятия оказывают положительный эффект и в более поздние сроки.
При любом патогенетическом варианте с первых часов манифестации клинических симптомов необходимо назначить антитромбоцитарные препараты, что уменьшает риск повторных ишемических событий на 20-25%.
Дальнейшая профилактика повторных ишемических инсультов должна быть нацелена на коррекцию основных факторов риска церебральной ишемии. Следует проводить адекватную антигипертензивную терапию, побудить пациента прекратить курение или уменьшить количество выкуриваемых сигарет, проводить коррекцию обменных нарушений (гипергикемии, гиперлипидемии), бороться с избыточным весом и гиподинамией.
Курс восстановительного лечения больных, перенесших инсульт включает в себя лечебную гимнастику, занятия на тренажерах для пассивной и активной реабилитации, слинг-тренажерах для эрготерапии, массаж, аппаратную вертикализацию и локомоторные занятия (восстановление ходьбы), физиопроцедуры, стимуляционное лечение, подбор протезно-ортопедических приспособлений.
Лечебные мероприятия при ОНМК следует начинать как можно раньше, желательно в промежутке «терапевтического окна» – в первые 3–6 ч с момента развития заболевания. Адекватность их состоянию больного и интенсивность в значительной степени определяют дальнейшее течение и исход заболевания. Больным показана госпитализация в неврологический или нейрососудистый стационар, в случае развития обширного инсульта – в реанимационное отделение. Учитывая высокую частоту сочетания сосудистого поражения головного мозга и сердца, большинству больных требуется консультация кардиолога. По возможности в максимально ранние сроки следует решить вопрос о необходимости и возможности нейрохирургического лечения. Нецелесообразна госпитализация больных в состоянии глубокой комы с расстройствами витальных функций, тяжелой органической деменцией, некурабельными онкологическими заболеваниями.
Больным с ПНМК необходим постельный режим до окончания острого периода и стабилизации состояния. Стационарное лечение показано в случае острой гипертонической энцефалопатии, тяжелого гипертонического криза, повторных ТИА. Показанием для го спитализации служат также отсутствие эффекта от проводимой в амбулаторных условиях терапии и обострение сопутствующих заболеваний, в частности ИБС.
Существуют два основных направ ления лечения – дифференцированное, зависящее от характера инсульта (геморрагический или ишемический) и недифференцированное (базисное), направленное на поддержание витальных функций и коррекцию гомеостаза.
Недифференцированное лечение. Коррекция деятельности сердечно-сосудистой системы в первую очередь направлена на контролъ артериального давления. Цифры его должны на 15– 25 мм рт. ст. превышать привычные для больного. Следует избегать редкого снижения артериального давления во избежание развития синдрома обкрадывания. Гипотензивная терапия включает в себя применение бета адреноблокаторов (анаприлин, атенолол), блокаторов кальциевых каналов (как краткосрочного действия – нифедипин, так и пролонгированных – амлодипин), диуретиков (фуросемид), при необходимости – ингибиторов АПФ (каптоприл, эналаприл). При невозможности или неэффективности перорального приема препараты вводят внутривенно капельно под контролем артериального давления. При развитии артериальной гипотензии назначают кардиотонические средства (мезатон, кордиамин), при отсутствии эффекта – внутривенное введение кортикостероидов (гидрокортизон, дексаметазон). При наличии показаний проводят коррекцию нарушений коронарного кровообращения, остро возникших нарушений сердечного ритма и проводимости и сердечной недостаточности
Контроль за функцией органов дыхания включает обеспечение проходимости дыхательных путей туалет полости рта и носа, удаление секрета и рвотных масс из верхних дыхательных путей при помощи отсоса. Возможны интубация и перевод пациента на искусственную вентиляцию легких. При развитии отека легких требуется введение сердечных гликозидов (коргликон, строфантин), диуретиков. В случае тяжелого инсульта с первых суток следует начинать введение антибиотиков широкого спектра действия (синтетические пенициллины, цефалоспорины) для профилактики пневмонии. С целью профилактики застойных явлений в легких необходимо в максимально ранние сроки начинать активную и пассивную (включая переворачивание с бока на бок) дыхательную гимнастику.
Для поддержания гомеостаза требуется введение адекватного количества солевых раство ров (2000–3000 мл в сутки в 2–3 при ема): Рингера –Локка, изотонического раствора хлорида натрия, 5% раствора глюкозы, при этом необходимо контролировать диурез и экспираторные потери жидкости. Учитывая, что у больных с инсультом нередко развивается ацидоз, показано применение 4-5 % раствора бикарбоната натрия, 3,6 % раствора трисамина (под контролем показателей КОС). При необходимости корригируется содержание в крови ионов калия и хлора. В остром периоде инсульта больные должны получать диету, богатую витаминами и белками, с низким содержанием глюкозы и животных жиров. При нарушениях глотания пища вводится через назогастральный зонд.
Борьба с отеком головного мозга включает применение кортикостероидов, в первую очередь дексазона (16–24 мг в сутки, 4 введения) или преднизолона (60–90 мг в сутки). Противопоказанием к их применению являются некупируемая артериальная гипертензия, геморрагические осложнения, тяжелые формы сахарного диабета Показан глицерол perosа также внутривенное капельное введение осмотических диуретиков (15 % раствор маннитола, реоглюман) или салуретиков (фуросемид).
Контроль за вегетативными функциями включает регуляцию деятельности кишечника (богатая клетчаткой и молочнокислыми продуктами диета, при необходимости – применение слабительных препаратов, очистительные клизмы) и мочеиспускания. При необходимости проводится катетери зация мочевого пузыря, назначение уросептиков с целью профилактики восходящей инфекции мочевыводящих путей. С первых суток требуется регулярная обработка кожных покровов антисептическими препаратами для предупреждения пролежней, желательно использование функциональных противопролежневых матрасов При гипертермии – применение антипиретиков
Дифференцированное лечение. Основные направления дифференцированной терапии острых нарушений мозгового кровообращения – восстановление адекватной перфузии в зоне ишемической полутени и ограничение размеров очага ишемии, нормализация реологических и свертывающих свойств крови, зашита нейронов от повреждающего действия ишемии и стимуляция репаративных процессов в нервной ткани.
Одним из наиболее эффективных методов лечения является гемодилюция – введение препаратов, уменьшающих уровень гематокрита (до 30–35 %). Для этого используется реополиглюкин (реомакродекс), суточный объем и скорость введения которого определяются как показателями гематокрита, так и уровнем артериального давления и наличием признаков сердечной недостаточности. При невысоком артериальном давлении возможно применение полиглюкина или солевых изотонических растворов. Одновременно внутривенно назначаются растворы эуфиллина, пентоксифиллина (трентал), ницерголина (сермиона). При отсутствии нарушений сердечного ритма применяется винпоцетик (кавинтон). По мере стабилизации состояния больного внутривенное введение препаратов заменяется пероральным приемом. Наиболее эффективными являются ацетилсалициловая кислота (1–2 мг/кг массы тела), желательно использовать формы препарата. оказывающие минимальное отрицательное действие на слизистую оболочку желудка (тромбоасс): пентоксифиллин, циннаризин, продектин (ангинин).
В случае нарастающего тромбоза мозговых артерий, при прогредиентном течении инсульта, кардиогенной эмболии показано применение антикоагулянтов Гепарин вводится внутривенно в суточной дозе 10–24 тыс. ЕД или подкожно по 2.5 тыс ЕД 4-6 раз в сутки. При применении гепарина необходим обязательный контроль коагулограммы и времени кровотечения. Противопоказаниями к его использованию, так же как и тромболитиков, является наличие источников кровотечений различной локализации (язвенная болезнь желудка, геморрой), стойкая некупируемая гипертензия (систолическое давление выше 180 мм рт.ст.), тяжелые расстройства сознания. При развитии ДВС-синдрома, в связи со снижением уровня антитромбина III показано введение нативной или свежезамороженной плазмы крови. После прекращения введения гепарина назначаются антикоагулянты непрямого действия (фенилин, синкумар) с контролем показателей свертывающей системы крови.
Установленный характер тро мботического инсульта позволяет использование в первые часы заболевания тромболитиков (урокиназа, стрептаза, стрептокиназа). В связи с тем что при внутривенном введении этих препаратов существует высокий риск геморрагических осложнений, наиболее эффективным способом является направленный тромболизис, при котором препарат под рентгенологическим контролем вводится непосредственно в зону тромбоза. Мощное фибринолитическое действие оказывает рекомбинантный тканевый активатор плазминогена, введение которого также целесообразно только в первые часы заболевания.
В комплексном лечении больных с острыми нарушениями мо згового кровообращения показано применение препаратов, оказывающих антиагрегантное и вазоактивное действие: блокаторов кальциевых каналов (нимотоп, флунаризин), вазобрала, танакана. Обосновано применение ангиопротекторов: продектина (ангинин). Применение указанных препаратов целесообразно по миновании острой фазы заболевания, а также у больных с ТИА.
С целью предупреждения геморрагии в зону ишемии при обширных инфарктах назначается дицинон (этамзилат натрия) внутривенно или внутримышечно.
Исключительно важным является применение препаратов, оказывающих нейротрофическое и нейропротективное действие на мозговую ткань. С этой целью используют ноотропил (до 10–12 г в сутки), глицин (1 г в сутки сублингвально), аплегин (по 5,0 мл в 200,0 мл изотонического раствора хлорида натрия внутривенно 1–2 раза в сутки), семакс (по 6–9 мг 2 раза в сутки интраназально), церебролизин (10,0–20,0 мл в сутки внутривенно). Применение указанных препаратов способствует более полному и быстрому восстановлению нарушенных функций. В ряде случаев, в частности при глобальной ишемии мозга, возможно использование барбитуратов (тиопентал натрия) для снижения энергетических потребностей мозга в условиях ишемии. Широкое применение данного метода ограничивается выраженным кардиодепрессивным и гипотензивным действием препарата, угнетением дыхательного центра. Определенный эффект дают препараты, ингибирующие процессы перекисного окисления липидов: унитиол, витамин Е, аевит.
Профилактика ишемического инсульта включает в себя коррекцию артериального давления, нормализацию липидного спектра крови, при повышении вязкости крови назначают антиагреганты. Большое значение имеют диетотерапия, дозированная физическая нагрузка, рациональное трудоустройство. Одним из эффективных методов профилактики ишемического инсульта является хирургическая реконструкция артерий, кровоснабжающих головной мозг, в первую очередь сонных, а также позвоночных, подключичных и безымянных артерий. Показанием к проведению операции является выраженный стеноз артерии, проявляющийся преходящими нарушениями мозгового кровообращения. В отдельных случаях возникают показания для восстановления проходимости артерий и при бессимптомно протекающих стенозах.
Дифференцированное консервативное лечение при геморрагическом инсульте. Основным направлением является уменьшение проницаемости сосудистой стенки и предупреждение лизиса сформировавшегося тромба. С целью угнетения фибринолиза и активирования выработки тромбопластина применяется эпсилон-аминокапроновая кислота. На протяжении 3– 5 дней внутривенно вводится 50,0–100,0 мл 5 % раствора препарата 1 или 2 раза в сутки. Применяют ингибиторы протеолитических ферментов: трасилол (контрикал, гордокс) в начальной дозе 400–500 тыс. ЕД в сутки, затем – по 100 тыс. ЕД 3–4 раза в день внутривенно капельно. Эффективным гемостатическим препаратом, обладающим низким риском тромбообразования, является дицинон (этамзилат натрия). Для профилактики вазоспазма, осложняющего течение субарахноидального кровоизлияния, больным назначается нимотоп.
Хирургическое лечение при геморрагическом инсульте. Удаление типичных для геморрагического инсульта медиальных гематом, локализующихся в подкорковых узлах, внутренней капсуле, таламусе, как правило, не приводит к улучшению состояния больных и существенно не изменяет прогноза. Лишь иногда показания к операции могут возникнуть у больных относительно молодого возраста при нарастании общемозговых и очаговых симптомов после периода относительной стабилизации состояния. В противоположность этому удаление гематом, локализующихся в белом веществе больших полушарий латерально по отношению к внутренней капсуле, как правило, приводит к существенному улучшению состояния больного и регрессу дислокационных симптомов, в связи с чем хирургическое вмешательство при этих гематомах следует считать абсолютно показанным.
Основным методом оперативного лечения с целью удаления внутримозговых гематом является краниотомия. При латеральном распо ложении гематомы с распространением ее на островок мозга наименее травматичным является подход к гематоме через латеральную (сильвиеву) борозду, при этом трепанация проводится в лобно-височной области. Гематомы, локализующиеся в области зрительного бугра, могут быть удалены через разрез в мозолистом теле. При атипичных кровоизлияниях хирургический доступ определяется расположением гематомы в мозге.
Для удаления глубинно расположенных гематом может быть использован метод стереотаксической аспирации. По результатам КТ-исследования определяются координаты гематомы. С помощью стереотаксического аппарата, фиксированного на голове больного, через фрезевое отверстие вводится специальная канюля, подключенная к аспиратору. В просвете канюли находится так называемый винт Архимеда, вращение которого приводит к разрушению и удалению гематомы. Преимущество указанного метода заключается в его минимальной травматичности.
Кровоизлияние в мозжечок может вызвать опасное для жизни сдавление ствола мозга, что делает хирургическое вмешательство в данной ситуации необходимым. Над местом расположения гематомы проводится резекционная трепанация задней черепной ямки. Последовательно вскрывается твердая мозговая оболочка и рассекается ткань мозжечка, скопившаяся кровь удаляется путем аспирации и промывания раны.
Профилактика Ишемического инсульта:
Согласно современным представлениям ишемический инсульт является не самостоятельным заболеванием, но одним из осложнений различных заболеваний сердечно-сосудистой системы. Развитие ишемического инсульта свидетельствует о значительном поражении кровоснабжения головного мозга. При этом в отсутствие адекватной терапии основного заболевания риск повторных инсультов весьма высок. Поэтому одной из основных задач ведения пациентов, перенесших ишемический инсульт, является вторичная профилактика повторных нарушений мозгового кровообращения. Профилактические мероприятия следует начинать незамедлительно с первых часов манифестации ишемического инсульта.
К каким докторам следует обращаться если у Вас Ишемический инсульт:
Достижения в лечении ишемического инсульта: вчера, сегодня, завтра
Домашенко М.А. Пирадов М.А.
Ишемический инсульт (ИИ) в течение последних десятилетий остается одним из самых социально-значимых заболеваний. Во многом это обусловлено высокой распространенностью сердечно-сосудистых заболеваний (артериальная гипертония, атеросклероз, ишемическая болезнь сердца, мерцательная аритмия), осложнениями которых являются цереброваскулярные заболевания, и в частности ИИ. Следует отметить, что в связи с качественным улучшением помощи, прежде всего профилактической, пациентам старших возрастных групп, ведущим к существенному увеличению продолжительности жизни данной категории лиц, эксперты Всемирной организации здравоохранения ожидают дальнейшего роста распространенности как сердечно-сосудистых заболеваний в целом, так и ИИ. Следующим существенным аспектом актуальности проблемы лечения ИИ являются высокие показатели летальности и, что не менее важно, инвалидизации выживших пациентов. Так, по данным регистров инсульта. летальность в остром периоде инсульта в России достигает 35%, увеличиваясь на 12–15% к концу первого года после перенесенного инсульта. При этом инсульт является ведущей причиной инвалидизации у взрослых, обусловливая до 80% частичной и до 10% полной нетрудоспособности [1, 2].
Последнее десятилетие было ознаменовано широким развитием и внедрением принципов медицины, основанной на доказательствах. При этом, несмотря на ряд спорных моментов данной парадигмы, прежде всего связанных с абсолютизацией результатов мультицентровых исследований, концепция доказательной медицины позволила сформулировать ряд практических европейских и североамериканских рекомендаций по лечению и профилактике острых нарушений мозгового кровообращения (ОНМК), широкое внедрение которых в значительной степени качественно улучшило систему помощи пациентам с ИИ. Вместе с тем, следует отметить, что лишь четыре подхода к лечению ИИ обладают самыми высокими степенью и уровнем доказательности:
• незамедлительная госпитализация пациента с ИИ в специализированное неврологическое отделение для больных с ОНМК;
• внутривенное назначение альтеплазы у определенной категории пациентов с ИИ в течение первых 4,5 ч от развития неврологической симптоматики;
• применение препаратов ацетилсалициловой кислоты (АСК) в течение первых 48 ч ИИ;
• гемикраниэктомия у пациентов с обширным ИИ при окклюзии средней мозговой артерии для профилактики «злокачественного» отека головного мозга.
Госпитализация в отделения ОНМК
Данные ряда систематических обзоров [3, 4], а также результаты обсервационных исследований [5, 6] продемонстрировали статистически значимое снижение смертности (абсолютное снижение на 3%) и инвалидизации (увеличение на 5% независимых пациентов) у пациентов, которые лечились в отделении ОНМК по сравнению с теми, кто лечился в неврологическом отделении общего профиля. При этом польза от незамедлительной госпитализации в специализированный стационар не зависела от пола, возраста, подтипа инсульта и его тяжести [3]. В дальнейших фармакоэкономических исследованиях было подтверждено, что, несмотря на сравнительно более дорогое лечение пациентов с ИИ в специализированном отделении ОНМК по сравнению с отделением общего профиля, данный подход позволяет существенно снизить затраты на дальнейшее лечение и является экономически более выгодным [7, 8].
Можно выделить несколько принципиальных моментов, обусловливающих эффективность госпитализации в отделения ОНМК:
1. Мультидисциплинарный подход. Основными специалистами мультидисциплинарной бригады являются врачи, медицинские сестры, инструкторы лечебной физкультуры (кинезотерапевты) и трудотерапии (эрготерапевты), логопеды и социальные работники [9], работающие координированно, проводя регулярные встречи для составления плана лечения каждого пациента с ИИ.
2. Адекватное лабораторно-инструментальное обследование, включающее доступные ежедневно (24 ч в сутки 7 дней в неделю) методы нейровизуализации (КТ, МРТ); ранняя оценка необходимого ухода и терапии, возможность проведения ранней мобилизации, базисной терапии (коррекция гипо- и гипергликемии; фебрилитета; дегидратации и др.) и профилактики осложнений.
Внутривенная тромболитическая терапия
Внутривенное введение альтеплазы (рекомбинантного тканевого активатора плазминогена, rt-PA) в дозе 0,9 мг/кг (максимально – 90 мг; 10% болюсно и последующей инфузией в течение 60 мин.) в первые 4,5 ч от начала ИИ получило самый высокий уровень доказательности (класс I, уровень А) и рекомендовано к применению как в европейских (ESO, 2008/2009) [10], так и североамериканских (AHA-ASA, 2013) [11] руководствах по ведению пациентов с острым ИИ. Столь высокий уровень доказанности этого терапевтического метода основан на результатах опубликованных к настоящему времени 5 международных плацебо-контролируемых исследований NINDS [12], ECASS [13], ECASS II [14], ATLANTIS [15], ECASS III [16], нескольких метаанализов и анализов индивидуальных данных [17–19], а также данных международного регистра SITS по изучению эффективности и безопасности внутривенного введения rt-PA для лечения острого ИИ [20]. Наиболее важным преимуществом данного вида лечения ИИ является улучшение функционального исхода на фоне тромболитической терапии: так, по данным анализа 23 942 пациентов регистра SITS-MOST, включившего 21 566 больных, которым тромболитическая терапия была проведена в течение первых 3 ч ИИ, и 2376 пациентов, пролеченных rt-PA в течение 3–4,5 ч после развития ИИ, уровень функциональной независимости составил соответственно 57 и 60% для пациентов, которым была проведена терапия rt-PA в первые 3 ч и в интервале 3–4,5 ч соответственно [20]. О высокой эффективности системного тромболизиса свидетельствует также такой статистический показатель, как NNT (number needed to treat): NNT, необходимое для достижения благоприятного клинического исхода через 3 мес. после развития ИИ, составляет 7 [12]. Следует также подчеркнуть, что, несмотря на расширение окна терапевтических возможностей с 3 до 4,5 ч, максимально раннее начало лечения приводит к лучшим результатам (0–90 мин. ОШ 2,11; 95% ДИ от 1,33 до 3,55; 90–180 мин. ОШ 1,69; 95% ДИ от 1,09 до 2,62) [18].
Более того, согласно опубликованным в 2013 г. результатам международного мультицентрового рандомизированного исследования IST-3 (International Stroke Trial-3), внутривенная тромболитическая терапия rt-PA ассоциировалась не только с лучшим функциональным исходом, но и с улучшением качества жизни пациентов спустя 18 мес. после ИИ [21].
В последнее десятилетие стремительно увеличилось число работ, посвященных изучению различных аспектов тромболитической терапии. При этом, несмотря на успехи и широкое внедрение внутривенного (системного) тромболизиса rt-PA, альтернативные способы введения тромболитика и/или достижения реперфузии (внутриартериальный тромболизис, комбинация внутривенного и внутриартериального способов введения тромболитика, различные способы механической тромбоэкстракции и тромбэктомии и т.д.), а также поиск и апробация клинического применения тромболитиков нового поколения (в т.ч. фибрин-специфических), данные методы не оправдали возлагаемых на них ожиданий в рамках медицины, основанной на доказательствах.
Так, внутриартериальный тромболизис, при котором доза активного вещества значительно меньше, чем при использовании внутривенного введения тромболитика, фибринолитик вводится непосредственно в область тромботической закупорки, сопряжен со значительно большим процентом летальных исходов, чем системный тромболизис [22]. Данный факт лежит в основе рекомендаций ESO и AHA-ASA, в которых внутриартериальный тромболизис рассматривается как вариант лечения отобранной категории пациентов с ИИ, которым системный тромболизис не может быть проведен в силу тех или иных причин, в т.ч. и окна терапевтических возможностей, превышающего 4,5 ч [10, 11].
Также усиление действия тромболитика с помощью ультразвука (так называемый сонотромболизис) не нашло активного применения в широкой клинической практике в связи с противоречивыми результатами рандомизированных исследований [23, 24].
Большие надежды возлагались мировыми экспертами в области ангионеврологии на так называемую концепцию bridging (от слова bridge (англ. – мост), при которой пациенту проводится внутривенная тромболитическая терапия rt-PA, при ее неэффективности через 30 мин. от начала выполнения проводится внутриартериальный тромболизис. Ожидания экспертов также не оправдались, и в 2012 г. международное исследование IMS 3, направленное на доказательство эффективности и безопасности данного подхода реперфузионной терапии по сравнению с системным тромболизисом, было прекращено: на этапе предварительной оценки данных исследователи не смогли доказать преимущества bridging-подхода перед внутривенным тромболизисом [25].
Последнее десятилетие также можно охарактеризовать как бум различных по механизму средств механической тромбэктомии (аспирация тромба, тромбоэкстракция и т.д.). Несколько небольших рандомизированных многоцентровых исследований по изучению их эффективности и безопасности были завершены в последние годы. При этом два устройства механической тромбэктомии – ретривер MERCI и Penumbra – получили одобрение FDA. Доказательная база эффективности MERCI основывалась на исследованиях MERCI [26] и multi MERCI [27], при которых тромбэктомия проводилась пациентам с ИИ в течение 8 ч после развития симптоматики на фоне окклюзии средней мозговой артерии (исследование MERCI) и артерии более крупного калибра (исследование multi MERCI). Исследователям удалось продемонстрировать высокую степень реканализации – 46 и 57% соответственно [26, 27].
Еще больший процент реканализации – 82% – отмечался при использовании устройства для механической тромбэктомии Penumbra у пациентов в течение 8 ч ИИ [28]. Вместе с тем, несмотря на впечатляющие показатели реканализации, использование как MERCI, так и Penumbra было сопряжено с недостаточно высоким процентом пациентов, достигших хорошего функционального исхода (36% в исследовании MERCI и 25% – в исследовании Penumbra) [27, 28], а также существенными показателями летальности (34% при использовании MERCI, 33% – Penumbra) [27, 28]. Следует подчеркнуть, что при проведении системного тромболизиса при не столь высоких показателях реканализации удается достичь существенно большего процента случаев с хорошим функциональным исходом и значительно меньшего показателя летальности [20].
Дальнейшее развитие технологий внутрисосудистых вмешательств в остром периоде ИИ привело к появлению устройств Solitaire и Trevo, продемонстрировавших лучшие показатели эффективности и безопасности по сравнению с ретривером MERCI. Так, в исследовании SWIFT [29] у 61 и 58% пациентов, которым была проведена тромбэктомия системой Solitaire, была выполнена реканализация окклюзированной средней мозговой артерии и достигнут хороший функциональный исход соответственно по сравнению с 24 и 33% группы MERCI (р<0,001). При этом летальность в течение 90 сут. была также ниже в группе Solitaire и составила 17% по сравнению с 38% пациентов группы MERCI (p=0,001).
Аналогичные результаты были получены в исследовании TREVO 2 [30], в котором удалось достичь показателя реканализации 86%, используя систему тромбэктомии Trevo. При этом механическая тромбэктомия с использованием ретривера multi MERCI была сопряжена с полной реканализацией у 60% пациентов. Хорошего функционального исхода удалось достичь у 40 и 22% пациентов группы Trevo 2 и MERCI соответственно (р=0,01), при этом было зарегистрировано статистически недостоверное увеличение частоты летальных исходов на фоне использования системы Trevo 2 по сравнению с multi MERCI. Таким образом, обе системы для механической тромбэктомии Solitaire и Trevo 2 продемонстрировали лучшие показатели эффективности и безопасности по сравнению с MERCI [29, 30]. Вместе с тем, выборки пациентов, участвующих в описанных выше исследованиях, были небольшими, что требует проведения дальнейших исследований вышеописанных устройств механической тромбэктомии.
Следует отметить, что технологии инвазивных вмешательств в остром периоде ИИ в настоящее время исследуются достаточно активно, и в ближайшие годы можно ожидать появления новых устройств с доказанной эффективностью.
Нельзя не отметить некоторую «монополию» rt-PA в отношении системного тромболизиса при ИИ. В течение истекших лет большие надежды возлагались на поиск и апробацию новых тромболитиков, в частности фибринселективной десмотеплазы. Некоторый терапевтический оптимизм привнесли результаты доклинических, а также небольших исследований II фазы DIAS [31] и DEDAS [32]. Вместе с тем исследование II фазы DIAS-2 [33] имело негативный исход, что временно приостановило использование десмотеплазы для лечения ИИ. Возможно, исследователи учтут особенности разработки протокола DIAS-2 и в ближайшие годы у неврологов появится альтернатива rt-PA при решении вопроса о тромболитической терапии.
Ацетилсалициловая кислота
в остром периоде инсульта
Ацетилсалициловая кислота (АСК) является единственным антиагрегантным препаратом, эффективность которого при назначении в острый период ИИ подкреплена данными доказательной медицины. Оценке эффективности терапии АСК при ее назначении в течение первых 48 ч ИИ посвящено два крупных исследования: IST [34] и CAST [35]. Сопоставление результатов этих двух исследований позволило рекомендовать как можно более раннее назначение АСК при ИИ [10, 11]. При этом следует иметь в виду, что при прочих равных условиях применение АСК в остром периоде ИИ не является альтернативой тромболитической терапии. Также не рекомендовано применение АСК в течение первых 24 ч после проведения тромболизиса [10, 11].
Широко применяемые с целью вторичной профилактики атеротромботического инсульта тромбоцитарные антиагреганты клопидогрел и комбинация АСК и дипиридамола замедленного высвобождения не нашли доказательств своей эффективности в лечении пациентов в первые сутки ИИ. Также распространенные в кардиологии подходы для лечения острого коронарного синдрома с применением «нагрузочных» доз антиагрегантов, комбинации клопидогрела и АСК в остром периоде ИИ сопряжены с большим риском геморрагических осложнений и не рекомендованы к повседневному применению.
Следует также отметить, что большинство «новых» антиагрегантов и/или их комбинаций начинают исследоваться ангионеврологами после успешного их применения в неотложной кардиологии. Вследствие этого, учитывая широкий спектр антиагрегантов новых поколений, доказавших свою эффективность и безопасность в лечении острого коронарного синдрома и инфаркта миокарда, следует ожидать большого количества испытаний этих препаратов у пациентов с ИИ в течение ближайших лет.
Гемикраниэктомия
Объединенный анализ 93 пациентов, включенных в исследования DECIMAL, DESTINY и HAMLET, показал, что по сравнению с контрольной группой через год у пациентов в группе декомпрессионной хирургии было больше пациентов с баллом по модифицированной шкале Рэнкина (mRS) <4 или <3 и был более высокий процент выживших [36]. Критериями включения в данный комбинированный анализ являлись возраст 18–60 лет, балл по шкале NIHSS >15, уровень сознания 1 балл или выше при ответе на вопрос 1а по NIHSS, признаки инфаркта в бассейне основного ствола средней мозговой артерии на КТ, занимающего 50% и более территории кровоснабжения СМА, или >145 см 3 по данным ДВ-МРТ, появление симптомов менее чем за 45 ч до принятия решения об операции (хирургическое лечение менее чем через 48 ч после ИИ).
Систематический обзор 12 обсервационных ретроспективных исследований продемонстрировал, что такие факторы, как время хирургического вмешательства, сторона поражения, клинические признаки вклинения и вовлечение других сосудистых территорий, достоверно не влияют на конечный результат [37].
В 2013 г. были опубликованы результаты исследования DESTINY II, целью которого было оценить эффективность и безопасность гемикраниэктомии у пациентов старше 60 лет. Было продемонстрировано, что гемикраниэктомия, проведенная в соответствии с вышеизложенными показаниями у пациентов старше 60 лет, также сопряжена с лучшим функциональным исходом (mRS <4 через 6 мес.) и меньшей частотой летальных исходов (р<0,05) по сравнению с пациентами без гемикраниэктомии [38].
Вместе с тем, существенным, прежде всего с этической точки зрения, аспектом проблемы гемикраниэктомии, является больший процент выживших пациентов с грубым неврологическим дефицитом. Так, например, в исследовании DESTINY II процент пациентов, оцененных по шкале mRS в 5 баллов (пациент прикован к постели и нуждается в постоянном постороннем уходе), более чем в 2 раза превышал таковой в группе стандартной медикаментозной, в т.ч. противоотечной терапии, и составил четверть от всех включенных в исследование пациентов [38]. Данный факт, с одной стороны, существенно ограничивает широкое распространение данного доказанного и эффективного метода лечения «злокачественных» инфарктов мозга, вызванных окклюзией основного ствола СМА, а, с другой стороны, требует поиска новых медикаментозных и/или немедикаментозных средств и подходов к лечению и профилактике отека головного мозга при данном жизнеугрожающем состоянии.
Говоря о минувшем десятилетии в отношении лечения ИИ, нельзя не остановиться на еще двух важных стратегических направлениях – нейропротекции и ранней реабилитации.
В минувшее десятилетие было опубликовано значительное число работ, посвященных поиску новых эффективных нейропротекторов. И снова традиционно были получены положительные результаты на экспериментальных моделях ИИ, не нашедшие отражения при клинической оценке эффективности нейропротекторов в условиях клинической практики с применением критериев медицины, основанной на доказательствах. В качестве примера следует отметить крупные рандомизированные исследования, завершившиеся в последние годы, которые были посвящены исследованию эффективности церебролизина – CASTA [39], цитиколина – ICTUS [40], закончившиеся нейтральными результатами, а также альбумина – исследование ALIAS 2 [38], прерванное досрочно по соображениям безопасности (в группе альбумина в 10,8 раз чаще развивался отек легких, в 2,4 раза чаще – внутримозговые гематомы, в 1,69 раз – пароксизмы мерцательной аритмии по сравнению с группой плацебо при сопоставимой с плацебо частотой достижения первичной конечной точки).
Полемика в отношении причин нейтральных и/или негативных результатов рандомизированных исследований нейропротекторов заслуживает отдельной публикации, вместе с тем даже нейтральные результаты исследований позволили выявить узкие «целевые» группы пациентов, у которых эффективность нейропротекторов превышала эффект плацебо (а по сути, базисной терапии в лучших специализированных клиниках мира, где проводись контролируемые исследования). Так, подгрупповой анализ исследования ICTUS продемонстрировал, что применение цитиколина было более эффективным у пациентов в возрасте старше 70 лет (p=0,001 по сравнению с группой плацебо), при инсульте умеренной тяжести c оценкой по NIHSS <14 баллов (p=0,021) и у пациентов, которым не проводился тромболизис (p<0,041) [40]. Подгрупповой анализ исследования CASTA выявил, что эффект церебролизина превышал эффект плацебо у пациентов с тяжелым ИИ: в подгруппе пациентов с выраженностью неврологической симптоматики более 12 баллов по шкале NIHSS было продемонстрировано уменьшение как показателей смертности (отношение рисков 1,97), так и инвалидизации (отношение шансов 1,27) [39]. Несмотря на некоторое скептическое отношение к подгрупповому анализу у ряда экспертов, подобные результаты могут лечь в основу новых протоколов изучения указанных препаратов, а критический анализ протоколов исследований, посвященных изучению нейропротекторов, завершившихся нейтрально и/или негативно, возможно, станет ключом к созданию более тонко спланированных контролируемых исследований такого потенциально эффективного класса препаратов, как нейропротекторы.
Вторым важным «прорывом» в лечении пациентов в остром периоде ИИ является широкое внедрение методик активной ранней реабилитации, предпосылкой к которому послужила публикация результатов исследования AVERT [41]. На большой выборке пациентов исследования AVERT как с ишемическим. так и геморрагическим инсультом была продемонстрирована безопасность ранней двигательной активизации. В дальнейшем число работ по двигательной, в т.ч. роботизированной, реабилитации пациентов в остром периоде ИИ неуклонно росло. Наиболее важными аспектами ранней активизации пациентов являются уменьшение частоты и выраженности осложнений длительной иммобилизации (гипостатическая пневмония, тромбозы глубоких вен нижних конечностей, тромбоэмболия легочной артерии, пролежни), а также более быстрое достижение пациентом вертикального положения и, соответственно, увеличение реабилитационного потенциала. Несомненно, что развитие новых технологий в нейрореабилитации в ближайшие годы приведет к появлению качественно новых подходов к лечению прежде всего тяжелых пациентов с ИИ, в т.ч. и находящихся в отделениях нейрореанимации.
Таким образом, последнее десятилетие в значительной степени изменило наше представление о лечении пациентов с ИИ. Внедрение результатов медицины, основанной на доказательствах, фундаментальных исследованиях, позволило значительно улучшить систему оказания помощи при ИИ. Дальнейшее развитие фундаментальных нейронаук позволит в течение следующих лет углубить наши представления о патогенезе ишемического повреждения головного мозга, а также о процессах восстановления нарушенных функций при инсульте, а разработка новых протоколов клинических исследований с учетом новых знаний и уже накопленного опыта дает надежду на прогресс в лечении данного социально-значимого заболевания.
Литература
1. Инсульт: диагностика, лечение, профилактика / Под ред. З. А. Суслиной, М. А. Пирадова. М. МЕДпресс-информ, 2008.
2. Суслина 3.А. Варакин Ю.Я. Эпидемиологические аспекты изучения инсульта. Время подводить итоги. // Анналы клин. и эксперим. неврологии. 2007. Т. 1, № 2. С. 22–28.
3. Stroke Unit Trialists’ Collaboration: Organised inpatient (stroke unit) care for stroke // Cochrane Database Syst. Rev. 2007:CD000197.
4. Seenan P. et al. Stroke units in their natural habitat: Systematic review of observational studies // Stroke. 2007. Vol. 38. P. 1886–1892.
5. Candelise L. et al. Stroke-unit care for acute stroke patients: An observational follow-up study // Lancet. 2007. Vol. 369. P. 299–305.
6. Walsh T. et al. Stroke unit care is superior to general rehabilitation unit care // Ir. Med. J. 2006. Vol. 99. P. 300–302.
7. Patel A. et al. Alternative strategies for stroke care: Cost-effectiveness and cost-utility analyses from a prospective randomized controlled trial // Stroke. 2004. Vol. 35. P. 196–203.
8. Moodie M. et al. Economic evaluation of australian stroke services: A prospective, multicenter study comparing dedicated stroke units with other care modalities // Stroke. 2006. Vol. 37. P. 2790–2795.
9. Langhorne P. Pollock A. What are the components of effective stroke unit care? // Age Ageing. 2002. Vol. 31. P. 365–371.
10. Guidelines for Management of Ischaemic Stroke of the European Stroke Organisation, 2008/2009 http://www.eso-stroke.org/recommendations.
11. Jauch E. et al. Guidelines for the Early Management of Patients With Acute Ischemic Stroke A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association // Stroke. 2013. Vol. 44.
12. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke // N. Engl. J. Med. 1995. Vol. 333. P. 1581–1587.
13. Hacke W. et al. For the ECASS Study Group. Intravenous thrombolysis with recombinant tissue plasminogen activator for acute ischemic stroke: the European Cooperative Acute Stroke Study (ECASS) // JAMA. 1995. Vol. 274. P. 1017–1025.
14. Hacke W. et al. Randomized double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II) // Lancet. 1998. Vol. 352. P. 1245–1251.
15. Clark W. Recombinant Tissue-Type Plasminogen Activator (Alteplase) for Ischemic Stroke 3 to 5 Hours After Symptom Onset. The ATLANTIS Study: A Randomized Controlled Trial // JAMA. 1999. Vol. 282 (21). P. 2019–2026.
16. Hacke W. et al. Thrombolysis with Alteplase 3 to 4.5 hours after acute ischemic stroke // NEJM. 2008. Vol. 359(13). P. 1317–1329.
17. Wardlaw J. et al. Thrombolysis for acute ischaemic stroke // Cochrane Database Syst. Rev. 2003; CD000213.
18. Hacke W. et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials // Lancet. 2004. Vol. 363. P. 768–774.
19. Lees K. et al. Time to treatment with intravenous alteplase and outcome in stroke: an updated pooled analysis of ECASS, ATLANTIS, NINDS, and EPITHET trials // Lancet. 2010. Vol. 375. P. 1695–1703.
20. Ahmed N. et al. Implementation and outcome of thrombolysis with alteplase 3–4,5 h after an acute stroke: an updated analysis from SITS-ISTR // Lancet. Neurol. 2010. Vol. 9. P. 866–874.
21. The IST-3 collaborative group. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6 h of acute ischaemic stroke (the third international stroke trial [IST-3]): a randomised controlled trial // Lancet. 2012. Vol. 379(Issue 9834). P. 2352–2363.
22. Furlan A. et al. Intra-arterial prourokinase for acute ischemic stroke: the PROACT II study: a randomized controlled trial: Prolyse in Acute Cerebral Thromboembolism // JAMA. 1999. Vol. 282. P. 2003–2011.
23. Alexandrov A. et al. Ultrasound-enhanced systemic thrombolysis for acute ischemic stroke // N. Engl J. Med. 2004. Vol. 351. P. 2170–2178.
24. Daffertshofer M. et al. Transcranial low-frequency ultrasound-mediated thrombolysis in brain ischemia: increased risk of hemorrhage with combined ultrasound and tissue plasminogen activator: results of a phase II clinical trial // Stroke. 2005. Vol. 36(7). P. 1441–1446.
25. National Institute of Neurological Disorders and Stroke. Interventional Management of Stroke III Trial (IMS III). http://www.ninds.nih.gov/disorders/clinical_trials/NCT00359424.htm. Accessed September 12, 2012
26. Smith W. et al. Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial // Stroke. 2005. Vol. 36. P. 1432–1438.
27. Smith W. et al. Mechanical thrombectomy for acute ischemic stroke: final results of the Multi MERCI trial // Stroke. 2008. Vol. 39. P. 1205–1212.
28. The Penumbra Pivotal Stroke Trial Investigators. The Penumbra Pivotal Stroke Trial: safety and effectiveness of a new generation of mechanical devices for clot removal in intracranial large vessel occlusive disease // Stroke. 2009. Vol. 40. P. 2761–2768.
29. Saver J. et al. Solitaire flow restoration device versus the Merci Retriever in patients with acute ischaemic stroke (SWIFT): a randomised, parallel-group, non-inferiority trial // Lancet. 2012. Vol. 380. P. 1241–1249.
30. Nogueira R. et al. Trevo versus Merci retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischaemic stroke (TREVO 2): a randomized trial // Lancet. 2012. Vol. 380. P. 1231–1240.
31. Hacke W. et al. The Desmoteplase in Acute Ischemic Stroke Trial (DIAS): a phase II MRI-based 9-hour window acute stroke thrombolysis trial with intravenous desmoteplase // Stroke. 2005. Vol. 36. P. 66–73.
32. Furlan A. et al. Dose Escalation of Desmoteplase for Acute Ischemic Stroke (DEDAS): evidence of safety and efficacy 3 to 9 hours after stroke onset // Stroke. 2006. Vol. 37. P. 1227–1231.
33. Hacke W. et al. Intravenous desmoteplase in patients with acute ischaemic stroke selected by MRI perfusion-diffusion weighted imaging or perfusion CT (DIAS-2): a prospective, randomised, doubleblind, placebo-controlled study // Lancet Neurol. 2009. Vol. 8. P. 141–150.
34. International Stroke Trial Collaborative Group. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke // Lancet. 1997. Vol. 349. P. 1569–1581.
35. CAST (Chinese Acute Stroke Trial) Collaborative Group. CAST: randomised placebo-controlled trial of early aspirin use in 20,000 patients with acute ischaemic stroke // Lancet. 1997. Vol. 349. P. 1641–1649.
36. Vahedi K. et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: A pooled analysis of three randomised controlled trials // Lancet. Neurol. 2007. Vol. 6. P. 215–222.
37. Gupta R. et al. Hemicraniectomy for massive middle cerebral artery territory infarction: A systematic review // Stroke. 2004. Vol. 35. P. 539–543.
38. Материалы 22 European Stroke Conference. London, 2013.
39. Heiss W.D. Cerebrolysin in patients with acute ischemic stroke in Asia: results of a double-blind, placebo-controlled randomized trial // Stroke. 2012. Vol. 43(3). P. 630–636.
40. D|avalos A. et al. Citicoline in the treatment of acute ischaemic stroke: an international, randomised, multicentre, placebo–controlled study (ICTUS trial) // Lancet. 2012. Vol. 380(9839). P. 349–357.
41. Bernhardt J. et al. A Very Early Rehabilitation Trial for Stroke (AVERT): phase II safety and feasibility // Stroke. 2008. Vol. 39. P. 390–396.