Atrial Fibrillation in Patients With Type 2 Diabetes Mellitus: Specific Features of Development and Antirecurrence Therapy
S.G. Kanorsky, Yu.S. Kanorskaya
Kuban State Medical University, Sedina ul. 4, 350063 Krasnodar, Russia
Обследованы 212 больных в возрасте от 52 до 70 лет с персистирующей фибрилляцией предсердий (ФП), сопровождавшейся выраженными клиническими симптомами. При сравнении субстрата ФП у больных с сахарным диабетом (СД) 2-го типа (n=26) и без СД (n=27) выявлены замедление внутрипредсердного проведения, повышение уязвимости предсердий и более выраженное ухудшение диастолической функции левого желудочка в первом случае. Путем сопоставления групп больных с диабетической кардиальной автономной нейропатией — КАН (n=32) и без нее (n=33) в первой выявлены усиление адренергических влияний на сердце и сравнительно более высокая противорецидивная эффективность соталола. У 94 больных с СД 2-го типа, осложненным КАН, после рандомизации проводилась антиаритмическая терапия соталолом в комбинации с периндоприлом (n=33), с α-липоевой кислотой (n=31), с периндоприлом и с α -липоевой кислотой (n=30), результаты лечения сравнивались с монотерапией соталолом. Через 6 мес синусовый ритм достоверно чаще сохранялся при применении комбинации соталола, периндоприла и α -липоевой кислоты, вероятно, одновременно корригировавшей нарушения, обусловленные «диабетической кардиомиопатией» и КАН.
Ключевые слова: фибрилляция предсердий, сахарный диабет 2-го типа, соталол, периндоприл, a-липоевая кислота.
We examined 212 patients aged 52-70 years with persistent symptomatic atrial fibrillation (AF). Comparison of AF substrates in patients with (n=26) and without (n=27) type 2 diabetes mellitus (DM2) revealed slowing of intraatrial conduction, increased vulnerability of atria, and more pronounced worsening of left ventricular diastolic function among DM2 patients. Comparison of groups of patients with (n=32) and without (n=33) diabetic cardiac autonomic neuropathy (CAN) revealed augmentation of adrenergic influences on the heart and comparatively higher antirecurrence efficacy of sotalol among patients with CAN. In 94 patients with type 2 DM complicated with CAN after randomization we admistered antiarrhythmic therapy with sotalol in combination with perindopril (n=33), α -lipoic acid (n=31), perindopril and α -lipoic acid (n=30), and compared results with sotalol monotherapy. In 6 months percentage of patients in sinus rhythm was significantly higher in the group of combination therapy (sotalol plus perindopril plus α -lipoic acid). This was probably a result of simultaneous correction of disturbances caused by both «diabetic cardiomyopathy» and CAN.
Key words: atrial fibrillation; type 2 diabetes mellitus; sotalol; perindopril; lipoic acid.
Фибрилляция предсердий (ФП) — наиболее распространенная аритмия в клинической практике, регистрируемая у 1—1,5% людей в общей популяции, а у лиц старше 65 лет — в 5% случаев. Ожидается резкое увеличение числа больных с ФП в ближайшие десятилетия, связанное со старением населения [1—3]. ФП трудно поддается лечению, повышает риск развития инсульта, хронической сердечной недостаточности (ХСН), заболеваемость и смертность, ухудшает качество жизни [4—8].
В последние годы ФП наиболее часто ассоциируется с артериальной гипертензией (АГ), ХСН, ишемической болезнью сердца (ИБС) [9—11]. Полагают, что при этих заболеваниях часто формируется субстрат ФП в виде дилатации левого предсердия и электрофизиологических изменений в нем [12].
Сахарный диабет (СД) — один из независимых факторов риска, повышающих частоту развития ФП примерно в 2, а при наличии АГ — в 3 раза [13, 14]. Механизм, лежащий в основе этой связи, еще предстоит выяснить [15]. Можно предположить, что появлению ФП при СД способствуют развитие так называемой диабетической кардиомиопатии [16] и диабетической кардиальной автономной нейропатии (КАН) [17]. Распространенность СД в популяции стремительно возрастает и, согласно прогнозам, увеличится с 2,8% в 2000 г. до 4,4% — в 2030 г. [18], поэтому его сочетание с ФП, резко ухудшающее прогноз для пациентов [19], будет встречаться все чаще.
Специальные исследования у больных СД, направленные на изучение механизмов развития ФП и оценку эффективности медикаментозной терапии, не проводились, что указывает на актуальность таких разработок.
Цель работы — оценить особенности аритмогенного субстрата, течения и эффективности модифицированной противорецидивной терапии у больных с ФП на фоне СД 2-го типа.
Материал и методы
Обследованы 212 больных (109 мужчин и 103 женщины) в возрасте от 52 до 70 лет (средний возраст 64,6±3,8 года) с персистирующей ФП. У всех пациентов основным заболеванием являлась ИБС со стенокардией напряжения I—II функциональных классов, в 135 (63,7%) случаях сочетавшаяся с АГ. Инфаркт миокарда (ИМ) перенесли 44 (20,8%) больных. С учетом направленности работы 185 пациентов, набранных в исследование, страдали СД 2-го типа и у 152 выявлялась КАН.
В исследование включали больных, давших информированное согласие на проведение обследования и лечения. Критериями включения являлись возраст не старше 70 лет и ФП, сопровождавшаяся выраженными клиническими симптомами, не прекращавшаяся спонтанно, но купировавшаяся антиаритмическими препаратами.
В исследование не включали больных с декомпенсированным СД, острыми коронарными синдромами, тяжелой неконтролируемой АГ, фракцией выброса левого желудочка (ЛЖ) менее 50%, ХСН III— IV функциональных классов (ФК) по классификации NYHA, синдромом Вольфа—Паркинсона—Уайта, синдромом слабости синусного узла, атриовентрикулярной блокадой, имплантированным искусственным водителем ритма, удлинением интервала QT (корригированный показатель более 450 мс), устойчивой желудочковой тахикардией, пороками сердца, кардиомиопатиями, дисфункцией щитовидной железы, тяжелыми заболеваниями внутренних органов с нарушением их функции, способными существенно сократить продолжительность жизни.
В первой части исследования проводили сравнительную оценку особенностей аритмогенного субстрата у больных ИБС, сочетанной с СД 2-го типа (n=26) и у пациентов без СД (n=27). При синусовом ритме вне действия антиаритмических препаратов регистрировали стандартную электрокардиограмму (ЭКГ) в 12 отведениях, выполняли программированную чреспищеводную электрическую стимуляцию предсердий [20], трансторакальную эхокардиографию по стандартной методике, оценивая и диастолическую функцию ЛЖ [21].
Во второй части исследования больных ИБС, сочетанной с СД 2-го типа, разделяли на имевших (n=32) и не имевших КАН (n=33). В первую группу включали пациентов с нормальными результатами стандартных сердечно-сосудистых вегетативных тестов по D. Ewing [22], во вторую — с положительными результатами минимум одного из 5 тестов. Вне действия препаратов, изменяющих вегетативные влияния на сердце, оценивали вариабельность его ритма по данным суточного холтеровского мониторирования ЭКГ. Всем пациентам проводили контролируемую противорецидивную терапию ФП соталолом в дозе 80—160 мг/сут в течение 6 мес, при рецидивах аритмии выполняли кардиоверсию.
В третьей части исследования участвовали больные с сочетанием ИБС и СД 2-го типа, осложненного КАН по данным вегетативных тестов. Пациентов рандомизировали для лечения соталолом (80—160 мг/сут) в комбинации с периндоприлом (4—8 мг/сут; n=33), соталолом с α-липоевой кислотой – тиоктацидом БВ (быстрого высвобождения), «Меда Фармасьютикалс Швейцария ГмбХ» (600 мг/сут; n=31) или соталолом с периндоприлом и α-липоевой кислотой — тиоктацидом БВ (n=30), сопоставляя его результаты с эффективностью монотерапии соталолом (80— 160 мг/сут). Контролируемое лечение продолжалось 6 мес, при возобновлении ФП выполняли кардиоверсию.
Контроль ритма сердца включал регулярную, не реже 1 раза в месяц, регистрацию ЭКГ. При появлении неправильного сердцебиения, одышки, головокружения и т.д. нерегулярности пульса во время ежедневной пальпации лучевой артерии и/или измерении артериального давления пациенты немедленно обращались к врачу, который устанавливал характер ритма с помощью электрокардиографии и/или холтеровского мониторирования ЭКГ. Для кардиоверсии использовали пропафенон внутрь и/или амиодарон внутривенно капельно.
До и в конце длительной терапии проводили холтеровское мониторирование ЭКГ, эхокардиографию, тест с 6-минутной ходьбой.
В анализ включали данные о пациентах, полностью выполнивших протокол исследования.
Статистическую обработку полученных данных проводили с использованием программы SPSS 12.0. Все результаты представлены средними с указанием ошибки средней (M ± m). Достоверность различий между количественными признаками определяли по критерию t Стьюдента (р or =65 years of age (the cardiovascular health study). Am J Cardiol 2006;97:83—89.
11. Hohnloser S.H. Crijns H.J. van Eickels M. et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009;360:668—678.
12. Nattel S. Shiroshita-Takeshita A. Brundel B.J. Rivard L. Mechanisms of atrial fibrillation: lessons from animal models. Prog Cardiovasc Dis 2005;48:9—28.
13. Ostgren C.J. Merlo J. Rastam L. Lindblad U. Atrial fibrillation and its association with type 2 diabetes and hypertension in Swedish community. Diabetes Obes Metab 2004;6:367—374.
14. Movahed M.R. Hashemzadeh M. Jamal M.M. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to over cardiovascular disease. Int J Cardiol 2005;105:315—321.
15. Ryden L. Standl E. Bartnik M. et al. Guidelines on diabetes, pre diabetes, and cardiovascular diseases: full text. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). Eur Heart J 2007;9 (Suppl C):C3—C74.
16. Boudina S. Abel E.D. Diabetic cardiomyopathy revisited. Circulation 2007;115:3213—3223.
17. Vinik A.I. Ziegler D. Diabetic cardiovascular autonomic neuropathy. Circulation 2007;115:387—397.
18. Wild S. Roglic G. Green A. et al. Global prevalence of diabetes: estimates for year 2000 and projections for 2030. Diabetes Care 2004;21:1047—1053.
19. Du X. Ninomiya T. de Galan B. et al. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009;30:1128—1135.
20. Чреспищеводная электрическая стимуляция сердца. Под ред. В.А. Сулимова, В.И. Маколкина. М: Медицина 2001;208.
21. Lang R.M. Biering M. Devereux R.B. et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005;18:1440—1463.
22. Ewing D.J. Martyn C.N. Young R.J. Clarke B.F. The value of cardiovascular function tests: 10 years experience in diabetes. Diabetes Care 1985;8:491—498.
23. Fuster V. Ryden L.E. Cannom D.S. et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients with Atrial Fibrillation). J Am Coll Cardiol 2006;48:e149—e246.
24. Klem I. Wehinger C. Schneider B. et al. Diabetic atrial fibrillation patients: mortality and risk for stroke or embolism during a 10-year follow-up. Diabetes Metab Res Rev 2003;19:320—328.
25. Singh B.N. Singh S.N. Reda D.J. et al. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005;352:1861—1872.
26. Yamagishi S.I. Matsui T. Nakamura K. Possible molecular mechanisms by which angiotensin II type 1 receptor blockers (ARBs) prevent the development of atrial fibrillation in insulin resistant patients. Horm Metab Res 2008;40:640—644.
27. Boldt A. Wetzel U. Lauschke L. et al. Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart 2004;90:400—405.
28. Schena F.P. Gesualdo L. Pathogenetic mechanisms of diabetic nephropathy. J Am Soc Nephrol 2005;16 (Suppl 1):S30—S33.
29. Kato T. Yamashita T. Sekiguchi A. et al. What are arrhythmogenic substrates in diabetic rat atria? J Cardiovasc Electrophysiol 2006;17:890—894.
30. Akyurek O. Sayin T. Dincer I. et al. Lengthening of intraatrial conduction time in atrial fibrillation and its relation with early recurrence of atrial fibrillation. Jpn Heart J 2001;42:575—584.
31. van der Meer R.W. Rijzewijk L. Diamant M. et al. The ageing male heart: myocardial triglyceride content as independent predictor of diastolic function. Eur Heart J 2008;29:1516—1522.
32. McGavock J.M. Lingvay I. Zib I. et al. Cardiac steatosis in diabetes mellitus: a H1-magnetic resonance spectroscopy study. Circulation 2007;116:1170—1175.
33. Murray A.J. Anderson R.E. Watson G.C. et al. Uncoupling proteins in human heart. Lancet 2004;364:1786—1788.
34. Poornima I.G. Parikh P. Shannon R.P. Diabetic cardiomyopathy: the search for a unifying hypothesis. Circ Res 2006;98:596—605.
35. Konduracka E. Gackowski A. Rostoff P. et al. Diabetes-specific cardiomyopathy in type 1 diabetes mellitus: no evidence for its occurrence in the era of intensive insulin therapy. Eur Heart J 2007;28:2465—2471.
36. Olshansky B. Interrelationships between the autonomic nervous system and atrial fibrillation. Prog Cardiovasc Dis 2005;48:57—78.
37. Chen J. Wasmund S.L. Hamdan M.H. Back to the future: the role of the autonomic nervous system in atrial fibrillation. Pacing Clin Electrophysiol 2006;29:413—421.
38. de Vos C.B. Nieuwlaat R. Crijns H.J.G.M. et al. Autonomic trigger patterns and anti-arrhythmic treatment of paroxysmal atrial fibrillation: data from the Euro Heart Survey. Eur Heart J 2008;29:632—639.
39. Nieuwlaat R. Prins M.H. Le Heuzey J-Y. et al. Prognosis, disease progression, and treatment of atrial fibrillation patients during 1 year: follow-up of the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2008;29:1181—1189.
40. Steven D. Rostock T. Lutomsky B. et al. What is the real atrial fibrillation burden after catheter ablation of atrial fibrillation? A prospective rhythm analysis in pacemaker patients with continous atrial monitoring. Eur Heart J 2008;29:1037—1042.
41. Belluzzi F. Sernesi L. Preti P. et al. Prevention of recurrent lone atrial fibrillation by the angiotensin-II converting enzyme inhibitor ramipril in normotensive patients. J Am Coll Cardiol 2009;53:24—29.
42. GISSI-AF Investigators. Disertori M. Latini R. Barlera S. et al. Valsartan for prevention of recurrent atrial fibrillation. N Engl J Med 2009;360:1606—1617.
43. Канорский С.Г. Бодрикова В.В. Канорская Ю.С. Влияние периндоприла, розувастатина или омега-3 полиненасыщенных жирных кислот на эффективность противорецидивной терапии соталолом у больных с персистирующей фибрилляцией предсердий. Кардиология 2007;12:39—44.
44. Верткин А.Л. Ткачева О.Н. Подпругина Н.Г. и др. Диабетическая автономная нейропатия: диагностика и метаболическая терапия. Клиническая фармакология и терапия 2004;13:39—43.
45. Ziegler D. Schatz H. Conrad F. et al. Effects of treatment with the antioxidant α-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4-month randomized controlled multicenter trial (DEKAN Study). Diabetes Care 1997;20:369—373.
46. MMW Spezial, Münch.med.Wschr.1999;141:2.
47. De Denus S. Sanoski C.A. Carlsson J. et al. Rate vs rhythm control in patients with atrial fibrillation: a meta-analysis. Arch Intern Med 2005;165:258—262.
48. Roy D. Talajic M. Nattel S. et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008;358:2667—2677.
49. Nieuwlaat R. Capucci A. Camm A.J. et al. on behalf of the Euro Heart Survey Investigators. Atrial fibrillation management: a prospective survey in ESC member countries. The Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005;26:2422—2434.
50. Nieuwlaat R. Eurlings L.W. Capucci A. et al. Atrial fibrillation in ‘real world’: undecided issues. Eur Heart J 2007;9 (Suppl I):I122—I128.
Поступила 22.08.09
HTML-код для размещения ссылки на сайте или в блоге:
Мерцательная аритмия и сахарный диабет: терапия предупреждения
РЕКЛАМА
По мнению выдающегося современного кардиолога E. Braunwald’а (1997 г.), судьбу человечества в XXI веке определяют три важнейших сердечно-сосудистых эпидемии: застойная сердечная недостаточность, мерцательная аритмия (МА) и сахарный диабет (СД).
Работы, посвященные изучению мерцательной аритмии, начинают расценивать эту патологию как новую сердечно-сосудистую эпидемию примерно с 2001–2004 гг. [1–3]. МА, впервые описанная в 1909 г. в настоящее время является наиболее часто встречаемым нарушением сердечного ритма. МА характеризуется потерей способности предсердий миокарда к координированному сокращению.
За последние 50 лет частота распространения МА возросла примерно в 2,5 раза. В настоящее время МА страдает более 3 млн человек в США и 4,5 млн человек в Европе (около 1% всего населения).
Частота развития МА увеличивается с возрастом, и среди лиц старше 80 лет МА страдает не менее 9% населения.
Основываясь на данных переписи США, прогноз роста количества больных, страдающих так называемыми «неклапанными» формами МА, представляется следующим: в 2004 г. с подобным диагнозом было зафиксировано 2,3 млн человек, в 2020 г. прогнозируется рост до 3,3 млн человек и к 2050-м гг. — 5,6 млн человек (рис. 1) [1].
Исследователи из клиники Мэйо (США) считают, правда, что этот прогноз существенно недооценивает интенсивность реального роста этого заболевания. По данным этой знаменитой клиники, расположенной в г. Рочестер штата Миннесота, реальная заболеваемость «неклапанными» формами МА в этой местности за последние 30 лет возросла в три раза, если учитывать ее уровень в конкретных возрастных категориях.
При этом отмечается непрерывное нарастание клинической тяжести этого заболевания. За последние 15 лет частота госпитализаций по поводу МА возросла примерно в 2–3 раза. Так, по поводу собственно МА число госпитализаций возросло с 154 086 до 376 487 случаев (изолированная МА) и с 787 750 случаев до 2 283 673 случаев (МА на фоне других заболеваний) (рис. 2) [4].
Анализируя проблему роста заболеваемости МА, A. S. Go и соавт. [5] указали на причины, по которым величина роста данной патологии может недооцениваться.
Хорошо известно, что идентификация МА наиболее часто происходит при наличии ее устойчивых клинически явных форм, а транзиторные и асимптоматические случаи часто не диагностируются из-за отсутствия ясных клинических симптомов. Так, у 30% больных в исследовании Cardiovascular Health Study и у 45% больных в исследовании Stroke Prevention in Atrial Fibrillation Trials диагноз МА был поставлен при случайном снятии электрокардиограммы. По другим данным, соотношение асимптоматических пароксизмов к пароксизмам, сопровождающимся клинической симптоматикой у больных с пароксизмальной МА, доходит до 12:1.
В большом популяционном исследовании типа случай-контроль, основанном на анализе впервые зафиксированной МА у 1410 больных и 2203 лиц контрольной группы, обследованных Seattle за период с октября 2001 года по декабрь 2004 года в интегрированной системе здравоохранения Group Health (США), было обнаружено, что соотношение различных форм МА, выявленных у этих больных, выглядит следующим образом: у 39% больных МА имела транзиторный характер, у 45% — персистирующий/интермитирующий характер, носила устойчивой характер — у 15% лиц и ее характер не мог быть точно установлен у 1,7% больных (рис. 3) [6].
Использованная классификация МА основывалась на материалах Американской коллегии кардиологов (American College of Cardiology, АСС), Американской ассоциации сердца (American Heart Association, AHA), Европейского общества кардиологов (European Society of Cardiology, ASC) (2006 г.).
Транзиторная МА определялась как эпизод, длительностью до 7 дней и отсутствием повторного приступа в последующие 6 месяцев. Персистирующая/интермиттирующая форма заболевания диагностировалась при длительности приступа более 7 дней или если приступ имел повторный характер, но в дальнейшем в течение 6 месяцев сохранялся синусовый ритм. Об устойчивой МА говорили в тех случаях, когда аритмия сохранялась не менее 6 месяцев без признаков появления синусового ритма (аналогична термину ACC/AHA/ESC — перманентная).
Совершенно очевидно, что имеющиеся у исследователей возможности фиксации различных форм МА предопределяют результаты оценки распространенности данной патологии в конкретной популяции и позволяют оценить факторы риска, влияющие на возникновение МА.
Одной из основных общепризнанных причин нарастания частоты встречаемости МА является хорошо известный факт старения населения индустриально развитых стран мира. Показано, что частота развития МА увеличивается с возрастом населения. Приблизительно 1/3 всех больных с МА находится в возрастной группе 80 лет и старше. В то же время восьмидесятилетние лица являются наиболее быстро растущей группой населения в индустриально развитых странах. Существующие прогнозы на 2050-е гг. подчеркивают тот факт, что к этому времени большинство больных с МА будут иметь возраст 80 лет и старше (рис. 4)
Если взаимосвязь между увеличением заболеваемости СД 2-го типа и ростом застойной сердечной недостаточности хорошо известна, то специфическая взаимосвязь между СД и МА стала привлекать к себе особо пристальное внимание именно в последние годы.
Взаимосвязь СД и МА описывалась уже в течение нескольких десятилетий.
Еще в 1990-х гг. Фремингемское исследование обнаружило, что СД, как и артериальная гипертония, является независимым фактором риска развития МА с относительным риском (ОР) для мужчин 1,4, а для женщин — 1,6. Эта закономерность сохранялась и после учета влияния возраста и других сопутствующих факторов риска развития МА.
МА встречается у больных СД по крайней мере вдвое чаще, чем у людей без СД [7], и в три раза чаще, если больной СД страдает к тому же артериальной гипертензией (рис. 5) [8].
МА встречается примерно у 4% больных СД, наблюдаемых в поликлинических условиях, и у 15% госпитализированных больных [7, 8].
Однако не все эпидемиологические исследования, оценивая взаимосвязь МА и СД, дали однозначный положительный ответ на вопрос о независимом причинно-следственном характере данной взаимосвязи: 10 исследований подтвердили подобную взаимосвязь, в то время как 9 исследований — не обнаружили таковой (табл.).
В первую очередь подобной независимой взаимосвязи не обнаружили те исследователи, которые изначально специально не планировали в своих работах анализировать наличие этой взаимосвязи. По этой причине в дизайне их работ зачастую не учитывались такие показатели, как различный характер приступов МА, длительность существования СД и степень его гликемического контроля.
В 2005 г. были опубликованы данные крупномасштабного исследования, проходившего в Калифорнии США на базе Административного госпиталя ветеранов, специально поставившего перед собой цель оценить значимость СД как фактора риска развития МА [7]. Исследование включало в себя данные 293 124 больных СД 2-го типа, выписанных из этого госпиталя с 1990 по 2000 гг. В качестве контрольной группы были использованы данные 552 624 больных с артериальной гипертензией, не страдающих СД и отобранных на основании данных таких же историй болезни, как и больные основной группы. Исследователи учитывали наличие у больных МА, трепетания предсердий, застойной сердечной недостаточности, ишемической болезни сердца, гипертрофии миокарда левого желудочка сердца.
При проведении многомерного анализа было обнаружено, что СД является независимым фактором риска развития МА с ОР, равным 2,13 (95% ДИ: 2,10–2,16; р
В результате этого специализированного крупномасштабного исследования было однозначно доказано, что СД сам по себе является мощным и независимым фактором риска развития МА и трепетания предсердий.
Дополнительные сведения о взаимосвязи СД и МА были получены в уже упоминавшемся ранее исследовании в Seattle [6].
Авторы этого исследования исключили из анализа всех больных СД, не получавших фармакологического лечения. Это было сделано по той причине, что подобных больных было очень немного, и потому, что ранее какой-либо взаимосвязи между «нелеченным» СД и приступами МА ими обнаружено не было [6]. По данным этих исследователей ОР развития МА у лиц с фармакологически нелеченным СД не отличался достоверно от ОР лиц без нарушений углеводного обмена и составлял всего 1,04 (95% ДИ 0,75–1,45). Возможно, это связано с тем, что фармакологически нелеченный СД имел более мягкое течение и длительность нарушений углеводного обмена у подобных больных была довольно короткой.
Оценивая взаимосвязь «фармакологически леченного» СД с приступами МА, исследователи обнаружили следующее. Среди 1410 лиц с МА 252 (17,9%) имели фармакологически леченный СД, в то время как среди 2203 лиц контрольной группы без МА подобных больных было только 311 (14,1%).
ОР развития МА у больных с «фармакологически леченным» СД составлял 1,40 (95% ДИ 1,15–1,71) по сравнению с лицами без диабета. Кроме того, среди лиц с «фармакологически леченным» СД риск развития МА повышался на 3% с каждым годом увеличения продолжительности существования СД (95% ДИ 1–6%) (рис. 6) [6].
Относительный риск развития МА у лиц с «фармакологически леченным» СД возрастал по мере увеличения декомпенсации показателей их углеводного обмена.
Так, у больных со средним уровнем гликированного гемоглобина (HbA1c ) ≤ 7 ОР = 1,06 (95% ДИ 0,74–1,51); при HbA1c > 7, но ≤ 8 ОР = 1,48 (1,09–2,01); HbA1c > 8, но ≤ 9 ОР = 1,46 (1,02–2,08) и при HbA1c > 9 ОР = 1,96 (1,22–3,14) (рис. 7) [8].
Было отмечено, что взаимосвязь между «фармакологически леченным» СД и МА была достоверно сильнее выражена (p = 0,02) у лиц с ожирением (ОР = 1,64, 95% ДИ 1,27–2,12), чем у лиц без повышенного веса (ОР = 1,10, 95% ДИ 0,80–1,52). При этом не было отмечено существенного влияния пола, возраста, наличия артериальной гипертензии, гиперхолестеринемии, ишемической болезни сердца или застойной сердечной недостаточности (все р > 0,10).
Относительный риск возникновения транзиторной МА у больных «фармакологически леченным» СД составлял 1,35 (95% ДИ 1,03–1,78); для персистирующей/интермитирующей формы — 1,36 (1,06–1,76); для устойчивой формы — 1,71 (1,17–2,49). Достоверных различий при этом обнаружено не было (р = 0,5).
В результате исследование подтвердило, что «фармакологически леченный» СД ассоциируется с 40-процентным повышением риска развития МА и этот риск тем выше, чем более длительно протекает СД и чем хуже осуществляется контроль гликемических показателей.
По мнению профессора Anushk Patel, директора отдела сердечно-сосудистых заболеваний Георгиевского института международного здоровья (Университет Сиднея, Австралия), при нарастании количества больных СД к 2025 г. до 380 млн человек, количество больных МА возрастет среди них до 40 млн человек. Пожалуй, именно это в ближайшем будущем и определит ведущую роль СД в формировании контингента, страдающего МА во всем мире.
Значимость МА, как проблемы общественного здравоохранения, определяется ее тесной взаимосвязью с увеличенным риском возникновения нарушений мозгового кровообращения и развитием тяжелой сердечной недостаточности — двух наиболее тяжелых и экономически-затратных сердечно-сосудистых осложнений, определяющих продолжительность жизни подобного рода лиц.
По данным Фремингемского исследования пациенты с МА имеют в 1,5–2 раза более высокий риск годовой смертности, по сравнению с общей популяцией. Ежегодно у 5% лиц с диагностированной МА «неклапанного происхождения» возникают нарушения мозгового кровообращения. Это в 2–7 раза чаще, чем у лиц без МА. В результате МА является причиной от 75 000 до 100 000 эмболических инсультов в год [9].
Первым современным исследованием, обратившим внимание на МА как на один из сердечно-сосудистых показателей, влияющих на результаты интенсивной терапии больных СД 2-го типа, стало исследование ADVANCE (The Action in Diabetes and Vascular disease preterAx and diamicroN-MR Controlled Evalution).
В исследовании ADVANCE было проанализировано, насколько МА влияет на смертность и сердечно-сосудистый риск у больных с СД [10].
Напомню, что ADVANCE является рандомизированным факториальным исследованием, включающем в себя 11 140 больных СД 2-го типа в возрасте 55 лет и старше, имеющих, по крайней мере, 1 дополнительный фактор риска сердечно-сосудисых заболеваний. Больные основной группы получали фиксированную дозу периндоприла и индапамида, которая постепенно увеличивалась до максимальной дозы периндоприла в 8 мг/сутки.
Среди 11 140 больных, включенных в исследование, было выявлено 847 человек, страдавших МА.
При наблюдении за больными в течение 4,3 года умерло 879 человек и 15% из этих больных составили больные с МА.
При сравнении общей и сердечно-сосудистой смертности больных с и без МА было обнаружено, что МА ассоциируется с увеличением на 61% общей смертности и значительно более высоким риском сердечно-сосудистой смертности, инсульта и недостаточности кровообращения (рис. 8) [10].
После учета влияния сопутствующих факторов при многовариантном анализе группы достоверно различались по показателям общей смертности, сердечно-сосудистой смертности и частоте хронической сердечной недостаточности (рис. 9) [10].
Различия в уровне коронарных осложнений и цереброваскулярных событий при многовариантном анализе не подтвердились.
Взаимосвязь между развитием общей смертности, коронарных осложнений и цереброваскулярных событий у женщин была выражена больше, чем у мужчин, но эти различия не достигли статистически значимого уровня.
В исследовании ADVANCE при активном лечении МА впервые возникла у 3,3% больных, а при приеме плацебо в 3,6% (ОР = 0,92; 95% ДИ 0,74–1,13; р = 0,41).
Активное лечение привело к одинаковому снижению относительного риска у больных с и без МА. Однако, учитывая больший исходный сердечно-сосудистый риск у больных МА, абсолютная величина благоприятного влияния у больных с МА была значительно более выражена. Особенно отчетливо это видно из следующего.
Так, среди больных с МА 5-летнее активное лечение предотвращало одну смерть среди 39 больных, а среди больных без МА — 1 смерть у 89 больных. Еще больше это было выражено при оценке сердечно-сосудистой смертности. У больных с МА удавалось предотвратить 1 смерть среди 42 больных, в то время как у больных без МА — только среди 120 человек.
В заключение авторами исследования был сделан вывод о том, что:
- МА является сильным независимым маркером общей сердечно-сосудистой смертности, тяжелой хронической сердечной недостаточности у больных СД;
- снижение артериального давления приводит к большему абсолютному благоприятному эффекту у больных СД с МА;
- выявление МА у больных СД является показанием к наиболее агрессивной коррекции у них сердечно-сосудистых факторов риска.
Ряд физиологических механизмов могут лежать в основе взаимосвязи СД и МА. Ряд из них откровенно бросается в глаза. Во-первых, это характерное для СД развитие диастолической дисфункции левого желудочка, сопровождающейся значительным увеличением размеров левого предсердия, со стимуляцией фиброза сердечной стенки и ранним появлением признаков застойной сердечной недостаточности [11]. Во-вторых, наличие у большинства больных СД 2-го типа артериальной гипертензии еще более провоцирует развитие диастолической дисфункции с соответствующими последствиями. В-третьих, ускоренное развитие коронарного атеросклероза с его мощным ишемизирующим воздействием на миокард с формированием очаговых зон фибросклероза как морфологической основы феномена «re-entry».
Кроме того, для больных СД характерен высокий уровень С-реактивного белка, маркера системного воспаления, который в свою очередь ускоряет развитие миокардиального фиброза и диастолической дисфункции. Хорошо известно также, что диабет вызывает перестройку (ремоделирование) иннервации предсердий, включая парасимпатическую и гетерогенную симпатическую деиннервацию. Более того, имея часто сопутствующее ожирение, лица с диабетом имеют высокую частоту развития обструктивного апноэ, которое в свою очередь способствует развитию МА.
И, тем не менее, все вышеописанные механизмы в том или ином сочетании могут присутствовать и у лиц без нарушения углеводного обмена.
В то же время оказалось, что именно механизмы, формирующие нарушения углеводного обмена, наиболее тесно связаны с механизмами формирования ритма сердца как в норме, так и при его патологии. Возможно, именно это и определяет особенности течения и прогноза МА при СД.
В последнее десятилетие ХХ века было обнаружено, что наружная сарколемальная мембрана миокардиоцита заключает в себе сложный комплекс медиаторов, одновременно участвующих как в регуляции поступления глюкозы в клетку, так и в формировании электролитных потоков, исходящих и проникающих внутрь кардиомиоцита и формирующих как потенциал действия миокардиальной клетки, так и периоды ее электрической рефрактерности. Этот сложный комплекс включает в себя ряд рецепторов, ионных каналов, а также внутримембранные структуры, важнейшим из которых является фосфоинозитоловый механизм.
Этот своеобразный глюкозотранспортный механизм может активироваться или при связи инсулина с клеточным рецептором, или при воздействии определенных препаратов сульфанилмочевины с клеточным компонентом фосфолипазы С (рис. 10). Возникающий при этом диацилглицерол, стимулируя пируваткиназу С, увеличивает в клетке доступность транспортных переносчиков глюкозы и таким образом способствует поступлению глюкозы внутрь кардиомиоцита.
Кроме того, активация этого медиаторного пути влечет за собой изменение состояния ряда ионных каналов сарколеммы. В первую очередь это К + -АТФ-зависимые каналы, играющие важнейшую роль в правильном формировании потенциала действия миокардиальной клетки (рис. 11). От состояния фосфоинозитолового обмена сарколемальной мембраны зависит также состояние внутриклеточного Са ++ -баланса, Na + /H + -обмена, определяющих способность миокарда к сокращению и расслаблению и таким образом его способность к переходу из состояния рефрактерности к состоянию возбуждения и проведению электрического импульса. Отсутствие инсулина или состояние инсулинорезистентности резко нарушает не только поступление глюкозы внутрь миоцита, но и дезинтегрирует электрофизиологическую деятельность его ионных каналов.
Это процесс получил название электрофизиологического ремоделирования ионных каналов.
Некоторые исследователи называют СД болезнью внутриклеточного обмена кальция. При СД отмечается нарушение мембранного транспорта Са ++. изменение Са ++ -АТФ-азы саркоплазматического ретикулума, снижение активности Na + /К + -АТФ-азы сарколеммы, с дисбалансом между Na + /К + -АТФ-азой, Na + /Са ++ — и Na + /H + -обменами и со сниженной способностью митохондрий больного СД аккумулировать ионы Са ++ .
Гиперинсулинемия, свойственная СД 2-го типа, воздействуя на механизмы регуляции внутриклеточного Са ++. создает внутриклеточную кальциевую перегрузку в большинстве тканей больного, в том числе и в его сердечной мышце. Гипергликемия и дефицит инсулина усугубляют нарушения внутриклеточной регуляции ионов Na + и Са ++. У больных с длительным и тяжелым течением СД на этапе абсолютного дефицита инсулина внутриклеточное содержание ионов Na + и Са ++ значительно повышено, что создает высокий риск развития электрофизиологических нарушений, в том числе и развитие МА. Неудивительно поэтому, что при СД антиаритмические свойства препаратов, регулирующие эти ионные потоки, значительно изменены. В первую очередь это относится к таким препаратам, как флекаинид и верапамил.
Активность фосфоинозитолового пути сарколеммы, контролирующая электрофизиологические свойства мембраны миокардиоцита, может быть модифицирована при воздействии на рецепторы сарколеммы, связанные с регуляцией фосфоинозитолового пути (рис. 12).
Особенно интересны с этой точки зрения ингибиторы ангиотензинпревращающего фермента (АПФ-ингибиторы) и блокаторы АТ1-рецепторов, воздействующие на рецепторы к ангиотензину II. Так, блокада АТ1-рецепторов, воздействуя на фосфоинозитоловый механизм регуляции, вполне способна уменьшить нарушения функций ионных каналов сарколеммы, возникших вследствие фосфоинозитолового дисбаланса [12].
Метаанализ 11 рандомизированных клинических исследований, анализирующих возможности АПФ-ингибиторов и АТ1-блокаторов предотвращать развитие МА, был опубликован в 2005 году [13]. Общее количество больных, включенных в анализ, составило 56 308 пациентов. В 4 исследованиях влияние вышеназванных групп препаратов оценивалось у больных с хронической сердечной недостаточностью, в 3 — у больных с артериальной гипертензией, в 2 — у лиц, перенесших кардиоверсию по поводу МА и еще в 2 — у больных с инфарктом миокарда.
Клинические исследования по влиянию АПФ-ингибиторов и АТ1-блокаторов по предотвращению развития новых случаев МА у больных с инфарктом миокарда, недостаточностью кровообращения и/или артериальной гипертензией были отражены в исследованиях по первичной профилактике МА, таких как TRACE, SOLVD, Val-HeFT, CHARM, STOP-2, HOPE, LIFE и VALUE [13]. Вторичная профилактика МА в виде предотвращения повторных приступов МА также была исследована в ряде клинических работ [14–20].
В целом АПФ-ингибиторы и АТ1-блокаторы снижали относительный риск МА на 28% (95% доверительный интервал [ДИ] от 15% до 40%, р = 0,0002). Снижение частоты МА было одинаковым при сравнении АПФ-ингибиторов и АТ1-блокаторов (АПФ-ингибиторы 28%, р = 0,01; АТ1-блокаторы 29%, р = 000002), и наибольшее снижение отмечалось у больных с признаками хронической сердечной недостаточности (относительный риск снижения (ОРС) = 44%, р = 0,007). При этом не отмечалось значительного снижения МА у больных с артериальной гипертензией (ОРС = 12%, р = 0,4), хотя в одном из исследований отмечалось снижение на 29% у лиц с гипертрофией левого желудочка. У пациентов, подвергнутых кардиоверсии, ОРС составлял 48%, однако доверительный интервал был очень широким (95% ДИ от 21% до 65%).
В результате, по мнению ведущих экспертных рекомендаций «The 2007 Guidelines for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology» и «The 2006 Guidelines for the Management of patients with AF from the American College of Cardiology (ACC)/American Heart Association (AHA) Task Force on Practice Guidelines and European Society of Cardiology Committee for Practice Guidelines (Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society)» [21], результаты проведенных исследований и относительная безопасность применения АПФ-ингибиторов и АТ1-блокаторов по сравнению с антиаритмическими препаратами подчеркивают важную роль этих препаратов в предотвращении возникновения первичных и повторных эпизодов МА у больных с АГ, ИМ, ХСН и/или СД.
Подобный относительно новый фармакологический подход, направленный на предотвращение возникновения МА с помощью лекарственных средств, воздействующих на процессы, предшествующие формированию нарушенных электрофизиологических свойств миокарда и возникновению МА, получил в англоязычной литературе название «upstream»-терапии. В русском переводе некоторые авторы использовали прямой перевод — «терапии вверх по течению». Возможно, более удачно было бы говорить о «заградительной или препятствующей» терапии.
Широкий доверительный интервал эффективности данного вида терапии указывает на то, что механизмы формирования МА, чувствительные к ней, в неодинаковой мере выражены у всех групп больных. В первую очередь это, конечно, «неклапанные» формы МА, то есть не гемодинамически обусловленные. С другой стороны, это формы поражения миокарда, где развитие снижения сократительной способности левого желудочка и формирование канальцевых ионных нарушений тесно связаны между собой, и в данном случае трудно представить себе более понятную модель повреждения миокарда, чем функционирование миокарда у больного СД.
Именно у этих больных специфическое нарушение фосфоинозитолового механизма сарколемальной мембраны, клинически проявляющейся в формировании гипергликемии, ведет одновременно к «оглушению» миокарда и снижению его сократительных возможностей, а также к перестройке ионных каналов сарколеммы и изменению электрических свойств миокарда, предрасполагая последний к развитию МА.
Безусловно, для формирования специальных рекомендаций требуются дальнейшие исследования. Ясно, однако, что «преграждающая» терапия МА уже сейчас является состоявшейся клинической реальностью.
- Gersh B. J. Tsang T. S. M. Seward J. B. The changing epidemiology and natural history of non-valvular atrial fibrillation: clinical implication // Trans Am Clin Climatol Assoc. 2004; 115: 149–59; discussion 159–160.
- Tsang T. S. Gersh B. J. Atrial fibrillation: an old disease, a new epidemic // Am J Med. 2002, Oct 1; 113 (5): 432–435.
- Chugh S. S. Blackshear J. L. Shen W. K. Hammil S. C, Gersh B. J. Epidemiology and natural history of atrial fibrillation: clinical implications // J Am Coll Cardiol. 2001, Feb; 37 (2): 371–378.
- Wattigney W. A. Mensah G. A. Croft J. B. Increasing trends in hospitalization for atrial fibrillation in the United States, 1985 through 1999: implications for primary prevention // Circulation. 2003, Aug 12; 108 (6): 711–716. Epub 2003 Jul 28.
- Go A. S. Hylek E. M. Phillips K. A. Chang Y. C. Henault L. E. Selby J. V. Singer D. E. Prevalence of Diagnosed Atrial Fibrillation in Adults National Implications for Rhythm Management and Stroke Prevention: the AnTicoagulation and Risk: Factors In Atrial Fibrillation (ATRIA) Study // JAMA. 2001, May 9; 285 (18): 2370–2375.
- Dublin S. Glazer N. L. Smith N. L. Psaty B. M. Lumley T. Wiggins K. L. Page R. L. Heckbert S. R. Diabetes mellitus, glycemic control, and risk of atrial fibrillation // J Gen Intern Med. 2010, Aug; 25 (8): 853–858. Epub 2010 Apr 20.
- Movahed M. R. Hashemzadeh M. Jamal M. M. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition toother cardiovascular disease // Int J Cardiol. 2005, Dec 7; 105 (3): 315–318.
- Ostgren C. J. Merlo J. Rastam L. Lindblad U. Atrial fibrillation and its association with type 2 diabetes and hypertension in a Swedish community // Diabetes Obes Metab. 2004, Sep; 6 (5): 367–374.
- Wolf P. A. Abbott R. D. Kannel W. B. Atrial fibrillation as an independent risk factor for stroke: the Framingham study // Stroke. 1991, Aug; 22 (8): 983–988.
- Du X. Ninomiya T. de Galan B. Abadir E. Chalmers J. Pillai A. Woodward M. Cooper M. Harrap S. Hamet P. Poulter N. Lip G. Y. Patel A. ADVANCE Collaborative Group. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study // Eur Heart J. 2009, May; 30 (9): 1128–1135. Epub 2009 Mar 11.
- Rutter M. K. Parise H. Benjamin E. J. Levy D. Larson M. G. Meigs J. B. Nesto R. W. Wilson P. W. Vasan R. S. Impact of glucose intolerance and insulin resistance on cardiac structure and function: sex-related differences in the Framingham Heart Study // Circulation. 2003, Jan 28; 107 (3): 448–454.
- Ford W. R. Clanachan A. S. Lopaschuk G. D. Schulz R. Jugdutt B. L. Intrinsic ANG II type 1 receptor stimulation contributes to recovery of postischemic mechanical function // Am J Physiol. 1998; 274: H1524-H1531.
- Healey J. S. Baranchuk A. Crystal E. Morillo C. A. Garfinkle M. Yusuf S. Connolly S. J. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers // A Meta-Analysis. JACC. 2005; 45 (11): 1832–1839.
- Tsang T. S. Barnes M. E. Bailey K. R. et al. Left atrial volume: important risk marker of incident atrial fibrillation in 1655 older men and women // Mayo Clin Proc. 2001; 76: 467–475.
- Benjamin E. J. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study // JAMA. 1994; 271: 840–844.
- Vaziri S. M. Larson M. G. Benjamin E. J. Levy D. Echocardiographic predictors of nonrheumatic atrial fibrillation: the Framingham Heart Study // Circulation. 1994; 89: 724–730.
- Kalifa J. Jalife J. Zaitsev A. V. et al. Intra-atrial pressure increases rate and organization of waves emanating from the superior pulmonary veins during atrial fibrillation // Circulation. 2003; 108: 668–671.
- Li D. Fareh S. Leung T. K. Nattel S. Promotion of atrial fibrillation byheart failure in dogs: atrial remodeling of a different sort // Circulation. 1999; 100: 87–95.
- Fox K. M. For the European Trial on Reduction of Cardiac Events With Perindopril in Stable Coronary Artery Disease Investigators. Efficacy of Perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomized, double-blind, placebo-controlled, multicenter trial (the EUROPA study) // Lancet. 2003; 362: 782–788.
- Weber M. A. Julius S. Kjeldsen S. E. et al. Blood pressure dependent and independent effects of anti-hypertensive treatment on clinical events in the VALUE trial // Lancet. 2004; 363: 2049–2051.
- Dorian P. Singh B. N. Upstream therapies to prevent atrial fibrillation // Eur Heart J. 2008; 10 (Supplement H): H11-H31.
А. А. Александров*, доктор медицинских наук, профессор
М. Н. Ядрихинская*, кандидат медицинских наук
Е. Н. Абдалкина**, кандидат медицинских наук
С. С. Кухаренко*, кандидат медицинских наук
О. А. Шацкая*, кандидат медицинских наук
* ФГБУ ЭНЦ МЗ РФ, Москва
** НОУ ВПО СМИ РЕАВИЗ, Самара
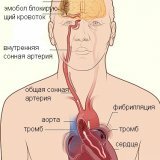
Аритмия и сахарный диабет взаимосвязаны
Исследователи из Калифорнийского университета в Дэвисе обнаружили чёткую связь между диабетом и болезнями сердца, что может объяснить, почему страдающие сахарным диабетом имеют повышенный риск развития заболеваний сердца. Об этом свидетельствуют данные исследования, опубликованного в журнале Nature .
Исследователи обнаружили, что когда сахар в крови является аномально высоким (гипергликемия), это активизирует сбои в проводимости в ритме сердца, который вызывает нерегулярное сердцебиение — это состояние называется сердечной аритмией – которое связано с сердечной недостаточностью и внезапной остановкой сердца.
По данным «Всемирной сердечной федерации сердца», люди, которые страдают сахарным диабетом в три — четыре раза более склонны к развитию сердечно-сосудистых заболеваний, по сравнению с людьми, у которых нет сахарного диабета .
Американская ассоциация сердца говорит, что около 65% больных сахарным диабетом умирают от болезней сердца или инсульта. подчеркивая необходимость для новых исследований чтобы проследить связь с ещё несколькими заболеваниями.
Для этого исследования, сотрудники в университете Джона Хопкинса, провели ряд экспериментов по определению любых причин, почему страдающих сахарным диабетом имеют более высокий риск сердечно-сосудистых заболеваний.
Зона аритмии.
В их опытах изучен подробный молекулярный анализ крысиных и человеческих белков и тканей, особенно наличие кальция в изолированных кардиомиоцитах крыс, (клетки, находящиеся в мышечной ткани сердца), которые были накачены высоким содержанием глюкозы, а также прослеживание взаимодействия концентрации глюкозы и сердечной аритмии. И как будут функционировать сердечные клетки в условиях искусственно созданного сахарного диабета .
Боли в груди
Исследователи обнаружили, что молекула сахара, O-GlcNAc, связывается с белком который называется CaMKII и они вместе вызывают аритмию у пациентов с высоким содержанием уровня глюкозы в крови.
Их результаты показали, что скачок от умеренного до высокого уровня глюкозы в крови, аналогичные тем, что наблюдаются у больных сахарным диабетом, вызываются парой ранее названных молекул.
По словам исследователей, белок CaMKII играет важную роль в регуляции нормального уровня кальция, электрической активности и насосной деятельности сердца.
Результаты этого исследования несомненно приведут к новому лечению аритмии сердца при сахарном диабете.
Профессор Харт отмечает, что эти данные, несомненно, приведут к разработке новых методов лечения для больных сахарным диабетом, таких как сердечно-сосудистые заболевания и будут разработаны потенциально новые препараты для снижения токсичности глюкозы в других тканях, которые страдают от диабета, например, нервная система, почки и сетчатка.
Дональд Берс, заведующий кафедрой фармакологии Калифорнийского университета в Дэвисе и главный автор исследования, говорит:
«Механизм молекулярного понимания выявленных нами белков прокладывает путь для новых методов лечения. которые помогут защитить сердце у больных страдающим сахарным диабетом».
Авторы исследования говорят, что необходимы дальнейшие исследования, в частности, определить, является ли слияние белков ( O-GlcNAc с CaMKI) провоцирующим фактором играющим роль в расстройстве периферической нервной системы (диабетическая полинейропатия), состояние, которое также встречается у диабетиков.