Сердечная недостаточность после инфаркта миокарда. Терапевтическая ценность инфаркта миокарда
Весьма интересны результаты ретроспективного анализа по группе больных. которые вошли в исследование ВНАТ, с ХСН в анамнезе либо с ХСН, компенсированной приёмом мочегонных и дигоксина (К. Chadda et al. 1986). Оказалось, что эти больные (без признаков недостаточности кровообращения на момент рандомизации) хорошо переносили лечение бета-блокатором. На фоне терапии пропранололом значительно снизилась частота развития внезапной смерти (на 47 %), а также показатель общей смертности по группе (на 27 %).
У больных без ХСН в анамнезе частота развития внезапной смерти уменьшилась на 13 %.
В пользу осторожного назначения бета-блокаторов больным с сердечной недостаточностью после инфаркта миокарда свидетельствуют результаты исследования Е. Lichstein и соавт. (1990). По их данным, риск смерти больных с фракцией изгнания > 30 % в течение 2,5 лет был на 47 % ниже, если они принимали бета-блокаторы.
Благоприятное действие. по данным эхокардиографического исследования, на внутрисердечную гемодинамику сочетания эналаприла с бета-блокаторами отметили V. V. S. Bonarjee и соавт. (1996) через 3 сут, 1 и 6 мес после инфаркта миокарда. Используя рентгеноконтрастную вентрикулографию, М. Kyriakidis и соавт. (1996) показали, что у больных с фракцией изгнания левого желудочка < 40 % его функцию можно улучшить, комбинируя в течение первого месяца после развития инфаркта миокарда каптоприл с бета-блокаторами и нитратами.
Практика назначения бета-блокаторов больным, страдающим сердечной недостаточностью, в том числе перенесшим инфаркт миокарда, получила в последние годы дополнительную поддержку. Два больших рандомизированных исследования в Европе были прекращены ранее запланированных сроков в связи с отмеченным существенным снижением смертности среди пациентов с сердечной недостаточностью, которым дополнительно назначали (3-блокаторы.
Результаты исследований CIBIS-II и MERIT-HF, полученные почти на 6500 больные при достаточно длительном периоде наблюдения, более внушительны, нежели данные об эффективности карведилола, полученные в США на 1094 пациентах (которых предварительно отбирали на переносимость 6,25 мг препарата дважды в сутки) при наблюдении в течение полугода (М. Packer et al, 1996).
Многоцентровое международное рандомизированное исследование COPERNICUS (Carvedilol Prospective Randomized Cumulative Survival Trial) продемонстрировало безопасность и терапевтическую ценность назначения карведилола больным с выраженной сердечной недостаточностью (М. Packer, 2000). У вошедших в него 2289 больных среднее значение фракции изгнания левого желудочка составляло 20%.
В исследования не включали пациентов. находящихся на внутривенном введении инотропных препаратов или вазодилятаторов, с задержкой жидкости (неконтролируемой мочегонными средствами), с выраженной гипотензией, почечной недостаточностью, а также — с острой сердечной недостаточностью. По данным, представленным на симпозиуме, общая смертность в течение года составила на фоне приёма карведилола 11,4% (130/1156). В контрольной группе этот показатель равнялся 18,5% (190/1133). Таким образом, общую смертность удалось снизить на 35% (р < 0,0002).
Подробная журнальная публикация позволит уточнить многие важные клинические вопросы, касающиеся того, каким больным с выраженной сердечной недостаточностью и как именно следует назначать карведилол.
Оглавление темы «Лекарственная терапия инфаркта миокарда»:
ХРОНИЧЕСКАЯ ЗАСТОЙНАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ У БОЛЬНЫХ ПОСЛЕ ИНФАРКТА МИОКАРДА
Кириченко А.А.
В обзорной статье показано, что наилучшие результаты лечения больных с застойной сердечной недостаточностью достигаются при использовании методов терапии, позволяющих не только улучшить показатели гемодинамики, но и снизить активность ряда нейроэндокринных систем.
The review demonstrates that the best treatment results in patients with congestive heart failure care are achieved with the therapy that not only improves hemodynamic parameters, but decreases the activity of some neuroendocrine systems.
А.А. Кириченко – зав. кафедрой №2 терапии РМА последипломного образования, Москва
A.A.Kirichenko, Head, Department of Therapy №2, Russian Medical Academy of Postgr aduate Training, Moscow
С овершенствование методов лечения инфаркта миокарда (ИМ) привело к существенному снижению смертности, как больничной, так и в течение одного года после выписки из стационара. Однако в последующие 5 лет смертность остается высокой. Более успешное лечение пациентов в острой стадии привело к увеличению числа больных, выживших после больших и даже повторных инфарктов миокарда, имевших значительные нарушения функции левого желудочка. В связи с этим возросло число пациентов с признаками застойной сердечной недостаточности (СН). ИМ является стартовой точкой в патогенезе СН.
Механизмы развития СН
Важную роль играют морфологические изменения левого желудочка. В зоне инфаркта происходит непропорциональное растяжение и истончение стенки желудочка. Этот процесс, начинающийся на ранней стадии (в течение первых 2 нед после ИМ), был описан в конце 70-х годов как “экспансия инфаркта”. Гистопатологические механизмы дилатации и истончения стенки инфарцированной области включают: растяжение клеток, разрыв миоцитов, уменьшение межклеточного пространства, соскальзывание клеток. Клеточное растяжение – большое повреждение, которое имеет место в некротизированных клетках инфарцированной области. Клеточное соскальзывание означает удлинение жизнеспособной миокардиальной ткани в результате перемещения и новой ориентации миокардиальных клеток.
В более поздней фазе ИМ (между 2-й и 6-й неделей) отложения коллагена ведут к формированию прочного рубца и “излечению” инфаркта.
Изменения происходят также в интактном миокарде. Развивается миогенная дилатация левого желудочка. Однако как в нормальном, так и в декомпенсированном сердце расстояние между дисками составляет в среднем 1,4 – 1,5 мкм. Следовательно, удлинение миокарда происходит не за счет перерастяжения мышечных волокон, а за счет их смещения, при этом количество слоев по мере дилатации уменьшается.
Некоторые авторы считают, что дилатация непораженных участков миокарда вначале носит компенсаторный характер и направлена на восстановление ударного объема и поддержание системной гемодинамики. Ввиду ограниченности максимального расстояния, на которое каждый саркомер может уменьшить свою длину, повышение ударного объема достигается за счет увеличения числа последовательно расположенных саркомеров (соскальзывание), что в свою очередь приводит к увеличению объема полости желудочка. При этом устанавливаются новые соотношения между давлением в левом желудочке и его объемом, что позволяет сохранить ударный объем несмотря на уменьшение фракции выброса.
Существует и другая точка зрения. N.Gadsbool и соавт. показавшие, что дилатация левого желудочка происходит независимо от величины и направления изменений ударного объема, высказывают сомнение относительно компенсаторного характера дилатации и предполагают иные, пока не установленные механизмы ее развития. Гистологические исследования показали, что при ИМ в сохраненных участках левого желудочка, а также в правом желудочке и предсердии имеются мозаичные структурные повреждения. Авторы постоянно наблюдали набухание отдельных эндотелиоцитов с замыканием просвета капилляров и считают это явление универсальной реакцией на гипоксию и перегрузку. Этот феномен можно было наблюдать в каждой исследованной микрозоне миокарда, начиная с первых часов заболевания. Заметно нарушалась связь между капиллярами и лежащими вблизи них миоцитами за счет отека интерстиция. Уменьшалась площадь диффузии капилляр–миоцит в результате исчезновения складчатости стенок капилляров и сарколеммы миоцитов. При возникновении недостаточности микроциркуляторного русла нарушается поступление кислорода и субстратов питания к миоцитам. Происходит разобщение составных элементов гистиона (капилляр–строма–паренхима), наступает частичная гибель миоцитов. Повреждение и гибель миоцитов в сохраненных зонах сердца коррелируют с обширностью ИМ и характером его осложнений. Эти наблюдения согласуются с экспериментальными данными.
R.McKay и соавт. считают, что ранняя дилатация приводит к напряжению стенки, не пораженной инфарктом, вызывая ее гипертрофию. Уцелевшему миокарду приходится выполнять и работу погибшей части левого желудочка. Компенсаторная гиперфункция миокарда быстро приводит к увеличению синтеза белка и к гипертрофии миокарда. В такой высокодифференцированной ткани, как сердечная мышца, гиперплазия (увеличение числа клеток) практически не имеет места. Гипертрофия миокарда происходит за счет увеличения массы отдельных его волокон. Гипертрофия сердечной мышцы без увеличения полостей сердца обозначается как концентрическая и характеризуется утолщением сердечной стенки. Гипертрофия в комбинации с дилатацией является эксцентрической и при ней не отмечается утолщения стенок . Следовательно, при увеличении общей массы сердца толщина стенок может быть нормальной. В условиях высокого напряжения стенки рост мышечных волокон в длину ускоряется, что обусловливает сруктурную дилатацию. Гипертрофия миокарда не всегда может компенсировать возросшие нагрузки и предотвратить развитие СН после перенесенного ИМ.
Эффективность компенсаторных процессов во многом зависит от состояния коронарного кровоснабжения уцелевшего миокарда. При неадекватном его кровоснабжении дилатация полостей больше и сочетается с более высокой смертностью. Это связано с тем, что повышенная нагрузка на миокард и компенсаторные гипертрофические процессы должны быть обеспечены энергией и пластическим материалом. Если повышенная потребность в кровотоке ограничивается стенозированием артерии, компенсаторные процессы не достигают необходимого уровня и не могут поддерживаться длительно.
Таким образом, увеличение объемов левого желудочка является неблагоприятным прогностическим показателем при остром ИМ. Самым сильным предсказующим фактором неблагоприятного прогноза после острого ИМ служит увеличение конечного систолического объема левого желудочка; значимость этого параметра оказалась выше, чем фракции выброса.
Комплекс изменений, происходящих в сердце (дилатация и изменение конфигурации полостей, гипертрофия) при инфаркте миокарда и в последующем периоде в настоящее время часто обозначается термином “постинфарктное ремоделирование”.
Нейроэндокринные изменения при СН
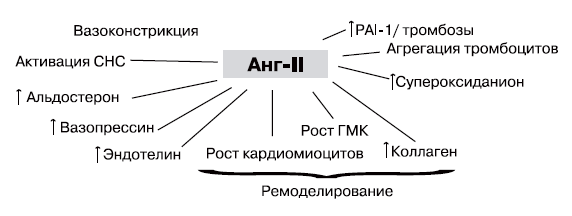
В процессах постинфарктной перестройки важную роль играет и нейроэндокринная активация. Уже в первые дни ИМ происходит ряд нейрогормональных изменений, прежде всего повышение активности симпатической и ренин-ангиотензин-альдостероновой (РАА) систем. При этом наблюдается и местная активация ренин-ангиотензиновой системы миокардиальной ткани, достигающая максимума через 72 ч от начала ИМ. Выраженность нейрогормональной активации зависит от степени дисфункции левого желудочка. Активность РАА-системы нормализуется в течение 5 – 7 дней, если для лечения СН не применялись диуретики. Однако уровень норадреналина и предсердного натрийуретического фактора (ПНФ) в плазме крови остается повышенным, причем их содержание коррелирует со степенью дисфункции левого желудочка. В исследовании SAVE (Survival and Ventricular Enlargement – “Выживание и расширение желудочка”) показано, что незначительная нейрогормональная активация, в том числе РАА-системы, может сохраняться до 12 дней после развития ИМ. Активация симпатической и РАА-систем играет важную роль в приспособлении к новым условиям функционирования, стимулируя раннюю гипертрофию кардиомиоцитов и замещение зоны инфаркта рубцовой тканью.
Изменения структуры и формы желудочка (ремоделирование), а также нейрогормональная активация способствуют нормализации сердечного выброса в первые недели. Однако приблизительно у 1/5 пациентов с крупноочаговыми инфарктами на протяжении последующих месяцев и лет отмечаются прогрессивное увеличение конечно-диастолического и конечно-систолического объемов, рост конечно-диастолического давления (КДД) в левом желудочке, появляются клинические признаки СН.
До недавнего времени считалось, что развитие застойной СН связано с нарушениями гемодинамики. Поэтому при планировании лечения и оценке его эффективности учитывали сердечный выброс, легочное давление заклинивания, фракцию изгнания левого желудочка и другие характеристики давления и потоков. Однако длительные наблюдения показали, что прогрессирование застойной СН нередко отмечалось несмотря на улучшение показателей гемодинамики. Вазодилататоры и стимуляторы сократимости миокарда, улучшая гемодинамический статус, часто не останавливают прогрессирования заболевания и даже могут снижать выживаемость. Эти наблюдения стимулировали поиск других причин прогрессирования сердечной патологии.
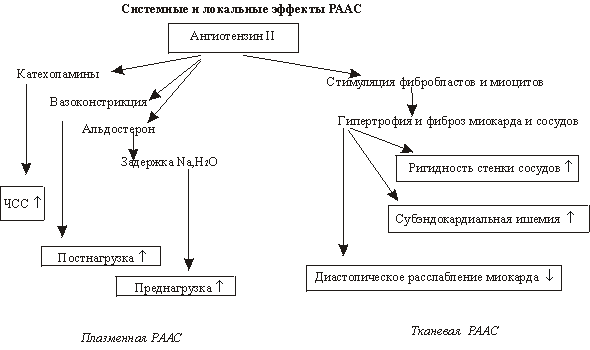
В отличие от острой СН при хроническом ее течении большее значение в компенсации периферического кровобращения при малом сердечном выбросе имеет увеличение объема циркулирующей крови. Если несмотря на гипертрофию сердечной мышцы и дилатацию желудочка пропульсивная сила сердца недостаточна для обеспечения адекватного кровоснабжения тканей, включаются экстракардиальные компенсаторные механизмы, которые должны способствовать повышению кровотока в тканях. В физиологических условиях эти механизмы повышают минутный объем сердца через увеличение количества крови в кровеносном русле и, следовательно, венозного притока к сердцу. Нейрогормональная активация является важным механизмом гомеостатического контроля, в котором ключевую роль играет активация вазоконстрикторных систем. У пациентов с застойной СН выявлено повышение содержания в плазме основных нейрогормонов этих систем (норадреналин; ренин; ангиотензин II; аргинин–вазопрессин – АВП). Повышается также продукция допамина, простагландинов, ПНФ, эндотелина и эндотелийпродуцируемого релаксирующего фактора. Хотя некоторые гормоны являются вазодилататорами, суммарный эффект нейрогормональной активации при СН проявляется вазоконстрикцией.
На уменьшение сердечного выброса симпатическая нервная система отвечает высвобождением катехоламинов. которые увеличивают частоту сердечного ритма, артериальное давление и сократимость миокарда, а также активируют РАА-систему. Нарушение функции сердечно-легочных барорецепторов низкого давления ведет к уменьшению парасимпатической и увеличению симпатической импульсации, что является одним из возможных механизмов повышения уровня норадреналина в плазме у пациентов с СН. Хроническая симпатическая активация при СН также ведет к уменьшению плотности b-адренергических рецепторов на кардиомиоцитах, что является важным фактором в ослаблении инотропного эффекта циркулирующих катехоламинов.
Высокий уровень катехоламинов может вызывать миокардиальные некрозы и аритмии, что особенно важно, поскольку около 50% смертей пациентов с СН связывают с возникновением тахиаритмий. Увеличение уровня циркулирующих катехоламинов прямо коррелирует с тяжестью заболевания и обратно – с вероятностью выживания пациентов с СН.
Активация РАА-системы вносит дополнительный вклад в вазоконстрикцию и задержку жидкости. Ренин катализирует превращение ангиотензиногена в ангиотензин I, который в свою очередь преобразуется ангиотензин-конвертирующим ферментом (АКФ) в мощный вазоконстриктор ангиотензин II, стимулирующий высвобождение альдостерона и АВП, что ведет к задержке натрия и воды. В дополнение к плазменной РАА-системе тканевой ангиотензин II также играет важную роль в развитии застойной СН. Тканевая ренин-ангиотензиновая система была распознана Dzau. Ангиотензин II, синтезированный в тканях сердца, может способствовать миокардиальной сократимости прямо или опосредованно, облегчая высвобождение норадреналина из окончаний сердечных нервов. Он также усиливает рост кардиомиоцитов. Высокое содержание ангиотензина II, как и катехоламинов, может вызывать желудочковые аритмии.
Система АВП — сильный медиатор периферической вазоконстрикции. Эта система поддерживает уровень воды в организме, оказывая прямое антидиуретическое воздействие на почечные канальцевые клетки. Ее эффекты опосредуются двумя различными АВП-рецепторами. В гладкой сосудистой мускулатуре АВП вызывает вазоконстрикцию через взаимодействие с V1-рецептором; взаимодействие с V2-рецептором увеличивает абсорбцию воды в почках. Секреция АВП стимулируется ангиотензином II и ингибируется ПНФ. У пациентов с застойной СН концентрация АВП в плазме обычно повышается.
ПНФ продуцируется миоцитами предсердий и выделяется в кровоток при их растяжении. В норме его роль заключается в обеспечении натрийуреза, диуреза и вазодилатации. Дополнительно ПНФ угнетает секрецию ренина и альдостерона. Предполагается, что ПНФ дает противоположный регуляторный эффект и ослабляет действие вазоконстрикторных систем. Высокая концентрация ПНФ также может играть роль в уменьшении задержки натрия почками. ПНФ оказывает влияние на симпатическую и парасимпатическую системы, на почечные канальцы и сосудистую стенку. Уровень ПНФ в плазме у пациентов с застойной СН обычно повышен. Однако ответ на повышенный выброс ПНФ при СН ослабевает. Механизмы, лежащие в основе сниженного ответа на ПНФ при застойной СН неясны.
Эндотелин – один из наиболее сильных вазоконстрикторов. Норадреналин, АВП и интерлейкин-1 стимулируют его высвобождение из эндотелиальных клеток, а эндотелин в свою очередь увеличивает уровень ПНФ, АВП и альдостерона в плазме. Содержание эндотелина в плазме у пациентов с застойной СН повышено, но не коррелирует с системным сосудистым сопротивлением или сердечным выбросом.
Данные, полученные в исследовании левожелудочковой дисфункции (SOLVD) и в эксперименте, свидетельствуют, что симпатическая активация обычно предшествует трансформации дисфункции левого желудочка в СН. Подобные результаты наблюдались в исследовании SAVE, в котором пациенты после ИМ с фракцией изгнания менее 40%, но без признаков СН имели более высокий уровень норадреналина, ренина, АВП и ПНФ, чем пациенты контрольной группы. Естественно, возникает вопрос: является ли увеличение содержания нейрогормонов причинным фактором или просто предвестником СН. Имеются как прямые, так и непрямые свидетельства того, что нейрогормоны играют причинную роль в патогенезе застойной СН.
Методы медикаментозной коррекции сердечной недостаточности
Тот факт, что попытки приостановить прогрессирование сердечной недостаточности с помощью лекарств, преимущественно влияющих на пред- и постнагрузку и сократимость миокарда терпят неудачу, представляет непрямое доказательство важности нейрогормонов в этом процессе. Терапия b- агонистами и ингибиторами фосфодиэстеразы. за счет положительного инотропизма обеспечивающая улучшение гемодинамики, сочеталась с увеличением смертности при застойной СН. Результаты исследований, оценивающих влияние вазодилататоров на заболеваемость и смертность, связанную с застойной СН, разноречивы. В исследовании, в котором сравнивали лечебное действие празозина и комбинации гидралазина с изосорбидом динитратом, выявлено, что терапия празозином, приводившая к наибольшему снижению артериального давления, не сопровождалась снижением летальности. Снижение смертности под влиянием комбинированной терапии гидралазин + изосорбида динитрат было статистически значимым, хотя и небольшим (p = 0,05). Хотя в этих исследованиях и не оценивали содержание нейрогормонов, было показано, что гемодинамическое улучшение не обязательно замедляет прогрессирование СН.
Некоторые из наиболее значимых данных, подтверждающих влияние нейрогормонов на развитие застойной СН, получены в исследованиях, демонстрирующих положительное действие ингибиторов АКФ и b- блокаторов. т.е. двух классов лекарств, которые вмешиваются в нейрогормональные реакции. Результаты Cooperativ North Scandinavian Enalapril Survival Study показали, что эналаприл снижает смертность на 31% у пациентов с СН к концу первого года наблюдения. Исследование SOLVD также продемонстрировало, что использование эналаприла привело к значительному снижению смертности у пациентов с умеренной и выраженной СН. В одном из исследований, наиболее ясно подтвердившем значение нейрогормонов – Veterans Affairs Heart Failure Trial – сравнили эффективность комбинации гидралазина и изосорбида динитрата, благоприятно влиявшей на гемодинамику, но не изменившей содержание нейрогормонов в крови, с эффективностью эналаприла, оказывавшего благоприятное как нейрогормональное, так и гемодинамическое действие. Отмечено более значительное увеличение фракции изгнания левого желудочка при лечении комбинацией гидрадазин + изосорбида динитрат, а у получавших эналаприл – снижение в плазме уровня норадреналина. К концу последующего 2-летнего периода смертность оказалась значительно ниже среди пациентов, леченных эналаприлом.
Важность симпатической активации в прогрессировании застойной СН подтверждается результатами нескольких контролированных исследований, которые показали лечебный эффект b- блокаторов (метопролол, буциндолол, небиволол, бисопролол и карведилол). Важные результаты были получены в большом исследовании, в котором изучалось влияние карведилола на заболеваемость и смертность у пациентов с застойной СН. Пациенты получали плацебо или карведилол в комбинации с базовой терапией, состоящей из ингибиторов АКФ, диуретиков и дигоксина. У пациентов, хорошо переносивших карведилол, терапия сочеталась со снижением летальности и уменьшением числа госпитализаций. Однако эти данные, по-видимому, нельзя переносить на всех больных с застойной СН, особенно с тяжелыми ее формами. Это связано с низкими показателями летальности в обеих группах. Последнее характерно для больных с весьма умеренной формой СН.
Определение важности активации нейрогормональной системы в прогрессировании СН способствовало появлению более критического отношения к существующей лекарственной терапии. В частности, диуретики, одни из наиболее часто используемых препаратов для лечения застойной СН, не замедляют прогрессирования СН. Показано, что диуретики сильно стимулируют компенсаторную активацию РАА-системы. Петлевые диуретики, такие как фуросемид, активируют РАА-, АВП- и симпатическую системы. Они могут также уменьшить уровень ПНФ в плазме, приводя таким образом к вазоконстрикции. Хотя диуретики важны для контроля перегрузки жидкостью, они могут оказывать неблагоприятное влияние на течение СН.
В многих исследованиях показана эффективность ингибиторов АКФ в снижении нейрогормональной активации. Эти препараты противодействуют РАА-системе, ингибируя АКФ и снижая образование ангиотензина II, уменьшают вазоконстрикцию и задержку натрия. Ингибиторы АКФ также снижают активность симпатической нервной системы, они улучшают функцию барорецепторов, что может способствовать предотвращению появления нейрогормонального каскада. Данные исследования AIREX свидетельствуют о выраженной, долговременной и статистически достоверной эффективности рамиприла при лечении больных с СН, развившейся после острого ИМ. Проведенный анализ показал, что наибольшая эффективность проявляется после 12 мес терапии. Большой интерес представляют отдаленные результаты лечения: к концу 5-летнего периода относительный риск смерти у пациентов, получавших рамиприл в первые 12 мес после ИМ, оказался на 36% ниже. Результаты, полученные в исследовании GISSI-3, свидетельствуют о значительно более высокой эффективности комбинированной терапии ингибиторами АКФ (лизиноприл) и нитратами (депонит 10), особенно в группах высокого риска, таких как женщины и пациенты пожилого возраста.
Из-за негативного инотропного действия b-блокаторы у пациентов с СН используются очень осторожно. Эти агенты, очевидно, осуществляют свое благотворное действие через b-рецепторы, посредством блокады симпатической стимуляции. Они могут также защитить миокард от прямого токсического действия высоких уровней норадреналина. Предполагается, что b-блокаторы, нормализуя функцию b-рецепторов, улучшают ответ на катехоламины и снижают по механизму обратной связи потребность в норадреналине.
Дигиталис снижает нейрогормональную активацию, восстанавливая ингибирующее влияние кардиальных барорецепторов на симпатические ответы. Этот эффект, вероятно, способствует их отдаленному благотворному влиянию при застойной СН. Дигиталис уменьшает также содержание норадреналина и активность ренина в плаземе. В рандомизированном 6-месячном исследовании 64 пациента с застойной СН (класс II или III по NYHA) получали ибопамин (агонист допамина, предназначенный для приема per os), дигоксин или плацебо. Уровень эпинефрина в плазме в группах, получавших ибопамин и дигоксин уменьшился, а активность ренина снизилась только на фоне приема дигоксина. Однако у принимавших ибопамин отмечено увеличение смертности. В недавнем исследовании Digitalis Investigation Group сравнивалась эффективность дигоксина с плацебо у пациентов с застойной СН и фракцией изгнания менее 45%. Больные обеих групп получали ингибиторы АКФ и диуретики. На фоне приема дигоксина выявлены значительное снижение частоты случаев госпитализации по поводу застойной СН (р < 0,001) и тенденция к снижению смертности.
Экспериментальные исследования, в которых изучались ингибиторы ренина . показали, что они действуют подобно ингибиторам АКФ. Но ингибиторы ренина плохо всасываются из желудочно-кишечного тракта и в настоящее время не находят клинического применения. Блокаторы рецепторов к ангиотензину II (типа АТ1) оказывали благоприятное гемодинамическое и почечное действие, подобно ингибиторам АКФ. Лозартан, антагонист АТ1-рецепторов к ангиотензину II, в исследовании, включавшем 134 больных с застойной СН, при кратковременном применении вызывал повышение уровня ренина и ангиотензина II в плазме. Продолжительная (12 нед) терапия сопровождалась снижением уровня норадреналина. В исследовании, сравнивавшем эффективность лозартана и каптоприла у пациентов старше 65 лет с застойной СН, на фоне приема лозартана отмечена более низкая летальность, чем в группе приема каптоприла.
Исследуются также антагонисты АВП . Селективный антагонист V1-рецепторов вызывает периферическую вазодилатацию и улучшает сердечную функцию у некоторых пациентов с застойной СН. Использование ПНФ ограничено относительной резистентностью к его нитрийуретическому действию. Первые обнадеживающие результаты в лечении гипертензии и застойной СН получены при использовании нейтральных эндопептидазных ингибиторов . увеличивающих содержание ПНФ в плазме.
Патогенез застойной СН у больных после ИМ
СН, вероятно, начинается с гемодинамических расстройств, ведущих к снижению артериального давления, тканевой перфузии и оксигенации. Вазоконстрикторные системы (симпатическая, РАА и АВП) активируются через барорецепторы. Следствием этого являются повышение тонуса артериальных и венозных сосудов, задержка натрия и воды. Происходит компенсаторное увеличение артериального давления, частоты сердечных сокращений и сократимости миокарда, возрастает преднагрузка. Если функция левого желудочка ослабевает, то происходит увеличение конечно-диастолических давления и объема. Теоретически эти адаптивные меры должны способствовать поддержанию циркуляции и тканевой перфузии. Однако когда сократимость миокарда резко снижается, увеличение преднагрузки и постнагрузки вызывает дальнейшее уменьшение сердечного выброса. Уменьшение перфузии почек вследствие малого сердечного выброса ведет к высвобождению ренина, содействующего синтезу ангиотензина II, который увеличивает вазоконстрикцию и стимулирует высвобождение альдостерона. Повышенный уровень альдостерона приводит к задержке натрия и воды, увеличению объема циркулирующей крови, накоплению жидкости и образованию отеков. В результате увеличения притока крови к декомпенсированному сердцу появляется застой крови в малом и большом круге кровообращения. Эти гемодинамические нарушения обусловливают дальнейшую нейрогормональную активацию. В конечном итоге происходит дополнительное снижение сердечного выброса, которое замыкает порочный круг нарушений. Следовательно, гемодинамические и нейрогуморальные нарушения потенцируют друг друга и ускоряют прогрессирование заболевания.
Таким образом, профилактика развития застойной СН в отдаленном периоде должна начинаться в первые часы острого ИМ. Следует использовать препараты, ограничивающие зону некроза (тромболитические средства, нитраты, b-блокаторы), а в последующие дни – препараты, уменьшающие нагрузку на миокард и устраняющие избыточную активацию нейрогормональной системы.
Литература (частично):
1. Зербино Д.Д. Кияк Ю.Г. Роль микроциркуляторных изменений в сократительной недостаточности непораженных отделов миокарда в остром периоде инфаркта миокарда. // Кардиология. – 1977. – № 8. – С. 123–127.
2. Кириченко А.А. Выживаемость больных ишемической болезнью сердца при терапевтическом лечении. // Кровообращение. – 1986. – № 3. – С. 6–8.
3. Князев М.Д, Аслибекян И.С, Кириченко А.А. и др. Клиническое течение и диагностика при атеросклеротическом поражении основного ствола левой коронарной артерии. // Клиническая медицина. – 1980. – № 6. – С. 22–27.
4. Меерсон Ф.З. Адаптация к большой нагрузке и сердечная недостаточность. Москва, 1975.
5. Парин В.В. Меерсон Ф.З. Очерки клинической физиологии и кровообращения. М. 1965.
6. Сычева И.М. Виноградов Хроническая недостаточность кровообращения. М. 1977.
7. Abraham W. New neurohormonal antagonists and atrial natriuretic peptide in the treatment of congestive heart failure. Coron Artery Dis 1994;5:127–36.
8. Anguenot T, Bassand JP, Bernard Y. Le remodelage ventriculaire ganche apres infarctus myocardique. Arch Mal Coeur Vaiss 1992; 85 (Suppl):781-787.
9. Anversa P,Beghi C, Kikkawa Y, et al. Myocardial infarction in rats: infarct size, myocite hypertrofy, and capillary growth. Circ Res 1986;58:26-37.
10. Benedict C, Weiner D, Johnstone D, et al. Comparative neurohormonal responses in patiets with preserved and impaired left ventricular ejection fraction: Results of the Studies of Left Ventricular Dysfunction (SOLVD) registry. J Am Coll Cardiol 1993;22 (suppl):146-153.
11. Benedict C. Neurohormonal aspects of heart failure. Cardiol Clin 1994;12:9-23.
12. Benjamin IJ, Jalil JE, Tan LB, et al. Isoproterenol-induced myocardial fibrosis in relation to myocyte necrosis. Circ Res 1989; 65: 657-670.
13. Bristow M, Hershberger R, Port J, et al. b-adrenergic pathways in nonfailing and failing human ventricular myocardium. Circulation 1990; 82 (suppl 1):12-25.
14. Bristow M. Pathophysiologic and pharmacologic rationales for clinical management of chronic heart failure with beta-blocking agents. Am J Cardiol 1993;71 (suppl):12-22.
15. Bristow M, O’Connell J, Gilbert E, et al. Dose-response of chronic b-blocker treatment in heart failure from either idiopathic dilated or ischemic cardiomyopathy. Circulation 1994; 89: 1632-1642.
16. Carter-Grinstead W, Yong JB. The myocardial renin-angiotensin system: existence, impotence, and clinical implications. Am Heart J 1992; 123: 1039-1045.
17. Cavero P, Miller W, Heublain D, et al. Endotelin in experimental congestive heart failure in anesthetized dog. Am J Physiol 1990; 259 (suppl): 312-317.
Полный список литературы можно запросить у автора
Первая помощь, оказываемая при сердечном приступе, признаки и лечение
Сердце
 Сердечные приступы (инфаркты миокарда) опасны для жизни. Первая неотложная помощь предполагает следующие действия. Если вы испытываете боль в груди или другие симптомы сердечного приступа, не откладывайте, звоните, вызывайте врача. Сядьте и подождите, пока приедет скорая; не пытайтесь добираться до больницы самостоятельно. Врачи неотложки начнут лечение немедленно. Это важно, потому что наибольший ущерб наносится в течение первых двух часов после сердечного приступа. Задержка в вызове помощи при инфаркте может привести к неблагоприятным последствиям и даже смерти.
Сердечные приступы (инфаркты миокарда) опасны для жизни. Первая неотложная помощь предполагает следующие действия. Если вы испытываете боль в груди или другие симптомы сердечного приступа, не откладывайте, звоните, вызывайте врача. Сядьте и подождите, пока приедет скорая; не пытайтесь добираться до больницы самостоятельно. Врачи неотложки начнут лечение немедленно. Это важно, потому что наибольший ущерб наносится в течение первых двух часов после сердечного приступа. Задержка в вызове помощи при инфаркте может привести к неблагоприятным последствиям и даже смерти.
Не пытайтесь диагностировать состояние самостоятельно. Многие заболевания вызывают симптомы. похожие на сердечный приступ. Только 15% пациентов с болью в груди фактически получают сердечный приступ. Поэтому оценка и тестирование должно выполняться сразу же после прибытия в отделение неотложной помощи. Оперативное лечение приступа направлено на уменьшение количества необратимых повреждений тканей, путем возвращения адекватного кровоснабжения сердечной мышце.
Если у вас нет серьезных проблем с кровотечением желудка, перед приездом скорой примите аспирин. Эта первая помощь при сердечном приступе уменьшит вероятность дополнительного сгустка в сосуде. Это спасет вам жизнь.
Перечень характерных признаков сердечного приступа: симптомы
Медицинские эксперты отмечают, что при остром инфаркте организм передает один или более из следующих предупредительных сигналов, признаков сердечного приступа:
- Неприятное ощущение в центре грудной клетки.
- Болят плечи, шея или руки. Боль варьируется от легкой до интенсивной.
- Ощущение тяжести, жжения. Локализуется оно в груди, верхней части, животе, шее, внутри рук и плеч.
- Дискомфорт в грудной клетке сопровождается обмороком, потливостью, тошнотой или одышкой.
- Беспокойство, нервозность и / или холодная кожа.
- Бледность.
- Увеличение или нерегулярный пульс.
- Чувство обреченности.
Приступ проявляется не всеми этими признаками одновременно. Иногда они уходят и возвращаться. Симптомов может и не быть вовсе. Фактический диагноз сердечного приступа должен делать врач. Для этого изучаются результаты исследований:
- Обзор полной истории болезни пациента.
- Медицинский осмотр.
- ЭКГ для определения нарушений, вызванных повреждением сердца.
- Анализ крови, позволяющий обнаружить в ней аномальные уровни определенных ферментов.
Диета и упражнения после инфаркта
Пережив его, вы должны изменить свой рацион, включить в меню больше фруктов, овощей и цельного зерна, уменьшить количество насыщенных жиров и холестерина. Разработка схемы упражнений, в дополнение, поможет избавиться от лишних килограммов. Ваш лечащий врач поможет вам в осуществление этой программы и с правильным питанием. Если вы привыкли к пище с высоким содержанием жиров и в течение многих лет не практиковали регулярные физические упражнения, чтобы адаптироваться к изменениям потребуется время. Тем не менее придерживаться плана очень важно.
Если курите, вы должны немедленно прекратить это дело. Курение удваивает вероятность сердечного приступа.
Какие продукты вредны для сердечно-сосудистой системы и почему
 Если вы сталкиваетесь с выбором между красным мясом (с высоким содержанием насыщенных жиров) и морепродуктами (с холестерином), каким будет правильное решение? Есть 2 основных типа холестерина. «Хороший» холестерин помогает разрушить отложения «плохого», который собирается в артериях и образует бляшки.
Если вы сталкиваетесь с выбором между красным мясом (с высоким содержанием насыщенных жиров) и морепродуктами (с холестерином), каким будет правильное решение? Есть 2 основных типа холестерина. «Хороший» холестерин помогает разрушить отложения «плохого», который собирается в артериях и образует бляшки.
Организм регулирует количество холестерина в крови, но без правильной диеты эффективность этих процессов низкая. Тип жира, содержащегося в пище, определяет, какой эффект это даст на повышение уровня холестерина в крови. Продукты с высоким содержанием насыщенных жиров, красное мясо, пальмоядровое, сливочное масло и другие молочные худшее с точки зрения повышения уровня холестерина.
Яйца, моллюсков и ракообразных следует избегать или употреблять их в пищу в умеренных количествах. Мононенасыщенные жиры, оливковое масло — лучший выбор, потому что они не увеличивают содержание «плохого» холестерина в крови. Уровень «хорошего» холестерина повышается при осуществлении программы реабилитации сердца и отказе от курения.
Программа реабилитации сердца после перенесенного инфаркта поможет вам узнать об изменениях в образе жизни, уменьшающих вероятность второго сердечного приступа. Инструкторы контролируют пациентов, постепенно увеличивая физическую активность. Врач является лучшим источником информации о возможных вариантах лечения и лекарствах для вас.
Ангиопластика и шунтирование: описание операций на сердце до и после перенесенного инфаркта
Ангиопластика умеренно агрессивная процедура, актуальная только при определенных обстоятельствах. Ангиопластика считается альтернативой лекарственных препаратов растворяющих сгустки в сосудах. Процедура проводится 12 часов квалифицированным врачом (интервенционным кардиологом). Доктор вводит гибкую трубку (катетер) в артерию в паху, перемещает устройство через артерии к сердцу, и надувает воздушный шар в области затора. Блокировка снимается и вставляется стент, устройство, предназначенное для сохранения артерии открытой.
Если вы по-прежнему испытываете боль в груди или у вас большие участки ткани сердца, не получившие достаточного количества кислорода, делается шунтирование. Эта операция — чрезвычайно агрессивная процедура, врачи работают непосредственно с сердечной мышцей. Делается она пациентам, у которых блокада не поддается лечению путем ангиопластики или если серьезно пострадали несколько судов. Во время процедуры шунтирования хирург прикрепляет секцию артерии или вены до перекрытого и суженого сосуда. При этом кровь начинает циркулировать в обход блокировки. Тем самым создается альтернативный маршрут для кровотока. Эти артерии или вены берутся из другой части тела, как правило, из ноги. Также от стенки грудной клетки отделяется внутренняя грудная артерия и открытым концом прикрепляется к коронарной ниже блокированной области. Кровь получает новую дорогу и свободно течет к сердечной мышце.
Операция длится от 3 до 6 часов, в течение которых сердце останавливают и охлаждают, его потребность в кислороде становится очень низким. Качают и обеспечивают кислородом кровь за пациента аппараты искусственного сердца / легких.
Восстановление и осложнения после инфаркта миокарда
 Хотя шунтирование является основной операцией, большинство пациентов, когда идут на поправку, сообщают, что они чувствуют себя намного лучше, боль в груди исчезла. Становится легче делать упражнения, задыхаешься не так быстро. Однако время восстановления от 4 до 6 недель, возможно, и больше, в зависимости от общего состояния здоровья.
Хотя шунтирование является основной операцией, большинство пациентов, когда идут на поправку, сообщают, что они чувствуют себя намного лучше, боль в груди исчезла. Становится легче делать упражнения, задыхаешься не так быстро. Однако время восстановления от 4 до 6 недель, возможно, и больше, в зависимости от общего состояния здоровья.
Прежде чем принимать любой тип растительных лекарственных средств проконсультируйтесь с врачом. Препараты, содержащие эфедру, вызывают ангину, сердечный приступ и могут привести к смерти.
Осложнения инфаркта миокарда опасны для жизни, за пациентом наблюдают очень внимательно. Важно заметить любые предупреждающие знаки о неприятности как в больнице, так и после пребывания в ней. Почти все пациенты после сердечного приступа в опасности развития нерегулярного ритма органа (аритмии). Для восстановления нормального ритма сердца используется электронное устройство — дефибриллятор. Воздействие электрического тока также применяют, если ненормальное сердцебиение становится опасным для жизни.
Хроническая сердечная недостаточность
Хроническая сердечная недостаточность происходит, когда большая площадь ткани умирает и сердечная мышца не в состоянии перекачивать кровь адекватно. По этой причине жидкость накапливается в легких и других тканях. Симптомы хронической сердечной недостаточности: одышка и учащенное сердцебиение. Требуются лекарства от застойной сердечной недостаточности.
Прогноз варьируется в зависимости от уровня постоянного повреждения сердечной мышцы и других факторов. Это зависит от того, насколько хорошо функционирует левая сторона сердца, получает ли мышца достаточно кислорода. Также важно, стабильна ли электрическая система, управляющая сердечным ритмом и прогрессия нарастания отложений в артерии. Худший прогноз, если возникли проблемы с нерегулярным сердечным ритмом и / или орган потерял большую часть способности перекачивать кровь.
Процедуры и меры: помощь, реабилитация после инфаркта, диета — профилактика
Решающее значение для эффективности реабилитации имеет тщательный мониторинг в коронарном или отделение интенсивной терапии, особенно в течение первых 24 часов после сердечного приступа. В постели нужно лежать в течение первых 12—24 часов, так как деятельность дает нагрузку на сердце и может поспособствовать его большему повреждению. В течение первых 24 часов допустимо вставать, сидеть на краю кровати. В течение 4—5 дней нужно 3 раза в сутки понемногу ходить.
Через 3 дня после сердечного приступа проводится стресс-тестирование. Во время проверки нужно принимать лекарства, имитирующие эффект воздействия физических упражнений на сердце. Это позволит врачу оценить, насколько хорошо оно функционирует при нагрузках. Исследование зависит от вашего состояния и времени, прошедшего после инфаркта. Эти тесты помогут врачу определить степень повреждения мышцы, насколько хорошо сердце функционирует, испытываете ли вы боль в груди при повышенной активности и сколько вы в состоянии сделать.
Пока вы находитесь в больнице, вы будете на специальной диете. После выписки домой в рамках реабилитационной программы врачи порекомендуют вам изменить режим питания и выполнение физических упражнений. Начинается курс профилактики с диеты на прозрачной жидкости. Далее, нужна специальная сердечная диета: половина калорий получается из сложных углеводов, менее 30% от дневной нормы энергии берется из жиров. Нужно есть продукты с низким содержанием насыщенных жиров, с большим количеством калия, магния и клетчатки (например, фрукты, овощи и цельные зерна), очень мало соли.
После выписки из больницы, назначается ряд препаратов, предназначенных для помощи в восстановлении и предотвращения второго сердечного приступа. В дополнение к другим препаратам потребуются лекарства, помогающие контролировать уровень высокого кровяного давления и холестерина.