Одним з найбільш древніх, і тим не менш, найефективніших способів схуднення є застосування насіння льону.

Початкове положення — стоячи ноги на ширині плечей, гімнастична палиця лежить на лопатках, плечі розправлені.

Якщо ви знаходитесь в пошуках найбільш ефективної дієти для схуднення, рекомендуємо спробувати вам дієту, розроблену медиками з клініки Майо в Мінессоті.
Будь яка подружня пара, що проходить програму ЕКЗ, знає, що дуже важливо не просто завагітніти, але й благополучно виносити малюка.
Дилатаційна кардіоміопатія, причини, симптоми, лікування
Дилатаційна кардіоміопатія виникає тоді, коли відбуваються зміни в м’язах серця. До цього моменту вчені не можуть визначити, які точні причини викликають дане захворювання, але зараз кардиомиопатию лікарі вже можуть відрізнити від інших серцевих захворювань, які викликані патологіями і пороками в серцево-судинній системі. Кардіоміопатія може бути первинною, вторинною, все залежить від того, коли такі зміни в м’язах серця відбулися.
4. Вірусні.
5. Аутоімунні.
Дуже часто до 40% дилатаційна кардіоміопатія — це сімейне захворювання. Також дане захворювання виникає через зловживання алкоголю, тому що етанол, його метаболіти токсично впливають на міокард, при цьому пошкоджується мітохондрій, зменшується синтез білків, утворюються вільні радикали і порушується метаболізм. Токсичними факторами можуть бути тривалі контакти з різними матеріалами для мастила — аерозолі, промислова пил, метали і т.д.
Дилатаційна кардіоміопатія може виникати через нестачу в харчуванні, при дефіциті білка, гіповітамінозі, брак карнітину і дефіциті селену.
Дилатаційна кардіоміопатія може виникати через аутоімунних порушень, проявляється через такі аутоантитіл — антіламініна, антіактіна, антіміозіна у важких ланцюгах, антитіл в мітохондріальної мембрани і т.д.
Негативно на серцеву м’яз впливають ентеровіруси, віруси герпесу, аденовіруси і т.д. Дуже часто результатом вірусу міокардиту може бути дилатаційна кардіоміопатія.
У жінок після пологів також може виникнути дилатаційна кардіоміопатія, яка починає розвиватися у жінки, яка була абсолютно здорова, а в останньому триместрі у неї з’явилися проблеми. Вік ризику розвитку даного захворювання для жінки старше 30 років. У групі ризику знаходяться жінки, у яких вагітність багатоплідна, наявність більше трьох родів, виникнення пізнього токсикозу при вагітності, негроїдна раса.
Найчастіше дуже важко дізнатися справжню причину розвитку дилатаційною кардіоміопатії, вона може розвиватися через вплив екзогенних, ендогенних факторів, у осіб, які генетично схильні до цього захворювання.
Симптоми дилатаційною кардіоміопатії
1. Дане захворювання може розвиватися поступово.
2. Дуже часто відсутні всі скарги.
3. Рідко може загострюватися після пневмонії або ГРВІ.
9. У правому підребер’ї виникає сильний біль.
10. Набрякають ноги.
11. У випадки виникнення проблем з серцебиття, може з’являтися запаморочення.
Дилатаційна кардіоміопатія може виникати повільно і швидко. Якщо вона швидко прогресує, перші симптоми з’являються через 2 роки. При повільному прогресуванні вона може виникнути, коли завгодно.
Лікування дилатаційна кардіоміопатія
Мета лікування відкоригувати всі прояви в серцевої недостатності, порушений ритм, гіперкоагуяцію. Хворим потрібно постійно лежати, якомога менше вживати сіль і рідину.
1. Інгібітори АПФ (периндоприл, еналаприл, каптоприл і т.д.).
2. Діуретики (фуросемід, спіронолактон).
3. Якщо порушується ритм серця використовують адреноблокатори (метопролол, карведилол і т.д.).
4. Рідко з обережністю призначають дігоксин.
5. Пролонговані нітрати, які допоможуть знизити приплив крові, які надходить у правий відділ серця.
6. До радикальних методів лікування дилатаційною кардіоміопатії є трансплантація серця, після пересадки серця виживаність до 90%.
2.Постоянно спостерігатися, потрібна консультація у медиків і генетиків, якщо ви знаєте, що у вас генетична схильність.
3. Активно лікувати вірусні та респіраторні інфекції.
4. Постійно вживати мінерали і вітаміни.
Кардіоміопатія дилатаційна
КАРДІОМІОПАТІЯ ДИЛАТАЦІЙНА
За визначенням ВООЗ (1996), дилатаційна кардіоміопатія характеризується дилатацією і порушенням скоротливості лівого або обох шлуночків.
Епідеміологія. Дилатаційна кардіоміопатія трапляється в більшості країн світу і на сьогодні є основним показанням до трансплантації серця. За даними аналізу, проведеного в Західній Швеції, на частку цього захворювання припадає близько 27% випадків госпіталізації з приводу застійної серцевої недостатності осіб віком від 16 до 65 років. Захворюваність на дилатаційну кардіоміопатію становить 6—7,5 випадка на 100 тис. населення на рік, а поширеність — 13,1—36,5 випадка на 100 тис. населення.
Етіологія. Імовірно, дилатаційна кардіоміопатія є поліетіологічним захворюванням, пов’язаним з кількома чинниками, однак роль жодного з них у його виникненні остаточно не доведено.
У багатьох випадках, однак, причина дилатаційної кардіоміопатії залишається невідомою. У таких випадках її вважають ідіопатичною.
Вірусна інфекція. Останнім часом найпоширенішою є думка про вірусну етіологію дилатаційної кардіоміопатії. Її розглядають як наслідок міокардиту, спричиненого переважно вірусами Коксакі групи В, ECHO і герпесу. На користь цієї гіпотези свідчать:
а) результати перспективних клінічних спостережень, які засвідчують розвиток дилатаційної кардіоміопатії протягом 6 міс — 5 років після перенесеного міокардиту;
б) велика частота виявлення в крові хворих на дилатаційну кардіоміопатію антитіл до кардіотропних вірусів, переважно Коксакі групи В;
в) виявлення ентеровірусної РНК в ендоміокардіальних біоптатах у 12—67% хворих на дилатаційну кардіоміопатію;
г) створення експериментальної моделі дилатаційної кардіоміопатії у тварин як наслідку міокардиту, спричиненого вірусами Коксакі групи В;
Спадкова схильність. Завдяки суцільному цілеспрямованому обстеженню родичів хворих на дилатаційну кардіоміопатію виявлено, що частота сімейних форм цього захворювання становить 20—25%.
Токсичні речовини. Про можливу роль цих чинників свідчить ураження міокарда, за морфологічними і клінічними ознаками ідентичне дилатаційній кардіоміопатії, що описано при тривалому вживанні протипухлинних препаратів, а також надлишковому надходженні в організм кобальту хлориду — стабілізатора піни, який використовують у виготовленні пива («пивне серце»). Дані про підвищення в крові хворих на дилатаційну кардіоміопатію рівня кадмію і міді дають змогу припустити зв’язок цього захворювання з ксенобіотиками.
Аліментарний дефіцит різних речовин. Захворювання, подібне до ідіопа- тичної дилатаційної кардіоміопатії за морфологічним субстратом і клінічною картиною, описане в жителів однієї з китайських провінцій, де вміст у грунті селену зовсім незначний.
Патогенез. Патогенез дилатаційної кардіоміопатії не цілком з’ясований. З урахуванням наявних фактів про її зв’язок з вірусним міокардитом видається ймовірним, що принаймні у 30—40% пацієнтів це захворювання може бути пізньою стадією автоімунної патології, що прогресує. Утворенню нових антигенів у кардіоміоцитах можуть сприяти персистенція в них вірусної РНК та епізоди реінфекції ентеровірусами.
На користь ймовірного автоімунного патогенезу дилатаційної кардіоміопатії може свідчити її відповідність більшості загальноприйнятих критеріїв органоспецифічного автоімунного захворювання. Так, у крові хворих і клінічно здорових членів їхніх родин виявляють циркулюючі автоантитіла, специфічні для цього захворювання й ураженого органа, тобто міокарда. Фіксацію антитіл у міокарді виявляють за допомогою імунофлуоресцентного методу у хворих на дилатаційну кардіоміопатію і тварин з експериментальною моделлю цього захворювання. У розвитку клітинно-опосередкованого імунного ушкодження міокарда при дилатаційній кардіоміопатії можуть брати участь також цитокіни. Про це свідчить отримання експериментальної моделі дилатаційної кардіоміопатії шляхом уведення тварині чинника некрозу пухлин а і збільшення вмісту в крові хворих цього цитокіну, а також інтерлейкіну-1.
Для пояснення прогресивного характеру загибелі кардіоміоцитів у хворих на дилатаційну кардіоміопатію існує припущення про розвиток апоптозу як запрограмованої загибелі клітин міокарда, що не потерпають від нестачі енергії і поживних речовин. Морфологічні ознаки цього процесу виявлені у вилучених під час трансплантації серцях таких хворих, а також у міокарді собак з експериментальною моделлю дилатаційної кардіоміопатії, зумовленою частою і тривалою електричною стимуляцією шлуночків.
Патологічна анатомія. Під час макроскопічного дослідження серця хворих на дилатаційну кардіоміопатію виявляють значне збільшення їхньої маси і виражену дилатацію всіх порожнин, особливо лівого шлуночка. Міокард блідого забарвлення, в’ялий. Товщина стінок шлуночків і міжшлуночкової перегородки майже не змінена. Досить показовим є також зміна форми серця, що наближається до кулястого. Виражена дилатація шлуночків призводить до розтягання кілець мітрального і тристулкового клапанів з виникненням їх відносної недостатності. Тривала регургітація крові може зумовлювати вторинне локальне стовщення однієї або більше стулок клапанів унаслідок розвитку фіброзних змін і набряку. Часто спостерігають пристінковий тромбоз, що є основним джерелом тромбоемболії у великому і малому колі кровообігу. Здебільшого тромби локалізуються в шлуночках, переважно у лівому.
У міокарді лівого і (рідше) правого шлуночків визначають велику кількість білуватих рубчиків, переважно дрібновогнищевих, розміщених інтрамураль- но або субендокардіально, що місцями зливаються в масивніші рубці.
Вінцеві артерії серця істотно не змінені.
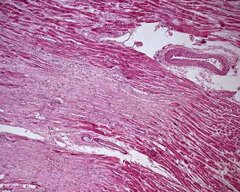
Гістологічні зміни міокарда при дилатаційній кардіоміопатії неспецифічні. Найчастіше відзначають дистрофічні зміни кардіоміоцитів різного ступеня, аж до некробіозу і некрозу. Характерні поліморфізм і аморфність ядер клітин скоротливого міокарда й індукція утворення в них ядерцевого апарату. Не змінені за площею й об’ємом, гіпертрофовані клітини скоротливого міокарда оточені численними атрофованими кардіоміоцитами.
Розпізнавальною рисою атрофії при дилатаційній кардіоміопатії є поширення суцільними вогнищами і виявлення її у різних відділах міокарда, тоді як при патології міокарда коронарогенного походження вогнища атрофії розміщуються мозаїчно, а при гострому міокардиті їх практично не виявляють.
Характерне збільшення сполучнотканинного компонента за рахунок інтер- стиційного фіброзу і замісного склерозу різного ступеня зрілості, що вказує на етапність загибелі кардіоміоцитів.
Під час ультраструктурного дослідження міокарда відзначають зниження об’ємної щільності міофібрил і показника співвідношення кількості міто- хондрій і міофібрил у полі зору. Досить характерна кальцифікація матриксу мітохондрій, що при дилатаційній кардіоміопатії, на відміну від захворювань серця іншої етіології, займає всю площу органел і має дифузний характер.
Таким чином, критеріями для встановлення діагнозу дилатаційної кардіоміопатії під час патологоанатомічного дослідження є наявність дилатації обох шлуночків і збільшення маси серця за відсутності даних, що свідчать про наявність ІХС, вад серця та іншої патології серцево-судинної системи. Діагноз уточнюють після мікроскопічного дослідження. При цьому його встановлюють з урахуванням особливостей морфологічних проявів захворювання і відсутності чітко патогномонічних ознак лише після виключення інших причин дистрофії і гіпертрофії кардіоміоцитів передусім специфічної кардіоміопатії.
Клінічна картина. Дилатаційна кардіоміопатія може розвиватися в будь- якому віці, однак найчастіше хворіють чоловіки віком 30—45 років — 60,7% усіх випадків з цим діагнозом.
Клінічна картина дилатаційної кардіоміопатії неспецифічна. У більшості випадків захворювання починається поступово без видимої причини, рідше — підгостро, зазвичай після гострої респіраторної інфекції (у 20%) або пневмонії (6,3% випадків), що відповідає уявленню про можливий зв’язок дилатаційної кардіоміопатії з вірусним міокардитом.
Першими клінічними проявами дилатаційної кардіоміопатії, як правило, є симптоми застійної серцевої недостатності, яка від початку часто має бівентрикулярний характер, що пов’язано з дифузним ураженням міокарда. Найчастіше хворі скаржаться на задишку під час фізичного навантаження й у стані спокою, загальну слабкість і швидку втомлюваність, прискорене серцебиття, периферійні набряки, тяжкість у правому підребер’ї і надчеревній ділянці. Рідше спостерігають неінтенсивну і нетривалу кардіалгію.
Значно рідше відзначають «безпричинне» виникнення порушень ритму і тромбоемболії. Як доклінічні прояви дилатаційної кардіоміопатії описані також систолічний шум відносної недостатності мітрального клапана, ритм галопу і порушення реполяризації на ЕКГ. Ці зміни зазвичай виявляють випадково, і протягом кількох років вони можуть бути єдиним проявом дилатаційної кардіоміопатії, яку до розвитку симптомів застійної серцевої недостатності майже не діагностують.
Основні клінічні прояви захворювання при фізикальному обстеженні включають ознаки застійної серцевої недостатності, кардіомегалію, ритм галопу, порушення серцевого ритму, провідності і тромбоемболії.
Особливостями серцевої недостатності при дилатаційній кардіоміопатії є швидке прогресування з розвитком різко вираженого розладу кровообігу (ІІБ—III стадії) протягом 2—5 років і рідкість виникнення гострої декомпенсації, що виявляється нападами серцевої астми і набряку легень.
До найважливіших і постійних діагностичних ознак дилатаційної кардіоміопатії відносять кардіомегалію зі збільшенням розмірів усіх порожнин серця.
Дані аускультації серця при дилатаційній кардіоміопатії неспецифічні. Відзначають ритм галопу (III або IV тон). Часто вислуховують систолічний шум відносної мітральної недостатності, що здебільшого супроводжується добре помітним шумом недостатності тристулкового клапана. Може визначатися також незвучний мезодіастолічний шум над верхівкою серця, зумовлений відносним стенозом мітрального отвору внаслідок різкої дилатації лівого шлуночка, рідше — ослаблення І тону і посилення II тону над легеневою артерією.
Різні порушення серцевого ритму, за даними холтерівського монітору- вання ЕКГ, реєструють практично у 100% випадків дилатаційної кардіоміопатії. Серед них перше місце за частотою посідають шлуночкові аритмії, у тому числі пароксизми шлуночкової тахікардії. Незважаючи на значні порушення кардіогемодинаміки, частота миготливої аритмії у хворих на дилатаційну кардіоміопатію порівняно з пацієнтами, в яких виявлено інші серцево-судинні захворювання, відносно невелика і становить близько 25—40%.
Із порушень провідності для дилатаційної кардіоміопатії найхарактерніша блокада лівої ніжки передсердно-шлуночкового пучка або її передньо-верхньої гілки (30—50%). Блокада правої ніжки передсердно-шлуночкового пучка спостерігається вкрай рідко, і частіше — неповна.
Не такими частими, як порушення серцевого ритму, однак досить поширеними ускладненнями дилатаційної кардіоміопатії є тромбоемболії. Найчастішою локалізацією тромбоемболії є система легеневої артерії, потім — артерій кінцівок, головного мозку і нирок.
Діагностика дилатаційної кардіоміопатії ґрунтується на зіставленні клінічних даних з результатами інструментальних методів дослідження із застосуванням неінвазивних методик — електрокардіографії, рентгенографії органів грудної клітки і ехокардіографії. У нез’ясованих випадках можна використовувати інвазивні методи дослідження — ангіокардіографію та ендо-міокардіальну біопсію.
На ЕКГ крім порушень ритму виявляють неспецифічні порушення репо- ляризації (у 81,3%). Вони характеризуються стабільністю при дослідженні в динаміці й зумовлені дистрофічними змінами в міокарді і кардіосклерозом.
Часто реєструють також ознаки гіпертрофії шлуночків, переважно лівого (у 63,7%), рідше — обох (у 13,2%). У 5—20% хворих на дилатаційну кардіоміопатію виявляють патологічні зубці Q унаслідок дифузного або вогнищевого кардіосклерозу.
Рентгенологічне дослідження в усіх випадках визначає збільшення розмірів серця, ступінь якого варіює від відносно невеликої до різко вираженої, за типом бичачого серця. Унаслідок переважної міогенної дилатації шлуночків, більше лівого, тінь серця набуває кулястої форми (мал. 20). Однак у разі значного збільшення лівого передсердя серце може набувати мітральної конфігурації. Характерна невідповідність між значною кардіомегалією і менше вираженими застійними змінами в легенях.
Ехокардіографія є найважливішим методом діагностики дилатаційної кардіоміопатії. У всіх хворих спостерігають дилатацію порожнин серця, незмінену або незначно збільшену товщину стінок і порушення систолічного спорожнення.
Під час кількісного аналізу функціонального стану лівого шлуночка виявляють значне збільшення його кінцево-діастолічного і кінцево-систолічного поперечного розміру й об’єму, а також зниження фракції викиду.
Під час сцинтиграфії міокарда з використанням 201 Т1 при дилатаційній кардіоміопатії виявляють дрібні, мозаїчно розміщені фокуси порушення захоплення ізотопу, що локалізуються у вогнищах інтерстиційного фіброзу і замісного склерозу. На відміну від ІХС при цьому характернішим є не повне, а часткове порушення захоплення ізотопу, що в типових випадках має оборотний характер і займає менш як 20% обводу лівого шлуночка.
Під час катетеризації порожнин серця і великих судин у хворих на дилатаційну кардіоміопатію спостерігають істотне підвищення кінцевого діастоліч- ного тиску в лівому шлуночку, систолічного і діастолічного тиску в легеневій артерії, середнього тиску в легеневих капілярах і лівому передсерді. У значній кількості випадків визначають підвищення тиску наповнення правого шлуночка і середнього тиску в правому передсерді, що свідчить про наявність правошлуночкової недостатності, досить характерної для дилатаційної кардіоміопатії.
Диференціальна діагностика. Останніми роками спостерігають тенденцію до гіпердіагностики ідіопатичної дилатаційної кардіоміопатії через недостатньо активний пошук інших відомих причин ураження міокарда, що супро воджується кардіомегалією і систолічною серцевою недостатністю.
Це зумовлює актуальність проведення її диференціальної діагностики із багатьма захворюваннями з подібними проявами, насамперед хронічною ІХС з вираженою застійною серцевою недостатністю (так званою ішемічною кардіомі- опатією), тяжким міокардитом, первинною мітральною недостатністю ревматичної і неревматичної етіології і стенозом устя аорти. Необхідно також пам’ятати про певну подібність клінічних проявів ідіопатичної дилатаційної кардіоміопатії і більш рідкісної патології — ексудативного перикардиту, специфічної кардіоміопатії при амілоїдозі, гемохроматозі і сарко’їдозі та інших формах ідіопатичної кардіоміопатії.
Ішемічна кардіоміопатія. До її класичних диференціально-діагностичних ознак відносять етапність розвитку ліво- і правошлуночкової недостатності, наявність ангінозного болю, перенесений інфаркт міокарда в анамнезі й ознаки великовогнищевого ураження міокарда на електрокардіограмі, а також наявність чинників ризику ІХС (висока артеріальна гіпертензія, цукровий діабет, гіпер(дис)ліпопротеїдемія й обтяжена спадковість).
Диференціально-діагностичне значення може мати стрес-ехокардіографічна проба з добутаміном. Уведення максимальної дози добутаміну хворим на ІХС зумовлює погіршення регіонарної скоротливості шести й більше сегментів лівого шлуночка, тоді як у хворих на ідіопатичну дилатаційну кардіоміопатію скоротливість більшості сегментів під час проведення такої проби поліпшується.
Незважаючи на вдосконалювання неінвазійних методів диференціальної діагностики ідіопатичної та ішемічної дилатаційної кардіоміопатії, їх точність значно поступається коронарографії, що залишається золотим стандартом у розпізнаванні цих захворювань.
Для тяжкого міокардиту характерні гострий розвиток або посилення серцевої недостатності у зв’язку з інфекцією, вакцинацією, вживанням ліків, тоді як у більшості хворих на дилатаційну кардіоміопатію захворювання розвивається поступово. На користь міокардиту свідчать прояви алергії і сенсибілізації у вигляді поліартралгії, лімфаденопатії, гепатолієнального синдрому, еозинофілії, базофілії, а також супутній перикардит і запальний характер зрушення у формулі крові. Показовими є також минущі зміни кінцевої частини шлуночкового комплексу на ЕКГ і позитивна динаміка симптомів серцевої недостатності і даних ехокардіографії під впливом протизапального лікування, що включає глюкокортикостероїди.
Мітральна недостатність ревматичної і неревматичної етіології. На користь первинного ураження мітрального клапана свідчать етапність у розвитку серцевої недостатності, рідкість виникнення тромбоемболії, що розвивається, як правило, тільки за наявності миготливої аритмії, і значна інтенсивність систолічного шуму, що зростає зі зменшенням вираженості застійної серцевої недостатності під впливом лікування. Збереження синусового ритму у хворого з кардіомегалією і бівентрикулярною серцевою недостатністю — переконливий аргумент на користь ідіопатичної кардіоміопатії. При первинній мітральній недостатності в цій стадії розвитку захворювання практично в 100% випадків спостерігають миготливу аритмію.
Під час рентгенологічного дослідження у хворих на дилатаційну кардіоміопатію визначають кулясту форму тіні серця, тоді як для первинної мітраль- ної недостатності характерні мітральна форма і виражені ознаки змішаної легеневої гіпертензії.
Підтвердити діагноз ревматичної мітральної вади при ехокардіографії дає змогу виявлення ознак фіброзу клапана. У пацієнтів з мітральною недостатністю неревматичної етіології часто визначають пролапс стулок клапана або розрив хорди.
При стенозі устя аорти ревматичного або неспецифічного дегенеративного походження, на відміну від ідіопатичної дилатаційної кардіоміопатії, типовими є скарги на ангінозний біль і знепритомнення, а також послідовний розвиток спочатку ліво-, а згодом — правошлуночкової недостатності. Під час аускультації порівнювані захворювання відрізняються за формою, епіцентром і проведенням систолічного шуму і характером II тону над аортою. Важливу інформацію дає допплєроехокардіографія, під час якої визначають грубий фіброз аортального клапана, звуження його отвору і градієнт систолічного тиску, а також виражену гіпертрофію лівого шлуночка. У нез’ясованих випадках діагноз вади підтверджує катетеризація серця.
Ексудативний перикардит. Кардіомегалія та ознаки застою крові у великому й малому колі кровообігу характерні і для дилатаційної кардіоміопатії, і для хронічного ексудативного перикардиту. Уточнити діагноз допомагає ехокардіографія, що дає змогу виявити характерне для ексудативного перикардиту скупчення рідини в порожнині перикарда при відсутності дилатації порожнин шлуночків і їх незміненій скоротливій здатності.
У цілому діагноз ідіопатичної дилатаційної кардіоміопатії встановлюють за наявності симптомів і ознак стійкої застійної серцевої недостатності, що розвивалася поступово, без видимої причини, або після респіраторної вірусної інфекції, що від початку зазвичай має бівентрикулярний характер і супроводжується кардіомегалією. Ехокардіографія виявляє дилатацію порожнин серця, переважно лівого шлуночка, його дифузну гіпокінезію при незміненій товщині стінок. Обов’язковою умовою є виключення відомих причин серцевої недостатності, насамперед ІХС, специфічних кардіоміопатій і вад серця.
Клінічна картина ідіопатичної дилатаційної кардіоміопатії характеризується значною варіабельністю. Тривалі спостереження засвідчують, що у 35% пацієнтів з цим захворюванням можна досягти відносно стійкої клінічної стабілізації й у 6% — поліпшення функціонального стану на один ФК і підвищення фракції викиду лівого шлуночка більш як на 10%. Кількість хворих на дилатаційну кардіоміопатію із 5-річним виживанням становить 45-75%, а з 10-річним — 20—35%.
Виживання хворих на дилатаційну кардіоміопатію з вираженою застійною серцевою недостатністю III—IV ФК у цілому вища, ніж у порівнюваних за віком, статтю і ФК серцевої недостатності хворих на ішемічну кардіоміопатію.
Основною причиною смерті хворих на дилатаційну кардіоміопатію є рефрактерна застійна серцева недостатність. Випадки раптової смерті на тлі більш- менш вираженої декомпенсації серцевої недостатності становлять 30—50% летальних наслідків.
Оскільки етіологія ідіопатичної дилатаційної кардіоміопатії не встановлена, її лікування симптоматичне й ґрунтується на корекції і профілактиці основних клінічних проявів і ускладнень — застійної серцевої недостатності, порушень ритму і тромбоемболії.
Лікування застійної серцевої недостатності (див. також «Хронічна серцева недостатність»). Загальні заходи включають усунення чинників, здатних збільшувати дисфункцію міокарда (алкоголь, нікотин, вагітність, кардіодеп- ресивні препарати).
З урахуванням основних патогенетичних механізмів серцевої недостатності (зниження скоротливої здатності міокарда і зменшення маси життєздатних кардіоміоцитів) призначають медикаментозне лікування: сечогінні засоби, периферійні вазодилататори, насамперед інгібітори АПФ, і кардіотонічні препарати. Особливе місце в терапії таких хворих посідають Р-адреноблокатори.
Сечогінні препарати сприяють усуненню симптомів перевантаження об’ємом, у тому числі ортопное, однак можуть призводити до зниження ударного викиду шлуночків серця і рефлекторної стимуляції активності ренін-ангіотензинової і симпатико-адреналової систем, збільшення затримки Na + і води. З огляду на це сечогінні препарати призначають у поєднанні з інгібіторами АПФ. Потрібно використовувати найефективніші дози, починаючи лікування за відносно невеликої вираженості об’ємного перевантаження з тіазидних похідних — гідрохлортіазиду в дозі 25—50 мг на добу. За недостатньої ефективності цього препарату призначають сильніші петльові діуретичні засоби — фу- росемід (по 20—40 мг і більше 1 раз на добу, максимальна доза 240 мг за два рази) і торасемід (по 5—20 мг 1—2 рази на добу; максимальна доза 200 мг). Показано призначення антагоніста альдостерону спіронолактону (по 25 мг 1—2 рази на добу). У разі розвитку резистентності, що часто відзначають у хворих на дилатаційну кардіоміопатію, використовують принцип послідовної блокади реабсорбції Na + і води шляхом комбінації препаратів трьох груп, вдаються до тривалої внутрішньовенної інфузії діуретичних доз допаміну (1—5 мкг/кг за 1 хв) і ультрафільтрації плазми.
Серед периферійних вазодилататорів центральне місце посідають інгібітори АПФ, що зумовлено їхньою здатністю поєднувати артеріоло- і венодилатаційну дію з усуненням інших несприятливих ефектів ангіотензину II, зокрема проліферативного, що спричинює необоротне ремоделювання серця і судин. Важливе значення в механізмі дії цих препаратів має також зниження активності симпатико-адреналової системи.
Інгібітори АПФ вважають препаратами І ряду при лікуванні застійної серцевої недостатності у хворих на дилатаційну кардіоміопатію. У безсимптомних випадках їх застосовують як монотерапію, а при розвитку симптомів поєднують із сечогінними засобами. Лікування рекомендують починати зі стартової дози, що для каптоприлу становить 6,25 мг, а для еналаприлу — 2,5 мг, поступово збільшуючи їх до цільових доз, ефект яких щодо виживаності доведений у багатоцентрових дослідженнях (для каптоприлу 50 мг 3 рази на добу і для еналаприлу 10 мг 2 рази на добу).
Крім каптоприлу й еналаприлу, у контрольованих дослідженнях доведена також ефективність при серцевій недостатності лізиноприлу (початкова доза 2,5 мг, цільова доза 20 мг 1 раз на добу), раміприлу (2,5—5 мг 2 рази на добу) і трандалаприлу (по 4 мг 1 раз на добу).
У разі непереносимості інгібіторів АПФ слід призначити блокатори рецепторів ангіотензину II, що внаслідок вищої специфічності впливу на систему ангіотензину II дають менше побічних ефектів. Великі контрольовані дослідження засвідчують їхню ефективність у високих дозах. При застійній серцевій недостатності доведено ефективність двох препаратів цієї групи — кандесартану і валсартану. Стартова доза кандесартану — 4—8 мг 1 раз на добу, цільова доза — 32 мг 1 раз на добу. Стартова доза валсартану — 40 мг 2 рази на добу, цільова — 160 мг 2 рази на добу.
Великі дослідження довели здатність кардіоселективних $-адреноблокаторів бісопрололу і метопрололу, а також некардіоселективного з додатковими властивостями а,-адреноблокатора, антиоксиданту й антипроліферативного засобу карведилолу поліпшувати прогноз хворих із хронічною серцевою недостатністю.
Сприятливий вплив Р-адреноблокаторів на прогноз у хворих з дилатаційною кардіоміопатією значно вираженіший, ніж у разі коронарогенного походження застійної серцевої недостатності. Включення p-адреноблокаторів у лікування хворих на дилатаційну кардіоміопатію показано практично за будь-якого ступеня вираженості застійної серцевої недостатності, крім украй тяжкого, після досягнення стабілізації за допомогою загальноприйнятої терапії інгібіторами АПФ і сечогінними препаратами. Уживання цих препаратів починають з малих стартових доз, що зазвичай відповідають 1/8 терапевтичних доз: для метопрололу CR/XL по 12,5 мг 1 раз на добу, карведилолу — по 3,125 мг 2 рази на добу, бісопрололу — по 1,25 мг 1 раз на добу з подальшим обережним і поступовим, не частіше ніж 1 раз на тиждень, підвищенням доз до цільових, що становлять для метопрололу CR/XL 50 мг 3 рази на добу, бісопрололу 10 мг 1 раз на добу і карведилолу — 25 мг 2 рази на добу.
Серцевий глікозид дигоксин, безумовно, ефективний лише за наявності супутньої миготливої аритмії. Додавання дигоксину до лікування сечогінними препаратами й інгібіторами АПФ сприяє зменшенню сумарної кількості летальних наслідків і частоти госпіталізацій, пов’язаних з наростанням серцевої недостатності. Вважають, що такий сприятливий ефект дигоксину значною мірою зумовлений його здатністю зменшувати гіперактивацію симпатико-адреналової системи. Препарат призначають у малих дозах — по 0,125— 0,250 мг на добу, що зумовлює зменшення вмісту норадреналіну в крові без істотних змін ЧСС, показників кардіогемодинаміки в стані спокою і фізичного навантаження.
Для підвищення інотропізму міокарда у хворих з різко вираженою застійною серцевою недостатністю на додаток до загальноприйнятої терапії доцільно призначати короткі курси внутрішньовенної інфузії стимулятора Р,-адренорецепторів добутаміну та інші неглікозидні інотропні засоби. Ці речовини справляють значно могутнішу, ніж серцеві глікозиди, кардіотонічну дію, що поєднується з периферійною вазодилатацією — прямою (левосимендан) або рефлекторною — унаслідок зменшення активності симпатико-адреналової системи (добутамін). З огляду на останній ефект, препарати не можна застосовувати при вираженій артеріальній гіпотензії. Щоб уникнути тахікардії і шлуночкових аритмій, добутамін призначають у відносно малих дозах — по 2—5 мкг/кг за 1 хв.
Левосимендан справляє позитивну інотропну і системну вазодилатацій- ну дію. Його можна призначати хворим з малим серцевим викидом і низьким систолічним артеріальним тиском. Лікування левосименданом розпочинають із внутрішньовенного введення болюсом 12—24 мг/кг протягом 10 хв, після чого переходять на інфузію 0,05—0,2 мкг/кг протягом 24 год.
Лікування порушень серцевого ритму і запобігання раптовій смерті. До призначення антиаритмічних засобів при дилатаційній кардіоміопатії необхідно ставитися обережно у зв’язку з можливістю кардіодепресивної проаритмічної дії більшості з них. Лікування слід починати із застосування (і-адрено-блокаторів, у разі їх неефективності або поганої переносимості перевагу віддають аміодарону. Ефективний щодо більшості суправентрикулярних і шлуночкових аритмій, цей препарат не погіршує скоротливості міокарда і має властивості периферійного вазодилататора.
Абсолютними показаннями до профілактичного застосування аміодарону у хворих на дилатаційну кардіоміопатію є симптоматичні шлуночкові аритмії.
Ризик раптової смерті від аритмії значно підвищений у хворих із симптоматичною шлуночковою тахікардією або фібриляцією шлуночків. Таким пацієнтам рекомендують підбирати антиаритмічну терапію з контролюванням результатів за допомогою електрофізіологічного дослідження, а в разі неефективності — імплантувати кардіовертер-дефібрилятор, що сприяє підвищенню показника виживання.
При лікуванні фібриляції передсердь у хворих на дилатаційну кардіоміопатію слід дотримувати активної тактики, спрямованої на відновлення синусового ритму, крім випадків значної вираженості серцевої недостатності. Показано, що успішна кардіоверсія — лікарська (за допомогою аміодарону, новокаїнаміду або пропафенону) або електрична — сприяє істотному підвищенню фракції викиду лівого шлуночка.
Профілактику тромбоемболії за допомогою антикоагулянтів непрямої дії проводять за загальноприйнятими показниками, що включають випадки фібриляції передсердь і наявність в анамнезі хоча б одного тромбоемболічного епізоду, незалежно від ритму серця. Застосування з цією метою АСК менш ефективне порівняно з антикоагулянтами непрямої дії.
Хірургічні й електрофізіологічні методи лікування. За неефективності медикаментозного лікування хронічної серцевої недостатності у хворих на дилатаційну кардіоміопатію можна використовувати хірургічні, механічні й електрофізіологічні методи лікування.
Операція трансплантації серця є засобом вибору в лікуванні хворих із серцевою недостатністю унаслідок дилатаційної кардіоміопатії, що не піддається терапевтичному впливу. При сучасній імуносупресивній терапії п’ятирічне виживання таких хворих сягає 80%, причому понад 65% з них через рік після операції повертаються до праці.
З моменту першого пересадження серця, проведеного в грудні 1967 р. К. Барнардом у США, накопичено й узагальнено досвід 52 195 таких операцій. Десятирічне виживання хворих з пересадженим серцем становить 70%, що набагато вище, ніж виживання пацієнтів, яких лікували лікарськими препаратами.
Головними обмеженнями до ефективного використання цього методу є: відсутність достатньої кількості донорських сердець, проблема відторгнення пересадженого органа і хвороба вінцевих артерій пересадженого серця.
Показаннями до пересадження серця є різко виражена серцева недостатність і несприятливий найближчий прогноз за умови емоційної стійкості хворого і його здатності до співробітництва з лікарем, а також за відсутності медичних протипоказань.
Пересадження серця протипоказане при:
• зловживанні алкоголем або наркотиками (на сьогодні);
• відсутності належного розуміння з боку хворого;
• хронічних психічних захворюваннях, які неможливо належним образом контролювати;
• лікованому злоякісному новоутворенні в стані ремісії менш як 5 років;
• системних захворюваннях з ураженням багатьох органів;
• неконтрольованих інфекціях;
• нирковій недостатності в разі кліренсу креатиніну менш як 50 мл/хв;
• стійкому судинному опору в малому колі кровообігу (6—8 одиниць за Буду, середній транслегеневий градієнт тиску понад 15 мм рт. ст. систолічний тиск у легеневій артерії понад 60 мм рт. ст.);
• нещодавно перенесеному тромбоемболічному ускладненні;
• незагойній пептичній виразці;
• значних порушеннях функції печінки;
• наявності захворювання з несприятливим прогнозом.
Головною альтернативою трансплантації серця нині може бути використання апаратів штучного кровообігу, що отримали назву «обхідний лівий шлуночок». Нині доведено, що встановлення допоміжного лівого шлуночка поліпшує прогноз хворих із хронічною серцевою недостатністю і через кілька місяців забезпечує часткове відновлення функції власного серця, що дало змогу розглядати цей метод лікування не як «міст до пересадження», а як «міст до одужання». Згідно з даними контрольованих досліджень, застосування штучного лівого шлуночка знижує ризик смерті хворих із хронічною серцевою недостатністю на 48 %, а частота ускладнень у вигляді кровотечі або неврологічних ускладнень невисока (відповідно 0,56 і 0,35%).
Ефективність інших хірургічних методів лікування серцевої недостатності не підтверджена спеціальними дослідженнями (операція Батисти), що обмежує можливості їх широкого використання.
Механічні методи лікування серцевої недостатності зводяться до застосування зовнішньої еластичної сітки (сітки Апсог), що являє собою мішок, сплетений з багатошарових ниток, для механічного обмеження дилатації серця. Сітку пришивають уздовж атріовентрикулярної борозни до лівого шлуночка між основними вінцевими артеріями. Еластичні нитки, з яких сплетена сітка, сильніше розтягуються в поздовжньому, ніж у поперечному напрямку, що дає змогу не лише обмежити дилатацію лівого шлуночка, а й зберегти його еліптичність. Нині ефективність і безпека такого методу лікування вивчається.
Активно вивчається можливість використання штучного серця. Нині компанія ABIOMED створює штучне серце АЬіоСог, що являє собою автономну імплантаційну систему для заміни серця, яку повністю розташовують в грудній клітці. Керування пристроєм здійснюється контактним способом через шкіру без порушення її цілості, що дає змогу уникати інфікування. АЬіоСог має дві камери, аналогічні шлуночкам серця. Права камера (насос) постачає кров’ю легені, ліва — через аорту — інші життєво важливі органи. Кожний з насосів здатний перекачати понад 8 л крові за 1 хв. Штучне серце компактне, практично безшумне, а енергію отримує від внутрішньої батареї, що може заряджатися від зовнішнього джерела також без порушення цілості шкіри.
Електрофізіологічні методи лікування хворих із серцевою недостатністю включають:
• встановлення кардіостимулятора з фіксованою або адаптивною частотою стимуляції, що дає змогу ефективніше й безпечніше проводити медикаментозну терапію;
• усунення асинхронії в роботі шлуночків, його досягають трикамерною стимуляцією серця із встановленням оптимального для кожного хворого ат- ріовентрикулярного затримання. Доведено, що ресинхронізація роботи серця сприяє клінічному поліпшенню, уповільненню ремоделювання серця, підвищенню якості життя і зниженню декомпенсації серцевої недостатності.
Прогноз. Прогноз дилатаційної кардіоміопатії визначається переважно ступенем вираженості застійної серцевої недостатності, ризик раптової смерті зростає з її збільшенням. Як і у хворих на ІХС, велику прогнозувальну цінність (89—95%) має відсутність шлуночкових аритмій високих ступенів, що вказує на відносно низький ризик потенційно фатальних аритмій і раптової смерті.
Профілактика. Оскільки етіологія ідіопатичної дилатаційної кардіоміопатії остаточно не з’ясована, специфічної профілактики захворювання не існує.
Згідно з вірусоімунологічною теорією його розвитку, обговорюється питання про вивчення чинників ризику виникнення дилатаційної кардіоміопатії і вакцинації схильних до неї осіб проти кардіотропних вірусів у періоди епідемій, а також активне лікування респіраторних інфекцій за допомогою антивірусних препаратів і рекомбінантного а-інтерферону. За обтяженого сімейного анамнезу доцільно провести медико-генетичне консультування.
Також рекомендуємо переглянути