Лакунарный инсульт
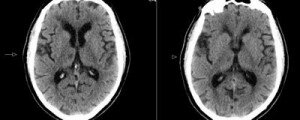
Лакунарным называется ишемический инфаркт головного мозга, ограниченный территорией кровоснабжения одной из малых перфорантных артерий, расположенный в глубинных отделах полушарий и ствола головного мозга. В процессе организации лакунарного инфаркта формируется полость округлой формы, заполненная ликвором — лакуна.
Согласно классификации ТОАST, выделяют 5 патогенетических подтипов ишемического инсульта (ИИ):
атеротромбоэмболический,
кардиоэмболический,
лакунарный (ЛИ),
ИИ установленной редкой этиологии,
ИИ неустановленной этиологии.
Инцидентность ЛИ среди других подтипов ИИ составляет по данным различных авторов от 13% до 37% (в среднем, около 20%) [2; 3; 4; 5]. В 80 % случаев, ЛИ протекает асимптомно.
Для лакунарного патогенетического подтипа ишемического инсульта характерно:
1) клиническая картина ИИ проявляется одним из традиционных «лакунарных» синдромов;
2) данные КТ/МРТ нормальные или имеются субкортикальные/стволовые повреждения диаметром менее 1,5 см;
3) отсутствуют потенциальные источники кардиоэмболии или стеноз ипсилатеральной мозговой артерии более 50%.
Впервые термин «лакуна» употребил невролог Durand-Fardel, который опубликовал в 1843 г. в Париже свой трактат о «размягчении» мозга, основанный на 78 патологоанатомических наблюдениях. Он писал: «В стриатуме с каждой стороны видны маленькие лакуны. поверхности которых связаны с очень маленькими сосудами». Он считал, что данные изменения являются следствием воспалительного процесса головного мозга.
В последующем Virchow высказал предположение, что дебют инфаркта головного мозга связан с изменением в стенке церебральных артерий, а тромбоз артерии связан с атероматозным поражением сосудистой стенки [6]. Он также впервые указал на возможность тромбоза сосуда вследствие атеросклеротического процесса и эмболии.
В 1902 году Ferrand»s опубликовал монографию, в которой были проанализированы данные патологоанатомического исследования 50 пациентов с постмортально верифицированными лакунами [8]. Ferrand»s постулировал, что к каждой лакуне ведет центрально расположенный сосуд, который, однако, ни в одном из наблюдений не был закупорен. Он обнаружил, что просвет перфорантных артерий сужен, а стенки их утолщены, и считал, что данные изменения приводили к прижизненной окклюзии сосуда, которая нивелировалась в процессе танатогенеза. Вторым важным открытием явилось утверждение, что изменение в стенке мелких артерий могут быть не только причиной их окклюзии и развития ишемического инсульта, но и разрыва, и, как следствие, дебюта геморрагического инсульта.
В 1965 году Fisher C.М. доложил о материале 114 патологоанатомических исследований, где были верифицированы 376 церебральных лакун. Автор дал определение ЛИ: «: это маленькие глубинно расположенные в головном мозге ишемические очаги, формирующие непостоянные полости 1-15 мм в диаметре в хронической стадии» [9]. У 6 из 7 пациентов, которым проводился целенаправленный поиск, была обнаружена окклюзия питающей перфорантной артерии, причем в большинстве случаев устье данной артерии не было перекрыто атеромой.
Fisher C.М. считал, что ведущую роль в патогенезе ЛИ играют гипертоническая болезнь и церебральный атеросклероз. Церебральная эмболия, по мнению автора, также могла быть причиной развития ЛИ, но эмбол окклюзирует не собственно перфорантные артерии, а питающие их артерии (средняя мозговая артерия, задняя мозговая артерия), перекрывая кровоток в устье. Такой механизм возникновения лакун был редким. Вопрос о возможности эмболии в пенетрирующие артерии он считал крайне дискутабельным и акцентировал внимание на то, что было недостаточно данных для того, чтобы подтвердить или опровергнуть данное заключение.
На основании проведенного исследования Fisher C.М. сформулировал «лакунарную гипотезу», согласно которой возникновение ЛИ обусловлено окклюзией одной из перфорантных церебральных артерий и, в большинстве случаев, связано с артериальной гипертензией и церебральным атеросклерозом. Он также ввел термины «липогиалиноз» и «микроатерома», для характеристики изменений, происходящих в стенке перфорантных артерий.
В 1997 г были опубликованы данные клинико-патоморфологического исследования, которое провел Lammie G.A. [10]. Он описал 70 препаратов головного мозга с верифицированной микроангиопатией перфорантных артерий. Морфология поражения артерий была одинаковой во всех случаях: концентрическое гиалиновое утолщение стенок малых сосудов с одновременным сужением их просвета (липогиалиноз). Липогиалиноз поражал малые пенетрирующие артерии, характеризовался потерей архитектоники нормальной сосудистой стенки, отложением гиалина под интимой и инфильтрацией пенистыми макрофагами. В 22 случаях (31%) была обнаружена микроангиопатия, однако не было свидетельств о наличии при жизни артериальной гипертензии (АГ). Автор сделал вывод, что изменения в стенке перфорантных артерий у данных пациентов были обусловлены повышенной проницаемостью малых сосудов головного мозга вследствие почечной, печеночной и поджелудочной недостаточности, а также алкоголизма. Больший вклад в возникновение таких поражений вносил отек, а не ишемия.
В исследовании Максимовой М.Ю. также указывается на гетерогенность причин развития лакунарных инсультов. Выделены 2 основных механизма развития ЛИ — микроангиопатия вследствие гипертонической болезни (тяжелые плазморрагии, фибриноидный некроз стенок артерий, облитерирующий гиалиноз и склероз соудистых стенок, образование милиарных аневризм, пристеночных тромбов, кровоизлияний) и пролиферация внутренней оболочки перфорантных артерий на фоне системного атеросклеротического процесса.
Ряд авторов считает, что эшелонированное поражение экстра- интра- краниальных артерий, является одной из самых частых причин развития ЛИ.
Механизмом возникновения ЛИ в этих случаях, является сосудисто-мозговая недостаточность на фоне стено-окклюзирующего процесса брахиоцефальных артерий [11; 13; 14; 15].
В последнее время появляется все больше сообщений о возможности эмболического механизма развития ЛИ. Эмболия в перфорантные артерии возможна из кардиального или артериального источников. Так, по данным Bakshi R. и соавт, при инфекционном эндокардите (ИЭ) в 50% случаев по данным МРТ головного мозга визуализируются лакунарные очаги [16]. К схожим выводам пришли и отечественные исследователи, которые доказали, что при ИЭ в большинстве случаев визуализируются мелкие (до 2 см) ишемические очаги в бассейнах концевых ветвей средних мозговых артерий или лакуны в глубинных отделах полушарий головного мозга [17]. Авторы считают, что такое ишемическое повреждение головного мозга обусловлено небольшими размерами эмболов, представляющих собой фрагменты клапанных вегетаций.
Deborah R с соавт. в 1992 г. опубликовали данные исследования 108 пациентов с лентикулостриарной локализацией ЛИ. Гипертоническая болезнь была верифицирована у 68% пациентов, сахарный диабет — у 37%, одномоментно обе нозологии присутствовали у 28% больных, одномоментно ГБ и СД отсутствовали у 23%. Атеросклеротические бляшки, как возможный источник церебральной эмболии, были диагностированы у 23% пациентов, а 18% имели потенциальные кардиальные источники эмболии. Авторы пришли к выводу, что частая встречаемость эмболических источников у пациентов с ЛИ в условиях отсутствия таких факторов риска, как ГБ или СД, свидетельствуют о существовании механизмов развития ЛИ отличных от микроангиопатии [18].
Целью настоящего исследования было разработка диагностических алгоритмов для верификации различных патогенетических подтипов ЛИ.
Материал и методы:
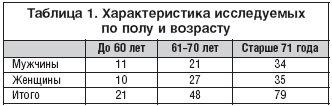
Обследовано 211 больных лакунарным ишемическим инсультом, находившихся на обследовании и лечении в Пироговском Центре в период с 2003 по 2007 гг. Среди обследованных больных было 97 мужчин и 114 женщин в возрасте от 38 до 84 лет, средний возраст составил 61,2+12,2 года.
На основана эмпирических данных литературы больные ЛИ были разделены на три группы: вследствие гипертонической микроангиопатии (группа I) — 99 пациентов; вследствие атеросклеротической микроангиопатии (группа II) — 80 пациентов; с эмболическим генезом ЛИ (группа III) — 32 пациента. В I группу были включены пациенты с ЛИ и длительным анамнезом гипертонической болезни. Во II группу — пациенты с атеросклеротическим поражением церебральных артерий, без ГБ в намнезе. В III группу — больные с потенциальными источниками кардиальной и артерио-артериальной церебральной эмболии. Группы были равнозначны по возрасту, процентному соотношению мужчин и женщин.
У всех больных клиническая картина была представлена одним из лакунарных синдромов. Всем пациентам выполнялось:
Оценка факторов риска;
КТ головного мозга (SIEMENS SOMATOM Sensation 4);
Магнитно-резонансная («Giroscan INTERA NOVA», Голландия) томография головного мозга, в Т1, Т2, Т2 FLAIR и диффузионном режимах;
Трансторакальная или трансэзофагеальная эхокардиография (VIVID 7, General Elektrik, США);
Дуплексное сканирование (VIVID 7, General Elektrik, США) или селективная ангиография (Toshiba, Infinix CS-I, Япония) брахиоцефальных и церебральных артерий;
Транскраниальная допплерография (Companion III) с билатеральной локацией средних мозговых артерий в течение 60 мин и детекцией микроэмболических сигналов;
Лабораторная диагностика биохимических показателей крови (HITACHI 902) и состояния свертывающе-противосвертывающей систем крови (BCT DADE BEHRING);
Оценка тяжести неврологического дефицита по шкале NIHSS;
Оценка функциональных исходов инсультов по шкале Ранкин.
Результаты
Лакунарный инсульт у всех пациентов клинически манифестировал одним из классических лакунарных синдромов. Наиболее часто встречался «чисто двигательный инсульт». В I группе — у 53 пациентов (53, 5%), во II — у 53 пациентов (66,2%), в III — у 20 пациентов (62,5%), причем статистически значимые различия в инцидентности изолированного гемипареза между группами отсутствовали, р>0,05. Синдромы дизартрии с неловкостью руки, сенсорно-моторный инсульт, атактический гемипарез, чисто чувствительный инсульт встречались реже, и, по частоте встречаемости, также не обнаружили статистически значимых различий между группами.
Тяжесть неврологического дефицита в остром периоде инсульта оценивалась по шкале NIHSS. У больных с эмболическим генезом ЛИ в дебюте заболевания отмечались наиболее выраженные неврологические расстройства — 7,1+2,5 балла. По сравнению с III группой, тяжесть инсульта в первые сутки в группах больных с гипертонической и атеросклеротической микроангиопатией была достоверно ниже — 5,8+2,4, р=0,05 и 5,5+2,5, р=0,01, соответственно. Через 21 день после дебюта ЛИ, по сравнению с первым днем заболевания, тяжесть неврологического дефицита в III группе была достоверно ниже и составила 5,0+2,5, р
Лакунарный инсульт
ЛАКУНАРНЫЙ ИНСУЛЬТ: ПАТОГЕНЕТИЧЕСКИЕ ПОДТИПЫ
Виноградов О.И. Кузнецов А.Н.
Национальный центр патологии мозгового кровообращения
Национальный медико-хирургический центр имени Н.И.Пирогова, Москва
Лакунарным называется ишемический инфаркт головного мозга, ограниченный территорией кровоснабжения одной из малых перфорантных артерий, расположенный в глубинных отделах полушарий и ствола головного мозга. В процессе организации лакунарного инфаркта формируется полость округлой формы, заполненная ликвором — лакуна.
Согласно классификации ТОАST, выделяют 5 патогенетических подтипов ишемического инсульта (ИИ): атеротромбоэмболический, кардиоэмболический, лакунарный (ЛИ), ИИ установленной редкой этиологии, ИИ неустановленной этиологии [1]. Инцидентность ЛИ среди других подтипов ИИ составляет по данным различных авторов от 13% до 37% (в среднем, около 20%) [2; 3; 4; 5]. В 80 % случаев, ЛИ протекает асимптомно [6]. Для лакунарного патогенетического подтипа ишемического инсульта характерно: 1) клиническая картина ИИ проявляется одним из традиционных «лакунарных» синдромов; 2) данные КТ/МРТ нормальные или имеются субкортикальные/стволовые повреждения диаметром менее 1,5 см; 3) отсутствуют потенциальные источники кардиоэмболии или стеноз ипсилатеральной мозговой артерии более 50%.
Впервые термин «лакуна» употребил невролог Durand-Fardel, который опубликовал в 1843 г. в Париже свой трактат о «размягчении» мозга, основанный на 78 патологоанатомических наблюдениях. Он писал: «В стриатуме с каждой стороны видны маленькие лакуны. поверхности которых связаны с очень маленькими сосудами» [7]. Он считал, что данные изменения являются следствием воспалительного процесса головного мозга.
В последующем Virchow высказал предположение, что дебют инфаркта головного мозга связан с изменением в стенке церебральных артерий, а тромбоз артерии связан с атероматозным поражением сосудистой стенки [6]. Он также впервые указал на возможность тромбоза сосуда вследствие атеросклеротического процесса и эмболии.
В 1902 году Ferrand»s опубликовал монографию, в которой были проанализированы данные патологоанатомического исследования 50 пациентов с постмортально верифицированными лакунами [8]. Ferrand»s постулировал, что к каждой лакуне ведет центрально расположенный сосуд, который, однако, ни в одном из наблюдений не был закупорен. Он обнаружил, что просвет перфорантных артерий сужен, а стенки их утолщены, и считал, что данные изменения приводили к прижизненной окклюзии сосуда, которая нивелировалась в процессе танатогенеза. Вторым важным открытием явилось утверждение, что изменение в стенке мелких артерий могут быть не только причиной их окклюзии и развития ишемического инсульта, но и разрыва, и, как следствие, дебюта геморрагического инсульта.
В 1965 году Fisher C.М. доложил о материале 114 патологоанатомических исследований, где были верифицированы 376 церебральных лакун. Автор дал определение ЛИ: «: это маленькие глубинно расположенные в головном мозге ишемические очаги, формирующие непостоянные полости 1-15 мм в диаметре в хронической стадии» [9]. У 6 из 7 пациентов, которым проводился целенаправленный поиск, была обнаружена окклюзия питающей перфорантной артерии, причем в большинстве случаев устье данной артерии не было перекрыто атеромой.
Fisher C.М. считал, что ведущую роль в патогенезе ЛИ играют гипертоническая болезнь и церебральный атеросклероз. Церебральная эмболия, по мнению автора, также могла быть причиной развития ЛИ, но эмбол окклюзирует не собственно перфорантные артерии, а питающие их артерии (средняя мозговая артерия, задняя мозговая артерия), перекрывая кровоток в устье. Такой механизм возникновения лакун был редким. Вопрос о возможности эмболии в пенетрирующие артерии он считал крайне дискутабельным и акцентировал внимание на то, что было недостаточно данных для того, чтобы подтвердить или опровергнуть данное заключение.
На основании проведенного исследования Fisher C.М. сформулировал «лакунарную гипотезу», согласно которой возникновение ЛИ обусловлено окклюзией одной из перфорантных церебральных артерий и, в большинстве случаев, связано с артериальной гипертензией и церебральным атеросклерозом. Он также ввел термины «липогиалиноз» и «микроатерома», для характеристики изменений, происходящих в стенке перфорантных артерий.
В 1997 г были опубликованы данные клинико-патоморфологического исследования, которое провел Lammie G.A. [10]. Он описал 70 препаратов головного мозга с верифицированной микроангиопатией перфорантных артерий. Морфология поражения артерий была одинаковой во всех случаях: концентрическое гиалиновое утолщение стенок малых сосудов с одновременным сужением их просвета (липогиалиноз). Липогиалиноз поражал малые пенетрирующие артерии, характеризовался потерей архитектоники нормальной сосудистой стенки, отложением гиалина под интимой и инфильтрацией пенистыми макрофагами. В 22 случаях (31%) была обнаружена микроангиопатия, однако не было свидетельств о наличии при жизни артериальной гипертензии (АГ). Автор сделал вывод, что изменения в стенке перфорантных артерий у данных пациентов были обусловлены повышенной проницаемостью малых сосудов головного мозга вследствие почечной, печеночной и поджелудочной недостаточности, а также алкоголизма. Больший вклад в возникновение таких поражений вносил отек, а не ишемия.
В исследовании Максимовой М.Ю. также указывается на гетерогенность причин развития лакунарных инсультов [19]. Выделены 2 основных механизма развития ЛИ — микроангиопатия вследствие гипертонической болезни (тяжелые плазморрагии, фибриноидный некроз стенок артерий, облитерирующий гиалиноз и склероз соудистых стенок, образование милиарных аневризм, пристеночных тромбов, кровоизлияний) и пролиферация внутренней оболочки перфорантных артерий на фоне системного атеросклеротического процесса.
Ряд авторов считает, что эшелонированное поражение экстра- интра- краниальных артерий, является одной из самых частых причин развития ЛИ [11; 12; 13]. Механизмом возникновения ЛИ в этих случаях, является сосудисто-мозговая недостаточность на фоне стено-окклюзирующего процесса брахиоцефальных артерий [11; 13; 14; 15].
В последнее время появляется все больше сообщений о возможности эмболического механизма развития ЛИ. Эмболия в перфорантные артерии возможна из кардиального или артериального источников. Так, по данным Bakshi R. и соавт, при инфекционном эндокардите (ИЭ) в 50% случаев по данным МРТ головного мозга визуализируются лакунарные очаги [16]. К схожим выводам пришли и отечественные исследователи, которые доказали, что при ИЭ в большинстве случаев визуализируются мелкие (до 2 см) ишемические очаги в бассейнах концевых ветвей средних мозговых артерий или лакуны в глубинных отделах полушарий головного мозга [17]. Авторы считают, что такое ишемическое повреждение головного мозга обусловлено небольшими размерами эмболов, представляющих собой фрагменты клапанных вегетаций.
Deborah R с соавт. в 1992 г. опубликовали данные исследования 108 пациентов с лентикулостриарной локализацией ЛИ. Гипертоническая болезнь была верифицирована у 68% пациентов, сахарный диабет — у 37%, одномоментно обе нозологии присутствовали у 28% больных, одномоментно ГБ и СД отсутствовали у 23%. Атеросклеротические бляшки, как возможный источник церебральной эмболии, были диагностированы у 23% пациентов, а 18% имели потенциальные кардиальные источники эмболии. Авторы пришли к выводу, что частая встречаемость эмболических источников у пациентов с ЛИ в условиях отсутствия таких факторов риска, как ГБ или СД, свидетельствуют о существовании механизмов развития ЛИ отличных от микроангиопатии [18].
Целью настоящего исследования было разработка диагностических алгоритмов для верификации различных патогенетических подтипов ЛИ.
Материал и методы:
Обследовано 211 больных лакунарным ишемическим инсультом, находившихся на обследовании и лечении в Пироговском Центре в период с 2003 по 2007 гг. Среди обследованных больных было 97 мужчин и 114 женщин в возрасте от 38 до 84 лет, средний возраст составил 61,2+12,2 года.
На основана эмпирических данных литературы больные ЛИ были разделены на три группы: вследствие гипертонической микроангиопатии (группа I) — 99 пациентов; вследствие атеросклеротической микроангиопатии (группа II) — 80 пациентов; с эмболическим генезом ЛИ (группа III) — 32 пациента. В I группу были включены пациенты с ЛИ и длительным анамнезом гипертонической болезни. Во II группу — пациенты с атеросклеротическим поражением церебральных артерий, без ГБ в намнезе. В III группу — больные с потенциальными источниками кардиальной и артерио-артериальной церебральной эмболии. Группы были равнозначны по возрасту, процентному соотношению мужчин и женщин.
У всех больных клиническая картина была представлена одним из лакунарных синдромов. Всем пациентам выполнялось:
- Оценка факторов риска;
- КТ головного мозга (SIEMENS SOMATOM Sensation 4);
- Магнитно-резонансная («Giroscan INTERA NOVA», Голландия) томография головного мозга, в Т1, Т2, Т2 FLAIR и диффузионном режимах;
- Трансторакальная или трансэзофагеальная эхокардиография (VIVID 7, General Elektrik, США);
- Дуплексное сканирование (VIVID 7, General Elektrik, США) или селективная ангиография (Toshiba, Infinix CS-I, Япония) брахиоцефальных и церебральных артерий;
- Транскраниальная допплерография (Companion III) с билатеральной локацией средних мозговых артерий в течение 60 мин и детекцией микроэмболических сигналов;
- Лабораторная диагностика биохимических показателей крови (HITACHI 902) и состояния свертывающе-противосвертывающей систем крови (BCT DADE BEHRING);
- Оценка тяжести неврологического дефицита по шкале NIHSS;
- Оценка функциональных исходов инсультов по шкале Ранкин.
Лакунарный инсульт у всех пациентов клинически манифестировал одним из классических лакунарных синдромов. Наиболее часто встречался «чисто двигательный инсульт». В I группе — у 53 пациентов (53, 5%), во II — у 53 пациентов (66,2%), в III — у 20 пациентов (62,5%), причем статистически значимые различия в инцидентности изолированного гемипареза между группами отсутствовали, р>0,05. Синдромы дизартрии с неловкостью руки, сенсорно-моторный инсульт, атактический гемипарез, чисто чувствительный инсульт встречались реже, и, по частоте встречаемости, также не обнаружили статистически значимых различий между группами.
Тяжесть неврологического дефицита в остром периоде инсульта оценивалась по шкале NIHSS. У больных с эмболическим генезом ЛИ в дебюте заболевания отмечались наиболее выраженные неврологические расстройства — 7,1+2,5 балла. По сравнению с III группой, тяжесть инсульта в первые сутки в группах больных с гипертонической и атеросклеротической микроангиопатией была достоверно ниже — 5,8+2,4, р=0,05 и 5,5+2,5, р=0,01, соответственно. Через 21 день после дебюта ЛИ, по сравнению с первым днем заболевания, тяжесть неврологического дефицита в III группе была достоверно ниже и составила 5,0+2,5, р 0,05.
Сахарный диабет (СД) в группе больных ЛИ вследствие атеросклеротической микроангиопатии диагностирован у 24 пациентов (30,0%), в группе с эмболическим генезом ЛИ — у 12 пациентов (37,5%), статистически значимые различия между данными группами отсутствовали р>0,05. В группе больных с гипертонической микроангиопатией СД встречался редко — 13 пациентов (13,1%), что показало значимые различия и со II и с III группами р 0,05. В группе больных с гипертонической микроангиопатией дислипидемия зафиксирована у 43 пациентов (49,5%), что было значимо ниже по сравнению со II и с III группами р 70% или окклюзия) верифицировано у 42 больных ЛИ. В группе больных с атеросклеротической микроангиопатией — у 28 пациентов (38,9%), в группе больных с эмболическим генезом ЛИ — у 14 (46,7%), что не обнаружило значимых различий, р>0,05. В группе больных ЛИ вследствие гипертонической микроангиопатии не наблюдалось грубого стено-окклюзирующего поражения церебральных артерий, и различия с I и II группами были статистически значимыми р 0,05). Соответствующие изменения МРТ-сигнала не были обнаружены ни у одного больного в группе с эмболическим генезом ЛИ.
По данным диффузионной МРТ большой (более 15 мм) или несколько мелких очагов в одном сосудистом бассейне были обнаружены у 39 пациентов (18,5%). В группе больных с эмболическим генезом ЛИ — у 8 пациентов (25,0%) и атеросклеротической микроангиопатией — у 18 пациентов (22,5%), причем различия не были значимыми (р>0,05). В группе больных ЛИ вследствие гипертонической микроангиопатии только у 13 пациентов (13,1%) верифицированы указанные выше изменения, что обнаружило статистически значимые различия с III группой (р
Лакунарный инфаркт мозга
Термин, от которого происходит название лакунарный инсульт — «лакуна» был введен французским врачом по фамилии Декамбре в 1838 году и обозначал образованные размягчения и полости в сером веществе. Однако полное освещение картины, диагностики и лечения лакунарного инсульта, (иначе – лакунарный инфаркт сосудов головного мозга) было сделано в 80х годах ХХ века.
Лакунарный инсульт – ишемический вид инсульта. который вызывает инфаркт. Последствием инфаркта является образование лакуны, небольшой полости в головном мозгу, а точнее, его глубинных отделах.
Особенности ЛИ
Предпосылкой инсульта считается артериальная гипертензия с последующим образованием очагов некроза. Из-за того, что очаги эти расположены в глубинных слоях вещества, сама кора полушарий не поражается, даже в случае небольшого кровоизлияния.
Факт: величина лакуны составляет в различных случаях от 10мм до 150-200мм. Человек может не замечать симптомы и продолжать обычную жизнедеятельность с микроскопическими лакунами, которые выявит только гистологический анализ.
А вот еще медицинские факты:
- На долю лакунарных инсультов головного мозга приходится 15% всех случаев;
- Чаще всего лакунарный инсульт регистрируется у пожилых людей, страдающих АГ;
- Выявить эту патологию на 100% можно только при помощи аутопсии;
- Диаметр поражаемых глубинных (пенетрирующих и внутримозговых) артерий составляет от 40 до 900мк.
Причины возникновения ЛИ
Лакунарный инфаркт является следствием артериальной гипертонии головного мозга. От общего артериального давления, тонуса сосудов насколько сильно пострадала стенка артерии. В том числе, влияние на сосуды головного мозга имеют суточные скачки, не понижающееся в ходе сна значение в ночное время или, наоборот, слишком резкие перепады.
В группу риска людей, для которых лакунарный инфаркт более вероятен, относят:
- Тех, кто имеет гиалиновую дистрофию АГ;
- Кто страдает атеросклерозом;
- Кто перенес инфекционное воспаление артериол головного мозга;
- У кого выявлен сахарный диабет или слишком повышен сахар в крови.
Также причиной данного вида инсульта могут являться васкулиты специфической или неспецифической формы проявления.
Признаки лакунарного инфаркта
Для начала выявим клиническую и первые симптомы, по которым можно распознать ЛИ. Основная проблема как раз в том и заключается, что это нарушение глубинное, и поскольку кора не задета, у пациента сохранено сознание, нет дефекта зрительных органов, нарушений других функций письма, счета, движений или речи, как в случае обыкновенного инсульта.
Как же тогда определить лакунарный инфаркт? На него укажут признаки диффузного поражения вещества головного мозга:
- Симметрично повышается тонус мышц по всему телу, возникают двусторонние судороги;
- Может снизиться память, речь – стать менее четкой;
- Нарушение равновесия при ходьбе;
- Появляется неконтролируемый стул и мочеиспускание;
Причем перечисленные симптомы могут возникать и не сразу, а лишь с течением времени. Продолжим перечень, включив в него первичные признаки:
- Около 50% случаев подразумевает наступление односторонней слабости в мыщцах, сразу в нескольких отделах, например, лицо и рука;
- Около 5% случаев включают нарушение тактильной, температурной или болевой чувствительности;
- Лакунарный инфаркт может привести к синдрому «неловкой руки», онемению (парезу) отдельных суставов.
- Проконтролировать свою диету, исключив из нее продукты с повышенным содержанием холестерина, сахара, иных вредных веществ; Принимать профилактические препараты, укрепляющие стенки сосудов головного мозга;
- Следить за артериальным давлением, причем пожилым людям рекомендуется измерять его несколько раз в сутки;
- Если вы уже переносили подобную болезнь, и первые симптомы инсульта дали о себе знать – немедленно обратитесь к доктору. Осторожность в данном случае не будет излишней;
- Разумеется, экология, курение и алкоголь тоже приближают лакунарный инфаркт. Чаще следует отдыхать на природе, отказаться от вредных привычек.
В любом случае, точные симптомы инсульта головного мозга сумеет установить врач. Поэтому необходимо при появлении первых признаков обеспечить госпитализацию пациента и провести МРТ на предмет выявления диффузного поражения.
Диагностика и лечение
Проведя первичные анализы и диагностику лакунарного инсульта, врачи обязательно должны подтвердить артериальную гипертензию. Симптомы могут нарастать после приступа в течение первых часов или даже нескольких дней. Поэтому больной должен находиться под непрерывным контролем.
Часто приступ происходит во сне: казалось бы, с вечера мучает обычная головная боль, повысилось давление, многие списывают это на усталость. С утра проявляются первые симптомы – онемение мышц или суставов, слабость, дезориентация.
В большинстве случаев при своевременном выявлении лакунарный инфаркт поддается лечению, двигательные и прочие функции полностью восстанавливаются за период до 6 месяцев. После определения при помощи КТ и МРТ головного мозга диаметров лакуны выносится диагноз, предварительно прописывается лечение и план ликвидации АГ. Далее лечение происходит по тому же пути, что и лечение ишемического инсульта. Больному предписан реабилитационный режим, прием снижающих давление лекарств, меры по улучшению кровообращения и диета.
Чем опасен ЛИ?
Если кора не повреждена, значит, с этим можно как-то прожить. Так, увы, считают многие. Однако вследствие лакунарного инсульта развивается деменция – постепенные изменения психического состояния. Появляются все большие провалы в памяти, дезориентация, затрудняется общение с близкими. Чувство беспомощности, плаксивости, вплоть до состояния аффекта и истерик – это тоже могут быть последствия лакунарного очага инсульта .
Профилактика лакунарного инсульта
К сожалению, не только люди в пожилом возрасте подвержены этому заболеванию. Даже зрелые и молодые мужчины (в 55% случаев) и женщины (в 45%) подвержены ЛИ. Основная причина кроется в стрессовом и неблагоприятном образе жизни, чрезмерных нагрузках на сосуды, сердце и нейроны головного мозга.
Наилучшим профилактическим лекарством, а также снижающим риск повторного заболевания — инфаркт сосудов, считается аспирин. Принимать его следует в чистом, желательно растворимом виде.
Чтобы воспрепятствовать образованию даже самых мелких лакун, как следствия инсульта, следует обеспечить здоровый образ жизни:
Возьмите себе за правило – вести дневник показаний давления. Производите замеры утром, натощак, затем после приема пищи, и на ночь, перед сном.
Отдых и умеренный труд должны стать основой вашего образа жизни. Делайте то, что приятно вам, не позволяйте поддаваться стрессам. Не переутомляйтесь и не «испытывайте» работу сердца чрезмерными физическими нагрузками. Слишком много спорта – это тоже вредно. Наконец, не поленитесь раз в год провести МРТ головного мозга и обследование на предмет нарушения деятельности мелких, глубинных сосудов. И тогда такое явление, как инфаркт вообще покажется вам невозможным.