Реабилитация больных, перенесших инсульт, в условиях городской поликлиники
Бугрова С.Г.
Церебральный инсульт (острое нарушение мозгового кровообращения – ОНМК) является серьезной медицинской и социальной проблемой, сопровождающейся высокой летальностью, значительной инвалидизацией и социальной дезадаптацией перенесших его пациентов [4]. Степень, характер и длительность восстановления функций, утраченных вследствие инсульта. вариабельны. Наиболее существенное улучшение в состоянии больного отмечается в первые 6 мес. в 5% случаев положительная динамика может наблюдаться в течение года. Ранняя диагностика инсульта. лечение и реабилитация больных. перенесших ОНМК, отнесены к приоритетным направлениям государственной политики в области здравоохранения. Постановлением Правительства Ивановской области утвержден план мероприятий по снижению смертности населения области от инсульта и инфаркта. Одной из поставленных задач является обретение полной независимости в каждодневной жизни в течение 3 мес. более 70% больных. выживших в 1–й месяц заболевания. Ранняя реабилитация пациентов с инсультом начинается уже в региональных сосудистых центрах, имеющих в штатах кинезотерапевта, физиотерапевта, социального работника. Каждому больному разрабатывается индивидуальная реабилитационная программа. Основная нагрузка по реабилитации больных с инсультом приходится на амбулаторно–поликлиническое звено. Более чем у половины больных, перенесших ОНМК, развиваются двигательные нарушения в виде спастических парезов. Постинсультная спастичность рассматривается как комбинированное поражение пирамидных и экстрапирамидных структур внутри головного мозга, сопровождающееся ослаблением тормозных влияний преимущественно на a–мотонейроны, которые обеспечивают движение антигравитационных мышц [6]. Характерны приведение плеча, сгибание руки в локтевом и лучезапястном суставах, приведение бедра, разгибание колена и подошвенное сгибание в голеностопном суставе. Спастичность обычно нарастает в паретичных конечностях в течение нескольких недель и месяцев, ухудшает двигательные функции, способствует развитию контрактуры и деформации конечности, затрудняет уход за обездвиженным больным и иногда сопровождается болезненными мышечными спазмами. В клинической практике для лечения постинсультной спастичности наиболее часто используются пероральные антиспастические лекарственные средства [7,9]. В настоящее время доказано, что активизация пораженных конечностей непосредственно влияет на процессы функциональной церебральной реорганизации и таким образом способствует лучшему восстановлению неврологического дефекта [3]. Кроме того, адекватные реабилитационные мероприятия позволяют адаптировать больного к самообслуживанию, научить пользоваться подручными средствами для передвижения даже при наличии выраженного гемипареза.
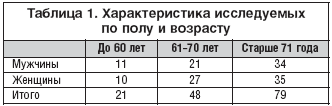
Материал и методы. Проведен анализ лечения 145 больных в возрасте 54–72 лет (в среднем 65,9±8,7 года), перенесших ОНМК и выписанных на долечивание в поликлинику №5 г. Иваново в 2007–2009 гг. Обследование включало оценку выраженности неврологического дефицита по оригинальной шкале Гусева Е.И. Скворцовой В.И. [2], степени утраты способности к самообслуживанию (шкала Бартела, шкала Ривермида). Выраженность пареза оценивалась по визуально–аналоговой шкале, степень спастичности – в соответствии со шкалой Ashworth. Качество жизни оценивалось по опроснику SF–36 [1].
Лечение больных с инсультом проводилось в соответствии со стандартами [4,5]. Для уменьшения выраженности двигательных нарушений у 53 больных (34 женщины,19 мужчин) применялся толперизон (Мидокалм) – мышечный релаксант центрального действия, который близок к лидокаину по химической структуре и стабилизирует мембраны нервных клеток, снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Препарат применялся в дозе 150 мг внутрь 3 раза/сут. в течение 3 мес. Для сравнения больные были подразделены на 3 группы в зависимости от выраженности двигательных расстройств при первичном осмотре. 1–ю группу (14 человек) составили пациенты с выраженными нарушениями (выраженный гемипарез), 2–ю группу (29 человек) – больные с умеренными нарушениями (моноплегия, умеренный гемипарез), 3–ю группу (10 человек) – пациенты с легкими двигательными расстройствами (легкий гемипарез, пирамидная недостаточность без слабости).
Наряду с медикаментозной терапией проводился комплекс мероприятий в условиях реабилитационного отделения поликлиники.
Обследование проводилось в 1–й день, на 45–е сутки лечения, на 90–е сутки. Полученные результаты были обработаны статистически с использованием программного пакета Statistica 6.0
Результаты. Срок с момента развития заболевания до начала проведения лечебных мероприятий в условиях поликлиники составил 28–52 дня.
Наряду с гипертонической болезнью у 6,89% пациентов в анамнезе перенесенный инфаркт миокарда, у 10,35% имелись нарушения сердечного ритма, у 12,4% – сахарный диабет, заболевания легких диагностированы у 28,97%, эндокринные нарушения – у 13,4%, заболевания суставов и позвоночника – у 78%, атеросклероз сосудов нижних конечностей и варикозная болезнь – у 26,1%, онкопатология – у 9,66%. 0,69% больных ранее перенесли каротидную эндартэктомию, 1,38% – коронарное стентирование.
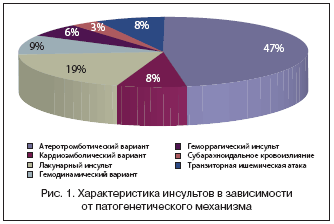
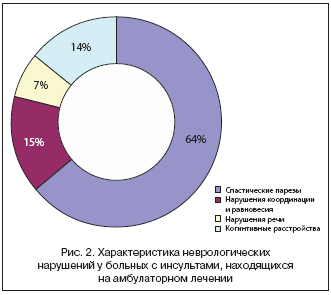
Результаты, приведенные на рисунках 1 и 2, свидетельствуют, что среди больных, принятых на амбулаторное лечение в условиях поликлиники. преобладали пациенты с атеротромботическим ишемическим инсультом. В клинической картине ведущее место занимали двигательные нарушения в виде спастических парезов различной степени выраженности.
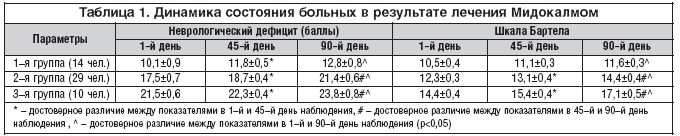
В результате лечения Мидокалмом у больных всех групп отмечалось уменьшение выраженности неврологического дефицита (табл. 1). Более значительным улучшение было у больных с умеренными и легкими двигательными нарушениями (2–я и 3–я группы), достоверное различие показателей неврологического дефицита и способности к самообслуживанию выявлено уже на 45–й день лечения по сравнению с исходными (табл. 2). Достоверных различий показателей у больных в зависимости от варианта перенесенного инсульта, локализации очага и возраста больных выявлено не было. В 2 случаях отмечались побочные эффекты в виде головокружения, тошноты в начале лечения, которые постепенно ослабли и позволили продолжить лечение, не меняя дозировки. У 3 пациентов в возрасте старше 65 лет отмечено незначительное снижение АД, что было скорректировано изменением дозы гипотензивных препаратов.
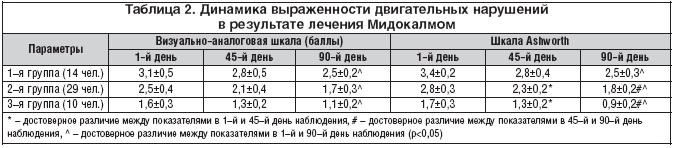
В результате лечения Мидокалмом у больных отмечалось достоверное снижение выраженности пареза и уменьшение спастичности мышц. У больных 2–й и 3–й групп положительный эффект отмечался к 45–му дню лечения, у больных с выраженными двигательными нарушениями – к концу лечения.
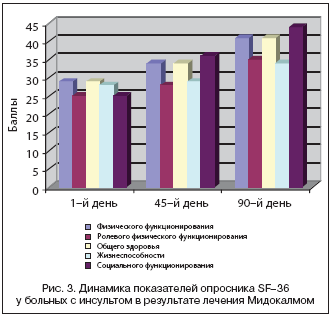
Результаты Опросника качества жизни у больных, получавших лечение Мидокалмом, приведены на рисунке 3. Отмечено достоверное улучшение показателей шкал физического функционирования, общего здоровья, жизнеспособности, ролевого физического и социального функционирования.
Специалистами реабилитационного отделения поликлиники разработан комплекс лечебной гимнастики, направленный на тренировку движений в паретичных конечностях и предотвращение контрактур. В группе пациентов с умеренными и легкими двигательными нарушениями (51,6%) представилось возможным использование тренажеров (степпер, беговая дорожка). В группе больных с выраженными гемипарезами лечение проводилось на дому (48,4%). Использовалось лечение положением, обучение пациентов стоянию, сидению, ходьбе (с помощью дополнительных средств и самостоятельно). Одной из проблем в организации реабилитационных мероприятий, с которой мы столкнулись, явился недостаток методических рекомендаций по ЛФК в домашних условиях. наглядных материалов, памяток для больных. Обучение проводилось в рамках школы для больных, перенесших инсульт, как пациентов, так и их родственников в виде групповых и индивидуальных занятий.
Из физиопроцедур использовались тепловые воздействия на спастичные мышцы, а также электрическая стимуляция определенных мышечных групп. Физиолечение было проведено у 33,8% больных с учетом имеющейся сопутствующей патологии и наличия противопоказаний. Массаж мышц паретичных конечностей проводился по щадящей методике в сочетании с растиранием и неглубоким разминанием в мышцах–антагонистах в более быстром темпе. В результате реабилитационных мероприятий удалось добиться полной независимости в самообслуживании у 47% пациентов с постинсультными двигательными расстройствами. Вернулись к трудовой деятельности 18,3% больных.
Обсуждение и выводы
Анализ результатов исследования показал высокий удельный вес двигательных расстройств у больных с инсультами, находящихся на амбулаторном лечении. Полученные результаты свидетельствуют об эффективности Мидокалма в раннем восстановительном периоде инсульта. Применение препарата способствует снижению выраженности спастического пареза и нормализации мышечного тонуса, увеличению степени независимости пациента в повседневной жизни. Эффективность Мидокалма сопоставима у больных как с геморрагическим, так и с ишемическим инсультом. При умеренных и легких двигательных нарушениях рекомендуется курс лечения в дозе 450 мг/сут. в 3 приема длительностью не менее 3 мес. При выраженных парезах (более 3 баллов по шкале Ashworth), по–видимому, необходимо более длительное применение препарата в более высоких дозах. В работе Stamenova P. Koytchev R. Kuhn K. et al. [8] приведены результаты исследования 97 пациентов, страдающих связанной с инсультом спастичностью (51 больной получал толперизон и 46 плацебо). В 45% случаев использовалась доза толперизона 600 мг/сут. 15% пациентов получали 900 мг/сут. В среднем пациенты получали терапию толперизоном в течение 88,3±17,1 дня и плацебо в течение 88,1±16,4 дня. По завершении исследования средние изменения исходных значений Индекса Бартела составили 5,3 в группе толперизона и 1,7 в группе плацебо, достоверно более значительное снижение степени спастичности по показателям 5–пунктовой шкалы Ашворта отмечалось в группе толперизона. Как по данным авторов, так и нашего исследования отмечены хорошая переносимость и безопасность применения Мидокалма у больных, перенесших инсульт. Ни один из больных, получавших препарат, не прекратил лечение вследствие побочных эффектов.
Необходимо дальнейшее совершенствование мероприятий по реабилитации больных с инсультом в амбулаторно–поликлинических условиях .
Литература
1. Белова А.Н.Шкалы, тесты и опросники в неврологии инейрохирургии.М.–2004.–433 с.
2. Гусев Е.И. Скворцова В.И. Бурд Г.С. Гехт А.Б. и др. Метаболическая терапия ишемического инсульта: применение ноотропила // Ж. неврол. и психиатр. – 1997. – Т.97.№5–С.24–29.
3. Дамулин И.В. Постинсультные двигательные расстройства.// Consilium Medicum, 2003, т.5, №2, с.64–70.
4. Инсульт: диагностика, лечение, профилактика. Под.ред. З.А.Суслиной, М.А. Пирадова.–М.:МЕДпресс–информ,2008.–288с.
5. Снижение заболеваемости, смертности и инвалидности от инсультов в Российской Федерации. Сборник методических рекомендаций, программ, алгоритмов. Под.ред.В.И.Скворцовой.–М.:Литерра,2007.–192с.
6. Парфенов В. А. Спастичность. В кн. Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / под ред. О. Р. Орловой, Н. Н. Яхно. М. Каталог, 2001. С. 91–122.
7. Feher M. Juvancz P. Szontagh M. Effect of Mydocalm in the rehabilitation of hemiparesis // Balneologia Rehailitdcio Gyogyfurdougy. 1985. Vol. 6. P. 201–205.
8. Stamenova P. Koytchev R. Kuhn K. et al. A randomized, double–blind, placebo–controlled study of the efficacy and safety of tolperisone in spasticity following cerebral stroke. European Journal of Neurology. 2005; 12: 453–461.
9. Gallichio J. E. Pharmacologic management of spasticity following stroke. // Phys Ther. 2004. Vol. 84. P. 973–981.
Эффективность Кортексина при ранней реабилитации больных с ишемическим инсультом
Куренкова Н.А. Филатова М.С. Попов Д.В. Макарова Л.Д. Маханьков О.В.
Церебральные нарушения ишемического характера составляют до 80% от общего числа инсультов. Ишемический инсульт (ИИ) – одна из ведущих причин первичной инвалидизации. В России насчитывается свыше 1 млн человек, перенесших инсульт. при этом третью часть их составляют лица трудоспособного возраста, однако к труду возвращается лишь каждый четвертый больной. Принципиальное значение имеет разработка концепции гетерогенности ИИ, которая выявила большое разнообразие его причин и механизмов, определяющих полиморфизм структурных поражений головного мозга и клинических проявлений заболевания.
Проблемы реабилитации последствий инсульта продолжают оставаться большой клинической и социальной задачей. Разработка современной стратегии патогенетической терапии позволит уменьшить бремя трагических последствий инсульта – смертности и инвалидности, что в конечном итоге повысит качество жизни пациентов [1, 4].
Лечение больных с острым ИИ включает такие основные направления, как максимально раннее восстановление нарушенного мозгового кровотока, предупреждение и лечение осложнений инсульта, ограничение зоны повреждения путем назначения препаратов метаболического действия, а также своевременное начало реабилитационных мероприятий.
В этом плане возрастает внимание к медицинской реабилитации как к неотъемлемому компоненту лечебного процесса [2]. Целью реабилитации является возвращение пострадавшего к социально-бытовой деятельности, создание оптимальных условий для его активного участия в жизни общества [3]. Только правильно организованная система реабилитации позволяет снизить тяжесть постинсультных двигательных расстройств, оказать положительное влияние на нарушенные когнитивные функции, возникающие в результате развития ИИ. При начале реабилитационных мероприятий в течение первых дней (и часов!) с момента развития инсульта вероятность наилучшего восстановления увеличивается в 6 раз по сравнению со случаями, когда лечение было начато в более поздние сроки. В этой связи имеются основания для использования новых лекарственных препаратов в комплексной терапии ИИ.
Большое значение при лечении ИИ отводится нейропротекции. Существует большое число нейропротекторных препаратов с различной степенью активности. Особый интерес представляют нейропептиды в силу их высокой эффективности при условии их малой концентрации в организме. Кортексин – отечественный низкодозированный препарат пептидной структуры, обладающий нейрометаболическими, антиоксидантными и антигипоксическими свойствами. Кортексин обладает целым рядом потенциально полезных свойств, необходимых при коррекции ишемических повреждений головного мозга. Прежде всего, это активация пептидов нейронов и нейротрофических факторов мозга. Кроме того, под действием Кортексина происходит оптимизация баланса тормозных и возбуждающих аминокислот, допамина, серотонина [5]. В последние годы доказано, что препарат обладает энергетически сберегающим действием, он уменьшает энерготраты, необходимые для выполнения когнитивных функций [5].
Цель работы – изучить эффективность ранних реабилитационных мероприятий у больных с ИИ на фоне применения Кортексина – препарата, обеспечивающего нейрометаболическую защиту головного мозга пациентов после инсульта.
Материал и методы
В исследование включены 35 пациентов (21 мужчина, 14 женщин) с полушарным ИИ в возрасте от 45 до 68 лет, находившихся на стационарном лечении в Региональном сосудистом центре ГБУЗ ОКБ № 3 г. Челябинска.
Все пациенты доставлены в стационар в течение первых 24–48 ч от начала развития острого нарушения мозгового кровообращения (ОНМК). Проводилось общеклиническое обследование, которое включало общесоматический (жалобы, физикальные и аускультативные методы, контроль артериального давления (АД), частоты сердечных сокращений (ЧСС) и других общепринятых методов контроля) и неврологический осмотр с оценкой по специальным шкалам выраженности неврологической симптоматики (шкала NIHSS, модифицированная шкала Рэнкина, индекс мобильности Ривермид).
Оценка когнитивных функций проводилась с использованием шкалы MMSE, теста рисования часов, батареи лобной дисфункции, таблицы Шульте, теста запоминания 10 слов.
Всем пациентам было проведено КТ-обследование головного мозга. Лабораторное и инструментальное обследование включало общий и биохимический анализы крови, контроль кислотно-основного состояния и водно-электролитного баланса, ЭКГ, ультразвуковую диагностику экстракраниальных сосудов, при необходимости – эхокардиографическое исследование сердца.
Пациенты были сопоставимы по характеру жалоб, степени выраженности неврологического дефицита; исключались больные с тяжелой соматической патологией, тотальной афазией, повторным инсультом.
Путем случайной выборки больные были распределены в две группы: 1-я группа (основная) – 19 человек; 2-я группа (контроля) – 16 человек.
Все больные получали базисную терапию ИИ, направленную на нормализацию гомеостаза, центральной и церебральной гемодинамики. 19 пациентов из 35 в дополнение к базисной терапии получали Кортексин (10 мг в/м в течение 10 дней). Кортексин назначался с 3–5–х сут болезни, когда наряду с медикаментозной терапией активно использовался комплекс реабилитационных мероприятий, проводимых инструктором-методистом по лечебной физкультуре, логопедом, медицинским психологом, массажистом (массаж, пассивная и активная гимнастика, обучение ходьбе и навыкам самообслуживания, восстановление утраченных функций с использованием роботизированной техники, электростимуляция, артикуляционная гимнастика, индивидуальные занятия с психологом).
Результаты
На момент включения в исследование выраженность неврологического дефицита в обеих группах была практически идентичной (значения шкалы NIHSS – 9–10 баллов, шкалы Рэнкина – 3–4, индекс мобильности Ривермид – 6–7).
С учетом субъективных и объективных показателей установлено, что хороший клинический эффект характеризовался значительным регрессом или полным восстановлением утраченных функций, он наблюдался у 19 пациентов, 12 из которых получали на фоне базисной терапии Кортексин; удовлетворительный эффект – уменьшением неврологической симптоматики, он был отмечен у 7 больных, получавших Кортексин, и 5 больных, не получавших препарат; неудовлетворительный эффект (отсутствие динамики в неврологическом статусе) был выявлен у 4 пациентов, в лечении которых данный препарат не применялся.
К концу госпитализации (15–16-е сут) в основной группе оценка по шкале NIHSS с 9–10 баллов снизилась до 2–5, по шкале Рэнкина – с 3–4 до 1–2 баллов, индекс мобильности Ривермид изменился с 6–7 до 9–14 баллов. В группе контроля неврологический дефицит менялся менее значительно.
При нейропсихологическом тестировании тест заучивания 10 слов оказался наиболее показательным. Он позволил определить объем мгновенной, непосредственной, кратковременной слухоречевой памяти, прочность ее следа и эффективность заучивания.
В основной и контрольной группах пациентов объем мгновенной памяти при первом обследовании (3–5-е сут болезни) у всех пациентов был снижен. На фоне приема Кортексина через 10 дней при повторном обследовании в основной группе у 17 (89%) человек наблюдалось улучшение непосредственной памяти и у 2 (11%) человек она оставалась на низком уровне. В группе контроля у 3 (18,7%) человек показатели нормализовались, и у 13 (87,5%) человек объем мгновенной, непосредственной памяти характеризовался низкими показателями.
Объем кратковременной слухоречевой памяти (эффективность заучивания) в основной группе при первичном осмотре у 15 (79%) человек был на низком уровне, у 4 (21%) – в пределах возрастной нормы. После курса лечения Кортексином 12 (63%) человек имели хорошие результаты и 5 (37%) пациентов – прежний низкий уровень.
В группе контроля при первичном обследовании у 13 (81%) человек показатели эффективности заучивания низкие, у 3 (19%) – в пределах нормы. При обследовании в динамике через 10 дней эти показатели не изменились.
На фоне лечения препаратом Кортексин отмечалось улучшение мнестических функций, повышались активность и внимание при выполнении нейропсихологических тестов, уменьшались речевые нарушения, повышались способность к самоконтролю и самокоррекции речи, уменьшались двигательные нарушения, что подтверждается количественной характеристикой тяжести состояния больных в виде изменения суммарного балла по шкалам NIHSS, модифицированной шкале Рэнкина, индекса мобильности Ривермид.
За период наблюдения ни у одного из больных, получавших Кортексин, не наблюдалось побочных эффектов.
Заключение
Применение в терапии острого полушарного ИИ Кортексина, наряду с базисной терапией, обеспечивает более выраженную положительную динамику, что подтверждает эффективность препарата.
Результаты проведенного исследования совпадают с материалами известных работ [6, 7] и свидетельствуют о целесообразности применения Кортексина при ранней реабилитации постинсультных пациентов, поскольку использование данного препарата приводит к улучшению качества жизни пациентов и их близких, что, в свою очередь, является основной и конечной целью медицинской реабилитации и представляется экономически обоснованным [8].
Литература
1. Гусев Е.И. Скворцова В.И. Платонова И.А. Терапия ишемического инсульта // Consilium Medicum. 2003; специальный выпуск. С. 18–20.
2. Иванова Г.Е. Организация реабилитационного процесса // Здравоохранение Чувашии. 2013. № 1. С. 18–23.
3. Ковальчук В.В. Особенности реабилитации пациентов после инсульта. Сборник статей «Актуальные вопросы терапии цереброваскулярной патологии». М. Медиа Сфера, 2013. С. 65–72.
4. Скворцова В.И. Механизмы повреждающего действия церебральной ишемии и новые терапевтические стратегии // Журнал неврологии и психиатрии им. С.С. Корсакова 2003. № 3. С. 20–25.
5. Танашян М.М, Бархатов Д.Ю. Глотова Н.А. и др. Терапия когнитивных нарушений при цереброваскулярных заболеваниях: новые факты // Труды II Национального конгресса «Неотложные состояния в неврологии». М. 2011. С. 131–135.
6. Скоромец А.А. Стаховская Л.В. Белкин А.А. и др. Новые возможности нейропротекции в лечении ишемического инсульта // Журнал неврологии и психиатрии им. С.С. Корсакова, 2008. № 22. С. 32–38.
7. Стаховская Л.В. Мешкова К.С. Дадашева М.Н. и др. Многоцентровое рандомизированное проспективное двойное слепое плацебо-контролируемое исследование безопасности и эффективности кортексина в остром и раннем восстановительном периоде ишемического инсульта // Вестник Российской Военно- медицинской академии. 2012. № 1(37). С. 238–244.
8. Зырянов С.К. Стаховская Л.В. Гильдеева Г.Н. Мешкова К.С. Клинико-экономический анализ эффективности кортексина у больных с полушарным ишемическим инсультом в остром и раннем восстановительном периоде в условиях специализированных сосудистых центров // Вестник Российской Военно-медицинской академии. 2012. 3 № (39). С. 69–74.
Modern approaches to rehabilitation of stroke patients
The article provides an overview of available and the most effective methods of rehabilitation of stroke patients. The principles of rehabilitation measures at the main clinical manifestations of stroke, causing persistent disability of the patient are considered. The efficiency of new experimental methods of rehabilitation is discussed.
Инсульт — острое нарушение мозгового кровообращения, представляющее одну из основных причин инвалидизации и смертности населения. Помимо безусловного медико-социального значения инсульт приносит также колоссальный экономический ущерб. Например, в США расходы, связанные с лечением и реабилитацией пациентов с инсультом, а также экономические потери, связанные с потерей трудоспособности, составляют 6,5-11,2 миллиарда долларов в год. Особенно актуальна проблема инсульта в Российской Федерации, где ежегодно регистрируют 450 тысяч случаев инсультов и на каждые 100 тыс. населения приходится 600 пациентов с последствиями инсульта, из которых 60% остаются инвалидами [2, 9].
В последние десятилетия достигнуты существенные достижения в диагностике, лечении и профилактике ишемического инсульта, позволившие в значительной степени снизить летальность и улучшить функциональный прогноз. Концепция патогенетической гетерогенности ишемического инсульта стала основой дифференцированного подхода к лечению и первичной/вторичной профилактике. Лечение пациентов с ишемическим инсультом включает следующие аспекты: общие мероприятия, реперфузионную терапию, вторичную профилактику и реабилитацию, симптоматическую терапию, купирование осложнений [4, 8].
Всем больным, перенесшим ишемический инсульт или транзиторную ишемическую атаку, показана вторичная профилактика повторных нарушений мозгового кровообращения [16]. Конкретный перечень профилактических мероприятий зависит от подтипа инсульта. Во всех случаях необходима коррекция факторов риска, в первую очередь нормализация АД, компенсация сахарного диабета, изменение образа жизни (прекращение курения, злоупотребления алкоголем, адекватная диета и др.) [10]. В настоящее время перенесенный ишемический инсульт рассматривают как прямое показание к началу терапии статинами [11]. Основу вторичной профилактики в настоящее время составляют антиагреганты, в частности ацетилсалициловая кислота [5]. Дипиридамол или клопидогрел назначают при непереносимости ацетилсалициловой кислоты, а также если инсульт развился на фоне ее приема. В случае кардиоэмболического инсульта допустимо применение непрямых антикоагулянтов (варфарин) [7, 14, 15, 19].
К основным принципам реабилитации больных, перенесших инсульт. следует отнести раннее начало реабилитационных мероприятий с активизацией пациента, мультидисциплинарный организованный подход, непрерывность, последовательность и преемственность на всех этапах ее проведения. В большинстве случаев (более 80%) двигательные расстройства (гемипарезы, монопарезы) определяют степень инвалидизации, утрату трудоспособности и нарушения бытовой активности [17]. Реабилитация больных после инсульта не исчерпывается мероприятиями по восстановлению только двигательных функций. Другие расстройства, обусловливающие необходимость проведения реабилитации, включают нарушения речи (различные афазии) и других высших корковых функций, сенсорные расстройства, дисфагию, зрительные нарушения и др. [22].
Нейрофизиологические механизмы, позволяющие восстанавливаться двигательным функциям у больных с инсультом, сложны и многообразны. В раннем периоде (первые дни и недели после инсульта) основное значение представляет восстановление функциональной активности морфологически сохранных, но временно дезорганизованных нейронов, расположенных перифокально по отношению к очагу поражения. Это возможно благодаря таким явлениям, развивающимся в первые недели после инсульта, как разрешение отека, развитие системы коллатерального кровообращения и восстановление перфузии пораженной зоны мозга. В дальнейшем нейрофизиологической основой восстановления становятся процессы мозговой пластичности, связанной с реорганизацией нормальных физиологических соотношений между различными мозговыми структурами, принимающими участие в осуществлении данной функции. Ведущее значение имеют коллатеральный спрутинг (разрастание поврежденных волокон с формированием новых синапсов), денервационная сверхчувствительность (рецепторы становятся более чувствительным к нейротрансмиттерам или же увеличиваются в количестве), демаскировка, при которой находящиеся в покое нейрональные связи заторможены, но активизируются после повреждения [21, 22, 39, 54].
Кинезиотерапия — форма лечебной гимнастики, включающей лечение положением, пассивные и активные движения. С учетом того, что процессы восстановления функциональной активности сохранных нейронов и функциональной реорганизации наиболее активно протекают в ранние сроки после инсульта, реабилитация должна начинаться как можно раньше — в первые сутки, причем кинезиотерапии отводится важнейшее значение [1, 3]. Основная цель этих мероприятий направлена на предотвращение развития контрактур и пролежней. В дальнейшем кинезиотерапия предназначена решать две основные группы задач — общетонизирующее воздействие на организм, тренировка сердечно-сосудистой системы, активизация мозговой гемодинамики; и воздействие на двигательные нарушения (в восстановительном периоде заболевания — содействие восстановлению двигательных функций, в резидуальном — выработка субкомпенсаций, разработка контрактур). Используемые с этой целью методы лечебной физкультуры условно подразделяют на стандартные и нейрофизиологические [32, 53]. К стандартной лечебной физкультуре относят различные комбинации упражнений на увеличение объема движений и упражнения с сопротивлением, мобилизационная активность, компенсаторные техники, функционально ориентированные (то есть тренирующие движения повседневной активности). К нейрофизиологическим техникам относят методы, где программа упражнений основана на нейромышечных «переобучающих» программах. Наиболее широко в клинической практике применяют методику проприоцептивного нервно-мышечного облегчения (PNF), Brunnstom (предполагает использование синергий в качестве средства выработки произвольных контролируемых движений), Rood (основана на применении кожной сенсорной стимуляции в форме поверхностного постукивания, вибрации, нанесении тепловых или холодовых раздражений с целью облегчения или торможения тех или иных движений), «двигательного переучивания» Carr и Shepard (1976) (основанная на повторяющейся тренировке конкретных действий, в первую очередь стояния и ходьбы) и др.
По результатам многочисленных исследований доказано, что ранняя мобилизация и вертикализация пациента после инсульта благодаря широкому применению стандартной и нейрофизиологической лечебной гимнастики приводит к значительно лучшему функциональному восстановлению. К тому же данные мероприятия способствуют профилактике развития застойной пневмонии, пролежней и тромбофлебита нижних конечностей [57].
В последние годы изучаются новые методики постинсультной реабилитации и прилагаются усилия для того, чтобы найти более эффективные упражнения. Один из методов этой техники принудительной двигательной терапии заключается в интенсивном обучении в течение 2 недель паретичной конечности функционально ориентированным упражнениям, при этом непаретичную верхнюю конечность связывают, для того чтобы работала слабая верхняя конечность. Принудительная двигательная терапия создана благодаря существенным результатам небольших исследований постинсультной реабилитации, в которых предполагается, что улучшение функции может быть достигнуто даже у людей с хроническими, стойкими двигательными дефицитами [58]. Показано изменение функции коры на функциональной магнитно-резонансной томографии и транскраниальной магнитной стимуляции, связанное с принудительной двигательной терапией [47, 46]. В одном исследовании изучено применение этой техники у пациентов в ранний период после инсульта и была доказана безопасность, хорошая переносимость и положительный эффект этого метода [27]. Теоретическая база этих подходов остается неясной. Предположительно эффект этой терапии связан с предотвращением неиспользования пораженной конечности и мобилизацией сохранных, но неактивных корковых двигательных центров [56].
Физиотерапия. Из методов физиотерапии, традиционно используемых в реабилитации больных после инсульта, следует упомянуть мероприятия по уменьшению спастичности, которая вносит существенный вклад в инвалидизацию больных. Помимо лечения положением, позволяющим предотвратить развитие ранних контрактур и нормализовать рефлекс на растяжение, и ежедневных пассивных и пассивно-активных упражнений в медленном темпе, иногда с помощью специальных приспособлений, также предотвращающих развитие контрактур, уменьшающих гиперактивность рефлексов на растяжение и улучшающих моторный контроль, применяют криотерапию, гидротерапию, электростимуляцию мышц [18, 12].
Компьютеризированные и роботизированные системы кинезиотерапии. В последние годы появилось множество методик кинезиотерапии с использованием различных компьютеризированных и роботизированных систем. Успехи в роботостроении позволили разработать роботизированные системы, которые могут надежно и безопасно ассистировать во время проведения упражнений. Роботы функционируют под управлением специальных программ для оказания помощи при выполнении движений, сопротивления нежелательным движениям или даже оказания сопротивления запланированным движениям, чтобы обеспечить точность выполнения упражнений. У этой категории больных отмечено улучшение двигательной функции при выполнении упражнений на полуавтоматическом роботе в раннем восстановительном периоде после инсульта и у отдельных лиц со стойким хроническим двигательным дефицитом [29, 30]. Полученные результаты сохраняются длительное время [60]. Очевидно также качественное улучшение движения при реабилитации роботизированной верхней конечностью, которые после упражнений становятся более плавными и координированными [51]. Вероятно, один из механизмов действия данной методики это пластические изменения в двигательной коре головного мозга. Полуавтоматизированное роботизированное лечение в будущем может сочетаться с принудительной двигательной терапией. В конечном итоге, это способствует увеличению количества эффективных лечебных упражнений.
Тренировки в виртуальной реальности направлены на создание благоприятной окружающей обстановки для обучения двигательным навыкам. Комплекс для создания виртуальной реальности помимо компьютера включает многочисленные датчики движения и положения, очки с жидкокристаллическим монитором, куда непосредственно передается изображение. Упражнения проводят в специально отведенных помещениях. Наиболее часто с помощью виртуальной реальности моделируется комнаты с бытовой обстановкой и коридоры, по которым необходимо перемешаться. Эффективность применения разработанных систем для создания виртуальной в процессе реабилитации постинсультных больных и после черепно-мозговых травм показана в малых пилотных исследованиях [36, 38], но они не тестировались в хорошо контролируемых клинических испытаниях. На сегодняшний день системы виртуальной реальности в основном основаны на визуальных эффектах, хотя будущие системы позволят создавать еще и тактильные ощущения. Некоторые исследователи предпочитают применять неиммерсивные (немногонаправленные) тренировки в виртуальной реальности из-за более легкой переносимости и низкого риска развития побочных эффектов, такие как головокружение и тошнота. По этой причине тренировка в виртуальной окружающей обстановке должна быть направлена на компенсацию определенных двигательных навыков, поскольку в исследованиях на здоровых людях продемонстрирована при развитии побочных эффектов потеря эффективности комплексных упражнений в виртуальной реальности [45].
Для тренировки ходьбы на беговой дорожке используют специальные ремни, позволяющие частично уменьшить массу тела больного. В исследованиях на кошках с поврежденным спинным мозгом продемонстрировано эффективное облегчение генерирования паттерна ходьбы благодаря тренировкам на беговой дорожке. Существует гипотеза, что схожие тренировки у больных после инсульта могут стимулировать генерацию нарушенного паттерна ходьбы. И в некоторых исследованиях на людях наблюдалось улучшение ходьбы [35]. В других исследованиях обнаружено, что применение агрессивной тренировки ходьбы с использованием более обычной техники (т.е. интенсивная физиотерапия в паре с ранним укреплением нижних конечностей) может быть эффективна в одинаковой мере [44]. Эффективность тренировки на беговой дорожке зависит от скорости перемещения самой дорожки: в одном из исследований наблюдались более лучшие результаты восстановления ходьбы [50, 54]. Но метод тренировки очень трудозатратный, что является серьезным ограничивающим фактором для применения его в рутинной практике. Разработка роботизированных систем и тренировочных пособий для нижних конечностей сделает данный тип тренировок более выполнимым в будущем [34, 61].
Электромиографическая-биологическая обратная связь долгое время рассматривалась в качестве многообещающего метода для восстановления контроля над движениями после инсульта. Во многих случаях после инсульта сохраняется способность к незначительному произвольному контролю движений. Теоретически функциональная недостаточность сохранившихся областей центральной нервной системы может быть восполнена посредством обратной связи, что возможно доказывается на практике. Проведено множество испытаний электромиографической-биологической обратной связи [24] с противоречивыми результатами. Выполнено несколько мета-анализов в попытке определить пользу этой техники, но их результаты неоднозначны. В настоящее время недостаточно существующих высококачественных данных, чтобы категорически утверждать относительно эффективности электромиографической-биологической обратной связи. И недавнее хорошо разработанное крупное многоцентровое испытание, кажется, дало ответ на вопрос о широте применения этого метода. Использовалось несколько вариаций электромиографической-биологической обратной связи, включая электрогониометры для обеспечения обратной связи и силовой преобразователь. Результаты получились многообещающими, но окончательный вывод делать рано. Одно исследование свидетельствовало, что позиционная биологическая обратная связь может быть эффективнее электромиографической-биологической обратной связи. Эти системы разработаны, скорее, для обеспечения биологической обратной связи траектории движения, чем для суставного положения или мышечной силы. Для обеспечения силовой и позиционной биологической обратной связи, а также физического вспомогания для завершения двигательного акта может быть применен полуавтоматический робот. В конце концов, можно объединить роботизированные технологии со сложной биологической обратной связью в комбинированную тренировочную систему [52].
Функциональная электрическая стимуляция. При изучении эффективности функциональной электрической стимуляции для улучшения двигательных функций после инсульта получены различные результаты. И в мета-анализах, и в систематизированных обзорах обнаружено подтверждение эффективности функциональной электрической стимуляции в виде увеличения мышечной силы у больных после инсульта. Необходимо более определенное и крупное клиническое испытание, чтобы доказать целесообразность применения функциональной электрической стимуляции в этой категории больных. Функциональная электрическая стимуляция также была совмещена с электромиографической-биологической обратной связью с вполне успешными результатами. При использовании этого метода поверхностные электроды располагали над интересующими мышцами, которые регистрировали электромиографическую активность, а электрическая стимуляция обеспечивала необходимый мышечный тонус для мышечного сокращения и «завершения» движения. Функциональная электрическая стимуляция также была совмещена с позиционной биологической обратной связью: при достижении определенного суставного угла происходила мышечная стимуляция [33, 25].
Транскраниальная магнитная стимуляция. В настоящее время транскраниальную магнитную стимуляцию (ТКМС) рассматривают как один из перспективных методов восстановительного лечения у больных с патологией ЦНС, в том числе с двигательными и иными расстройствами после инсульта.
Воздействие ритмической ТКМС обладает следующими терапевтическими эффектами: непосредственное активирует сохранные двигательные нейроны прецентральной извилины, вероятно, способствует формированию новых синаптических связей; уменьшает дезадаптирующий эффект транссинаптической функциональной деактивации; вызывает транзиторное повышение регионарного мозгового кровотока; способствует снижению спастичности [55].
О позитивном влиянии ТКМС на двигательные функции конечностей сообщают Dafotakis M. et al. (2008), Takeuchi N. et al. (2009), Conforto A.B. et al. (2010) и др. Проведение ТКМС у больных с постинсультными гемипарезами способствовало более быстрому улучшению функции кисти, ходьбы, общей активности, бытовой адаптированности [28], причем удается достичь стойкого положительного отдаленного эффекта [30, 32].
Многочисленные исследования свидетельствуют о безопасности ТКМС в лечении больных с ишемическим или геморрагическим инсультом [23]. Процедура ТКМС может вызывать неприятные ощущения у больного, а стимуляция при более высоких интенсивностях и частотах обычно более болезненна. Болевые ощущения во время ритмической стимуляции напоминают таковые при повторной стимуляции периферических мышц лица или скальпа, что у части людей приводит к головным болям напряжения (примерно у 5-20% в разных исследованиях). Эти головные боли поддаются лечению ацетаминофеном или аспирином. В процессе ТКМС также возникает высокочастотный шум, который может вызвать кратковременное изменение слухового порога. Этого можно избежать, если больные используют заглушки для ушей [20]. Крайне минимальное повышение температуры мозговой ткани от воздействия магнитного поля не оказывает негативного воздействия на пациента [26]. В качестве осложнения описан случай развития у больного с инсультом кратковременного генерализованного судорожного приступа. Риск развития приступов связан с параметрами стимуляции, во всяком случае, не было ни одного сообщения о эпиприступах при одноимпульсной или низкочастотной ритмической ТКМС (1 Гц).
Медикаментозная коррекция спастичности. Миорелаксанты (толперизон, тизанидин, баклофен) — широко применяемая группа препаратов, способных тормозить полисинаптические спинальные рефлексы с меньшим влиянием на моносинаптические. Их успешно используют в реабилитации больных со спастическими параличами, в том числе после инсульта. Из побочных эффектов стоит отметить артериальную гипотензию, в ряде случаев ограничивающую их применение. К тому же у некоторых больных их миорелаксирующий эффект недостаточный либо непродолжительный, в связи с этим в последние годы все шире используют с обнадеживающими результатами локальные внутримышечные инъекции ботулинического токсина типа А. Терапевтическая активность препарата обусловлена его способностью вызывать обратимую химическую денервацию мышцы [1].
Реабилитация сенсорных и болевых синдромов . Гемигипоестезия и неглект (игнорирование пораженной половины тела или поля зрения) — симптомы поражения теменной доли головного мозга. Эффективные средства коррекции данных состояний практически не разработаны. Имеются обнадеживающие положительные результаты при ранней двигательной активации, тактильной и сенсорной электрической стимуляции пораженной конечности и ТКМС. На функциональной МРТ продемонстрировано, что пассивное тактильное раздражение пораженной конечности сопровождается изменением активности постцентральной извилины. Из препаратов стимулировать сенсорную активность головного мозга способен дофамин, но доказательства его эффективности весьма ограничены [57].
Значимую проблему в реабилитации представляет комплексный регионарный болевой синдром пояса верхней конечности на стороне гемипареза, ограничивающий объем движений в плечевом суставе, тем самым иммобилизуя руку. В основе синдрома лежит развитие трофических расстройств с присоединением артропатии плечевого сустава и выпадение головки плечевой кости из суставной впадины из-за растяжения суставной сумки, наступающей под действием тяжести паретичной руки и пареза мышц пояса верхней конечности. Реабилитационные мероприятия направлены на скорейшую максимально возможную мобилизацию и профилактику патологических установок пораженной конечности. При выпадении головки плечевой кости показаны ношение фиксирующей повязки, электростимуляция мышц плеча и плечевого пояса [6].
У 6-8% пациентов, перенесших инсульт, развивается центральный постинсультный болевой в результате поражения афферентных проводников головного мозга, чаще при поражении таламуса и прилежащих к нему областей, что приводит к деафферентации сохранных чувствительных корковых нейронов и возникновению болевого ощущения. Боль при этом носит невропатический характер (мучительная, трудно локализуемая, то есть ярко выраженное проявление протопатической чувствительности), усиливается при тактильных раздражениях или движении. Обычно центральный болевой синдром манифестирует через 3-4 месяца после инсульта, нередко на фоне регрессирующего гемипареза. Антиконвульсанты, такие как карбамазепин и габапентин, оказывая ГАМК-ергическое действие, способны уменьшить активность сохранных гиперактивных чувствительных нейронов, уменьшая тем сам болевое ощущение. Дополнительный эффект оказывает трициклический антидепрессант амитриптилин, наряду с воздействием на афферентную составляющую болевого синдрома непосредственно влияющий на ноцицептивную систему [32].
Реабилитация координаторных нарушений. Тренировка устойчивости в вертикальной позе одна из основных задач реабилитации в раннем восстановительном периоде после инсульта. У пациентов с постинсультными гемипарезами часто отмечают асимметрию вертикальной позы, вызванную смещением центра тяжести в сторону здоровой ноги, что способствует неустойчивости при ходьбе и повышает риск падения. Очевидно, смещение центра тяжести обусловлено не только пирамидной симптоматикой, но и уменьшением проприоцептивной афферентации от пораженной конечности и в более тяжелых случаях — неглектом.
С целью уменьшения асимметрии позы и улучшения устойчивости в вертикальном положении используют различные виды баланс-терапии: степ-тренировку, специальные лечебно-гимнастические упражнения и метод функционального биоуправления с обратной связью по статокинезограмме с применением компьютерно-стабилографического комплекса. Получены доказательства того, что тренировка равновесия после инсульта в независимости от выбранного метода способствует улучшению устойчивости пациента в вертикальной позе, уменьшает асимметрию шага при ходьбе, повышает скорость и правильность походки [6, 34].
В некоторых случаях ранняя вертикализация больного затруднительна из-за развития выраженной и трудно корригируемой ортостатической гипотензии. Методы же коррекции данного состояния весьма ограничены и сводятся в основном к постепенной тренировке в процессе лечебной физкультуры сердечно-сосудистой системы.
Реабилитация глазодвигательных и зрительных нарушений. Гомонимная гемианопсия — основной симптом поражения теменной доли при инсультах в вертебробазилярном бассейне, а также при окклюзии перфорирующих артерий, кровоснабжающих внутреннюю капсулу и глубокое белое вещество височной и теменной долей. Нередко гомонимная гемианопсия сочетается с нарушением следящих глазодвижений в сторону пораженного полушария. В основе коррекции гомонимной гемианопсии и вызванных ею глазодвигательных расстройств лежит тренировка зрительного поиска в процессе чтения или слежения за движущими объектами, что может способствовать увеличению амплитуды и точности саккадических глазодвижений в сторону гемианопсии [49].
С помощью оптической терапии, где используют призмы, зеркальные линзы и телескопические приборы, можно увеличить площадь сохранного зрительного поля. Чаще всего используют призмы, встроенные в одну или обе линзы очков, отражающие изображение, которое должно проецироваться на область гемианопсии. Таким образом, пациент может видеть изображение на стороне утраченного поля зрения. Применение данной терапии ограничено малой распространенностью и высокой стоимостью вышеперечисленных оптических приборов, к тому же у некоторых больных на фоне сниженных компенсаторных возможностей вестибулярной системы и нарушенных интегративных процессов возникает чувство головокружения, тошноты и иллюзии дрожания видимого изображения (осциллопсии) [43].
Коррекция дисфагии . Основные цели реабилитационных мероприятий при нейрогенной дисфагии включают нормализацию или улучшение глотания, устранение аспирации, восстановление иннервации. Спектр лекарственных средств для лечения дисфагии весьма ограничен. В редких случаях для уменьшения слюноотделения и накопления слюны в ротовой полости вследствие нарушенного глотания используют атропин и инъекции ботулинического токсина типа А в ушную железу. Большое значение приобретает диета, состоящая из пищи, которую легко проглотить. В некоторых случаях полезным оказывается компенсаторные методики глотания, изменяющие конфигурацию глотки и направление пищевого потока, предупреждая тем самым аспирацию и задержку болюса. Так, например, позиционные методики предполагают изменение положения головы и тела больного во время глотания, что в 75-80% случаев эффективно устраняет аспирацию [6]. К тому же разработаны специальные глотательные маневры, предназначенные для перевода специфических аспектов физиологии глотательных движений под произвольный контроль. Следует отметить, что выполнение глотательных маневров требует не только постоянного постороннего контроля, но и повышенных мышечных усилий. Из-за этого данная методика не применима у истощенных или слабоумных больных. При хронической аспирации единственным эффективным методом остается наложение трахеостомы, обеспечивающее адекватный туалет трахеобронхиальных дерева и действительно эффективно защищающее нижние дыхательные пути от попадания инородных веществ. В наиболее тяжелых случаях, когда глотание невозможно, применяют заместительный метод с нутритивной поддержкой, подразумевающий использование жидких форм пищи или смесей, поступающих в кишечник через трубки, которые помещены через нос, рот или чрескожно [1].
Коррекция речевых нарушений. Примерно у каждого третьего пациента с инсультом, локализующимся в левой гемисфере, развивается афазия, в 70% случаев сочетающаяся с парезом мышц языка, то есть речевые нарушения имеют сложное патогенетическое происхождение, что требует комплексного подхода к реабилитации. В основе восстановления речевых нарушений лежат многократно повторяемые упражнения на артикуляцию и фонацию, помогающие пациенту приспособиться к имеющемуся двигательному дефициту лицевой мускулатуры и языка. Также упражнения направлены на активацию сохранившихся речевых центров головного мозга. В процессе занятий пациент отрабатывает произношение отдельных букв, слов и коротких словосочетаний. Доказано, что пять или более часов занятий в неделю с логопедом оказывает значительно лучшее функциональное восстановление, чем самостоятельное занятие пациента. Особо эффективным оказывается групповое обучение пациента речи и письму. По результатам нескольких исследований получены свидетельства положительного влияния на некоторые речевые способности низкочастотной ТКМС при стимуляции области, проекционно соответствующей центру Брока [32].
Тем не менее полное восстановление речи, особенно при афазии, наблюдают крайне редко, что связано в первую очередь с органическим разрушением речевых центров. В частности, плохой прогноз наблюдают при обширном корково-подкорковом поражении доминантного полушария с распространением на обе речевые зоны (Брока и Вернике). Умеренной степени восстановление происходит при изолированной моторной или сенсорной афазии. Хорошее же восстановление возможно при корковых очагах в пределах одной речевой зоны с сохранностью подкорковых областей. Другой фактор, препятствующий восстановлению речи, — интеллектуальные расстройства пациента и недостаточная его приверженность к лечению. Часто ранее восстановленные речевые навыки вследствие нечастого их использования в повседневной жизни, например, из-за стеснения или боязни своего дефекта могут быть вновь потеряны либо пациенты ограничиваются произнесением элементарных звуков и слов. Для профилактики этого необходима как можно более ранняя социальная адаптация пациента, способствующая стимулированию использования вновь освоенных навыков и воспитанию самостоятельности в повседневной жизни [1].
Коррекция когнитивных нарушений. Наиболее сложной проблемой у данной категории больных остается восстановление когнитивных функций — памяти, внимания и праксиса. Основной принцип реабилитации включает занятия, направленные на активацию психической деятельности, такие как чтение, письмо, упражнения на развитие ассоциаций и памяти. В этом аспекте полезным оказывается обучение пациента работе со специальными обучающими компьютерными программами. Данный тип тренировок целесообразно сочетать с медикаментозной терапией. Доказанной эффективностью в качестве профилактики ухудшения когнитивных функций обладают ацетилсалициловая кислота, мемантин, нимодипин, статины, пентоксифилин. В то же время применение гипотензивных препаратов (ингибиторов АПФ), несмотря на профилактику развития повторного инсульта, слабо коррелирует с замедлением нарастания слабоумия, что, по всей видимости, связано с прогрессирующим атеросклеротическим поражением мелких сосудов головного мозга. В нескольких исследований получены доказательства, что ежедневные упражнения на память и внимание ассоциируются с восстановлением позднего компонента N140 соматосенсорных вызванных потенциалов, что отражает улучшение ассоциативных способностей головного мозга. Применение же электроакупунктуры и высокоинтенсивной низкочастотной чрескожной электрической стимуляции нервов (TENS) не оказывает положительного влияния на постинсультный когнитивный дефицит [57].
Экспериментальные подходы к реабилитации пациентов после инсульта. Основополагающим патоморфологическим субстратом при инсульте является некроз мозговой ткани, которая состоит из нейронов, их отростков и нейроглии. Базовый принцип терапии инсульта должен быть направлен на восстановление некротизированной ткани. Хотя достижение этой цели дело будущего, уже на современном этапе развития медицины возможно частичное восстановление поврежденных связей между нейронами и утраченных нейронов. Новые достижения в применении факторов роста для стимулирования репаративных процессов и нейрональных стволовых клеток для восполнения утраченных нейронов — активно и быстро развивающаяся область базовых медицинских исследований. В грядущих годах ранее начатое клиническое применение этих методов приобретет все большую значимость в качестве компонента реабилитации.
Факторы роста могут стимулировать дендритное и аксональное прорастание и увеличивать взаимосвязь существующих нейронов, также они стимулируют пролиферацию нейрональных стволовых клеток, которые в принципе способны заместить некоторые потерянные клетки. В исследованиях восстановительных процессов после инсульта обнаружены признаки аксонального прорастания и формирование новых синапсов. Прорастание аксонов зависит от активности больного в период раннего постинсультного восстановительного периода и обездвиженность может препятствовать этому процессу [40].
На животных продемонстрировано, что факторы роста улучшают восстановление после инсульта [41]. Также у животных пересадка генетически модифицированных фибробластов, экспрессирующих факторы роста, способствует аксональной регенерации и функциональному улучшению [48]. Результаты же клинических испытаний основных фибробластных факторов роста на человеке были неутешительными: наблюдались выраженные побочные эффекты и отсутствие очевидной эффективности. Изучается возможность применения в качестве постинсультной восстановительной терапии и других факторов роста [42].
Стволовые клетки — плюрипотенциальные (способные к дифференцировке в различных направлениях) предшественники клеток, сохраняющие способность регенерировать, а также дифференцироваться во многие зрелые типы клеток. Недавно в мозге млекопитающих были обнаружены нейрональные стволовые клетки [31]. Многообещающими оказались результаты исследований эффективности пересадки стволовых клеток после экспериментального инсульта у животных. В одном из этих исследований продемонстрировано уменьшение двигательного дефицита [59]. Полностью известны все факторы, модулирующие пролиферацию и дифференцировку эндогенных стволовых клеток [37]. Стратегия применения стволовых клеток включает использование факторов роста для стимуляции пролиферации, инъекции клеток, секретирующие локальные трофические факторы и пересадка экзогенных стволовых клеток. До настоящего времени этот подход остается экспериментальным и требует дальнейших исследований.
М.Ф. Ибрагимов, Ф.А. Хабиров, Т.И. Хайбуллин, Е.В. Гранатов
Республиканская клиническая больница восстановительного лечения МЗ РТ, г. Казань
Казанская государственная медицинская академия
Хайбуллин Тимур Ильдусович — кандидат медицинских наук, доцент кафедры неврологии и мануальной терапии
1. Белова А.Н. Нейрореабилитация / А.Н. Белова. — М. Антидор, 2002. — 568 с.
2. Верещагин Н.В. Гетерогенность инсульта: взгляд с позиций клинициста // Инсульт. Приложение к Журн. невр. и психиатр. — 2003. — Выпуск 9. — С. 8-9.
3. Верещагин Н.В. Принципы диагностики и лечения больных в остром периоде инсульта / Н.В. Верещагин, М.А. Пирадов, З.А. Суслина // Consilium medicum. — 2001. — № 5. — C. 221-225.
4. Гусев Е.И. Ишемия головного мозга / Е.И. Гусев, В.И. Скворцова. — М. Медицина, 2001. — 328 с.
5. Гусев Е.И. Неврология. Национальное руководство / Е.И. Гусев, А.Н. Коновалов, В.И. Скворцова и др. — М. ГЭОТАР-Медиа, 2009. — 1040 с.
6. Кадыков А.С. Реабилитация неврологических больных / А.С. Кадыков, Л.А. Черникова, Н.В. Шахпаронова. — М. МЕДпресс-информ, 2008. — 560 с.
7. Карлов В.А. Терапия нервных болезней / В.А. Карлов. — М. 1996. — 553 с.
8. Кузнецов А.Н. Ишемический инсульт и транзиторные ишемические атаки / А.Н. Кузнецов, В.И. Скворцова, Л.В. Стаховская, З.А. Суслина / Клинические рекомендации. Неврология и нейрохирургия [под. ред. Е.И Гусева, А.Н. Коновалова, А.Б. Гехт]. — М. ГЭОТАР-Медиа, 2007. — С. 129-177.
9. Кузнецов А.Н. Ишемический инсульт и транзиторные ишемические атаки / А.Н. Кузнецов, В.И. Скворцова, Л.В. Стаховская [и соавт.] / Клинические рекомендации. Неврология и нейрохирургия. [под. ред. Е.И Гусева, А.Н. Коновалова, А.Б. Гехт]. — М. ГЭОТАР-Медиа, 2007. — С. 129-177.
10. Ольбинская Л.И. Лечение артериальной гипертензии и профилактика инсульта / Л.И. Ольбинская // Инсульт. Приложение к Журн. невр. и психиатр. — 2001. — Выпуск 2. — С. 45-47.
11. Парфенов В.А. Антигипертензивная терапия в профилактике инсульта и когнитивных расстройств / В.А. Парфенов // Невр. журн. — 2006. — № 4. — С. 31-35.
12. Пономаренко Г.Н. Руководство по физиотерапии / Г.Н. Пономаренко, М.Г. Воробьев. — СПб: ИИЦ Балтика, 2005. — 396 с.
13. Скворцова В.И. Ишемический инсульт: патогенез ишемии и терапевтические подходы / В.И. Скворцова // Невр. журн. — 2001. — № 3. — С. 4-9.
14. Скворцова В.И. Принципы ранней реабилитации больных с инсультом / В.И. Скворцова, В.В. Гудкова, Г.Е. Иванова и др. // Инсульт. Приложение к Журн. невр. и психиатр. — 2002. — Выпуск 7. — С. 28-33.
15. Скворцова В.И. Результаты исследования MATCH свидетельствуют о преимуществе монотерапии клопидогрелем в качестве вторичной профилактики у больных с цереброваскулярной патологией / В.И. Скворцова, Н.А. Шамалов // Инсульт. Приложение к Журн. невр. и психиатр. — 2004. — Выпуск 11. — С. 7-12.
16. Суслина З.А. Лечение ишемического инсульта / З.А. Суслина // Лечение нервных болезней. — 2000. — № 1. — С. 3-7.
17. Тахавиева Ф.В. Нарушения двигательных функций при мозговом инсульте: оценка, реабилитация, прогноз: дисс. … д.м.н. — М. 2004. — 233 с.
18. Ушаков А.А. Современная физиотерапия в клинической практике / А.А. Ушаков. — М. 2002. — 364 с.
19. Шкловский В.М. Концепция нейрореабилитации больных с последствиями инсульта / В.М. Шкловский // Инсульт. Приложение к Журн. невр. и психиатр. — 2003. — Выпуск 8. — С. 10-23.
20. Afra J. Cortical excitability in migraine // J. Headache Pain. — 2000. — Vol. 2. — P. 73-81.
21. Bach-y-Rita P. Neural aspects of motor function as a basis of early and postacute rehabilitation / P. Bach-y-Rita, A. Brown, J. Lazarus [et al.] // In: Rehabilitation medicine; principles and practice. — 1993. — P. 381-403.
22. Burns M.S. Application of Neuroscience to Technology in Stroke Rehabilitation / M.S. Burns // Top Stroke Rehabil — 2008. — Vol. 15. — P. 570-579.
23. Caramia M.D. Ipsilateral activation of the unaffected motor cortex in patients with hemiparetic stroke / M.D. Caramia, M.G. Palmieri, P. Giacomoni [et al.] // Clin. Neurophysiol. — 2000. — Vol. 111. — P. 1990—1996.
24. Colborne G.R. Feedback of ankle joint angle and soleus electromyography in the rehabilitation of hemiplegic gait / G.R. Colborne, S.J. Olney, M.P. Griffin // Arch. Phys. Med. Rehabil. — 1993. — Vol. 74. — P. 1100—1106.
25. de Kroon J.R. Therapeutic electrical stimulation to improve motor control and functional abilities of the upper extremity after stroke: a systematic review / J.R. de Kroon, J.H. van der Lee, M.J. Ijzerman [et al.] // Clin. Rehabil. — 2002. — Vol. 16. — P. 350-360.
26. Dressler D. Safety aspects of transcranial brain stimulation in man tested by single photon emission-computed tomography / D. Dressler, E. Voth, M. Feldmann [et al.] // Neurosci. Lett. — 1990. — Vol. 119. — P. 153-155.
27. Dromerick A.W. Does the application of constraint-induced movement therapy during acute rehabilitation reduce arm impairment after stroke? / A.W. Dromerick, D.F. Edwards, M. Hahn // Stroke. — 2000. — Vol. 31. — P. 2984—2988.
28. Emara T.H. Repetitive transcranial magnetic stimulation at 1Hz and 5Hz produces sustained improvement in motor function and disability after ischaemic stroke / T.H. Emara, R.R. Moustafa, N.M. Elnahas [et al.] // Eur. J. Neurol. — 2010. — Vol. 17. — P. 1203—1209.
29. Fasoli S.E. Effects of robotic therapy on motor impairment and recovery in chronic stroke / S.E. Fasoli, H.I. Krebs, J. Stein [et al.] // Arch. Phys. Med. Rehabil. — 2003. — Vol. 84. — P. 477-482.
30. Ferraro M. Robot-aided sensorimotor arm training improves outcome in patients with chronic stroke / M. Ferraro, J.J. Palazzolo, J. Krol [et al.] // Neurology. — 2003. — Vol. 61. — P. 1604—1607.
31. Gage F.H. Mammalian neural stem cells / F.H. Gage // Science. — 2000. — Vol. 287. — P. 1433—1438.
32. Garrison S. Rehabilitation of the stroke patient / S. Garrison, L. Rolak // In: Rehabilitation medicine; principles and practice /Ed. by J.De Lisa, Lippincott Company,Philadelphia, 1993. — P. 801-823.
33. Glanz M. Functional electrostimulation in poststroke rehabilitation: a meta-analysis of the randomized controlled trials / M. Glanz, S. Klawansky, W. Stason [et al.] // Arch. Phys. Med. Rehabil. — 1996. — Vol. 77. — P. 549-553.
34. Hesse S. Gait pattern of several disabled hemiparetic subjects on a new controlled gait trainer as compared to assisted treadmill walking with partial body weight support / S. Hesse, D. Uhlenbrock, T. Sarkodie-Gyan // Clin. Rehabil. — 1999. — Vol. 12. — P. 401-410.
35. Hesse S. Restoration of gait in nonambulatory hemiparetic patients by treadmill training with partial bodyweight support / S. Hesse, C. Bertelt, A. Schaffrin [et al.] // Arch. Phys. Med. Rehabil. — 1994. — Vol. 75. — P. 1087—1093.
36. Holden M.K. Retraining movement in patients with acquired brain injury using a virtual environment / M.K. Holden, A. Dettwiler, T. Dyar [et al.] // Stud. Health Technol. Inform. — 2001. — Vol. 81. — P. 192-198.
37. Horner P.J. Regeneration in the adult and aging brain / P.J. Horner, F.H. Gage // Arch. Neurol. — 2002. — Vol. 59. — P. 1717—1720.
38. Jack, D. Virtual reality-enhanced stroke rehabilitation / D. Jack, R. Bojan, A.S. Merians [et al.] // IEEE Trans. Neural. Systems Rehab.Eng.— 2001. — Vol. 9. — P. 308-318.
39. Johansson B.B. Brain Plasticity and Stroke Rehabilitation / B.B. Johansson // Stroke — 2000. — Vol. 31. — P. 223-230.
40. Jones T.A. Use-dependent growth of pyramidal neurons after neocortical damage / T.A. Jones, T. Schallert // J. Neurosci. — 1994. — Vol. 14. — P. 2140—2152.
41. Kawamata T. Intracisternal basic fibroblast growth factor (bFGF) enhances functional recovery and upregulates the expression of a molecular marker of neuronal sprouting following focal cerebral infarction / T. Kawamata, W.D. Dietrich, T. Schallert [et al.] // Proc. Natl. Acad. Sci. USA. — 1997. — Vol. 94. — P. 8179—8184.
42. Kawamata T. The role of polypeptide growth factors in recovery from stroke / T. Kawamata, E.K. Speliotes, S.P. Finklestein // Adv. Neurol. — 1997. — Vol. 73. — P. 377-382.
43. Kerkhoff G. Neurovisual rehabilitation in cerebral blindness / G. Kerkhoff, U. Munssinger, K. Meier // Arch. Neurol. — 1994. — Vol. 51. — P. 474-481.
44. Kosak M.C. Comparison of partial body weight-supported treadmill gait training versus aggressive bracing assisted walking post stroke / M.C. Kosak, M.J. Reding // Neurorehabil. Neural. Repair. — 2000. — Vol. 14. — P. 13-19.
45. Kozak J.J. Transfer of training from virtual reality / J.J. Kozak, P.A. Hancock, E.J. Arthur [et al.] // Ergonomics. — 1993. — Vol. 36. — P. 777-784.
46. Levy C.E. Functional MRI evidence of cortical reorganization in upper-limb stroke hemiplegia treated with constraint-induced movement therapy / C.E. Levy, D.S. Nichols, P.M. Schmalbrock [et al.] // Am. J. Phys. Med. Rehabil. — 2001. — Vol. 80. — P. 4-12.
47. Liepert J. Treatment-induced cortical reorganization after stroke in humans / J. Liepert, H. Bauder, H.R. Wolfgang [et al.] // Stroke. — 2000. — Vol. 31. — P. 1210—1216.
48. Liu Y. Transplants of fibroblasts genetically modified to express BDNF promote regeneration of adult rat rubrospinal axons and recovery of forelimb function / Y. Liu, D. Kim, B.T. Himes [et al.] // J. Neurosci. — 1999. — Vol. 19. — P. 4370—4387.
49. Pelak V.S. Homonymous hemianopia: a critical analysis of optical devices, compensatory training, and NovaVision / V.S. Pelak, M. Dubin, E. Whitney // Curr. Treat. Options Neurol. — 2007. — Vol. 9. — P. 41-47.
50. Pohl M. Speeddependent treadmill training in ambulatory hemiparetic stroke patients: a randomized controlled trial / M. Pohl, J. Mehrholz, C. Ritschel [et al.] // Stroke. — 2002. — Vol. 33. — P. 553-558.
51. Rohrer B. Movement smoothness changes during stroke recovery / B. Rohrer, S. Fasoli, H.I. Krebs [et al.] // J. Neurosci. — 2002. — Vol. 22. — P. 8297—8304.
52. Schleenbaker R.E. Electromyographic biofeedback for neuromuscular reeducation in the hemiplegic stroke patient: a meta-analysis / R.E. Schleenbaker, A.G. Mainous // Arch. Phys. Med. Rehabil. — 1993. — Vol. 74. — P. 1301—1304.
53. Stein J. Motor Recovery Strategies After Stroke / J. Stein // Top Stroke Rehabil. — 2004. — Vol. 11. — P. 12-22.
54. Sullivan K.J. Step training with body weight support: effect of treadmill speed and practice paradigms on poststroke locomotor recovery / K.J. Sullivan, B.J. Knowlton, B.H. Dobkin // Arch. Phys. Med. Rehabil. — 2002. — Vol. 83. — P. 683-691.
55. Takeuchi N. Repetitive transcranial magnetic stimulation over bilateral hemispheres enhances motor function and training effect of paretic hand in patients after stroke / N. Takeuchi, T. Tada, M. Toshima [et al.] // J. Rehabil. Med. — 2009. — Vol. 41. — P. 1049—1054.
56. Taub E. Technique to improve chronic motor deficit after stroke / E. Taub, N.E. Miller, T.A. Novack [et al.] // Arch. Phys. Med. Rehabil. — 1993. — Vol. 74. — P. 347-354.
57. Teasell R. Evidence-based review of stroke rehabilitation: executive summary, 12th edition / R. Teasell, N. Foley, K. Salter [et al.] // Top Stroke Rehabil. — 2009. — Vol. 16. — P. 463-488.
58. van der Lee, J.H. Constraint-induced therapy for stroke: more of the same or something completely different? / J.H. van der Lee // Curr. Opinion Neurol. — 2001. — Vol. 14. — P. 741-744.
59. Veizovic, T. Resolution of stroke deficits following contralateral grafts of conditionally immortal neuroepithelial stem cells / T. Veizovic, J.S. Beech, R.P. Stroemer [et al.] // Stroke. — 2001. — Vol. 32. — P. 1012—1019.
60. Volpe B.T. Robot training enhanced motor outcome in patients with stroke maintained over 3 years / B.T. Volpe, H.I. Krebs, N. Hogan [et al.] // Neurology. — 1999. — Vol. 53. — P. 1874—1876.
61. Werner C. Treadmill training with partial body weight support and an electromechanical gait trainer for restoration of gait in subacute stroke patients: a randomized crossover trial / C. Werner, Von S. Frankenberg, T. Treig [et al.] // Stroke. — 2002. — Vol. 33. — P. 2895—2901.