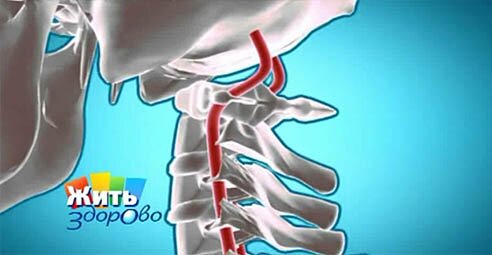
УЗИ сосудов головного мозга и шеи
Опубликовано 1 Июль, 2012
Читайте подробнее о режимах УЗИ .
УЗИ сосудов головного мозга и шеи — это ультразвуковое исследование состояния кровеносных сосудов шеи и головы как снаружи, так и внутри черепа. Процедура безопасна и абсолютно безболезненна. Во время УЗИ пациент сидит или лежит на кушетке, поворачиваясь к специалисту нужным участком головы и шеи. Длительность УЗИ — до 30-40 минут. в конце выдается протокол исследования с заключением врача.
Другое название УЗИ сосудов головного мозга — нейросонография .
Кровоснабжение головного мозга
Кровеносные сосуды головного мозга :
- две внутренние сонные артерии (каротидный бассейн, 70-85% кровоснабжения мозга) и две позвоночные артерии (вертебро-базилярный бассейн, 15-30%) образуют артериальное кольцо на основании мозга (Виллизиев круг). Позвоночные артерии кровоснабжают задние отделы головного мозга (мозжечок и продолговатый мозг).
- глубокие и поверхностные вены головного мозга, венозная кровь от которых попадает в две яремные вены на шее. Имеются и позвоночные вены .
Теория: как кровоснабжается головной мозг .
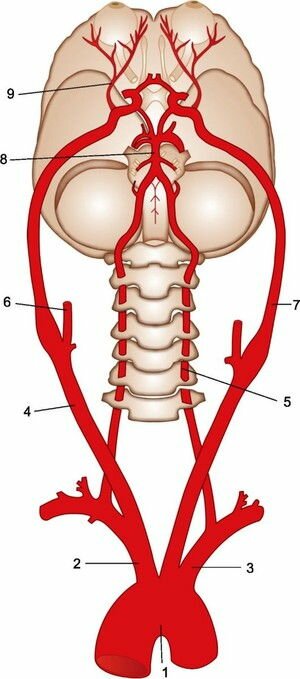
Кровоснабжение головного мозга (вид снизу).
От дуги аорты (1) по очереди отходят плечеголовной ствол (2), левая общая сонная артерия и левая подключичная артерия (3). С каждой стороны общая сонная артерия (правая — 4) делится на наружную (правая — 6) и внутреннюю. Внутренние сонные артерии (левая — 7) идут к головному мозгу и кровоснабжают его передние отделы, а также глаз (глазная артерия — 9).
От подключичной артерии с каждой стороны отходит позвоночная артерия (левая позвоночная артерия — 5). Позвоночные артерии проходят в отверстиях поперечных отростков шейных позвонков. В полости черепа на основании мозга 2 позвоночные артерии соединяются в одну базилярную (основную) артерию (8).
Две внутренние сонные артерии содиняются между собой и базилярной артерией с помощью соединительных ветвей, в 25-50% случаев образуя артериальное кольцо — Виллизиев круг. который позволяет отделам мозга не погибнуть, если кровоток по 1 из 4 артерий к мозгу вдруг прекратится. При хроническом нарушении кровоснабжения головного мозга по позвоночным артериям возникает вертебро-базилярная недостаточность .
Режимы УЗИ сосудов головного мозга и шеи
Для полноты исследования сосудов головы и шеи УЗИ проводится в нескольких режимах последовательно или одновременно:
- B-режим (двухмерный) — в этом режиме получают полную информацию о структуре сосуда и окружающих тканей и минимальную информацию о кровотоке. В B-режиме УЗИ исследуют только сосуды шеи и сосуды головы за пределами черепа. В B-режиме можно изучать вещество головного мозга. но исследовать сосуды головного мозга внутри черепа в этом режиме принципиально невозможно.
- дуплексное сканирование — в этом режиме УЗИ получают подробную информацию о кровотоке в сосуде. С помощью дуплексного сканирования можно исследовать не только сосуды шеи и головного мозга за пределами черепа, но и внутри черепа. В последнем случае дуплексное сканирование называется транскраниальным (от слова cranium — череп ).
На этой странице далее изложена информация о двухмерном (B-режиме) УЗИ сосудов головного мозга и шеи, но для полноты исследования необходим следующий этап УЗИ — дуплексное сканирование .
Одно из официальных названий — ультразвуковая допплерография магистральных сосудов головы (УЗДГ).
Исследуемые параметры
Если при оценке состояния артерий возможна четкая визуализация сосудистой стенки и просвета (плечеголовной ствол, сонные и позвоночные артерии вне черепа. артерии рук и ног), то в В-режиме оценивают следующие параметры:
- проходимость сосуда,
- геометрию сосуда (соответствие хода сосуда анатомической траектории),
- диаметр просвета сосуда,
- состояние сосудистой стенки (целостность, толщину комплекса «интима-медиа» — внутренняя и средняя оболочка, эхогенность, степень разделения на слои, форму поверхности);
- состояние просвета сосуда (наличие, расположение, протяженность, эхогенность внутрипросветных образований, степень нарушения проходимости);
- состояние тканей вокруг сосуда (наличие, форма, степень, причина внесосудистого воздействия).
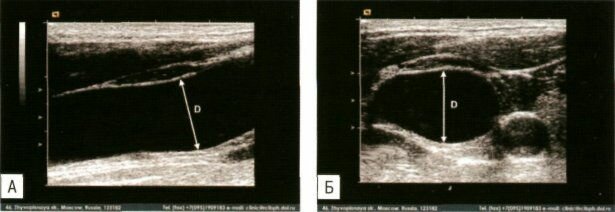
Измерение диаметра внутренней яремной вены
(А — продольное сканирование, Б — поперечное).
Для осмотра обычно используются датчики УЗИ линейного формата с частотой 5-15 МГц — в зависимости от задач исследования и глубины расположения сосуда.
Показания к УЗИ сосудов головного мозга
Показаниями к направлению на УЗИ сосудов головного мозга и шеи являются:
- клинические признаки острой или хронической недостаточности сосудов головного мозга, в том числе синдром головной боли;
- наличие факторов риска поражения сосудов головного мозга (курение, гиперлипидемия, артериальная гипертензия, сахарный диабет, ожирение);
- признаки поражения других артериальных бассейнов при системном характере сосудистой патологии;
- планирование операции по поводу различных видов сердечной патологии, в первую очередь ИБС (аортокоронарное шунтирование);
- патология окружающих органов и тканей. являющаяся возможным источником внесосудистых воздействий.
Цели исследования сосудов головы и шеи
Цели ультразвукового исследования сосудов головного мозга вне и внутри черепа:
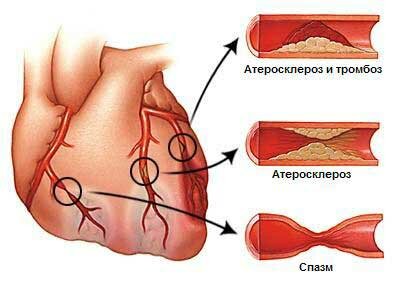
- обнаружение стенозов (сужений) и закупорки в сосудах головного мозга, оценка их значимости в развитии заболевания и в нарушении кровотока,
- обнаружение комплекса нарушений, вызванных наличием системного сосудистого заболевания,
- обнаружение первых (доклинических) признаков системной сосудистой патологии,
- контроль эффективности лечения,
- оценка местных и центральных механизмов регуляции тонуса сосудов,
- оценка резервных возможностей кровообращения в сосудах головного мозга,
- обнаружение пороков развития сосудов, аневризм, соустий, спазма сосудов, нарушений венозного кровообращения,
- оценка роли обнаруженной патологии в происхождении клинических симптомов у пациента.
Главный вопрос, на который должен ответить специалист ультразвуковой диагностики врачу-клиницисту после проведения УЗИ: способны ли обнаруженные изменения стать причиной развития имеющихся у пациента клинических симптомов? Кроме того, в большинстве случаев комплексное УЗИ сосудов головного мозга и шеи позволяет решить вопрос о целесообразности проведения операции.
Сосудистая мозговая недостаточность: клиника, диагностика и терапия
РЕКЛАМА
Инсульт и хронические формы сосудистой мозговой недостаточности представляют собой одну из наиболее актуальных проблем современной неврологии. По эпидемиологическим данным, заболеваемость инсультом в мире составляет 150 случаев на 100 тыс. населения в год. Весьма широко распространена также хроническая недостаточность кровоснабжения головного мозга.

В отечественной литературе для обозначения клинического синдрома поражения головного мозга в результате недостаточности кровоснабжения мозга обычно используется термин «дисциркуляторная энцефалопатия» (ДЭ). Согласно классификации сосудистых заболеваний головного мозга, предложенной Е. В. Шмидтом (1985), дисциркуляторная энцефалопатия относится к хроническим нарушениям мозгового кровообращения.
Сосудистые заболевания головного мозга (Е. В. Шмидт и соавт. 1985)
– Ишемический инсульт (тромботический, эмболический, гемодинамический, лакунарный)
– Геморрагический инсульт (паренхиматозное кровоизлияние, субарахноидальное кровоизлияние)
*Преходящие нарушения мозгового кровообращения
– Транзиторные ишемические атаки
– Гипертонические церебральные кризы
*Начальные проявления недостаточности кровоснабжения мозга
*Дисциркуляторная энцефалопатия
Однако, как показывают современные исследования, разнообразные сердечно-сосудистые заболевания, как правило, приводят одновременно и к хронической ишемии головного мозга, и к повторным острым нарушениям мозгового кровообращения. Поэтому правильнее было бы определить дисциркуляторную энцефалопатию как синдром хронического прогрессирующего поражения головного мозга, в основе которого лежат повторные инсульты и/или хроническая недостаточность кровоснабжения головного мозга (Н. Н. Яхно, И. В. Дамулин, 2001).
Этиология и патогенез ДЭ
Наиболее частыми причинами нарушения кровоснабжения головного мозга являются атеросклероз магистральных артерий головы, заболевания сердца с высоким риском тромбоэмболии в головном мозге и гипертоническая болезнь. Реже нарушения мозгового кровообращения развиваются в результате воспалительных изменений сосудов (васкулитов), нарушений свертывающей системы крови, аномалий развития сосудов и т. д. В подавляющем большинстве случаев сосудистая мозговая недостаточность развивается у лиц пожилого возраста, страдающих указанными выше сердечно-сосудистыми заболеваниями.
Как следует из определения ДЭ, в формировании данного синдрома играют роль 2 основных патогенетических механизма: инсульт и хроническая ишемия головного мозга. Ишемические инсульты головного мозга развиваются в результате тромбоза церебральных артерий, тромбоэмболии в головной части мозга, артериолосклероза, реологических и гемодинамических нарушений.
В основе хронической ишемии головного мозга лежат структурные изменения сосудистой стенки, которые возникают как следствие длительной артериальной гипертензии или атеросклеротического процесса. Установлено, что липогиалиноз сосудов небольшого калибра, пенетрирующих вещество головного мозга, может приводить к хронической ишемии глубинных отделов белого вещества. Отражением этого процесса являются изменения белого вещества (лейкоареоз), которые определяются как очаговые или диффузные изменения интенсивности сигнала от глубинных церебральных структур на Т2-взвешенных изображениях при магнитно-резонансной томографии головного мозга. Данные нарушения рассматриваются как типичные нейровизуализационные симптомы, развивающиеся у пациентов с длительной неконтролируемой артериальной гипертензией.
Клинические проявления ДЭ
Клиническая картина ДЭ весьма вариабельна. Как уже указывалось выше, большинство пациентов с хроническими сосудистыми заболеваниями головного мозга в анамнезе имеют инсульты, нередко неоднократные. Локализация перенесенных инсультов, несомненно, во многом определяет особенности клиники. Однако в подавляющем числе случаев при цереброваскулярной патологии, наряду с последствиями перенесенных инсультов, присутствуют также неврологические, эмоциональные и когнитивные симптомы дисфункции лобных долей головного мозга. Данная симптоматика развивается в результате нарушения связей между лобной корой и подкорковыми базальными ганглиями (феномен «разобщения»). Причина «разобщения» заключается в диффузных изменениях белого вещества головного мозга, которые, как говорилось выше, являются следствием патологии церебральных сосудов небольшого калибра.
В зависимости от выраженности нарушений, принято выделять 3 стадии дисциркуляторной энцефалопатии. Первая стадия характеризуется преимущественно субъективной неврологической симптоматикой. Пациенты жалуются на головную боль, головокружение, тяжесть или шум в голове, расстройства сна, повышенную утомляемость при физических и умственных нагрузках. В основе указанных симптомов лежит легкое или умеренное снижение фона настроения, связанное с дисфункцией лобных долей головного мозга. Объективно выявляются легкие нарушения памяти и внимания, а также, возможно, других когнитивных функций. Могут отмечаться асимметричное повышение сухожильных рефлексов, неуверенность при выполнении координаторных проб, легкие изменения походки. Важное значение в диагностике сосудистой мозговой недостаточности на данном этапе патологического процесса имеют инструментальные методы исследования, которые позволяют обнаружить патологию церебральных сосудов.
О второй стадии дисциркуляторной энцефалопатии говорят в тех случаях, когда неврологические или психические нарушения формируют клинически очерченный синдром. Например, речь может идти о синдроме умеренных когнитивных расстройств. Данный диагноз правомерен в тех случаях, когда нарушения памяти и других когнитивных функций явно выходят за рамки возрастной нормы, но не достигают выраженности деменции. На второй стадии ДЭ могут развиваться также такие неврологические нарушения, как псевдобульбарный синдром, центральный тетрапарез, как правило, асимметричный, экстрапирамидные расстройства в виде гипокинезии, легкого или умеренного повышения мышечного тонуса по пластическому типу, атактический синдром, неврологические расстройства мочеиспускания и др.
На третьей стадии дисциркуляторной энцефалопатии отмечается сочетание нескольких из указанных выше неврологических синдромов и, как правило, присутствует сосудистая деменция. Сосудистая деменция является одним из наиболее тяжелых осложнений, развивающихся при неблагоприятном течении сосудистой мозговой недостаточности. По статистике сосудистая этиология лежит в основе не менее 10–15% деменций в пожилом возрасте.
Сосудистая деменция, как и ДЭ в целом, является патогенетически разнородным состоянием. Сосудистая деменция возможна после единичного инсульта в стратегической для когнитивной деятельности зоне головного мозга. Так, например, деменция может развиваться остро в результате инфаркта или кровоизлияния в таламус. Однако значительно чаще сосудистая деменция вызвана повторными инсультами (так называемая мультиинфарктная деменция). Другой патогенетический механизм сосудистой деменции — хроническая ишемия головного мозга, отражением которой являются изменения белого вещества головного мозга. Наконец, помимо ишемии и гипоксии головного мозга в патогенезе деменции при сосудистой мозговой недостаточности, по крайней мере у части пациентов с ДЭ, важную роль играют вторичные нейродегенеративные изменения. Современные исследования убедительно доказали, что недостаточность кровоснабжения головного мозга — значимый фактор риска развития дегенеративных заболеваний центральной нервной системы, в частности болезни Альцгеймера. Присоединение вторичных нейродегенеративных изменений, несомненно, усугубляет и модифицирует когнитивные расстройства при сосудистой мозговой недостаточности. В таких случаях правомерен диагноз смешанной (сосудисто-дегенеративной) деменции.
Клинические проявления сосудистой деменции в каждом конкретном случае зависят от определяющих заболевание патогенетических механизмов. При постинсультной и мультиинфарктной деменции особенности клиники зависят от локализации инсультов. Изменения белого вещества глубинных долей головного мозга в результате хронической ишемии приводят к когнитивным нарушениям по «лобному» типу. Для данных нарушений типичны эмоциональные расстройства в виде снижения фона настроения, подавленности или апатии, утраты интереса к окружающему. Весьма характерна также эмоциональная лабильность, которая представляет собой быструю, иногда беспричинную смену настроения, плаксивость или повышенную раздражительность. В когнитивной сфере определяются нарушения памяти и внимания, замедленность мышления, снижение интеллектуальной гибкости, трудности, связанные с переключением от одного вида деятельности к другому. Изменяется поведение больных: снижаются способность к самокритике и чувство дистанции, отмечаются повышенная импульсивность и отвлекаемость, могут присутствовать такие симптомы, как пренебрежение принятыми в обществе правилами поведения, асоциальность, дурашливость, плоский и неуместный юмор и т. д.
Наличие вторичных нейродегенеративных изменений при сосудистой деменции проявляется прежде всего прогрессирующими нарушениями памяти. При этом в большей степени пациент забывает то, что случилось недавно, в то время как воспоминания об отдаленных событиях сохраняются достаточно долго. Для нейродегенеративного процесса весьма характерны также нарушения пространственной ориентировки и речи.
Диагностика дисциркуляторной энцефалопатии
Для диагностики синдрома дисциркуляторной энцефалопатии необходимо тщательное изучение анамнеза заболевания, оценка неврологического статуса, применение нейропсихологических и инструментальных методов исследования. Важно подчеркнуть, что присутствие сердечно-сосудистых заболеваний у пожилого человека само по себе еще не служит доказательством наличия сосудистой мозговой недостаточности. Необходимым условием правильной диагностики является получение убедительных доказательств наличия причинно-следственной связи между неврологическими и когнитивными симптомами и цереброваскулярной патологией, что нашло отражение в принятых сегодня диагностических критериях ДЭ.
Диагностические критерии ДЭ (Н. Н. Яхно, И. В. Дамулин, 2001)
- Наличие признаков (клинических, анамнестических, инструментальных) поражения головного мозга.
- Наличие признаков острой или хронической церебральной дисциркуляции (клинических, анамнестических, инструментальных).
- Наличие причинно-следственной связи между нарушениями гемодинамики и развитием клинической, нейропсихологической, психиатрической симптоматики.
- Клинические и параклинические признаки прогрессирования сосудистой мозговой недостаточности.
Подтверждениями сосудистой этиологии симптомов будут наличие очаговой неврологической симптоматики, инсульт в анамнезе, характерные изменения при нейровизуализации, такие, как постишемические кисты или выраженные изменения белого вещества.
Лечение сосудистой мозговой недостаточности
Недостаточность мозгового кровообращения представляет собой осложнение различных сердечно-сосудистых заболеваний. Поэтому этиотропная терапия ДЭ должна быть, в первую очередь, направлена на лежащие в основе сосудистой мозговой недостаточности патологические процессы, такие, как артериальная гипертензия, атеросклероз магистральных артерий головы, заболевания сердца и др.
Проведение антигипертензивной терапии является существенным фактором вторичной профилактики нарастания психических и двигательных симптомов сосудистой мозговой недостаточности. До настоящего времени, однако, не решен вопрос о том, каких показателей артериального давления следует добиваться при лечении гипертензии. Большинство неврологов полагают, что полная нормализация артериального давления у пожилых пациентов с длительным анамнезом гипертензии, уменьшая риск острых сосудистых эпизодов, может одновременно способствовать усугублению хронической ишемии мозга и нарастанию выраженности нарушений когнитивных функций по «лобному» типу.
Наличие гемодинамически значимого атеросклероза магистральных артерий головы требует назначения антиагрегантов. К препаратам с доказанной антиагрегатной активностью относятся ацетилсалициловая кислота вдозах 75-300 мг в сутки и клопидогрель (плавикс) в дозе 75 мг в сутки. Исследование показали, что назначение данных препаратов снижает риск развития ишемических событий (инфаркт миокарда, ишемический инсульт, периферические тромбозы) на 20-25%. В настоящее время доказанавозможность одновременного применения указанных препаратов. К лекарственным средствам, обладающим антиагрегантными свойствами, относится также дипиридамол (курантил), который применяется в дозах 25 мг три раза в день. Монотерапия данным препаратом не обеспечивает профилактики церебральной или иной ишемии, однако при сочетанном применении дипиридамол достоверно увеличивает профилактический эффект ацетилсалициловой кислоты. Помимо назначения антиагрегантов наличие атеросклеротического стеноза магистральных артерий головы требует направления больного на консультацию к сосудистому хирургу для решения вопроса о целесообразности хирургического вмешательства.
При наличии высокого риска тромбоэмболии в головной части мозга, например в случаях мерцательной аритмии предсердий и клапанных пороков, антиагреганты могут быть малоэффективны. Перечисленные состояния служат показанием к назначению непрямых антикоагулянтов. Препаратом выбора является варфарин. Терапию непрямыми антикоагулянтами следует проводить под строгим контролем показателей коагулограммы.
Наличие гиперлипидемии, не корригируемой соблюдением диеты, требует назначения гиполипидемических препаратов. Наиболее перспективны препараты из группы статинов (зокор, симвор, симгал, ровакор, медостатин, мевакор и др.). По некоторым данным, терапия этими средствами не только нормализует липидный обмен, но и, возможно, обладает профилактическим эффектом в отношении развития вторичного нейродегенеративного процесса на фоне сосудистой мозговой недостаточности.
Важным патогенетическим мероприятием является также воздействие на другие известные факторы риска ишемии головного мозга. К ним относятся курение, сахарный диабет, ожирение, гиподинамия и др.
При наличии сосудистой мозговой недостаточности патогенетически обосновано назначение препаратов, воздействующих преимущественно на микроциркуляторное русло. К их числу относятся:
- ингибиторы фосфодиэстеразы: эуфиллин, пентоксифиллин, винпоцетин, танакан и др. Сосудорасширяющий эффект данных препаратов связан с увеличением в гладкомышечных клетках сосудистой стенки содержания цАМФ, что приводит к их расслаблению и увеличению просвета сосудов;
- блокаторы кальциевых каналов: циннаризин, флюнаризин, нимодипин. Оказывают вазодилатирующий эффект благодаря уменьшению внутриклеточного содержания кальция в гладкомышечных клетках сосудистой стенки. Клинический опыт свидетельствует о том, что блокаторы кальциевых каналов, например циннаризин и флюнаризин, возможно, более эффективны при недостаточности кровообращения в вертебрально-базилярной системе; это проявляется такими симптомами, как головокружение и неустойчивость при ходьбе;
- блокаторы α2 -адренорецепторов: ницерголин. Данный препарат устраняет сосудосуживающее действие медиаторов симпатической нервной системы: адреналина и норадреналина.
Вазоактивные препараты являются одними из наиболее часто назначаемых препаратов в неврологической практике. Помимо сосудорасширяющего действия многие из них обладают также положительными метаболическими эффектами, что позволяет использовать данные препараты в качестве симптоматической ноотропной терапии. Экспериментальные данные свидетельствуют о наличии у вазоактивного препарата танакан способности дезактивировать свободные радикалы, уменьшая тем самым процессы перекисного окисления липидов. Антиоксидантные свойства данного препарата позволяют использовать его также для вторичной профилактики нарастания нарушений памяти и других когнитивных функций в случаях присоединения вторичных нейродегенеративных изменений.
В отечественной практике вазоактивные препараты принято назначать курсами по 2-3 мес 1-2 раза в год.
Широко применяется при сосудистой мозговой недостаточности метаболическая терапия, целью которой является стимуляция репаративных процессов головного мозга, связанных с нейрональной пластичностью. Кроме того, метаболические препараты оказывают симптоматический ноотропный эффект.
Пирацетам был первым препаратом, специально синтезированным для воздействия на память и другие высшие мозговые функции. В последние годы, однако, удалось доказать, что в принятых ранее дозах данный препарат оказывает относительно небольшой клинический эффект. Поэтому в настоящее время рекомендуется использование пирацетама в дозировках не менее 4–12 г/сут. Более целесообразны внутривенные введения данного препарата на физиологическом растворе: 20–60 мл пирацетама на 200 мл физиологического раствора внутривенно капельно, 10–20 вливаний на курс.
Пептидергический препарат церебролизин не менее успешно применяется при сосудистой мозговой недостаточности, а также сосудистой и дегенеративной деменции. Как и в случае с пирацетамом, в последние годы существенно изменились взгляды на режим дозирования данного препарата. Согласно современным представлениям, клинический эффект наступает в случае внутривенных введений церебролизина в дозах 30–60 мл внутривенно капельно на 200 мл физиологического раствора, 10–20 вливаний на курс.
К пептидергическим препаратам, благоприятно влияющим на церебральный метаболизм, относится также актовегин. Актовегин применяется в виде внутривенных инфузий (250–500 мл на инфузию, 10–20 инфузий на курс), либо в виде внутривенных или внутримышечных инъекций по 2–5 мл 10 — 20 инъекций, либо внутрь по 200 — 400 мг 3 раза в сутки в течение 2-3 мес.
Как и вазоактивные препараты, метаболическая терапия проводится курсами 1-2 раза в год. Патогенетически оправданным и целесообразным является сочетанное проведение вазоактивной и метаболической терапии. В настоящее время в распоряжении врача имеется несколько комбинированных лекарственных форм, в состав которых входят действующие вещества с вазоактивным и метаболическим эффектами. К числу таких препаратов относятся инстенон, винпотропил, фезам и некоторые другие.
Развитие синдрома сосудистой деменции требует проведения более интенсивной ноотропной терапии. Из современных ноотропных препаратов наиболее мощным клиническим эффектом в отношении когнитивных функций обладают ингибиторы ацетилхолинэстеразы. Первоначально препараты данной группы использовались в лечении легкой и умеренной деменции при болезни Альцгеймера. Сегодня доказано, что ацетилхолинергическая недостаточность играет важную патогенетическую роль не только при этом заболевании, но также при сосудистой и смешанной деменции. Поэтому когнитивные расстройства сосудистой и смешанной этиологии все чаще фигурируют среди показаний к назначению ингибиторов ацетилхолинэстеразы.
В России на сегодняшний день доступны 2 препарата из группы ингибиторов ацетилхолинэстеразы последнего поколения: экселон и реминил. Экселон назначается в начальной дозе 1,5 мг 2 раза в день, далее разовая доза увеличивается на 1,5 мг каждые 2 нед. до 6,0 мг 2 раза в день или до возникновения побочных эффектов. Частыми побочными эффектами при использовании экселона являются тошнота и рвота. Данные явления не представляют угрозы для жизни или здоровья пациента, но могут препятствовать достижению терапевтического эффекта. Реминил назначается по 4 мг 2 раза в день в течение первых 4 нед, а затем по 8 мг 2 раза в день. Данный препарат реже вызывает нежелательные явления.
К ингибиторам ацетилхолинэстеразы первого поколения относится нейромидин. По некоторым данным, этот препарат оказывает положительный ноотропный эффект как при сосудистой, так и при первично-дегенеративной и смешанной деменции. Он назначается в дозе 20–40 мг 2 раза в день.
Терапия ингибиторами ацетилхолинэстеразы должна проводиться постоянно. При этом необходимо 1 раз в 3–6 мес контролировать уровень печеночных ферментов в крови.
Патогенетически обосновано при сосудистой деменции также назначение акатинола мемантина. Данный препарат является ингибитором NMDA-рецепторов к глютамату. Постоянный прием акатинола мемантина оказывает симптоматический ноотропный эффект, а также, возможно, замедляет темпы нарастания когнитивных расстройств. Действие препарата проявлялось как при легкой и умеренной, так и при тяжелой деменции. Следует отметить, что акатинол мемантин — это единственный препарат, эффективный на стадии тяжелой деменции. Он назначается в течение первой недели по 5 мг 1 раз в день, в течение второй недели — по 5 мг 2 раза в день, начиная с третьей недели и далее постоянно — по 10 мг 2 раза в день.
В заключение следует подчеркнуть, что всесторонняя оценка состояния сердечно-сосудистой системы пациентов с сосудистой мозговой недостаточностью, а также воздействие как на причину нарушений, так и на основные симптомы ДЭ, несомненно, способствуют повышению качества жизни пациентов и предотвращению тяжелых осложнений сосудистой мозговой недостаточности, таких, как сосудистая деменция и двигательные расстройства.
В. В. Захаров, доктор медицинских наук
Клиника нервных болезней им. А. Я. Кожевникова, Москва
Сочетанная патология магистральных артерий головы — Патология головного мозга при атеросклерозе и артериальной гипертонии
Страница 8 из 32
Сочетанная патология магистральных артерий головы, экстра- и интрацеребральных артерий
К сочетанной патологии артерий мозга при атеросклеротической ангиопатии относятся две основные формы. Первая — это так называемый эшелонированный, или тандемный атеростеноз, при котором стенозирующие бляшки располагаются в разных отделах внутренней сонной артерии, чаще в ее синусе и сифоне, или в ней же и в одной из церебральных артерий, чаще средней мозговой, с той же стороны. То же самое относится и к вертебрально-базилярной системе: стенозирующие бляшки располагаются в разных отделах позвоночной артерии или в ней же и в ее ветвях, чаще в нижней задней мозжечковой, или бляшки располагаются в позвоночной и базилярной артериях и их ветвях. Эшелонированные атеростенозы могут наблюдаться не только в каротидной и вертебрально-базилярной артериальных системах с обязательным участием МАГ, но и в одной из церебральных артерий, т.е. в основном стволе и ветвях этой артерии.
Эшелонированный стеноз является тяжелой формой атеросклеротической ангиопатии даже в том случае, если имеются лишь две стенозирующие бляшки, расположенные по направлению кровотока в сосуде или сосудах какой-либо из систем (каротидной или вертебрально-базилярной). В практике, как правило, встречаются множественные стенозирующие бляшки в артериях каждой из указанных систем или в одной церебральной артерии и ее ветвях — это "глубоко" эшелонированный атеростеноз. К этому следует добавить, что эшелонированный атеростеноз всегда сопровождается перекалибровкой не только экстрацеребральных, но и интрацеребральных артерий вплоть до мельчайших, а также резко выраженными изменениями МЦР, характерными для хронической гипоксии.
Если для описанной первой формы сочетанной патологии артерий мозга типична локализация стенозирующих бляшек "по вертикали", т.е. по направлению кровотока в сосудах, то для второй формы характерна локализация стенозирующих бляшек "по горизонтали", т.е. в артериях каротидной или вертебрально-базилярной систем с обеих сторон, или в этих же системах с одной стороны. Нередко встречается сочетание атеростеноза не только в одноименных, но и в разноименных системах, причем число вариантов может быть весьма значительным. По тяжести и распространенности эта форма сочетанной патологии артерий мозга не уступает эшелонированному атеростенозу и также служит проявлением тяжелой атеросклеротической ангиопатии. В практике нередко наблюдается комбинация этих двух форм сочетанной патологии артерий мозга в одном и том же случае с развитием тяжелой патологии мозга.
На основании результатов исследования церебральной гемодинамики в сочетании с данными ангиографии и КТ мозга установлено, что при множественной дометанной патологии
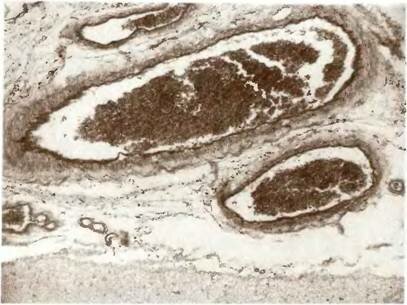
Рис. 9. Расширение просветов ветвей конвекситальной поверхности полушария большого мозга после операции наложения экстра- и интракраниального микроанастомоза.
Окраска фукселином на эластические волокна. х100.
артерий, питающих мозг, стабильность мозгового кровообращения нарушается и мозговой кровоток снижается, если суммарный стеноз артерий превышает 40 %. Стабильность мозгового кровотока является показателем сохранности его саморегуляции. "Запас" (резерв) этой стабильности при сосудистой патологии получил название гемодинамического, или цереброваскулярного, резерва мозга. Его следует учитывать при уточнении показаний к ангиохирургическим операциям [Малышев Н.В. и др. 1987; Верещагин Н.В. 1996].
Различные формы сочетанной патологии МАГ и экстрацеребральных артерий имеют особое значение при разработке показаний к проведению каротидной эндартерэктомии и создания экстра- и интракраниального микроартериального анастомоза [Добжанский Н.В. и др. 1996; Переседов В.В. 1996]. Эффективность такой операции может оказаться низкой при эшелонированном атеростенозе сосудов каротидной системы. В таких случаях может быть применена операция по созданию экстра- и интракраниального микроартериального анастомоза с целью предупреждения локальной ишемии мозга.
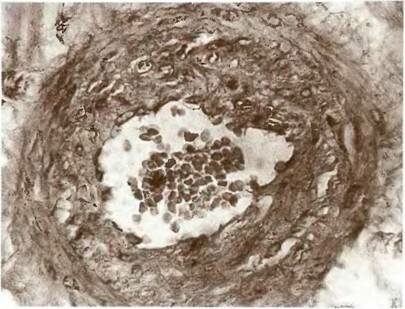
Рис. 10. Внутрисосудистый сфинктер в зоне смежного кровоснабжения средней и передней мозговых артерий после операции наложения экстра- и интракраниального микроанастомоза.
Окраска гематоксилином и эозином. *100.
Эта операция приводит к улучшению кровоснабжения ишемизированных областей полушария мозга не только бассейна средней и передней мозговых артерий. Улучшается также кровоснабжение и бассейнов одноименных артерий другого полушария через переднюю соединительную артерию [Добжанский Н.В. и др. 1994]. После этой операции выявляются и морфологические признаки улучшения кровоснабжения полушария мозга. Так, в исследованном нами случае (смерть больного наступила через год после операции и не была связана с наложением анастомоза) констатированы значительное расширение ветвей средней мозговой артерии конвекситальной поверхности полушария на стороне операции (рис. 9), а также образование внутрисосудистых сфинктеров (замыкающих артерий) в области смежного кровоснабжения этой артерии и передней мозговой артерии (рис. 10). Расширение сосудов и образование внутрисосудистых сфинктеров мы расцениваем как структурную перестройку сосудов данной области на дополнительный кровоток через анастомоз.
Несмотря на очевидный положительный эффект операции у ряда больных, показания к проведению операции по созданию экстра-интракраниального микроартериального анастомоза остаются дискутабельными. Особое внимание уделяется оценке ее реальной эффективности, влиянию на локальный кровоток и метаболизм мозга [Ausman J. 1994].
* * *
Таким образом, в разных структурно-функциональных отделах артериальной системы мозга имеются особенности строения атеросклеротических бляшек. В МАГ и СОМ развиваются фиброзно-липидные бляшки, бляшки с атероматозным распадом, петрификацией и кровоизлияниями из новообразованных сосудов. В артериях поверхности мозга преобладают фиброзно-липидные бляшки без обызвествлений и кровоизлияний.
Морфологические изменения сосудистой системы, обусловленные АС, целесообразно обозначать термином "атеросклеротическая ангиопатия". Применительно к головному мозгу этим термином следует обозначать все многообразные процессы, развивающиеся в МАГ, СОМ, артериях поверхности мозга, интрацеребральных артериях и сосудах МЦР. Такое многообразие обусловливается разнокачественными процессами, а именно, с одной стороны изменениями сосудистой стенки в процессе атерогенеза и формирования бляшки, с другой — уменьшением или прекращением кровотока в артерии и ее ветвях, микрососудах и анастомозах в результате стеноза, облитерации артерий атеросклеротической бляшкой и эмболии ветвей артерии материалом распавшейся бляшки. Все эти процессы, наблюдающиеся в перечисленных отделах сосудистой системы мозга, имеют разные механизмы развития, но общую причину — АС.
Сочетание патологических и адаптивных процессов, развивающихся при АС в сосудах, представляет собой нечто большее, чем их сумма: оно приобретает ярко выраженную новую качественную характеристику, усложняющую общую картину болезни.
Итак, атеросклеротическая ангиопатия головного мозга — это комплекс деструктивных и репаративных изменений, развивающихся в артериях при формировании атеросклеротических бляшек со стенозом (атеростеноз), с облитерацией (атерооблитерация) артерий, эмболией их ветвей материалом бляшки (атероэмболия), а также адаптивных к измененному кровотоку перестройка сосудистой системы мозга.
К осложнениям атеросклеротической ангиопатии относится тромбоз артерий, сопровождающийся в некоторых случаях эмболией этой артерии или ее ветвей материалом распавшегося тромба.
Таким образом, на различных структурно-функциональных уровнях единой артериальной системы мозга проявления атеросклеротической ангиопатии имеют свои особенности. Так, экстракраниальные отделы МАГ, определяющие объем крови, которая поступает в мозг, являются тем участком системы, где наблюдаются наиболее разнообразные атеросклеротические изменения и их осложнения. В этом случае, по-видимому, наиболее ярко проявляется роль гемодинамического фактора в возникновении и локализации атеросклеротических бляшек, а также тромбозов. На этом же уровне наблюдаются разнообразные деструктивные и репаративные процессы в бляшках. Особую роль играют кровоизлияния в бляшки, приводящие к резкому увеличению их объема, т.е. превращению стабильной бляшки в нестабильную. Это приводит к еще большему нарушению кровотока в артериях и нередко к развитию ишемических НМ К.
В МАГ нередко наблюдается также такая форма АС, как эшелонированный атеростеноз, особенно неблагоприятно влияющий на мозговой кровоток.
Снижение кровотока в МАГ приводит и к гемодинамической перестройке более дистальных отделов артериальной системы мозга, относящихся к двум другим структурно-функциональным уровням. Все эти обстоятельства следует учитывать при хирургической коррекции патологии МАГ.
Проявления атеросклеротической ангиопатии на втором структур но-функциональном уровне артериальной системы мозга, т.е. уровне, на котором кровь распределяется по основным сосудистым бассейнам мозга, также весьма разнообразны. Помимо самой разной локализации атеросклеротических бляшек, в данном случае обнаруживаются признаки гемодинамической перестройки сосудов на редуцированный и избыточный кровоток, перестройки, обусловленной патологией как МАГ, так и артерий этого уровня. Это свидетельствует о том, что свойственная данному уровню функция распределения сохраняется и даже активируется в условиях патологии.
В сосудах указанного уровня также наблюдаются атеростеноз (в том числе эшелонированный) и атеротромбоз. Эшелонированный атеростеноз нередко приводит к гемодинамической перестройке (на редуцированный кровоток) мелких интрацеребральных артерий, особенно в глубинных отделах мозга. Разнообразие атеросклеротических изменений сосудов и гемодинамической перестройки сосудов этого уровня необходимо учитывать при создании искусственного притока крови к сосудам, в том числе путем наложения экстра-интракраниального микрососудистого анастомоза.
Сосуды МЦР, относящиеся к третьему структурно-функциональному — метаболическому — уровню артериальной системы мозга, также претерпевают значительные изменения. Последние складываются из редукции этого русла, обусловленной уменьшением или прекращением кровотока в сосудах вследствие атеросклеротической патологии артерий первых двух структурно-функциональных уровней. Это подчеркивает взаимосвязь и взаимозависимость всех уровней, т.е. структурно-функциональное единство всей сосудистой системы мозга.
На уровне МЦР развертываются и процессы, компенсирующие его редукцию (формирование конволютов). Оба процесса — редукция МЦР и образование конволютов — являются характерными признаками атеросклеротической ангиопатии на метаболическом структурно-функциональном уровне.
Таким образом, атеросклеротическая ангиопатия складывается из таких компонентов, как атеросклеротические бляшки и структурная перестройка сосудов в ответ на изменения кровотока в сосудах. Эти компоненты проявляются по-разному на каждом структурно-функциональном уровне и в своей совокупности определяют характер и локализацию ишемической патологии мозга при АС.