Бивентрикулярный электрокардиостимулятор
новое направление в электрокардиостимуляционной терапии хронической середечной недостаточности. в котором основное значение придается восстановлению измененных функций миокарда, вызванных нарушениями внутрисердечного проведения
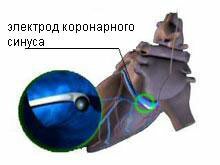
Рис. Схематично показано проведение электрода в коронарный синус сердца
Бивентрикулярная ЭКС
Информация для специалистов — переход на другую страницу сервера.
В тематических разделах Вы ознакомитесь с данными наших исследований клинического применения кардиоресинхронизационной терапии с тяжелыми формами сердечной недостаточности (СН)
Презентации докладов.
 Отделение СХ и ВК является одним из ведущих по клиническому применению бивентрикулярных ЭКС в нашей стране.
Отделение СХ и ВК является одним из ведущих по клиническому применению бивентрикулярных ЭКС в нашей стране.
Накоплен клинический опыт применения кардиоресинхронизирующей терапии у пациентов с тяжелыми формами сердечной недостаточности, в том числе у пациентов с мерцательными аритмиями.
У пациентов с тахиформами мерцательной аритмии (МА) проводилась радиочастотная аблация (РЧА)с целью нормализации частоты середечных сокращений.
За последнее время существенно пересмотрены показания к имплантации бивентрикулярного ЭКС и данный вид кардиоресинхронизирующей терапии рекомендован для лечения неосложненных форм середечной недостаточности.
 Если у Вас возникнут вопросы по ходу чтения раздела, мы рекомендуем Вам записать их в разделе «конференции» нашего сайта.
Если у Вас возникнут вопросы по ходу чтения раздела, мы рекомендуем Вам записать их в разделе «конференции» нашего сайта.
 Хроническая сердечная недостаточность (ХСН) –
Хроническая сердечная недостаточность (ХСН) –
это синдром, развивающийся в результате различных заболеваний сердечно-сосудистой системы, характеризующийся неспособностью сердца обеспечивать кровообращение, соответствующее потребностям организма, снижением насосной функции миокарда и проявляющийся одышкой, сердцебиением, повышенной утомляемостью, ограничением физической активности и избыточной задержкой жидкости в организме.
 Статистические данные заболеванием сердечной недостаточностью
Статистические данные заболеванием сердечной недостаточностью
По данным проводимых исследований начиная с 2000 года отмечается увеличение пациентов с хронической середечной недостаточностью.
По данным исследования «Framingham» в США ХСН страдает 2 – 3 млн человек, ежегодно регистрируется 400.000 новых случаев.
По данным исследования «Beatle» в Европе ХСН страдает 6,5 млн человек, ежегодно увеличивается на 580.000 новых случаев.
В России (эпидемиологические исследования), встречаемость заболевания ХСН достигает 6% от общей популяции, что превышает аналогичные зарубежные показатели в 2-3 раза.
В течении пяти лет после начала заболевания и проводимой медикаментозной терапии погибает 42% женщин и 62% мужчин.
Расходы на лечение ХСН как в России, так и в зарубежных странах огромны и имеют тенденцию к повышению.
Приводятся следующие цифры. Расходы на лечение декомпенсации ХСН в США в 2003 году составили 21 миллиард долларов. Это больше, чем лечение острого инфаркта миокарда и онкологических больных вместе взятых.
В России по данным на 2003 год, на лечение ХСН было затрачено 135 миллиардов рублей, то есть 4.2 миллиарда долларов .
История создания электрокардиостимулятора
 Развитие кардиостимуляции в последние десятилетия привело к решению многих проблем, связанных с нарушением ритма сердца.
Развитие кардиостимуляции в последние десятилетия привело к решению многих проблем, связанных с нарушением ритма сердца.
Бурное развитие техники для электрокардиостимуляции (ЭКС) привело к тому, что уже в 80-х годах минувшего века ее возможности стали значительно превосходить изначальные потребности в коррекции брадиаритмий. Возникли новые сферы применения электрокардиотерапевтических устройств, в том числе и для лечения сердечной недостаточности.
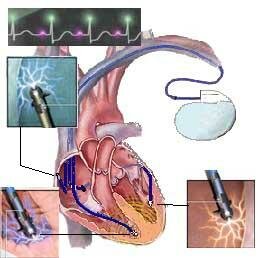
Рис. Схематично показаны имплантированные электроды бивентрикулярного ЭКС.
Электроды расположены в плости правого предсердия, правого желудочка и электрода кронарного синуса для стимуляции левого желудочка
Бивентрикулярный электрокардиостимулятор разработан специально для пациентов с ХСН, в то время как обычный электрокардиостимулятор используется для лечения пациентов с нарушениями сердечного ритма, сопровождающимися очень редким ритмом и остановками сердца.
Бивентрикулярный электрокардиостимулятор поступил на испытания Американского Лицензирующего Ведомства (FDA) в 2001 году и разрешен для клинического применения в Российской Федерации в 2003 году.
Первые результаты лечения больных с ХСН оказались успешными.
1990–1992 гг. Margarete применил двухкамерную (предсердно-желудочковую) электростимуляцию с укороченной атриовентрикулярной задержкой с целью лечения терминальной СН, вызванной дилатационной кардиомиопатией.
В 1994 г. две группы исследователей – S.Cazeau и P.Bakker – впервые предприняли трехкамерную (атриально-бивентрикулярную) ЭКС у больных с сочетанием тяжелой СН и внутрижелудочковой блокадой.
В 1998 г. J.Daubert предложили вводить электрод в стенку левого желудочка через вену из коронарного синуса.
Показания к имплантации ЭКС
- Сердечная недостаточность (СН) средней и тяжелой степени.
— Чем выраженней степень СН, тем лучше результаты.
- Длительность QRS > 130ms.
— Блокада левой ножки пучка Гиса или межжелудочковая диссоциация.
- Длительная медикаментозная терапия середечной недостаточности, в том числе и неэффективность медикаментозной терапии .
При нормальной работе сердца, оба желудочка сердца работают одновременно друг с другом с небольшой задержкой после сокращения предсердий.
При ХСН у многих пациентов наблюдается нарушение проведения возбуждения к желудочкам (блокада ножки пучка Гиса или нарушение внутрижелудочковой проводимости). В результате левый и правый желудочки теряют синхронность в работе.
Также стенки левого желудочка (отвечающего за доставку крови к органам тела) сокращаются асинхронно, снижая эффективность насосной функции сердца, и заставляя кровь в буквальном смысле «плескаться» внутри камеры.
В таких случаях сердце увеличивает частоту сокращений для обеспечения доставки крови в органы, чтобы удовлетворить потребность организма. При этом увеличивается нагрузка на сердце, что способствует его преждевременному истощению.
 Одним из проявлений является дисинхрония (асинхрония) обоих желудочков сердца,
Одним из проявлений является дисинхрония (асинхрония) обоих желудочков сердца,
которая вызвана патологическими изменениями миокарда:
Электрическая. нарушение внутрижелудочковой проводимости. Блокада ножек пучка Гиса.
Структурная. изменения коллагенового матрикса проводящих путей.
Механическая. локальная асинхрония миокарда выявляемая при стресс — ЭхоКГ.
Операция по имплантации электрокардиостимулятора
 Имплантация бивентрикулярного электрокардиостимулятора для врачей нашего отделения является относительно несложной хирургической операцией. Операция проводится натощак. Пациенту необходимо заблаговременно проконсультироваться с лечащим кардиологом о приостановке или временном уменьшении дозировки некоторых лекарственных препаратов.
Имплантация бивентрикулярного электрокардиостимулятора для врачей нашего отделения является относительно несложной хирургической операцией. Операция проводится натощак. Пациенту необходимо заблаговременно проконсультироваться с лечащим кардиологом о приостановке или временном уменьшении дозировки некоторых лекарственных препаратов.Операция имплантации (вшивания) стимулятора представляется простой, поскольку мало травмирует ткани. Она выполняется в операционной, оснащенной рентгеновским аппаратом. Под ключицей пунктируется (прокалывается) вена, в нее вводится специальная пластмассовая трубка (интродьюсер), через которую в верхнюю полую вену вводятся эндокардиальные электроды.
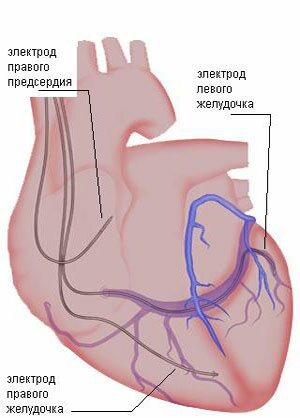
Под контролем рентгена электроды направляется в правое предсердие, правый желудочек и через кронарный синус в латеральную вену левого желудочка где и фиксируются.
Самой сложной процедурой является установка и закрепление кончика электрода в предсердии или желудочке так, чтобы получить хороший контакт.
Обычно хирург делает несколько проб, все время измеряя порог возбудимости, т.е. наименьшую величину импульса (в вольтах), на которые сердце отвечает сокращением, видимым по ЭКГ.
Задача состоит в том, чтобы найти наиболее чувствительное место и в то же время получить хорошую графику ЭКГ, регистрируемую с устанавливаемых электродов. После того, как цель достигнута, делают небольшой «карман» под кожей, а если человек худой, то «карман» делается под мышцей. В него укладывается стимулятор и ткани над ним зашиваются.
Разумеется, операция требует строгой стерильности и тщательной остановки кровотечения, чтобы избежать скопления крови под кожей и нагноения. Сам стимулятор и электроды поставляются в стерильном виде. В общей сложности все эти манипуляции занимают до двух часов времени.
Заключение
Бивентрикулярный электрокардиостимулятор вызывает возбуждения предсердий и затем одновременно правого и левого желудочков сердца.
Генератор импульсов представляет собой прибор длиной около 5 см и весом около 100 г.
Бивентрикулярный электрокардиостимулятор работает от литиевых батарей, срок службы которых составляет от 5 до 10 лет.
После разряда батарей меняется весь прибор. Бивентрикулярный электрокардиостимулятор вырабатывает электрический импульсы, управляющие ритмом сердца и обеспечивающие синхронную работу предсердий и обоих желудочков.
Бивентрикулярный электрокардиостимулятор — это новый тип искусственного водителя ритма сердца, разработанный для пациентов с ХСН. У многих пациентов с СН стенки левого желудочка – важнейшей камеры сердца, выполняющей насосную функцию, работают асинхронно.
Бивентрикулярный электрокардиостимулятор разработан для того, чтобы обеспечить одновременное сокращение желудочков и устранить асинхронность сокращения мышцы левого желудочка. Именно поэтому он иногда называется вентрикулярный ресинхронизатор
Обычный кардиостимулятор вызывает возбуждение либо только правого желудочка (однокамерные электрокардиостимуляторы), либо и правого предсердия и правого желудочка (двухкамерные электрокардиостимуляторы).
Бивентрикулярный электрокардиостимулятор стимулирует оба желудочка сердца. Это позволяет прибору обеспечить более эффективную насосную функцию сердца.
Также как и обычные электрокардиостимуляторы или кардиовертеры-дефибрилляторы, бивентрикулярный электрокардиостимулятор имплантируется в наружные отделы грудной клетки пациента путем несложной операции. Пациент с имплантированным электрокардиостимулятором регулярно наблюдается у специалиста для контроля работы прибора. Хотя исследования влияния бивентрикулярного электрокардиостимулятора на клиническое течение ХСН еще далеки от завершения, результаты, получаемые уже сегодня весьма успешны.
На сегодняшний день влияние внешних воздействий на работу бивентрикулярного электрокардиостимулятора изучено недостаточно. Тем не менее, предполагается, что выводы совпадут с результатами аналогичных исследований обычного электрокардиостимулятора. Поэтому, пациентам не рекомендуется пребывание в зоне действия сильных электромагнитных полей.
Информация для специалистов — переход на другую старницу сервера
Комплексная терапия сердечной недостаточности
Кафедра Реанимации и интенсивной терапии
Основные принципы интенсивной терапии
Препараты, используемые для поддержания кровообращения
Вазодилятаторы
Литература
1. Основные принципы интенсивной терапии
Принципы интенсивной терапии неоригинальны – она должна быть комплексной, этиопатогенетической, индивидуализированной и носить упреждающий характер.
Принцип комплексности во многом проистекает из теории функциональных систем П.К. Анохина (1975), постулирующей, что организм реагирует на травму «не отдельными органами и системами, а определенным образом организованными и соподчиненными между собой функциональными системами органов, обладающими различной реактивностью». Это означает, что независимо от клинических проявлений, в стресс-реакцию вовлекаются все функциональные системы, только в силу различной их реактивности и выраженности агрессии одни делают это раньше, другие – позже. Отсюда программа интенсивной терапии должна разрабатываться таким образом, чтобы учитывать интересы не только наиболее пораженного органа, а организма в целом, и не препятствовать развитию саногенных процессов в посттравматическом (послеоперационном) периоде.
Знание специфики болезни, приведшей пациента к критическому состоянию, ее патогенетических особенностей – основа грамотных действий любого врача. Этиопатогенетический принцип интенсивной терапии наряду с этим должен учитывать особенности развертывания типовых патологических процессов и общего адаптационного синдрома в целом.
Данный принцип очень тесно взаимодействует с необходимостью индивидуализации проводимой терапии, которая определяется не только специфическими особенностями того или иного человека как личности, его реактивностью, наличием или отсутствием сопутствующей патологии, но и степенью развертывания адаптационных реакций. Например, подходы к использованию методов экстракорпоральной детоксикации у раненого с полноценным развертыванием процесса срочной (аварийной) адаптации в первом и втором периодах травматической болезни должны быть иными, чем у такого же пострадавшего, но на более поздних этапах лечения, когда механизмы аварийной адаптации себя уже исчерпали, а долговременной еще не стали состоятельными. Содержание лечения раненого в бою, вследствие наличия у него синдрома эколого-профессионального перенапряжения, также должно быть иным, чем у получившего случайное ранение в условиях крупного города и быстро доставленного в стационар.
В основе принципа упреждающего подхода к интенсивной терапии лежит знание закономерностей развертывания типовых патологических процессов, упомянутая выше теория функциональных систем П.К. Анохина, а также многолетний опыт лечения тяжело больных и пострадавших, свидетельствующий, что несостоятельность систем жизнеобеспечения легче предотвратить, чем лечить.
2. Препараты, используемые для поддержания кровообращения
В лечении острой и хронической недостаточности кровообращения ведущее место занимают препараты, увеличивающие сократительную способность миокарда и изменяющие тонус периферических сосудов. Наиболее эффективными из них являются катехоламины, эффект которых проявляется активацией различных подтипов адренорецепторов. Для правильного понимания того, как действуют препараты, необходимо учитывать локализацию основных адренорецепторов и физиологические эффекты, связанные с их активацией (табл.1).
Таблица 1
Локализация адренорецепторов и эффекты, связанные с их активацией
Терапия сердечной недостаточности у новорожденного. Методы лечения сердечной недостаточности.
При терапии сердечной недостаточности необходим комплексный подход. Лечебные мероприятия должны быть направлены на снижение требований к сердечному выбросу, объемную разгрузку сердца и его инотропную поддержку. К основным методам терапии относятся следующие.
Снижение метаболических потребностей организма и миокарда; обеспечение энергозатрат. Создание комфортных температурных условий и ограничение физической активности являются основными факторами, снижающими метаболические затраты и необходимость высокого сердечного выброса. Один из простейших способов уменьшить нагрузку — исключить грудное вскармливание и перейти на кормление из бутылочки или через гастродуоденальный зонд. При лечении сердечной недостаточности у младенцев большое значение приобретает седация и контроль температуры тела. Как правило, поддержание температурного гомеостаза у этих больных затруднено за счет сниженной мышечной активности, относительно большой поверхности тела, ограниченной способности к усилению кровоснабжения периферических тканей. Опасность представляют как перегревание, так и охлаждение ребенка. Вследствие нарушений терморегуляции увеличивается скорость обменных процессов и потребление кислорода, что предъявляет повышенные требования к сердечному выбросу. Высокая температура (более 38,5°) помимо неконтролируемой тахикардии опасна возникновением вазодилатации со снижением артериального давления вплоть до шокового состояния и судорогами. При охлаждении развивается сужение сосудов с увеличением гипоксии, ацидоза и опасностью остановки дыхания.
При лечении сердечной недостаточности необходимо обеспечить энергетически адекватное питание в относительно небольшом объеме. В качестве первого шага прибегают к частому кормлению небольшими порциями, используя смеси с повышенной калорийностью. Возможны периодические инфузии 10—20% глюкозы. Однако в большинстве случаев для доставки в организм питательных веществ в достаточном объеме (140—200 ккал/кг в сутки) приходится переходить на их введение через гастродуоденальный зонд. Только 24-часовое непрерывное питание позволяет сохранить стабильную прибавку в весе. Больным, не способным усвоить достаточный объем при зондовом питании, может потребоваться парентеральное питание с использованием изотонических растворов аминокислот (3—3,5%), 10% глюкозы, витаминов, минеральных веществ и электролитов.

Воздействие на объем циркулирующей крови (ОЦК) при сердечной недостаточности.
Объемная разгрузка сердца — важный компонент терапии сердечной недостаточности. Наиболее часто используют ограничение поступающей в организм жидкости и/или стимуляцию мочеотделения с помощью диуретиков. Общий объем жидкости вместе с кормлением не должен превышать 80% от возрастной нормы. Основным используемым диуретиком является фуросемид (лазикс), который вводят в дозе 0,5—3,0 мг/кг внутривенно, внутримышечно или перорально. Возможно также добавление верошпирона по 2—4 мг/кг в сутки. Общим правилом при лечении диуретиками является контроль баланса жидкости и концентрации электролитов в сыворотке крови.
Эффективным средством контроля за лечением является ежедневное взвешивание ребенка.
Воздействие на резистентность легочных или периферических сосудов. Колебания общего легочного сопротивления (ОЛС) оказывают значительное влияние на функцию сердца. Таким образом, меняя величину ОЛС, можно облегчить или осложнить работу сердца.
Наиболее сильными дилататорами легочных сосудов являются оксид азота (NO), простагландины и кислород. Использование данных средств для искусственного снижения общего легочного сопротивления может быть показано у новорожденных с правожелудочковой недостаточностью (например, при персистирующей легочной гипертензии, дисфункции трикуспидального клапана). Однако, как показывает опыт, необходимо отказаться от рутинного использования кислорода в терапии сердечной недостаточности при ВПС. Это может привести к развитию неконтролируемой вазоплегии в легочном сосудистом русле при одновременном повышении системного сосудистого сопротивления, усилению сброса крови через ДМЖП, ОАП или ДМПП и «неожиданному» нарастанию сердечной недостаточности. Еще вработе Mashall Н.исоавт. (1961) было показано, что назначение 100% кислорода детям с большим ДМЖП приводит к снижению сердечного выброса на 15%. Кроме того, в обстоятельствах, когда точный диагноз еще не установлен, велика опасность с помощью кислорода закрыть ОАП у дуктус-зависимых больных. Использование кислорода оправданно только при сопутствующих дыхательных расстройствах у дуктус-независимых пациентов.
Искусственное снижение резистентности системных сосудов показано при объемной перегрузке левого желудочка (недостаточность аортального или митрального клапана, ДМЖП) и может быть достигнуто прямыми вазодилататорами (нитропруссид, нитроглицерин) или ингибиторами синтеза АПФ. Внутривенное введение вазодилататоров используется только при острых расстройствах гемодинамики и в условиях отделения интенсивной терапии. Доза наиболее распространенного препарата — нитропруссида — колеблется от 0,5 до 5,0 мкг/кг/мин. Передозировка может привести к цианидной интоксикации, индикатором которой является метаболический ацидоз.
Нейрогуморальная модуляция сердечной недостаточности.
Основным механизмом действия препаратов данной группы является деактивация ренин-ангиотензин-альдостероновой системы и предотвращение повреждения, фиброза и ремоделирования миокарда. Наряду с этим достигается снижение постнагрузки, облегчающее работу сердца. В современной терапии это направление развивается достаточно интенсивно. К лекарствам данного ряда относятся ингибиторы синтеза АПФ (ИАПФ), адреноблокаторы, антагонисты альдостерона, частично дигоксин. Известны случаи успешного применения ИАПФ у детей с большими шунтами через ДМЖП и застойной сердечной недостаточностью, при недостаточности аортального или митрального клапана, а также для создания управляемой артериальной гипотонии в случаях послеоперационной дисфункции левого желудочка. Результатом терапии является уменьшение перегрузки сердца и длительное поддержание удовлетворительной функции левого желудочка, что позволяет отсрочить оперативное вмешательство. Использование препаратов данного ряда противопоказано при наличии обструкции выбросу левого желудочка (аортальный стеноз), сопровождающейся снижением артериального давления.
Среди ингибиторов синтеза АПФ у детей наибольшее распространение получил каптоприл, который используют в дозе 1-2 мг/кг/сутки. Управляемая артериальная гипотония достигается через двое—трое суток лечения.
В последние годы интенсивно изучаются антагонисты рецепторов ангиотензина. Однако исследований применительно к маленьким детям нет.
Сообщения о благоприятном действии адреноблокаторов при ВПС немногочисленны. В клинической практике применялись малые дозы пропранолола (1,8 мг/кг/сут) у больных с большим шунтом слева направо, у которых были исчерпаны возможности традиционной терапии дигоксином и мочегонными препаратами. В последние годы изучается возможность использования у детей с ВПС препаратов третьего поколения (карведилол, дилатренд), дополнительно обладающих периферическим сосудорасширяющим эффектом, как у ингибиторов синтеза АПФ. Наиболее широко данные препараты применяются при лечении кардиомиопатий.
Искусственная вентиляция легких (ИВЛ). В критических ситуациях при выраженной сердечной недостаточности следует использовать ИВЛ с целью выключения из работы дыхательной мускулатуры и снижения тем самым требований к сердечному выбросу. При ВПС со сбросом крови слева направо вентиляцию необходимо проводить с нормальным содержанием кислорода (21%) в дыхательной смеси, чтобы избежать увеличения легочного кровотока. Для лечения и предупреждения легочного отека используют вентиляцию с положительным давлением в конце выдоха в 4—10 см вод. ст.
Оглавление темы «Пороки сердца у новорожденных и детей.»:


желаю всем быть здоровыми, следить за своим здоровьем, профилактикой заниматься.. спорт, правильное питание, здоровый образ жизни!витамины пить, добавки. для сердца самая легкая по составу — кардиоактив, на травах, но в качестве профилактики — замечательно