Хроническая сердечная недостаточность: возможности профилактики и лечения
С.Б. МИГУТИНА. к.м.н. завотделом кардиологии ГКБ №60, Москва
Проблема хронической сердечной недостаточности остается в наши дни актуальной. По данным исследования ЭПОХА-ХСН, распространенность данного заболевания в нашей стране достигает 12%. В 66% случаев ХСН имеет ишемическую этиологию. Рациональный подход к лечению с оценкой всех возможных рисков позволит значительно улучшить состояние пациента и уменьшить тяжесть заболевания. Немедикаментозные методы лечения включают малосолевую диету и физическую реабилитацию с использованием дозированных аэробных нагрузок. Несмотря на внушительный список препаратов, рекомендованных и применяемых при ХСН, не ослабевает интерес к ряду средств, называемых миокардиальными цитопротекторами.
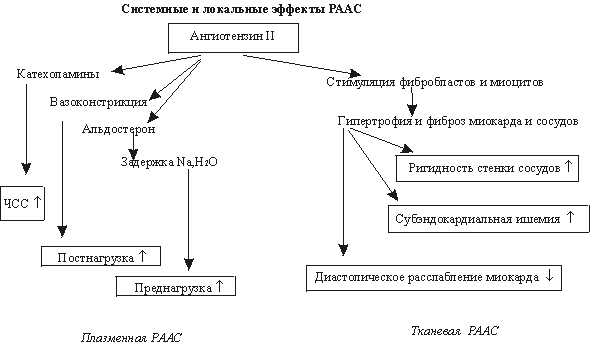
Современные знания о хронической сердечной недостаточности (ХСН) значительно расширили возможности профилактики и лечения этого грозного синдрома, однако в мировой практике актуальность данной проблемы по-прежнему высока. Снижение общей и сердечно-сосудистой смертности как конечная точка многих крупных исследований непосредственно подразумевает и наличие ХСН, т. к. она является осложнением практически всех заболеваний сердца. По данным ВОЗ, 5-летняя выживаемость больных с ХСН не превышает 30–50%. Вне зависимости от этиологии этот синдром имеет прогрессирующее течение, поэтому выявление ХСН на начальных стадиях обуславливает наиболее благоприятный прогноз. Использование национальных регистров позволяет более точно представить картину заболеваемости. По данным исследования ЭПОХА-ХСН, распространенность ХСН в нашей стране достигает 12%, среди них доля тяжелых пациентов с ХСН III–IV стадии составляет более 2%. В 66% случаев ХСН имеет ишемическую этиологию. В исследовании ЭПОХА-О-ХСН средние цифры АД во всей популяции больных ХСН превышают 150/90 мм рт. ст. В IMPROVEMENT HF не менее 26% больных с ХСН имели диастолическую недостаточность. Тем не менее в последние годы отмечают тенденцию к снижению роли АГ в генезе ХСН, что связывают с успехами, достигнутыми в лечении АГ. Более опасным представляется распространение и омоложение ИБС. Исследования возрастной зависимости показывают, что после 50 лет с каждым десятилетием число больных с ХСН удваивается. После 75 лет отмечается особенно резкий подъем. В эпидемиологию вошло понятие «факторы риска» ХСН, наличие которых в бессимптомной стадии предполагает вероятность прогрессирования синдрома. К таким факторам относят: увеличение размеров сердца, изменения на ЭКГ и ЭХО-КГ, стойкое учащение сердечного ритма и снижение жизненной емкости легких. Фоном для развития недостаточности кровообращения является сахарный диабет, ожирение, нарушение липидного обмена, анемия и патология почек, из дополнительных модифицируемых факторов риска – курение и употребление алкоголя. Большинство этих причин непосредственно связаны с формированием ИБС. Наиболее агрессивным состоянием считают СД, причем у таких больных ХСН может развиваться как самостоятельно, так и осложнять течение ИБС. На третьем месте по распространенности среди причин ХСН – клапанные пороки сердца, приобретенные и некорригированные ревматические. Современные возможности хирургического лечения могут способствовать улучшению ситуации при своевременном направлении пациентов на кардиохирургическое вмешательство, особенно при наличии стенозов клапанов. Кардиомиопатии неишемической этиологии встречаются реже, однако быстро приводят к ХСН с тяжелыми дистрофическими изменениями. В последние годы значительно возрос интерес к изучению метаболического синдрома как предиктора развития ХСН. По данным популяционных исследований NHANES, риск развития ХСН в 2,5–4 раза выше у лиц, страдающих МС, вне зависимости от возраста и пола. Получены доказательства отчетливой причинно-следственной связи между этими патологическими состояниями и достоверного ухудшения прогноза при их сочетании. Очевидно, что, воздействуя на отягчающие факторы на начальных стадиях заболевания и осуществляя основополагающий принцип медицины о том, что «лечить нужно больного, а не болезнь», можно значительно улучшить состояние пациента и предотвратить развитие необратимых осложнений.
Тактика лечения
Рациональный подход к лечению с оценкой всех возможных рисков позволит значительно улучшить состояние пациента и уменьшить тяжесть заболевания. Специалисты ВНОК рекомендуют выделить 3 критерия эффективности лечения:
1) динамика клинического состояния,
2) динамика качества жизни,
3) влияние на прогноз больных.
Для того чтобы все вышеперечисленные требования были выполнимы, лечение ХСН начинают как можно раньше, при наличии отягощенного анамнеза, предикторов (инструментальные методы и биомаркеры, в т. ч. предсердный Na-уретический гормон) и начальных симптомов.
Немедикаментозные методы
Немедикаментозные методы лечения включают малосолевую диету и физическую реабилитацию с использованием дозированных аэробных нагрузок.
Главный принцип диеты – ограничение потребления соли и – в меньшей степени – жидкости. При любой стадии ХСН больной должен принимать не менее 750 мл жидкости в сутки (оптимальный режим 1–1,5 л.). Ограничения по употреблению соли для больных ХСН I ФК – менее 3 г/сут, для больных II–III ФК – 1,2–1,8 г/сут, для IV ФК – менее 1 г/сут.
Из физических нагрузок оптимальна ходьба или велотренажер по 20–30 минут в день до пяти раз в неделю с осуществлением самоконтроля самочувствия и частоты пульса (эффективной считается нагрузка при достижении 75–80% от максимальной для пациента ЧСС). При хорошей переносимости можно рекомендовать увеличение времени тренировок до 45 минут и дистанции от 3 до 6 км. Доказано, что постепенное увеличение продолжительности тренировок снижает риск прогрессирования ХСН на 14%. Данные рекомендации применимы у стабильных пациентов с ХСН ишемической природы. В тяжелых случаях декомпенсации ХСН физические тренировки вначале ограничиваются дыхательной гимнастикой. Основным методом для выбора режима нагрузок является определение исходной толерантности при помощи теста 6-минутной ходьбы.
Медикаментозные методы
Основными целями медикаментозного лечения ХСН (по Кушаковскому М.С.) являются:
1) уменьшение нагрузки на сердце,
2) улучшение систолической и диастолической функций миокарда,
3) устранение отечного синдрома,
4) профилактика метаболических нарушений,
5) профилактика тромбоэмболических осложнений,
6) профилактика почечной недостаточности,
7) лечение нарушений ритма и проводимости.
Весь перечень лекарственных средств, применяемых для лечения ХСН, подразделяют на три группы: основная, дополнительная, вспомогательная в соответствии с принципами доказательной медицины. К основной группе (степень доказанности А) относят препараты, эффект которых доказан в крупных международных контролируемых исследованиях и не вызывает сомнений. К дополнительным (степень доказанности В) относятся препараты, эффективность и безопасность которых исследованы, но требуют уточнения. К третьей группе вспомогательных средств (степень доказанности С) относят лекарства с неизвестным влиянием на прогноз, применение которых диктуется клиникой.
I. Основные средства
ИАПФ обладают более чем обширной доказательной базой и являются золотым стандартом в лечении ХСН. ИАПФ показаны всем больным вне зависимости от этиологии, стадии и тяжести декомпенсации. Наиболее раннее назначение ИАПФ, уже при I ФК сердечной недостаточности, способно замедлить прогрессирование ХСН. В России полностью доказана эффективность и безопасность при лечении ХСН следующих ИАПФ: каптоприла, эналаприла, рамиприла, фозиноприла, трандолаприла. Наибольшее число исследований посвящено классическим ИАПФ – каптоприлу и эналаприлу. Однако и другие представители этой группы являются востребованными в той или иной клинической ситуации. В исследовании EUROPA изучена эффективность периндоприла, который достоверно уменьшал риск развития ХСН на 39%, превосходя по этому показателю трандолаприл и рамиприл. Кроме того, у пациентов с инсультами в анамнезе (половина с АГ) применение периндоприла и его комбинации с индапамидом сопровождалось достоверным снижением риска развития ХСН на 26%. Доказана способность периндоприла снижать число госпитализаций в группе пожилых больных с сохраненной систолической функцией ЛЖ. В исследовании PRE-AMT применение периндоприла уменьшало процессы постинфарктного ремоделирования, которые лежат в основе прогрессирования ХСН. Одним из эффективных ИАПФ является также зофеноприл, препарат с высокой липофильностью, что обеспечивает его быстрое проникновение в ткани и в большей степени подавление активности РААС. Квинаприл также показал высокую эффективность у пациентов с ХИБС, перенесших АКШ. Препарат также рекомендован для использования в постинфарктном периоде, причем в ранние сроки. Применение лизиноприла, несмотря на выраженные органопротективные свойства, ограничивается при наличии почечной недостаточности, т. к. препарат имеет единственный путь элиминации – через почки. В таких случаях целесообразно использование фозиноприла или спираприла. Следует помнить, что при снижении почечной фильтрации менее 60 мл/мин дозы ИАПФ должны быть уменьшены вдвое, а менее 30 мл/мин – на 75%. Также необходимо учитывать риск гипотонии. ИАПФ следует назначать больным ХСН при уровне систолического АД выше 85 мм рт. ст. В противном случае стартовую дозу нужно уменьшить вдвое, а при остановке лечения сделать все для возможно более быстрого возврата к терапии ИАПФ.
БРА (блокаторы рецепторов к АТ или сартаны) применяются преимущественно в случаях непереносимости ИАПФ в качестве средства первого ряда для блокады РААС у больных с клинически выраженной декомпенсацией, а также дополнительно к ИАПФ у пациентов с ХСН, у которых эффективность одних ИАПФ недостаточна. Наиболее обоснованно применение кандесартана, который в исследовании CHARM у больных с сердечной недостаточностью и систолической дисфункцией ЛЖ продемонстрировал улучшение клинической симптоматики, сокращение частоты госпитализации и уменьшение общей и сердечно-сосудистой смертности. Снижение риска смерти составляло 33% после первого, 20% после второго и 12% после третьего года наблюдения. Лозартан в дозах 100 мг/сут может предупреждать развитие ХСН, в т. ч. у пациентов с диабетом и нефропатией, что обусловливает его применение для профилактики декомпенсации сердечной деятельности. Эффективность валсартана при хронической ИБС доказана в исследованиях VALIANT и JIKEY. Также применение валсартана сопровождается клиническим улучшением и торможением процессов ремоделирования сердца. Многочисленные ретроспективные анализы подтверждают также способность БРА (валсартан, кандесартан, лозартан) снижать риск развития и рецидивирования мерцательной аритмии до 28–29%.
Бета-адреноблокаторы (БАБ), благодаря своему разноплановому действию на различные аспекты патогенеза ХСН, прочно заняли место в ряду жизненно важных средств и также имеют хорошую доказательную базу. Несмотря на отрицательный инотропный эффект, препараты используются на разных стадиях ХСН. Помимо основного действия – адренергической блокады, БАБ свойственны антипролиферативные и антиоксидантные свойства, необходимые при запуске РААС и процессах ремоделирования. В ходе эпидемиологического исследования IMPROVEMENT HF было установлено, что клинический эффект применения кардиоресинхронизирующей терапии сопоставим с эффектами БАБ. При проведении ряда исследований по применению БАБ при ХСН было доказано, что препараты имеют интересный гемодинамический профиль воздействия, сходный с сердечными гликозидами, т. е. длительное назначение этих препаратов приводит к росту насосной функции сердца и снижению ЧСС. В исследованиях CIBIS-II, MERIT-HF, COPERNICUS доказана способность бисопролола, Метопролола сукцината и карведилола снижать общую смертность в среднем на 35%. В CIBIS-III бисопролол на 46% уменьшал сердечно-сосудистую смертность по сравнению с эналаприлом. Кроме трех рекомендованных БАБ, в лечении пожилых больных ХСН (старше 70 лет) может применяться небиволол, который достоверно не снижает общую смертность, но уменьшает заболеваемость пациентов и число повторных госпитализаций, а также риск внезапных смертей. Тем не менее необходимо соблюдать ряд принципов при назначении БАБ. При обычной клинической ситуации БАБ всегда назначаются «сверху» ИАПФ и не назначаются впервые при декомпенсации ХСН. Необходим контроль за артериальной гипотензией и дозами диуретиков, т. к. из-за начального снижения насосной функции возможно некоторое нарастание симптомов ХСН. Стартовая доза любого БАБ при ХСН – 1/8 от средней терапевтической дозы. Желательно достижение целевых доз БАБ, например, для Метопролола сукцината – 200 мг/сут. Однако, как показывает практика и данные эпидемиологических исследований, в нашей стране это происходит крайне редко, и лишь у 1 из 4 больных достигается целевая доза.
Антагонисты альдостерона. Воздействие на основное звено патогенеза ХСН позволяет спиронолактону уже десятилетия оставаться необходимым компонентом комбинированной терапии. В 80-е гг. было доказано присутствие альдостероновых рецепторов в миокарде и эндотелии сосудов, хроническая активация этих рецепторов сопровождается развитием фиброза и усугубляет ремоделирование миокарда. О значимости антиальдостероновой терапии свидетельствует факт перевода этой группы из категории дополнительных средств лечения ХСН в основную (III пересмотр рекомендаций ВНОК). В период достижения компенсации (особенно у пациентов с ХСН III—IV ФК) применение спиронолактона абсолютно необходимо, и можно не бояться сочетания его высоких доз с ИАПФ или БРА, если параллельно правильно используются диуретики и достигается положительный диурез. Однако после достижения состояния компенсации применение высоких доз спиронолактона прекращается и назначаются невысокие поддерживающие дозы препарата – 25–50 мг. При длительном лечении ХСН не рекомендуется лишь сочетание больших доз спиронолактона и высоких доз ИАПФ. В процессе лечения требуется контроль уровня калия и креатинина. В настоящее время в нашей стране используется спиронолактон. Хотя уже имеются данные о том, что у пациентов, перенесших ИМ, осложнившийся развитием ХСН II ФК, применение нового антагониста альдостерона эплеренона (в России не зарегистрирован) позволяло снижать риск смерти, в т. ч. и внезапной.
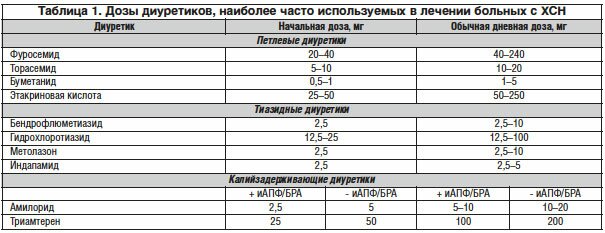
Диуретики. Это основная группа препаратов, с которых начинают лечение ХСН в стационарах, особенно при декомпенсации. Однако не существует ни одного исследования, которое доказало бы эффективность мочегонных средств (за исключением антагонистов альдостерона). Основное показание для назначения мочегонных препаратов – клинические признаки и симптомы избыточной задержки жидкости в организме больного ХСН, при этом следует помнить о том, что диуретики обладают двумя негативными свойствами, вызывая гиперактивацию нейрогормонов РААС и электролитный дисбаланс. Кроме того, возможны метаболические расстройства. В настоящее время в основном применяются две группы диуретиков: тиазидные и петлевые. Из группы тиазидных диуретиков предпочтение отдается гидрохлоротиазиду, который назначается при умеренной ХСН (II–III ФК NYHA). Препараты повышают диурез и натрийурез на 30–50%, эффективны при уровне почечной фильтрации до 30–50 мл/мин. Поэтому при почечной недостаточности их применение бесполезно. Индапамид по профилю безопасности существенно превосходит гипотиазид, однако данных по его применению в лечении ХСН в настоящее время недостаточно. Еще один представитель этого класса диуретиков – хлорталидон, синтезированный в России, в настоящее время в ней не применяется. Петлевые диуретики в настоящее время являются основными мочегонными в лечении отечного синдрома при ХСН. Традиционно и длительно используется фуросемид. В 2006 г. в России зарегистрирован торасемид – самый эффективный и безопасный петлевой диуретик. Стартовая доза препарата при ХСН 5–10 мг, которая при необходимости может быть увеличена до 100–200 мг/сут. Благоприятный фармакокинетический профиль и двойной путь выведения позволяют избежать свойственных другим диуретикам нежелательных эффектов, таких как гипокалиемия, гиперурикемия, влияние на липидный профиль и клиренс креатинина. В исследовании REACH выявлено более благоприятное влияние торасемида на клинические исходы и качество жизни больных ХСН. Результаты исследования TORIC, в котором были задействованы более 2 000 больных, продемонстрировали снижение общей и сердечно-сосудистой смертности на фоне лечения торасемидом по сравнению с фуросемидом, хотя изначально данные критерии не являлись основными целями исследования. Способность торасемида оказывать антиальдостероновое действие обеспечивает препарату дополнительные преимущества в лечении ХСН.
Сердечные гликозиды – самая старая группа препаратов, применяемая по сей день и не утратившая своих позиций. Разработанная У. Уитерингом в XVIII в. методика применения наперстянки сохранила свое значение и до нашего времени. Можно охарактеризовать СГ как «кардиоактивные средства», влияющие на гемодинамику и увеличение ударного (минутного) объема сердца. Помимо центрального действия у СГ существуют и периферические эффекты в отношении венозного русла, приводящие к уменьшению преднагрузки. Также СГ способны восстанавливать барорецепторные рефлексы, нарушенные при ХСН, что особенно актуально у пожилых больных, нуждающихся в лечении СГ. В настоящее время доказано, что препараты этой группы не оптимизируют прогноза больных ХСН и не замедляют прогрессирования болезни, но улучшают клиническую симптоматику, качество жизни и снижают потребность в госпитализациях из-за обострения декомпенсации, причем не только при мерцательной аритмии, но и при синусовом ритме. Дигоксин у больных ХСН всегда должен применяться в малых дозах: до 0,25 мг/сут (для больных с массой тела более 85 кг – до 0,375 мг/сут, а при массе тела менее 65 кг – до 0,125 мг/сут). В таких дозировках он действует преимущественно как нейрогормональный модулятор, оказывает слабое положительное инотропное действие и не стимулирует развитие нарушений сердечного ритма. У пожилых больных дозы дигоксина дополнительно должны быть снижены. При мерцательной аритмии дигоксин можно использовать в качестве средства первой линии, при синусовом ритме дигоксин лишь пятый препарат после ИАПФ (БРА), БАБ, антагонистов альдостерона и мочегонных. Ранее считалось, что его применение требует осторожности, особенно у пациентов с коронарной патологией, постинфарктным кардиосклерозом и стенокардией, но эти опасения не подтверждаются при условии строгого использования малых доз.
Эфиры ω-3 ПНЖК. Среди основных средств лечения ХСН в Российских рекомендациях 2009 г. впервые появились эфиры ω-3 полиненасыщенных жирных кислот (ПНЖК). Из результатов исследований последнего десятилетия следует, что недостаточное содержание ω-3 ПНЖК в мембране эритроцитов определяет риск желудочковых нарушений ритма сердца и внезапной смерти. Предполагается, что употребление ω-3 ПНЖК теоретически может приводить к снижению риска аритмий и внезапной смерти. В частности, в исследовании GISSI-HF показано снижение общей смертности на 9% при добавлении к основной терапии препарата Омакор в дозе 1 г/сут.
II. Дополнительные средства
К вспомогательным средствам лечения ХСН при определенных клинических ситуациях относятся статины и антикоагулянты. Доказанный для статинов эффект вторичной профилактики ИБС и снижения риска повторных острых коронарных событий не является при ХСН основополагающим. Эффективность статинов в профилактике неблагоприятных исходов ХСН не подтверждена. В исследовании GISSI-HF не было установлено никакого влияния статинов (в сравнении с ω-3 ПНЖК) на конечные точки (снижение смертности) вне зависимости от возраста, пола, наличия сахарного диабета и исходной гиперлипидемии. В исследовании CORONA изучение розувастатина по сравнению с плацебо также не выявило преимуществ в общей популяции, уменьшился риск коронарных событий лишь в группе ХСН ишемической этиологии. Таким образом, применение статинов при ХСН III–IV признано нецелесообразным, т. к. пациенты чаще всего погибают от аритмий, а не от ИБС. Однако, если в патогенезе ХСН ведущую роль играет ИБС, в частности перенесенный инфаркт миокарда, применение статинов рекомендовано.
До 40% больных с выраженной ХСН имеют признаки тромбоза глубоких вен, и у 5,5% пациентов тромбоэмболии легочной артерии осложняют течение декомпенсации, причем чем тяжелее ХСН и ниже ФВ, тем более вероятно появление тромбозов и эмболии. В связи с этим оральные непрямые антикоагулянты обязательны для лечения больных с мерцательной аритмией и повышенным риском тромбоэмболии. Особенный риск имеют пациенты с мерцательной аритмией в сочетании с одним из следующих факторов: пожилой возраст, наличие в анамнезе тромбоэмболии, нарушений мозгового кровообращения, операций на сердце, наличие внутрисердечных тромбов, резкое снижение ФВ (< 35%) и выраженная дилатация полостей сердца.
III. Вспомогательные средства
Вспомогательные средства призваны облегчить состояние и самочувствие пациентов с ХСН, хотя абсолютно не влияют на прогноз, в некоторых случаях даже способствуя его ухудшению. Из периферических вазодилататоров чаще всего применяют нитраты. Средства из этой группы могут назначаться при ХСН лишь при наличии доказанной ИБС и стенокардии, которая проходит только от нитропрепаратов. Во всех остальных случаях нитраты при ХСН не показаны. В качестве артериолярных периферических вазодилататоров можно применять лишь дигидропиридины длительного действия (предпочтительно амлодипин), уменьшающие постнагрузку на миокард, в частности у больных с высокой легочной гипертензией. Использование дигидропиридинов (обязательно в комплексе с ИАПФ, БАБ, диуретиками, антагонистами альдостерона) может быть показано при ХСН, в основе которой диастолические нарушения.
Использование антиаритмических средств продиктовано высокой вероятностью жизнеугрожающих желудочковых нарушений ритма у больных ХСН. В случае необходимости предпочтение следует отдавать БАБ с доказанной эффективностью снижения риска внезапной смерти. При наличии в анамнезе фибрилляции желудочков, рецидивирующих аритмий высокой градации по Lown-Wolf на фоне терапии БАБ возможно применение препаратов III класса (амиодарон, соталол). Антиаритмики I и IV классов противопоказаны больным ХСН.
Также нет клинических подтверждений эффективности дезагрегантов при ХСН, несмотря на то что без применения этой группы препаратов трудно представить лечение пациента с ИБС. В то же время действие аспирина ограничивает эффективность ИАПФ, основной группы в лечении ХСН, увеличивает риск геморрагических осложнений в условиях тканевой гипоксии. Использование низких доз двух антиагрегантов – аспирина (до 75 мг) и клопидогрела (до 75 мг), которое является эффективным, безопасным и абсолютно показанным для больных с перенесенным ОИМ, не может быть рекомендовано пациентам с ХСН. Тем не менее вопрос остается дискутабельным. Приемлемым считается назначение только минимально эффективных доз препаратов этого класса при наличии прямых показаний.
Негликозидные инотропные средства, несмотря на способность кратковременно улучшать гемодинамику и клиническое состояние больных с обострением декомпенсации, при продолжительном приеме повышают риск смерти больных ХСН. Поэтому эти препараты не могут быть рекомендованы для длительного лечения. При крайне тяжелом состоянии используют ингибитор фосфодиэстеразы левосимендан. Препарат повышает чувствительность сократительных белков к кальцию путем связывания с тропонином С. Этот препарат максимально улучшает показатели гемодинамики, не имеет негативных взаимодействий с БАБ (в отличие от добутамина) и рекомендован ЕОК для лечения обострения ХСН.
Средства для улучшения метаболизма
Несмотря на внушительный список препаратов, рекомендованных и применяемых при ХСН, не ослабевает интерес к ряду средств, называемых миокардиальными цитопротекторами. Основой для изучения их действия стало предположение о возможном улучшении прогноза больных сердечно-сосудистыми заболеваниями за счет стимуляции энергообеспечения миокарда. По сравнению с основными фармакологическими группами метаболические препараты не имеют прямого гемодинамического и инотропного действия, а обеспечивают антиангинальный и антиишемический эффект путем увеличения метаболизма глюкозы и угнетения окисления свободных жирных кислот. Наиболее изучен (с 90-х гг. ХХ в.) препарат триметазидин. Имеются данные об эффективности триметазидина в плане улучшения качества жизни в комплексной терапии ХСН при наличии стенокардии. По мнению ряда авторов, назначение метаболического цитопротектора для лечения ХСН является оправданным с патофизиологической точки зрения, т. к. именно метаболические изменения лежат в основе всех дальнейших нарушений. Однако следует помнить, что применение цитопротекторов должно не заменять, а дополнять комплексную терапию ХСН и основываться на конкретных клинических случаях с оценкой всех факторов риска.
Литература
1) Кушаковский М.С. Хроническая застойная сердечная недостаточность // Идиопатические кардиомиопатии. Фолиант, 1998.
2) Фомин И.В. Беленков Ю.Н. Мареев В.Ю. и соавт. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации – данные ЭПОХА-ХСН // Сердечная недостаточность. 2006. Т. 7 (3). С. 112–115.
3) Беленков Ю.Н. Сердечно-сосудистый континуум // Сердечная недостаточность. 2002. Т. 3 (1). С. 7–11
4) Беленков Ю.Н. Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. Медиа Медика, 2000.
5) Оганов Р.Г. Факторы риска и профилактика сердечно-сосудистых заболеваний. М. Медицина, 2003.
6) Национальные рекомендации ВНОК и ОССН по диагностике и лечению хронический сердечной недостаточности (III пересмотр) // Сердечная недостаточность. 2009. Т. 10. С. 64–106
7) Преображенский Д.В. Павлова А.В. Тарыкина Е.В. Ермакова Т.А. Сидоренко Б.А. Ингибиторы нейрогуморальных систем в комплексной терапии хронической сердечной недостаточности // Consilium Medicum. 2005. Т. 7 (11). С. 929–935.
8) Петрухина А.А. Мареев В.Ю. Скворцов А.А. и соавт. Влияние спиронолактона и дигоксина на прогноз больных ХСН // Сердечная недостаточность. 2008. Т. 9 (3). С. 123–127.
9) Yamori Y. Liu L. Mizushima S. Ikeda K. Nara Y.; CARDIAC Study Group. Male cardiovascular mortality and dietary markers in 25 population samples of 16 countries. J Hypertens. 2006, 24(8), 1499–505.
10) McMurray J. Renin angiotensin blockade in heart failure with preserved ejection fraction: the signal gets stronger. Eur Heart J 2006, 27, 2257–2259.
11) McMurray J.J. Ostergren J. Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and redused left-ventricular function taking angiotensin-converting enzyme inhibitors: the CHARM-Added trial. Lancet 2003, 362, 767–71.
12) Braunwald E. Domanski M.J. Fowler S.E. et al. Angiotensin–converting–enzyme inhibition in stable coronary artery disease. N Engl J Med 2004, 351, 2058–2068.
13) Magliano D.J. Shaw J.E. Zimmet P.Z. How to best define the metabolic syndrome. Ann Med 2006, 38 (1), 34–41.
14) Cosin J. Diez J. and TORIC investigators. Torasemide m chronic heart failure results of the TORIC study Eur J Heart Fail, 2002, 4 (4), 507–513
15) Gheorghiade M. Collucci W.S. Swedberg K. β-Blockers in Chronic Heart Failure. Circulation 2003, 107 (12), 1570–1575.
16) Житникова Л.М. Триметазидин в метаболической терапии сердечно-сосудистых заболеваний // РМЖ. 2012. №14. С. 718–723
17) Покровская Е.М. Гордеев И.Г. Волов Н.А. Кокорин В.А. Таурин в клинике внутренних болезней // Российский кардиологический журнал. 2011. №1. С. 56–60.
Источник: журнал "Медицинский совет" №1 в поликлинике (2013)
Профилактика ХСН
Традиционно любой вид энергичных физических нагрузок не приветствовался при ХСН из-за опасения, что дополнительная гемодинамическая нагрузка приведет к дальнейшему ухудшению сократительной функции миокарда. Однако данное мнение было опровергнуто отсутствием корреляции между функцией ЛЖ и работоспосо.
Основные цели лечения больных миокардитом, на достижение которых должна быть направлена терапия: предотвращение формирования необратимой дилатации камер сердца; предотвращение развития ХСН; предупреждение возникновения угрожающих жизни больного состояний (тяжёлые нарушения ритма и проводимости).
Высокая эффективность ЛС, служащих основой терапии больных с ХСН, подтверждена результатами крупных рандомизированных исследований. Постоянно растет и роль хирургических методов лечения таких больных. Большое значение имеет организация амбулаторного наблюдения. Хотя меры, связанные с образом жизни.
Закон Франка-Старлинга описывает механизм, который способствует поддержанию ударного объема при остром поражении миокарда и может также играть компенсаторную роль при ХСН, хотя последнее маловероятно. Нейрогуморальная активация (внешний механизм) и закон Франка-Старлинга — адаптивные явления, включа.
Нарушения липидного спектра крови занимают ведущее место в перечне факторов риска основных заболеван.
Артериальная гипертензия и сердечная недостаточность
В течение последних двух десятилетий отмечается прогрессирующее увеличение распространенности хронической сердечной недостаточности (ХСН) и смертности больных вследствие данной патологии. Это обусловлено повышением выживаемости больных с сердечно-сосудистыми заболеваниями, в частности перенесших острый коронарный синдром и, таким образом, объективно предрасположенных к развитию ХСН, а также неуклонной тенденцией к нарастанию в популяции доли населения старших возрастных групп. Синдром ХСН – самая частая причина госпитализации и сердечно-сосудистой смертности среди лиц старше 65 лет.
По результатам Фремингемского исследования артериальная гипертензия относится к наиболее распространенным предвестникам ХСН. В 70% случаев наличие АГ предшествует развитию этого синдрома. Конкурирует с АГ ишемическая болезнь сердца (ИБС), которая предполагает формирование ХСН в 59% случаев у мужчин и в 48% случаев у женщин.
Артериальная гипертензия (АГ) является одним из главных патогенетических факторов развития ХСН, обусловленной нарушением диастолической функции левого желудочка (ЛЖ), – так называемой диастолической сердечной недостаточности (СН), которая по современным представлениям относится к клиническому синдрому ХСН с сохраненной систолической функцией ЛЖ.
Диагностика хронической сердечной недостаточности
Диагностика ХСН базируется на следующих критериях:
• симптомы сердечной недостаточности (в покое или при физической нагрузке) – одышка, утомляемость, периферические отеки;
• объективные доказательства дисфункции сердца в покое;
• положительный ответ на специфическое лечение.
Наличие первых двух критериев обязательно во всех случаях установления диагноза ХСН. Улучшение состояния пациента после проведенной терапии (например, приема мочегонных препаратов или нитратов) не является достаточным для подтверждения синдрома ХСН. Лекарственное лечение, вызывая положительную клиническую динамику, может сгладить или замаскировать исходную картину заболевания. В связи с этим началу терапии должен предшествовать четко установленный диагноз ХСН.
Диагностика ХСН не основывается лишь на оценке клинических симптомов и признаков, ни один из которых не является достаточно чувствительным и специфичным. Для подтверждения синдрома ХСН требуются объективные доказательства дисфункции сердечной мышцы, полученные при проведении эхокардиографии или/и радионуклидной вентрикулографии, сцинтиграфии, магнитно-резонансной томографии, катетеризации полостей сердца.
Классификация хронической сердечной недостаточности Украинской ассоциации кардиологов
Основные термины:
• клиническая стадия СН;
• вариант СН;
• функциональный класс (ФК) пациента.
Шифр по МКБ-10: I 50, I 50.0.
Клинические стадии СН: I; II А; II Б; III.
Указанные стадии соответствуют I, IIА, IIБ и III стадиям хронической недостаточности кровообращения согласно классификации Н.Д. Стражеско, В.Х. Василенко.
Варианты СН:
• с систолической дисфункцией ЛЖ: фракция выброса (ФВ) ЛЖ ≤45%;
• с сохраненной систолической функцией ЛЖ: ФВ ЛЖ >45%.
Функциональные классы кардиологических пациентов в соответствии с критериями Нью-Йоркской ассоциации сердца:
• ФК I – пациенты с заболеванием сердца, у которых выполнение обычных физических нагрузок не вызывает одышки, усталости или сердцебиения.
• ФК II – пациенты с заболеванием сердца и умеренным ограничением физической активности. Одышка, усталость, сердцебиение наблюдаются при выполнении обычных физических нагрузок.
• ФК III – пациенты с заболеванием сердца и выраженным ограничением физической активности. В состоянии покоя жалобы отсутствуют, но даже при незначительных физических нагрузках появляются одышка, усталость, сердцебиение.
• ФК IV – пациенты с заболеванием сердца, у которых любой уровень физической активности вызывает вышеуказанные субъективные симптомы, возникающие и в состоянии покоя.
Определение вариантов ХСН возможно только при наличии соответствующих данных эхокардиографического исследования, а именно – фракции выброса. Кроме того, необходимо учитывать возможные причины развития ХСН. Так, в случае выраженной митральной регургитации (III-IV степени) определенная ФВ завышена, поэтому установление варианта СН в этом случае является недостаточно объективным. Наиболее простым способом уточнения ФК пациента с СН является проведение 6-минутного теста с ходьбой. Состояние пациентов, способных за 6 минут преодолеть от 426 до 550 м, соответствует I ФК; 301-425 м – II ФК; 150-300 м – III ФК; менее 150 м – IV ФК. Невозможность за 6 минут пройти более 300 м является предиктором неблагоприятного прогноза. Тем не менее, следует помнить, что снижение толерантности к физической нагрузке, свойственное больным с ХСН, слабо коррелирует со степенью дисфункции ЛЖ, однако может служить критерием оценки эффективности проводимой терапии в ежедневной практике.
Лечение хронической сердечной недостаточности
Рекомендации по лечению больных с ХСН базируются на результатах, полученных в многоцентровых международных рандомизированных исследованиях, и выполняют следующие задачи:
• профилактика и/или лечение заболеваний, которые приводят к дисфункции миокарда и ХСН;
• сохранение или улучшение качества жизни пациентов;
• увеличение продолжительности жизни пациентов.
В соответствии с ними выделяют мероприятия общего характера, лекарственную терапию, а также хирургические, механические и электрофизиологические вмешательства.
Общие мероприятия предусматривают лечение основного заболевания и коррекцию факторов риска ХСН.
Артериальная гипертензия относится к основным факторам риска развития ХСН, поэтому нормализация и контроль артериального давления (АД) уменьшают вероятность возникновения ХСН. У пациентов, длительно принимающих антигипертензивные препараты, ХСН формируется значительно реже (в среднем на 50%). Раннее выявление и лечение АГ считается наиболее эффективным методом предупреждения ХСН. В соответствии с современными рекомендациями Украинской ассоциации кардиологов по профилактике и лечению АГ целевой уровень АД для больных с АГ составляет 140/90 мм рт. ст. и ниже, а у пациентов с сопутствующей СН систолическое АД (САД) следует понижать до 110-130 мм рт. ст.
У значительной части пациентов АГ сочетается с ишемической болезнью сердца (ИБС). Эпизоды ишемии миокарда, развитие диффузного и очагового миокардиофиброза могут сопровождаться сначала ухудшением диастолической функции ЛЖ, а затем формированием диастолического варианта ХСН. В случае существенной потери сократительной зоны миокарда, патологического ремоделирования ткани с преимущественной дилатацией полости сердца развивается ХСН со сниженной систолической функцией ЛЖ. В связи с этим для эффективного предотвращения ХСН у больных с ИБС необходимо проведение ее вторичной лекарственной профилактики и, по показаниям, решение вопроса о реваскуляризации миокарда.
Рекомендуются диетическая и лекарственная коррекции гипер- и дислипидемий, снижение уровня гипергликемии при сахарном диабете, фармакологическая или хирургическая коррекция тахиаритмий и пороков сердца. Необходимо устранять факторы, которые могут самостоятельно вызывать повреждение сердца (отказ от курения, употребления алкоголя и наркотиков, лечение гипертиреоза и др.), проводить диетические мероприятия, направленные на снижение массы тела при ожирении.
Пациенту следует ограничить потребление натрия хлорида с пищей: при доклинической и умеренной ХСН (I-II ФК) – менее 3 г в сутки, не употреблять соленых продуктов и не подсаливать пищу во время еды; при ХСН III-IV ФК – менее 1,5 г в сутки, не солить пищу во время приготовления, регулярно измерять массу тела (1 раз в день в период активной диуретической терапии и 1-2 раза в неделю после достижения эуволемического состояния). Объем жидкости, поступающей в организм больного, который находится в состоянии декомпенсации, не должен превышать 1-1,2 л.
Следует поощрять ежедневную физическую активность у компенсированных пациентов в соответствии с их функциональными возможностями и не рекомендовать выполнение изометрических нагрузок. Физическая реабилитация больных предусматривает ходьбу, тредмил или велотренинг, начиная с 5-10-минутных ежедневных занятий с постепенным увеличением продолжительности физических упражнений до 15-30 минут 3-5 раз в неделю при достижении 60-80% максимальной частоты сердечных сокращений. В исследованиях показано, что у пациентов с СН II-III ФК регулярная физическая активность повышает толерантность к физическим нагрузкам на 15-25%, снижает выраженность клинической симптоматики и улучшает качество жизни (уровень доказательности В).
Пациенту с синдромом ХСН желательно избегать длительных перелетов, смены климата (поднятие на высоту, жара, высокая влажность), что может способствовать обезвоживанию или задержке жидкости в организме, образованию венозных тромбов.
Больного с СН, особенно III-IV ФК, следует предостеречь от чрезмерной сексуальной активности для уменьшения риска декомпенсации. В качестве симптоматического средства рекомендуется предварительный прием нитратов.
Проведение иммунизации вакциной против гриппа и пневмококка позволяет снизить риск респираторных инфекций и избежать последующего ухудшения состояния больного.
Существует ряд лекарственных препаратов, которые могут ухудшать клиническое состояние пациента с ХСН, поэтому их следует применять с особой осторожностью:
• нестероидные противовоспалительные средства;
• антиаритмические препараты первого класса;
• антагонисты кальция (препараты первого поколения дигидропиридинового ряда); верапамил и дилтиазем (не рекомендуется назначать пациентам с ХСН и систолической дисфункцией ЛЖ). Длительно действующие антагонисты кальция (амлодипин, фелодипин) могут использоваться в качестве антигипертензивных препаратов и дополнять базовую лекарственную терапию при ХСН;
• трициклические антидепрессанты, литий;
• кортикостероиды;
• β-адреноблокаторы;
• некоторые антибиотики (аминогликозиды – стрептомицин, гентамицин, канамицин, амикацин и др.; эритромицин, тетрациклин, амфотерицин В).
Медикаментозная терапия при хронической сердечной недостаточности с систолической дисфункцией левого желудочка
Ингибиторы АПФ следует назначать всем больным с ХСН, обусловленной систолической дисфункцией ЛЖ (ФВ≤45%), если нет противопоказаний к их применению или данных о непереносимости ингибиторов АПФ в анамнезе. Дозу ингибиторов АПФ необходимо титровать до уровней, установленных в контролируемых исследованиях по лечению ХСН, а не исходя из терапевтического эффекта.
При бессимптомной дисфункции ЛЖ и документированной сниженной систолической функции ЛЖ препаратами первой линии являются ингибиторы АПФ. В ряде исследований продемонстрировано, что длительный прием ингибиторов АПФ у этой категории больных снижает развитие клинически выраженной ХСН и уменьшает количество госпитализаций.
При отсутствии признаков задержки жидкости лечение ХСН начинают с ингибиторов АПФ, а при задержке жидкости их применяют вместе с диуретиками. К лечению приступают не ранее чем через 24 ч после отмены (или снижения интенсивности) терапии диуретиками, коррекции дозы вазодилататоров (желательно в вечернее время для уменьшения вероятности гипотонии). Во время приема препаратов необходимо контролировать содержание калия и креатинина в крови через 1-2 недели после каждого увеличения дозы, затем – через 3 месяца, в последующем – через 6 месяцев после начала лечения. Увеличение содержания креатинина в крови на 50% – показание к отмене ингибиторов АПФ.
К абсолютным противопоказаниям к назначению ингибиторов АПФ относят беременность, лактацию, двусторонний стеноз почечных артерий, ангионевротический отек при приеме препаратов этой группы в анамнезе, САД менее 90 мм рт. ст. гиперкалиемия более 5,4 ммоль/л. Особой осторожности и тщательного наблюдения при терапии ингибиторами АПФ требуют больные с концентрацией креатинина в крови, приближающейся к значению 265 мкмоль/л (3 мг/дл), содержанием натрия в крови менее 135 ммоль/л, а также наличием критических стенозов клапанов. Нестероидные противовоспалительные препараты могут ослаблять благоприятные эффекты ингибиторов АПФ и усиливать их нежелательные реакции, поэтому следует избегать их использования у больных с ХСН.
Наша справка
Согласно рекомендациям по диагностике и терапии ХСН, опубликованным Рабочей группой по диагностике и терапии ХСН Европейского общества кардиологов в 2005 г. терапию ингибиторами АПФ необходимо начинать с низкой дозы, а затем повышать ее до целевого уровня. Рекомендованные начальные и поддерживающие дозы (с зарегистрированным влиянием на снижение показателей смертности/госпитализации) ингибиторов АПФ, эффективность которых при СН была доказана в странах Европы, приведена в таблице (Прим. ред.).
Диуретики. Больные с признаками застоя жидкости должны получать диуретик до достижения эуволемического состояния, после чего терапию диуретиками нужно продолжить для предупреждения рецидива задержки жидкости. Диуретики вызывают симптоматическое улучшение состояния больного: уменьшают одышку и увеличивают толерантность к физической нагрузке, причем клинические эффекты препаратов этого класса проявляются значительно быстрее, чем других (ингибиторов АПФ, β-адреноблокаторов, сердечных гликозидов), используемых при лечении ХСН.
Предпочтение отдают петлевым диуретикам (фуросемид, буметанид, торасемид). В случае умеренной ХСН и сохраненной функции почек могут применяться тиазидные диуретики (гидрохлортиазид, метолазон), которые малоэффективны при скорости клубочковой фильтрации менее 30 мл/мин, что приблизительно соответствует уровню креатинина 221 мкмоль/л, или 2,5 мг/дл, за исключением случаев совместного назначения с петлевым диуретиком. Тиазидоподобный диуретик метолазон сохраняет свою эффективность и при тяжелой почечной недостаточности (снижении клиренса креатинина до 10 мл/мин).
Терапию диуретиками начинают с назначения низких доз препаратов, которые в дальнейшем повышают в зависимости от количества выделяемой мочи. Как правило, масса тела в начале лечения мочегонным средством должна снижаться не более чем на 0,5-1,0 кг в сутки. У пациентов с тяжелой ХСН применение максимальных доз не всегда приводит к желаемому диуретическому эффекту. Резистентность к высоким дозам диуретиков может развиваться по следующим причинам:
• употребление больным большого количества натрия с пищей;
• совместное назначение нестероидных противовоспалительных средств, включая ингибиторы циклооксигеназы-2;
• значительное нарушение функции почек или снижение их перфузии.
Для преодоления рефрактерности к лечению мочегонными препаратами назначают петлевой диуретик дважды в сутки или внутривенное введение (в том числе в виде непрерывной инфузии), комбинацию петлевого и тиазидного диуретиков (гидрохлортиазида, более мощного – метолазона), а также сочетание диуретиков и негликозидных инотропных средств (например, допамина в дозе 1-2 мкг/кг/мин). Калийсберегающие диуретики (амилорид, триамтерен, спиронолактон) применяют при персистирующей гипокалиемии, которая сохраняется, несмотря на сопутствующее лечение ингибиторами АПФ, а у пациентов с тяжелой ХСН – несмотря на сочетание ингибиторов АПФ и низких доз спиронолактона. Лечение препаратами калия в этой ситуации считается менее эффективным. Доза калийсберегающего диуретика титруется под контролем содержания калия и креатинина в крови, определение которого проводится каждые 5-7 дней до стабилизации уровня калия в крови. В дальнейшем исследование крови осуществляется каждые 3-6 месяцев.
β-Адреноблокаторы согласно современным рекомендациям следует назначать всем стабильным больным с мягкой, умеренной и тяжелой ХСН (ІІ-IV ФК) с систолической дисфункцией ЛЖ, которые получают ингибиторы АПФ и диуретики, если у них нет противопоказаний или указаний о непереносимости β-адреноблокаторов в анамнезе. У пациентов с перенесенным инфарктом миокарда и сниженной систолической функцией ЛЖ, клинически явной ХСН или без нее длительное лечение β-адреноблокаторами должно дополнять терапию ингибиторами АПФ с целью снижения смертности больных.
Лечение β-адреноблокаторами эффективно лишь при соблюдении определенных правил. Карведилол, метопролола сукцинат CR/XL, бисопролол и небиволол обычно дополняют стандартную терапию, включающую ингибиторы АПФ и диуретики. Пациент должен находиться в гемодинамически стабильном состоянии, не требующем инфузии негликозидных инотропных препаратов и активной терапии диуретиками. Применение β-адреноблокаторов противопоказано у больных с бронхоспастическими заболеваниями легких, атриовентрикулярной блокадой I, II и III степеней (если не имплантирован водитель ритма), клинически выраженной брадикардией (<55-60 уд/мин) и гипотонией (САД<90 мм рт. ст.), синдромом слабости синусового узла, тяжелым поражением артерий нижних конечностей. Следует учитывать, что действие b-адреноблокаторов может быть двухфазным: долгосрочному улучшению прогноза жизни больного иногда предшествует первоначальное ухудшение его клинического состояния. Терапию β-адреноблокаторами начинают с назначения очень низких доз, которые в зависимости от переносимости постепенно, в течение недель (месяцев), повышают до целевых. У тяжелой категории пациентов с ХСН (IV ФК) и ФВ<25% препаратом выбора является карведилол.
Больному необходимо ежедневно измерять массу тела для своевременного распознавания задержки жидкости, которая может наблюдаться в начале терапии β-адреноблокаторами. При увеличении массы тела следует повысить дозу диуретика и добиться ее возвращения к исходному значению, отложив запланированное повышение дозы препарата. Внезапное прекращение терапии может привести к острой декомпенсации ХСН. Лишь при выраженной декомпенсации β-адреноблокатор может быть временно отменен до стабилизации состояния больного. После улучшения состояния больного терапию β-адреноблокаторами возобновляют. Лечение продолжают неопределенно долгое время в целевых или максимально переносимых дозах. Ни задержка жидкости, ни признаки и симптомы декомпенсации ХСН не являются основанием для долговременной отмены β-адреноблокаторов.
Антагонисты рецепторов ангиотензина ІІ могут быть назначены больным с ХСН в случаях клинической непереносимости ингибиторов АПФ. Антагонисты рецепторов ангиотензина ІІ не следует применять у больных, ранее не получавших ингибиторы АПФ, и ими не следует заменять ингибиторы АПФ у больных, которые переносят их удовлетворительно. Подобно ингибиторам АПФ антагонисты рецепторов ангиотензина ІІ вызывают гипотонию, нарушение функции почек и гиперкалиемию.
В настоящее время в клинике для лечения больных с ХСН используются лосартан, валсартан, ирбесартан, кандесартан, телмисартан, эпросартан. Опыт их применения при ХСН намного меньший, чем ингибиторов АПФ, поэтому продолжаются исследования, которые позволят получить окончательный ответ на вопрос, являются ли антагонисты рецепторов ангиотензина ІІ равноценной заменой ингибиторам АПФ у больных с ХСН. Следует заметить, что на сегодня положительный опыт применения антагонистов рецепторов ангиотензина ІІ у больных с ХСН существует лишь для валсартана и кандесартана.
Сердечные гликозиды рекомендуются при фибрилляции предсердий у больных с ХСН для замедления частоты желудочковых сокращений, что позволяет улучшить функцию сердца и ослабить симптомы ХСН. У пациентов с синусовым ритмом и ХСН дигоксин назначают для улучшения клинического состояния больного в период декомпенсации, если оно сохраняется, несмотря на совместное применение ингибиторов АПФ, диуретиков и β-адреноблокаторов.
Из всех сердечных гликозидов лишь эффективность и безопасность дигоксина изучались в плацебо контролируемых исследованиях. Доказано, что лечение дигоксином у больных с легкой и умеренной ХСН может ослаблять ее симптомы, улучшать качество жизни и повышать толерантность к физической нагрузке независимо от этиологии ХСН, характера сердечного ритма и сопутствующей терапии (β-адреноблокаторами и/или ингибиторами АПФ). Однако недавний проспективный анализ результатов исследования DIG показал, что пациенты женского пола, получавшие дигоксин, имели худший прогноз по сравнению с группой плацебо. Таким образом, дигоксин лучше назначать в низкой дозе пациентам мужского пола в случаях, когда, несмотря на комбинированное лечение ингибитором АПФ, диуретиком и β-адреноблокаторами, сохраняются симптомы ХСН. Обычная суточная доза дигоксина при пероральном приеме составляет 0,125 – 0,250 мг при нормальном уровне креатинина в крови (у пожилых пациентов – 0,0625 – 0,125 мг), при нарушении функции почек доза препарата должна быть снижена на 30-70%.
Спиронолактон рекомендуется назначать пациентам с ХСН (ІІІ-IV ФК) в дополнение к терапии ингибитором АПФ, диуретиком и β-адреноблокатором для улучшения выживаемости больных
Нитраты при ХСН могут использоваться как дополнительные средства с целью лечения сопутствующей стенокардии или АГ, а также в случае декомпенсации, сопровождающейся признаками легочного застоя и левожелудочковой недостаточностью.
Негликозидные инотропные препараты допускаются при лечении больных с терминальной стадией ХСН с целью улучшения гемодинамики и клинической симптоматики в случае рефрактерности ко всем другим лекарственным препаратам.
Непрямые антикоагулянты назначаются больным с ХСН и систолической дисфункцией ЛЖ для профилактики тромбообразования при постоянной форме фибрилляции предсердий, тромбоэмболических эпизодах любой локализации, митральном стенозе. Если при терапии непрямыми антикоагулянтами невозможно осуществлять регулярный лабораторный контроль (определение международного нормализованного отношения или протромбинового индекса) либо имеются противопоказания к их применению, рекомендуется назначать аспирин в дозе 100-325 мг в сутки. Однако у пациентов, склонных к повторным госпитализациям, длительный прием аспирина может увеличивать риск развития декомпенсации кровообращения.
Амиодарон используют для купирования или предупреждения пароксизмов фибрилляции предсердий, лечения и профилактики опасных для жизни желудочковых аритмий высоких градаций, которые наблюдаются, несмотря на лечение β-адреноблокаторами и ингибиторами АПФ в оптимальных дозах.
Хроническая сердечная недостаточность с сохраненной систолической функцией левого желудочка
У значительной части больных (около 30%) с клиническими проявлениями СН фракция выброса не снижена. Для обозначения этих случаев используют термин «сердечная недостаточность с сохраненной систолической функцией ЛЖ».
СН с сохраненной систолической функцией ЛЖ и диастолическая СН по определению Европейского общества кардиологов (2001) не являются синонимами. Первое определение – более широкое понятие, включающее любые проявления СН с ФВ более 45%, второе – только случаи СН с подтвержденным нарушением диастолической функции ЛЖ.
Причины ХСН у больных с сохраненной систолической функцией ЛЖ:
• Диастолическая дисфункция.
Аномальное расслабление ЛЖ:
— диффузная ишемия;
— гипертрофия ЛЖ (АГ, гипертрофическая кардиомиопатия, аортальный стеноз);
— кардиомиопатия;
— пожилой возраст.
Изменение пассивных эластических свойств миокарда ЛЖ:
— гипертрофия миокарда;
— накопление аномального коллагена;
— фиброз;
— инфильтративные заболевания сердца (амилоидоз, саркоидоз);
— гемохроматоз;
— эндомиокардиальные поражения (эндомиокардиальный фиброз).
• Транзиторное ухудшение диастолической функции ЛЖ, которое при последующих исследованиях исчезает (тахикардия, ишемия, высокое АД, алкогольная кардиомиопатия).
• Правожелудочковая СН (при хронических обструктивных заболеваниях легких).
• Механическое препятствие притоку крови в ЛЖ (митральный стеноз, миксома левого предсердия, констриктивный или экссудативный перикардит, тампонада).
• Брадисистолии.
• Неправильная интерпретация систолической функции ЛЖ (например, при митральной недостаточности).
Диагностические критерии диастолической сердечной недостаточности
Заподозрить диастолическую СН практический врач должен в тех случаях, когда фракция выброса >45% (особенно когда она превышает 50%), очевидна клиническая картина СН с ее типичными проявлениями: одышкой, ортопноэ, отеками и др. Никаких клинических отличий диастолической СН от систолической нет. Характерна эхокардиографическая картина: конечный диастолический размер ЛЖ не увеличен, стенки, как правило, утолщены, ФВ в норме. Эти признаки указывают на высокую вероятность диастолического варианта СН и требуют исключения других причин СН с сохраненной ФВ: пороков сердца, перикардита, правожелудочковой недостаточности («легочного» сердца). Необходимо обратить внимание на такие возможные преходящие причины СН, как тахикардия, значительное повышение АД, ишемия миокарда, злоупотребление алкоголем, что также может обусловливать развитие синдрома СН у больных с нормальными до этого показателями ФВ. После исключения указанных состояний диагноз диастолической СН становится очень вероятным. Для его подтверждения необходимы доказательства нарушения диастолической функции ЛЖ, полученные с помощью допплерэхокардиографии или вентрикулографии (контрастной или радионуклидной). В связи с тем, что эти методы не являются рутинными, постановка диагноза диастолической СН в повседневной клинической практике затруднена, и он, как правило, носит предположительный характер.
Наибольшее значение в оценке состояния диастолической функции ЛЖ имеют неинвазивные методы исследования: радионуклидная вентрикулография и допплерэхокардиография. Для установления диагноза диастолической СН наряду с клиническими признаками ХСН и наличием нормальной или незначительно сниженной ФВ (>45%) необходимо объективное подтверждение аномального расслабления или наполнения, или растяжимости (податливости), или жесткости ЛЖ. Согласно рекомендациям Рабочей группы Европейского общества кардиологов (1998) к критериям первичной диастолической ХСН относятся:
• клинические признаки или симптомы ХСН;
• нормальная или незначительно сниженная систолическая функция ЛЖ (ФВ ≥45% и индекс конечно-диастолического объема ЛЖ<102 мл/м 2 );
• объективные доказательства нарушения диастолической функции ЛЖ – расслабления, наполнения, растяжимости (податливости) и жесткости ЛЖ.
Критерии ухудшения расслабления:
• время изоволюмического расслабления IVRT>92 мс (<30 лет), >100 мс (30-50 лет), >105 мс (>50 лет);
• константа активного расслабления Tau>48 мс;
• степень (скорость) падения давления в ЛЖ dP/mindt <1100 мм рт. ст.·с -1 .
Критерии замедленного раннего наполнения ЛЖ:
• соотношение скоростей раннего и позднего диастолического наполнения Е/А<1,0 и время замедления раннего диастолического наполнения DT>220 мс (<50 лет), Е/А<0,5 и DT>280 мс (>50 лет);
• соотношение систолической и диастолической антеградных волн спектра легочных вен S/D>1,5 (<50 лет), >2,5 (>50 лет);
• скорость раннего диастолического наполнения ЛЖ по данным контрастной вентрикулографии PFR<160 мл· с-1 м -1 ;
• PFR (по данным радионуклидной вентрикулографии) <2,0 (<30 лет), <1,8 (30-50 лет), <1,6 (>50 лет) КДО·с -1;
Критерии ухудшения растяжимости (податливости) ЛЖ:
• конечно-диастолическое давление ЛЖ >16 мм рт. ст. или легочное капиллярное давление заклинивания >12 мм рт. ст.;
• скорость предсердной волны в легочных венах Аpv >35 см·с -1 .
Критерии повышения жесткости миокарда или камеры ЛЖ:
• константа жесткости камеры >0,27;
• константа миокардиальной жесткости >16.
По данным допплерэхокардиографии выделяют три патологических типа кривых трансмитрального кровотока: с нарушенным расслаблением (гипертрофический), псевдонормальный и рестриктивный. Характер трансмитрального кровотока отражает степень тяжести имеющейся диастолической дисфункции ЛЖ. Прогрессирование диастолических нарушений сопровождается последовательным переходом трансмитрального спектра с нарушенным расслаблением в псевдонормальный и рестриктивный типы диастолического потока.
Для улучшения распознавания диастолической СН предлагается использовать определение в крови натрийуретических пептидов (МНУП, ЦНУП), хотя их уровень у больных с ХСН повышается как при наличии систолической дисфункции ЛЖ, так и при выявлении диастолических нарушений ЛЖ. В настоящее время золотой стандарт диагностики диастолической СН отсутствует, тем не менее клиницистам не следует игнорировать этот вариант СН, поскольку риск смерти у больных с диастолической ХСН в 4 раза выше, чем у лиц соответствующего пола и возраста без признаков СН.
Принципы лечения при ХСН, обусловленной диастолической дисфункцией ЛЖ, базируются на клинических исследованиях, проведенных в небольших группах пациентов, и в основном имеют эмпирический характер, основанный на патофизиологических механизмах формирования диастолической ХСН. В отличие от лечения ХСН с систолической дисфункцией ЛЖ, терапия диастолической ХСН только начинает изучаться в крупных рандомизированных исследованиях.
Современное лечение диастолической ХСН предполагает коррекцию причинных и усугубляющих факторов диастолической дисфункции ЛЖ, а именно:
• контроль уровня АД;
• контроль тахикардии;
• регресс гипертрофии ЛЖ;
• уменьшение ишемии миокарда;
• уменьшение гиперволемии;
• подавление нейрогуморальной активации.
Для больных с АГ и диастолической СН рекомендуют снижение АД до уровня <130/80 мм рт. ст. Помимо этого, тактика лечения определяется тяжестью СН, степенью выявленных диастолических нарушений и давлением наполнения ЛЖ. Чем выше давление наполнения ЛЖ, тем тяжелее состояние больного и выше его функциональный класс. Лечение диастолической СН должно способствовать его снижению.
Диуретики и нитраты вызывают снижение давления наполнения за счет уменьшения системного и легочного венозного возврата, тем самым, облегчая клинические проявления застойной ХСН. Однако чрезмерное снижение преднагрузки ЛЖ может привести к тяжелой гипотензии и низкому сердечному выбросу, поскольку по мере прогрессирования диастолической дисфункции ЛЖ возрастает значимость высокого давления в левом предсердии для обеспечения адекватного сердечного выброса.
У пациентов с рестриктивным типом трансмитрального кровотока наполнение ЛЖ определяется собственно высоким давлением в левом предсердии. В связи с этим назначение диуретиков и нитратов требует большой осторожности и соответствующей коррекции дозы. Несмотря на клиническое улучшение при их применении, влияние этих препаратов на выживаемость больных с ХСН неизвестно. Доказательства эффективности β-адреноблокаторов, антагонистов кальция, ингибиторов АПФ также не получены. β-Адреноблокаторы, замедляя сердечный ритм, удлиняют диастолу, создавая условия для полного завершения исходно замедленного расслабления ЛЖ. Они уменьша ют потребность миокарда в кислороде, оказывают антигипертензивное действие, могут ингибировать развитие гипертрофии ЛЖ и фиброза. Подобно антагонистам кальция, β-адреноблокаторы контролируют частоту сердечных сокращений при фибрилляции предсердий, таким образом способствуя улучшению наполнения ЛЖ в период систолы предсердия.
Антагонисты кальция благоприятно воздействуют на диастолическую дисфункцию ЛЖ, контролируя уровень АД, снижая потребность миокарда в кислороде, вызывая дилатацию коронарных артерий и обратное развитие гипертрофии ЛЖ. Однако еще не оценено их влияние на выживаемость и прогрессирование ХСН, обусловленной диастолической дисфункцией.
Дигоксин не рекомендуется при диастолической СН, поскольку может усугубить диастолическую дисфункцию ЛЖ. Вместе с тем у больных с фибрилляцией предсердий и тахиаритмией возможно его использование в качестве альтернативного препарата или в комбинации с β-адреноблокаторами или антагонистами кальция для замедления частоты сердечных сокращений. Ингибиторы АПФ доказали свою высокую эффективность при лечении ХСН с систолической дисфункцией ЛЖ и являются наиболее перспективными при лечении ХСН с сохраненной систолической функцией ЛЖ. В недавнем исследовании продемонстрировано, что применение антагониста рецепторов ангиотензина II кандесартана у данной категории больных приводило к снижению частоты госпитализаций в связи с декомпенсацией ХСН.
Продолжение в №21.