Pharmacological effects on sympathetic tonus and heart rate in cardiovascular disease
N.Sh. Zagidullin*, Sh.Z. Zagidullin
Bashkir State Medical University. Ufa, Bashkir Republic, Russia
Одним из основных направлений в лечении артериальной гипертензии (АГ) и ишемической болезни сердца (ИБС) в последнее время служит снижение активности симпатической нервной системы и одного из ее важнейших маркеров — частоты сердечных сокращений (ЧСС), которая является независимым фактором риска развития сердечно-сосудистых осложнений. В настоящее время выделяют 3 наиболее распространенные группы лекарственных препаратов, модулирующих симпатическую активность: β-адреноблокаторы (β-АБ), ингибиторы If канала и антагонисты кальция, преимущественно дигидропиридинового ряда (верапамил СР). Верапамил СР, в отличие от β-АБ, умеренно снижает ЧСС и гиперсимпатикотонию, одновременно обладая высокой антигипертензивной, антиангинальной активностью, и минимальным количеством побочных эффектов, является препаратом выбора как при АГ, так и ИБС.
Ключевые слова: симпатическая нервная система, частота сердечных сокращений, регуляция ритма сердца, сердечно-сосудистая смертность, фармакотерапия.
Recently, one of the leading approaches in the management of arterial hypertension (AH) and coronary heart disease (CHD) is reduction of sympathetic activity and one of its markers, heart rate (HR). HR is known as an independent predictor of cardiovascular risk. At present, there are three main groups of the medications modulating sympathetic activity: beta-adrenoblockers (BAB), If channel inhibitors, and calcium antagonists, mostly dihydropyridine-type ones (verapamil SR). In contrast to BAB, verapamil SR combines moderate reduction in HR and sympathetic tonus with high antihypertensive and anti-anginal activity and minimal adverse effects. Therefore, verapamil SR is a medication of choice in AH and CHD treatment.
Key words: Sympathetic autonomous system, heart rate, heart rate regulation, cardiovascular mortality, pharmacotherapy.
Актуальность
В последние десятилетия широко обсуждается роль симпатической нервной системы (СНС) в патогенезе сердечно-сосудистых заболеваний (ССЗ), в частности, при гипертонической болезни (ГБ) и ишемической болезни сердца (ИБС). Одним из самых важных проявлений гиперсимпатикотонии является повышенная частота сердечных сокращений (ЧСС), которая увеличивает смертность от ССЗ как в популяции, так и в некоторых группах риска. Поэтому среди целей лечения перечисленных заболеваний должно быть снижение ЧСС до рекомендуемых цифр. Для контроля ритма сердца в арсенале врача существуют следующие основные группы препаратов:
β-адреноблокаторы (β-АБ), If ингибиторы и антагонисты кальция (АК). Классическим препаратом для снижения симпатической активности и ЧСС в последние десятилетия считают β-АБ, однако данная группа лекарственных средств обладает наименьшей комплаентностью среди всех антигипертензивных препаратов (АГП) и не всегда хорошо контролирует артериальное давление (АД), в особенности у пожилых лиц [1]. В лечении АГ в настоящее время не существует убедительных доказательств превосходства β-АБ по влиянию на первичные и вторичные конечные точки при АГ перед другими препаратами, в частности АК [2,3]. Наличие у β-АБ целого ряда побочных эффектов, таких как отрицательное инотропное действие, депрессии, бронхоконстрикция и т. п. обуславливают необходимость поиска новых стратегий для контроля ЧСС, АД и повышения приверженности. Одним из таких вариантов при ГБ или ИБС может быть использование пролонгированного АК верапамила (Изоптина СР, ЭББОТТ, США) самостоятельно или в комбинации с другими АГП, в частности, ингибитором ангиотензин-превращающего фермента (ИАПФ), препаратом трандолаприл (Тарка, ЭББОТТ, США). Одним из самых новых препаратов для «чистого» урежения ритма сердца является ингибитор If канала ивабрадин.
В настоящем обзоре были продемонстрированы значимость и влияние СНС и ЧСС на сердечно-сосудистые события, механизмы регуляции ритма сердца, а также лекарственные средства, обладающие способностью контролировать ритм сердца.
СНС, ЧСС и сердечно-сосудистые события
СНС является важным регулятором кардиоваскулярного гомеостаза. Ее базальная активность определяется генетическими факторами, физической активностью и особенностями медикаментозной терапии. Симпатическая активность стимулируется стрессовыми факторами, холодом, болью, физической активностью и некоторыми заболеваниями. Действие СНС опосредуется через свои медиаторы, в первую очередь адреналин и норадреналин. Установлено, что АГ в большинстве случаев сопровождается гиперсимпатикотонией. Более того, гиперактивность СНС у гипертоников в ответ на стресс является проявлением наследственной предрасположенности [4]. При сердечной недостаточности (СН), которая ассоциируется с увеличением симпатической активности, концентрация катехоламинов в крови обратно пропорциональна выживаемости [5]. По данным некоторых исследователей [6,7], примерно у 2/3 больных АГ отмечена тахикардия. Поэтому одной из важнейших задач антигипертензивной терапии (АГТ) должно быть снижение активности СНС, что проявляется не только в улучшении качества жизни (КЖ), но и в уменьшении смертности. В некоторых других исследованиях была выявлена зависимость между ЧСС и степенью выраженности коронарного атеросклероза [8-10], а также риском разрыва атеросклеротической бляшки [11].
Наблюдаются различные проявления гиперсимпатикотонии, прежде всего, в вазоконстрикции с повышением АД и ЧСС (рисунок 1). У млекопитающих была установлена четкая корреляция между ЧСС и продолжительностью жизни. В частности, у мышей при ЧСС
600 уд/мин продолжительность жизни составляет 1 год, а у кита с частотой 20 уд/мин — 30-45 лет. В многочисленных клинических исследованиях (рисунок 2), в т.ч. в Российской Федерации [12-14], были показаны прямая зависимость между продолжительностью жизни и ЧСС и, соответственно, снижение сердечно-сосудистого риска и смертности при приеме ЧСС-снижающих препаратов, в частности β-АБ [15,16]. Однако полученные результаты были лишь «побочными» результатами исследований и специальной задачи для определения подобной корреляции не ставилось. В исследовании BEAUTIFUL (MorBidity-mortality EvAlUaTion of the If inhibitor ivabradine in patients with coronary disease and left ventricULar dysfunction) [17] и INVEST (INternational VErapamil-SR/trandolapril STudy) [7], одной из основных задач впервые было определение зависимости между этими параметрами. В проекте BEAUTIFUL была показана зависимость частоты госпитализации вследствие фатального и нефатального инфаркта миокарда (ИМ), а также коронарной реваскуляризации от ЧСС. За время наблюдения в подгруппе больных с ЧСС > 70 уд/мин обнаружено превышение риска кардиоваскулярной смерти на 34 %, увеличение госпитализации по поводу СН на 53 %, увеличение госпитализации по поводу ИМ (фатального и нефатального) на 46 % и частоты коронарной реваскуляризации на 38 %. Для риска кардиоваскулярных событий и госпитализации в связи с СН была показана прямая зависимость от роста ЧСС. В исследовании INVEST среди пожилых больных ИБС и АГ базовая ЧСС в покое ассоциировалась с повышением риска побочных эффектов независимо от стратегии лечения и некоторых сопутствующих заболеваний, таких как сахарный диабет (СД) или перенесенный ИМ, а оптимальная ЧСС при данных сочетаниях болезней определялась на уровне 59 уд/мин. В некоторых эпидемиологических исследованиях было показано, что АГ ассоциируется с небольшим, но достоверным увеличением ЧСС [14,18].
Рис. 1. Гиперактивность СНС и риск развития ССО.
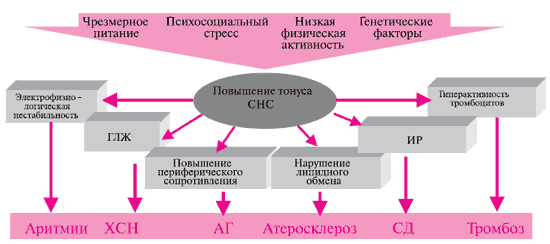
Рис. 2 Зависимость ОС и сердечно-сосудистой смертности от ЧСС у мужчин в возрасте 35-55 лет.
Примечание: ОС — общая смертность.
Механизмы регуляции ритма сердца
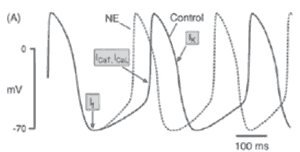
Для более глубокого понимания механизмов действия лекарственных средств, способных модулировать ЧСС, следует учитывать клеточные механизмы ее регуляции и точки приложения препаратов. β- и α1 -адренорецепторы в сердце ответственны за первичный прямой эффект адренергической активации в сердце. В настоящее время идентифицированы несколько подтипов β-рецепторов: β1. β2 и β3. β1 -рецепторы в основном (
70 %) находятся в миокарде, в то время как β2 -рецепторы — в сердце и гладкомышечной мускулатуре мелких сосудов и бронхиол. Стимуляция обоих типов рецепторов ведет к повышению сократительной способности сердца и ЧСС. Катехоламины, медиаторы СНС, соединяясь с рецепторами, активируют G-белки, включая стимулирующий G-белок (Gs ), ингибирующий Gj -белок (активирующийся β2 -рецепторами) и Gq -белок (активирующийся α1 -рецепторами) (рисунок 3). Первичный эффект β1 стимуляции с помощью Gs -белка ведет к активации аденилатциклазы, которая увеличивает концентрацию внутриклеточного циклического аденозинмонофосфата (цАМФ). Вслед за цАМФ запускается цАМФ-зависимая протеинкиназа А (ПКА), которая ведет к увеличению уровня фосфорилирования и модификации многих клеточных белков, включая различные ионные каналы и транспортеры. ПКА-связанные плазменные Ca 2+ -каналы L-типа и сарколемальные Ca 2+ -высвобождающие каналы увеличивают внутриклеточный Ca 2+ с последующим усилением контрактильной функции клетки, а цАМФ увеличивает ЧСС благодаря стимуляции If канала. Антагонисты кальциевых каналов L-типа блокируют этот путь усиления контрактильной функции, а ингибиторы If канала — за счет блокирования If канала с внутренней стороны канала. β-АБ являются антагонистами адренорецепторов, препятствуя активации сигнальных путей при усиленной симпатической стимуляции. Если β-селективные β-АБ бисопролол и метопролол блокируют только β1 ,то неселективный карведилол еще и α1 и β2 -рецепторы, угнетая, тем самым, каскад реакций, указанных выше.
Рис. 3 Молекулярные механизмы действия рβАБ (бисопролол, метопролол, карведилол) и If ингибиторов (ивабрадин).
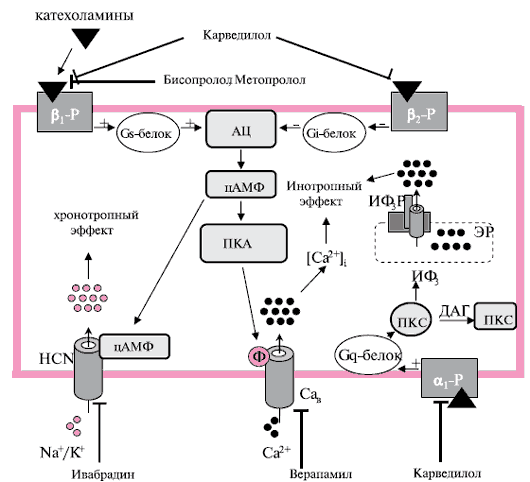
Примечание: α1 -Р — α1 -адренергический рецептор; АЦ — аденилатциклаза; β1/2 -Р — адренергические рецепторы; [Ca +2 ] — вольтаж зависимый Са 2+ -канал; ДАГ — диацилглицерол; ЭР — эндоплазматический ретикулум; HCN, — канал, активирующийся при гиперполяризации; ИФ3 — инозитол-1,4,5-трифосфат; ИФ3Р — ИФ3 рецептор; Ф — фосфорилирование; ПКА А/С — протеин киназа A/C; ФЛС — фосфолипаза С.
Канал If и кальциевые каналы L и Т типа непосредственно участвуют в формировании потенциала действия (ПД). Был предположен следующий механизм диастолической деполяризации [19]. If ток дезактивируется во время начала ПД и активируется во время реполяризации тогда, когда напряжение достигает порогового значения (-40мВ). Медленная активация входящего If канала заставляет потенциал мембраны медленно деполяризироваться до порогового уровня с последующей активацией входящим кальциевым током и развитием нового ПД (рисунок 4).
Рис. 4 Автоматизм синоатриального узла.
Примечание: Стрелками показаны точки приложения действия If. Ca 2+ T и L типа и отложенного калиевого каналов (IK) [19].
Лекарственные препараты, снижающие тонус СНС и ЧСС
Значение повышенного тонуса СНС и тахикардии, как основной детерминанты потребления миокардом кислорода и кардиальной нагрузки, было показано при некоторых ССЗ и способствовало разработке антигипертензивной и антиангинальной тактики лечения с акцентом на снижение ЧСС до рекомендуемых значений. В антиангинальной терапии стабильной стенокардии напряжения (ССН) урежение ритма сердца является одним из важных критериев эффективности лечения. Например, в Европейских рекомендациях по лечению ССН рекомендуемый уровень ЧСС для больных ИБС и ССН отмечен как 55-60 уд/мин, а в некоторых случаях — 50 уд/мин [20].
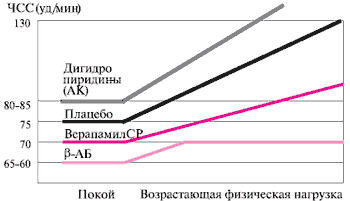
If канал и кальциевые L и T каналы участвуют не только в регуляции ЧСС, но и непосредственно в формировании ПД. Существуют 3 основные группы препаратов, модулирующие сердечный ритм: β-АБ — через ингибирование связывания катехоламинов с соответствующими рецепторами; If ингибиторы — путем блокирования активации пейсмекерного канала в период диастолической деполяризации; АК (в основном, подгруппа фенилалкиламинов) — L-типа кальциевых каналов, уменьшая инотропную функцию и влияя на формирование ПД (рисунок 5).
Рис. 5 Сравнительное снижение ЧСС при воздействии различных классов фармпрепаратов.
β-АБ. Классическими препаратами, снижающими ЧСС, являются β-АБ; именно данный эффект является определяющим в антиангинальной активности препарата. Известно, что β-АБ сильно различаются по своей селективности, липофильности и наличию внутренней симпатомиметической активности. Согласно Европейским рекомендациям, все больные ИБС, особенно перенесшие ИМ, должны принимать данную группу препаратов. В отношении АГ β-АБ являются лишь одними из препаратов выбора. β-АБ однозначно подавляют активность СНС, одновременно обладая отрицательными инотропным и хронотропным эффектами.
АК. В последнее время незаслуженно забытой оказалась еще одна группа препаратов, селективно снижающих ЧСС, — АК. Существуют три подгруппы в этой группе лекарственных средств: фенилалкиламины (подгруппа верапамила), бензодиазепины (подгруппа дилтиазема) и дигидропиридины (подгруппа нифедипина). Урежение ритма сердца характерно для первых двух подгрупп. АК урежают сердечный ритм в меньшей степени (в
2 раза), чем β-АБ. В максимальной дозе дилтиазем урежает ритм на
6,9 уд/мин, а верапамил — на
7,2 уд/мин по сравнению с уменьшением ЧСС на 15 уд/мин при назначении атенолола, метопролола или ивабрадина [21]. Следует отметить, что при применении верапамила СР не наблюдается рефлекторная тахикардия, которая появляется при приеме нифедипина.
В клинических и экспериментальных исследованиях были показаны определенные различия в действии разных АК на тонус СНС. В частности, длительный прием дигидропиридиновых АК приводил к активации СНС, АК III поколения (амлодипин) в этом отношении оказались нейтральными, а верапамил СР 240 мг уменьшал ее активность [1]. В рандомизированном, клиническом, двойном слепом исследовании VAMPHYRE (Effects on autonomic function of Verapamil СР versus AMlodipine in Patients with mild-to-moderate HYpertension at Rest and during Exercise) сравнивали клиническую эффективность и влияние Изоптина СР 240 мг и амлодипина у больных АГ на симпатическую активность [22]. Эффективность препаратов в отношении снижения АД была одинаковой, однако верапамил СР, в отличие от амлодипина, значительнее снижал активность СНС, что выражалось в повышении чувствительности барорецепторов и уменьшении концентрации сывороточного норадреналина.
Безопасность и эффективность данного препарата была исследована также в рандомизированном, многоцентровом исследовании EVERESTH (Evaluation of VERapamil for Efficacy, Safety and Tolerability in the management of Hypertension), по изучению безопасности использования длительно действующего верапамила СР у 13755 больных АГ [23]. В исследование были включены больные с впервые выявленной АГ. При этом достаточно быстро (в течение полугода) большинство пациентов достигало оптимального уровня АД, что свидетельствует о высокой антигипертензивной эффективности препарата. При этом отмечались невысокая частота побочных эффектов (4,3 %), а также положительная динамика показателей КЖ (качество жизни).
АК хорошо показали себя в лечении АГ и ССН. Например, в последних Европейских руководствах по ССН эти средства рекомендуются при непереносимости или противопоказаниях к назначению β-АБ [22].
В исследовании INVEST [24] сравнивали влияния на развитие конечных точек: смерть, нефатальные ИМ, инсульт (МИ), у 22576 пожилых больных ИБС и АГ при длительной терапии двумя препаратами, действующими на тонус СНС и ритм сердца — верапамила СР и β-АБ атенолола. В исследование были включены пациенты в возрасте > 50 лет. Одной рандомизированной группе больных назначали верапамил СР в дозе 240 мг/сут. а второй — атенолол 50 мг/сут. В дальнейшем к верапамилу СР добавляли трандола-прил (Гоптен, ЭББОТТ, США), а к другой группе — гидрохлортиазид (Гхт) 25 мг/сут. В последующем титровали дозы препаратов. В результате исследования было показано, что у больных, лечившихся верапамилом СР, уменьшение смертности и риска развития сердечно-сосудистых событий (нефатальных ИМ и МИ) произошло примерно с такой же частотой, как и в группе с β-АБ. В то же время антиангинальная эффективность — уменьшение приступов стенокардии, была выше в группе АК, а частота развития побочных эффектов — достоверно выше на 15 % в группе атенолола. Таким образом, это исследование показало с одной стороны, одинаковое влияние исследуемых препаратов на смертность, а с другой — лучшие метаболический и антиангинальный эффекты верапамила СР.
В недавно опубликованном мета-анализе Bangalore and Messerli оценивалось влияние пульс-урежающего действия β-АБ на прогноз пациентов с АГ [33]. Единственным проанализированным представителем недигидропиридиновых (НДГП) АК был верапамил и стоял он «по другую сторону баррикад» — в ряду препаратов сравнения. В настоящее время проведено внушительное количество крупных исследований, в которых достоверно показано, что при равной степени снижения АД различные группы препаратов оказывают разное влияние на прогноз (по истинным конечным точкам) у больных АГ. Это связано как с различием механизмов снижения АД, так и с наличием дополнительных точек приложения в т.ч. действие на сопутсвующие состояния, оказывающих влияние на прогноз и т.д.
Можно предположить, что при равном уменьшении ЧСС различными препаратами можно ожидать разного влияния на исход. В частности, правомочность этой гипотезы подтверждает надавно опубликованный субанализ исследования INVEST, которое вошло в мета-анализ Мессерли. В упомянутом субанализе была изучена степень снижения ЧСС в группах атенолола и верапамила и влияния этого снижения на прогноз. Результаты показали, что, несмотря на достоверно большее уменьшение ЧСС в группе атенолола, влияние на исход было одинаковым в обеих группах. Это свидетельствует о том, что на исход влияют не только «голые» цифры снижения ЧСС, а механизм этого снижения, который нужно рассматривать в рамках комплексного воздействия препарата на организм, включая дополнительные точки приложения и влияние на сопутствующие состояния снижение активности СНС, нефропротективные и метаболические аспекты органопротекции.
Целесообразно рассмотреть патогенетический механизм, который по гипотезе Мессерли и соавт. приводит к негативному воздействию медикаментозной пульс-урежающей терапии. Авторы связывают это действие с возникновением диссинхронии между работой сердца и периферических сосудов. В норме пульсовая волна (ПВ), отразившись от периферии благодаря наличию общего периферического сосудистого сопротивления (ОПСС), возвращается к сердцу в период диастолы. В случае медикаментозного снижения ЧСС, по гипотезе авторов, отраженная ПВ приходит к сердцу раньше времени и встречается с исходящей систолической волной. Это приводит к повышению давления в крупных сосудах и отрицательно влияет на прогноз. Следует подчеркнуть, что такое объяснение применимо только к действию β-АБ, которые, как известно, повышают ОПСС, в связи с чем и развивается пульсовая диссинхрония. Что касается верапамила, то этот препарат, напротив, снижает ОПСС. Все вышеперечисленное свидетельствует о том, что патогенетических причин для развития диссинхронии при использовании НДГП АК нет. В пользу этого вывода также говорят данные по применению верапамила на фоне физической нагрузки (рисунок 5), подтверждая более «физиологичное» действие Изоптина СР в сравнении с β-АБ.
ИАПФ и блокаторы рецепторов к ангиотензину II не обладают эффектом влияния на СНС [25], комбинация этих препаратов с АК в частности, верапамил СР + ИАПФ трандолаприл (ТАРКА), способна потенцировать эффективность каждого компонента [26]. Данное сочетание, помимо указанного эффекта, обладает метаболической нейтральностью [27], нефропротективной активностью [28] и способно нивелировать негативные эффекты диуретиков на метаболический профиль [29].
If ингибиторы. В последние годы на фармацевтическом рынке появились так называемые If ингибиторы, обладающие «чистым» хромотропным эффектом; единственный представитель — ивабрадин. Последние исследования показали, что данный препарат обладает ангиангинальным эффектом, сравнимым с β-АБ и АК [30,31], но, в то же время, в комбинированной терапии не улучшает выживаемость больных ИБС и СН [32].
Из других групп препаратов, воздействующих на симпатической тонус, можно выделить сердечные гликозиды, α-АБ, препараты центрального действия, однако эффект от их применения на СНС и ЧСС не так значителен, как у трех вышепредставленных классов препаратов.
Выводы
Гиперсимпатикотония, весьма часто ассоциирующаяся с АГ за счет выброса катехоламинов, приводит к вазоконстрикции, учащению ритма сердца и повышению риска ССО.
ЧСС > 70 уд/мин, как проявление гипертонуса СНС, является независимым ФР ССЗ.
В настоящее время существуют 3 основные группы АГП, влияющих на ЧСС: β-АБ, If ингибиторы и АК. β-АБ ингибируют связывание катехоламинов с β-рецепторами, If ингибиторы блокируют внутриклеточно If канал, действуя на диастоличекую деполяризацию, и АК блокируют кальциевые канала L-типа, замедляя развитие потенциала действия и уменьшая инотропную функцию. Две группы препаратов: β-АБ и АК, кроме того, еще и угнетают СНС.
Среди АК верапамил СР обладает высокой безопасностью и умеренным эффектом в отношении снижения ЧСС. В отличие от дигидропиридиновых АК, он не приводит к гиперсимпатикотонии, а наоборот, снижает ее, уменьшая уровень норадренала плазмы крови и чувствительность барорецепторов.
В клинических исследованиях при прямом сравнении верапамила СР и β-АБ атенолола, несмотря на меньшее снижение ЧСС в группе верапамила, влияние препаратов на конечные точки оказалось одинаковым при более высокой антиангинальной эффективности последнего и более благоприятном его действии на гликемический профиль.
Таким образом, одним из современных приоритетных направлений лечения АГ и ИБС является снижение активности СНС и ЧСС, и одним из наиболее подходящих для этой цели лекарственных средств является верапамил СР.
Литература
1. Messerli FH, Grossman E, Goldbourt U. Are beta-blockers efficacious as first-line therapy for hypertension in the elderly? A systematic review. JAMA 1998; 279: 1903-7.
2. Rehnqvist N, Hjemdahl P, Billing E, et al. Effects of metoprolol vs. verapamil in patients with stable angina pectoris. The Angina Pectoris Study in Stockholm (APSIS). Eur Heart J 1996; 17: 76-81.
3. Dardie HJ, Ford I, Fox KM. Total Ischemic Burden European Trial (TIBET). Effects of ischemia and treatment with atenolol, nifedipine SR and their combinations on outcome in patients with chronic stable angina. The TIBET Study Group. Eur Heart J 1996; 17: 104-12.
4. Mo R, Nordrehaug J, Omvick P, Lund-Johansen P. The Berg blood pressure study: prehypertensive changes in cardiac structure and function in offspring of hypertensive families. Blood Pressure 1995; 4: 1017-27.
5. Cohn JN, Levine TB, Olivari MT, et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 1984; 311: 819-23.
6. Farinaro E, Della Valle E, Ferrantino G. PLasma lipids and cardiovascular risk: lesions in the community. Ann Ital Med Int 1995: 10(Suppl.): 31-4.
7. Kolloch R, Legler U, Champion A, et al. Impact of resting heart rate on outcomes in hypertensive patients with coronary artery disease: findings from the International VErapamil-SR/trandolapril STudy (INVEST). Eur Heart J 2008; 29: 1327-34.
8. Shell W Sobel B. Deleterious effects of increased heart rate on infarct size in the conscious dog. Am J Cardiol 1973; 31: 474-9.
9. Levy RL, White PD, Strod WD, Hillman CC. Transient tachycardia: prognostic significance alone and in association with transient hypertension. JAMA 1945; 129: 585-8.
10. Perski A, Hamsten A, Lindvall K, Theorel T. Heart rate correlates with severity of coronary atherosclerosis in young postinfarction patients. Am Heart J 1988; 116: 1369-73.
11. Heidland UE, Stauer BE. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque dysruption. Circulation 2001; 104: 1477-82.
12. Шальнова С.А. Деев А.Д. Оганов Р.Г. и др. Частота пульса и смертность от сердечно-сосудистых заболеваний у российских мужчин и женщин. Результаты эпидемиологического исследования. Кардиология 2005; 10: 45-50.
13. Gillum R, Makus D, Feldman J. Pulse rate, coronary heart disease and death: The NHANES I epidemiological follow-up study. Am Heart J 1991; 121: 172-7.
14. Gilman M, Kannel W, Belanger A, D’Agostino R. Influence of heart rate on mortality among persons with hypertension The Framingham study. Am H J 1993; 125: 1148-54.
15. Palatini P. Heart rate as a risk factor for atherosclerosis and cardiovascular mortality: the effect of antihypertensive drugs. Drugs 1999; 57: 713-24.
16. CIBIS II Investigators and committers. The cardiac insufficiency bisoprolol study II (CIBIS II): a randomized trial. Lancet 1999; 353: 9-13.
17. Fox K, Ford I, Steg PG, et al. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomized controlled trial. Lancet 2008; 372: 817-21.
18. Benetos A, Rudnichi A, Thomas F, et al. Influence of heart rate on mortality in a French population: role of age, gender and blood pressure. Hypertension 1999; 33: 44-52.
19. DiFrancesco D. Pacemaker mechanisms in cardiac tissue. Ann Rev Physiol 1993; 55: 455-72.
20. Fox K, Garcia MA, Ardissino D, et al. Guidelines on the management of stable angina pectoris: executive summary: the Task Force on the management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J 2006; 27: 1241-381.
21. Boden WE, Vray M, Eschwege E, et al. Heart rate-lowering and -regulating effects of once-daily sustained-release diltiazem. Clin Cardiol 2001; 24(1): 73-9.
22. Lefrandt JD, van Roon AM, van Gessel, et al. Improved Short-Term Blood Pressure Control by treatment with calcium antagonists in patients with mild or moderate hypertension. J Hypertens 1999; 17(Suppl.3).
23. Novo S, Alaimo G, Abrignani MG, et al. Noninvasive blood pressure monitoring evaluation of verapamil slow-release 240-mg anti-hypertensive effectiveness. J Cardiovasc Pharmac 1989; 13(Suppl. 4): S38-41.
24. Pepine CJ, Handberg E, Cooper-De-Hoff R, et al. A Calcium Antagonist vs Non-Calcium Antagonist Hypertension Treatment Strategy for Patients With Coronary Artery Disease. The International Verapamil-Trandolapril Study (INVEST): A Randomized Controlled Trial. JAMA 2003; 290(21): 2805-16.
25. de Champlain J, Yacine A, Le Blanc R, et al. Effects of trandolapril on the sympathetic tone and reactivity in systemic hypertension. J Hypertens 1994; 73(10): 18C-25.
26. Messerli F, Frishman WH, Elliott WJ, et al. Antihypertensive properties of a high-dose combination of trandolapril and verapamil-SR. Blood Press Suppl 2007; 1: 6-9.
27. Bakris G, Molitch M, Hewkin M, et al. Difference in glucose tolerance between fixed-dose antihypertensive drug combinations in people with metabolic syndrome. Diabetes Care 2006; 12: 2592-7.
28. Bakris GL, Williams B. Angiotensin converting enzyme inhibitors and calcium antagonists alone or combined: does the progression of diabetic renal disease differ? J Hypertens 1995; 13(Suppl. 2): S95-101.
29. Bakris G, Molitch M, Zhou Q, et al. Reversal of Diuretic-Associated Impaired Glucose Tolerance and New-Onset Diabetes: Results of the STAR-LET Study. J Cardiometab Syndr 2008; 3: 18-25.
30. Tardif JC, Ford I, Tendera M, et al. Efficacy of ivabradine, a new selective I (f) inhibitor, compared with atenolol in patients with chronic stable angina. Eur Heart J 2005; 26: 2529-36.
31. Borer J, Fox K, Jaillon P. Antianginal and Antiischemic Effects of Ivabradine, an If Inhibitor, in Stable Angina. A Randomized, Double-Blind, Multicentered, Placebo-Controlled Trial. Circulation 2003; 107: 817-23.
32. Fox K, Ford I, Steg PG, et al. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372(9641): 779-80.
33. Sripal Bangalore, Sabrina Sawhney, Franz H.Messerli. Relation of Beta-Blocker-Induced Heart Rate Lowering and Cardioprotection in Hypertension. Jornal of the American College of Cardioily; vol.52,No18, 2008
HTML-код для размещения ссылки на сайте или в блоге:
Кораксан — крупнейшая инновация от компании «Сервье»
КОРАКСАН — первый представитель нового класса антиангинальных препаратов, абсолютно новое лечение стабильной стенокардии, основанное исключительно на снижении частоты сердечных сокращений (ЧСС).
ПОЧЕМУ ВАЖНО СНИЖАТЬ ЧСС ПРИ СТАБИЛЬНОЙ СТЕНОКАРДИИ?
Согласно новому Руководству Европейского общества кардиологии (European Society of Cardiology, 2006) предложен новый терапевтический подход для ваших пациентов с симптомами стенокардии. Это — стратегия снижения ЧСС с помощью препарата КОРАКСАН (1).
Повышенная ЧСС является основным патогенетическим фактором возникновения ишемии миокарда. Чем выше ЧСС — тем интенсивнее работа сердца и потребление кислорода. В то же время повышенная ЧСС снижает длительность диастолы (известно, что кровоснабжение миокарда происходит именно в диастолу) и способствует развитию ишемии миокарда.
Терапевтическая стратегия по снижению ЧСС позволяет обеспечить выраженный антиишемический и антиангинальный эффекты у пациентов со стенокардией. На практике снижение ЧСС уменьшает количество приступов стенокардии и улучшает качество жизни пациентов.
Результаты многочисленных исследований, проведенных в этой области за последние годы, свидетельствуют, что ЧСС определяет не только качество, но и продолжительность жизни пациентов со стенокардией, пишут разработчики Индекса риска смертности клиники Купера (Cooper Clinic Mortality Risk Index). Создание и валидация этого индекса осуществлялись в ходе исследования, проведенного канадскими и американскими учеными, в том числе из Центра интегрированных исследований здоровья Института Купера (Centers for Integrated Health Research, The Cooper Institute). В результате исследования, продолжавшегося с 1979 по 1998 г. с участием 21 766 мужчин без серьезных заболеваний, наличие повышенной ЧСС покоя признано независимым фактором риска, повышающим показатель индекса смертности. Так, ЧСС покоя, превышающая 80 уд./мин, соответствует 2 баллам риска (то же — при артериальной гипертензии I и II степени (2).
СУЩЕСТВУЕТ ЛИ ОПТИМАЛЬНЫЙ УРОВЕНЬ ЧСС?
На основе эпидемиологических данных, позволивших установить связь повышенной ЧСС с уровнем смертности, полученных Институтом Купера, была разработана клиническая шкала долгосрочного риска смертности, при этом за единицу оптимальной ЧСС взят показатель ≤59 уд./мин (2).
КАКОВЫ ПРЕИМУЩЕСТВА СНИЖЕНИЯ ЧСС С КОРАКСАНОМ?
Вы, вероятно, согласитесь с тем, что из-за побочных эффектов большинство современных антиангинальных препаратов часто назначают в низких дозах. При этом пациенты по-прежнему испытывают приступы стенокардии, а уровень ЧСС у них может превышать 60 уд./мин.
Ситуация изменилась с появлением КОРАКСАНА. который сегодня считается абсолютно инновационным препаратом в лечении стенокардии, способным качественно изменить жизнь ваших пациентов!
Конечно, существуют препараты, снижающие ЧСС, но КОРАКСАН — препарат абсолютно нового класса. Он снижает ЧСС, действуя непосредственно на синусовый узел, избирательно ингибируя его f-каналы (находятся в пейсмекерных клетках — водителях ритма сердца и регулируют ЧСС). В то же время КОРАКСАН не влияет на Ca++- и К+-каналы и не взаимодействует с β-рецепторами. КОРАКСАН — единственный антиангинальный препарат, который снижает только ЧСС, без побочных эффектов, характерных для блокаторов β-адренорецепторов или антагонистов кальциевых каналов. Итак,
- КОРАКСАН эффективно и дозозависимо снижает ЧСС, в среднем на на 10–14 уд./мин. Степень снижения ЧСС также прямо пропорциональна исходному уровню ЧСС (при ЧСС >80/мин можно ожидать ее снижения на 25 уд. в то время как при исходной ЧСС 60 уд./мин она снизится на 7–9 уд./мин при лечении Кораксаном) (3);
- КОРАКСАН более чем в 3 раза снижает количество приступов стенокардии и значительно улучшает переносимость пациентом физической нагрузки (4);
- КОРАКСАН не провоцирует ангиоспазм, не влияет на сократимость миокарда и артериальное давление (5).
Лечение КОРАКСАНОМ хорошо переносится. Среди побочных эффектов могут отмечать незначительные и транзиторные симптомы со стороны органа зрения (фотопсии и нечеткость зрения), требующие отмены лечения менее чем у 1% пациентов. После прекращения лечения эти симптомы полностью исчезают, спонтанно проходят во время лечения или после его окончания, не требуют специальных обследований, не влияют на способность управлять транспортным средством.
КОМУ НАЗНАЧАТЬ КОРАКСАН?
Европейское общество кардиологии рекомендует КОРАКСАН как новое терапевтическое решение для пациентов с противопоказаниями или непереносимостью β-блокаторов. Таким образом, препарат назначают при симптомах стабильной стенокардии, синусовом ритме и ЧСС >60 уд./мин. пациентам:
- со стабильной стенокардией с ХОЗЛ или бронхиальной астмой;
- со стабильной стенокардией и заболеванием периферических сосудов;
- со стабильной стенокардией с нормальным или низким АД;
- со стабильной стенокардией и эректильной дисфункцией;
- со стабильной стенокардией с депрессией или расстройством сна;
- со стабильной стенокардией и астенией;
- со стабильной стенокардией с диабетом/метаболическим синдромом.
Как назначать КОРАКСАН. 1 таблетка за завтраком и 1 за ужином. Обычно лечение начинают с 5 мг 2 раза в сутки. В случае, если ЧСС остается на уровне >60 уд./мин через 3–4 нед, необходимо рассмотреть возможность повышения дозы Кораксана до 7 мг 2 раза в сутки (под контролем ЧСС).
КАКОВЫ ПРЕИМУЩЕСТВА ДВУХ ФОРМ ВЫПУСКА КОРАКСАНА: ПО 28 И 56 ТАБЛЕТОК В УПАКОВКЕ?
Назначение Кораксана, № 56, позволяет быть более увереным в том, что пациент последует рекомендациям врача и будет принимать препарат длительно. Меньше риск, что после 2 нед лечения пациент прекратит прием лекарственного средства самостоятельно или же забудет приобрести следующую упаковку в аптеке. В то же время, в вашем распоряжении упаковки Кораксана 5 и 7,5 мг по 28 таблеток, что позволяет следовать индивидуальным потребностям пациента. o
RSS лента
Сложившаяся парадигма утверждает, что чем выше частота сердечных сокращений (ЧСС), тем больше риск кардиоваскулярных осложнений и сердечной смерти у пациентов с артериальной гипертензией (АГ).
В соответствии с данной парадигмой замедление ЧСС является необходимым условием продления продолжительность жизни, в особенности для пациентов с перенесенным инфарктом миокарда и сердечной недостаточностью. Более того, утверждается, что чем меньшая ЧСС будет достигнута, тем лучше. Новые исследования, однако, показывают, что снижение ЧСС, в том числе путем постоянного приема бета-блокаторов и препаратов некоторых других групп, у лиц с АГ связано с более высоким кардиоваскулярным риском и смертностью.
В соответствии с опубликованными в последнее время данными замедление ЧСС при АГ ассоциируется с укорочением продолжительности жизни, большей частотой сердечных приступов, большим числом инсультов, увеличением частоты и тяжести сердечной недостаточности.
Так, Bangalore S, Sawhney S и Messerli FH. (госпиталь Святого Луки, Рузевельт, Италия) полагают, что вероятным объяснением неблагоприятных эффектов замедления ЧСС бета-блокаторами является увеличение центрального давления, которое и может быть определяющим фактором инсульта, сердечного приступа и даже сердечной смерти.
Доктор J. Cockcroft (Институт сердца, Кардифф, Великобритания), эксперт по артериальной гипертензии, видит эту проблему немного по-другому и утверждает, что причиной неблагоприятных событий при лечении АН являются не бета-блокаторы вообще, а конкретно атенолол.
В этой связи жизненно важным является вопрос, что именно плохо. атенолол или снижение ЧСС, потому что, например, есть препараты, не относящиеся к бета-блокаторам и при этом снижающие ЧСС.
Брадикардия. не синоним кардиопротекции при АГ
В обзоре Bangalore S с соавторами проведен анализ данных девяти контролируемых рандомизированных исследований, в которых оценивалось влияние бета-блокаторов на течение и исходы АГ и при этом принималась во внимание ЧСС. Всего в исследования было вовлечено 34 096 пациентов (30 139 – совместно с другими гипотензивными средствами принимавших бета-блокаторы, 3987 – плацебо). Из пациентов в группе бета-блокаторов 78 % принимали атенолол, 9 % — окспренолол, 1% — пропранолол, 12 % — атенолол/метопролол/пиндолол или гидрохлортиазид.
Как ни парадоксально, оказалось, что более низкая ЧСС, достигнутая в группе бета-блокаторов в конце исследования, была связана с большим риском общей смертности (r =-0.51; p