Прогрессирующий инсульт (инсульт в ходу)
При прогрессирующем инсульте (инсульте в ходу) очаговые неврологические нарушения постепенно нарастают. Обычно такое нарастание происходит в течение нескольких часов, однако инсульт в вертебробазилярном бассейне может прогрессировать 2-3 сут и более. К прогрессирующему инсульту многие авторы относят нарастающие преходящие ишемии мозга (серия преходящих ишемий мозга в течение нескольких часов или суток). Возможны различные механизмы прогрессирующего инсульта. Однако вероятнее всего он развивается из-за дистального роста тромба, в результате которого постепенно перекрываются сосуды, обеспечивающие коллатеральный кровоток.
Классификация инсультов
 По причине смертности после ишемии сердца и онкологических заболеваний третье место занимают инсульты. Они развиваются стремительно, неожиданно для больного, и обычно для их предотвращения почти не остается времени. Под этим заболеванием подразумевается инфаркт головного мозга или мозговое кровоизлияние, в том числе и субарахноидальное. Классификация инсультов проводится по характеру их происхождения и клиническим показаниям. Среди инсультов выделяются два основных вида:
По причине смертности после ишемии сердца и онкологических заболеваний третье место занимают инсульты. Они развиваются стремительно, неожиданно для больного, и обычно для их предотвращения почти не остается времени. Под этим заболеванием подразумевается инфаркт головного мозга или мозговое кровоизлияние, в том числе и субарахноидальное. Классификация инсультов проводится по характеру их происхождения и клиническим показаниям. Среди инсультов выделяются два основных вида:
- ишемический
- геморрагический.
Их процентное соотношение составляет 5:1, и лидирующее место занимает ишемический вид инсульта.
Инфаркт головного мозга (ишемический инсульт)
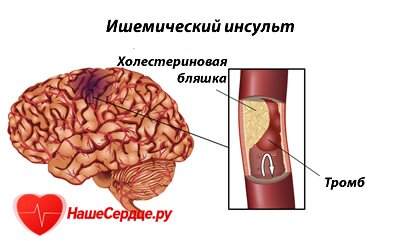
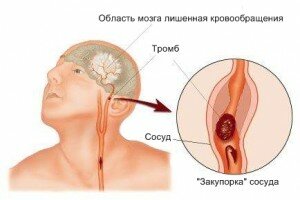
Ишемический, или атеротромботический инсульт, развивается на фоне неинфекционного воспаления, спровоцированного наслаиванием на стенках сосудов жиров, что ведет к появлению склеротического образования. Просвет сосуда перекрывается телом бляшки, и на ней формируется тромб. Он может препятствовать свободному кровотоку в артерии в области головы или шеи, а может оторваться и течением крови перенестись в более тонкий внутричерепной сосуд, и стать причиной его эмболии. Чаще всего закупорке тромбом подвержена сонная артерия.
Виды ишемических инсультов:
- Лакунарный;
- Гемодинамический;
- Тромбоэмболический.
Лакунарный инсульт – следствие повреждения периферийных артериальных сосудов. Его причиной является высокое артериальное давление, особенно если состояние здоровья осложнено сахарным диабетом. Частые и значительные повышения АД ведут к разрыву стенок мелких кровеносных сосудов, в результате чего происходят точечные мелкоочаговые кровоизлияния в вещество мозга. Если перепады давления происходят часто и сопровождаются резкими скачками, множество кровоизлияний сливаются в одну обширную гематому, что может закончиться инсультом гипертонического типа с последующим параличом.
Гемодинамический инсульт развивается на фоне повторяющихся спазмов сосудов головного мозга, что приводит к недостатку насыщения клеток мозга кислородом. Спазмы могут быть спровоцированы резко поднимающимся артериальным давлением, но чаще всего наоборот – перепадами АД с его понижением. Возникает гемодинамический инсульт при сужении просветов кровеносных сосудов атеросклеротическими бляшками или расслаивающейся аневризмой в области шеи.
При инфаркте головного мозга больной вначале чувствует онемение в руке, противоположной очагу поражения в мозговой ткани, и в половине лица, а потом наступает нарушение речи. Опасность церебрального ишемического инсульта в том, что из-за нарушения кровообращения в тканях головного мозга испытывается дефицит кислорода.
Если не восстановить кровоток в пораженной области и не возобновить доступ кислорода к мозгу, скорее всего, начнутся необратимые процессы, включая некроз тканей мозга.
Если в течение суток после некоторой стабилизации, начальные неврологические симптомы продолжают проявляться все четче, выделяется острый прогрессирующий инсульт. Обострение симптомов нарастает в течение трех суток, и это бывает вызвано с дистальным ростом тромба. Из-за этого просветы в сосудах, отвечающих за коллатеральный кровоток, постепенно перекрываются
Геморрагический инсульт
В отличие от инфаркта головного мозга, когда нарушается кровоток из-за закупорки артерий или мелких кровеносных сосудов, геморрагический инсульт – это кровоизлияние в мозг. Он также может иметь разный характер происхождения и разную степень поражения мозговой ткани.
Если нарушение кровообращения происходит в стволе головного мозга, инсульт классифицируется как стволовой. В результате кровоизлияния в вещество головного мозга нарушается работоспособность определенных его частей, контролирующих работу дыхательных путей, кровообращения, терморегуляции и других функций организма, важных для жизни человека. Больной, перенесший стволовой церебральный инсульт. теряет способность координировать свои движения, дышать, говорить и глотать. Часто этот вид инсульта сопровождается частичным или полным параличом.
В 5 случаях из 100 диагностируется субарахноидальный инсульт. Это не так много по сравнению с другими видами кровоизлияний в головной мозг. Он происходит, когда кровь проникает в пространство между двумя оболочками, окутывающими головной мозг – паутинной и мягкой мозговой. В норме пространство между этими оболочками заполнено спинномозговой жидкостью, а во время субарахноидального кровоизлияния она смешивается с кровью, поступающей из внутричерепных артериальных аневризм. Разрыв аневризмы не единственная причина субарахноидального кровоизлияния – оно может быть вызвано черепно-мозговой травмой или онкологическим заболеванием.
Хотя это самый редкий вид инсульта, но может иметь самые тяжелые последствия – в 50 случаев из 100 кровоизлияние субарахноидального типа заканчивается смертью, а большая часть выживших пациентов остаются инвалидами.
Субарахноидальное кровоизлияние чаще случается с людьми среднего возраста от 30 лет. Оно может быть следствием хронического алкоголизма, разового употребления спиртного в большом количестве, курения или злоупотребления наркотиками на основе кокаина. Риск увеличивается, если у человека избыточный вес тела или он страдает артериальной гипертензией.
Как предугадать инсульт
Предвестником нарушения кровообращения в сосудах головного мозга может стать малый инсульт. Он происходит за несколько дней, недель или месяцев до обширного поражения мозга. При малом инсульте работа мозга приостанавливается на короткое время – всего на 15 минут, а затем полностью восстанавливается. Симптомы очень схожи с симптомами настоящего инсульта, но организм пока еще может справиться с нарушением кровообращения самостоятельно. Если подобное уже произошло, не следует медлить с обращением за медицинской помощью.
В подавляющем большинстве случаев, заболевание возникает на фоне определенных болезней:
- Артериальная гипертензия;
- Болезни сердца;
- Атеросклероз;
- Сахарный диабет;
- Аневризмы на мозговых артериях и артериях в области шеи;
- Васкулиты;
- Тромбоцитоз, эритремия.
 Те, кто страдает подобными болезнями, должны быть осведомлены, какие бывают инсульты на фоне их заболеваний.
Те, кто страдает подобными болезнями, должны быть осведомлены, какие бывают инсульты на фоне их заболеваний.
Осторожность нужно проявлять тем, кто уже однажды перенес инсульт, так как для них остается большая вероятность повторного апоплексического удара. Он повторяется у 2% перенесших инсульт в течение первого года и у 30% в прошествии 5 лет после заболевания.
В принципе, предвестником инсульта могут быть многие «легкие» симптомы: недомогание, головная боль, слабость и прочее. Конечно, причины могут быть разные – от переутомления до смены погоды, но если вы входите в группу риска, обязательно покажитесь врачу.
Прогрессирующий ишемический инсульт и методы его прогнозирования тема диссертации и автореферата по ВАК 14.00.13, кандидат медицинских наук Седова, Ольга Аркадьевна
Оглавление диссертации кандидат медицинских наук Седова, Ольга Аркадьевна
Введение.
Глава 1. Обзор литературы.
1.1. Инсульт. Ишемический инсульт.
1.2. Прогрессирующий инсульт.
1.2.1. Определение понятия « прогрессирующий инсульт » и критерии прогрессирующего инсульта.
1.2.2. Причины прогрессирования ишемического инсульта.
1.2.3. Клинические предикторы ИЛИ и предикторы, выявленные с помощью нейровизуализации и ультразвуковой допплерографии брахиоцефальных артерий.
1.2.4. Биохимические предикторы ИЛИ.
Глава 2. Материалы и методы исследования.
2.1. Материалы исследования.
2.2. Методика исследования.
2.3. Статистическая обработка данных.
Глава 3. Результаты исследований и их обсуждение.
3.1. Характеристики прогрессирующего инсульта.
3.2. Клинические факторы, связанные с развитием ИЛИ.
3.3. Инструментальные факторы, связанные с развитием ИЛИ.
3.4. Лабораторные факторы, связанные с развитием ИЛИ.
3.5. Прогнозирование влияния клинических факторов на развитие ИЛИ.
3.6. Прогнозирование влияния инструментальных и лабораторных факторов на развитие ИЛИ.i.
УЛ. Предикторы ИЛИ у пациентов, поступивших в течение первых 3 и 6 часов от начала ишемического инсульта, предикторы раннего и позднего ИЛИ.
3.8. Предикторы ИЛИ у пациентов с различными подтипами ишемического инсульта.
3.9. Предикторы ИЛИ с нарастанием общемозговых симптомов и ИЛИ без нарастания.
3.10. Сочетанное влияние возможных предикторов ИЛИ.
3.11. Возможности применения алгоритмов для индивидуального прогноза ИЛИ.
Введение диссертации (часть автореферата) На тему «Прогрессирующий ишемический инсульт и методы его прогнозирования»
Актуальность проблемы
Во всем мире острое нарушение мозгового кровообращения (ОНМК) как причина смерти находится на третьем месте [21, 30, 32, 35, 164]. По данным исследований, выполненных в России, ряде стран Европы, в Японии и США. ишемический инсульт занимает 70 — 80% среди всех ОНМК [9, 36].
Согласно определению, данному в 1976 году S. Hatano, инсульт — это клинический синдром, характеризующийся быстро возникшими клиническими жалобами и/или симптомами утраты очаговых и иногда общемозговых функций, с симптомами. длящимися дольше 24 часов, без иной явной причины, кроме сосудистой патологии [89].
Прогрессирующий инсульт, или инсульт в ходу — это ухудшение первичного неврологического статуса или присоединение новых симптомов. соответствующих тому же бассейну кровоснабжения. возникающее после начала появления симптомов ОНМК [72]. При прогрессирующем инсульте нарастание неврологической симптоматики может развиваться как постепенно, так и внезапно, в виде одного или серии острых эпизодов в течение нескольких часов или суток [6, 27].
Согласно определениям, данным JC. Gautier (1985), Ч.П. Ворлоу (1998), « инсульт в развитии » или « прогрессирующий инсульт » — это ухудшение неврологического статуса пациента в виде снижение уровня сознания, усиления неврологической симптоматики или присоединения новых симптомов, указывающих на поражение других участков мозга [9, 85].
В отечественной литературе нарастание неврологической симптоматикиг после начала1, ишемического инсульта расценивается как ремиттирующее или прогрессирующее (прогредиентное) течение ишемического инсульта или- как инсульт в развитии (в стадии прогрессирования ) в отличие от завершенного инсульта [1, 36].
По данным ряда исследований, прогрессирующий инсульт диагностируется при изменении неврологического статуса по Канадской шкале инсульта на 1 балл и более, исключая ориентировку в месте и времени, или по шкале NIHSS (Шкала Инсульта Национального Института Здоровья, National Institutes of Health Stroke Scale) на 4 балла и более при его оценке при поступлении и через 24, 48 часов и далее до 7 суток [52, 74].
Прогрессирующий инсульт описан у 24 — 43% пациентов с ишемическим инсультом [72, 141, 155]. Доказано, что прогрессирование ишемического инсульта увеличивает летальность и ухудшает функциональный исход [43, 143].
По нашему мнению, можно выделить следующие основные патологические процессы в организме, которые приводят к нарастанию клинических проявлений ишемического инсульта: действие системных факторов без прогрессирования церебральной ишемии (возможно, вследствие ухудшения метаболических процессов), отек головного мозга, острая гипертоническая энцефалопатия, геморрагическое пропитывание, увеличение ишемического поражения головного, мозга вследствие ранней повторной эмболизации. прогрессии тромбоза, перфузионной недостаточности из-за неадекватного коллатерального кровотока.
В различных исследованиях доказана значимость определенных признаков, которые, возможно, связаны с патологическими процессами, лежащими в основе ишемического прогрессирующего инсульта (ИЛИ), и, соответственно, могут быть использованы в качестве предикторов ИЛИ. Имеются данные о возможном влиянии- на развитие ИЛИ возраста пациента [72, 95], ишемической болезни сердца (ИБС) [5, 72], фибрилляции предсердий (ФП) [5, 35, 95, 109], сахарного диабета в-анамнезе [5, 45, 72, 166]. тяжести поражения мозга, измеренной’в баллах по шкале NIHSS [103. 109, 163].
Однако, такие предикторы развития ИЛИ как низкий уровень сознания [103], головная боль при поступлении [72, 110], более раннее время поступления от начала заболевания [109, 155], более позднее начало специфической терапии ишемического инсульта [73], гипертермия при поступлении более 37.5° С [47, 61, 72, 73], наличие в анамнезе ОНМК [5], сердечной недостаточности [103] изучены недостаточно. Незначительное количество исследований посвящено влиянию бассейна [70] и подтипа ишемического инсульта [149, 152, 166] на развитие ИЛИ, результаты этих исследований неоднозначны. Имеются противоречивые данные по поводу влияния артериального давления (АД) на развитие ИЛИ [45, 64, 70, 72, 73]. Предполагалось, что наличие выраженного атеросклеротического повреждения брахиоцефальных артерий (БЦА) может быть предиктором ИЛИ [43, 72, 137, 157], однако, исследовалось малое количество пациентов, в разные сроки инсульта и разными методами.
Больший объем очага ишемии являлся радиологическим предиктором ИЛИ [73, 103, 155]. Такие предикторы, как ранняя гиподенсная зона [155], симптом гиперденсной средней мозговой * артерии (СМА): [73] по данным компьютерной томографии головного мозга, признаки дислокации срединных структур головного мозга [3, 73, 143], а также локализация очага изучены мало. Исследования влияния геморрагического пропитывания зоны ишемии на развитие ИЛИ показали противоречивые данные [3, 9, 35, 81, 155, 156].
Биохимические признаки воспаления (С-реактивный белок (С-РБ), лейкоцитоз), показатели, отражающие состояние свертывающей системы (d-димер, тромбоциты), и гипергликемия как возможные предикторы ИЛИ предполагались, но были изучены недостаточно [70, 72, 103; 109, 155, 160, 161, 163]. В ряде исследований наблюдалась связь уровня нейрон-специфической энолазы (NSE), отражающей повреждение нейронов, и уровня белка- S100, который высвобождается при повреждении астроцитов, с клиническим исходом ишемического- инсульта [50, 123, 167], а также с объемом очага [41, 97].
В доступной нам литературе не найдено методик прогнозирования течения ишемического инсульта, основанных на применении суммарной, шкальной оценки.
Таким образом, исследование различных предикторов ИЛИ с учетом подтипа ишемического инсульта и времени от начала инсульта, изучение сочетанного влияния факторов на развитие ИЛИ остаются актуальными, способствуя более точному и раннему прогнозу и профилактике ИЛИ.
Цель работы
Целью настоящей работы является исследование факторов, позволяющих прогнозировать нарастание тяжести ишемического инсульта в остром периоде, для более эффективной профилактики прогрессирования инсульта.
Задачи работы
1. Оценка. частоты прогрессирования ишемического инсульта с учетом его подтипов и времени от начала инсульта.
2. Выявление предикторов ухудшения по данным клинической картины и анамнеза заболевания.
3. Выявление предикторов ухудшения по данным инструментальных и лабораторных методов исследования.
4. Оптимизация профилактики прогрессирования ишемического инсульта в остром периоде.
Научная новизна результатов исследования
Проведены выявление и оценка предикторов ухудшения состояния больных в остром периоде ишемического инсульта в зависимости от сроков госпитализации и от подтипов ишемического инсульта.
Определены возможности ряда сочетаний таких предикторов для прогнозирования развития ИЛИ в подгруппах пациентов и у отдельного пациента.
Осуществлено исследование связи уровня нейрон-специфической энолазы (NSE), антител к белку S100 бета, к фрагментам NMDA- (N-метил-В-аспартат), АМРА-рецепторов (амино-3-гидрокси-5-метил-4-изоксазол-проприоновая кислота).
Основные положения, выносимые на защиту
1. В условиях специализированного нейрососудистого отделения городской больницы при применении методов ранней реабилитации и активизации пациентов прогрессирование ишемического инсульта возникает в 23,1% случаев ишемического инсульта, что соответствует нижней границе данных, приводимых в литературе. ИЛИ развивается при любом подтипе ишемического инсульта, как в первые 48 часов, так в более поздние сроки, и у каждого второго — третьего пациента с ИЛИ приводит к летальному исходу.
2. Влияние таких осложнений острого периода’ инсульта, как пневмония. инфекция мочевыводящих путей, дегидратация, на развитие как раннего, так и позднего ИЛИ незначительно в связи с небольшим числом таких осложнений.
На развитие ИЛИ преимущественно влияли факторы, связанные с отеком головного мозга, а также факторы, отражающие состояние сердечнососудистой системы. Влияние АД при поступлении было"’ неоднозначным, однако прослеживалась взаимосвязь заболеваний сердца и развития раннего ИЛИ, а также ИЛИ у пациентов с ЧИКБ.
3. Оценка клинических, анамнестических. инструментальных и лабораторных факторов, которые могут быть получены при обследовании пациентов с инсультом в условиях крупного многопрофильного стационара. недостаточна для высокой точности прогноза ИЛИ, что, по всей вероятности, связано с многообразием причин возникновения раннего и позднего ИЛИ. Вместе с тем, применение в раннем периоде инсульта определенных алгоритмов оценки позволяет выявить большинство пациентов, у которых возникнет ИЛИ, и принять адекватные меры профилактики. Необходим дальнейший поиск эффективных предикторов ИЛИ и внедрение их в практику отделений острого инсульта.
Теоретическая и практическая значимость работы
Проведенное исследование позволило выявить наиболее значимые предикторы неврологического ухудшения для различных подгрупп пациентов с ишемическим инсультом и, для улучшения точности прогноза, предложить комплексную оценку вероятности возникновения ИЛИ с учетом как клинических, биохимических данных, так и данных нейровизуализации.
Выявление этих факторов позволит проводить более эффективную профилактику прогрессирования ишемического инсульта, начиная с первых часов его возникновения.
Апробация работы
Основные положения исследования доложены и обсуждены на Международной научно-практической конференции « Измерительные информационные технологии и приборы в охране здоровья » (СПбГПУ, 7-9 октября 2003 г.), Всероссийских межвузовских научно-технических конференциях студентов и аспирантов, проводимых в рамках ежегодной XXXV и XXXVII Недели науки СПбГПУ (20-25 ноября 2006 г. и 24-29 ноября" 2008 г.), Всероссийском форуме студентов, аспирантов и молодых учёных. «Наука.и инновации, в,технических университетах» (СПбГПУ, 28-31 октября 2008 г.), Всероссийской» научно-практической, конференции « Поленовские чтения» (СПб, 22-24 апреля 2009 г.), Международной научно-практической конференции «Инновационные диагностические и лечебные технологии в неврологии » (Астана, 21-22 мая 2009), совместном заседании проблемной комиссии № 15 « Неврология. восстановительная, спортивная медицина и физиотерапия », кафедры неврологии с клиникой, кафедры неврологии и мануальной медицины ГОУ ВПО «Санкт-Петербургского Государственного Медицинского Университета им. акад. И.П.Павлова Минздравсоцразвития России» от 28 мая 2009 года.
По материалам диссертации опубликовано 7 печатных работ, из них 1- в журнале, рекомендованном ВАК.
Внедрение в практику результатов исследования
Полученные научные и практические данные используются в работе клиники неврологии ГОУ ВПО «Санкт-Петербургского Государственного Медицинского Университета им. акад. И.П.Павлова Минздравсоцразвития России» и отделения сосудистой неврологии ГМПБ №2, включены в лекции для студентов, интернов. клинических ординаторов, врачей-неврологов на кафедре неврологии и курсе неврологии факультет постдипломного образования ГОУ ВПО «Санкт-Петербургского Государственного Медицинского Университета им. акад. И.П.Павлова Минздравсоцразвития России».
Заключение диссертации по теме «Нервные болезни», Седова, Ольга Аркадьевна
выводы
1. Частота прогрессирования ишемического инсульта среди пациентов, включенных в исследование по сплошной выборке (134 пациента), составила 23,1 ± 3,6%. Достоверного влияния времени поступления на прогрессирование ишемического инсульта не выявлено (р=0,809). Частота прогрессирования инсульта оказалась наибольшей при тотальном инсульте в каротидном бассейне (36,0 ± 9,6%), меньшей при частичном инсульте в каротидном бассейне (29,2 ± 6,6%) и наименьшей — при ишемическом инсульте в вертебрально-базилярном бассейне (14,3 ± 5,0%), однако различия незначимы.
2. Достоверными предикторами ишемического прогрессирующего инсульта, выявляемыми клинически и по данным анамнеза, являются: возраст 75 — 89 лет, угнетение сознания, измеряемое по шкале комы Глазго, тотальный инсульт в каротидном бассейне, более низкое диастолическое или более высокое систолическое артериальное давление при поступлении, наличие дисциркуляторной энцефалопатии П-Ш стадии в анамнезе. У пациентов с частичным инсультом в каротидном бассейне возможным предиктором может являться женский пол и заболевания клапанов сердца.
3. Предикторами ишемического прогрессирующего инсульта, выявляемыми по данным инструментальных и лабораторных методов исследования, являются: уровень глюкозы более 6,3 ммоль/л, уровень тромбоцитов менее 184*109/л, увеличение СОЭ. Менее явная связь наблюдалась с дислокацией срединных структур головного мозга и большим объемом очага ишемии по данным нейровизуализации, с уровнем антител к нативному белку S100 бета.
4. Не обнаружена ожидаемая связь прогрессирующего инсульта и атеросклеротического поражения брахиоцефальных артерий по данным ультразвуковой допплерографии. наличия в анамнезе гипертонической болезни. сахарного диабета, фибрилляции предсердий, тяжести инсульта.
5. Выявлены предикторы ишемического прогрессирующего инсульта, характерные только или преимущественно для раннего и позднего прогрессирующего инсульта, для прогрессирующего инсульта с нарастанием и без нарастания общемозговых симптомов.
6. Создано несколько логистических моделей и алгоритмов оценки пациента, позволяющих с большей точностью, чем отдельные признаки, определить вероятность развития ишемического прогрессирующего инсульта для различных подгрупп пациентов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Г. Для оценки риска прогрессирования ишемического инсульта более информативны количественная оценка уровня сознания по шкале комы Глазго. чем качественная, и измерение объема очага инфаркта мозга по сравнению с измерением его площади по данным нейровизуализации.
Для оценки вероятности развития ИПИ у пациента, поступившего в первые 6 часов от начала заболевания, надо учитывать возраст и пол пациента, подтип ишемического инсульта, количество баллов по шкале комы Глазго и уровень глюкозы крови при поступлении. Для оценки вероятности развития ИПИ в течение 48 часов от начала заболевания надо учитывать возраст пациента, количество баллов по шкале комы Глазго, наличие заболеваний сердца. уровень глюкозы и тромбоцитов при поступлении, а в более поздние сроки — возраст, наличие дисциркуляторной энцефалопатии IT-HI стадии, в анамнезе,- уровень СОЭ *.
2. Вероятность прогрессирования ишемического инсульта можно определить с большей точностью, используя не отдельные предикторы прогрессирования, а их сочетания.
3. У пациента с ишемическим инсультом, поступившего в стационар, полезно применение ряда алгоритмов, измеряющих вероятность раннего и позднего прогрессирования инсульта.
Список литературы диссертационного исследования кандидат медицинских наук Седова, Ольга Аркадьевна, 2009 год
1. Акимов Г.А. Одинак М.М. Дифференциальная диагностика нервных болезней. — СПб: Гиппократ, 2004. — 744 с.
2. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. Руководство для врачей и научных работников. М. 2004.432 с.
3. Биллер X. Практическая неврология. Лечение: Пер. с англ. М. Мед.лит. 2005. — 416 с.
4. Бююль А. Цёфель П. SPSS: Искусство обработки информации. Анализ статистических данных и восстановление скрытых закономерностей: Пер. с нем. СПб, 2005. — 608 с.
5. Василенко Ф.И. Церебральный инсульт. Осложненные формы: патогенез. клиника, диагностика, лечение: Автореф.дис. доктора медицинских наук: 14.00.13 / МЗ СССР. Киев, ин-т усовершен. врачей К. 1990.-42 с.
6. Виберс Д. Фейгин В. Браун Р. Инсульт. Клиническое руководство: Пер. с англ. М. Издательство « БИНОМ », 2005.-608 с.
7. Виленский Б.С. Инсульт. Руководство для врачей. СПб. Медицинское информационное агентство, 1995. — 288 с.
8. Виленский Б.С. Неотложные состояния в неврологии. СПб. Издательство « ФОЛИАНТ », 2004. — 512 с.
9. Ворлоу Ч.П. Деннис М.С. ван Гейн Ж. др. Инсульт. Практическое руководство для ведения больных: Пер. с англ. СПб. Политехника, 1998.629 с.10: Голубев В:Л. Неврологические синдромы. Руководство для врачей. -М. 2002. С. 198.
10. Гринберг Д.А. Аминофф М.Дж. Саймон Р.П. Клиническая неврология: Пер. с англ. М. МЕДпресс-информ, 2004. — 520 с.
11. Гусев Е.И. Бурд Г.С. Никифоров А.С. Неврологические симптомы. синдромы, симптомокомплексы и болезни. М. Медицина. 1999. — 880 с.
12. Гусев Е.И. Скворцова В.И. Ишемия головного мозга. — М. Медицина, 2001. 328 с.
13. Дубовская Н.Г. Классификации болезней нервной системы. М. Триада-Х, 2002. — 256 с.
14. КурачВ.В. Повторный мозговой инсульт: Автореф. дис. канд. мед. наук: 14.00.13 / Украин. ин-т усовершенствования врачей. Харьков, 1990. -14 с.
15. Липовецкий Б.М. Инфаркт, инсульт, внезапная смерть. Факторы риска, предвестники, профилактика. СПб. 1997,- 191 с.
16. Мументалер М. Маттле X. Неврология: Пер. с нем. М. МЕДпресс-информ, 2007. — 920 с.
17. Наследов А.Д. SPSS 15: Профессиональный статистический анализ данных. СПб. Питер, 2008. — 416 с.
18. Никифоров А.С. Гусевv В.И. Общая неврология. М. ГОЭТАР-Медия, 2007. — С. 469.
19. Одинак М.М. Михайленко А.А. Иванов Ю.С. Сосудистые заболевания головного.мозга. СПб. Гиппократ, 2003. — 160 с.
20. Одинак В.М. Вознюк И.А1. Янишевский; С.Н. Инсульт. Вопросы этиологии ; патогенеза, алгоритмы* диагностики- и- терапии. СПб: ВМёдА, 2005.- 192 с:
21. Румянцева С.А. Интенсивная терапия неврологических заболеваний электронный ресурс. // Российский государственный медицинский университет. (07.08.09).
22. Рябова B.C. Инсульт и его последствия: Автореф. дис. канд. мед. наук: 14.00.13. М. 1985. — 20 с.
23. Самуэльс М. Неврология: Пер. с англ. М. Практика, 1997. — 640 с.
24. Семенова Г.М. Факторы, влияющие на исход инсульта: Автореф. дис. канд.мед.наук: 14.00.13 /СПб НИПНИ им. В.М. Бехтерева.-СПб, 1993. -16 с.
25. Скворцова В.И. Механизмы повреждающего действия церебральной ишемии и нейропротекция. Избранные лекции по неврологии. СПб, 2006.624 с.
26. Скворцова В.И. Снижение заболеваемости, смертности и инвалидизации от инсультов в Российской Федерации. М. Литтерра, 2007. -192 с.
27. Степанченко А.В. Марьяновский А.А. Нейрохимическе системы. -М. 2002.-112 с.
28. Суслина З.А. Очерки ангионеврологии. М: Атмосфера, 2005.- 368 с.
29. Тул Дж.Ф. Сосудистые заболевания головного мозга. Пер. с англ. -М. ГЭОТАР-Медиа, 2007. 608 с.
30. Хеннерици М.Г. Инсульт: Клиническое руководство: Пер. с англ. -М. МЕДпресс-информ, 2008. 224 с.
31. Хэнки Г.Дж. Инсульт, ответы на ваши вопросы: Пер. с англ. -Будапешт, 2002. 381 с.
32. Яхно Н.Н. Болезни нервной системы: Руководство для врачей: В 2 т. М. Медицина, 2005. — Т.1. — С. 232.
33. Adams HP, Bendixen ВН, Kappelle LJ, etc. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment // Stroke. -1993. №24. -P.35-41.
34. Adams H.P. Principles of cerebrovascular disease. New York, London,2006. 564 p.
35. Alawneh JA, Moustafa RR, Baron JC. Hemodynamic factors and perfusion abnormalities in early neurological deterioration // Stroke. 2009. — Vol. 40, №6. — P. 443-50.
36. Ali LK, Saver JL. The ischemic stroke patient who worsens: new assessment and management approaches // Reviews of Neurological Diseases.2007. Vol. 4, №2. — P. 85-91.
37. Anand N, Stead LG. Neuron-specific enolase as a marker for acute ischemic stroke: a systematic review // Cerebrovascular Diseases. 2005. — Vol. 20, №4. — P. 213-219.
38. Arboix A. Prognostic value of headache in cardioembolic stroke // Medicina Clinica. 2006. — Vol: 127, №1. — P. 5-7.
39. Arenillas JF, Rovira A, Molina С A, etc. Prediction of early neurological deterioration using diffusion- and perfusion-weighted imaging in hyperacute middle cerebral artery ischemic stroke // Stroke. 2002. — Vol. 33, №9. — P. 2197-2203.
40. Audebert HJ, Pellkofer TS, Wimmer ML, etc. Progression in lacunar stroke is related to elevated acute phase parameters // European Neurology. 2004. -Vol. 51, №3.-P. 125-131.
41. Barber M, Wright F, Stott DJ, etc. Predictors of early neurological deterioration after ischemic stroke: a case-control study // Gerontology. 2004. -Vol. 50, №2. — P. 102-109.
42. Barber M, Langhorne P, Rumley A, etc. Hemostatic function and progressing ischemic stroke: D-dimer predicts early clinical progression // Stroke. -2004. Vol. 35, №6. — P.1421-1425.
43. Barber M, Langhorne P, Rumley A, etc. D-dimer predicts early clinical progression in ischemic stroke: confirmation using routine clinical assays // Stroke. -2006.-Vol. 37, №4.-P. 1113-1115.
44. Berger C, Fiorelli M, Steiner T, etc. Hemorrhagic transformation of ischemic brain tissue: asymptomatic or symptomatic? // Stroke. 2001. — Vol. 32, №6. — P. 1330-1335.
45. Bergui M, Bradac GB. Progressive stroke, lacunae, and systemic blood pressure // Stroke. 2002. — Vol. 33, №12. — P. 2735-2736.
46. Bertsch T, Casarin W, Kretschmar M, etc. Protein S-100B: a serum marker for ischemic and infectious injury of cerebral tissue // Clinical Chemistry and Laboratory Medicine. 2001. — Vol. 39, №4. — P. 319-323.
47. Bielewicz J, Kurzepa J, Bartosik-Psujek H, etc. The correlation between S100BB and tau protein serum levels vs. clinical status of patients during acute phase of ischemic stroke // International Journal of Stroke. 2008. — Vol. 3, №1. -P. 404.
48. Birschel P, Ellul J, Barer D, etc. Progressing stroke: towards an internationally agreed definition// Cerebrovascular Diseases. 2004. -Vol. 17, № 23. — P. 242-252.
49. Branston NM, Symon L, Crockard HA, etc. Relationship between the cortical evoked potential and local cortical blood flow following acute middlecerebral artery occlusion in the baboon // Experimental Neurology. 1974. -Vol.45, №2.-P. 195-208.
50. Brierley J.B. Graham D.I. Hypoxia and vascular disorders of the central nervous system// Greenfield’s Neuropathology, fourth edition / Ed. by Adams J.H. et al. London, 1984. — Ch.4. — P. 126 — 164.
51. Burghaus L, Liu WC, Dohmen C, etc. Evoked potentials in acute ischemic stroke within the first 24 h: possible predictor of a malignant course // Neurocritical Care. 2008. — Vol. 9, №1. — P. 13-16.
52. Carbonell T, Rama R. Iron, oxidative stress and early neurological deterioration in ischemic stroke // Current Medicinal Chemistry. 2007. — Vol. 14, №8. — P. 857-874.
53. Carter AB. Anticoagulant treatment in progressing stroke // British Medical Journal. 1961. — Vol. 2, №5244. — P. 70-73.
54. Castellanos M, Leira R, Serena J, etc. Plasma Metalloproteinase-9 Concentration Predicts Hemorrhagic Transformation in Acute Ischemic Stroke // Stroke. 2003. — №34. — P. 40-46.
55. Castellanos M, Serena J. Applicability of biomarkers in ischemic stroke // Cerebrovascular Diseases. 2007. — Vol. 24, №1. — P. 7-15.
56. Castillo J, Davalos A, Noya M. Progression of ischaemic stroke and excitotoxic aminoacids // Lancet. 1997. — № 349. — P. 79-83.
57. Castillo J, Davalos A, Marrugat J, etc. Timing for fever-related brain damage in acute ischemic stroke // Stroke. 1998. — № 29. — P. 2455-2460.
58. Castillo J, Noya M. Mechanisms of progression of cerebral infarction // Neurologia. 1999. — Vol. 14″, № 2. — P. 2-12.
59. Castillo J, Leira R. Predictors of deteriorating cerebral infarct. role of inflammatory mechanisms. Woukl its early treatment be useful? // Cerebrovascular Diseases. 2001. — Vol. 11, № 1. — P. 40-48.
60. Castillo J, Leira R, Garcia MM, etc. Blood pressure decrease during the acute phase of ischemic stroke is associated with brain injury and poor stroke outcome // Stroke. 2004. — Vol. 35, № 2. — P. 520-526.
61. Cho Y-J, Hong K-S, Koo J-S, etc. Comparison of 2 types of progression after acute ischemic stroke: continuous deterioration vs. fluctuation of stroke severity. 16th European Stroke Conference // Cerebrovascular diseases. 2007. -Vol. 23, №2.-P. 1-147.
62. Cho YJ, Koo JS, Park JM, etc. Factors associated with stroke progression in acute cerebral infarction // International Journal of Stroke. 2008. — Vol. 3, № 1.- P. 405.
63. Dassan P, Keir G, Brown MM. Criteria for a clinically informative serum biomarker in acute ischaemic stroke: a review of S100B // Cerebrovascular diseases.- 2009. Vol. 27, № 3. — P. 295-302.
64. Davalos A, Cendra E, Teruel J; etc. Deteriorating ischemic stroke: risk factors and prognosis //Neurology. 1990. — Vol. 40, № 12. — P. 1865-1869.
65. Davalos Errando A. Emergency assessment in the hospital: the ability of early diagnostic tests to predict short-term prognosis, progression of infarct, hemorrhagic conversion and cerebral edema // Neurologia: 1995. — Vol». 10, №2. -P. 8-15.
66. Davalos A. Progressing stroke: pathophysiology and therapeutical approaches. Lisbon, 1999. — 13 p.
67. Davalos A, Toni D, Iweins F, etc. Neurological deterioration in acute ischemic stroke: potential predictors and associated factors in the European Cooperative Acute Stroke Study (ECASS) I // Stroke. 1999. — № 30. — P. 26312636.
68. Davalos A, Castillo J, Marrugat J, etc. Body iron stores and early neurologic deterioration in acute cerebral infarction // Neurology. 2000. — Vol. 54, № 8. — P. 1568-1574.
69. Di Napoli M. С reactive protein and acute phase of ischaemic stroke // BMJ. 2001. — Vol: 322, № 7302: — P. 1605-1606.
70. Donnan GA, Tress BM, Bladin PF. A prospective study of lacunar infarction using computerized tomography // Neurology. 1982. — Vol. 32, № 1. -P. 49-56.
71. Ferrari J, Flamm-Horak A, Lischka-Lindner A, etc. Worsening in patients treated in acute stroke units results of the Austrian Stroke Unit Registry // Wiener medizinische Wochenschrift — 2008. — Vol. 158, №15-16. — P. 425-428.
72. Fisher CM. Lacunar strokes and infarcts: a review // Neurology. 1982. -Vol. 32, №8.-P. 871-876.
73. Foix C, Levy M. Les ramollissements sylviens: syndromes des lesions en foyer du territoire de l’artere sylvienne et de ses branches // Revue Neurologique. -1927.-Vol. 2, № 1. P. 1-51.
74. Fothergill A, Christianson TJ, Brown RD Jr, etc. Validation and refinement of the ABCD2 score: a population-based analysis // Stroke. 2009. -Vol. 40, № 8. — P. 2669-2673.
75. Gautier JC. Stroke-in-progression // Stroke. 1985. — № 16. — P. 729-733.
76. Geiger S, Holdenrieder S, Stieber P, etc. Nucleosomes in serum of patients with early cerebral stroke // Cerebrovascular Diseases. -2006.- Vol. 21, № 1-2. P. 32-37.
77. Geiger S, Holdenrieder S, Stieber P, etc. Nucleosomes as a new prognostic marker in early cerebral stroke // Journal of Neurology. 2007. — Vol. 254, №5.-P. 617-623.
78. Hamann GF, del Zoppo GJ, von Kummer R. Hemorrhagic transformation of cerebral infarction—possible mechanisms // Thrombosis and Haemostasis. -1999. Vol. 82, № 1. — P. 92-94.
79. Hatano S. Experience from a multicentre stroke register: a preliminary report // Bulletin of the World Health Organization. 1976. — Vol. 54, № 5. — P. 541-553.
80. Heiss WD, Hayakawa T, Waltz AG. Cortical neuronal function during ischemia. Effects of occlusion of one middle cerebral artery on single-unit activity in cats // Archives of Neurology. 1976. — Vol. 33, №12. — P. 813-820.
81. Herzig R, Schneiderka P, Burval S, etc. S100B protein predicts the early recanalization of the acute middle cerebral artery occlusion. 16th European Stroke Conference // Cerebrovascular diseases. 2007. — Vol. 23, № 2. — P. 1-147.
82. Hornig CR, Bauer T, Simon C, etc. Hemorrhagic transformation in cardioembolic cerebral infarction // Stroke. 1993. — Vol. 24, № 3. — P. 465-468.
83. Hossmann KA. Viability thresholds and the penumbra of focal ischemia // Annals of Neurology. 1994. — Vol. 36, №4. — P. 557-565.
84. Hossmann KA. Pathophysiology and therapy of experimental stroke // Cellular and Molecular Neurobiology. 2006. — Vol. 26, № 7-8. — P. 1057-1083.
85. Itoh H, Shioi M, Oshida N, etc. Progressive stroke during the acute state of cerebral infarction in the territory of the internal carotid artery// No To Shinkei. -1996. Vol. 49, № 2. — P. 138-144.
86. Jaramillo A. Gongora-Rivera F. Labreuche J. etc. Predictors for malignant middle cerebral artery infarctions // Neurology. 2006. — Vol. 66, № 6. -P. 815-820.
87. Jauch EC, Lindsell C, Broderick J, etc. Association of Serial Biochemical Markers With Acute Ischemic Stroke // Stroke. 2006. — №37. — P. 2508 — 2513.
88. Johnston SC, Leira EC, Hansen MD, etc. Early recovery after cerebral ischemia risk of subsequent neurological deterioration // Annals of Neurology. -2003. Vol. 54, № 4. — P. 439-444.
89. Jones HR Jr, Millikan CH, Sandok BA. Temporal profile (clinical course) of acute vertebrobasilar system cerebral infarction // Stroke. 1980. — Vol. 11, №2. -P. 173-177.
90. Kalowska E, Rostrup E; Rosenbaum S, etc. Acute MRI changes in progressive ischemic stroke // European Neurology. 2008. — Vol. 59, №5. — P. 229-236.
91. Kang DW, Yoo SH, Chun S, etc. Inflammatory and hemostatic biomarkers associated with early recurrent ischemic lesions in acute ischemic stroke // Stroke. 2009. — Vol. 40, №5. — P. 1653-1658.
92. Karepov VG, Gur AY, Bova I, etc. Stroke-in-evolution: infarct-inherent mechanisms versus systemic causes // Cerebrovascular Diseases. 2006.- Vol. 21, № 1-2. — P. 42-46.
93. Kasner SE, Demchuk AM, Berrouschot J, etc. Predictors of fatal brain edema in massive hemispheric ischemic stroke // Stroke. 2001. — Vol. 32, № 9. P. 2117-2123.
94. Kim YS, Lee KY, Koh SH, etc. The role of matrix metalloproteinase 9 in early neurological worsening of acute lacunar infarction // European Neurology. -2006.-Vol. 55, №1.-P. 11-15.
95. Ют SK, Song P, Hong JM, etc. Prediction of progressive motor deficits in patients with deep subcortical infarction // Cerebrovascular Diseases. 2008. -Vol. 25, №4.-P. 297-303.
96. Kim SM, Yoo SH, Ют HJ, etc. Biochemical markers associated with infarct growth in acute ischemic stroke // International Journal of Stroke. 2008. -Vol. 3, № 1.- P. 411.
97. Koton S, Bornstain NM. Antiplatelets use and ischemic stroke severity and outcome among patients in the first National Acute Stroke Israeli Survey (NASIS 2004) // International Journal of Stroke. 2008. — Vol. 3, № 1.- P. 411.
98. Koukou E, Siassiakuo S, Koutete D, etc. Temperature within first 48 hours after acute ischemic stroke as a predictor of outcome // International Journal of Stroke. 2008. — Vol. 3, № 1.- P. 412.
99. Kwan J, Hand P. Early neurological deterioration in acute stroke: clinical characteristics, andtimpact on outcome // QJM.’ 2006. — Vol. 99, № 9. — P. 625-633.
100. Leira R, Davalos A, Aneiros A, etc. Headache as a surrogate marker of the molecular mechanisms implicated in progressing stroke // Cephalalgia. 2002. -Vol. 22, № 4. — P. 303-308.
101. Leira EC, Chang КС, Davis PH, etc. Can we predict early recurrence in acute stroke? // Cerebrovascular Diseases. 2004. — Vol. 18, № 2. — P. 139-144.
102. Leira R, Rodriguez-Yanez M, Castellanos M, etc. Hyperthermia is a surrogate marker of inflammation-mediated cause of brain damage in acute ischaemic stroke // Journal of Internal Medicine. 2006. — Vol. 260, № 4. — P. 343349.
103. Lesser T, Venth S, Lesser K. Progressive stroke in cases of common carotid occlusion—indication for revascularization // Zentralblatt fur Chirurgie. -2008. Vol. 133, № 4. — P. 374-375.
104. Leys D, Pruvo JP, Godefroy O, etc. Prevalence and significance of hyperdense middle cerebral artery in acute stroke // Stroke. 1992. — Vol. 23, № 3. -P. 317-324.
105. Libman R, Kwiakowski T, Lyden P, etc. Asymptomatic hemorrhagic transformation of cerebral infarction does not worsen long-term outcome // Journal of Stroke and Cerebrovascular Diseases. 2005. — Vol. 14, № 2. — P. 50-54.
106. Lindley RI, Wardlaw JM, Sandercock PA, etc. Frequency and risk factors for. spontaneous hemorrhagic transformation of cerebral infarction // Journal of Stroke and Cerebrovascular Diseases. 2004. — Vol. 13, №6. — P. 235-246.
107. Mallolas J, Hurtado O, Castellanos M, etc. A polymorphism in the EAAT2 promoter is associated with higher glutamate concentrations and higherfrequency of progressing stroke // The Journal of experimental medicine.- 2006. -Vol. 203, №3.- P. 711-717.
108. Matsumoto N, Kimura K, Yokota C, etc. Early neurological deterioration represents recurrent attack in acute small non-lacunar stroke // Journal of the Neurol Sciences. 2004. — Vol. 217, №2. — P. 151-155.
109. Mies G, Ishimaru S, Xie Y, etc. Ischemic thresholds of cerebral protein synthesis and energy state following middle cerebral artery occlusion in rat // Journal of Cerebral Blood Flow and Metabolism.-1991. Vol. 11, № 5. — P.753-761.
110. Missler U, Wiesmann M, Friedrich C, etc. S-100 protein and neuron-specific enolase concentrations in blood as indicators of infarction volume and prognosis in acute ischemic stroke // Stroke. 1997. — Vol. 28, № 10. — P. 1956- -1960.
111. Montaner J, Perea-Gainza M, Delgado P, etc. Etiologic diagnosis of ischemic stroke subtypes with plasma biomarkers // Stroke. 2008. — Vol. 39, № 8. -P. 2280-2287.
112. Nagakane Y, Naritomi H, Oe H, etc. Neurological and MRI findings as predictors of progressive-type lacunar infarction 11 European Neurology. 2008. -Vol. 60, №3.-P. 137-141.
113. Ois A, Martinez-Rodriguez JE, Munteis E, etc. Steno-occlusive arterial disease and early neurological deterioration in acute ischemic stroke // Cerebrovascular Diseases. 2008: — Vol. 25, № 1-2. — P. 151 — 156.
114. Olah L, Csepany T, Bereczky Z, etc. Activity of natural coagulation* inhibitor proteins in the acute phase of ischemic stroke // Ideggyogyaszati Szemle. -2005. Vol. 58, № 1-2. — P: 33-39.
115. Ong CT, Wu CS. Neurological deterioration in patients with first-ever ischemic stroke // Acta Neurologica Taiwanica. 2007. — Vol. 16, № 3. — P. 143149.
116. Raichle ME. The pathophysiology of brain ischemia // Annals of Neurology. 1983. — Vol. 13, № 1. — P. 2-10.
117. Roden-Jullig A, Britton M. Effectiveness of heparin treatment for progressing ischemic stroke: before and after study // Journal of Internal Medicine. -2000. Vol. 248, № 4. — P. 287-291.
118. Roden-Jullig A, Britton M, Malmkvist K, etc. Aspirin in the prevention of progressing stroke: a randomized controlled study // Journal of Internal Medicine. 2003. — Vol. 254, № 6. — P. 584-590.
119. Rodriguez-Yanez M, Castillo J. Role of inflammatory markers in brain ischemia// Current opinion in neurology. 2008. — Vol. 21, № 3. p. 353-357.
120. Rodriguez-Yanez M, Castellanos M, Sobrino T, etc. Molecular markers are associated with early computed tomography ischemic changes // Neurologia; -2008. Vol. 23, №4. — P. 220-225.
121. Roquer J, Rodriguez-Campello A, Gomis M, etc. Acute stroke unit care and early neurological deterioration in ischemic stroke // Journal of Neurology. -2008. Vol. 255, №7. — P. 1012-1017.
122. Ross R. The pathogenesis of atherosclerosis an update // New England journal of medicine. — 1986. — Vol. 314, № 8. — P. 488-500.
123. Ryu JK, Davalos D, Akassoglou K. Fibrinogen signal transduction in the nervous syste // Journal of thrombosis and haemostasis. 2009. — Vol. 7, № 1. — P. 151-154.
124. Sasaki Y, Ueyama H, Hashimoto Y, etc. Familial antithrombin III abnormality accompanied with progressing ischemic stroke // Rinsho Shinkeigaku. -1989. Vol. 29, № 4. — P. 450-455.
125. Scandinavian Stroke Study Group. Multicenter trial of hemodilution in ischemic stroke: background and study protocol. Scandinavian Stroke Study Group // Stroke. 1985. — Vol. 16, №5. — P.885-890.
126. Segura Т. Serena J. Castellanos M. etc. Cerebrovascular hemodynamics in Progressing Stroke. IX European Stroke conference, Vienna, 2000 // Cerebrovascular Deseases. 2000. — Vol. 10, №2.
127. Seisio BK. Pathophysiology and treatment of focal cerebral ischemia. Part I: Pathophysiology // Journal of neurosurgery. 2008. — Vol. 108. — P. 616631.
128. Serena J, Leira R, Castillo J, etc. Neurological Deterioration in Acute Lacunar Infarctions. The Role of Excitatory and Inhibitory Neurotransmitters // Stroke.- 2001.-№32.-P. 1154-1161.
129. Serena J, Blanco M, Castellanos M, etc. The prediction of malignant cerebral infarction by molecular brain barrier disruption markers // Stroke. 2005. -Vol. 36, №9.-P. 1921-1926.
130. Serena J, Rodriguez-Yanez M, Castellanos M. Deterioration in acute ischemic stroke as the target for neuroprotection // Cerebrovascular Diseases. -2006. Vol. 21, № 2. — P. 80-88.
131. Steger C, Pratter A, Martinek-Bregel M, etc. Stroke patients with atrial fibrillation have a worse prognosis than patients without: data from the Austrian Stroke registry // European Heart Journal. 2004. — Vol. 25, № 19. — P. 1734-1740.
132. Steinke W, Ley SC. Lacunar stroke is the major cause of progressive motor deficits // Stroke. 2002. — Vol. 33, № 6. — P.1510-1516.
133. Stroick M, Fatar M, Ragoschke-Schumm A, etc. Protein S-100B—a prognostic marker for cerebral damage // Current Medicinal Chemistry. 2006. -Vol. 13, №25. — P. 3053-3060.
134. Sumer M, Ozdemir I, Erturk O. Progression in acute ischemic stroke: frequency, risk factors and prognosis // Journal of Clinical Neuroscience. 2003. -Vol. 10, №2. — P. 177-180.
135. Tanaka Y, Koizumi C, Marumo T, etc. Serum S100B indicates brain edema formation and predicts long-term neurological outcomes in rat transient middle cerebral artery occlusion model // Brain Research. 2007. — Vol. 1137, № 1. -P. 140-145.
136. Tei H, Uchiyama S, Koshimizu K, etc. Accuracy of three-step diagnosis in discriminating subtypes of acute ischemic stroke // Rinsho Shinkeigaku. 1997. -Vol. 37, №L-P. 21-25.
137. Tei H, Uchiyama S, Ohara K, etc. Deteriorating ischemic stroke in 4 clinical categories classified by the Oxfordshire Community Stroke Project // Stroke. 2000. — Vol. 31, № 9. — P. 2049-2054.
138. Tei H, Uchiyama S, Fukuzawa M, etc. Predictors of good prognosis in total anterior circulation infarction // Rinsho Shinkeigaku (Clinical Neurilogy). -2002. Vol. 42, №4. — P. 287-292.
139. Thanvi B, Treadwell S, Robinson T. Early neurological deterioration in acute ischaemic stroke: predictors, mechanisms and management // Postgraduate Medical’Journal. 2008. — Vol. 84, № 994. — P. 412-417.
140. Toni D, Fiorelli M, Gentile M, etc. Progressing neurological deficit secondary to- acute ischemic stroke. A study on predictability, pathogenesis, and prognosis // Archives of Neurology. 1995. — Vol. 52, № 7. — P; 670-675.
141. Toni D, Fiorelli M, Bastianello S, etc. Hemorrhagic transformation of brain infarct: predictability in the first 5 hours from stroke onset and influence on clinical outcome // Neurology. 1996. — Vol. 46, № 2. — P. 341-345.
142. Toni D, Fiorelli M, Zanette EM, etc. Early spontaneous improvement and deterioration of ischemic stroke patients: a serial study with transcranial Doppler ultrasonography // Stroke. 1998. — № 29. — P. 1144-1148.
143. Toyoda K, Fujimoto S, Kamouchi M, etc. Acute blood pressure levels and neurological deterioration in different subtypes of ischemic stroke // Stroke. -2009. Vol. 40, № 7. — P. 2585-1588.
144. Ueyama H, Hashimoto Y, Uchino M, etc. Progressing ischemic stroke in a homozygote with variant antithrombin III // Stroke. 1989. — Vol. 20, № 6. — P. 815-818.
145. Vazquez-Cruz J, Marti-Vilalta JL, Ferrer I, etc. Progressing cerebral infarction in relation to plasma glucose in gerbils // Stroke.- 1990. Vol. 21, № 11. -P. 1621-1624.
146. Vila N, Castillo J, Davalos A, etc. Proinflammatory cytokines and early neurological worsening in ischemic stroke // Stroke. 2000. — Vol. 31, № 10. — P. 2325-2329.
147. Vila N, Castillo J, Davalos A, etc. Levels of anti-inflammatory cytokines and neurological worsening in acute ischemic stroke // Stroke. 2003. -Vol. 34, № 3.-P. 671-675.
148. Wang JY, Zhou DH, Li J, etc. Association of soluble intercellular adhesion molecule 1 with neurological deterioration of ischemic stroke: The Chongqing Stroke Study //Cerebrovascular Diseases. 2006. — Vol. 21, № 1-2. -P. 67-73.
149. Warlow C, van Gijn J, Dennis M, etc. Stroke: Practical. Management. Third edition; Oxford; 2007. — 995 p.
150. Weglewski A, Ryglewicz D; Mular A, etc. Changes of protein S100B serum concentration during ischemic and hemorrhagic stroke in relation to thevolume of stroke lesion // Neurologia i neurochirurgia polska. 2005. — Vol. 39, № 4.-P. 310-317.
151. Weimar C, Mieck T, Buchthal J, etc. Neurologic worsening during the acute phase of ischemic stroke // Archives of Neurology. -2005.-Vol. 62, № 3.-P.393-397.
152. Yamamoto H, Bogousslavsky J, van Melle G. Different predictors of neurological worsening in different causes of stroke // Archives of Neurology. -1998. Vol. 55, № 4. — P. 481-486.
153. Zaremba J, Losy J. Early TNF-alpha levels correlate with ischaemic stroke severity // Acta Neurologica Scandinavica. 2001.-Vol. 104, № 5.- P.288-295. 1
154. Zaremba J, Losy J. Interleukin-18 in acute ischaemic stroke patients // Neurological Sciences. 2003. — Vol. 24; № 3. — P. 117-124.
155. Zaremba J, Skrobanski P, Losy J. Acute ischaemic stroke increases the erythrocyte sedimentation, rate, which correlates, with early brain damage // Folia Morphologica. 2004. — Vol. 63, № 4. -P.373-376.
156. Zaremba J, Losy J. Interleukin-12 in acute ischemic stroke patients // Folia Neuropathologies 2006. — Vol. 44, № 1. — P. 59-66.
Обратите внимание, представленные выше научные тексты размещены для ознакомления и получены посредством распознавания оригинальных текстов диссертаций (OCR). В связи с чем, в них могут содержаться ошибки, связанные с несовершенством алгоритмов распознавания.
В PDF файлах диссертаций и авторефератов, которые мы доставляем, подобных ошибок нет.