Лечение хронической сердечной недостаточности
При хронической сердечной недостаточности проводят лечение основного заболевания (медикаментозное или хирургическое), а также собственно сердечной недостаточности. для чего применяют сердечные гликозиды, диуретические препараты, ряд средств, улучшающих метаболизм миокарда, периферические вазодилататоры.
Для лечения основного заболевания применяют противовоспалительные, десенсибилизирующие средства и гликокортикоиды (при ревмокардите и инфекционно-аллергических миокардитах), нормализуют функцию щитовидной железы (при тиреотоксикозе) и АД (при артериальной гипертензии) и т. д.
Хирургическое лечение является методом выбора при декомпенсированных ревматических пороках сердца у детей и подростков. Операции при недостаточности клапанов и стенозе предсердно-желудочковых отверстий в настоящее время сопровождаются низкой летальностью и в большинстве случаев устраняют нарушение гемодинамики.
Высокая физическая активность — характерная черта поведения детей — сохраняется и при недостаточности кровообращения. Между тем физическое напряжение и психоэмоциональное возбуждение увеличивают нагрузку на сердце и способствуют прогрессированию сердечной недостаточности. Поэтому ограничение физической нагрузки и психоэмоционального напряжения должно быть неотъемлемой частью комплексного лечения. При остром миокардите даже без выраженной острой и хронической сердечной недостаточности II, III стадий следует назначать строгий постельный режим. Физический и психический покой, лечебная гимнастика, массаж, оксигенотерапия уменьшают нагрузку на миокард и способствуют купированию сердечной недостаточности.
Декомпенсация кровообращения оказывает неблагоприятное влияние на пищеварительную систему. Питание и количество принятой жидкости могут существенно влиять на кровообращение и его нормализацию. При ограничении приема жидкости необходимо учитывать водный баланс — количество вводимой жидкой пищи, инфузии и выделения (диурез, стул, рвотные массы), принимая во внимание температуру тела ребенка и окружающей среды. Водный баланс без учета перспирации целесообразно поддерживать в пределах ±50- 100 мл.
В питании больных ограничивают поваренную соль, включают калийсодержащие продукты: печеный картофель, молоко, творог, чернослив, орехи, абрикосы, фруктовые соки. Исключаются наваристый бульон, чай, кофе. При декомпенсации кровообращения с явлениями дыхательной недостаточности уменьшают объем принимаемой пищи и увеличивают частоту кормления.
Снятие ограничений физической активности, приема жидкости и питания проводят в индивидуальном порядке (в зависимости от лечебного эффекта) через 3-4 недели от начала лечения.
Из лекарственных препаратов при недостаточности кровообращения назначают сердечные гликозиды, диуретики, вазодилататоры, противовоспалительные, десенсибилизирующие средства, препараты, нормализующие обмен веществ в миокарде, кислотно-основное состояние. При хронической сердечной недостаточности ведущую роль играют сердечные гликозиды, которые увеличивают внутриклеточную фракцию ионизированного кальция — основного иона, обеспечивающего реализацию процесса мышечного сокращения. В результате увеличивается сократимость миокарда, то есть сила и скорость его систолических сокращений (положительное инотропное действие). Помимо этого, сердечные гликозиды замедляют ритм сердечных сокращений (отрицательное хронотропное действие), замедляют предсердно-желудочковую проводимость (отрицательное дромотропное действие) и повышают возбудимость миокарда (положительное батмотропное действие). В условиях целостного организма увеличение сократимости миокарда под влиянием сердечных гликозидов приводит к уменьшению остаточного систолического объема крови и венозного давления, к повышению ударного объема и минутного объема крови, что способствует исчезновению или уменьшению клинических признаков сердечной недостаточности.
Несмотря на то, что в настоящее время известно свыше 300 сердечных гликозидов, практическое применение получило лишь небольшое количество препаратов с хорошо изученными фармакотерапевтическими свойствами.
Обычно применяют строфантин К, коргликон и группу препаратов наперстянки (дигоксин, целанид, дигитоксин).
Строфантин К и коргликон практически не всасываются в пищеварительном аппарате (вводятся только внутривенно), начинают действовать уже через 2-10 мин после введения, максимальный эффект наблюдается через 15-30 мин и полностью выводятся из организма к концу 2-3-х суток после применения. Поэтому их используют преимущественно в ситуациях, связанных с развитием острой сердечной недостаточности.
При выраженной кардиомегалии введение строфантина К небезопасно в связи с возможным быстрым развитием желудочковых аритмий (вплоть до фибрилляции). В этих случаях лучше применять (хотя и менее эффективно) коргликон. Строфантин К и коргликон вводят 2 раза в сутки в изотоническом растворе натрия хлорида.
Дигитоксин практически полностью всасывается в кишках (применяется только внутрь), начинает действовать через 2-4 ч после приема, максимальный эффект отмечается через 8-12 ч и полностью выводится из организма через 14-21 день. Применяют при длительном лечении хронической сердечной недостаточности.
Дигоксин и изоланид по своим фармакодинамическим свойствам занимают промежуточное положение между строфантином К и дигитоксином.
Дигоксин при внутривенном введении действует через 15-30 мин, при приеме внутрь — через 1-2 ч; продолжительность терапевтического действия — соответственно 2-3 и 4-6 ч; период полувыведения из плазмы составляет 36 ч. Дигоксин и изоланид применяют при хронической и острой сердечной недостаточности.
Лечение сердечными гликозидами слагается из фазы насыщения и фазы поддерживающей терапии. Фаза насыщения может осуществляться разными темпами — быстрым, умеренно-быстрым и медленным. При быстром темпе дигитализации доза насыщения достигается в течение суток. При хронической сердечной недостаточности этот тип насыщения применяется редко, так как сопряжен с высоким риском передозировки препарата. При умеренно-быстрой дигитализации доза насыщения достигается в течение 3-5 дней, причем в первые сутки вводится ее половина. Ее целесообразно проводить больным хронической сердечной недостаточностью с выраженной тахикардией.
Медленный темп насыщения наиболее безопасен с точки зрения развития интоксикации и часто применяется при хронической сердечной недостаточности. При этом насыщение достигается за 7-10 дней.
Расчет дозы насыщения у детей может проводиться по возрастному «дозис-фактору», с использованием минимальных, средних и максимальных доз насыщения массы взрослых. Выбор дозы насыщения — максимальной, средней или минимальной — определяется тяжестью клинического состояния пациента. Максимальную дозу используют только в условиях стационара у наиболее тяжелого контингента больных.
Как правило, лечение недостаточности кровообращения начинают со строфантина К, а затем переходят на поддерживающие дозы дигоксина. В 1-й день перехода нужно ввести 40 % препарата от дозы насыщения дигоксина, во 2-й и 3-й — 30 %, в 4-й — 25 %. С 5-го дня следует перейти на поддерживающую дозу, равную 20 % от дозы насыщения.
Следует отметить известную условность различных схем дозирования сердечных гликозидов, так как чувствительность к ним может варьировать в широких пределах и зависеть от индивидуальных свойств организма, степени выраженности воспалительного процесса в миокарде, состояния водно-электролитного обмена, выделительной функции почек (в случае нарушения последней следует проводить лечение сниженными дозами гликозидов). При выраженной кардиомегалии доза насыщения снижается на 20-40 %.
Основными критериями адекватности дигитализации являются уменьшение или исчезновение клинических симптомов сердечной недостаточности и нормализация ЧСС.
Интоксикация сердечными гликозидами проявляется характерным симптомокомплексом, включающим нарушения ритма сердца (резко выраженная брадикардия, частая желудочковая экстрасистолия, предсердно-желудочковая блокада различной степени, мерцательная аритмия), расстройства функции пищеварительного аппарата (потеря аппетита, тошнота, рвота, понос), неврологические нарушения (головная боль, адинамия, депрессия, бессонница), расстройство зрения (цветные кольца, пятна, полосы в поле зрения, снижение его остроты, дрожание предметов).
Непосредственной причиной летального исхода при интоксикации сердечными гликозидами обычно является фибрилляция желудочков, предшественником которой на ЭКГ является частая желудочковая экстрасистолия. При возникновении признаков интоксикации сердечными гликозидами необходимы следующие мероприятия:
1. Отмена сердечных гликозидов, усиление их выведения (солевые слабительные, мочегонные).
2. Назначение или увеличение дозы препаратов калия. Предпочтительно применять панангин в дозе 0,2 мл/кг массы тела, лучше в сочетании с глюкозой и инсулином («поляризующая смесь»).
3. Назначение препаратов, блокирующих действие сердечных гликозидов — унитиола (в разовой дозе 1 мл на 10 кг массы), изоптина, натрия цитрата (50-100 мл 2 % раствора внутривенно капельно) 2-3 раза в сутки в течение нескольких дней.
При дигиталисной артимии применяют контрагент дигиталиса в электрофизиологическом и фармакологическом отношении — дифенин (дилантин). Он угнетает эктопическую импульсацию и улучшает проводимость.
При выраженной синусовой брадикардии, а также предсердно-желудочковых блокадах показано применение атропина, эуфиллина.
Терапия диуретическими препаратами является важным составным элементом лечения хронической сердечной недостаточности. Клинический эффект при применении мочегонных средств достигается за счет уменьшения объема циркулирующей крови.
Основные диуретические средства снижают реабсорбцию натрия, хлора и воды в канальцах нефрона и по преимущественной локализации эффекта подразделяются на ряд групп. В настоящее время при лечении сердечной недостаточности используются в основном салуретические препараты, действующие на восходящую часть нефрона (фуросемид, этакриновая кислота) или на корковый нефрон (дихлотиазид, клопамид). Применяются они самостоятельно или с диуретическими препаратами (спиронолактон, триамтерен), которые действуют на дистальную часть канальца нефрона (усиливают выведение Na и, таким образом, мочегонный эффект салуретиков).
Средняя терапевтическая доза фуросемида (лазикса), этакриновой кислоты (урегита) и дихлотиазида (гипотиазида) — 1-2 мг/кг массы тела в сутки. При приеме внутрь их эффект наступает через 1-2 ч и продолжается 6-12 ч.
Суточная доза применяется одномоментно утром после еды или в два приема для предупреждения слишком большого диуреза. Салуретические препараты усиливают также продукцию альдостерона (вторичный альдостеронизм).
Они способствуют избыточному выведению К, что усугубляет снижение сократительной функции миокарда и провоцирует дигиталисные аритмии. Поэтому лечение этими препаратами необходимо дополнять препаратами калия (калия хлорид, панангин) или калийсберегающими диуретическими средствами (спиронолактон, триамтерен). Спиронолактон (верошпирон) блокирует экскрецию К в дистальном отделе нефрона, а также повышает минералокортикоидную функцию надпочечников у больных сердечной недостаточностью. Средняя терапевтическая доза препарата — 2-3 мг/кг массы тела в течение 2-3 дней, поддерживающая — 1 -1,5 мг/кг.
Триамтерен (50 мг в капсуле) в комбинации с салуретическими препаратами назначают по 1-2 капсулы в сутки. Он оказывает более выраженный диуретический эффект, чем верошпирон.
Осмодиуретические препараты противопоказаны, так как они увеличивают объем циркулирующей крови.
Диуретические препараты предпочтительнее назначать циклами — салуретические средства в течение 4-5 дней с 2-5-дневным интервалом, калийсберегающие диуретические препараты — 10 дней с перерывом 5- 10 дней. При длительной терапии диуретическими препаратами могут быть гипокалиемия, гипохлоремический алкалоз и обезвоживание. Клинически это проявляется слабостью, жаждой, тошнотой, анорексией. снижением диуреза, желудочковыми аритмиями, судорогами. Возможны тромбоэмболии. В связи с этим при длительном применении мочегонных препаратов необходимо постоянно учитывать диурез (лучше баланс выпитой и выделенной жидкости), периодически проверять концентрацию электролитов в крови.
При ослаблении мочегонного эффекта следует сменить диуретический препарат или использовать новое их сочетание.
Для улучшения сократительной функции сердечной мышцы при хронической недостаточности определенную (вспомогательную) роль играют средства, улучшающие метаболизм миокарда. К ним относятся препараты, стимулирующие синтез нуклеотидов и белка в миокарде (рибоксин, калия оротат), стероидные и нестероидные гормоны, препараты калия (панангин, аспаркам), кокарбоксилаза, кислота аденозинтрифосфорная, пиридоксин, цианокобаламин, кальция пангамат, кислота фолиевая.
В последнее десятилетие для лечения тяжелых форм сердечной недостаточности, особенно после операций с применением искусственного кровообращения в качестве эффективного вспомогательного средства используют препараты, влияющие на состояние сосудистого тонуса и усиливающие сердечную деятельность. К ним относятся нитраты (нитроглицерин, нитропрусид, нитросорбид), апрессин (гидралазин), фентоламин, обладающие выраженным вазоплегическим действием, а также изадрин (новодрин), орципреналина сульфат (алупент) и дофамин (допамин). Они снижают периферический венозный и артериальный тонус и тем самым улучшают гемодинамику, усиливают сердечную деятельность за счет увеличения ударного объема и сердечного выброса, уменьшения потребления кислорода миокардом. Дофамин, в отличие от других катехоламинов, оказывает более слабое влияние на периферическое сосудистое сопротивление, более слабое хронотропное и выраженное инотропное действие на миокард, увеличивает почечный кровоток. Нитроглицерин можно назначать в виде таблеток и мази на область сердца. Применяют также препарат пролонгированного действия — тринитролонг. Суточная доза гидралазина — 7 мг/кг массы тела, но не более 200 мг, фентоламина — 2-3 мг/кг массы тела. Препарат снижает сопротивление легочных сосудов. М. Я. Студеникин, В. И. Сербин указывают на высокую эффективность фентоламина при недостаточности левого предсердно-желудочкового и аортального клапанов, при дефекте межжелудочковой перегородки, предсердно-сосудистой коммуникации. Однако опыт применения указанных препаратов в педиатрической практике небольшой, требует дальнейших исследований и наблюдений.
Бета-адреноблокатор III поколения небиволол: перспективы применения при хронической сердечной недостаточности
В статье обсуждаются перспективы применения нового бета-адреноблокатора небиволола (небилета) у больных с хронической сердечной недостаточностью (ХСН). Представлены данные литературы и результаты собственных исследований клинической фармакодинамики данного препарата при ХСН.
Ключевые слова: хроническая сердечная недостаточность, патогенез, лечение, небиволол.
Л. Г. Воронков, д. м. н. профессор
Институт кардиологии им. Н. Д. Стражеско АМН Украины, Киев
Как известно, с 2001 года бета-адреноблокаторы (bБ) признаны в качестве стандартного средства фармакотерапии больных с хронической сердечной недостаточностью (ХСН) и включены в международные и отечественные рекомендации по лечению данного синдрома [2]. Мотивом для этого послужили результаты крупных (охвативших в общей сложности более 10 тыс. пациентов) многоцентровых плацебо-контролируемых исследований, в которых была продемонстрирована способность некоторых представителей этого класса лекарственных средств (а именно – бисопролола, ретардной формы метопролола сукцината и карведилола) при длительном применении улучшать систолическую функцию левого желудочка сердца (ЛЖ), клиническое состояние пациентов и главное – увеличивать продолжительность их жизни [USCP, 1996, CIBIS-II, 1999, MERIT-HF, 1999, COPERNICUS, 2001]. В качестве универсальных механизмов благоприятного влияния b-адреноблокады на клиническое течение ХСН рассматриваются: ее кардиопротекторное действие, нормализация передачи b-адренергического сигнала в кардиомиоцитах, блокада активации ренин-ангиотензиновой системы на наиболее раннем этапе – путем угнетения секреции ренина, снижение симпатического тонуса и нормализация барорефлекторного ответа, подавление эктопической активности миокарда.
В отличие от ингибиторов ангиотензин-превращающего фермента (АПФ) с их унитарным механизмом действия (подавление АПФ), bБ представляют собой более гетерогенный класс препаратов, существенно различающихся по сочетанию и по выраженности присущих им фармакологических свойств. Поэтому, по мнению экспертов, клинические результаты, полученные в отношении эффективности и безопасности при ХСН того или иного bБ, не могут быть экстраполированы на иных представителей этого класса препаратов. Таким образом, исходя из данных доказательной медицины, а именно – результатов указанных выше многоцентровых исследований, лишь применение бисопролола, метопролола CR/XL и карведилола сегодня официально рекомендовано при клинически манифестированной ХСН с систолической дисфункцией ЛЖ (фракция выброса (ФВ) 40 % и менее). Обоснованность такого подхода определяется и тем, что применительно к остальным bБ масштабные рандомизированные исследования при клинически развернутой ХСН либо не проводились (пропранолол, тимолол, атенолол, надолол, ацебутолол, целипролол, соталол), либо не позволили выявить статистически достоверного их влияния на выживаемость пациентов (буциндолол, метопролол тартрат).
Поэтому вполне оправданным является интерес клиницистов к возможности расширения перечня bБ, рекомендуемых для лечения больных с ХСН. Анализ соответствующих данных литературы свидетельствует о том, что из всех клинически актуальных bБ сегодня в качестве реального «кандидата» для использования в качестве средства фармакотерапии ХСН может рассматриваться небиволол.
К настоящему времени небиволол утвердился в кардиологии в качестве эффективного и весьма безопасного антигипертензивного и антиангинального средства [3, 12]. Как фармацевтическая субстанция он представляет собой рацемическую смесь двух стереоизомеров – D-небиволола и L-небиволола в равных соотношениях. D-стереоизомер обладает b-блокирующей активностью, в то время как с действием L-стереоизомера небиволола связана его способность к стимуляции синтеза NO сосудистым эндотелием [6].
Как b1-селективный агент небиволол существенно превосходит все известные bБ: соотношение блокады b1- и b2-рецепторов (показатель b1-селективности) у небиволола составляет 288 (в другой серии опытов – 293), в то время как для бисопролола – 26, метопролола – 25, атенолола – 15, целипролола – 4,8, пропранолола и пиндолола – по 1,9 [11, 12]. Так же, как карведилол, бисопролол и метопролол, небиволол лишен внутренней симпатомиметической активности [9].
С селективностью небиволола связан его высокий профиль безопасности (частота побочных эффектов составляет 0,3-6 %). Небиволол не вызывает ухудшения бронхиальной проводимости; при его продолжительном применении не регистрировались случаи возникновения синдрома Рейно и другие признаки ухудшения периферического кровотока.
Высокая b1-селективность небиволола позволяет использовать его в соответствии с показаниями у максимально широкого круга кардиологических пациентов, а способность этого препарата модулировать функцию эндотелия представляется той важнейшей характеристикой, которая определяет его благоприятное влияние на патофизиологические механизмы прогрессирования ХСН. В основе эндотелий-опосредуемых фармакодинамических эффектов небиволола лежит его способность увеличивать синтез оксида азота (NO) эндотелиоцитами. Физиологическими сосудистыми эффектами NO являются вазодилатация, подавление пролиферации клеток, угнетение процессов активации и агрегации тромбоцитов, адгезии, активации и миграции лейкоцитов. Кроме того, NO улучшает люзитропную функцию (активное диастолическое расслабление) сердечной мышцы.
Оксид азота синтезируется из аминокислоты L-аргинина под влиянием NO-синтетазы (NOS). Идентифицированы 3 изоформы последней: нейрональная, эндотелиальная (eNOS) и индуцибельная (iNOS). Патогенетическое значение при ХСН имеет активность последних двух изоформ (рис. 1).
eNOS является мембраносвязанным энзимом, обязательное условие активации которого – увеличение концентрации свободного Са2+ в цитозоле, поэтому eNOS продуцирует ограниченное количество локально действующего NO, необходимое для поддержания нормального вазодилататорного тонуса.
Физиологическими факторами активации eNOS являются:
а) «напряжение сдвига» (shear stress), под которым понимается скользящее прижимающее механическое воздействие потока крови на поверхность эндотелия;
б) воздействие ряда эндогенных субстанций, действующих через свои специфические рецепторы в эндотелиоцитах (катехоламинов, брадикинина, гистамина, серотонина, тромбина) [7]. Угнетают активность eNOS ангиотензин II и провоспалительные цитокины – в частности, тумор-некротический фактор альфа (TNF-a).
Для пациентов с ХСН характерна эндотелиальная дисфункция, связанная со сниженной активностью eNOS и, соответственно, дефицитом NO. В результате этого происходит:
а) снижение сердечного выброса, а следовательно – уменьшение скорости кровотока, влекущее за собой снижение «напряжения сдвига»;
б) повышенный вследствие активации АПФ распад брадикинина, стимулирующего выработку эндотелиального NO;
в) повышенная продукция ангиотензина ІІ, который стимулирует образование в эндотелиоцитах супероксидного аниона, инактивирующего эндотелий – продуцируемый NO;
г) активация противовоспалительных цитокинов (TNF-a), подавляющих экспрессию eNOS.
Патогенетически важным следствием эндотелиальной дисфункции при ХСН является нивелирование контррегуляторного (по отношению к РАС, ангиотензину ІІ, норадреналину, эндотелину-1) сосудорасширяющего потенциала NO, в результате чего усугубляется периферическая вазоконстрикция, а через последнюю – гемодинамическая перегрузка сердца и гипоксия скелетной мускулатуры.
Другим не менее важным следствием эндотелиальной дисфункции при ХСН является утрата таких опосредуемых оксидом азота эффектов, как подавление пролиферации клеток, агрегации тромбоцитов и главное – угнетение активации моноцитов так называемыми молекулами адгезии. Последний механизм играет существенную роль реализации феномена иммуновоспалительной активации, значение которого в прогрессировании клинически развернутой застойной ХСН к настоящему времени доказано.
В развитии последнего феномена существенным фактором выступают разнонаправленные изменения экспрессии двух изоформ NOS – эндотелиальной (уменьшение, о чем говорилось выше) и индуцибельной (возрастание).
iNOS, в отличие от eNOS, не требует Са2+ и кальмодулина для своего синтеза и продуцирует NO в концентрациях, значительно превышающих те, которые образуются под влиянием eNOS. Кроме того, в отличие от эндотелиальной, индуцибельная NO-синтетаза экспрессируется лишь в патологических условиях – в ответ на активацию провоспалительными цитокинами (в частности, TNF-a) [5, 15].
Патогенетическая связь между eNOS и iNOS при ХСН состоит в том, что в результате угнетения eNOS и соответствующего этому подавления продукции NO эндотелием возрастает экспрессия так называемых молекул адгезии, активирующих моноциты. Активный синтез iNOS последними является ключевым фактором гиперпродукции тех же (по принципу порочного круга) TNF-a и иных провоспалительных цитокинов, повышенного образования свободных радикалов с последующим повреждением и апоптозом клеток тканей-мишеней.
Небиволол (а точнее, один из его активных метаболитов) через активацию локализованных в эндотелиоцитах b2-рецепторов стимулирует Са+-зависимую продукцию eNOS, увеличивая таким образом образование NO [10]. Следствием этого является отчетливый вазодилатирующий эффект препарата, эндотелий-зависимый характер которого продемонстрирован как на здоровых добровольцах, так и на пациентах с артериальной гипертензией [14].
Проведенными в нашей клинике в 2002-2003 годах исследованиях (И. А. Шкурат) установлено, что 12-недельное применение небиволола (небилет производства фирмы «Berlin-Chemie») в дозах 1,25-5 мг в сутки у пациентов с ХСН и фракцией выброса левого желудочка менее 40 % сопровождалось существенным возрастанием пиковой скорости магистрального периферического кровотока: в задней большеберцовой артерии – с 33,3 ± 7,5 до 47,2 ± 4,7 см/с (р
Применение бета-адреноблокаторов при хронической сердечной недостаточности: фокус на бисопролол
РЕКЛАМА
Хроническая сердечная недостаточность (ХСН) — это синдром, развивающийся в результате различных заболеваний сердечно-сосудистой системы, приводящий к снижению насосной функции сердца, хронической гиперактивации нейрогормональных систем и проявляющийся одышкой, сердцебиением, повышенной утомляемостью, ограничением физической активности и избыточной задержкой жидкости в организме. Синдром ХСН может осложнять течение практически всех заболеваний сердечно-сосудистой системы.
Интерес во всем мире к изучению различных аспектов ХСН обусловливается плохим прогнозом заболевания, увеличением числа больных с ХСН, увеличением числа госпитализаций из-за обострения ХСН, неудовлетворенностью качеством лечения, ростом затрат на борьбу с ХСН. Статистика свидетельствует о неуклонном росте числа больных с ХСН во всех странах, независимо от политической и экономической ситуации. В настоящее время распространенность клинически выраженной ХСН в популяции составляет не менее 2,0%. С возрастом (у лиц старше 65 лет) частота встречаемости ХСН возрастает до 6–10% и является самой частой причиной госпитализации пожилых больных. За последние 15 лет число госпитализаций больных с ХСН утроилось, а за 40 лет увеличилось в 6 раз. Пятилетняя выживаемость больных с ХСН все еще ниже 50%, а риск внезапной смерти в 5 раз выше, чем в популяции. Точной статистики о количестве пациентов в России нет, тем не менее можно предположить, что их не менее 3–3,5 млн человек, причем это только пациенты со сниженной насосной функцией левого желудочка (ЛЖ) и явными симптомами ХСН. Примерно столько же больных имеют симптомы ХСН при нормальной систолической функции сердца и их вдвое больше, чем имеющих бессимптомную дисфункцию ЛЖ, поэтому речь может идти о 12–14 млн больных с ХСН [1]. Доказано, что в наши дни именно ишемическая болезнь сердца (ИБС) (в сочетании с артериальной гипертонией или без нее) является самой частой причиной ХСН, составляя до 60% всех случаев декомпенсации. В связи со сказанным своевременная диагностика ХСН и знание современных методов лечения весьма актуально.
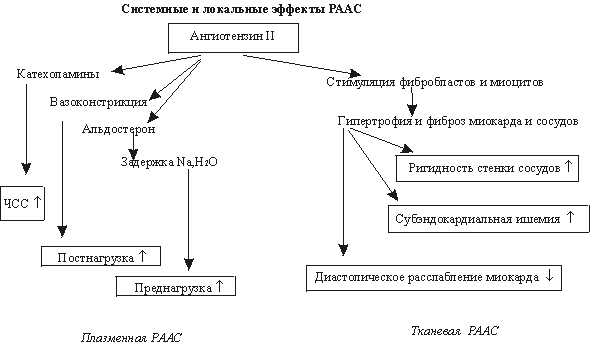
Подходы к лечению во многом зависят от понимания основных патофизиологических процессов, обусловливающих клинические проявления ХСН. Следует отметить, что в последние десятилетия ХХ века произошли значительные изменения взглядов как на саму проблему понимания развития ХСН, так и ее лечения. Получила распространение так называемая «миокардиальная теория патогенеза хронической сердечной недостаточности». В ее основе лежало представление о чрезмерной активации нейрогормональных систем — ренин-ангиотензин-альдостероновой (РААС) и симпатико-адреналовой (САС). Хорошо известно, что при снижении сердечного выброса, обусловленного нарушением систолы ЛЖ, происходит активация САС, которая носит компенсаторный характер. Это приводит к следующему:
- повышение частоты сердечных сокращений и сократимости миокарда обеспечивает насосную функцию сердца;
- происходит поддержание артериального давления (АД) в условиях сниженного сердечного выброса (СВ);
- потенцируется веноконстрикция, обеспечивая венозный возврат и повышение давления наполнения сердца через механизм Франка–Старлинга.
Когда необходимость в интенсификации кровообращения проходит, то нет необходимости в повышении активности САС. В условиях же постоянной гемодинамической (и иной) перегрузки сердца происходит длительная гиперактивация САС, нивелирующая положительные моменты активации данной системы.
Нежелательные эффекты длительной активации САС заключаются в следующем:
- Происходит дополнительная (помимо основного патологического процесса) гибель кардиомиоцитов в результате некроза и апоптоза. Развитие дисфункции и некроза мышечных волокон происходит вследствие их перегрузки кальцием и угнетения митохондрий, что опосредуется через бета1- и бета2-адренорецепторы сердца и циклического АМФ.
- Увеличение частоты сердечных сокращений (ЧСС) способно непосредственно негативно влиять на работу сердца при ХСН, независимо от развития ишемии миокарда и нарушений ритма сердца. В норме сила сокращений возрастает при увеличении ЧСС, в пораженном же сердце происходит дальнейшее снижение сократительной способности миокарда.
- Провоцируется ишемия вне зависимости от состояния коронарного русла.
- Провоцируются нарушения ритма сердца.
- Стимулируется секреция ренина, снижается почечный кровоток, задерживается жидкость вследствие повышения реабсорбции натрия.
Однако длительная терапия бета-адреноблокаторы (бета-АБ) больных ХСН тормозит и вызывает регрессию патологического ремоделирования сердца (гипертрофию и изменение формы полостей сердца), улучшает функцию сердца (уменьшение тахикардии, торможение апоптоза и кардиотоксического действия катехоламинов, электрическую нестабильность миокарда и косвенно активность РААС). Без преувеличения можно сказать, на сегодняшний день бета-АБ являются неотъемлемой частью лечения ХСН. Долгое время считалось, что бета-АБ противопоказаны у больных ХСН, обусловленной систолической дисфункцией ЛЖ.
Пересмотр представлений о возможности применения бета-АБ у больных ХСН начался в 80-е годы, когда Swedberg и соавт. [2] сообщили, что длительное назначение небольших доз бета-АБ (в сочетании с диуретиками) улучшает функцию ЛЖ и увеличивает продолжительность жизни больных с дилатационной кардиомиопатией (за 3 года наблюдения смертность среди больных, получавших бета-АБ, составила 48%, тогда как в контрольной группе — 90%). С того времени выполнено достаточное количество контролируемых исследований, посвященных изучению влияния различных бета-АБ на показатели функции ЛЖ и продолжительность жизни больных с ХСН.
В настоящее время бета-АБ являются неотъемлемым компонентом комплекса лекарственных средств, предназначенных для лечения больных ХСН различной этиологии. Особое внимание привлекает кардиоселективный бета-АБ 2-й генерации бисопролол (Конкор ® ). Так, в 1994 г. было проведено двойное слепое многоцентровое европейское исследование CIBIS [3]. В это исследование был включен 641 больной с III–IV функциональным классом ХСН, в добавление к ингибиторам ангиотензинпревращающего фермента (иАПФ) и мочегонным больные получали бисопролол (2,5–5 мг/сут) или плацебо в течение 2 лет. Риск смерти снизился на 20% среди больных, получавших бисопролол, наиболее успешной была терапия у тех пациентов, ЧСС которых была более 80 уд./мин, а также среди больных с ХСН неишемической этиологии. Это исследование отчетливо показало целесообразность применения бета-АБ (а конкретно, бисопролола) у больных с ХСН (достаточно тяжелой). Исследование CIBIS II [4] включало уже 2647 больных с ХСН III-IV функциональных классов и фракцией выброса ЛЖ менее 35%. Период наблюдения составил в среднем 1,3 года. Бисопролол (Конкор ® ) назначали в дозе 1,25 мг/сут с постепенным увеличением дозы до 10 мг/сут. Результаты исследования оказались весьма впечатляющими: выявлено снижение общей смертности на 32%, снижение частоты внезапной смерти на 42%, снижение частоты госпитализаций на 15% (в том числе по поводу сердечной декомпенсации на 32%). Важно отметить, что эффективность бисопролола (Конкора ® ) не зависела от тяжести и этиологии ХСН (у больных с ИБС эффект был даже более выраженным, чем при дилатационной кардиомиопатии). Риск декомпенсации, требующей госпитального лечения, под влиянием бисопролола снижался на 30%. Существенно, что бисопролол переносился так же хорошо, как и плацебо, частота вынужденной отмены препарата составила всего 15%. Основной опасностью при лечении больных с ХСН может быть развитие атриовентрикулярной блокады или выраженной гипотонии. Предупредить эти осложнения можно, начиная с назначения небольшой дозы препарата (1,25 мг), которая постепенно повышается. CIBIS II — первое крупное исследование, доказавшее положительное влияние кардиоселективного бета-АБ бисопролола на течение заболевания у больных с выраженной ХСН независимо от характера заболевания, приведшего к развитию декомпенсации. Это исследование показало способность бисопролола продлевать жизнь больных с ХСН.
В настоящее время бисопролол внесен Международными кардиологическими обществами, а также ВНОК в число препаратов, предназначенных для лечения ХСН различной этиологии.
Представляется также весьма интересным вопрос: можно ли начинать лечение больных с ХСН с назначения бета-АБ и, в частности, бисопролола? Дело в том, что в процессе развития ХСН САС активируется раньше, чем РААС, в то же время бета-АБ более эффективно снижают концентрацию норадреналина, нежели иАПФ (кроме того, бета-АБ способны снижать также активность РААС). иАПФ, в свою очередь, более эффективно снижают концентрацию ангиотензина II (А II) у больных ХСН (которые уже находятся на терапии бета-АБ, последние положительно влияют на «ускользание» влияния иАПФ на содержание АII). Сказанное позволяет утверждать, что на начальных этапах развития ХСН, возможно, более целесообразно назначать бета-АБ. На этот вопрос весьма недвусмысленный ответ дает многоцентровое исследование CIBIS III [5], основная гипотеза которого состоит в утверждении, что начало терапии больных с ХСН можно начинать с бета-АБ (в частности, бисопролола) к которому в дальнейшем добавляется иАПФ. Таким образом, основная цель CIBIS III состояла в том, чтобы показать, что стартовая терапия бисопрололом (к которому затем присоединялся эналаприл) сравнима (не хуже) с обратным назначением препаратов (сначала эналаприл, а затем бисопролол) в профилактике смерти и госпитализации по различным причинам (в первую очередь — кардиальным). В исследовании участвовало 1010 пациентов с ХСН II–III функционального класса. В одной группе больных бисопролол (Конкор ® ) титровался начиная с 1,25 мг/сут до целевой дозы в 10 мг/сут, в другой — эналаприл (Энап) начальную дозу составил 5 мг/сут, конечная доза была равна 20 мг/сут (данная фаза исследования составила 6 мес, затем в течение 18 мес больные получали одновременно оба препарата (бисопролол (Конкор ® )— с 1,25 мг/сут до 10 мг/сут, эналаприл (Энап) — начиная с 5 мг/сут до 20 мг/сут). Было установлено, что монотерапия бисопрололом в начале лечения ХСН не только не уступает по эффективности эналаприлу, а по некоторым показателям даже превосходит монотерапию иАПФ. Конкор ® так же безопасен, как и иАПФ, при использовании в качестве монотерапии в начальной стадии лечения ХСН. Таким образом, результаты исследования CIBIS III поддерживают концепцию «свободного выбора» для начальной терапии ХСН бета-АБ или иАПФ, основанную на личном решении врача с учетом индивидуальных особенностей больного. Вопрос стоит так: можно ли назначить больному с ХСН бета-АБ без иАПФ? Однако вопрос стоит не в противопоставлении иАПФ бета-АБ, а в выборе оптимального режима стартовой терапии. Внезапная смерть во время первых 6 месяцев монотерапии в группе больных, получавших бисопролол, отмечена в 8 из 23 смертельных исходов; смертельных исходов в группе, получавших эналаприл, — 16 из 32. В течение первого года в группе начинавших лечение бисопрололом было 16 (из 42), в группе начинавших лечение эналаприлом эти показатели равнялись соответственно 29 из 60 (то есть на 46% меньше в группе больных, начинавших лечение Конкором ® ). Это позволило сделать вывод, что у больных 65 лет и старше с легкой или умеренной стабильной ХСН (фракцией выброса, равной или менее 35%) начало терапии с назначения Конкора ® достоверно превосходит начало терапии с назначения эналаприла по снижению случаев внезапной смерти в течение первого года. Достоверные различия в количестве случаев внезапной смерти между стратегиями терапии сохранялись после 6 месяцев комбинированной терапии. Тем не менее современные рекомендации предлагают начинать лечение ХСН с иАПФ, вслед за чем советуют добавлять высококардиоселективный бета-АБ (в данном случае — бисопролол).
Применение бета-АБ существенно снижает смертность больных с ХСН. Таким образом, всех пациентов с ХСН и кардиомегалией следует рассматривать как претендентов на лечение бета-АБ. Для начала терапии необходима гемодинамическая стабильность пациента. Применение бета-АБ не является вариантом неотложной терапии в большинстве случаев ХСН. Необходимо начинать лечение с малых доз (применительно к бисопрололу — это 1,25 мг/сут), через две недели доза удваивается, что делается с целью предотвращения побочных явлений. Не следует значительно увеличивать дозу в интервале 2 нед. Именно постепенность в наращивании дозы препарата — залог успеха в применении бета-АБ у больных ХСН. Снижение ЧСС более 10 уд./мин является достоверным критерием бета-адреноблокады.
В настоящее время трудно представить лечение ХСН без применения высокоселективных бета-АБ; не случайно в учебнике «Внутренние болезни» S. Davidson (20-е издание, 2006 г.) приведены следующие слова: «Добавление пероральных бета-АБ в увеличивающихся дозах к стандартной терапии, включающей иАПФ, у больных с ХСН уменьшает частоту смерти и госпитализации. Число больных, которых следует лечить 1 год, чтобы предотвратить одну смерть, равно 21» [6].
- Беленков Ю. Н. Мареев В. Ю. Агеев Ф. Т. Эпидемиологические исследования сердечной недостаточности: состояние вопроса // Cons medicum. 2002, № 3, с. 112–114.
- Swedberg K. Hjalmarson A. et al. Prolongation of survival in congestive cardiomyopathy during treatment with beta-blocer // Lancet. 1; 1374–1376.
- CIBIS Investigators. A randomized trial of beta-blocade in heart failure. The Cardiac Insufficiensy Bisoprolol Study (CIBIS) // Circulation. 1994; 90: 1765–1773.
- CIBIS-II Investigators and Committees. The Cardiac InsufficiensyBisoprolol Study II (CIBIS-II): a randomized trial. 1999; 353: 9–13.
- Willenheimer R. van Veldhuisen D. J. Silke B. et al. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol by enalapril, as compared with the opposite sequence // Circulation. 2005; 112: 2426–2435.
- Lechat P. Parker M. Chalon S. et al. Clinicaleffects of beta-adrenergic blokad in chronic heart failure: a meta-analysis of double, placebo-controlled trials // Circulation. 1998, vol. 98, p. 1184–1199.
В. И. Маколкин, доктор медицинских наук, профессор, член-корреспондент РАМН
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития РФ, Москва
Контактная информация об авторах для переписки: [email protected]