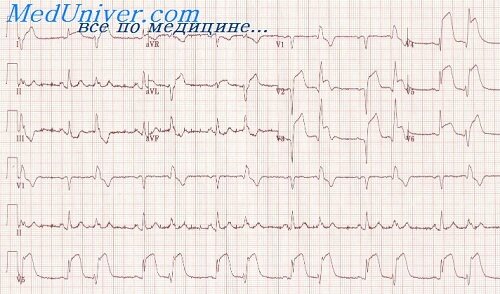
Виды инфаркта миокарда. Продромальные симптомы инфаркта миокарда.
Выделяют следующие инфаркты миокарда.
• повторный — возникает через 2 месяца (через 28 дней по МКБ-10) чаще в зоне предшествующего инфаркта (там, где были отдельные жизнеспособные участки среди зон некроза), но не во всех случаях. Возможны разнообразные и атипичные изменения ЭКГ (например, «освежение старого ИМ» или уменьшение его проявлений). Этому ИМ свойственны более тяжелое течение и частое формирование ХСН;
• рецидивирующий — появляется в пределах текущего ИМ (в первые 2 месяца). Формируются новые очаги некроза в период госпитальной фазы, когда в первичных очагах процесс еще не полностью завершился. Например, у больного на 15-й день ИМ повторно возник выраженный приступ болей в сердце, появились ЭКГ-признаки поражения той же локализации. С точки зрения клинической картины, этот ИМ чаще бывает атипичным (боль выражена слабо), но в ряде случаев возможно развитие ОЛЖН или КШ;
• продолженный — в плане прогноза самый плохой. Например, у больного имеется болевой синдром и изменения ЭКГ в задней стенке ЛЖ. Через некоторое время появляется поражение и боковой стенки ЛЖ (добавилась другая локализация ИМ).
Клиническая картина инфаркта миокарда зависит от состояния больного, наличия предшествующего ИМ, его размера, стадии и осложнений, а также проводимого лечения. До 30% случаев ИМ остаются нераспознанными из-за отсутствия типичной клинической картины (чаще у больных СД, АГ и пожилых).
Продромальные симптомыинфаркта миокарда.
В 60% случаев инфаркт миокарда не начинается внезапно. Ему предшествует болевой синдром, укладывающийся в клиническую картину НСт. Появляется дискомфорт в грудной клетке (сжатие, давление, чувство тяжести), похожий на «классическую Ст», но возникающий в покое и при меньшей ФН. Дополнительно выявляются общая слабость, изнеможение. Но нередко все это не побуждает больного обратиться к доктору. Так, у трети больных с предшествующими продромальными симптомами НСт они ощущались в течение 1—4 недель до госпитализации, а у оставшихся 2/3 больных — в течение последней недели перед доставкой в больницу; симптоматика в течение последних 24 ч имелась у 20% всех больных.
В основе этого феномена лежит нарастание сужения коронарной артерии и последующего снижения кровотока в ней вследствие постепенного разрыва атеросклеротической бляшки. У больного появляются Ст покоя на фоне имевшейся ранее Ст напряжения либо впервые выявленная Ст, нарушение стереотипа ангинозных болей (они усиливаются, изменяется их характер и локализация, слабее начинают действовать нитраты) и снижение ТФН. Иногда в этот период могут появиться аритмии (приступы СПТ, ФП), желудочный дискомфорт или усиление проявлений ХСН. На ЭКГ в этот период у 70% больных выявляют преходящую ишемию (депрессия сегмента ST, высокие остроконечные или отрицательные зубцы Т), но у 30% больных изменений ЭКГ не отмечается.
Наличие в анамнезе у больного ХСН, АГ, СД или ранее перенесенного инфаркта миокарда. а также комбинации этих факторов резко ухудшают течение ИМ и его исход.
В 20% случаев (особенно у молодых людей) инфаркт миокарда развивается без предшествующих продромальных симптомов (обычно в виде Ст). Как правило, в этих случаях ИМ протекает тяжелее, чем если бы ему предшествовала Ст (тогда бы происходило развитие коллатералей и миокард адаптировался бы к гипоксии).
Оглавление темы «Инфаркт миокарда.»:
Инфаркт
Инфаркт — очаг некроза, развившегося вследствие нарушения кровообращения. Инфаркт называют также циркуляторным, или ангиогенным некрозом.
Термин "инфаркт" (от лат. нафаршировать) был предложен Вирховым для формы некроза, при которой омертвевший участок ткани пропитывается кровью.
Размеры и морфологические особенности инфаркта определяются калибром обтурированного сосуда, наличием других нарушений кровообращения, на фоне которых он развивается. При магистральном типе ветвления артерии инфаркт по своим очертаниям напоминает конус, узкая часть которого (вершина) обращена к воротам органа, а основание ориентировано на периферию, к зоне терминального разветвления внутриорганных артерий. Инфаркты такой формы обычно выявляют в селезенке, почке, легких.
В органах с преобладанием рассеянного типа ветвления артерии, например в головном мозгу, кишечнике, сердце, кровоснабжае мая ею территория не образует конусовидных контуров и инфаркты не имеют определенной формы.
Виды инфаркта
Зона инфаркта может занимать весь орган или большую его часть (тотальный и субтотальный инфаркт) или выявляться только под микроскопом (микроинфаркт). По макроскопическим признакам различают 3 вида инфаркта: белый, белый с геморрагическим венчиком и красный.
Белый (ишемический) инфаркт формируется при непроходимости магистрального артериального ствола и запустевании всего сосудистого русла в его бассейне вследствие недостаточного развития сосудистых анастомозов и коллатералей.
Чаще всего выявляют в селезенке, иногда в головном мозгу, печени. Зона некроза хорошо видна при макроскопическом обследовании примерно через 24 ч после нарушения кровоснабжения. Под микроскопом ткань уплотнена, бледно-желтой окраски, структура ткани неразличима, а образующие ее элементы сливаются в гомогенную массу. По периферии зона инфаркта ограничивается воспалительным демаркационным валом.
Белый инфаркт с геморрагическим венчиком выглядит как участок белесовато-желтого цвета, окруженный темно-красной зоной кровоизлияний. Такой инфаркт развивается в случаях, когда компенсаторному включению коллатералей и реактивной артериальной гиперемии сосудов периферической зоны предшествует ангиоспазм, сменяющийся паралитическим расширением. В результате резкое полнокровие сосудов сопровождается явлениями стаза крови и диапедезными кровоизлияниями в некротизированную ткань. Белый инфаркт с геморрагическим венчиком развивается в сердце, селезенке, иногда в почках.
Красный (геморрагический) инфаркт обычно выявляют в легких, что связано с особенностями их кровоснабжения. Иногда геморрагический инфаркт возникает на фоне выраженной гиперемии и в других органах: кишечнике, головном мозгу, почках. При красном инфаркте зона ишемии пропитывается кровью, при обретает темно-красный цвет и четкие границы. Этот эффект возникает, если вслед за закупоркой артерии периферические сосуды омертвевшей ткани переполняются кровью, поступившей по коллатералям. При венозном застое ретроградное поступление кро ви из вен в зону ишемии также ведет к пропитыванию некротизированной ткани кровью.
Геморрагический инфаркт может развиваться также в результате выраженного венозного застоя при быстром прекращении оттока крови по крупным венозным стволам или одновременном выключении из кровотока большого количества мелких вен.
Венозные застойные инфаркты выявляют в селезенке при тромбозе вены, отводящей от нее кровь, в головном мозгу — при нарушении проходимости синусов твердой мозговой оболочки или яремных вен, в сердце — при обтурации венечного синуса тромботическими массами, в тканях нижних конечностей — при перевязке бедренной вены. Микроскопически в очаге геморрагического инфаркта отмечают массы гемолизированных эритроцитов, инфильтрирующих некротизированную ткань.
Общие закономерности формирования и заживления инфаркта
Стадия ишемии и некроза.
Развитию инфаркта предшествует ишемия. Первые сдвиги, обусловленные нарушением кровоснабжения, определяются угнетением тканевого дыхания, компенсаторной активацией анаэробного гликолиза, быстрым накоплением метаболитов в клетках в токсических концентрациях. Недостаточное воспроизводство энергии и гистотоксический эффект ишемии нарушают электролитный гомеостаз клеток и подавляют пластические процессы, что приводит к прогрессирующей диссоциации цитомембран, закислению внутриклеточной среды, денатурации белков, гибели и разру шению клеток.
Электронно-микроскопически при ишемизации выявляют внутриклеточный отек или, напротив, дегидратацию цитоплазматического матрикса. Органеллы клеток набухают, их мембраны подвергаются гомогенизации и фрагментации, гранулы лабильного гликогена исчезают, отмечают накопление липидов в виде капель вследствие их высвобождения из диссоциирующих фосфолипидов цитомембран и нарушения липидного обмена. В лизосомах накапливаются продукты внутриклеточного распада. Происходят перераспределение, конденсация либо вымывание ядерного хроматина и разрушение ядрышек, расплавление цитоплазматических рибосом и органелл немембранной структуры.
Гистохимически и биохимически в ишемизированной ткани определяется снижение уровня макроэргических фосфатов, активности окислительно-восстановительных ферментов, накопление недоокисленных метаболитов, нарушение обмена электролитов, уменьшение содержания гликогена, РНК и ДНК, а со временем — накопление продуктов распада стромальных структур. На некротической стадии инфаркта при микроскопическом исследовании ядра клеток не окрашиваются, все структурные элементы ткани сливаются в однородную массу.
Стадия репаративных изменений наступает вслед за формированием некроза. По периферии инфаркта всегда существует зона дистрофических изменений и реактивного воспаления — так называемый демаркационный вал.
Микроскопически воспалительная реакция отмечается уже через несколько часов, а максимум ее развития приходится на 3-и–5-е сутки. Воспаление в зоне демаркационного вала сопровождается выходом форменных элементов крови из капилляров. Некротические массы постепенно частично расплавляются под действием протеолитических ферментов, выходящих из нейтрофильных лейкоцитов, частично подвергаются фагоцитозу или резорбируются лимфатической сетью и выводятся по ее сосудам.
Организация зоны некроза — замещение некротических масс соединительной тканью, которая врастает со стороны демаркационного вала и к 7–10-м суткам трансформируется в грануляционную (юную) соединительную ткань, а со временем созревает в рубцовую.
Особенности развития инфаркта в различных органах
Морфология инфаркта во многом зависит от органной архитектоники сосудистой системы.
В клинической практике наиболее часто отмечают инфаркт сердца (миокарда), головного мозга, кишечника, легких, почек и селезенки. Время, необходимое для развития инфаркта в различных органах, неодинаково и зависит от функциональных энергозатрат и филогенетически сложившегося метаболизма, что определяет потребность ткани в обеспечении кислородом.
Для развития ИМ достаточно полного прекращения его кровоснабжения на 20–25 мин, однако ишемия длительностью 5 мин уже ведет к гибели отдельных мышечных клеток. В реальной жизни формирование инфаркта сердечной мышцы требует нес колько большего промежутка времени, так как в зоне ишемии всегда частично сохраняется кровоток по сосудистым анастомозам и коллатералям. Он недостаточен для того, чтобы полностью предотвратить некроз, но несколько увеличивает срок его развития и ограничивает размеры.
Инфаркт обычно локализуется в ЛЖ, чаще всего в передней стенке. По типу это белый инфаркт с геморрагическим венчиком, имеющий неправильную форму. В зависимости от объема и локализации пораженной ткани миокарда различают мелко- и крупноочаговый, субэпикардиальный, интрамуральный, субэндокардиальный и трансмуральный ИМ, охватывающий все слои сердечной стенки.
В зоне перехода инфаркта на эпикард или эндокард развивается реактивное вос паление, в первом случае приводящее к фиброзному перикардиту (выпот в полость перикарда плазмы крови, обогащенной фибрином, и образование фиб ринозных наслоений на эпикарде), во втором — к тромбоэндо-кардиту (пристеноч ный тромбоз соответственно зоне инфаркта).
Формирование ИМ начинается с ишемической стадии. Наряду с прогрессирующим нарушением метаболизма и дезинтеграцией клеточных мембран отмечают фрагментацию, растяжение и дезинтеграцию миофибрилл кардиомиоцитов.
В результате снижается активность внутриклеточных энзимов, изменяется характер окрашивания клеток при использовании основных или кислотных гистологических красителей, нарушается способность клеток к лучепреломлению в поляризованном свете и люминесцентно-микроскопические свойства. Эти явления используются для ранней диагностики метаболических и ишемических повреждений сердца.
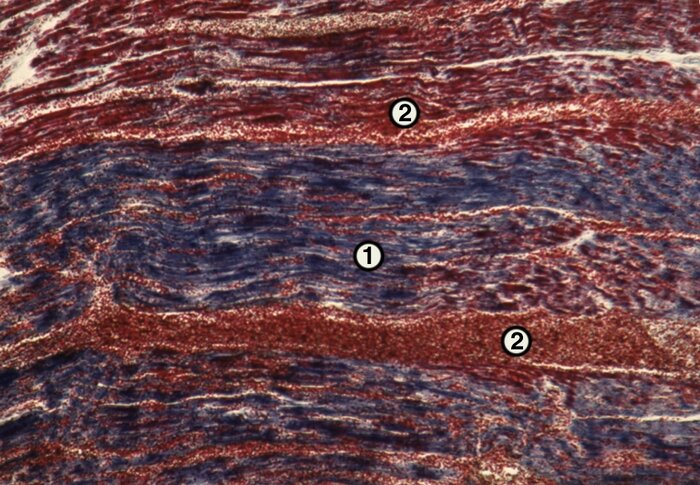
Гистологические признаки гибели клеток — сморщивание, набухание и разрушение клеточного ядра, исчезновение продольной и поперечной исчерченности, гомогенизирование саркоплазмы выявляют через 12 ч (рис. 2.1).
Рис. 2.1. Острый ИМ
Параллельно с деструктивными изменениями рабочих клеток миокарда происходит сосудистотканевая реакция, характеризующаяся спазмированием и паретической дилатацией интрамуральных артерий и артериол, плазматическим пропитыванием и повышением проницаемости их стенок, а также нарушением микроциркуляции с внутрисосудистой агрегацией эритроцитов, отеком интерстиция.
При развитии некроза кровоток в некротической зоне прекращается, а в периинфарктной увеличивается.
Наряду с диапедезными кровоизлияниями в ней происходит экстравазация лейкоцитов и формируется лейкоцитарный вал. В толще некротической зоны вокруг сохранившихся сосудов иногда выявляют островки жизнеспособной ткани, по периферии которых отмечают такие же явления, как и в окружающей инфаркт зоне.
В течение первых 18–24 ч от начала патологического процесса миокард в бассейне пораженной артерии отличается бледностью на фоне подчеркнуто неравномерного кровенаполнения остальной ткани.
В конце 1-х суток участок некроза становится различимым макроскопически. В связи с непрерывной деятельностью сердца, высокой активностью ферментов, выделяющихся из лейкоцитов, на 3-и–5-е сутки начинается размягчение (миомаляция) погибшей ткани. Постепенное рассасывание (резорбция) некротизированной массы осуществляется при активном участии микрофагальных клеток, которые появляются на 4-й день кнаружи от лейкоцитарного вала.
Фибропластическая реакция интерстиция также возникает на 4–5-е сутки, а первые волокнистые элементы новообразованной соединительной ткани в зоне инфаркта появляются еще через 3 сут. В течение последующей недели зона некроза представлена распадающимися мышечными волокнами, пропитана отечной жидкостью и инфильтрирована распадающимися лейкоцитами. По ее периферии и вокруг периваскулярных островков сохранившегося миокарда происходит новообразование соединительной ткани.
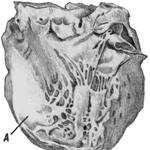
Процесс организации продолжается 2–2,5 мес. В дальнейшем соединительная ткань, образовавшаяся на месте некротических масс, уплотняется, ее сосуды запустевают и облитерируются, на мес те некроза образуется рубец (рис. 2.2).
Рис. 2.2. Постинфарктный кардиосклероз Проводящая система сердца более устойчива к гипоксии по сравнению с рабочим миокардом и способна дольше сохраняться в зонах ишемии, что важно для восстановления ритмичной работы сердца после экстренной инвазивной антиишемической терапии.
В почках обычно развивается белый инфаркт с геморрагическим венчиком.
Вследствие хорошего развития сосудистых анастомозов и коллатералей инфаркт возникает только при нарушениях проходимости сосудов больше го калибра, чем дольковая артерия. Характерное расположение инфаркта — передняя латеральная поверхность органа, так как в этой зоне почечные артерии ветвятся не по магистральному, а по рассеянному типу, при котором межсосудистые коллатерали выражены значительно слабее. Обычно инфаркт почки напоминает по форме конус, обращенный основанием к капсуле, верхушкой к почечной лоханке. Однако иногда процесс ограничивается только корой, не затрагивая пирамидки, и поражение приближается по форме к квадрату.
Инфаркт почки часто сопровождается гематурией вследствие попадания крови в мочевые канальцы при разрыве мелких сосудов. Ишемическая стадия инфаркта почек развивается по общим закономерностям.
Некроз всех структур почечной паренхимы наступает через 24 ч, однако повреждение эпителия почечных канальцев возникает значительно раньше. Так, уже через 6 ч отмечается гибель эпителия извитых, а через 12 ч — прямых канальцев нефрона. К этому же времени по периферии инфаркта развивается реактивное воспаление, достигающее своего максимума примерно к 3-му дню процесса.
Формирование демаркационной зоны сопровождается нарушениями кровотока в микрососудах, явления ми отека, плазморрагиями и диапедезными кровоизлияния ми, активной миграцией лейкоцитов. Это приводит спустя сутки к образованию периферической геморрагической зоны инфаркта и лейкоцитарного вала.
Примерно с этого же времени появляются макрофаги и начинается процесс резорбции некротических масс. На 7-е сутки деструктивнорезорбтивные процессы сочетаются с отчетливо выраженными явлениями организации, которая через несколько недель завершается образова- нием плот ного со едини тельно тканного рубца, реже — кисты.
В селезенке обычный морфологический тип инфаркта — белый (ишемический). В условиях выражен ного венозного застоя инфаркт селезенки может быть геморрагическим, приобретающим в течение нескольких суток серую или белую окраску.
Ишемический инфаркт селезенки конической формы, бледно-желтой окраски. На поверхности капсулы органа в области широкой части этого конуса, а также на границе зоны инфаркта развиваются реактивное воспаление, процессы лизиса, резорбции и организации некротических масс. Непосредственно в зоне некроза вначале разрушается красная пульпа, затем фолликулы и трабекулы. Организация инфаркта осуществляется по общим закономерностям. Созревание постинфарктного рубца сопровождается де формированием селезенки.
Инфаркт головного мозга в 85–90% случаев является белым, в остальных — красным или смешанного характера. Белый инфаркт может поражать любые отделы мозга. Первоначально это нечетко отграниченный участок дряблой или крошащейся консистенции, красновато-серого цвета, со стертым естествен ным рисунком базальных узлов или коры головного мозга. Геморрагические инфаркты в виде небольших очагов красного цвета локализуются преимущественно в пределах скоплений серого вещества, чаще всего в коре. Смешанные инфаркты состоят из белых и красных участков, причем последние располагаются в сером веществе.
Топография различных морфологических типов инфарктов мозга предопределена особенностями кровоснабжения его различных областей. Наиболее часто они возни кают в бассейне средней мозговой артерии, реже — позвоночных и базиллярных артерий. Геморрагические инфаркты формируются в хорошо васкуляризированных зонах — скоплениях серого вещества или в коре головного мозга.
Развитие инфаркта головного мозга включает ишемическую и некротическую стадии.
Ишемическая стадия характеризуется дистрофическими изменениями нервной ткани, кровоизлияниями и деструкцией клеточных мембран с необратимой дезорганизацией обменных процессов и электролитного гомеостаза нервных клеток. При микроскопическом исследовании отмечают лизис глыбок базофильного вещества, просветление цитоплазмы, гиперхроматоз и деформацию ядра. В результате нервные клетки и их ядра приобретают угловатую форму, а цитоплазма гомогенизируется, утрачивает базофильные включения и просветляется.
Нарушение циркуляции крови в микрососудах сочетается с перицеллюлярным отеком — появлением светлого промежутка между капиллярной стенкой или телом нейрона и окружающей тканью. Вокруг капилляров отмечают отек и набухание отростков окружающих их глиальных клеток.
Некротическая стадия инфаркта — стадия нарастающего аутолиза ишемизированной ткани мозга. Гибели нейронов предшествует их резкое просветление либо уплотнение и превращение в пикноморфные (уплотненные дегидратированные) клетки, а затем и в гомогенную бесструктурную массу. Вместе с нейроцитами в деструктивные изменения вовлекаются и клетки глии. Из мелких сосудов происходят диапедезные кровоизлияния, небольшие и единичные в очагах белого инфаркта, множественные и сливающиеся между собой при геморрагическом инфаркте.
К началу 2-х суток начинается резорбция некротизированной нервной ткани. На границе с очагом ишемического поражения скапливаются лейкоциты. Вместе с ними в зону некроза внедряются многочисленные активированные астроциты и появляются зернистые шары с липидными включениями. Часть астроцитов утрачивает цитоплазматические отростки, в их цитоплазме выявляют многочисленные фибриллы, приобретающие способность к образованию волокнистых структур. Вокруг очага некроза начинается новообразование сосудов, капилляров и сосудистых петель.
В организации некротических масс участвуют как глиальные, так и соединительнотканные клетки — фибробласты. Однако в конечной стадии процесса при небольших размерах инфаркта продукты мезодермальной пролиферации полностью вытесняются глиоволокнистыми структурами, образующими рубец. В крупных очагах срединная зона организовавшегося инфаркта остается соединительнотканной, а в центре сформировавшегося рубца образуется одна или несколько полостей, снаружи окруженных разрастаниями глии.
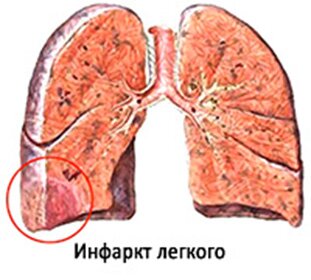
Инфаркт легких. как правило, имеет геморрагический характер, причиной чего являются двойное кровоснабжение легких и венозный застой.
Кровь попадает в легкие как по бронхиальным артериям, входящим в систему большого круга кровообращения, так и по артериям малого круга кровообращения. Между ЛА и бронхиальными артериями существуют многочисленные анастомозы, которые имеют строение артерий замыкающего типа и в обычных условиях не функционируют.
При обтурации достаточно крупной ветви ЛА в ее бассейн под большим давлением устремляется кровь из бронхиальных артерий по рефлекторно открывшимся анастомозам. Переполняющиеся кровью легочные капилляры резко дилатируются, их стенки разрываются, кровьизливается в интерстиций альвеолярных перегородок и в полости альвеол, имбибируя соответствующий учас ток ткани. Благодаря автономному артериальному кровоснабжению бронхи в зоне инфаркта сохраняют жизнеспособность. Нередко геморрагический инфаркт в легком развивается на фоне хронической венозной гиперемии, так как повышение давления в крупных венах способствует ретроградному поступлению крови в зону инфаркта.
Инфаркт чаще всего развивается в периферических зонах средних и мелких отделов легких. При этом макроскопически выявляют очаги более плотной консистенции, чем окружающая ткань, конусовидной формы, основанием обращенные к плевре, которая покрывается фибринозным налетом и гиперемируется вследствие реактивного воспаления. На разрезе некротизированная ткань темно-красного цвета, слегка зернистая, выбухает над поверхностью.
В 1-е сутки в зоне инфаркта микроскопически определяются отек и кровоизлияния в виде скоплений частично гемолизированных эритроцитов в интерстициальной ткани, в просветах альвеол и мелких бронхов, что сопровождается кровохар каньем. Затем присоеди няются признаки некроза стенок альвеол, накапливаются сидерофаги.
На 3-и–4-е сутки инфаркт представляет собой гомогенизированную массу из разрушившихся эритроцитов, на фоне которых видны следы некротизированных альвеолярных перегородок. Расплавление некротизированной ткани и излившейся крови, их резорбция и организация начинаются с периферии и из сохранившихся периваскулярных и перибронхиальных зон. Через 2–8 мес на месте инфаркта остается рубец или киста.
Белый инфаркт в легком выявляют редко. Возникает при нарушении кровотока в бронхиальных артериях на фоне затруднения капиллярного кровотока, например вследствие сдавления внутриальвеолярным экссудатом или при уплотнении (гепатизации) легочной ткани, обусловленного пневмонией.
В кишечнике инфаркт развивается по типу геморрагического. Наиболее характерная локализация — бассейн верхней брыжеечной артерии, которая в связи с большой протяженностью чаще подвергается обструкции. Макроскопически инфаркт кишки имеет вид темно-красного участка, который достаточно ясно отграничен от непораженного кишечника. Серозная оболочка в области инфаркта кишки становится тусклой, на ней появляются фибринозные наложения. Стенка кишки утолщена, слизистая оболочка синюшная.
Некротические и реактивные изменения в ишемизированном сегменте кишечника развиваются быстро.
Через 15–20 мин после прекращения кровоснабжения в его стенке выявляют выраженные микроциркуляторные нарушения: тотальный отек ткани, замедление и прекращение движения крови в резко полнокровных капиллярах и венулах, множественные кровоизлияния.
Через 30 мин в отечной строме слизистой оболочки кишки появляются лейкоциты, лимфоциты, развивается макрофагальная реакция. В течение 1–1,5 ч стенка кишки подвергается некрозу, который начинается с изъязвления ее слизистой оболочки.
В сетчатке глаза инфаркт имеет характер белого, который в условиях венозного застоя трансформируется в геморрагический. Участок пораженной ткани в виде конуса обращен вершиной к зрительному диску, обычно локализуется в височном сегменте. Микроскопически выявляют деструкцию внутренних слоев сетчатки, ганглиозных клеток и нервных волокон на фоне нарушения микроциркуляции, отека и кровоизлияний. Очень редко отмечают инфаркты в печени, мышцах, костях.
Последствия инфаркта чрезвычайно существенны для организма.
Так, поражение при ИМ >30% ткани ЛЖ сопровождается развитием ОСН с остановкой сердца. Повреждение проводящей системы сердца при формировании некроза влечет тяжелые нарушения ритма. При обширном трансмуральном инфаркте иногда происходит взбухание некротизированного участка сердечной стенки и его истончение — развивается острая аневризма сердца.
В некоторых случаях десинхронизация процессов миомаляции, резорбции некротических масс и организации зоны инфаркта приводит к разрыву аневризмы, заполнению полости перикарда кровью с летальным исходом. В результате ИМ могут возникать разрывы межжелудочковой перегородки, отрыв папиллярных мышц, что также ведет к серьезным последствиям. В более отдаленные сроки обширная рубцовая зона, изменяя геометрию сокращения сердца и внутрисердечную гемодинамику, способствует развитию ХСН и общей венозной гиперемии.
Инфаркт головного мозга сопровождается его отеком, расстройством микроциркуляции и метаболическими нарушениями как в непосредственной близости от очага поражения, так и в отдаленных участках. Исход инфаркта определяется его размерами, локализацией и темпами развития патологического процесса.
Смерть таких больных может быть обусловлена как самим очагом поражения в головном мозгу, так и причинами, непосредственно с ним не связанными. Нередко при медленном формировании инфаркта больные погибают не от деструктивных изменений, затрагивающих жизненно важные центры головного мозга, а вследствие СН, пневмонии и другой присоединившейся патологии, осложнившей течение инфаркта.
Серьезным осложнением инфаркта головного мозга является кровоизлияние в размягченную ткань. Как и отек мозга, так и увеличение его объема вследствие восстановления кровотока по сосудам в зоне ишемии могут вызывать дислокацию и ущемление ствола мозга. При благоприятном исходе на месте инфаркта формируется рубец или киста с более или менее значительными нарушениями функции ЦНС.
Инфаркт кишечника требует обязательного хирургического вмешательства, так как конечной фазой его развития является гангрена с прободением кишечной стенки. Попадание содержимого кишечника в брюшную полость влечет за собой развитие перитонита. Причиной перитонита может стать также инфаркт селезенки, обычно заканчивающийся формированием грубого рубца, деформирующего орган.
Инфаркт легкого обычно не несет непосредственной угрозы жизни больному. Однако его течение может осложниться пост инфарктной пневмонией, нагноением и распространением воспалительного процесса на плевру с развитием пневмоторакса и гангрены легкого. Одной из наиболее характерных причин нагноения инфаркта является попадание в сосуд гнойного эмбола. Это вызывает гнойное расплавление ткани легкого и образование абсцесса на месте инфаркта.
При инфаркте почек. обычно заживающем посредством рубцевания соответствующего участка, угрожающие жизни осложнения возникают при нагноении либо при обширных поражениях, особенно при симметричных некрозах коркового слоя, следствием которых может быть ОПН.
Инфаркт миокарда. Виды, причины и лечение инфаркта миокарда. Кардиогенный шок.
ИНФАРКТ МИОКАРДА.
Инфаркт Миокарда (ИМ ) — это очаговый некроз (омертвение) сердечной мышцы (миокарда), обусловленный более или менее длительным прекращением доступа крови к миокарду.
В основе этого процесса лежит нарушение проходимости одной из коронарных (венечных) артерий сердца, пораженных атеросклерозом, которая приводит к коронарной недостаточности сердца. Атеросклероз — это длительный процесс, который постепенно ведет к сужению сосудов, замедлению тока крови.
Инфаркт — самое тяжелое проявление ишемической болезни сердца.
Нарушение проходимости коронарных артерий может произойти в результате закупорки артерии тромбом или из-за резкого его сужения — спазма.
Чаще всего в происхождении Инфаркта миокарда одновременно участвуют оба этих фактора.
Возникший в результате нервных влияний (переутомление, волнение, психическая травма и пр) длительный и сильный спазм коронарной артерии, замедлению тока крови в нем и образованию вследствие этого тромба.
В механизме возникновения инфаркта большое значение имеет нарушение процесса свертывания крови: увеличение в крови протромбина и других веществ, повышаюших свертывание крови, что и создает условия для образования тромба в артерии.
При инфарктах миокарда, в благоприятных случаях после расплавления омертвевшей ткани происходит ее рассасывание и замена молодой соединительной тканью (рубцевание). Прочный рубец формируется в течение 1,5 — 6 месяцев.
Реже, при неблагоприятном, тяжелом течении инфаркта, когда сердечная мышца подверглась омертвению на большую глубину, она резко истончается, и под влиянием внутрисердечного давления в этом месте образуется выбухание участка сердечной мышцы — аневризма сердца. На этом месте может произойти разрыв, что может привести к немедленной смерти, но это происходит довольно редко.
- Тромбоз, тромбоэмболия +атеросклероз.
- А т еросклероз + нервно-психическое напряжение, физическая нагрузка.
- Стресс.
В результате стресса происходит выброс катехоламинов, которые усиливают и учащают сердечные сокращения, вызывающих сужение сосудов, в результате возникает хроническая гипоксия тканей и органов.
- Курение.
- Злоупотребление алкоголем.
Инфаркт чаще возникает у мужчин в возрасте 40-60 лет, а иногда и у более молодых. Заболевают чаще лица ведущие малоподвижный образ жизни, склонные к атеросклерозу, гипертонической болезни, ожирению, диабету и другим нарушениям обмена веществ. Около половины случаев инфаркт миокарда возникает на фоне стенокардии, и наоборот — у многих больных стенокардия наступает после перенесенного инфаркта.
Виды инфарктов миокарда.
Наиболее часто развиваются инфаркты в передней стенке левого желудочка, задней стенке левого желудочка, межжелудочковой перегородке и боковой стенке левого желудочка. Инфаркты правого желудочка встречаются очень редко.
По локализация очага некроза :
1. Инфаркт миокарда левого желудка (передний, боковой, нижний, задний),
2. Изолированный инфаркт миокарда верхушки сердца,
3. Инфаркт миокарда межжелудочковой перегородки,