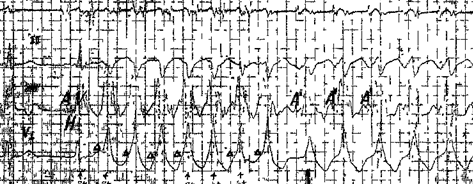
Тахикардии при синдроме WPW
Врожденные ДП предрасполагают к возникновению пароксизмальных тахикардий. Например, у половины больных с пучком Кента регистрируются тахикардии, среди которых встречаются следующие:
= Ортодромная АВ реципрокная тахикардия 70–80%.
= Фибрилляция предсердий 10–38%.
= Трепетание предсердий 5%.
= Антидромная АВ реципрокная и предвозбужденная тахикардии 4–5%.
Прогноз при большинстве тахикардий благоприятен, а частота внезапной смерти составляет около 0,1% (Zardini M. et al. 1994).
В 20% случаев ортодромная АВ реципрокная тахикардия сочетается с пароксизмальной ФП.
Проведение импульсов от предсердий к желудочкам при синусовом ритме и реципрокных тахикардиях изображено на рисунке 96. Заметим, что наличие признаков ДП не исключает возможности развития у этих пациентов и других видов тахикардии. Например, достаточно часто выявляется АВ узловая реципрокная тахикардия.
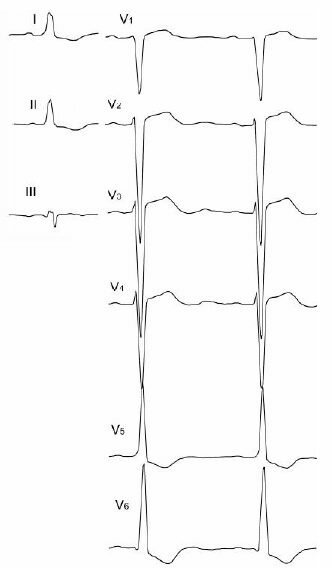
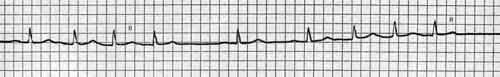
Рис. 94.
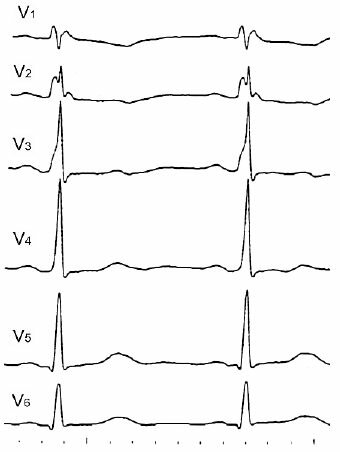
В отведениях I и V5регистрируется пологий подъем зубца R
, похожий на дельта–волну. Пациент со вторичным инфекционным эндокардитом на фоне недостаточности и стеноза аортального клапана и недостаточности митрального клапана.
АНТЕРОГРАДНОЕ ПРОВЕДЕНИЕ ВОЗБУЖДЕНИЯ ПО АВ-СОЕДИНЕНИЮ И АНОМАЛЬНЫМ ПУТЯМ У БОЛЬНЫХ С ПАРОКСИЗМАЛЬНОЙ РЕЦИПРОКНОЙ ОРТОДРОМНОЙ АВ ТАХИКАРДИЕЙ ПО ДАННЫМ ЧРЕСПИЩЕВОДНОЙ ПРОГРАММИРОВАННОЙ ЭЛЕКТРОКАРДИОСТИМУЛЯЦИИ
Аннотация
Определен характер антероградного проведения возбуждения по АВ-соединению и дополнительным проводящим путям у больных с синдромом WPW и ортодромной АВ тахикардией. Обсуждается влияние типов АВ-проведения и других электрофизиологических показателей на возможность инициации пароксизмов тахикардии и их устойчивость.

Пароксизмальные реципрокные атрио-вентрикулярные тахикардии составляют от 75 до 85% от всех пароксизмальных наджелудочковых тахикардий [4] и включают в себя пароксизмальную реципрокную атрио-вентрикулярную (АВ) узловую тахикардию ПРАВУТ) и пароксизмальную реципрокную АВ ортодромную тахикардию (ПРОАВТ) с участием дополнитель ных проводящих путей (ДПП).
Ортодромные тахикардии с узкими комплексами QRS возникаютв тех случаях, когда антероградное проведение возбуждения осуществляется через АВ-соединение, а ретроградное — либо по одному из каналов АВ-узла, либо по аномальным путям — при манифестирую щем, латентном или скрытом синдромах WPW [7]. При антидромных тахикардиях c широкими комплексами QRS антероградное проведение возбуждения осуществляется через ДПП, а ретроградное — по АВ-соединению или парасептальному ДПП. Аномалии, необходимые для возникновения реципрокных тахикардий, могут быть анатомическими, функциональными или сочетанными. Они создают электрофизиологические условия для возникновения реципрокных пароксизмальных тахикардий (ПТ) [2,3].
Успехи, достигнутые в последние годы в диагностике и лечении ПРАВТ обусловлены внедрением в практику инвазивных и неинвазивных методов электрофи зиологических исследований (ЭФИ). Раннее нами было показано [6], что c помощью неинвазивного метода чреспищеводного электрофизиологического исследования (ЧП ЭФИ) возможно изучение особенностей антероградного АВ-проведения возбуждения у больных с ПРАВУТ. Кривые АВ-проведения возбуждения, в большинстве случаев соответствовали кривым, выявленным с помощью инвазивного ЭФИ.
В задачу исследования входило изучение возможностей программированой чреспищеводной электрокар диостимуляции (ПЧП ЭКС) для определения особенностей антероградного проведения возбуждения по АВ-соединению и ДПП у пациентов с разной степенью устойчивости ПРОАВТ.
Материал и методы
Обследовано 274 больных в возрасте от 16 до 69 лет с различными заболеваниями сердечно-сосудистой системы, страдающих приступами ПРОАВТ. Первую группу составили 147 больных с манифестирующим синдромом WPW (WPWм) и ПРОАВТ. Среди них было 59 мужчин и 88 женщин, средний возраст которых составил 39,3±19,2 лет. ИБС в этой группе диагностиро вана у 12,9% пациентов, миокардитический кардиосклероз — у 15,6%, гипертоническая болезнь — у 8,8%, пролапс митрального клапана II-III степени — у 6,8%, ревматические пороки сердца у 3,4%, дистрофии миокарда различной этиологии — у 12,9%, вегетососудистая дистония — у 8,8%. У 21,8% больных помимо нарушений ритма сердца, обусловленных аномалиями ПСС, других заболеваний не было обнаружено.
Давность аритмического анамнеза колебалась от двух месяцев до 23 лет. Частота пароксизмов у больных этой группы составила в среднем 11,3±5,7 приступов в месяц, а их продолжительность — 9,2±2,7 часа.
Вторую группу составили 127 больных с ретрограднопроводящим (скрытым) синдромом WPW (WPWc) и ПРОАВТ. Среди них было 52 мужчины и 75 женщин, средний возраст составил 44,1±21,6 лет. ИБС в этой группе диагностирована у 10,2% больных, миокардити ческий кардиосклероз — у 15%, гипертоническая болезнь у 5,5%, пролапс митрального клапана II-III степени — у 16,5%, ревматические пороки сердца у 4,7%, дистрофии миокарда разного генеза — у 15%, вегето-сосудистая дистония — у 11% и у 13,4% больных нарушения ритма сердца были расценены как идиопатические.
Давность аритмического анамнеза колебалась от 4 месяцев до 19 лет. Частота пароксизмов у больных этой группы составила в среднем 9,8±6,4 приступов в месяц, а их продолжительность — 8,6±3,1 часа.
Представляется, что обследованные группы больных были достаточно представительными для проведения анализа электрофизиологических параметров проводящей системы сердца (ПСС). Всем больным проведено комплексное клиническое обследование, регистрировалась стандартная ЭКГ в 12 отведениях, а также проводилось суточное мониторирование ЭКГ (ДЭКГ) с использованием кардиомониторного комплекса «Кардиотехника-4000» (Инкарт, Ст-Петербург). Выполнялось также двухмерное ЭхоКГ исследование на аппарате CFM-750 фирмы Сонатрон (Германия).
ЧП ЭФИ проводили по стандартному протоколу [1,5] с использованием универсального электрокардио стимулятора «Кордэлектро-4» (Литва) и проводов-элек тродов ПЭДСП-2 (Каменец-Подольск, Украина). При этом определялся ряд электрофизиологических параметров: время восстановления функции синусового узла (ВВФСУ), коррегированное время восстановления функции СУ (КВВФСУ), точка Венкебаха (ТВ), эффективные рефрактерные периоды (ЭРП) АВ-соединения и ДПП, зона тахикардии (ЗТ).
По аналогии с результатами инвазивного ЭФИ [3] было выделено 4 типа кривых: 1 тип — непрерывные кривые АВ-проведения, характеризующиеся тем, что на кривой АВ-проведения возбуждения однократный прирост времени St2-R2 не превышал 20 мс при «шаге» тестирующего стимула в 10 мс. Данный тип кривой чаще отмечается у пациентов с «единственным» путем проведения через АВ-соединение, но в ряде случаев, может регистрироваться и у больных при наличии двух проводящих путей. 2 тип — прерывистые кривые АВ-проведе ния возбуждения, характеризующиеся тем, что уменьшение интервала сцепления тестирующего стимула на 10 мс приводит к «скачкообразному» увеличению St2-R2 на 80-160 мс. Данный тип кривой чаще отмечается у пациентов с двумя и более АВ проводящими путями (диссоциация АВ-узла на альфа- и бета-каналы). 3 и 4 типы, по сути, являются вариантами непрерывного и прерывистого типов АВ- проведения возбуждения при наличии феномена Gap [3].
Результаты и их обсуждение
В группе больных с ПРОАВТ и синдромом WPW(м) преобладали непрерывные типы кривых (95%). Преобладание непрерывных кривых антероградного проведения возбуждения можно объяснить своеобраз ным механизмом возникновения ПРОАВТ. Этот вариант ПРАВТ обусловлен круговым движением импульса, при котором антероградным звеном re-entry является АВ-соединение, а ретроградным — ДПП.
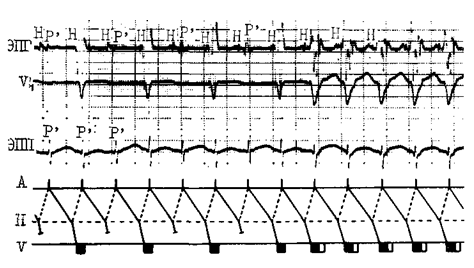
У пациентов с WPW(м) при синусовом ритме (СР) антероградное проведение возбуждения на желудочки осуществляется одновременно через АВ-соединение и ДПП, то есть комплекс QRS является «сливным». Проведение возбуждения по ДПП при синдроме WPW отличается от проведения по АВ-узлу, поскольку, как правило, подчинено закону «все или ничего», который означает, что импульс либо проводится по аномальному пути, либо блокируется. Особенности проведения по ДПП представлены на рис. 1.
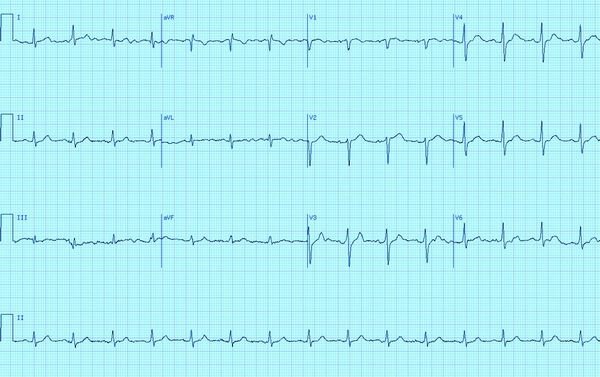
Больная Р. 19 лет. С детства регистрировались изменения на ЭКГ в виде WPWм. Один-два раза в год отмечала короткие приступы сердцебиения, проходившие самостоятельно. Последнее время отметила учащение и удлинение пароксизмов тахикардии. На стандартной ЭКГ — СР с ЧСС=86 уд/мин. PQ — 80 мс. за счет дельта-волны, QRS = 130 мс. (а). При проведении учащающей стимуляции (St1 -St1 = 410 мс) отмечалась внезапная «нормализация» комплекса QRS за счет блокады дельта-волны. При увеличении частоты стимуляции регистрировалось прогрессивное замедление проведения по АВ-соединению (б). Изменения проведения по ДПП в данном случае объясняются тем, что частые предсердные импульсы проводились без задержки в ДПП (не менялась величина интервала ST-дельта-волна) до критической частоты; при дальнейшем увеличении частоты стимуляции происходило блокирова ние проведения по ДПП, в результате чего импульс распространялся по «нормальному» АВ-соединению.
В ряде случаев было отмечено наличие декрементного проведения в ДПП (увеличение интервала Р — дельта волна), как результат программированной и учащающей ЧП ЭКС. Один из этих случаев представлен на рис. 2
#image.jpg
Больная Г. 30 лет. Около 10 лет назад во время профосмотра был выявлен феномен WPW. Приступы сердцебиения не беспокоили. В возрасте 25 лет во время родов возник пароксизм тахикардии, купированный в/в введением новокаинамида. В дальнейшем приступы сердцебиения возникали редко, но имели затяжной характер, купировались в/в введением новокаинамида. Последний год отмечала учащение приступов сердцебиения, ААП не принимала. На серии ДЭКГ регистрировался синдром WPW(м), частая монотопная предсердная экстрасистолия. ЭКГ: СЦ — 800 мс, дельта-волна (+), PQ — 90 мс, QRS — 130 мс (а). ЧП ЭФИ: ВВФСУ — 1150 мс, КВВФСУ — 350 мс. При проведении ПЧП ЭКС с интервалами сцепления от 500 до 420 мс регистрировалась постоянная величина St-дельта-волна (б). При интервалах сцепления от 410 до 290 мс. отмечалось прогрессивное увеличение интервала St-дельта-волна (в,г). При интервале сцепления 280 мс было зарегистрировано полное исчезновение дельта-волны и инициация ПРОАВТ (д). RRтах. — 310 мс, RP'- 120 мс. ЗТ — 50 мс, ТВ -194 уд/мин.
В данном случае регистрировалось антероградное замедление проведения по ДПП (St-дельта-волна) при проведении ПЧП ЭКС. Данный феномен сохранялся и при проведении контрольного ЧП ЭФИ, что ставит под сомнение внутрипредсердную задержку проведения между зоной стимуляции и ДПП, как причину дискретного проведения. Вероятнее всего в приведенном случае аномальный путь имел электрофизиологические свойства АВ-узла («добавочный» АВ-узел). О возможности строения ДПП, как добавочного АВ-узла упоминает ряд авторов [8,9]. В этих случаях нельзя исключить возможности диссоциации подобного «АВ-узла» на два канала.
Достаточно редко в ДПП наблюдается блокада II степени типа Самойлова-Венкебаха в ответ на стимуляцию. На рис. 3 представлен такой вариант возникнове ния блокады в ДПП: проведение ЧП ЭКС с постоянной частотой (570 мс) привело к тому, что один стимул проводится по ДПП и АВ-соединению, а следующий за ним стимул — только по АВ-соединению.
#image.jpg
Инициация ПРОАВТ у пациентов с WPW(м) возможна лишь при соблюдении ряда условий [4,7]:
а) антероградный ЭРП ДПП должен превышать ЭРП АВ-соединения;
б) ретроградный ЭРП ДПП должен заканчиваться ко времени активации желудочков антероградно через АВ-соединение.
Последнее условие может быть соблюдено только в том случае, если предсердный преждевременный импульс, застав ДПП в состоянии рефрактерности, проводится антероградно по АВ-соединению и желудочкам достаточно медленно, чтобы в ДПП восстановилось проведение возбуждения.
Это замедление не является истинным разрывом АВ-проведения, тем не менее, от длительности проведения по АВ-соединению зависит возможность инициации ПРОАВТ. То есть, для возникновения ПРОАВТ, также как и для ПРАВУТ, необходима блокада быстрого пути (ДПП) и определенная степень замедления проведения по АВ-соединению (медленный путь).
Проведенный анализ некоторых электрофизиоло гических параметров у пациентов с синдромом WPW и разной степенью устойчивости ПРОАВТ показал, что параметры, характеризующие функцию СУ (сердечный цикл, ВВФСУ и КВВФСУ) не изменялись, а следовательно, не оказывали существенного влияния на возникновение ПРОАВТ и степень ее устойчивости. Величина P-дельта-волна также не зависела от степени устойчивости ПРОАВТ.
Противоположные результаты получены при анализе значений ТВ. Чем выше была устойчивость ПРОАВТ, тем большими были значения ТВ, характеризую щей АВ-проведение возбуждения. То есть, при неустойчивой или неинициируемой пароксизмальной тахикардии АВ-проводимость была худшей, чем при устойчивой ПРОАВТ.
У больных с синдромом WPW(м) и устойчивой ПРОАВТ значения антероградного ЭРП ДПП составили в среднем 366,7±17,2 мс. у пациентов с неустойчивой ПРОАВТ — 331,1±19,3 мс, а если ПРОАВТ в период обследования не вызывалась, то средние значения ЭРП ДПП равнялись 314,1±13,8 мс. У больных с ПРОАВТ чаще удавалось определить ЭРП ДПП и АВ-соедине ния, чем у пациентов с феноменом WPW. Это объясняется тем, что для инициации ПРОАВТ должна быть определенная разница между значениями ЭРП ДПП и АВ-соединения.
В нашем исследовании разница между величинами ЭРП ДПП и ЭРП АВ-соединения у больных с устойчивой ПРОАВТ составила 110,3 мс, с неустойчивой — 53,9 мс и в тех случаях, когда вызвать пароксизм не удавалось — 24,6 мс. Именно поэтому у больных с ПРОАВТ при синдроме WPW(м) наблюдалась отрицательная корреляция степени устойчивости тахикардии и значений ЭРП АВ-соединения: чем меньше были значения ЭРП АВ-соединения, тем больше устойчивость пароксизмаль ной тахикардии.
Таким образом, у больных с устойчивой ПРОАВТ значения антероградного ЭРП ДПП были достоверно выше (р<0,05), а значения антероградного ЭРП АВ-соединения ниже, чем соответствующие величины при неустойчивой тахикардии и феномене WPW. Обращает на себя внимание и тот факт, что у больных с синдромом WPW и ПРОАВТ время проведения по АВ-соединению (St2-R2) определялось чаще, чем у пациентов с феноменом WPW, а главное, это время было достоверно больше, чем у пациентов с неустойчивой ПТ и феноменом WPW (р < 0,05).
Рис. 3. Развитие блокады II степени в ДПП (объяснения в тексте).
Этому возможно следующее объяснение: для инициации ПРОАВТ необходимо определенное антероград ное замедление проведения по АВ-соединению, чтобы ретроградный рефрактерный период ДПП смог закончиться ко времени антероградной активации желудочков через АВ-соединение.
По-видимому именно ретроградный рефрактерный период ДПП определяет возможность возникновения ортодромной тахикардии. В большинстве случаев, значения ретроградного ЭРП ДПП меньше антероградно го. Можно предположить, что при инициации ПРОАВТ должно соблюдаться условие, аналогичное тому, которое было установлено при возникновении ПРАВУТ: время проведения по медленному пути (АВ-соединение) должно превышать рефрактерный период блокирован ного быстрого пути (ДПП).
Следующим этапом работы было изучение изменений некоторых отнесенных показателей у пациентов с разной степенью устойчивости ПРОАВТ и WPW(м). Ранее нами была показана важность определения отнесенных показателей для оценки степени устойчивости ПРАВУТ [6]. Из данных, приведенных в табл. 1, следует, что чем меньше отношение St2 -R2 /ЭРП ДПП, тем меньше вероятность инициации тахикардии, а если ее удается вызвать, то как правило, она неустойчива.
Однако полученные различия отражали лишь тенденцию и были статистически недостоверны. Аналогичные, но более четко различающиеся данные были получены для отношения St2 -R2 /ЭРП АВ-соединения. Оказалось, что чем больше значения этого отношения, тем выше вероятность инициации устойчивой ПРОАВТ. Такая же тенденция оказалась характерной и для отношения ЭРП ДПП/ЭРП АВ-соединения.
Таблица 1.
Изменение некоторых отнесенных показателей у больных с разной степенью устойчивости ПРОАВТ на фоне WPW (M±m).
Ортодромная наджелудочковая тахикардия
Ортодромная наджелудочковая тахикардия бывает как при явном, так и при скрытом дополнительном пути проведения и является самым частым вариантом наджелудочковой тахикардии при синдроме WPW.
Во время ортодромной наджелудочковой тахикардии импульс проводится антероградно через АВ узел в желудочки, после чего возвращается ретроградно через дополнительный путь в предсердия. Поэтому зубцы Р регистрируются сразу после комплексов QRS.
У большинства больных с ортодромной наджелудочковой тахикардией дополнительный путь расположен слева, поэтому во время наджелудочковой тахикардии сначала возбуждается левое предсердие, а затем правое, и зубцы Р, как правило, отрицательны в I отведении.
Возбуждение распространяется по желудочкам нормально, поэтому дельта-волны нет и комплексы QRS не изменены, если не нарушено внутрижелудочковое проведение.
М. Коэн, Б. Линдсей
«Ортодромная наджелудочковая тахикардия» и другие статьи из раздела Заболевания сердца