Лечение — Хроническое легочное сердце
Страница 5 из 5
В основе лечения больных с хроническим легочным сердцем лежат мероприятия, направленные, прежде всего, на предотвращение легочной гипертензии и правожелудочковой недостаточности. Это возможно только при активном воздействии на основной патологический процесс в легких, приведший к возникновению легочного сердца. Успех лечения зависит в первую очередь от улучшения альвеолярной вентиляции, коррекции артериальной гипоксемии, гиперкапнии и ацидоза. Воздействие на эти, главные, звенья патогенеза легочного сердца в большинстве случаев уменьшает напряженность гипоксической легочной вазоконстрикции и способствует снижению давления в легочной артерии даже на стадии декомпенсированного легочного сердца.
Коррекция легочной артериальной гипоксемии
Наиболее эффективными методами коррекции альвеолярной вентиляции и газового состава крови у большинства больных легочным сердцем являются:
- ингаляции кислорода,
- применение бронхолитиков,
- применение антибиотиков
1. Ингаляция кислорода является одним из наиболее эффективных методов коррекции артериальной гипоксемии и гиперкапнии. Она позволяет восстанавливать поврежденные придыхательной недостаточности функции ЦНС, печени, почек; устраняет метаболический ацидоз, уменьшает катехоламинемию, улучшает механические свойства самих легких и т.п.
Показаниями для назначения кислородотерапии являются следующие клинические симптомы, возникающие у больного с дыхательной недостаточностью (А.П. Зильбер):
- выраженный цианоз;
- тахипноэ;
- тахикардия или брадикардия;
- системная артериальная гипотензия или гипертензия;
- признаки метаболического ацидоза;
- признаки артериальной гипоксемии (парциальное давление кислорода в артери
альной крови — РаО2 — ниже 65 мм рт. ст.).
В стационарах для ингаляции кислорода обычно используют носовой катетер, что создает меньше дискомфорта для пациента, позволяя ему говорить, принимать пищу, кашлять и т.д. При этом во вдыхаемой смеси создается достаточно безопасная концентрация кислорода, не превышающая 40%. Это позволяет длительно, на протяжении нескольких дней или даже недель, осуществлять оксигенотерапию, не опасаясь развития ее осложнений. В некоторых случаях оксигенотерапию проводят с помощью лицевой маски, которая обеспечивает более высокую концентрацию кислорода. Нельзя использовать для оксигенотерапии вдыхание 100% кислорода, так как это способствует угнетению дыхательного центра и развитию гиперкапнической комы. Следует также помнить, что при ингаляции кислорода требуется обязательное увлажнение вдыхаемой кислородной смеси.
Продолжительность оксигенотерапии зависит от тяжести состояния больного и колеблется от 60 мин 3-4 раза в день до 14-16 ч в сутки. В некоторых случаях эффект может быть получен только через 3-4 недели ежедневной оксигенотерапии.
Для получения кислорода могут использоваться так называемые концентраторы (пермеаторы), выделяющие кислород из воздуха. Они позволяют добиться концентрации кислорода во вдыхаемой смеси около 40-50% и могут использоваться в домашних условиях при необходимости длительной (в течение нескольких месяцев) оксигенотерапии.
При неэффективности самостоятельного дыхания кислородом и парциальном давлении СО2 в артериальной крови (РСО2) более 60 мм рт. ст. целесообразно использовать методы искусственной вспомогательной вентиляции легких.
В настоящее время доказана способность длительной оксигенотерапии эффективно снижать давление в легочной артерии, уменьшать признаки дыхательной и сердечной недостаточности и достоверно увеличивать продолжительность жизни больных с хроническим легочным сердцем.
2. Улучшение бронхиальной проходимости является вторым обязательным условием
снижения артериальной гипоксемии и гиперкапнии. В зависимости от характера
основного патологического процесса в легких применяют различные бронходилата-
торы, отхаркивающие средства и муколитики.
Бронхолитики по механизмам действия делят на три группы:
- стимуляторы β-адренергических рецепторов короткого действия: сальбутамол (вентолин), фенотерол (беротек) и длительного действия: сальметерол (серевент), форматерол (оксис)
- холинолитики короткого действия: ипратропиум бромид (атровент) и длительного действия: тиотропиум (спирива)
- метилксантины (теофиллин, теопек, теодур и др.).
Применяются и комбинированные препараты беродуал (беротек + атровент), эудур (теофиллин + тербуталин) и др.
Коррекция мукоцилиарною клиренса также оказывает существенное влияние на бронхиальную проходимость, вентиляцию легких и газовый состав крови. Перспективными считают лекарственные средства, улучшающие слизеобразование и стимулирующие образование сурфактанта (бромгексин), муколитики (калия йодид), щелочные ингаляции и т.п.
Выбор каждого из этих лекарственных средств зависит от характера основного патологического процесса в легких и должен учитывать возможность побочных эффектов, а также конкретные показания и противопоказания к назначению этих препаратов.
3. Антибиотики остаются основным этиологическим средством лечения бронхолегоч-
ной инфекции у больных хроническим легочным сердцем. Адекватно подобранная неспецифическая антибактериальная терапия в большинстве случаев приводит к уменьшению воспалительной реакции в бронхиальном дереве и легочной ткани, восстановлению вентиляции в легких и уменьшению легочной артериальной гипоксемии. Лечение проводится с учетом лекарственной чувствительности флоры возможных побочных эффектов, в том числе кардиотоксического действия антибиотиков.
Длительная оксигенотерапия, адекватное применение бронходилататоров и антибиотиков способствует уменьшению признаков дыхательной и сердечной недостаточности и удлиняет жизнь больных легочным сердцем. Уменьшение артериальной гипоксемии, гиперкапнии и ацидоза способствует снижению вазоконстрикции легочных артериол и давления в легочной артерии.
Коррекция легочного сосудистого сопротивления
Вторым направлением лечения больных с хроническим легочным сердцем является применение некоторых медикаментозных средств, снижающих повышенное легочное сосудистое сопротивление (величину постнагрузки на правый желудочек), приток крови к правым отделам сердца (уменьшение преднагрузки), объем циркулирующей крови (ОЦК) и давление в легочной артерии. С этой целью используют следующие препараты:
- блокаторы медленных кальциевых каналов;
- ингибиторы АПФ;
- нитраты;
- альфа адреноблокаторы и некоторые другие лекарственные средства.
1. Блокаторы медленных кальциевых каналов (антагонисты кальция). Показано, что антагонисты кальция способствуют не только снижению тонуса сосудов малого круга кровообращения, но и расслаблению гладкой мускулатуры бронхов, уменьшают агрегацию тромбоцитов и повышают устойчивость миокарда к гипоксии. Дозы антагонистов кальция подбирают индивидуально, в зависимости от величины давления в легочной артерии и переносимости препаратов. При умеренном повышении давленияв легочной артерии, например, у больных с легочным сердцем, развившемся на фоне хронических обструктивных болезней легких (ХОБЛ) или рецидивирующей тромбоэмболии, антагонисты кальция назначают в средних терапевтических дозах:
- нифедипин — 60-80 мг в сутки;
- дилтиазем — 360-420 мг в сутки;
- лацидипин (лаципил) -2-6 мг в сутки;
- исрадипии (ломир) 5-10 мг в сутки.
Лечение начинают с минимальных переносимых доз препаратов, постепенно увеличивая их каждые 4-6 дней под контролем клинической картины заболевания, давления в легочной артерии и системного АД. Лечение проводят длительно, на протяжении 5-6 недель, если не возникают побочные эффекты препаратов. Тем не менее, в 30-40% случаев такое лечение оказывается неэффективным, что нередко указывает на наличие необратимых органических изменений сосудистого русла.
В целом применение антагонистов кальция у больных легочным сердцем требует осторожности, в первую очередь, из-за возможного критического снижения системного АД и некоторых других нежелательных эффектов этих лекарственных средств.
2. Ингибиторы АПФ . Эти препараты, обладающие уникальными фармакологическими свойствами, в последние годы все шире используются для лечения больных с хроническим легочным сердцем, прежде всего пациентов с признаками сердечной декомпенсации. Воздействие ингибиторов АПФ на гуморальную (эндокринную) РААС и уменьшение под их влиянием образования циркулирующего ангиотензина ІІ имеет несколько важных последствий:
- Расширение сосудов (артериол и вен), которое обусловлено, прежде всего, уменьшением сосудосуживающих влияний самого ангиотензина ІІ. а также угнетением инактивации одного из наиболее мощных вазодилататоров организма — брадикинина. Последний, в свою очередь, стимулирует секрецию эндотелиальных факторов расслабления (PGI2, NO, ЭГПФ), также обладающих выраженным вазодилатирующим и ан-
тиагрегантным эффектами. В результате происходит не только системная артериальная вазодилатация, но и снижается легочное сосудистое сопротивление. Кроме
того, венозная дилатация, развивающаяся под действием ингибиторов АПФ, способствует уменьшению притока крови к правому сердцу, снижению давления наполнения и, соответственно, величины преднагружи на правый желудочек.
- Под действием ингибиторов АПФ уменьшается синтез альдостерона в надпочечниках, что сопровождается снижением альдостеронзависимой реабсорбции Na+ и воды
в дистальных канальцах почек. Одновременно уменьшается секреция ионов К+.
- Снижая содержание циркулирующего ангиотензина ІІ. ингибиторы АПФ уменшают апгиотензинзависимую реабсорбцию Na+ и воды в проксимальных канальцах. Таким образом, происходящее под действием ингибиторов АПФ уменьшение задержки Na+ и воды также ведет к уменьшению ОЦК и величины преднагрузки.
- Наконец, ингибиторы АПФ подавляют стимулированное ангиотензином II образование норадреналина и, соответственно, снижают активность САС.
В результате этих и некоторых других эффектов ингибиторов АПФ уменьшается величина пред- и постнагрузки на правый желудочек, ОЦК и снижается повышенное давление в легочной артерии.
У больных легочным сердцем с признаками сердечной декомпенсации ингибиторы АПФ назначают в относительно небольших дозах. Для лечения предпочтительно использовать современные препараты II и III поколений. Начальные и поддерживающие дозы ингибиторов АПФ представлены в таблице 2.
Табл. 2. Начальная и поддерживающая дозы ингибиторов АПФ при лечении больных декомпенсированным легочным сердцем
Хроническое легочное сердце
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже.
Подобные работы
Причины острого легочного сердца, его патогенез и лабораторно-инструментальные методы диагностики. Исследование симптомов заболевания. Показания госпитализации, лечения и профилактики хронического легочного сердца при проявлении желудочковых аритмий.
реферат [14,6 K], добавлена 28.05.2009
Тромбоэмболия легочной артерии как одно из наиболее распространенных сосудистых заболеваний. Факторы риска и клиническая картина заболевания. Острое легочное сердце: симптомы, признаки и методы лечения. ЭКГ-диагностика тромбоэмболиии легочной артерии.
презентация [603,3 K], добавлена 20.10.2013
Диагноз порока сердца. Диагностика и определение степени структурного поражения клапанов сердца. Определение размеров камер сердца, функционального состояния миокарда желудочков и нарушений внутрисердечной гемодинамики. Наблюдение за пациентами.
реферат [22,1 K], добавлена 28.02.2009
Клинические формы и общая характеристика подклапанного стеноза, основные причины и предпосылки его возникновения, этапы и факторы развития. Описание комбинированных пороков сердца, методика их диагностирования и определения опасности, схема лечения.
реферат [15,2 K], добавлена 08.05.2010
Прогностическая классификация желудочковых аритмий. Алгоритм лечения больных с жизнеугрожающими желудочковыми тахиаритмиями. Современные возможности лечения нарушений ритма сердца при ишемической болезни сердца. Дебют левожелудочковой тахикардии.
презентация [18,0 M], добавлена 23.10.2013
Развитие кардиогенного шока вследствие снижения минутного объема сердца, внутрисердечной гемодинамики из-за механических причин, изменения частоты сердечных сокращений. Патогенез травматического шока. Симптомы, диагностирование, методики лечения.
реферат [27,5 K], добавлена 20.08.2009
Патогенез железорефрактерной анемии, классификация лейкопений. Формирование «легочного сердца». Роль почек в реакциях компенсации нарушений кислотно-щелочного равновесия. Изменения в общем анализе крови при уремии. Этиология ишемической болезни сердца.
контрольная работа [67,8 K], добавлена 12.12.2009
Эпидемиология и распространенность врожденных пороков сердца. Основные причины развития, патогенетические аспекты и классификация заболевания. Исследование клинической картины, осложнений, особенностей диагностики и лечения врожденных пороков сердца.
реферат [80,5 K], добавлена 17.01.2014
Распространенность артериальной гипертонии. Концепция лечения на основе определения уровня давления, курсового лечения и рабочего давления. Цели лечения артериальной гипертонии. Медикаментозное и не медикаментозное лечение пациентов. Целевые уровни АД.
презентация [1,3 M], добавлена 20.02.2011
Митральный стеноз как приобретенный порок сердца, характеризующийся сужением левого предсердно-желудочкового отверстия, предпосылки и факторы его развития, принципы диагностирования и составление схемы лечения. Особенности гемодинамики и прогноз.
презентация [253,0 K], добавлена 29.04.2015
Хроническое легочное сердце
Уже более 200 лет внимание исследователей привлекает проблема диагностики и лечения хронического легочного сердца (ХЛС). Являясь тяжелым осложнением хронической обструктивной болезни легких (ХОБЛ), ХЛС определяет клинику, течение и прогноз заболевания, приводит к ранней инвалидизации больных и служит частой причиной летальных исходов. Эффективность лечения ХЛС во многом зависит от своевременной постановки диагноза. Однако диагностика легочного сердца на ранних этапах, когда оно сохраняет потенциальную обратимость, является весьма трудной проблемой. Между тем, лечение сформировавшегося ХЛС представляет собой сложную, порой малоперспективную задачу. Присоединение сердечной недостаточности приводит к рефрактерности заболевания к проводимой терапии и значительно ухудшает его прогноз. Все вышесказанное позволяет считать проблему ХЛС не только медицинской, но и социально значимой.
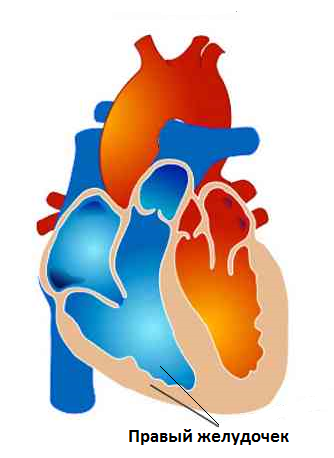
Под легочным сердцем следует понимать весь комплекс нарушений гемодинамики (в первую очередь, вторичную легочную гипертонию), развивающийся вследствие заболеваний бронхолегочного аппарата и проявляющийся, на конечном этапе, необратимыми морфологическими изменениями правого желудочка сердца, с развитием прогрессирующей недостаточности кровообращения.
Большинство исследователей считает, что легочному сердцу, как правило, предшествует гипоксическая легочная вазоконстрикция, приводящая к формированию легочной гипертонии (ЛГ). Важную роль в ее развитии играет перегрузка правого желудочка (ПЖ), связанная с увеличением легочного сопротивления на уровне мышечных артерий и артериол.
Повышение сосудистого сопротивления является следствием анатомических и функциональных факторов, чаще всего имеет место их сочетание. Анатомические изменения (бронхообструкция, эмфизема легких) приводят к редукции сосудистого ложа, сужению прекапилляров, что вызывает повышение сосудистого легочного сопротивления и легочную гипертонию.
Важнейшими функциональными факторами развития ЛГ являются альвеолярная гипоксия и гиперкапния. В ответ на альвеолярную гипоксию развивается, так называемый, альвеолярно-капиллярный рефлекс. Уменьшение парциального давления кислорода в альвеолах вызывает спазм легочных артериол и повышение легочного сосудистого сопротивления. Таким образом, предотвращается поступление ненасыщенной кислородом крови в большой круг кровообращения. В начале болезни легочная вазоконстрикция носит обратимый характер и может регрессировать при коррекции газовых расстройств на фоне лечения. Однако, по мере прогрессирования патологического процесса в легких, альвеолярно-капиллярный рефлекс утрачивает свое положительное значение из-за развития генерализованного спазма легочных артериол, что усугубляет легочную гипертонию, и при стойких нарушениях газового состава крови она трансформируется из лабильной в стабильную.
Кроме хронической гипоксии, наряду со структурными изменениями сосудов легких, на повышение легочного давления влияет и целый ряд других факторов: нарушение бронхиальной проходимости, повышение внутриальвеолярного и внутригрудного давления, полицитемия, изменения реологических свойств крови, нарушение метаболизма вазоактивных веществ в легких.
В настоящее время доказана связь между тканевой гипоксией и легочной вазоконстрикцией, обусловленной сосудосуживающим действием биологически активных веществ. В опытах на животных было установлено, что блокада синтеза оксида азота (NO), регулирующего сосудистый тонус, приводит к усилению гипоксической вазоконстрикции. Его синтез активируется при нарушениях кровотока и при воздействии ацетилхолина, брадикинина, гистамина и фактора агрегации тромбоцитов. Одновременно с NO, в ответ на воспаление, из эндотелиальных клеток освобождается простациклин и также участвует в расширении сосудов.
У больных ХЛС, уже на ранних этапах формирования недостаточности кровообращения, наблюдается снижение концентрации натрийуретического фактора в плазме крови, в результате чего не происходит адекватной вазодилатации легочных сосудов и давление в малом круге кровообращения остается повышенным.
Хорошо известно, что именно в кровеносных сосудах под влиянием ангиотензипревращающего фермента (АПФ) происходит превращение неактивного ангиотензина I в активный ангиотензин II, и именно локальные ренинангиотензиновые системы участвуют в регуляции сосудистого тонуса. Следует отметить, что АПФ одновременно участвует в инактивации NO в легких, что вызывает потерю легочными сосудами способности отвечать вазодилатацией на эндотелиозависимые субстанции.
Кроме того, ангиотензин II оказывает как прямое, так и опосредованное действие (через активацию симпатоадреналовой системы) на миокард и сосуды, что вызывает повышение общего периферического сосудистого сопротивления и артериального давления.
Некоторые авторы считают проблему легочной гипертонии во многом преувеличенной, так как она развивается только у части больных ХОБЛ, а выраженная ЛГ встречается не более, чем в 23 % случаев, в том числе и при наличии клинических признаков декомпенсации ХЛС. Повышение среднего давления в легочной артерии (СДЛА) возможно и у здоровых лиц при физической нагрузке и при дыхании гипоксическими смесями.
Состояние внутрисердечной гемодинамики на этапах формирования ХЛС
Неоднозначно отношение исследователей к функциональному состоянию левого желудочка у больных ХОБЛ. На ранних этапах ХЛС за счет тахикардии увеличивается работа левого желудочка (ЛЖ) и тип кровообращения соответствует гиперкинетическому. При увеличении нагрузки на правый желудочек отмечается снижение диастолической функции и сократительной способности миокарда, что приводит к уменьшению фракции изгнания ЛЖ и развитию гипокинетического типа гемодинамики.
Определенное влияние на функциональное состояние ЛЖ оказывает артериальная гипоксемия. Однако есть мнение, что левожелудочковая недостаточность при ХЛС объясняется сопутствующими сердечно-сосудистыми заболеваниями (ИБС, ГБ).
При формировании ХЛС наблюдаются изменения миокарда в виде гипертрофии, дистрофии, атрофии и некроза кардиомиоцитов (преимущественно, правого желудочка сердца). Эти изменения обусловлены нарушениями соотношения микроциркуляции и функции кардиомиоцитов. Перегрузка миокарда давлением и объемом приводит к изменениям его функции и сопровождается процессами ремоделирования обоих желудочков.
Патоморфологические изменения в сердце при ХОБЛ и ЛГ характеризуются, в основном, 2-мя типами изменений. Для первого (гипертрофически-гиперпластического) типа характерна не столько дилатация, сколько гипертрофия правого желудочка сердца.
При втором типе перестройки имеет место сочетание миогенной дилатации ПЖ с гипертрофией миокарда и, реже, с расширением полости ЛЖ. В мышечных волокнах ПЖ преобладают атрофически-склеротические процессы. В правом предсердии и правом желудочке выражен фиброэластоз эндокарда. В левом желудочке мышечные волокна не изменены или преобладает их гипертрофия, а кардиосклероз имеет крупноочаговый характер и отмечается лишь при наличии сопутствующих заболеваний (артериальная гипертония, атеросклероз).
В сосудах легких также отмечаются два типа системных изменений. Для прекапиллярной (артериальной) гипертонии малого круга кровообращения характерен гипертрофически — гиперпластический тип перестройки сосудов, а при выраженном кардиопульмональном синдроме с легочно-сердечной недостаточностью преобладают процессы склерозирования и атрофии.
У больных ХОБЛ нередко развивается вторичная симптоматическая пульмогенная артериальная гипертония, связанная с состоянием бронхиальной системы. К пульмогенной гипертонии следует относить случаи повышения системного АД на фоне обострения легочного процесса, сопровождающиеся значительными изменениями функции внешнего дыхания и снижением парциального давления кислорода крови. О пульмогенном происхождении гипертонии свидетельствует связь дыхательных расстройств с уровнем альдостерона, кортикотропина, кортизола, участвующих в формировании сосудистого тонуса и артериального давления. Системная гипертония возникает обычно через 3-5 лет от начала легочного заболевания и характеризуется гиперкинетическим типом кровообращения. Различают две фазы пульмогенной гипертонии — лабильную и стабильную, а также бронхообструктивный и бронхонагноительные ее типы.
Увеличение частоты возникновения системной артериальной гипертонии у больных ХОБЛ коррелирует с нарастанием легочной гипертонии, уровень которой тесно связан с парциальным давлением кислорода в крови и показателями ФВД. Наличие пульмогенной гипертонии приводит к более раннему развитию сердечной недостаточности и ее более тяжелому течению. В дальнейшем, при прогрессировании легочного заболевания и формировании ХЛС, особенно декомпенсированного, показатели системного артериального давления не достигают высоких цифр, а в ряде случаев наблюдается гипотония, особенно в ночные часы. Снижение АД носит систолодиастолический характер и сопровождается увеличением частоты эпизодов ишемии миокарда и признаков нарушения церебрального кровообращения.
Осложнениями ХОБЛ является не только формирование ХЛС, но и развитие сердечных аритмий, которые при длительной регистрации ЭКГ выявляются у 89-92% больных. Имеют место практически все виды нарушений сердечного ритма, нередко наблюдается сочетание нескольких их видов. Наиболее часто встречаются синусовая тахикардия, предсердная экстрасистолия, суправентрикулярная пароксизмальная тахикардия, мерцание и трепетание предсердий. Реже — желудочковые нарушения ритма и нарушения проводимости. Не характерны для больных ХОБЛ сложные нарушения проводимости, и частота их встречаемости не превышает общепопуляционные.
Степень градации желудочковой экстрасистолии возрастает по мере декомпенсации сердечной недостаточности на фоне ухудшения легочной вентиляции и газового состава крови. Частота желудочковых нарушений ритма сердца у больных при декомпенсации ХЛС, сравнима с частотой возникновения их при острой коронарной патологии. Кроме того, при развитии и прогрессировании ХЛС, наряду с увеличением прогностически неблагоприятных нарушений ритма сердца, снижаются показатели вариабельности сердечного ритма (ВСР), что позволяет прогнозировать развитие аритмогенных катастроф у этой группы больных. Прогностическая значимость показателей ВСР возрастает при наличии сердечной недостаточности.
Решение вопроса о причине развития нарушений ритма сердца является сложным. Трудно сказать однозначно, с чем связано их возникновение, или с сопутствующей ишемической болезнью сердца, или с имеющей место гипоксией. Ясно одно, что наличие сердечных аритмий утяжеляет течение и ухудшает прогноз ХЛС у больных ХОБЛ.
Механизмы развития сердечной недостаточности у больных хроническим легочным сердцем.
Вопросы развития недостаточности кровообращения при ХЛС также являются дискутабельными. Ряд исследователей связывает возникновение правожелудочковой недостаточности у больного легочным сердцем с экстракардиальными причинами. Так, по мнению W. Mac Nee (1994) при хронической гипоксии и ацидозе усиливается секреция альдостерона надпочечниками, что приводит к увеличению реабсорбции натрия почками и происходит задержка жидкости. Углекислый газ вызывает периферическую вазодилатацию с последующей активацией ренинангиотензиновой системы, что сопровождается выработкой вазопрессина. Увеличение внеклеточного объема жидкости и легочная гипертензия приводят к расширению правого предсердия и высвобождению предсердного натрийуретического пептида, который является основной защитой от отеков, но может быть подавлен ренин-ангиотензин-альдостероновой системой (РААС).
Хроническая гиперактивация РААС является важнейшим фактором дисфункции эндотелия, проявляющаяся дисбалансом между продукцией эндотелием вазодилатирующих, ангиопротективных, антипролиферативных факторов, с одной стороны, и вазоконстриктивными, протромботическими, пролиферативными факторами — с другой.
Большинство авторов основным патогенетическим механизмом развития недостаточности кровообращения при ХОБЛ считают легочную гипертонию, приводящую к перегрузке правых отделов сердца. Основополагающим фактором при этом является обострение бронхолегочного воспаления, что ведет к своеобразному «гипертоническому кризу» в малом круге кровообращения. На ранних стадиях формирования ХЛС возможно развитие гипертрофии правого желудочка и нарушение его диастолической функции, что является наиболее ранним диагностическим критерием развития сердечной недостаточности у больных ХЛС. При стабильно повышенном давлении в легочной артерии на фоне перегрузки объемом правого желудочка развивается его дилатация и начинает страдать систолическая функция сердца, что приводит к снижению ударного выброса. В случае выраженной гипоксической, токсико-аллергической дистрофии миокарда возможно и развитие дилатации ПЖ без его гипертрофии.
Таким образом, прогрессирующая дисфункция правой и левой половины сердца утяжеляет течение и прогноз ХЛС, приводя, со временем, к развитию легочно-сердечной недостаточности.
Терапевтические возможности лечения ХЛС
Несмотря на достигнутые за последние десятилетия очевидные успехи в терапии ХЛС, смертность больных остаётся высокой. При наличии развернутой клинической картины ХЛС двухлетняя выживаемость составляет 45% и продолжительность жизни больных, в среднем, колеблется от 1,3 до 3,8 лет. Поэтому поиск новых средств, позволяющих увеличить продолжительность жизни таких больных, продолжает оставаться актуальным.
Безусловно, терапия больных ХОБЛ, течение которых осложнилось развитием хронического легочного сердца, должна быть ранней, комплексной, рациональной, индивидуальной и многоэтапной. Следует отметить, что крупномасштабные многоцентровые контролируемые исследования (на уровне доказательной медицины) по оценке эффективности различных методов и способов (включая лекарственные) лечения больных ХЛС не проводились.
Профилактические мероприятия должны быть направлены на соблюдение режима труда и отдыха. Необходим полный отказ от курения (в том числе — и пассивного), по возможности избегание переохлаждения и профилактика острых респираторных вирусных инфекций, так как у многих больных ведущей причиной в развитии и прогрессировании ХЛС является инфекционно-воспалительный процесс, что требует назначения антибактериальных средств в период его обострения. Показано применение бронхолитической, муколитической и отхаркивающей терапии. Разумное ограничение физической активности показано больным с декомпенсированным ХЛС.
На всех этапах течения ХЛС патогенетическим средством является оксигенотерапия. Вследствие повышения парциального давления кислорода в альвеолах и увеличения его диффузии через альвеолярно-капиллярную мембрану достигается уменьшение гипоксемии, что нормализует легочную и системную гемодинамику, восстанавливает чувствительность рецепторов клеток к лекарственным веществам. Длительная оксигенотерапия должна назначаться как можно раньше с целью уменьшения газовых расстройств, снижения артериальной гипоксемии и предупреждения нарушений гемодинамики в малом круге кровообращения, что позволяет приостановить прогрессирование легочной гипертензии и ремоделирование легочных сосудов, повышает выживаемость и улучшает качество жизни больных, уменьшает количество эпизодов апноэ во сне.
Наиболее перспективным и патогенетически обоснованным является лечение оксидом азота, так как он оказывает действие, аналогичное эндотелий-релаксирующему фактору. При курсовом ингаляционном применении NO у больных ХЛС наблюдается снижение давления в легочной артерии, повышение парциального давления кислорода в крови, уменьшение легочного сосудистого сопротивления. Однако нельзя забывать о токсическом влиянии NO на организм человека, что требует четкого его дозирования. Целесообразно проведение прогностических острых лекарственных проб с оксидом азота с целью выявления больных, у которых вазодилатирующая терапия будет наиболее эффективной.
Учитывая ведущее значение легочной гипертензии в развитии ХЛС, необходимо применение лекарственных средств, корригирующих гемодинамические расстройства. Однако резкое медикаментозное снижение легочной гипертонии может приводить к ухудшению газообменной функции легких и увеличению шунта венозной крови за счет усиления перфузии недостаточно вентилируемых участков легких. Поэтому ряд авторов рассматривает умеренную легочную гипертонию при ХОБЛ как компенсаторный механизм вентиляционно-перфузионной дисфункции.
Простагландины являются группой лекарственных препаратов, которые позволяют успешно снижать давление в легочной артерии при минимальном влиянии на системный кровоток. Ограничением к их применению является необходимость длительного внутривенного введения, так как простагландин Е1 обладает коротким периодом полужизни.
Вопрос о целесообразности применения сердечных гликозидов в лечении больных ХЛС остается спорным. Считается, что сердечные гликозиды, обладая положительным инотропным действием, приводят к более полному опорожнению желудочков, увеличивают сердечный выброс. Однако у больных ХОБЛ с недостаточностью ПЖ, без сопутствующей патологии сердца, сердечные гликозиды существенно не улучшают показатели гемодинамики. На фоне приема сердечных гликозидов у больных ХЛС чаще встречаются симптомы дигиталисной интоксикации, возникают практически все виды аритмий и нарушений проводимости сердца. Следует отметить, что вентиляционные нарушения и артериальная гипоксемия способствуют развитию стойкой тахикардии, которая сохраняется и на фоне насыщающей дозы сердечных гликозидов. Следовательно, урежение ЧСС не может быть критерием эффективности применения сердечных гликозидов при декомпенсации легочного сердца, а их использование оправдано при развитии острой недостаточности левого желудочка.
Диуретические средства, показанные при наличии признаков застойной сердечной недостаточности, следует назначать осторожно из-за вероятности возникновения метаболического алкалоза, который усиливает дыхательную недостаточность за счет уменьшения стимулирующего действия СО2 на дыхательный центр. Кроме того, диуретики способны вызывать сухость слизистой бронхов, снижать мукозный индекс легких и ухудшать реологические свойства крови.
В терапии сердечной недостаточности широко применяются вазодилататоры различных групп: венозного, артериального и смешанного действия.
К препаратам венодилатирующего действия и, одновременно, донаторам NO, относятся нитраты. Как правило, во время однократных проб у больных ЛГ, нитраты снижают давление в легочной артерии, но при этом имеет место опасность усиления артериальной гипоксемии за счет увеличения кровотока через гиповентилируемые участки легочной ткани. Длительное применение нитратов у больных ХЛС не всегда оказывают влияние на давление в легочном стволе, вызывает уменьшение венозного возврата к сердцу и легочного кровотока, что сопровождается снижением рО2 крови. С другой стороны, увеличение венозной емкости, уменьшение притока крови к сердцу и, следовательно, снижение преднагрузки ведет к улучшению насосной функции ПЖ. По данным В.П. Сильвестрова (1991), у больных ХОБЛ с легочной гипертонией без признаков сердечной недостаточности под влиянием нитратов возможно снижение ударного объема и фракции выброса, что, при наличии гипокинетического типа кровообращения, приводит к снижению СИ. Из сказанного следует, что рационально применять нитраты у больных ХЛС с гиперкинетическим типом гемодинамики и признаками недостаточности ПЖ.
Применение нитратов может усугублять имеющую место у больных ХЛС систоло-диастолическую гипотонию, более выраженную при декомпенсации кровообращения. Кроме того, нитраты вызывают венозный застой на периферии, что приводит к усилению отеков нижних конечностей у больных.
Антагонисты кальция вызывают дилатацию сосудов малого и большого круга кровообращения и, по экспериментальным данным, являются прямыми легочными вазодилятаторами. Сокращение гладкой мускулатуры бронхов, секреторная активность слизистых желез бронхиального дерева зависят от проникновения кальция внутрь клетки по медленным кальциевым каналам. Однако убедительных данных, доказывающих прямое бронхорасширяющее действие антагонистов кальция, не получено. Оказывая положительное влияние на бронхоспазм, секрецию слизи, антагонисты кальция, по мнению одних авторов, незначительно влияют на давление в легочной артерии, а по мнению других — являются наиболее эффективными вазодилятаторами. При проведении острых лекарственных проб было показано, что антагонисты кальция расширяют легочные сосуды, если их начальный тонус повышен и не оказывают эффекта при изначально сниженном тонусе. У части больных при их приеме возможно развитие нежелательного торможения легочной вазоконстрикторной реакции на гипоксию, на что указывает снижение рО2 в артериальной крови. Тем не менее, антагонисты кальция являются одними из основных лекарственных средств, применяемых в лечении легочной гипертензии у больных ХОБЛ.
Исследованиями последних лет убедительно доказано, что ИАПФ значительно улучшают выживаемость и прогноз жизни у больных с застойной сердечной недостаточностью. Однако препараты из группы ИАПФ только в последнее время стали находить применение в лечении больных ХЛС.
Уменьшение конверсии инертного ангиотензина I в фармакологически активный ангиотензин II приводит к выраженному снижению тонуса артериол. Уменьшается ОПСС вследствие повышения содержания в организме кининов, эндотелиального релаксирующего фактора и простагландинов с вазодилатирующими свойствами. Замедляется деградация предсердно-натрийуретического фактора — мощного дегидратанта, улучшается почечная гемодинамика и снижается синтез альдостерона, что приводит к увеличению диуреза и натрийуреза. Сочетание этих механизмов приводит к гемодинамической разгрузке сердца. Положительное влияние оказывают ИАПФ и на показатели гемостаза.
Результатом применения ИАПФ является снижение артериолярного и венозного тонуса, уменьшение венозного возврата крови к сердцу, снижение диастолического давления в лёгочной артерии, увеличение сердечного выброса. ИАПФ снижают давление в правом предсердии, оказывают противоаритмическое действие, что связано с улучшением функции сердца, увеличением содержания калия и магния в сыворотке крови, снижением концентрации норадреналина, что ведет к снижению тонуса симпатоадреналовой системы.
Важным вопросом является дозировка ИАПФ при ХЛС. Клинический опыт и литературные данные демонстрируют возможность эффективного применения преимущественно пролонгированных форм ИАПФ в минимальных терапевтических дозах.
Как любые лекарственные средства, ИАПФ имеют и ряд побочных действий. Развитие артериальной гипотонии после приёма первой дозы является наиболее часто наблюдаемым.
Ухудшение функции почек, задержка калия в организме, кашель следуют далее по частоте возникновения осложнений. Сухой кашель, не связанный с бронхоконстрикцией, не может быть абсолютным препятствием к назначению у больных ХЛС ингибиторов АПФ.
Наибольшая эффективность ИАПФ отмечается при гипокинетическом типе кровообращения, так как повышение ударного и минутного объемов, уменьшение системного и легочного сосудистого сопротивления приводит к улучшению и нормализации гемодинамики.
Помимо гемодинамического эффекта, отмечается положительное влияние ИАПФ на размеры камер сердца, процессы ремоделирования, толерантность к физическим нагрузкам и повышение продолжительности жизни больных сердечной недостаточностью.
Таким образом, лечение пациентов, страдающих ХЛС на фоне ХОБЛ, должно быть комплексным, направленным, прежде всего, на профилактику и лечение основного заболевания, на адекватное снижение давления в легочной артерии и уменьшение явлений легочной и сердечной недостаточности.
1. Агеев Ф.Т. Овчинников А.Г. Мареев В.Ю. и др. Эндотелиальная дисфункция и сердечная недостаточность: патогенетическая связь и возможности терапии ингибиторами ангиотензинпревращающего фермента// Consilium medicum. 2001;2:61-65.
2. Бувальцев В.И. Дисфункция эндотелия как новая концепция профилактики и лечения сердечно-сосудистых заболеваний. Межд. мед. ж. 2001;3: компьютерная версия.
3. Демихова О.В. Дегтярева С.А. Хроническое легочное сердце: применение ингибиторов АПФ// Лечащий врач. 2000;7:1-4.
4. Задионченко В.С. Волкова Н.В. Свиридов А.А. и др. Системная пульмоногенная и вторичная легочная артериальная гипертония// Российский кардиологический журнал. 1997;6:28-37.
5. Казанбиев Н.К. Современные подходы к диагностике и лечению хронического легочного сердца// Кардиология. 1995;5:40-43.
6. Моисеев В.С. Хроническое легочное сердце.//Врач 2001;11:20-22.
7. Невзорова В.А. Гельцер Б.И. Окись азота и гемоциркуляция легких// Пульмонология 1997;2:80-85.
8. Ольбинская Л.И. Игнатенко С.Б. Патогенез и современная фармакотерапия хронической сердечной недостаточности// Сердечная недостаточность. 2002;2:87-92.
9. Скворцов А.А. Челмакина С.М. Пожарская Н.И. Мареев В.Ю. Модулирование активности системы нейрогуморальной регуляции при хронической сердечной недостаточности// Русск. мед. журнал, 2000;8;2:87-93.
10. Чазова И.Е. Современные подходы к лечению хронического легочного сердца// Рус. мед. журнал. 2001;2: 83-86.
Газета «Новости медицины и фармации» 10 (365) 2011
Вернуться к номеру
Лечение хронического легочного сердца
Авторы: Б.В. Норейко, д.м.н. профессор кафедры фтизиатрии и пульмонологии Донецкого национального медицинского университета им. М. Горького С.Б. Норейко, д.м.н. заведующий кафедрой физиологии, физической и психологической реабилитации Донецкого государственного института здоровья, физического воспитания и спорта при Национальном университете физического воспитания и спорта Украины
Версия для печати
Резюме / Abstract
Социальный и экономический ущерб, наносимый хроническими обструктивными заболеваниями легких (ХОЗЛ), туберкулезом (ТБ) и профессиональными заболеваниями легких, огромен. Только в США ХОЗЛ являются самыми частыми заболеваниями легких, приводящими к развитию легочной гипертензии (ЛГ) и правожелудочковой недостаточности. У 50 % больных с ХОЗЛ выявлены легочная гипертензия и хроническое легочное сердце (ХЛС), которые являются основной причиной смерти этой категории больных.
 В соответствии с классификацией хронического легочного сердца, в зависимости от вызывающих его заболеваний наиболее частыми причинами развития ХЛС являются заболевания, первично повреждающие воздухоносные пути легких и альвеолы. К ним отнесены хронические обструктивные заболевания легких с эмфиземой легких или без нее, бронхиальная астма (БА), легочный фиброз с эмфиземой легких или без нее. К числу частых причин развития ХЛС отнесены также туберкулез легких, пневмокониозы и легочные грануломатозы (саркоидоз, идиопатический фиброзирующий альвеолит). Стандарты лечения больных с ХОЗЛ и бронхиальной астмой приведены в приказе № 128 МЗ Украины «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «пульмонологія» от 19.03.2007 года. Соблюдение этих стандартов способствует предупреждению ХЛС. Успех в лечении ХЛС может быть достигнут вследствие комплексного лечения бронхообструктивного синдрома (БОС) и васкулярного компонента ХЛС.
В соответствии с классификацией хронического легочного сердца, в зависимости от вызывающих его заболеваний наиболее частыми причинами развития ХЛС являются заболевания, первично повреждающие воздухоносные пути легких и альвеолы. К ним отнесены хронические обструктивные заболевания легких с эмфиземой легких или без нее, бронхиальная астма (БА), легочный фиброз с эмфиземой легких или без нее. К числу частых причин развития ХЛС отнесены также туберкулез легких, пневмокониозы и легочные грануломатозы (саркоидоз, идиопатический фиброзирующий альвеолит). Стандарты лечения больных с ХОЗЛ и бронхиальной астмой приведены в приказе № 128 МЗ Украины «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «пульмонологія» от 19.03.2007 года. Соблюдение этих стандартов способствует предупреждению ХЛС. Успех в лечении ХЛС может быть достигнут вследствие комплексного лечения бронхообструктивного синдрома (БОС) и васкулярного компонента ХЛС.
Патогенез ХЛС на фоне ХОЗЛ представлен на рис. 1.
На рис. 1 видно, что в развитии ХЛС можно выделить 3 каскада взаимосвязанных патогенетических механизмов, которые в конечном итоге сопровождаются развитием ХЛС и правожелудочковой недостаточности кровообращения, если ХЛС прогрессирует. В патогенезе ХЛС имеют большое значение внутрисосудистые факторы. Гипоксемия, возникающая на фоне легочной недостаточности, является самым сильным активатором эритропоэза. Полицитемия приводит к ухудшению реологических свойств крови, повышению активности свертывающей системы крови, росту сосудистого сопротивления кровотоку в малом (МКК) и большом кругах кровообращения (БКК) с угрозой перехода ХЛС в фазу недостаточности кровообращения.
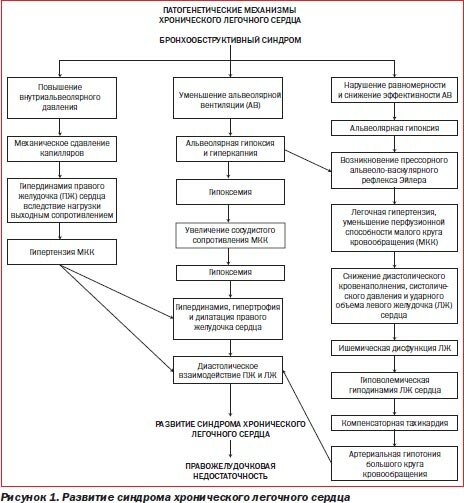
К числу существенных механизмов ХЛС относят также активацию симпатоадреналовой системы. Общеизвестно, что самой аварийной ситуацией для организма является нехватка кислорода. Развитию ХЛС с самого начала предшествует хроническая гипоксемия, которая значительно усиливается во время обострения ХОЗЛ и туберкулеза легких. Нарастание гипоксемии вызывает активацию симпатоадреналовой системы. Надпочечники в условиях гипоксического криза вырабатывают большое количество норадреналина, что приводит больного в состояние возбуждения, при этом резко увеличивается потребление кислорода, и гипоксия на организменном уровне достигает угрожающих масштабов. Активация симпатоадреналовой системы сопровождается тахикардией, нерациональным увеличением потребления кислорода и энергетических ресурсов сердца, истощением запасов гликогена в миокарде с развитием недостаточности кровообращения. Поскольку при ХОЗЛ, у больных туберкулезом легких гипертрофия миокарда не всегда соответствует росту сосудистого сопротивления в малом круге кровообращения, в процессе развития ХЛС создаются условия для рано возникающей дилатации правого желудочка (ПЖ) с появлением трикуспидальной регургитации с угрозой развития трикуспидальной недостаточности с нарушением внутрисердечной гемодинамики в правом отделе сердца. Стойкое увеличение давления крови в ПЖ на фоне ХЛС сопровождается диастолической и систолической дисфункцией, приводящей к нарушению кровоснабжения миокарда с развитием метаболических нарушений. Развитие ишемической дисфункции правых и левых отделов сердца ведет к сердечной недостаточности.
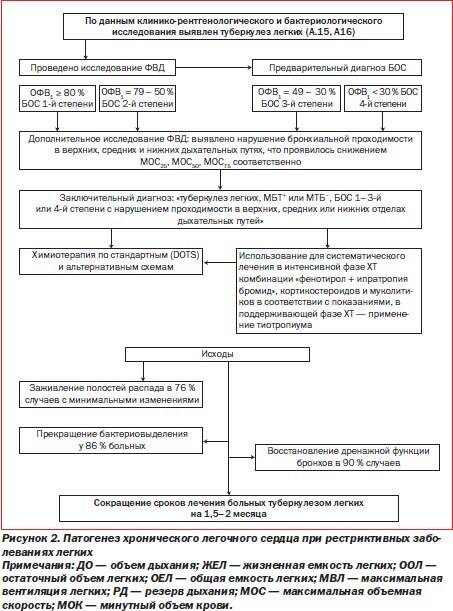
Хронические обструктивные заболевания легких являются главными, но единственными поставщиками ХЛС. Хронические формы туберкулеза, профессиональные заболевания легких пылевой этиологии и, особенно, силикоз и силикотуберкулез легких в большинстве случаев заканчиваются развитием тяжелых форм ХЛС. Преобладающим патоморфологическим субстратом при этих заболеваниях является диффузный, прогрессирующий пневмосклероз, который может составлять главный субстрат ХЛС. Последовательность развития патогенетических механизмов нарушений в кардиореспираторной системе при рестриктивных заболеваниях легких представлена на рис. 2.
Значение рационального питания больных с ХЛС на фоне ХОЗЛ и туберкулеза
Углеводы состоят из углекислого газа и воды. Поэтому, если пищевой режим больных ХЛС будет преимущественно состоять из углеводов, это будет способствовать увеличению эндогенной продукции СО2 с развитием гиперкапнии. Отсюда возникает практическая рекомендация ограничить углеводы в диете больных ХЛС. Если норма углеводов в пищевом режиме здорового человека составляет 250–400 г, то рекомендуется уменьшить потребление углеводов до 50–100 г, поддерживая калорийное содержание пищи за счет жиров и белков. Учитывая наличие легочной недостаточности и низкие ферментативные возможности больных ХЛС, рекомендуются нетугоплавкие жиры в виде сливочного масла и жиров растительного происхождения.
Лечение ХЛС направлено на коррекцию основных патогенетических механизмов этого синдрома с учетом последствий лечебного и отрицательного побочного действия медикаментозных препаратов на состояние функции внешнего дыхания (ФВД) и гемодинамическую ситуацию в большом и малом кругах кровообращения.
Оксигенотерапия хронического легочного сердца
Теоретическим аргументом для использования кислорода в лечении ХЛС является признанное значение альвеолярной гипоксии в качестве ведущего фактора и условия развития легочной гипертензии с последующей гипертрофией и дилатацией правого желудочка. Нужно отметить, что за рубежом было увлечение оксигенотерапией, которое продолжается и в настоящее время. Были созданы технические условия для проведения кислородной терапии в задаваемых режимах с одновременным мониторированием насыщения крови кислородом. В настоящее время имеется значительный опыт длительной оксигенотерапии больных с ХЛС. Изучена эффективность условно непрерывной оксигенации по 19 часов в сутки, 6- и 12-часовых сеансов оксигенотерапии. Положительный эффект оксигенотерапии проявился в увеличении продолжительности жизни больных, получавших непрерывную оксигенотерапию. Другие параметры жизнедеятельности не изменялись, то есть положительный лечебный эффект отсутствовал [6]. Большинство специалистов, применявших оксигенотерапию, единодушно приходят к сравнительно скромной оценке этого метода в лечении ХЛС. При длительном снабжении больного большим количеством кислорода происходит угнетение дыхательного центра [10, 11]. Как только гипероксигенация больного прекращается, газовая ситуация в организме больного становится хуже, чем до лечения, поскольку у больного с гипоксемией и гиперкапнией дыхательный центр находится в тонусе и за счет этого вентиляционная функция легких поддерживается на должном уровне. Причем стимулирует дыхательный центр не только избыток угольной кислоты, но и недостаток кислорода, и надо подчеркнуть, что главный механизм, регулирующий дыхание, — это недостаток кислорода. При кислородной терапии происходит вымывание СО2 из организма, приводящее к нарушению гуморальной регуляции дыхания. Кроме того, установлено, что хеморецепторы, которые следят за содержанием кислорода и угольной кислоты в крови, на фоне кислородной терапии как бы анестезируются, их чувствительность понижается и они теряют способность мониторировать газовый состав крови. В опытах Эдвар Ван Лира [31] пребывание животных в камерах, заполненных 100% кислородом в течение 4–4,5 ч, оказалось смертельным. Так были открыты токсические свойства кислорода, которые проявляются при избыточной оксигенации организма. Механизм токсического действия кислорода в настоящее время хорошо изучен. Под влиянием высоких концентраций кислорода происходит активация сурфактанта альвеолярных стенок, дополнительная мобилизация эндоперекисей в результате метаболизма полиненасыщенных жирных кислот. Возникает кислородный взрыв с развитием диффузного кислородного пневмонита, при котором внутренняя поверхность легких повреждается. Эти и другие известные научные исследования, в которых показано повреждающее действие кислорода на организм животных и человека, доказывают, что идеология оксигенотерапии не всегда верна. Можно согласиться с дозированной кислородной терапией в послеоперационном периоде и в реанимационных мероприятиях. Но речь идет о лечении ХЛС, при котором в организме установился свой газовый менталитет, когда человек многие годы живет и работает на скромном кислородном пайке, но при избытке углекислого газа. Известно, что гиперкапния вызывает газовый ацидоз, который на центральную нервную систему действует успокаивающе, вызывая феномен углекислого наркоза. Поэтому больные с глубокими нарушениями газообмена могут находиться в полном неведении об исходе своего заболевания. Избыток углекислого газа, который мы хотим во что бы то ни стало изгнать из организма больного, создает состояние внутреннего спокойствия.
Важным отрицательным следствием оксигенотерапии является снижение пневматизации легких вплоть до развития частичного ателектаза легких. Из физиологии дыхания известны противоателектатические свойства сурфактанта. Ингаляция кислорода сопровождается повреждением сурфактантного слоя альвеолярных стенок как в результате прямого токсического действия высоких концентраций кислорода, так и вследствие активации перекисного окисления липидов (ПОЛ), в процессе которого образуется каскад эндоперекисей, в состав которых входят активные свободнорадикальные формы кислорода, токсическое действие которых на респираторную поверхность легких сопровождается развитием диффузного альвеолита кислородного генеза. Вторая причина спадения легких проявляется непосредственно во время сеанса оксигенотерапии. Она является результатом вымывания азота альвеолярного воздуха вследствие замены его кислородом [6]. Попытка помочь больному, исходя из теоретической предпосылки, что оксигенотерапия уменьшает альвеолярную гипоксию и отменяет действие вазопрессорного рефлекса Эйлера, на практике приносит больше вреда, чем пользы. Среди аргументов в пользу оксигенотерапии ХЛС приводят известное свойство кислорода вызывать дилатацию прекапиллярных артериол МКК. Но это пример того, как желаемое выдается за действительное. Но если выяснить весь каскад нежелательных патогенетических механизмов, которые активизируются под влиянием оксигенотерапии, то можно выносить отрицательный вердикт этому методу. По данным ученых Московского НИИ медицинских проблем человека, жизнь на Земле зародилась при содержании кислорода в 100 раз меньшем, чем сейчас. Поэтому человек имеет высокую степень адаптации к низкому содержанию кислорода во вдыхаемом воздухе. Примером может быть высокогорная гипоксическая гипоксия. Токсическое действие высоких концентраций кислорода на альвеолярную поверхность и организм человека в целом в настоящее время хорошо изучено, тем не менее реверансы в сторону кислородной терапии продолжают делать не только ученые, но и практические врачи. Примером является гипербарическая оксигенация. Вместе с тем известно, что человек как биологический вид никогда не жил в атмосфере, содержащей кислорода больше 20 %. Гипоксия сопровождается ацидозом. Но в процессе длительных сеансов оксигенотерапии создается угроза развития алкалоза, который ничуть не лучше ацидоза. Оптимум рН крови, при котором хорошо работают все системы жизнеобеспечения, составляет 7,40. Отклонение от этой константы в любую сторону вредно, все зависит от степени алкалоза или ацидоза. Следует иметь в виду, что ацидоз бывает газовым и метаболическим. Газовый ацидоз обусловлен глубоким нарушением газообмена с развитием гиперкапнии. С этой формой ацидоза можно бороться. Стандартной рекомендацией при гиперкапнии является оксигенотерапия. Есть и другие методы коррекции газового ацидоза. Один из эффективных методов коррекции гиперкапнии был открыт при изучении газообмена на модели ребенка в период его внутриутробного развития. Оказалось, что во второй половине беременности, когда уже работает гормон желтого тела — прогестерон, кровь матери и ребенка почти не содержит угольной кислоты. Это объясняется тем, что под влиянием прогестерона происходит увеличение легочной вентиляции в покое и минутный объем дыхания может увеличиваться в 2–3 раза, что обеспечивает непрерывное вымывание углекислого газа из организма беременной женщины. Низкая концентрация СО2 в крови плода является филогенетически запрограммированным механизмом.
Но на фоне ХЛС развитие алкалоза маловероятно, потому что есть и второй параметр, от которого зависит рН крови и кислотно-щелочное равновесие в условиях ацидоза, — это метаболический ацидоз. От метаболического ацидоза избавиться непросто: необходимо восстановить вентиляционную функцию легких, активировать функциональное состояние почек, внести коррекцию в питание больного.
На заключительном этапе рассматриваемой проблемы хочется ознакомить вас с результатами уникальных исследований ученых Московского НИИ биологических проблем человека в Российской Федерации [15, 25]. В этом институте работали в свое время академик В.В. Парин, Ф.З. Меерсон и ряд других выдающихся личностей, посвятивших себя в основном обеспечению нормальных условий для длительного проживания космонавтов и подводников в замкнутых пространствах космических кораблей и подводных лодок [25]. Их исследования заключались в следующем. Они брали несколько серий крыс, вживляли им в нейроны головного мозга полярографические электроды и проводили непрерывную регистрацию концентрации кислорода в веществе мозга. В 1-й серии опытов крысы дышали воздухом с 20% содержанием кислорода. В следующих сериях содержание кислорода в воздушно-кислородной смеси повышалось до 40, 60, 80 и 100 %. Было выявлено парадоксальное явление: чем выше концентрация кислорода в ингалируемой азотно-кислородной смеси, тем меньшее количество кислорода поглощается мозговой тканью. Эта филогенетически запрограммированная реакция защищает фосфолипиды мозговой ткани от высоких концентраций кислорода. Условия для появления жизни на Земле появились, когда парциальное давление достигло 1,69 мм рт.ст. Всю историю эволюционной биологии можно представить как борьбу за выживание путем совершенствования механизмов самообороны от повреждающего действия растущих концентраций кислорода. Самым совершенным из известных нам способов защиты организма от кислорода является каскад убывания концентрации кислорода в процессе преодоления им множественных биологических мембран. В итоге в головном мозге парциальное давление кислорода колеблется от 0 в период диастолы сердца до 10 мм рт.ст. во время систолы. Максимальное содержание кислорода в нейронах составляет 10 мм рт.ст. Приведенные данные свидетельствуют об избирательном использовании оксигенотерапии у больных с ХЛС на фоне ХОЗЛ и туберкулеза.
Профессор В.К. Гаврисюк [11] подчеркивает, что если врач соглашается на проведение оксигенотерапии, то речь идет о 30–40% содержании кислорода в составе воздушно-кислородных смесей, не более!
Бронходилататоры
Основным патогенетическим механизмом легочной гипертензии, возникающим рефлекторно на самых ранних этапах развития ХЛС, является альвеолярная гипоксия. Она развивается как следствие генерализованной обструкции дыхательных путей и нарушения альвеолярной вентиляции. Прямым следствием обструкции бронхов является неравномерность распределения потока вдыхаемого воздуха с нарушением физиологического сопряжения между объемом легочной вентиляции и кровотоком в МКК [17, 18]. Альвеолярная гипоксия, возникающая у больных ХОЗЛ II, III и IV стадии, а также при выраженных формах туберкулеза, сопровождается увеличением давления крови в легочной артерии, способствуя формированию синдрома ХЛС.
Стандарты диагностики и лечения ХОЗЛ нашли полное отражение в приказе МЗ Украины № 128 от 19.03.2007 года. Методики лечения туберкулеза легких, осложненного бронхообструктивным синдромом, разработаны нами [21–23, 34]. Эти методы включают применение b2-агонистов, холинолитиков, кортикостероидов и муколитиков. По нашим данным, сочетание стандартной химиотерапии (ХТ) с патогенетическим лечением БОС у больных ТБ легких способствовало сокращению сроков излечения, что проявилось в прекращении симптомов интоксикации, заживлении каверн, рассасывании очагов бронхогенной диссеминации и абациллировании больных на 2–3 месяца раньше, чем это достигалось в контрольной группе.
Реабилитационный эффект патогенетической терапии БОС проявился значительным и статистически достоверным увеличением всех параметров ФВД, и особенно тех, которые являются адекватными критериями состояния бронхиальной проходимости, а именно: объем фиксированного выдоха за 1-ю секунду (ОФВ1), пиковая объемная скорость (ПОС), МОС25, МОС50, МОС75. Патогенетическая терапия туберкулеза способствовала быстрому исчезновению клинических, рентгенологических и функциональных признаков бронхообструктивного синдрома.
Полноценная этиотропная терапия туберкулеза в сочетании с комплексным лечением БОС сопровождалась уменьшением признаков легочной гипертензии в системе МКК и предотвращала развитие ХЛС.
Последовательность диагностических и лечебных мероприятий при лечении туберкулеза, осложненного бронхообструктивным синдромом, изложена на рис. 3.

Точным критерием диагностики начальных проявлений ХЛС являются ОФВ1 и ПОС. Если величина этих показателей снижается до 40 % от должных значений, что соответствует 3-й степени легочной недостаточности, необходимо использовать инструментальные методы для подтверждения ХЛС. Таким образом, у большинства больных ХОЗЛ и туберкулезом на фоне легочной недостаточности III степени включаются механизмы ХЛС. Поскольку легочная недостаточность III степени сопровождается всегда генерализованной обструкцией дыхательных путей, мы рекомендуем для профилактики развития и лечения ХЛС пользоваться b2-агонистами и холинолитиками одновременно или комбинированным бронходилататором. Если ХЛС прогрессирует и проявляется более выраженным нарушением дыхания в ночное время, то появляются показания для применения холинолитика продленного действия — тиотропиума бромида по 18 мкг 1 раз в сутки. Тиотропиум бромид блокирует холинергические рецепторы 3-го типа (М3), находящиеся непосредственно в гладкой мускулатуре бронхов, и способствует устранению бронхообструкции в верхних и средних дыхательных путях вследствие их дилатации и уменьшения продукции бронхиального секрета. Если бронходилататоры у больных ХОЗЛ и туберкулезом используются правильно и длительно, то легочное сердце не возникает. По общему признанию отечественных и зарубежных ученых, самым эффективным, недорогим и доступным методом профилактики и лечения ХЛС является применение бронходилататоров. Если ХЛС возникает у больных с БА, то в этом случае базисным компонентом лечения БОС являются ингаляционные кортикостероиды.
В соответствии со стандартами лечения ХОЗЛ III и IV степени в ряде случаев возникает резистентность к b2-агонистам, известная как тахифилаксия. С нашей точки зрения, сама тахифилаксия является следствием неправильного применения b2-агонистов. Активаторы b2-адренорецепторов наряду с прямым бронходилатирующим эффектом оказывают сильное противовоспалительное действие в результате активации симпатоадреналовой системы. В условиях физиологии гормон мозгового слоя коры надпочечников — норадреналин начинает поступать в кровь с 5 часов утра, он быстро разрушается, а продукты метаболизма норадреналина активируют кору надпочечников. Интенсивная продукция кортикостероидов начинается с 7 часов утра. Эту последовательность и взаимосвязь между мозговым и корковым слоем надпочечников следует учитывать при лечении больных с ХОЗЛ и БА. Именно поэтому при ХОЗЛ показано применение кортикостероидов. Кроме того, КС возвращают b2-рецепторам утраченную ими чувствительность к симпатомиметикам. При лечении БОС вначале активируют симпатоадреналовую систему при помощи b2-агонистов, а затем проводят ингаляцию кортикостероидами. При лечении БОС не следует забывать и об амброксоле, который активирует синтез и продукцию сурфактанта альвеолоцитами II порядка и возвращает легким воздушность. Под влиянием амброксола восстанавливаются реологические свойства бронхиального секрета и повышается эффективность работы мукоцилиарного аппарата, происходит очищение бронхов, восстанавливается дренажная функция бронхов. Сочетанное применение бронходилататоров, муколитиков и кортикостероидов обеспечивает максимальный лечебный эффект при ХОЗЛ и туберкулезе, осложненных бронхообструктивным синдромом.
Метилксантины
Теофиллин является природным алкалоидом, относящимся к метилированным производным ксантина. Подавляя активность фосфодиэстераз (ФДЭ), теофиллин потенцирует сосудо- и бронхорасширяющие эффекты простагландина и оксида азота; тормозит синтез и высвобождение медиаторов воспаления тучными клетками, в результате чего оказывает противовоспалительный эффект. Теофиллин оказывает благоприятное влияние на гемодинамические показатели МКК, снижает давление в легочной артерии; применяется при ХЛС на почве ХОЗЛ достаточно давно. Еще в 50-е годы ХХ столетия было известно, что теофиллин расширяет бронхи и сосуды МКК, создавая благоприятные условия для наиболее полной оксигенации крови. В настоящее время хорошо изучен механизм лечебного действия теофиллина, который заключается в блокаде ФДЭ, вследствие чего активируется циклическая форма аденозинтрифосфорной кислоты, нормализуются обменные процессы в стенках бронхов и сосудах легких, что способствует вазо- и бронходилатации. Теофиллин оказывает положительное инотропное действие на миокард правого и левого желудочков сердца. Метилксантины способствуют повышению работоспособности дыхательных мышц, в связи с чем они могут предотвратить рефрактерность дыхательной мускулатуры из-за ее усталости и закисления. Тем не менее метилксантины не являются препаратами первого выбора. Мощный сосудорасширяющий эффект теофиллина в отношении сосудов МКК может способствовать нежелательному восстановлению кровотока через невентилируемые альвеолы. Кроме того, всегда возникают проблемы с подбором оптимальной дозы теофиллина, поскольку его терапевтическая доза мало отличается от токсической.
Сердечные гликозиды
Вся история кардиологии начиналась с дигиталиса. В качестве теста, свидетельствующего о достаточности дозы дигиталиса в процессе ее титрования, является частота сердечных сокращений. Если частота пульса снижается до 60 ударов в 1 минуту, то дальнейшее увеличение дозы нужно прекратить. На чем основан механизм действия дигиталиса? На урежении ритма. На ЭКГ можно выявить увеличение продолжительности сердечного цикла (R–R) — в основном за счет диастолы. Во время продолжительного отдыха сердце полностью восстанавливает свой биохимический состав и готовится к следующему мощному сокращению. Лечебное действие дигиталиса связано с тем, что удлинение диастолы создает условия для устранения энергетической недостаточности в миокарде, что, в свою очередь, реализуется в инотропном эффекте дигиталиса.
Брадикардический эффект дигиталиса не всегда полезен больным с ХЛС, поскольку, урежая сердечный ритм, мы создаем предпосылку для уменьшения минутного объема крови. При легочном сердце в результате редукции сосудов МКК систолический объем правого желудочка снижается, по нашим данным, в 2–3 раза, и единственным способом сохранить МОК на должном уровне является тахикардия. Поэтому у больных с ХОЗЛ и туберкулезом, осложненным ХЛС, нужно избегать лекарственных препаратов, урежающих частоту сердечных сокращений.
В связи с этим, не отказываясь полностью от сердечных гликозидов, мы рекомендуем остановить свой выбор при лечении ХЛС на коргликоне и строфантине. Они меньше влияют на сердечный ритм, но обладают положительным инотропным действием и способствуют ликвидации метаболических нарушений в миокарде. Показания для назначения сердечных гликозидов возникают при наличии признаков недостаточности кровообращения. Следует обратить внимание, что практические врачи к числу основных признаков нарушения кровообращения по правожелудочковому типу относят застойные явления с развитием отеков. Но ХЛС не часто сопровождается отечным синдромом. Наша врачебная практика [18] и новая литература по этой проблеме [3] свидетельствуют о том, что застойные явления в системе БКК при ХЛС возникают не так часто [11]. В тех редких случаях, когда на фоне туберкулеза, осложненного хроническим легочным сердцем, отеки все же возникают, они обусловлены амилоидозом и являются результатом гипопротеинемии, при которой лучший эффект дают внутривенные вливания плазмы крови.
Дигоксин применяют при правожелудочковой недостаточности. Этот препарат увеличивает систолический объем правого и левого желудочков сердца. Применение дигоксина при легочной гипертензии и ХЛС согласуется с новыми данными доказательной медицины (класс IIB).
Диуретики
Большинство специалистов утверждают, что при ХЛС диуретики не должны применяться вообще. Имеется ряд аргументов в пользу критичности отношения к применению диуретиков при ХОЗЛ. Что касается ХЛС на почве туберкулеза, то ограничения для этих препаратов еще более строгие. У больных с ХОЗЛ, и особенно при туберкулезе, водно-солевой обмен отрицательный; у них нет лишней влаги, они обезвожены в результате минералокортикоидной недостаточности. Имеются и другие причины, объясняющие нецелесообразность применения диуретиков при ХЛС: в процессе обезвоживания происходит сгущение бронхиального секрета и резкое нарушение функции мукоцилиарного аппарата. Хроническая гипоксия, которая является неотъемлемым компонентом ХЛС у больных с ХОЗЛ и туберкулезом, сопровождается полицитемией, сгущением крови с нарушением ее реологических свойств, ростом сосудистого сопротивления в малом и большом кругах кровообращения.
Прямыми показаниями для применения диуретиков у больных с ХОЗЛ, осложненными ХЛС, может быть легочно-сердечная недостаточность по правожелудочковому типу. Однако отечный синдром у больных с ХЛС встречается не часто. В процессе лечения больных по поводу декомпенсированного легочного сердца необходимо мониторировать функциональное состояние почек и показателей электролитного обмена с целью предотвращения развития осложнений длительной диуретической терапии. Назначение диуретической терапии при легочной гипертензии и ХЛС относят к I классу доказательной медицины.
В последнее время появилась тенденция использовать богатейший опыт кардиологов по лечению болезней левых отделов сердца при ишемической болезни сердца (ИБС), инфаркте миокарда, послеинфарктных состояний, гипертонической болезни в сочетании с ИБС, диастолической дисфункцией желудочков и эндотелиальных дисфункциях [6]. Имеется несколько групп лекарственных препаратов, которые оправдали себя при лечении гипертонической болезни.
β-блокаторы
Они уменьшают возбуждение симпатоадреналовой системы и полезны при ИБС, гипертонической болезни на фоне нарушений сердечного ритма. Это и мерцательная аритмия, и синусовая тахикардия. В этих случаях b-блокаторы уменьшают электровозбудимость миокарда и нормализуют ритм сердца. b-блокаторы показаны в тех случаях, когда гипертоническая болезнь развивается по симпатоадреналовому варианту, когда тахикардия сочетается с нарушением ритма. Учащение ритма идет в основном за счет укорочения диастолы. Возникает диастолическая и систолическая дисфункция левого желудочка. Именно поэтому b-блокаторы при левожелудочковых дисфункциях показаны. Но переносить этот богатый опыт применения b-блокаторов на лечение ХЛС нужно с острожностью. Ведь мы знаем, что в лечении БОС, являющегося главным механизмом патогенеза ХЛС, b2-агонисты занимают видное место. Назначая b2-стимуляторы при ХЛС, мы сознательно усиливаем позицию симпатоадреналовой системы, а в выраженных случаях ХОЗЛ и туберкулеза назначаем дополнительно кортикостероиды. Брадикардический эффект b-блокаторов приводит к уменьшению минутного объема крови, лишает больного ХЛС важного компенсаторного механизма — тахикардии и способствует раннему развитию недостаточности кровообращения.
Ингибиторы ангиотензинпревращающего фермента
Ингибиторы ангиотензинпревращающего фермента (АПФ) с успехом применяются при лечении гипертонической болезни и хронической сердечной недостаточности, обусловленной систолической дисфункцией левого желудочка. Однако у больных ХОЗЛ, осложненных ХЛС, ингибиторы АПФ оказались менее эффективными. Мотивация к применению ингибиторов АПФ для лечения легочной гипертензии и ХЛС повышается в случаях сочетания ХЛС с артериальной гипертензией и ишемической болезнью сердца. Систематическое применение ингибиторов АПФ у больных ХЛС на почве ХОЗЛ и БА может способствовать обострению этих заболеваний с усилением бронхообструктивных изменений вследствие ваготропного действия ингибиторов АПФ, которое проявляется генерализованным бронхоспазмом и усиленным образованием слизистого бронхиального секрета.
Антагонисты кальция
Антагонисты кальция успешно применяются в стандартах лечения гипертонической болезни. Они также благоприятно влияют на легочную гемодинамику [26]. Уменьшая сосудистое сопротивление, они увеличивают ударный объем правого желудочка. Антагонисты кальция, в частности нифедипин и амлодипин, ослабляют легочную вазоконстрикцию гипоксического происхождения и могут вызывать снижение оксигенации крови в результате нарушения оптимального сопряжения между легочной вентиляцией и кровотоком [26]. Известно, что под влиянием кальция замедляется частота сердечных сокращений. Антагонисты кальция блокируют ваготропный эффект кальция и в этом отношении подходят для лечения ХЛС. Отрицательное влияние антагонистов кальция на сократительную способность миокарда может быть преодолено сочетанием их с препаратами дигиталиса. Способность амлодипина и фенигидина снижать легочное артериальное давление, не урежая сердечного ритма, позволяет рассматривать препараты этой группы как обоснованно перспективные для лечения ХЛС. Антагонисты кальция (амлодипин, нифедипин) отнесены к I классу рекомендаций доказательной медицины.
Однако антагонисты кальция оказывают отрицательное инотропное действие на миокард правого и левого желудочков сердца. Они могут усиливать дисфункцию правого желудочка и вызывать декомпенсацию ХЛС. Поэтому антагонисты кальция можно применять у больных ХОЗЛ только в тех случаях, когда исчерпаны другие методы лечения бронхообструктивного синдрома (b2-агонисты, холинолитики, кортикостероиды и муколитики).
Таким образом, антагонисты кальция (амлодипин) являются препаратами выбора при лечении легочной гипертензии и ХЛС.
Блокаторы альдостероновых рецепторов
При лечении ХОЗЛ и туберкулеза, осложненных ХЛС, целесообразно использовать блокаторы альдостероновых рецепторов, например спиронолактон, которые предотвращают прогрессирование ХЛС, эндотелиальную дисфункцию, способствуя нормализации сосудистого тонуса и восстановлению сократительной способности миокарда. Блокаторы альдостероновых рецепторов, в отличие от тиозидных и петлевых диуретиков, оказывают калийсберегающее действие и препятствуют выходу калия из кардиомиоцитов и гладких мышц стенок сосудов. Накопление калия в клеточных структурах легочной ткани под влиянием спиронолактона препятствует проникновению в них ионов натрия и хлора, что способствует дилатации бронхов и сосудов МКК. Калий как внутриклеточный электролит предотвращает дегидратацию легких и препятствует развитию пневмосклероза и эмфиземы легких. При декомпенсации ХЛС и развитии недостаточности кровообращения можно назначать спиронолактон в дозе 100–200 мг/сут в 1 или 2 приема.
Нитраты
Вазодилататоры, такие как нитроглицерин, изосорбида динитрат и молсидамин (корватон, сиднофарм), нашли применение при лечении ИБС, гипертонической болезни, инфаркте миокарда. Имеются некоторые предпосылки для использования нитратов в лечении легочной гипертензии и ХЛС. Все препараты этой группы активно дилатируют венозный отдел БКК, способствуя быстрому уменьшению возврата венозной крови по системе верхней и нижней полых вен к правому отделу сердца, что может сопровождаться кратковременным уменьшением легочной гипертензии.
Однако у больных с ХОЗЛ, особенно при наличии ХЛС, складывается типичная гемодинамическая ситуация, при которой гипердинамия миокарда правого желудочка [12, 18] сердца сочетается с гиподинамией левого желудочка и гиповолемической гиподинамией сосудов БКК. Стойкая гипотония БКК с низкими показателями артериального давления поддерживается прессорно-депрессорным рефлексом В.В. Парина [25]. Кроме того, гипоксемия и гиперкапния также способствуют дилатации сосудов БКК. Поэтому вазодилатирующий механизм нитратов у больных с ХОЗЛ и туберкулезом на фоне ХЛС оказывается невостребованным.
Антикоагулянты
Из классификации ХЛС [3] и данных литературы известно, что диссеминированные заболевания легких, которых более 100, в большинстве случаев сопровождаются поражением сосудов легких по типу хронического эндоваскулита и ДВС-синдрома в МКК. Тромбоэмболию мелких ветвей сосудистой системы легких иначе как ДВС-синдром не назовешь. Тромбоэмболические осложнения при ХЛС — обычное явление, и для их развития в легких при ХЛС имеются все условия. Во-первых, это обезвоживание организма, полицитемия и сгущение крови, повышение активности свертывающих систем крови и нарушение секреторной функции сосудистого эндотелия по синтезу и высвобождению в кровоток биологически активных факторов, способствующих дилатации сосудов, предотвращению гиперкоагуляции и обеспечивающих эффективные фибринолитические свойства сосудистых стенок с выделением оксида азота — эндотелийзависимого фактора сосудистой дилатации и простагландинов I2, E1 и E2. В патогенезе прогрессирующих форм ХЛС имеет значение нарушение равновесия между вазоактивными медиаторами в пользу вазоконстрикции, тромбообразования и гиперпродуктивной пролиферации сосудистых стенок с развитием пневмосклероза и эмфиземы легких. В подобной клинической ситуации может оказаться полезной гепаринотерапия в виде курса подкожных инъекций гепарина с последующим переходом на непрямые антикоагулянты (например, варфарин).
Простагландины (простаноиды)
Простаноиды принимают активное участие в регуляции функции эндотелия, адгезии и агрегации, воспалении и пролиферации клеток в легочных сосудах. Соответственно, недостаточность простациклина (абсолютная или относительная) может играть значимую роль в патогенезе легочной гипертензии. Следовательно, назначение экзогенного простациклина при ЛГ является патогенетически обоснованным. Один из простаноидов с доказанной эффективностью — илопрост. Ингаляционная терапия илопростом увеличивает дистанцию ходьбы в минутах, снижает функциональный класс заболевания, симптомы и качество жизни. Эта терапия эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево, тромбоэмболической болезни и III–IV функциональных классах ЛГ. Рекомендованная доза: 6–9 ингаляций по 2,5–5 мкг илопроста ежедневно с использованием портативного распылителя. Проспективные рандомизированные двойные слепые исследования подтвердили клиническую эффективность и хорошую переносимость ингаляций илопроста.
Ингибиторы фосфодиэстеразы-5
С учетом важной роли дисфункции эндотелия в патогенезе ЛГ применение препаратов, оказывающих непосредственное влияние на продукцию оксида азота, стало еще одним перспективным направлением в лечении этого заболевания. Первый из них — силденафил — специфический ингибитор ФДЭ-5. Этот фермент отвечает за распад цГМФ, посредством которого реализуются эффекты оксида азота. До последнего времени основным показанием для назначения силденафила была эректильная дисфункция. Было установлено, что этот препарат способен снижать давление и сосудистое сопротивление в легочной артерии, увеличивая сердечный выброс у пациентов с ЛГ. Рекомендованная доза составляет 20 мг 3 раза в сутки. Препарат противопоказан больным, принимающим органические нитраты или донаторы оксида азота [29].
Подводя итог обсуждаемой проблеме, следует заметить, что ХЛС возникает вторично чаще всего как результат прогрессирования хронических обструктивных заболеваний и туберкулеза легких. Поэтому можно утверждать, что своевременно начатое полноценное лечение основных заболеваний в соответствии с принятыми стандартами (приказ МЗ Украины № 128 от 19.03.2007 года) является основой профилактики и эффективного лечения ХЛС. Сосудистый эндотелий секретирует в крови большое количество противосвертывающих, противовоспалительных, фибринолитических факторов. И если сосудистые стенки повреждены воспалительным процессом или уже подверглись фиброзно-склеротической трансформации, то они не могут поддерживать внутрисосудистый гомеостаз. Возникает высокая наклонность к тромбообразованию. Появляется необходимость применения фибринолитических средств. ХЛС всегда является следствием тяжелого повреждения сосудов МКК. Поэтому ученые, занимающиеся этой проблемой, большое внимание уделяют вопросам профилактики тромбоэмболических осложнений. Примером может служить кафедра фтизиатрии и пульмонологии Киевского национального медицинского университета им. А.А. Богомольца, на которой выполнены серии научно-исследовательских работ по использованию гепарина, вводимого ингаляционно. Гепарин можно вводить парентерально (5000–10 000 ЕД). В последнее время стали применять низкомолекулярные гепарины. Гепаринотерапия особенно показана в период прогрессирования ХЛС, поскольку каждое обострение ХОЗЛ или туберкулеза сопровождается эндоваскулярными изменениями в сосудах МКК.
Современные источники научной литературы, посвященные данной проблеме [3–5], единогласно признают, что центральное место в патогенетическом лечении ХОЗЛ, туберкулеза, осложненных ХЛС, занимают хорошо изученные методы лечения бронхообструктивного синдрома, нашедшие отражение в международных стандартах и приказах МЗ Украины. В процессе комплексного лечения БОС нормализуется бронхиальная проходимость, повышается эффективность мукоцилиарного клиренса и дренажной функции бронхов в целом, улучшается эффективность альвеолярной вентиляции, повышается оксигенация крови, снижается легочное артериальное давление, предотвращается развитие ХЛС.
На фоне своевременного лечения БОС срабатывают естественные механизмы профилактики развития ХЛС.
Угроза неблагоприятного исхода возникает, когда легочное артериальное давление превышает 70 мм рт.ст. Перегрузка правого желудочка с признаками дилатации является предвестником недостаточности кровообращения по правожелудочковому типу. В этой ситуации показано применение вазодилататоров (нитраты, теофиллин), сердечных гликозидов, не влияющих на частоту сердечных сокращений (строфантин, коргликон). В случае развития отечного синдрома показаны петлевые диуретики типа фуросемида. При длительном применении диуретиков у больных с ХЛС в результате потери ионов хлора и водорода возможно развитие метаболического алкалоза. Для коррекции гипохлоремического алкалоза применяют ингибиторы карбоангидразы (диакарб, фонурит), которые при неоправданно длительном применении вызывают метаболический ацидоз и ряд серьезных осложнений. Их польза при лечении ХЛС в настоящее время оспаривается.
Наряду с медикаментозными методами лечения ХЛС больным с выраженными формами ХОЗЛ и туберкулеза необходимо лимитировать физическую нагрузку, поскольку она может способствовать развитию гипоксии и быть непосредственной причиной сердечной декомпенсации. Больным с ХЛС противопоказано пребывание в условиях высотной гипоксии, поскольку между снижением уровня содержания кислорода в альвеолярном воздухе и высотой давления крови в легочной артерии, в соответствии с рефлексом Эйлера, имеется прямая зависимость.
С целью предупреждения развития легочной гипертензии и хронического легочного сердца у больных с хроническими обструктивными заболеваниями легких, туберкулезом и пылевыми заболеваниями легких необходима клиническая терапия основных заболеваний с использованием бронходилататоров, пролонгированных форм метилксантинов, в показанных случаях — кортикостероидов. Для воздействия на васкулярный компонент ХЛС показано применение антагонистов кальция (амлодипин), ингибиторов АПФ, блокаторов альдостероновых рецепторов (спиронолактон), антиагрегантов и антикоагулянтов.
Список литературы / References
Список литературы находится в редакции