Рекомендации Европейского общества кардиологии по стабильной ИБС 2013 г. микроваскулярная стенокардия
Соболева Г.Н. Карпов Ю.А.
В сентябре 2013 г. были представлены новые рекомендации по диагностике и лечению стабильной ишемической болезни сердца (ИБС) [1]. Среди многих изменений в рекомендациях повышенное внимание привлекает стенокардия при неизмененных коронарных артериях (КА), или микроваскулярная стенокардия. Спектр клинико-патологических корреляций между симптомами и характером изменений КА при стенокардии достаточно широк и варьирует от типичных проявлений стенокардии. обусловленных стенозирующим поражением КА и транзиторной ишемией миокарда, до нетипичного для стенокардии болевого синдрома при неизмененных КА. Это диапазон от атипичного для стенокардии болевого синдрома на фоне значимых стенозов в КА, в конечном итоге приобретающего форму диагноза «стенокардия», до типичной клиники заболевания на фоне неизмененных КА, которое предлагается идентифицировать как «микроваскулярная стенокардия» (МВС) в Рекомендациях от 2013 г. по стабильной стенокардии, или ранее – кардиальный синдром Х (КСХ).
Определение «КСХ» впервые было применено в 1973 г. доктором H.G. Кеmр, обратившим внимание на исследования канадских ученых R. Arbogast и M.G. Bou-rassa. Болевой синдром в этой группе пациентов может отличаться следующими характеристиками:
1) боль может охватывать небольшую часть левой половины грудной клетки, продолжаться от нескольких часов до нескольких дней и не купироваться приемом нитроглицерина;
2) боль может иметь типичные характеристики ангинозного приступа по локализации, продолжительности, но при этом возникать в покое (атипичная стенокардия, обусловленная вазоспазмом);
3) возможно проявление болевого синдрома с типичными характеристиками ангинозного приступа, но более продолжительным по времени без четкой связи с физической нагрузкой и отрицательным результатом стресс-тестов, что соответствует клинической картине МВС.
Диагностика и определение тактики лечения у больных МВС представляют собой сложную задачу. У значительной части пациентов (приблизительно 50% женщин и 20% мужчин) при наличии стенокардии коронароангиография (КАГ) не выявляет атеросклероза эпикардиальных артерий, что указывает на нарушение функции (коронарного резерва) микрососудов [2, 3]. Данные исследования Women’s Ischemia Syndrome Evaluation (WISE), организованного Национальным институтом сердца, легких и крови, продемонстрировали 2,5% ежегодный риск развития неблагоприятных сердечно-сосудистых событий в этой группе больных, включая смерть, инфаркт миокарда, инсульт и сердечную недостаточность [4]. Результаты 20-летнего наблюдения за 17 435 больными в Дании с неизмененными КА и необструктивным диффузным поражением КА со стенокардией показали 52 и 85% повышение риска крупных сердечно-сосудистых событий (сердечно-сосудистая смертность, госпитализация по поводу ИМ, сердечной недостаточности, инсульта) и 29 и 52% повышение риска общей смертности соответственно в этих группах без существенных различий по половому признаку.
Несмотря на отсутствие универсального определения МВС, основным проявлениям заболевания соответствует наличие триады признаков:
1) типичная стенокардия, обусловленная нагрузкой (в комбинации или при отсутствии стенокардии покоя и одышки);
2) наличие признаков ишемии миокарда по данным ЭКГ, холтеровского мониторирования ЭКГ, стресс-тестов в отсутствие других заболеваний сердечно-сосудистой системы;
3) неизмененные или малоизмененные КА (стенозы <50%) [1]. Наиболее чувствительным методом диагностики ишемии миокарда у этих больных является применение фармакологических тестов или ВЭМ-теста в сочетании с однофотонной эмиссионной компьютерной томографией миокарда при введении 99mTc-МИБИ (аналог таллия-201), позволяющего визуализировать дефекты перфузии миокарда как результат нарушенного коронарного резерва в ответ на повышенные метаболические потребности миокарда. Приступы стенокардии могут возникать достаточно часто – несколько раз в неделю, но при этом иметь стабильный характер. Таким образом, МВС является формой хронической стенокардии и по МКБ-10 относится к коду 120.8 «Другие формы стенокардии». Диагноз формулируется в зависимости от функционального класса стенокардии, например «ИБС при неизмененных коронарных артериях. Стенокардия ФК II. (Микроваскулярная стенокардия)».
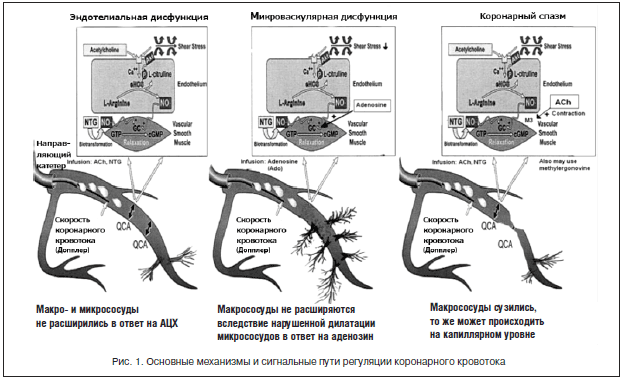
Основной причиной МВС является дисфункция коронарных микрососудов, определяемая как аномальный ответ коронарной микроциркуляции на вазоконстрикторные и вазодилатирующие стимулы. На рисунке 1 представлены основные механизмы и сигнальные пути регуляции коронарного кровотока. В качестве основных причин микрососудистой дисфункции обсуждаются дисфункция эндотелия, гиперреактивность гладкомышечных клеток и повышенная активность симпатической нервной системы [6–8]. Дефицит эстрогенов может способствовать развитию КСХ за счет дисфункции эндотелия (ДЭ) у женщин в постменопаузальном периоде. Известные традиционные факторы риска атеросклероза, такие как дислипидемия, курение, ожирение, нарушение углеводного обмена, также могут влиять на становление дисфункции эндотелия КА с последующим развитием МВС.
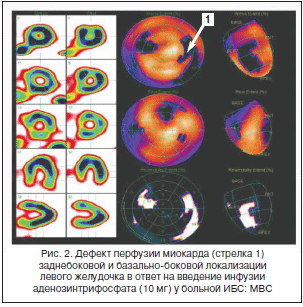
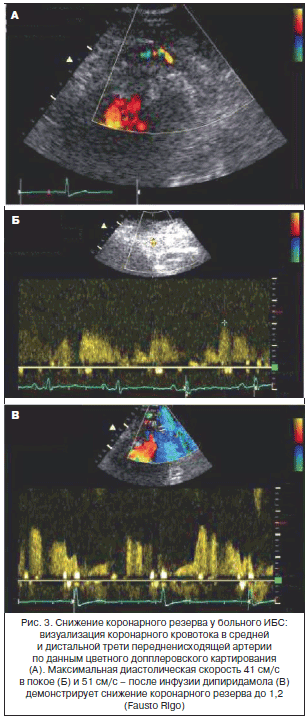
Коронарный резерв, определяемый как соотношение миокардиального кровотока в фазу гиперемии с базальным кровотоком, уменьшается при условии увеличенного базального кровотока либо сокращенного в фазу гиперемии. Базальный кровоток коррелирует с показателями гемодинамики (артериальное давление, нейрогуморальные параметры, метаболизм миокарда, частота сердечных сокращений – ЧСС). Недавно получены данные о наличии замедленного обратного захвата норадреналина в синапсах у женщин, что может объяснять специфичность МВС для женщин и нарушение автономной регуляции тонуса микрососудов со снижением коронарного резерва [9]. Напротив, гиперемический ответ регулируется эндотелийзависимой и эндотелийнезависимой реакцией. Механизмы, вызывающие повреждение гиперемического миокардиального кровотока у больных МВС, в настоящее время не уточнены: часть пациентов демонстрирует дисфункцию эндотелия, другие – аномалию эндотелийнезависимых вазодилатирующих реакций, в частности дефект метаболизма аденозина [10]. Нами впервые продемонстрировано снижение резерва миокардиальной перфузии при проведении АТФ-ОЭКТ миокарда (рис. 2) [11]. Возможно применение дипиридамола для оценки коронарного резерва с помощью трансторакальной ультразвуковой допплерографии (рис. 3), также убедительные доказательства в пользу снижения коронарного резерва были получены в исследованиях с применением позитронно-эмиссионной томографии сердца [12].
Ишемические изменения на ЭКГ и дефекты захвата миокардом таллия во время стресс-тестов идентичны у больных с МВС и обструктивным атеросклерозом эпикардиальных КА, но отличаются отсутствием зон гипокинеза при МВС, что обусловлено небольшими объемами очагов ишемии, частой локализацией их в субэндокардиальной зоне, быстрым вымыванием анаэробных метаболитов и появлением зон с компенсаторной гиперсократимостью сопредельных миоцитов, что существенно ограничивает возможность визуализации таких зон с нарушенной сократимостью [8, 13]. Все же компенсаторное высвобождение аденозина может оказаться достаточным для стимуляции афферентных волокон, вызывающих ощущение боли, что особенно ярко проявляется в условиях повышенной болевой чувствительности, характеризующей пациентов с МВС.
МВС, как было отмечено выше, устанавливается при наличии приступов стенокардии, документированной ишемии миокарда при отсутствии гемодинамически значимых стенозов в КА (стенозы ≤50% или интактные КА) и отсутствии признаков вазоспазма (как это имеет место при вариантной стенокардии Принцметала). Документируется ишемия миокарда обычно нагрузочными тестами, в качестве которых используются велоэргометрия (ВЭМ), тредмил-тест, или 24-часовым холтеровским мониторированием ЭКГ (ХМ-ЭКГ) путем выявления горизонтальной депрессии сегмента ST более чем на 1 мм от точки J на ЭКГ. Следует считать недопустимым практикуемый врачами метод исключения диагноза «ИБС» только выявлением неизмененных КА по данным КАГ у больных с болевым синдромом в грудной клетке, отказ от проведения дополнительных методов исследования, наиболее точно верифицирующих ишемию миокарда, т.к. это приводит к недооценке симптомов стенокардии и неназначению необходимой медикаментозной терапии, что ухудшает течение болезни, требует повторных госпитализаций. Таким образом, достоверная верификация ишемии миокарда у больных КСХ представляется детерминантой, определяющей стратегию и тактику лечения, а значит, и прогноз жизни в этой группе больных. производитель женская одежда ОДДИ
Для больных с МВС характерны низкая воспроизводимость ишемических изменений на ЭКГ при проведении нагрузочных тестов и практически отсутствие возможности выявить зоны гипокинеза по данным стресс-ЭхоКГ [14], что обусловлено развитием субэндокардиальной ишемии вследствие спазма интрамиокардиальных сосудов в отличие от больных с обструктивным атеросклерозом эпикардиальных артерий, соответствующей транмуральной ишемией и систолической дисфункцией миокарда [15, 16].
Верификация ишемии миокарда в этой группе больных возможна:
1) при визуализации дефектов перфузии миокарда в нагрузочных или фармакологических тестах;
2) подтверждением биохимическими методами нарушения метаболизма в миокарде.
В связи с трудоемкостью последней методики основополагающими методами верификации ишемии миокарда у больных МВС являются:
1. Однофотонная эмиссионная компьютерная томография сердца, совмещенная с ВЭМ-тестом или фармтестом. В первом случае при достижении субмаксимальной частоты сердечных сокращений (ЧСС) или ЭКГ-признаков ишемии миокарда во время выполнения ВЭМ-теста пациентам вводят внутривенно 99mTc-МИБИ (99mTc-метоксиизобутилизонитрила) активностью 185–370 мБк с последующим проведением через 1 ч ОЭКТ миокарда и оценкой дефектов перфузии. В случаях с недостаточной информативностью пробы с физической нагрузкой или при ее отрицательных результатах альтернативным методом при проведении радионуклидных исследований перфузии миокарда является метод с использованием фармакологического теста. В этом случае ВЭМ-тест заменяется введением внутривенно фармпрепарата (добутамина, дипиридамола, аденозина). Ранее проводились исследования в ФГБУ РКНПК Минздрава России с введением ацетилхолина интракоронарно и 99mTc-МИБИ внутривенно с целью провокации ишемии миокарда, обусловленной дисфункцией эндотелия [8]. Эти данные в последующем были подтверждены в исследовании ACOVA [17]. Указанный метод продемонстрировал высокую информативность, но не нашел широкого применения из-за инвазивного характера. Применение добутамина представляется нецелесообразным у больных МВС, т.к. ожидаемые эффекты снижения сократимости миокарда вследствие его ишемии будут крайне редки, как и в случае стресс-ЭхоКГ. В настоящее время исследования, проведенные в ФГБУ РКНПК Минздрава России, позволяют рекомендовать в широкой клинической практике способ верификации ишемии миокарда у больных МВС – ОЭКТ миокарда, совмещенную с введением доступного на фармрынке РФ аденозинтрифосфата (АТФ) [11, 18].
2. Интракоронарное введение аденозина с оценкой скорости кровотока методом внутрисосудистого ультразвукового исследования доказывает наличие аномальной скорости кровотока у больных МВС [19].
3. Аномальное соотношение фосфокреатина/АТФ в миокарде у больных МВС по данным МР-спектроскопии [2].
4. Субэндокардиальные дефекты перфузии по данным МРТ сердца [16].
При лечении у всех больных МВС должен быть достигнут оптимальный уровень факторов риска. Подбор симптоматической терапии носит эмпирический характер в силу неуточненной причины заболевания. Результаты клинических исследований не поддаются обобщению в связи с отсутствием единых критериев селекции и немногочисленностью выборок больных, несовершенным дизайном исследования и недостижением эффективности лечения МВС [1].
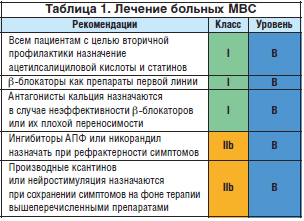
Традиционные антиангинальные препараты назначают на первых этапах лечения. Короткодействующие нитраты рекомендуют для купирования ангинозных приступов, но они часто не оказывают эффекта. В связи с доминирующей симптоматикой стенокардии напряжения рациональной представляется терапия β-блокаторами, положительное влияние которых на устранение симптомов стенокардии доказано в нескольких исследованиях; это препараты первого выбора, особенно у больных с очевидными признаками повышенной адренергической активности (высокая частота пульса в покое или при физической нагрузке).
Антагонисты кальция и пролонгированные нитраты продемонстрировали неоднозначные результаты в клинических исследованиях, их эффективность очевидна при дополнительном назначении к β-блокаторам в случае сохранения стенокардии. Антагонисты кальция могут быть рекомендованы как препараты первой линии в случае вариабельности порога стенокардии напряжения. У пациентов с сохраняющейся стенокардией, несмотря на проводимую оптимальную антиангинальную терапию, могут быть предложены следующие назначения. Ингибиторы АПФ (или блокаторы ангиотензина II) способны улучшить функцию микрососудов, нейтрализуя вазоконстрикторный эффект ангиотензина II, особенно у больных с артериальной гипертонией и сахарным диабетом. Возможно назначение некоторым пациентам с целью подавления повышенной симпатической активности α-адреноблокаторов, влияние которых на симптомы стенокардии остается неочевидным. Улучшение толерантности к физическим нагрузкам у больных МВС продемонстрировано в ходе терапии никорандилом.
Улучшение клинических симптомов достигалось за счет коррекции функции эндотелия при терапии статинами и эстрогензаместительной терапии. Больным с сохраняющейся стенокардией на фоне терапии препаратами, указанными выше, может быть предложено лечение производными ксантинов (аминофиллин, бамифиллин) в дополнение к антиангинальным препаратам с целью блокады аденозиновых рецепторов. Новые антиангинальные препараты – ранолазин и ивабрадин – также продемонстрировали эффективность у больных с МВС (табл. 1). Наконец, в случае рефрактерной стенокардии должны быть обсуждены дополнительные вмешательства (например, чрескожная нейростимуляция).
Литература
1. 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. http://eurheartj.oxfordjournals.org/ content/early/2013/ 08/28/eurheartj.eht296
2. Zipes D.P. Libby P. Bonow R.O. et al. Braunwald’s heartcdisease: a textbook of cardiovascular medicine, 8 edn. Saunders-Elsevier, Philadelphia 66. Zorc-Pleskovic R. Vraspir-Porenta O. Zorc M. et al .2008.
3. Sharaf B.L. Pepine C.J. Kerensky R.A. et al. Detailed angiographic analysis of women with suspected ischemic chest pain (pilot phase data from the NHLBI-sponsored Women’s Ischemia Syndrome Evaluation [WISE] Study Angiographic Core Laboratory // Am. J. Cardiol. 2001. Vol. 87. P. 937–941.
4. Johnson B.D. Shaw L.J. Buchthal S.D. et al. Prognosis in women with myocardial ischemia in the absence of obstructive coronary disease. Results from the National Institutes of Health–National Heart, Lung, and Blood Institute-sponsored Women’s Ischemia Syndrome Evaluation (WISE) // Circulation. 2004. Vol. 109. P. 2993–2999.
5. Jespersen L. Hvelplund A. Abildstrøm S.Z. et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events // Eur. Heart J. 2012. Vol. 33. P. 734–744.
6. Cannon R.O. 3rd, Watson R.M. Rosing D.R. Epstein S.E. Angina caused by reducedvasodilator reserve of the small coronary arteries // J. Am. Coll. Cardiol. 1983. Vol. 1. P. 1359–1373.
7. Camici P.G. Crea F. Coronary microvascular dysfunction // N. Engl. J. Med. 2007. Vol. 356. P. 830–840.
8. Сергиенко В.Б. Самойленко Л.Е. Саютина Е.В. и др. Роль дисфункции эндотелия в развитии ишемии миокарда у больных ИБС с неизмененными и малоизмененными коронарными артериями // Кардиология. 1999. № 1. С. 25–30.
9. Lanza G.A. Giordano A. Pristipino C. et al. Abnormal cardiac adrenergic nerve function in patients with syndrome X detected by [I 123] Metaiodobenzylguanidine myocardial scintigraphy // Circulation. 1997. Vol. 96. P. 821–826.
10. Meeder J.G. Blanksma P.K. van der Wall E.E. et al. Coronary vasomotion in patients with syndrome X: evaluation with positron emission tomography and parametric myocardial perfusion imaging // Eur. J. Nucl. Med. 1997. Vol. 24 (5). P. 530–537.
11. Патент на изобретение: Способ диагностики ишемии миокарда у больных Кардиальным синдромом Х по данным однофотонной эмиссионной компьютерной томографии с 99mТс-МИБИ в сочетании с фармакологической пробой с аденозинтрифосфатом натрия. Заявка N 2012122649, решение о выдаче патента от 22.07.2013г. Г.Н. Соболева, Л.Е. Самойленко, И.Е. Карпова, В.Б. Сергиенко, Ю.А. Карпов.
12. Graf S. Khorsand A. Gwechenberger M. et al. Myocardial perfusion in patients with typical chest pain and normal angiogram // Eur. J. Clin. Investig. 2006. Vol. 36. P. 326–332.
13. Zeiher A.M. Krause T. Schachinger V. et al. Impaired endothelial-dependent vasodilatation of coronary resistance vessels is associated with exercise induced myocardial ischemia // Circulation. 1995. Vol. 91. P. 2345–2352.
14. Рустамова Я.К. Алехин М.Н. Сальников Д.В. и др. Значение стресс-эхокардиографии у пациентов с ангиографически неизмененными коронарными артериями // Кардиология. 2008. № 12. С. 4–9.
15. Camici P.G. Is the chest pain in cardiac syndrome X due to subendocardial ischaemia? // Eur. Heart J. 2007. Vol. 28. P. 1539–1540.
16. Vermeltfoort I.A. Bondarenko O. Raijmakers P.G. et al. Is subendocardial ischaemia present in patients with chest pain and normal coronary angiograms? A cardiovascular MR study // Eur. Heart J. 2007. Vol. 28. P. 1554–1558.
17. Ong P. Athanasiadis A. Borgulya G. et al. High prevalence of a pathological response to acetylcholine testing in patients with stable angina pectoris and unobstructed coronary arteries. The ACOVA Study (Abnormal COronary VAsomotion in patients with stable angina and unobstructed coronary arteries) // J. Am. Coll. Cardiol. 2012. Vol. 59(7). P. 655–662.
18. Gemignani A.S. Abbott B.G. The emerging role of the selective A2A agonist in pharmacologic stress testing // J. Nucl. Cardiol. 2010. Vol. 17. P. 494–497.
19. Rigo F. Gherardi S. Cortigiani L. et al. Long-term survival of patients with chest pain syndrome and angiographically normal or near-normal coronary arteries // Eur. Heart J. 2007. (abstract).
Новые Американские рекомендации по контролю холестерина крови: фокус на здоровый образ жизни и статинотерапию у пациентов группы риска
Резюме. Новое американское руководство концептуально меняет подходы к нормализации липидного обмена
 Американская коллегия кардиологов (American College of Cardiology — ACC) и Американская кардиологическая ассоциация (American Heart Association — AHA) 12 ноября 2013 г. опубликовали онлайн новые клинические практические рекомендации по лечению гиперхолестеринемии. Рекомендации определяют терапевтическую тактику контроля липидного обмена у пациентов с высоким риском развития кардиоваскулярных заболеваний вследствие атеросклероза или уплотнения и стенозирования артерий, являющихся причиной развития инфаркта миокарда и мозгового инсульта.
Американская коллегия кардиологов (American College of Cardiology — ACC) и Американская кардиологическая ассоциация (American Heart Association — AHA) 12 ноября 2013 г. опубликовали онлайн новые клинические практические рекомендации по лечению гиперхолестеринемии. Рекомендации определяют терапевтическую тактику контроля липидного обмена у пациентов с высоким риском развития кардиоваскулярных заболеваний вследствие атеросклероза или уплотнения и стенозирования артерий, являющихся причиной развития инфаркта миокарда и мозгового инсульта.
Новое клиническое руководство определяет 4 основные группы пациентов, у которых применение холестеринснижающих препаратов класса ингибиторов ГМГ-КоА-редуктазы (3-гидрокси-3-метил-глутарил-КоА-редуктазы), или статинов, прогностически является наиболее эффективным с точки зрения профилактики развития инфаркта миокарда или мозгового инсульта. Рекомендации также подчеркивают важность модификации образа жизни для профилактики гиперхолестеринемии и эффективного контроля уровня холестерина крови.
По мнению авторов, новые рекомендации используют наиболее достоверные научные данные доказательной медицины для формирования эффективных терапевтических подходов в лечении пациентов, предполагающих достижение наилучших клинических исходов. Глава рабочей группы по подготовке нового руководства, профессор Медицинской школы Файнберга Северозападного университета (Northwestern University Feinberg School of Medicine), доктор Нейл Стоун (Neil J. Stone) отмечает, что новые рекомендации представляют собой принципиально новую концепцию в сравнении с предыдущим руководством, поскольку в них отсутствует фокус на достижение конкретного целевого уровня липопротеидов низкой плотности (ЛПНП) — так называемого плохого холестерина, — хотя критерии оптимального уровня ЛПНП остались без изменений. Основным отличием новых рекомендаций является установка на определение групп пациентов с наиболее высокой прогностической эффективностью липидстабилизирующей терапии.
Новое американское руководство рекомендует применение умеренной или интенсивной статинотерапии у следующих групп пациентов:
- с диагностированными кардиоваскулярными заболеваниями;
- с повышенным уровнем ЛПНП: ≥4,9 ммоль/л;
- с сахарным диабетом 2-го типа в возрасте 45–75 лет;
- с установленным показателем 10-летнего риска развития кардиоваскулярных событий ≥7,5% в возрасте 45–75 лет (формула расчета 10-летнего кардиоваскулярного риска приведена в рекомендациях).
С точки зрения клинической практики врачам предлагают в большей степени использовать инструменты оценки риска для определения группы пациентов с ожидаемо наилучшими клиническими результатами от проведения статинотерапии, чем фокусироваться лишь на оценке уровня холестерина в крови и его фракций для определения целевой группы больных для применения липидстабилизирующих медикаментов.
Основной ожидаемый эффект новых рекомендаций — большее количество больных, получающих статинотерапию, которым она наиболее показана, и меньшее количество пациентов, получающих статины, которым данные медикаменты не показаны. Авторы также надеются, что, благодаря новому руководству, доктора в большей степени будут склонны к применению статинов в более высоких дозах для достижения наилучших клинических результатов.
Рекомендации подготовлены группой экспертов на базе проведенного анализа результатов рандомизированных контролируемых клинических исследований. Мотивацией для создания нового руководства послужил существенный рост заболеваемости кардиоваскулярной патологией — основной причины смертности и инвалидности в США в настоящее время. Основное внимание рабочей группы было направлено на применение статинов в контексте тщательно проведенного анализа эффективности других холестеринснижающих лекарственных препаратов.
Статины были выбраны вследствие преимуществ эффективности и безопасности их применения в сравнении с другими классами препаратов. Однако для представителей других классов холестеринснижающих препаратов также остается место в клинической практике — например у пациентов с выраженными побочными эффектами, возникающими на фоне приема статинов.
В докладе также акцентируют внимание на важности модификации образа жизни в обеспечении контроля уровня холестерина крови и профилактики кардиоваскулярной патологии. В документе подчеркивают, что здоровый образ жизни — краеугольный камень нормализации липидного обмена в организме человека.
Это особенно важно для людей молодого возраста, поскольку своевременные меры по профилактике гиперхолестеринемии в более поздний период жизни — самый необходимый и наиболее эффективный шаг на пути к сохранению кардиоваскулярного здоровья. В то же время при наличии признаков атеросклероза одна лишь модификация образа жизни вряд ли будет достаточно эффективной для предупреждения развития инфаркта миокарда, мозгового инсульта или кардиоваскулярной смерти — в данном случае применение статинов является необходимым компонентом терапии.
Рекомендации предлагают также рекомендуемую интенсивность проведения статинотерапии для разных групп пациентов. Вместо подхода «чем ниже, тем лучше», часто используемого практическими врачами при применении статинов в комбинации с холестеринснижающими препаратами других классов, эксперты рекомендуют сосредоточить усилия клиницистов на нормализации образа жизни пациентов с применением высокодозовой статинотерапии, устраняя, таким образом, необходимость в дополнительных лекарственных препаратах.
В течение последних лет все внимание клиницистов было направлено на нормализацию уровня ЛПНП. Новые рекомендации не опровергают данные подходы, а всего лишь подчеркивают значимость способов достижения поставленной цели. На основании детального анализа эффективности всех существующих в клинической практике методов и подходов, наиболее эффективной тактикой признано соблюдение здорового образа жизни и проведение статинотерапии. Данные подходы обеспечивают наиболее существенное снижение риска развития инфаркта миокарда и мозгового инсульта у пациента в ближайшие 10 лет.
Предполагают, что новое руководство будет служить практикующим врачам в качестве отправной точки, поскольку у ряда пациентов, не подпадающих под критерии ни одной из названных 4 групп, статинотерапия также может способствовать улучшению клинических исходов. В каждом случае решение следует принимать, исходя из конкретной клинической ситуации.
Полный текст рекомендаций «2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults» будет опубликован в следующих печатных выпусках «Journal of the American College of Cardiology» и «Circulation». В настоящее время он доступен на сайтах ACC (http://content.onlinejacc.org/article.aspx?doi=10.1016/j.jacc.2013.11.002 ) и AHA (http://circ.ahajournals.org/lookup/doi/10.1161/01.cir.0000437738.63853.7a ).
- American College of Cardiology (2013) New guideline for management of blood cholesterol: Focuses on lifestyle, statin therapy for patients who most benefit. ScienceDaily, November 13 (www.sciencedaily.com/releases/2013/11/131112163210.htm).
- Stone N.J. Robinson J. Lichtenstein A.H. et al. (2013) 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults. J. Am. Coll. Cardiol. November 13 [Epub ahead of print].
Рекомендации по лечению артериальной гипертензии (ESH/ ESC) 2013

Это продолжение рекомендаций, разработанных Европейским обществом гипертензии (ESH ) и Европейским кардиологическим обществом (ESC) в 2003 и в 2007 гг.
1 Введение
2 Эпидемиологические аспекты
2.4 Гипертония и общий сердечно-сосудистый риск
2.4.1 Оценка общего сердечно-сосудистого риска
2.4.2 Ограничения
2.4.3 Краткий обзор рекомендаций по оценке общего сердечно-сосудистого риска
3 Диагностическое обследование
3.1 Измерение артериального давления
3.1.1 Артериальное давление, измеренное в кабинете врача или клинике
3.1.2 Артериальное давление, измеренное вне офиса
3.1.3 Изолированная офисная гипертония (или «гипертония белого халата») и маскированная гипертония (илиизолированная амбулаторная гипертония)
3.1.4 Клинические показания к амбулаторному измерению артериального давления
3.1.5 Артериальное давление во время физической нагрузки и лабораторного стресса
3.1.6 Центральное артериальное давление
3.2 Медицинский анамнез
3.3 Физикальное обследование
3.4 Краткий обзор рекомендаций по измерению артериального давления, сбору анамнеза и физикальному обследованию
3.5 Лабораторное и инструментальное обследование
3.6 Генетические исследования
3.7 Выявление бессимптомного поражения органов-мишеней
4 Подходы к лечению
4.1 Доказательства необходимости терапевтического снижения высокого артериального давления
4.2 Когда начинать медикаментозную антигипертензивную терапию
4.2.1 Предыдущие рекомендации
4.2.2 Гипертония 2 и 3 степени и гипертония 1 степени высокого риска
4.2.3 Гипертония 1 степени низкого и среднего риска
4.2.4 Изолированная систолическая гипертония у молодых
4.2.5 Гипертония 1 степени у пожилых
4.2.6 Высокое нормальное артериальное давление
4.2.7 Краткий обзор рекомендаций по назначению антигипертензивной медикаментозной терапии
4.3 Целевые показатели артериального давления
4.3.1 Значения, данные в предшествующих рекомендациях
4.3.2 Больные гипертонией низкого и среднего риска
4.3.3 Гипертония у лиц пожилого и старческого возраста
4.3.4 Пациенты высокого риска
4.3.5 Сравнение концепции «чем ниже, тем лучше» и J- образной кривой
4.3.6 Доказательства выбора целевых значений АД, полученные в исследованиях поражения органов -мишеней
4.3.7 Сравнение целевых значений АД в клинике, в домашних условиях и при амбулаторном мониторировании
4.3.8 Краткий обзор рекомендаций по целевым значениям АД у больных гипертонией
5 Подходы к лечению
5.1 Изменение образа жизни
5.1.1 Ограничение потребления соли
5.1.2 Умеренное потребление алкоголя
5.1.3 Другие изменения питания
6 Подходы к лечению в особых ситуациях
6.10 Цереброваскулярная болезнь
6.11 Болезни сердца
6.12 Атеросклероз, артериосклероз и поражение периферических артерий
6.12.1 Атеросклероз сонных артерий
6.13 Половая дисфункция
6.14 Резистентная гипертония