4.10 Атеросклероз – синдром адаптации к гиперволемии и гипертонии.
Несмотря на значительные общие механизмы макро- и микроангиопатий при сахарном диабете, клинические, да и патоморфологические характеристики этих поражений различны. Характеристика поражения сосудов крупного и среднего калибра при сахарном диабете (макроангиопатия) практически не отличается от атеросклеротического, которое имеет место и у больных без диабета, за исключением того, что указанное поражение сосудов у больных диабетом встречается на 8-10 лет раньше, чем у их сверстников, не страдающих диабетом.
Атеросклероз, который значительно чаще встречается при сахарном диабете, также развивается как результат взаимодействия нескольких факторов риска, к которым относятся гиперлипидемия и дислипидемия, инсулинорезистентность и гиперинсулинемия, гипертензия, повышенная агрегация тромбоцитов, повышение свертываемости крови, снижение фибринолиза, нарушение функции эндотелия сосудов. При сахарном диабете наблюдается [Мацкевичус З.К. 1987] усиление синтеза и отложения коллагена, входящих в состав базальных мембран. Инсулин усиливает катаболизм мембранных коллагенов, способствуя структурной нормализации патологически утолщенных мембран. Инсулин замедляет процесс деградации II типа в матриксе гиалинового хряща.
Связь инсулинорезистентности с активностью атеросклеротических процессов отмечалась неоднократно [Диденко В.А. 1999, Моисеев В.С. и др. 1995, Красильникова Е.И. и др. 1996]. Показано, что использование больших доз инсулина вызывает неблагоприятные сдвиги липидного спектра крови и иммунологических показателей, которые могут участвовать в развитии и прогрессировании атеросклероза и сохраняются даже при снижении доз инсулина [Красильникова Е.И. и др. 1996].
Современные исследования молекулярной биологии раскрыли механизмы гуморальных и клеточных реакций, которые формируют этапы атерогенеза, однако вопрос об этиологическом факторе, который инициирует атеросклероз, и по сей день остается предметом дискуссии [Ridker P.M. и др. 1998]. Многие этиологические факторы [Титов В.Н.,1991], которые запускают единые механизмы морфогенеза, дают основание рассматривать атеросклероз не как нозологическую форму заболевания, а как синдром.
Специфичность атеросклероза детерминирует тканевая инсулинорезистентность: чем “большим является в клетках дефицит эссенциальных ЖК”, тем “выше в крови уровень холестерина, точнее, полиеновых эфиров холестерина)” [Титов В.Н. 1999].
Повреждающее действие избыточного инсулина подтверждается обнаружением некротизированных клеток — эндотелиоцитов, макрофагов. Полагаем, что некрозу подвергнулись клетки не успевшие отреагировать тканевой инсулинорезистентностью. В ответ на гибель клеток запускается синдром аутоимунного неспецифического воспаления. Моноциты поглощают в крови и тканях эндогенные макромолекулы белка после их физиологической денатурации (перекисное окисление, гликирование, формирование иммунных комплексов) [Маянский Ф.Н. 1990].
Массивная клеточная гибель наряду с накоплением липидной и коллагеновой массы, скоплением пенистых клеток, гладкомышечных элементов и макрофагов является одной из основных морфологических характеристик атеросклеротической бляшки. Основной вклад в суммарную клеточную гибель вносит апоптоз. Все клеточные элементы, обнаруживаемые в атеросклеротических бляшках, подвергаются программированной гибели [Сторожаков Г.И. Утешев Д.Б. 2000].
Исследователями отмечается, что повреждение эндотелия вызывает не механическая травма, а сопутствие гемодинамического стресса. Он вызывает структурную перестройку эндотелиального актинового цитоскелета, в результате которой происходит локальное повышение проницаемости сосудистой интимы. Нарушение барьерной функции эндотелия приводит к инфильтрации субэндотелиального слоя клетками крови (лимфоцитами и макрофагами), белками плазмы (альбумином, С-реактивным белоком, сывороточным амилоидом А и др.), усилению секреции сосудосуживающего эндотелина-1. Наблюдается локальный синтез холестерина в сосудистой стенке, повышение синтеза и секреции коллагена и эластина. Это приводит к утолщению, снижению элластичности стенок артерий. Накопление продуктов метаболизма блокирует дренажную систему ткани.
Предполагают [Сторожаков Г.И. Утешев Д.Б. 2000], что в патогенезе атеросклероза коронарных сосудов сердца участвует апоптоз. При этом апоптоз должен "работать" практически на всех уровнях процесса: он должен элиминировать поврежденные эндотелиальные клетки сосудов, удалять мигрировавшие в интиму гладкомышечные клетки, устранять нагруженные липидами пенистые клетки и т.д. И действительно, на финальных стадиях эволюции атеромы, особенно в ядре атеросклеротической бляшки, состояние гиперплазии сменяется гипоплазией. Однако на начальных этапах развития атеросклероза этого не происходит. Другими словами, можно заподозрить общую несостоятельность апоптоза как ключевого фактора в патогенезе атеросклероза. Отсюда логическим продолжением будет допущение того, что существует некий единый механизм, контролирующий апоптоз всех клеток внутри органа или организма в целом. Полагаем, что его способна вызвать инсулинорезистентность.
Фиброзные бляшки предшествуют окклюзии сосудов. Их локализация фокальна, они не всегда располагаются на месте ранее существовавших жировых уплотнений. Характерная локализация фиброзных бляшек, определяется гемодинамическими условиями [Gerrity R. 1990]. Эти области характеризуются повышенной проницаемостью эндотелия и накоплением различных макромолекул даже у здоровых животных. В условиях же гиперлипидемии в этих участках наблюдается увеличение поглощения и накопления атерогенных липопротеидов низкой плотности через интактный эндотелий сосудов.
Гистологически такие бляшки состоят из нескольких слоев гладкомышечных клеток, некоторые из которых окружены липидсодержащими коллагеновыми фибриллами, фрагментами эластина и различными матричными соединениями, содержащими большое количество протеогликанов, образующими своеобразную “фиброзную шапочку”, которая отличается от основной бляшки количеством “липидсодержащих” макрофагов, а также значительным количеством внеклеточных липидов и различных некротических клеточных фрагментов. Фиброзные бляшки со временем подвергаются различным повреждениям. вследствие некроза, кальцификации, интрамурального тромбоза, что приводит к резкому увеличению их объема и блокаде (окклюзии) просвета сосуда.
Кальцификация сосудов является важной особенностью атеросклероза, но механизмы сосудистой кальцификации все еще неизвестны. Поскольку связанные с костью белки, такие, как остеонектон и Gla белок матрикса, были обнаружены в кальцифицированных сосудистых тканях, кальцификация стала рассматриваться как организованный, регулируемый процесс, сходный с минерализацией ткани кости. Клетки гладкомышечной мускулатуры сосудов сейчас рассматривают как ответственные за сосудистую кальцификацию. Апоптоз гладкомышечных клеток, по-видимому, является ключевым фактором в этом процессе, в то время как другие факторы, включая межклеточные взаимодействия (макрофагов и гладкомышечных клеток), липидов и уровень неорганического фосфата плазмы модулируют процесс кальцификации [Trion A, van der Laarse A. 2004].
Сосуды больных с атеросклерозом способны выдержать внезапные, чрезмерные и длительные повышения АД без видимых дефектов. Вместе с тем формирование атеросклеротической бляшки может являться механизмом окклюзии сосуда, питающего область органа с наиболее выраженными процессами дистрофии, выключая его из общего кровотока. Это подтверждается преобладанием ишемических осложнений атеросклероза и редкостью геморрагических. Заболеваемость ишемическим инсультом при сахарном диабете в 2–3 раза выше по сравнению с общей заболеваемостью [Stegmayr B. Asplund K. 1995].
На основании четкой связи начала атеросклероза с нарушением проницаемости для липопротеидов, обнаружением при атеросклерозе погибших клеток, сопутствия репаративного воспаления, связь локализации фиброзных бляшек с гемодинамическими условиями, кальцификации с избытком кальция, полагаем, что атерогенез является компенсаторным защитным механизмом, направленным на укрепление стенки сосуда, препятствуя его разрыву.
Атеросклероз облитерирующий
Атеросклероз облитерирующий (синоним артериосклероз облитерирующий) — атеросклеротическое поражение стенки аорты и крупных магистральных артерий, приводящее к запустеванию их просвета. Возникающие в результате стеноза и облитерации сосудов затруднения кровотока, вплоть до полного его прекращения, обусловливают в свою очередь такие особенности клинической картины и показания к лечебному вмешательству, что данная форма атеросклероза рассматривается отдельно от других форм. Длительно существующая атеросклеротическая бляшка постепенно суживает просвет кровеносного сосуда. До сужения на 80% первоначального диаметра сосуд оказывается функционально достаточным. Дальнейшее стенозирование ведет к декомпенсации. При расспросе больного всегда удается установить длительный характер заболевания. Клиническим проявлением облитерирующего А. является ишемия соответствующих областей тела. По локализации ишемических расстройств различают следующие синдромы.
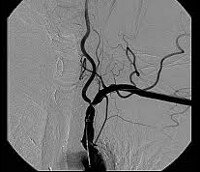
Рис. 4. Схема окклюзии брахиоцефальных артерий.
1. Окклюзия брахиоцефальных артерий (синдром Такаясу, рис. 4). Вследствие артерий ишемии головы и лица возникают головные боли, головокружение, нарушение зрения, атрофия мягких тканей лица. Ишемия верхних конечностей проявляется так называемое перемежающейся «хромотой» верхних конечностей. Окклюзии могут подвергаться сосуды, отходящие непосредственно от дуги аорты. С изолированной окклюзией безымянной артерии связан так называемый безымянный синдром, который характеризуется отсутствием пульса на сонной и подключичной артериях, быстрой утомляемостью, атрофией мышц плечевого пояса, болями и нарушением кровоснабжения головного мозга по системе правых сонной и позвоночной артерий. При этом отмечаются односторонние монопарезы и параличи, окулопирамидные расстройства, расстройства кровоснабжения стволового отдела мозга (вертебробазилярная недостаточность). Степень таких нарушений тем больше, чем меньше компенсаторные возможности коллатералей (система виллизиева круга).
Различают также изолированный «подключично-позвоночный синдром» при окклюзии подключичной артерии в месте отхождения от нее позвоночной артерии и изолированный «подключичный синдром», когда позвоночная артерия свободна от склеротических изменений (в последнем случае кровоснабжение головного мозга не страдает и имеются только явления ишемии правой верхней конечности). Склеротические сужения и окклюзии внутренней сонной артерии проявляются соответствующим монопарезом. Таким образом, клинические проявления синдрома окклюзии брахиоцефальных артерий весьма многообразны.
2. Окклюзия брыжеечной и чревной артерий (синдром брюшной жабы, рис. 5) проявляется постоянными болями в брюшной полости, прогрессивным похуданием, поносами и потерей веса. Заболевание распознается только при рентгенографии брюшной аорты. Синдром окклюзии почечной артерии проявляется реноваскулярной гипертонией, имеющей злокачественное течение.
3. Окклюзия бифуркации аорты (синдром Лериша, рис. 5 и 6) наблюдается у молодых людей, страдающих облитерирующим эндартериитом, и у пожилых, причем атеросклеротическая природа заболевания в этих случаях установлена с несомненностью.
Рис. 5. Схема окклюзии брыжеечных и почечных артерий, бифуркации аорты (синдром Лериша) и бедренной артерии.
Рис. 6. Синдром Лериша — окклюзия бифуркации аорты.
Рис. 7. Окклюзия бедренной артерии.
4. Окклюзии бедренных и подколенных артерий также часто бывают атеросклеротического происхождения (рис. 7). Выше и ниже окклюзии стенка сосуда бывает относительно неизмененной. Случаи поражения сосуда на значительном протяжении встречаются относительно редко.
Диагностика облитерирующего атеросклероза основывается на констатации ишемии той или иной области; необходимо точно распознать место, протяженность и характер изменений сосуда, а также выяснить состояние коллатерального кровообращения. С диагностической целью широко применяют осциллографию, термометрию, капилляроскопию, реографию (рис. 8) и особенно ангиографию, без которой невозможно решение вопроса о хирургическом лечении (см. Аортография, Ангиография). Дифференциальная диагностика облитерирующего атеросклероза должна проводиться прежде всего с облитерирующим эндартериитом (см.). Как правило, облитерирующий А. поражает больных старше 40 лет, а эндартериит — моложе 40 лет. Облитерирующий атеросклероз характеризуется более доброкачественным и продолжительным течением; заболевание иногда длится 10—12 лет и более, так что коллатерали могут постепенно компенсировать кровообращение в большой мере. Хорошая компенсация, малый процент гангрен — отличительная особенность облитерирующего А. Однако чем дистальнее обтурирован сосуд, тем раньше развивается гангрена.
Лечение консервативное менее успешно, чем при облитерирующем эндартериите, так как при облитерирующем атеросклерозе имеется анатомический перерыв просвета сосуда, а спастический компонент менее выражен. Хирургическое лечение облитерирующего А. может быть реконструктивным и паллиативным (см. Симпатэктомия). Последнее обычно малоэффективно (по тем же причинам, что и консервативное лечение). Реконструктивная операция состоит в удалении атеросклеротической бляшки и измененной интимы, иногда на значительном протяжении, и последующем наложении сосудистого шва (эндартериоэктомия или интимотромбэктомия; см. Кровеносные сосуды, операции). Чтобы избежать сужения сосуда на месте шва, применяют наложение «заплаты» либо из венозного аутотрансплантата, либо из пластмассовой ткани. Заплата может иметь в длину до 40 см и более (бедренные артерии), чаще же 6—8 см. При значительном разрушении, кальцинозе сосудистой стенки в отдельных случаях по строгим показаниям пораженный участок резецируют и дефект восполняют ауто-, гомо- или аллотрансплантатом. Операция находит применение при облитерирующем атеросклерозе брахиоцефальных артерий и в некоторых случаях окклюзий бедренных артерий. При весьма протяженном поражении сосуда (вся бедренная и часть подколенной артерии) предпочтительнее операция обходного шунтирования, т. е. создания коллатерального сосуда с использованием собственной вены или консервированного гомотрансплантата. Существующие аллопластические протезы для операции обходного шунтирования на бедренной артерии мало пригодны вследствие большого процента неудач в отдаленном послеоперационном периоде. Исходя из особенностей поражения в каждом отдельном случае, можно применить тот или иной способ, а также комбинацию различных способов реконструктивного вмешательства на сосуде. Успешная реконструктивная операция полностью устраняет все болезненные явления, вызванные окклюзией данного сосуда, но сама причина окклюзий — облитерирующий атеросклероз — может еще в дальнейшем дать повод для новых вмешательств на том же или на других сосудах.
Рис. 8. Реограммы при окклюзии правой бедренной артерии: 1 — ЭКГ (11 отведение); 2 — 7 — реограммы (2 — правого бедра, 3 — левого бедра и голеней, 4 — правой голени, 5 — левой голени, 6 — правой стопы, 7 — левой стопы).
Принципы хирургического лечения облитерирующего атеросклероза
Расширение просвета сосуда изнутри — ангиопластика и стентирование. Этот метод подразумевает введение в просвет артерии специального баллона, который раздуваясь сминает атеросклеротическую бляшку, чем восстанавливается просвет. Для укрепления стенки сосуда имплантируется специальная сетка — стент
Шунтирование — это обход закупоренного сосуда специальным искусственным сосудом или собственной веной. Кровоток восстанавливается ниже закупоренного участка