ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ АТРИОВЕНТРИКУЛЯРНОЙ БЛОКАДЫ II–III СТЕПЕНИ И ЭФФЕКТИВНОСТЬ ЭЛЕКТРОКАРДИОСТИМУЛЯЦИИ У БОЛЬНЫХ ОСТРЫМ ИНФАРКТОМ МИОКАРДА
Специальность 14.01.05 – Кардиология А В Т О Р Е Ф Е Р А Т диссертации на соискание ученой степени кандидата медицинских наук
ПЕНЗА – 2012
Работа выполнена в ГБОУ ДПО «Пензенский институт усовершенствования врачей» на кафедре терапии, кардиологии и функциональной диагностики.
Научный руководитель – доктор медицинских наук, профессор ИСКЕНДЕРОВ Бахрам Гусейнович
Официальные оппоненты: ШУТОВ Александр Михайлович доктор медицинских наук, профессор, ФГБОУ ВПО «Ульяновский государственный университет», заведующий кафедрой терапии и профессиональных болезней;
ГРИЦЕНГЕР Виктор Романович доктор медицинских наук, профессор, ГБОУ ВПО «Саратовский государственный медицинский университет им. В. И. Разумовского», профессор кафедры терапии ФПК и ППС Ведущая организация – ФГБУ «Саратовский научноисследовательский институт кардиологии»
Защита диссертации состоится «___» _________ 2012 г. в ____ часов, на заседании диссертационного совета ДМ 212.186.07 в ФГБОУ ВПО «Пензенский государственный университет» по адресу:
440026, г. Пенза, ул. Красная, 40.
С диссертацией и авторефератом можно ознакомиться в библиотеке ФГБОУ ВПО «Пензенский государственный университет».
Автореферат разослан «____» _______________ 2012 г.
Ученый секретарь диссертационного совета КАЛМИН Олег Витальевич
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Частота развития атриовентрикулярных (АВ) блокад II и III степени при остром инфаркте миокарда (ОИМ) колеблется от 6 до 15 % (Сыркин А. Л. 2003; Чазов Е. И. Голицын С. П. 2008; Ben Ameur Y. et al. 2003; Bhalli M. A. et al. 2009). Известно, что при передней локализации инфаркта миокарда, осложненного АВ блокадой III степени, прогноз значительно хуже и смертность без применения временной трансвенозной электрокардиостимуляции (ЭКС) достигает 80 % (Сыркин А. Л. 2004; Gomez J. F. et al. 2007;
Hreybe H. Saba S. 2009).
Применение временной трансвенозной ЭКС позволяет в большинстве случаев вывести больного из состояния кардиогенного шока и эффективно предупреждает синкопальные приступы (Люсов В. А. Колпаков Е. В. 2009; Ревишвили А. Ш. 2009;
Julian D. G. Lassers B. W. Godman M. J. 2006; Stojkovi A. et al. 2006). Однако АВ блокада II–III степени, осложняющая течение ОИМ, может носить более стойкий характер и даже сохраняться после госпитального периода лечения (Garca C. et al. 2005; Gang J. O.
et al. 2011). В связи с этим приобретает актуальное значение вопрос о сроках и показаниях имплантации искусственного водителя ритма (ИВР).
В современных рекомендациях по проведению клинических электрофизиологических исследований, катетерной аблации и имплантации антиаритмических устройств АВ блокады II–III степени, осложняющие течение ОИМ, отнесены в отдельную группу показаний к постоянной ЭКС (Рекомендации Всероссийского научного…, 2007; Epstein A.E. et al. 2008). При этом установлены только электрокардиографические показания (абсолютные и относительные) к имплантации ИВР – наличие как устойчивой, так и преходящей АВ блокады II–III степени, сочетающейся с полной блокадой ножек пучка Гиса (Vardas P. E. et al. 2007). Однако научнообоснованные положения о сроках и клинических показаниях имплантации ИВР пока не разработаны, и мнения специалистов по этому вопросу противоречивы (Ардашев В. Н. Ардашев А. В. Стеклов В. И. 2009; Trohman R. G. Kim M. H. Pinski S. L. 2004).
Считают, что ближайший прогноз у данной категории больных в основном зависит от величины некроза миокарда, степени дисфункции левого желудочка и динамики АВ блокады II–III степени, и поэтому операция имплантации ИВР может быть отсроченной (Рекомендации Всероссийского научного…, 2007; White H. D. Chew D. P. 2008). Несомненно, что для определения оптимальных сроков и показаний имплантации ИВР важно проведение проспективных наблюдений за состоянием АВ проведения у больных, перенесших инфаркт миокарда, осложненный АВ блокадой II–III степени, в том числе на фоне постоянной ЭКС.
Учитывая недостаточную изученность и противоречивость вопросов имплантации ИВР у больных с ОИМ, осложненным АВ блокадой II–III степени, важно проведение клинического исследования с целью уточнения оптимальных сроков и показаний к данной операции.
Цель исследования: улучшить эффективность лечения и качество жизни больных, перенесших инфаркт миокарда, осложненный АВ блокадой II–III степени, путем оптимизации сроков и показаний имплантации ИВР.
Задачи исследования:
1) изучить частоту, сроки развития и продолжительность АВ блокады II–III степени у больных с ОИМ;
2) определить предикторы АВ блокады II–III степени и оценить влияние тромболитической терапии (ТЛТ) на частоту развития и прогноз АВ блокады II–III степени у больных с ОИМ;
3) оценить состояние центральной гемодинамики при АВ блокаде II–III степени и эффективность временной трансвенозной ЭКС у больных ОИМ;
4) изучить динамику АВ проведения в течение года после инфаркта миокарда, осложненного АВ блокадой II–III степени, и уточнить показания и сроки операции имплантации ИВР;
5) оценить психоэмоциональное состояние, качество жизни и выживаемость больных с ИВР, перенесших инфаркт миокарда.
Научная новизна. Впервые проводилась оценка динамики АВ блокады II–III степени, в том числе на фоне постоянной ЭКС, в течение года после перенесенного инфаркта миокарда. Выявлено, что если АВ блокада II–III степени сохранялась более двух недель у больных ОИМ, то в 49,5 % случаев она носит стабильный характер в течение года, в 40,2 % случаев отмечается перемежающее (интермиттирующее) течение АВ блокады и лишь в 10,3 % случаев наблюдается стабильное восстановление АВ проведения. При сохранении АВ блокады II–III степени меньше одной недели у 72,7 % больных выявляется стабильно нормальное АВ проведение, у 11,9 % больных – рецидивирующее течение АВ блокады II–III степени и лишь у 8,3 % больных – стабильная АВ блокада II–III степени.
Установлены предикторы АВ блокады III степени у больных с крупноочаговым ОИМ. Женский пол ассоциируется с увеличением относительного риска развития АВ блокады III степени в 1,72 раз, проведение тромболитической терапии – в 2,08 раз, наличие острой сердечной недостаточности выше 2 класса по Killip – в 2,79 раз, перенесенный крупноочаговый инфаркт миокарда в анамнезе – в 2,49 раз и предшествующая полная блокада ножек пучка Гиса – в 3,55 раз.
Определены критерии, позволяющие конкретизировать сроки и показания к операции имплантации ИВР. Электрокардиографическими показаниями являются дистальная АВ блокада II степени 2:1 и субтотальная блокада, АВ блокада III степени стабильно сохраняющаяся более 10 суток и более двух недель при перемежающем течении блокады. При наличии осложнений инфаркта миокарда (тромбоэндокардит, острая аневризма сердца, тромбоэмболии) и замедленном темпе восстановления зоны поражения или рецидива инфаркта, а также при адекватном гемодинамическом эффекте временной ЭКС операция имплантации ИВР является отсроченной.
Практическая значимость работы. Установлено, что в группе больных ОИМ, получавших ТЛТ, по сравнению с больными без ТЛТ, частота развития АВ блокады II–III степени (8,9 и 14,1 % соответственно) и госпитальная летальность достоверно ниже (22,6 и 40,5 % соответственно; p 0,05).
При сравнительном анализе частоты и характера осложнений, возникших на фоне временной ЭКС (1-я группа) и после имплантации ИВР (2-я группа), выявлены существенные различия (табл. 2). Так, в 1-й группе в 30,3 % случаев диагностировалась пейсмекерная желудочковая экстрасистолия и в 13,2 % случаев – пароксизмальная желудочковая тахикардия. Кроме того, в 1-й группе рецидив инфаркта миокарда, гнойно-септические осложнения и дислокация электрода, вызвавшая неэффективность ЭКС, наблюдались реже, чем во 2-й группе.
Таблица Сравнение осложнений в группах больных, которым проводилась временная ЭКС и имплантация ИВР Характер осложнений 1-я группа 2-я группа (n = 386) (n = 97) Пейсмекерная желудочковая экстрасистолия 117 / 30,3 8 / 8,Пароксизмальная желудочковая тахикардия 51 / 13,2 2 / 2,Тромбоэмболические осложнения 19 / 4,9 – Рецидив инфаркта миокарда 48 / 12,4 5 / 5,Гнойно-септическое осложнение 15 / 3,9 1 / 1,Дислокация электрода, вызвавшая 82 / 21,4 2 / 2,неэффективность ЭКС Госпитальная летальность 112 / 29,0 – Анализ сроков имплантации ИВР показал, что сроки операции при АВ блокаде II степени составляли 15,9±4,2 сутки, при проксимальной АВ блокаде III степени – 17,9±3,4 сутки и дистальном типе – 14,4±3,5 сутки (p Авторефераты по всем темам >> Авторефераты по медицине
ИНФАРКТ МИОКАРДА
ИНФАРКТ МИОКАРДА — заболевание сердца, обусловленное острей недостаточностью его кровоснабжения, с возникновением очага некроза в сердечной мышце; важнейшая клиническая форма ишемической болезни сердца.
Главные факторы патогенеза: коронаротромбоз (острая закупорка просвета артерии), приводящий к крупно-очаговому, чаще ктрансмуральному, некрозу миокарда; коро-наростеноз (острое сужение просвета артерии набух’ией ате-росклеротической бляшкой, пристеночным тромбом) с круп-носнаговым, как правило, инфарктом миокарда; стенозирующий распространенный коронаросклероз (резкое сужение просвета 2-3 коронарных артерий) обычно на фоне значительно выраженного миокардиосклероза, приводящий к так называемым мелкоочаговым, чаще — субэндокардиальным инфарктам миокарда. Последняя категория инфарктов миокарда отнюдь не является «мелкой» по своему клиническому значению, по частоте осложнений и по последствиям для больного, в особенности это касается субэндокардиальных инфарктов в тех случаях, когда они обнаруживаются электрокардиографически во всех стенках левого желудочка сердца (летальность при таких инфарктах миокарда существенно превышает летальность при трансмурапьных инфарктах).
Симптомы, течение. Началом инфаркта миокарда считают появление приступа интенсивной и продолжительной (более 30 мин, нередко многочасовой) загрудинной боли (ангинозное состояние), не купирующейся повторными приемами нитроглицерина; реже в картине приступа преобладает удушье или боль сосредотачивается в подложечной области (астматическая и гастралгическая формы острого инфарктного приступа). Осложнения острого приступа: кардиоген-ный шок; острая левожелудочковая недостаточность вплоть до отека легких; тяжелые тахиаритмии с артериальной гипо-тензией, внезапная клиническая смерть следствие фибрил-ляции желудочков (реже асистолии). Желудочковые эктопические аритмии в первые часы после острого приступа часто отражают восстановление проходимости венечной артерии (лизис тромба), наступившее либо спонтанно, либо под действием тромболитической терапии (стрептодеказа и другие тромболитические препараты).
В остром периоде наблюдаются артериальная гипертензия (часто значительная), исчезающая после стихания боли и не требующая применения гипотензивных препаратов; учащение пульса (не всегда); повышение температуры тела (со 2-3-х суток); гиперлейкоцитоз, сменяющийся стойким повышением СОЭ; в сыворотке крови — преходящий прирост гликемии, азотемии, уровня фибриногена, активности ферментов — креатинкиназы и ее миокардиального изофермен-та (в пределах первых 48 ч), АсАТ (в пределах 72 ч), ЛДГи ее изофермента ЛДГ, (в пределах 5 сут); эпистенокардический перикардит (боль в области грудины, особенно при дыхании, нередко шум трения перикарда, выслушиваемый улевого края грудины).
На серии ЭКГ отмечаются значительный, часто куполообразный подъем сегментов ST, затем — появление уширенных (не менее 0,04 с) зубцов Q, снижение амплитуды зубцов R или возникновение QS-формы желудочкового комплекса (иногда лишь спустя 24-48 ч и даже 3-5 дней от начала инфаркта миокарда) в отведениях, соответствующих преимущественной локализации очага (зоны) поражения в сердечной мышце. Около 1 /4 всех крупноочаговых инфарктов миокарда либо не сопровождаются убедительными изменениями на ЭКГ (особенно при повторных инфарктах, при внутри-желудочковых блокадах), либо такие изменения выявляются лишь в дополнительных отведениях. Диагностически доказательны изменения не на одной ЭКГ, а только определенная последовательность изменений комплекса QRS и сегмента ST, зарегистрированная на серии ЭКГ.
Осложнения госпитального периода инфаркта миокарда: эйфория, некритичное поведение, вплоть до психотического состояния; возобновление болей в груди вследствие рецидива инфаркта, появления фибринозного перикардита, резких колебаний частоты и регулярности ритма сердца, присоединения инфаркта легкого (плеврит!), формирование внешнего разрыва миокарда; пароксизмы тахиаритмии, а также ранние (вблизи зубца Г предшествующего кардиокомплекса) поли-топные и групповые желудочковые экстрасистолы; атриовен-трикулярная блокада I!-II! степени; синдром слабости синусового узла; аневризма левого желудочка; внезапная смерть (аритмия терминального характера или разрыв сердца с ге-мотампонадой перикарда); острая сердечная недостаточность; кардиогенный шок; тромбоэмболии в системе легочной артерии. Редкие осложнения: эмболический инфаркт головного мозга; тромбоэмболии ветвей брыжеечной артерии; профуз-ное кровотечение из острых трофических язв слизистой оболочки желудка, кишечника; острое расширение желудка; эмболия артерий нижних конечностей; «постинфарктный синдром» (Дресслера); разрыв межжелудочковой перегородки; разрыв папиллярной мышцы.
Сердечная недостаточность нередко проявляется впервые лишь тогда, когда больной начинает ходить, и оказывается причиной «поздних» инфарктов легких (тромбоэмболия ветвей легочной артерии).
Диагноз инфаркта миокарда доказателен при одновременном наличии у больного клинической картины ангинозного приступа (или астматического его эквивалента), гиперфер-ментемии в типичные сроки, характерных изменений на ЭКГ, описанных выше. Типичная клиническая картина болевого приступа с появлением (в характерной последовательности) гиперлейкоцитоза, гипертермии, увеличенной СОЭ, признаков перикардита заставляет предполагать инфаркт миокарда и проводить соответствующее лечение больного даже в том случае, если на ЭКГ отсутствуют доказательные для инфаркта изменения. Диагноз подтверждается анализом дальнейшего течения болезни (выявление гиперферментемии, осложнений, в особенности левожелудочковой недостаточности). Подобным же образом обосновывается ретроспективное диагностическое предположение об инфаркте миокарда, осложняющем течение других болезней или послеоперационного периода.
Для диагноза мелкоочагового инфаркта необходимо наличие у больного названных выше 3 компонентов, но интенсивность и продолжительность болевого приступа, реактивные сдвиги со стороны крови, температуры тела, активности ферментов сыворотки, а также изменения ЭКГ выражены обычно в меньшей степени. Достоверность диагноза, основанного лишь на появлении отрицательных зубцов Гна ЭКГ в отсутствие убедительных клинико-лабораторных данных, сомнительна. Как правило, мелкоочаговый инфаркт наблюдается у лиц, много лет страдающих ишемической болезнью сердца и кардиосклерозом с различными его осложнениями, число и тяжесть которых, а также наклонность к рецидивированию возрастают с присоединением инфаркта, чем и определяются как продолжительность и отя-гощенность течения последнего, так и серьезность ближайшего и отдаленного его прогнозов. Если же он возникает в ранней, начальной фазе ишемической болезни сердца, то нередко оказывается предвестником тяжелого трансмурапь-ного инфаркта сердца, развивающегося несколько дней или недель спустя. Этими двумя особенностями определяются клиническая и прогностическая оценки мелкоочагового инфаркта и выбор тактики лечения. Дифференциальный диагноз инфаркта миокарда проводится с перикардитом (см.), с эмболией легочной артерии (см,), со спонтанным пневмотораксом (см.), с массивным внутренним кровотечением (см.), с острым панкреатитом (см.), с расслаивающей гематомой аорты (см.). Мелкоочаговый инфаркт миокарда отличают от коронарогенной очаговой дистрофии миокарда, от дис-гормональной (климактерической) кардиопатии (см. Кар-диалгии).
Лечение. Основная помощь при инфаркте миокарда: 1) непрерывное воздействие нитратами; 2) введение либо препарата, лизирующего тромб, либо прямого антикоагулянта внутривенно; 3) применение препарата, блокирующего бета-адренергические влияния на сердце; 4) введение хлорида калия в составе поляризующей смеси. Совокупность этих мер, в особенности если они приняты в первые часы заболевания, направлена на ограничение размера повреждения миокарда в инфарктной и периинфарктной зонах.
При ангинозном состоянии нитроглицерин применяют без промедления, сначала субпингеально (0,0005 г в таблетке или 2 капли 1 % спиртового раствора) многократно с интервалом в 2-3 мин до тех пор, пока интенсивность ангинозной боли существенно слабеет, а тем временем устанавливают систему для в/в капельных инфузий и продолжают воздействие нитроглицерином с помощью в/в непрерывного его введения. С этой целью йодный (не спиртовой!) 0,01 % раствор нитроглицерина, содержащий 100 мкг препарата в 1 мл, разводят стерильным изотоническим раствором хлорида натрия с таким расчетом, чтобы скорость в/в введения нитроглицерина больному могла составлять 50 мкг/мин и увеличивая ее каждую минуту добиваются стабильного антиангинального действия (обычно — со скоростью не свыше 200- 250-300 мкг/ мин); действенную скорость сохраняют на продолжительное время. Только полное отсутствие облегчения ангинозных болей, несмотря на адекватное применение нитроглицерина, оправдывает введение больному в/в (не в/м и не п/к!) наркотических анальгетиков: либо смеси из 1-2 мл 2% раствора промедола, 1-2 мл 50% анальгина и 1 мл 1 % раствора димедрола в 20 мл 5-10% раствора глюкозы; либо (в отсутствие брадикардии, артериальной гипотензии) — 1 мл 0,25% раствора дроперидола с 1 мл 0,005% раствора фентанида; либо (в отсутствие артериальной гипертензии) 30 мг (т.е. 1 мл) пентазоцина (фортрала). Потенцируют анальгезию ингаляцией смеси закиси азота и кислорода (1:1) либо введением в/в медленно (!) 20 мл 20% раствора натрия оксибутирата (гам-ма-оксимасляная кислота). Не следует спешить с гипотен-зивной терапией при артериальной гипертензии в первые часы инфаркта миокарда. Нитроглицерин — при невозможности в/в его введения — продолжают давать в таблетках сублингвально, поддерживая антиангинальное действие препарата аппликацией на кожу 2% мази с нитроглицерином.
Гепарин вводя в/в, начиная с 1000 ЕД, затем предпочтительна непрерывная в/в инфузия гепарина со скоростью 1000 ЕЕ/3, за 1 час, либо дробное введение в вену (можно пункцией катетера) не реже чем каждые 2 ч (!) по 2000 ЕД. В стационаре продолжают в/в введение гепарина (1000 ЕД в час), контролируемое повторными коагулограммами либо временем свертывания крови (оно должно возрасти в 2-3 раза). Предпочтительна тромболитическая терапия, проводимая при том условии, что больной доставлен в стационар в первые часы инфаркта миокарда (сегменты S-ЗГна ЭКГеще приподняты куполообразно) и что блок интенсивного наблюдения стационара располагает навыками, необходимыми для ведения больных в период тромболизиса; последний осуществляют стрептодеказой (обычно в дозе 3 000 000 ЕД) или другим тромболитическим препаратом.
Одновременно с геларином (в особенное™ вслед за введением стрептодеказы либо другого тромболитического препарата) продолжают введение нитроглицерина (лучше в/в непрерывно) и налаживают введением вену больного поляризующей смеси (500 мл 10% раствора глюкозы + 1,5 г калия хлорида) + 10-12 ЕД инсулина), в сочетании с которой можно вводить и гепарин и другие препараты. Целесообразна установка венозного катетера в крупную вену с расчетом на долгосрочное его использование. Вводят больному в/в капельно на протяжении примерно получаса обзидан в дозе 7-8 мг; 4 ч спустя по окончании инфузий обзидана препарат начинают давать внутрь, обычно в дозе 20-40 мг на прием каждые 4- 6 ч. Завершая гепаринотерапию, переходят от внутривенного его введения к инъекциям в подкожный жировой слой передней брюшной стенки (только не внутримышечно!) по 7500-5000 ЕД 2-4 раза в сутки. Прием антиагрегантов начинают с 3-4-го дня болезни, как правило, таким препаратом служитацетилсалициловая кислота, принимаемая по 100 мг (редко по 200 мг) 1 раз в день (после еды). Необходим контроль реакции на кровь в кале.
Инфузионную гепаринотерапию продолжают — при неосложненном течении инфаркта миокарда-5-7 дней; соли калия — внутрь в виде растворов калия хлорида или ацетата, либо препаратов «пенистый калий» или солнатрекс (с пищей); инфузий нитроглицерина постепенно заменяют на аппликации мази с 2% нитроглицерина; прием антиагреган-та (ацетилсалициловой кислоты) не следует прекращать до завершения периода реабилитации больного. Активность больного в постели — с первого дня, присаживание — со 2-4-го дня, вставание и ходьба по палате — на 7-9-11 -и дни. Рекомендуется эластическое бинтование ног, в особенности у тучных лиц (не массаж!). Сроки перевода больного на режим амбулаторной или санаторной реабилитации, а также возвращение к работе и трудоустройство (по заключению ВТЭК) определяются индивидуально.
Лечение осложнений. Частые желудочковые экстрасистолы высоких градаций по Лауну (ранние типа R на Т, политопные, групповые. «пробежки» тахикардии) в первые часы инфаркта миокарда могут быть следствием реканали-зации (в том числе спонтанной) просвета коронарной артерии, но вместе с тем — предвестником скорого возникновения желудочковой тахикардии либо фибрилляции желудочков. Поэтому необходима ввести в/в струйно медленно 10- 20 мл 1% раствора ксикаина (ксилокаина, лидокаина), затем ту же дозу превентивно вводят капельно на протяжении часа (если надо — повторно). Единичные экстрасистолы не требуют лечения. При наджелудочковой экстрасистолии — капельная инфузия поляризующей смеси; при пароксизмах наджелудочковой тахикардии, мерцания или трепетания предсердий, если они вызывают симптомы сердечной и сосудистой недостаточности,- также инфузия поляризующей смеси в сочетании с введением 1 мл 0,025% раствора дигоксина (не коргликона!) и 1-2 мл 25% раствора кордиамина в/в, в отсутствие таких симптомов-наблюдение, так как эти виды аритмий обычно преходящи. При пароксизме желудочковой тахикардии немедленная дефибрилляция предпочтительнее попыток проведения лекарственной терапии.
При атриовентрикулярной блокаде II-III степени изадрин (новодрин) 0,005 г (рассосать таблетку во рту) или орципре-налин сульфат (алупэнт) 0,02 г (рассосать) либо в/в капельно в виде 1-2 мл 0,05% раствора в 200-300 мл изотонического раствора натрия хлорида со скоростью 12-16 капель в 1 мин; продолжительность и повторность применения устанавливают в зависимости от сдвигов в степени блокады. Если полная АВ-блокада при инфаркте миокарда задней (нижней) стенки нередко оказывается преходящей, то при переднепе-регородочном инфаркте миокарда она резко ухудшает ближайший прогноз и требует электрокардиостимуляции, не всегда, к сожалению, улучшающей прогноз. Блокада ветвей пучка Гиса обычно не требует специального медикаментозного лечения.
При первых даже минимальных признаках острой сердечной, чаще левожелудочковой недостаточности в любом из периодов болезни показано применение препаратов сосудорасширяющего действия (нитраты, антагонисты кальция) предпочтительно в/в продолжительными периодами, но можно и внутрь (нитраты и в виде мази). Застойные явления вынуждают к назначению диуретических препаратов (фуросемид, гипотиазид, триамтерен, триампур, верошпирон), которые применяются малыми и умеренными дозами, но повторно, по мере надобности.
При отеке легких дать нитроглицерин под язык и при этом по возможности начать в/в введение нитроглицерина (см. выше), увеличивая скорость его введения вплоть до достижения убыли симптомов отека. Паническое настроение больного может потребовать введения в/в или подкожно 1 мл 1 % раствора морфина или других наркотических анапыетиков. Наряду с этим вводят в/в 6-8 мл раствора фуросемида в качестве диуретика (в отсутствие признаков кардиогенного шока). Только при резком повышении диастолического АД применяют регулируемое (опасность коллапса!) его снижение капельным в/в введением до 250 мг арфонада в 250- 300 мл 5% раствора глюкозы, скорость которого (число капель в минуту) подбирают, измеряя АД каждые 1-2 мин.
При кардиогенном шоке, т. е. при артериальной гипотензии, сочетающейся с анурией либо олигурией (менее 8 капель мочи в 1 мин по катетеру) и с острой сердечной недостаточностью (застойные явления в легких с одышкой, цианозом; синдром малого сердечного выброса; отек легких), необходимо прежде всего купировать ангинозную боль, как это описано при ангинозном приступе. Под обязательным контролем центрального венозного давления приступают к инфузии либо растворов, восполняющих сниженный объем циркулирующей крови-реополиглюкин 100-200 и даже 300 мл в/в с осторожностью (опасность отека легких); либо раствора дофамина в 5 % глюкозе или в изотоническом растворе хлорида натрия (из расчета 25 мг дофамина на 125 мл раствора; при этом скорость введения 1 мл в 1 мин, т. е. 16- 18 капель в 1 мин, будет соответствовать инфузии 200 мкг препарата за 1 мин). Скорость введения дофамина может и должна изменяться в зависимости от реакции сердечной деятельности и сосудистого тонуса, а также объема отделяемой почками мочи. Прогноз крайне серьезен, в особенности если кардиогенный шок сочетается с отеком легких. Признаком преодоления кардиогенного шока служит возобновление диуреза в объеме 1 мл и более в минуту; не следует ориентироваться только на повышение уровня АД. В специализированных отделениях выбор тактики лечения шока и контроль за ходом лечения облегчаются получением информации о давлении в легочной артерии, об объеме циркулирующей крови, о параметрах центральной гемодинамики, оксиге-низации и рН крови, величине минутного диуреза, а также о рентгенографической картине кровенаполнения легких и некоторых других данных.
При тромбоэмболии ветвей легочной артерии гепаринотерапия необходима тем более, чем более достоверен диагноз; ее следует сочетать с лечением недостаточности сердца (нередко латентной), являющейся причиной периферического, часто бессимптомного флеботромбоза (источник тромбоэмболии). В специализированных отделениях проводится тромболитическая терапия (см.выше).
Инфаркт миокарда 2 степени. Инфаркт миокарда: осложнения
Электрическая дисфункция возникает более чем у 90 % пациентов с инфарктом миокарда. Электрическая дисфункция, которая обычно приводит к смерти первые 72 ч, включает тахикардию (из любого источника) с достаточно высокой ЧСС, способной уменьшить сердечный выброс и снизить АД, атриовентрикулярную блокаду типа Мобитц II (2 степени) или полную (3 степень), желудочковую тахикардию (ЖТ) и фибрилляцию желудочков (ФЖ).
Асистолия встречается редко, за исключением случаев крайних проявлений прогрессирующей левожелудочковой недостаточности и шока. Больных с нарушениями сердечного ритма необходимо обследовать на предмет гипоксии и электролитных нарушений, которые могут быть как причиной, так и сопутствующим фактором.
В случае поражения артерии, кровоснабжающей синусовый узел, возможно развитие дисфункции синусового узла. Это осложнение более вероятно в том случае, если существовало предшествовавшее поражение синусового узла (часто встречающееся среди пожилых). Синусовая брадикардия, наиболее частая дисфункция синусового узла, обычно не требует лечения, за исключением случаев артериальной гипотензии или ЧСС < 50 в минуту. Более низкая ЧСС, но не критическая, приводит к уменьшению рабочей нагрузки на сердце и способствует уменьшению зоны инфаркта. При брадикардии с артериальной гипотензией (которые могут уменьшать кровоснабжение миокарда) используют атропин от 0,5 до 1 мг внутривенно; в случае недостаточного эффекта введение можно повторить через несколько минут. Введение нескольких малых доз лучше, поскольку высокие дозы могут вызывать тахикардию. Иногда требуется постановка временного кардиостимулятора.
Постоянная синусовая тахикардия обычно является угрожающим симптомом, часто свидетельствует о недостаточности левого желудочка низком сердечном выбросе. При отсутствии левожелудочковой недостаточности или другой очевидной причины этот вариант аритмии может ответить на введение b-адреноблокаторов внутривенно или внутрь в зависимости от степени экстренности.
Предсердные нарушения ритма (предсердная экстрасистолия, мерцательная аритмия и реже трепетание предсердий) развиваются приблизительно у 10 % больных инфарктом миокарда и могут отражать наличие левожелудочковой недостаточности или инфарктом миокарда правого предсердия. Пароксизмальная предсердная тахикардия встречается редко и обычно у больных, имевших подобные эпизоды ранее. Предсердная экстрасистолия обычно протекает доброкачественно, однако считают, что увеличение частоты может приводить к развитию сердечной недостаточности. Частая предсердная экстрасистолия может быть чувствительна к назначению b-адреноблокаторов.
Мерцательная аритмия обычно бывает преходящей, если возникает в первые 24 ч. Факторы риска включают возраст более 70 лет, сердечную недостаточность, перенесенные ранее инфаркты миокарда, обширный предшествующий инфаркт миокарда, инфаркт предсердий, перикардит, гипокалиемию, гипомагниемию, хронические заболевания легких и гипоксию. Применение фибринолитических средств снижает вероятность развития данного осложнения. Повторяющиеся пароксизмы мерцательной аритмии — плохой прогностический фактор, увеличивающий риск системных эмболии.
При мерцательной аритмии обычно назначают гепарин натрия, поскольку существует риск системных эмболии. Внутривенное введение b-адреноблокаторов (например, атенолол от 2,5 до 5,0 мг в течение 2 мин до достижения к полной дозы 10 мг за 10-15 мин, метопролол от 2 до 5 мг каждые 2-5 мин до полной дозы 15 мг за 10-15 мин) замедляет частоту желудочковых сокращений. Необходим тщательный контроль ЧСС и АД. Лечение прекращают при выраженном снижении ЧСС или систолическом АД < 100 мм рт. ст. Внутривенное введение дигоксина (менее эффективного, чем b-адреноблокаторы) используют осторожно и только у больных с мерцательной аритмией и систолической дисфункцией левого желудочка. Обычно требуется около 2 ч для снижения ЧСС при использовании дигоксина. В отношении больных без очевидной систолической дисфункции левого желудочка или нарушений проводимости, проявляющихся появлением широкого комплекса QRS, можно рассматривать внутривенное введение верапамила или дилтиазема. Последний препарат можно назначать в виде внутривенных введений для поддержания нормальной ЧСС длительное время.
Если мерцательная аритмия нарушает системную циркуляцию (например, приводя к развитию левожелудочковой недостаточности, артериальной гипотензии или боли в груди), показана экстренная кардиоверсия. В случае повторения мерцательной аритмии после кардиоверсии следует рассмотреть возможность внутривенного введения амиодарона.
При трепетании предсердий ЧСС контролируют так же, как и при мерцательной аритмии, однако не вводят гепарин натрия.
Из наджелудочковых тахиаритмии (если не учитывать синусовую тахикардию) в остром периоде инфаркта миокарда чаще всего наблюдается мерцание предсердий — у 10-20% больных. Все остальные варианты наджелудочковых тахикардии при инфаркте миокарда встречаются очень редко. При необходимости проводятся стандартные лечебные мероприятия.
Ранняя мерцательная аритмия (в первые сутки инфаркта миокарда), как правило, носит преходящий характер, ее возникновение связывают с ишемией предсердий и эпистенокардическим перикардитом. Возникновение мерцательной аритмии в более поздние сроки в большинстве случаев является следствием растяжения левого предсердия у больных с дисфункцией левого желудочка (аритмия сердечной недостаточности). При отсутствии заметных нарушений гемодинамики мерцание предсердий не требует проведения лечебных мероприятий. При наличии выраженных нарушений гемодинамики методом выбора является проведение неотложной электрической кардиоверсии. При более стабильном состоянии возможны 2 варианта ведения больных: (1) урежение ЧСС при тахисистолической форме в среднем до 70 в мин с помощью в/в введения бета-блокаторов, дигоксина, верапамила или дилтиазема; (2) попытка восстановления синусового ритма с помощью в/в введения амиодарона или соталола. Преимуществом второго варианта является возможность достижения восстановления синусового ритма и одновременно быстрое урежение ЧСС в случае сохранения мерцания предсердий. У больных с явной сердечной недостаточностью выбор проводится между двумя препаратами: дигоксин (в/в введение около 1 мг дробными дозами) илиамиодарон (в/в 150-450 мг). Всем больным с мерцанием предсердий показано в/в введение гепарина.
Нарушение функции синусового узла и атриовентрикулярные блокады чаще наблюдаются при инфаркте миокарда нижней локализации, особенно в первые часы. Синусовая брадикардия редко представляет какие-либо проблемы. При сочетании синусовой брадикардии с выраженной гипотонией («синдром брадикардии-гипотонии») используют внутривенное введение атропина.
Атриовентрикулярные (АВ) блокады также чаще регистрируются у больных с нижним инфарктом миокарда .
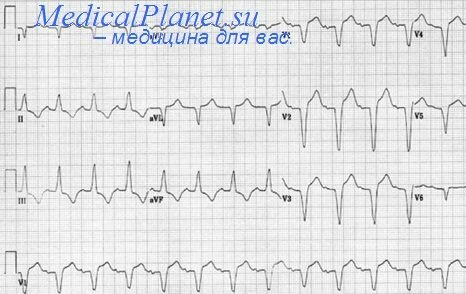
На ЭКГ отмечаются признаки острого коронарного синдрома с подъемом сегмента STII, III, aVF (в отведенииях I, aVL, V1-V5 отмечается реципрокная депрессия сегмента ST). У больного полная АВ-блокада, ритм АВ-соединения с частотой 40 в мин.
Частота возникновения АВ-блокады П-Ш степени при нижнем инфаркте миокарда достигает 20%, а если имеется сопутствующий инфаркт миокарда правого желудочка — АВ-блокада отмечается у 45-75% больных. АВ-блокада при инфаркте миокарда нижней локализации, как правило, развивается постепенно: сначала удлинение интервала PR, затем АВ-блокада II степени типа I (Мобитц-1, периодика Самойлова-Венкебаха) и только после этого — полная АВ-блокада. Даже полная АВ-блокада при нижнем инфаркте миокарда почти всегда носит преходящий характер и продолжается от нескольких часов до 3-7 сут (у 60% больных — менее 1 сут). Однако возникновение АВ-блокады является признаком более выраженного поражения: госпитальная летальность при неосложненном нижнем инфаркте миокарда составляет 2-10%, а при возникновении АВ-блокады достигает 20% и более. Причиной смерти при этом является не сама АВ-блокада, а сердечная недостаточность, вследствие более обширного поражения миокарда.
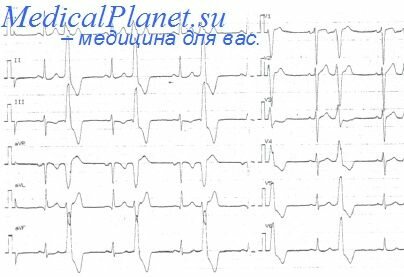
На ЭКГ регистрируется подъем сегмента ST в отведениях II, III, aVF и в V1-V3. Подъем сегмента ST в отведениях V1-V3 является признаком вовлечения правого желудочка. В отведениях I, aVL, V4-V6 отмечается реципрокная депрессия сегмента ST. У больного полная АВ-блокада, ритм АВ-соединения с частотой 30 в мин (в предсердиях синусовая тахикардия с частотой 100/мин).
У больных с нижним инфарктом миокарда при возникновении полной АВ-блокады выскальзывающий ритм из АВ-соединения, как правило, обеспечивает полную компенсацию, существенных нарушений гемодинамики обычно не отмечается. Поэтому лечения в большинстве случаев не требуется. При резком снижении ЧСС — менее 40 в мин и возникновении признаков недостаточности кровообращения используют в/в введение атропина (по 0,75-1,0 мг, при необходимости повторно, максимальная доза составляет 2-3 мг). Представляют интерес сообщения об эффективности в/в введения аминофиллина (эуфиллина) при АВ-блокадах, резистентных к атропину («атропин-резистентные» АВ-блокады). В редких случаях может потребоваться инфузия бета-2-стимуляторов: адреналина, изопротеренола, алупента, астмопента или ингаляция бета-2-стимуляторов. Необходимость в проведении электрокардиостимуляции возникает крайне редко. Исключение представляют случаи нижнего инфаркта миокарда с вовлечением правого желудочка, когда при правожелудочковой недостаточности в сочетании с выраженной гипотонией для стабилизации гемодинамики может потребоваться проведение двухкамерной электростимуляции, т.к. при инфаркте миокарда правого желудочка очень важно сохранение систолы правого предсердия.
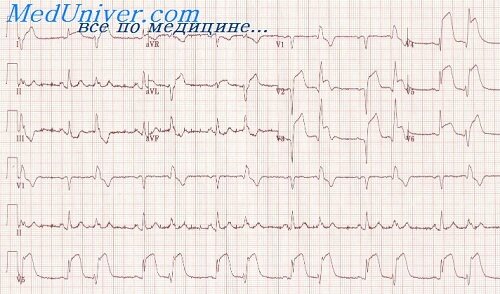
При инфаркте миокарда передней локализации АВ-блокада II-III степени развивается только у больных с очень массивным поражением миокарда. При этом АВ-блокада происходит на уровне системы Гиса-Пуркинье. Прогноз у таких больных очень плохой — смертность достигает 80-90% (как при кардиогенном шоке). Причиной смерти является сердечная недостаточность, вплоть до развития кардиогенного шока или вторичная фибрилляция желудочков.
Предвестниками возникновения АВ-блокады при переднем инфаркте миокарда являются: внезапное появление блокады правой ножки пучка Гиса, отклонение электрической оси и удлинение интервала PR. При наличии всех трех признаков вероятность возникновения полной АВ-блокады составляет около 40%. В случаях возникновения этих признаков или регистрации АВ-блокады II степени типа II (Мобитц-II) показано профилактическое введение стимуляционного зонда-электрода в правый желудочек. Средством выбора для лечения полной АВ-блокады на уровне ветвей пучка Гиса с медленным идиовентрикулярным ритмом и гипотонией является временная электрокардиостимуляция. При отсутствии кардиостимулятора используют инфузию адреналина (2-10 мкг/мин), возможно применение инфузии изадрина, астмопента или сальбутамола со скоростью, обеспечивающей достаточное увеличение ЧСС. К сожалению, даже в случаях восстановления АВ-проводимости прогноз у таких больных остается неблагоприятным, летальность значительно повышена как во время пребывания в стационаре, так и после выписки (по некоторым данным, летальность в течение первого года достигает 65%). Правда, в последние годы появились сообщения, что после выписки из стационара факт преходящей полной АВ-блокады уже не влияет на отдаленный прогноз больных с передним инфарктом миокарда.
Блокада типа Мобитц I (блокада Венкебаха, прогрессирующее удлинение интервала PR) часто развивается при нижнедиафрагмальном инфаркте миокарда; она редко прогрессирует. Блокада типа Мобитц II (редкие сокращения) обычно указывает на наличие массивного переднего инфаркта миокарда, так же как и полная атриовентрикулярная блокада с широкими комплексами QRS (предсердные импульсы не достигают желудочков), но оба типа блокад встречаются нечасто. Частота полных (III степени) АВ-блокад зависит от локализации инфаркта. Полная АВ-блокада встречается у 5-10 % больных с нижним инфарктом миокарда и обычно бывает преходящей. Она возникает менее чем у 5 % пациентов с неосложненным передним инфарктом миокарда, но до 26 % при таком же виде инфаркта миокарда, сопровождающегося блокадой правой или задней ветви левой ножек пучка Гиса.
Блокада типа Мобитц I обычно не требует лечения. В случае развития истинной блокады типа Мобитц II низкой ЧСС или при АВ-блокаде с редкими широкими комплексами QRS применяют временный кардиостимулятор. Можно использовать внешний кардиостимулятор до имплантации временного кардиостимулятора. Несмотря на то что введение изопротеренола может временно восстановить ритм и ЧСС, этот подход не используют, поскольку происходит увеличение потребности миокарда в кислороде и риска развития аритмий. Атропин в дозе 0,5 мг каждые 3-5 мин до достижения полной дозы 2,5 мг можно назначить при наличии АВ-блокады с узким желудочковым комплексом и небольшой ЧСС, но он не рекомендован при АВ-блокаде с впервые возникшим широким желудочковым комплексом.
Чаще всего при инфаркте миокарда отмечается желудочковая экстрасистолия.
До недавнего времени желудочковой экстрасистолии при инфаркте миокарда придавали очень большое значение. Популярной была концепция так называемых «предупреждающих аритмий», согласно которой желудочковые экстрасистолы высоких градаций (частые, полиморфные, групповые и ранние — типа «R на Т») являются предвестниками фибрилляции желудочков, а лечение желудочковых экстрасистол должно способствовать снижению частоты возникновения фибрилляции. Концепция «предупреждающих аритмий» не подтвердилась. В настоящее время установлено, что экстрасистолы, возникающие при инфаркте миокарда, сами по себе безопасны (их даже называют «косметической аритмией») и не являются предвестниками фибрилляции желудочков. А самое главное — лечение экстрасистолии не влияет на частоту возникновения фибрилляции желудочков.
В рекомендациях Американской кардиологической ассоциации по лечению острого инфаркта миокарда (1996 г.) было специально подчеркнуто, что регистрация желудочковых экстрасистол и даже неустойчивой желудочковой тахикардии (включая полиморфную желудочковую тахикардию, продолжительностью до 5 комплексов) не является показанием для назначения антиаритмических препаратов(!). Отрицательное прогностическое значение имеет выявление частых желудочковых экстрасистол через 1-1,5 сут от начала инфаркта миокарда, т.к. в этих случаях желудочковые экстрасистолы являются «вторичными» и, как правило, возникают вследствие обширного поражения и выраженной дисфункции левого желудочка («маркеры дисфункции левого желудочка»).
Неустойчивая желудочковая тахикардия
Неустойчивой желудочковой тахикардией называют эпизоды желудочковой тахикардии, продолжительностью менее 30 с («пробежки» тахикардии), не сопровождающиеся нарушениями гемодинамики. Многие авторы неустойчивую желудочковую тахикардию так же, как и желудочковую экстрасистолию, относят к «косметическим аритмиям» (их называют «энтузиастическими» выскальзывающими ритмами»).
Антиаритмические препараты назначают только при очень частых, обычно групповых экстрасистолах и неустойчивой желудочковой тахикардии, если они вызывают нарушения гемодинамики с возникновением клинических симптомов или субъективно очень плохо переносится больными. Клиническая ситуация при инфаркте миокарда очень динамична, аритмии часто носят преходящий характер, и очень трудно провести оценку эффективности лечебных мероприятий. Тем не менее в настоящее время рекомендуется избегать применения антиаритмических препаратов класса I (за исключением лидокаина), а при наличии показаний для антиаритмической терапии предпочтение отдается бета-блокаторам, амиодарону и, возможно, соталолу.
Лидокаин вводят внутривенно — 200 мг в течение 20 мин (обычно повторными болюсами по 50 мг). При необходимости проводят инфузию со скоростью 1-4 мг/мин. При отсутствии эффекта от лидокаина, чаще применяют бета-блокаторы или амиодарон. В России в настоящее время наиболее доступным бета-блокатором для внутривенного введения является пропранолол (обзидан). Обзидан при инфаркте миокарда вводят со скоростью 1 мг в течение 5 мин. Доза обзидана при в/в введении составляет от 1 до 5 мг. При наличии эффекта переходят на прием бета-блокаторов внутрь. Амиодарон (кордарон) вводят внутривенно медленно в дозе 150-450 мг. Скорость введения амиодарона при длительной инфузии составляет 0,5-1,0 мг/мин.
Устойчивая желудочковая тахикардия
Частота возникновения устойчивой желудочковой тахикардии (тахикардия, которая не проходит спонтанно) в остром периоде инфаркта миокарда достигает 15%. В случае возникновения выраженных нарушений гемодинамики (сердечная астма, гипотония, потеря сознания) методом выбора является проведение электрической кардиоверсии разрядом 75-100 Дж. При более стабильном состоянии гемодинамики прежде всего применяют лидокаин или амиодарон. В нескольких исследованиях показано преимущество амиодарона перед лидокаином в купировании желудочковых тахиаритмий. Если желудочковая тахикардия продолжается, то при сохранении стабильной гемодинамики можно продолжить эмпирический подбор терапии, например, оценить эффект в/в введения обзидана, соталола, магния сульфата или провести плановую электрическую кардиоверсию.
Интервал между введением различных препаратов зависит от состояния больного и при хорошей переносимости тахикардии, отсутствии признаков ишемии и относительно стабильной гемодинамике составляет от 20-30 мин до нескольких часов.
Для лечения полиморфной желудочковой тахикардии типа «пируэт» препаратом выбора является сульфат магния — в/в введение 1-2 г в течение 2 мин (при необходимости повторно) и последующая инфузия со скоростью 10-50 мг/мин. При отсутствии эффекта от сульфата магния у больных без удлинения интервала QT (в синусовых комплексах) оценивают действие бета-блокаторов и амиодарона. При наличии удлинения интервала QT используют электрокардиостимуляцию с частотой около 100/мин. Следует отметить, что у больных с острым инфарктом миокарда даже при удлинении интервала QT в лечение тахикардии типа «пируэт» может быть эффективно применение бета-блокаторов и амиодарона.
Фибрилляция желудочков
Известно, что приблизительно 50% всех случаев фибрилляции желудочков происходят в первый час инфаркта миокарда, 60% — в первые 4 часа, 80% — в первые 12 часов инфаркта миокарда.
Если ускорить вызов врача скорой помощи на 30 мин, можно предотвратить примерно 9% случаев смерти от фибрилляции желудочков за счет своевременной дефибрилляции. Это намного превышает эффект от тромболитической терапии.
Частота возникновения фибрилляции желудочков после поступления больного в блок интенсивной терапии составляет 4,5-7%. К сожалению, в 1-й час поступают менее 20% больных, в течение 2-х часов — около 40%. Расчеты показывают, что если ускорить поступление больных на 30 мин, можно будет спасти от фибрилляции примерно 9 больных из 100. В основном это так называемая первичная фибрилляция желудочков (не связанная с рецидивированием инфаркта миокарда, ишемией и недостаточностью кровообращения).
Единственным эффективным методом лечения фибрилляции желудочков является немедленное проведение электрической дефибрилляции. При отсутствии дефибриллятора реанимационные мероприятия при фибрилляции желудочков практически всегда безуспешны, более того, с каждой минутой снижается вероятность успешной электрической дефибрилляции. Эффективность немедленной электрической дефибрилляции при инфаркте миокарда составляет около 90%.
Прогноз у больных, перенесших первичную фибрилляцию желудочков, как правило, вполне благоприятный и, по некоторым данным, практически не отличается от прогноза у больных с неосложненным инфарктом миокарда. Фибрилляция желудочков, возникающая в более поздние сроки (после первых суток), в большинстве случаев является вторичной и обычно возникает у больных с выраженным поражением миокарда, рецидивирующими инфарктами миокарда, ишемией миокарда или признаками сердечной недостаточности. Следует отметить, что вторичная фибрилляция желудочков может наблюдаться и в течение первых суток инфаркта миокарда. Неблагоприятный прогноз при этом определяется тяжестью поражения миокарда. Частота возникновения вторичной фибрилляции желудочков составляет 2,2-7%, в т. ч. у 60% в первые 12 ч. У 25% больных вторичная фибрилляция желудочков отмечается на фоне мерцания предсердий. Эффективность дефибрилляции при вторичной фибрилляции составляет от 20 до 50%, повторные эпизоды возникают у 50% больных, летальность больных в стационаре составляет 40-50%. Имеются сообщения, что после выписки из стационара наличие в анамнезе даже вторичной фибрилляции желудочков уже не оказывает дополнительного влияния на прогноз.
Проведение тромболической терапии позволяет резко (в десятки раз) снизить частоту возникновения устойчивой желудочковой тахикардии и вторичной фибрилляции желудочков. Реперфузионные аритмии не представляют проблемы, в основном это частые желудочковые экстрасистолы и ускоренный идиовентрикулярный ритм («косметические аритмии») — показатель успешного тромболизиса. Редко возникающие более серьезные аритмии, как правило, хорошо поддаются стандартной терапии.
Больные с обширным инфарктом миокарда (по данным ЭКГ или сывороточным маркерам) и нарушением сократительной способности миокарда, АГ или диастолической дисфункцией более склонны к развитию сердечной недостаточности. Клинические проявления зависят от размера инфаркта, увеличения давления наполнения левого желудочкаи степени снижения сердечного выброса. Часто возникают одышка, инспираторные хрипы в нижних отделах легких и гипоксемия.
Сердечная недостаточность при инфаркте миокарда
Основной причиной смерти больных инфарктом миокарда в стационаре является острая сердечная недостаточность: отек легких и кардиогенный шок.
Клиническими проявлениями острой левожелудочковой недостаточности являются одышка, ортопноэ, ощущение нехватки воздуха, вплоть до удушья, повышенная потливость. При объективном обследовании отмечаются бледность, цианоз, увеличение частоты дыхания, нередко набухание шейных вен. При аускультации — разнообразные хрипы в легких (от крепитирующих до влажных крупнопузырчатых), III тон (протодиастолический ритм галопа), систолический шум. В большинстве случаев отмечаются синусовая тахикардия и снижение АД, пульс слабого наполнения или нитевидный.
При инфаркте миокарда используют классификацию острой сердечной недостаточности по Киллипу: I класс — нет застойных явлений, II класс-признаки умеренных застойных явлений: хрипы в нижних отделах легких, выслушивание III тона или умеренная правожелудочковая недостаточность (набухание вен шеи и увеличение печени), III класс — отек легких, IV класс — кардиогенный шок.
Характерные клинические проявления сердечной недостаточности наблюдаются при достаточно выраженной степени недостаточности кровообращения, когда ее «легче диагностировать, чем лечить». Раннее выявление сердечной недостаточности по клиническим признакам представляет очень трудную задачу (клинические проявления на ранних стадиях неспецифичны и не очень точно отражают состояние гемодинамики). Синусовая тахикардия может быть единственным признаком компенсированной недостаточности кровообращения (компенсация за счет синусовой тахикардии). К группе больных с повышенным риском возникновения недостаточности кровообращения относятся больные с распространенным инфарктом миокарда передней локализации, с повторным инфарктом миокарда, с АВ-блокадами II-III степени при наличии нижнего инфаркта миокарда (или с признаками вовлечения правого желудочка, с выраженной депрессией сегмента ST в передних отведениях), больные с мерцательной аритмией или выраженными желудочковыми аритмиями, нарушениями внутрижелудочковой проводимости.
Идеальным считается всем больным с повышенным риском или начальными признаками сердечной недостаточности проводить инвазивное мони-торирование гемодинамики. Для этой цели удобнее всего использовать «плавающие» катетеры Сван-Ганца. После введения катетера в легочную артерию измеряют так называемое «заклинивающее» давление в ветвях легочной артерии или диастолическое давление в легочной артерии. Используя метод термодилюции, можно вычислить сердечный выброс. Применение инвазивного контроля гемодинамики значительно облегчает выбор и проведение лечебных мероприятий при острой сердечной недостаточности. Для обеспечения адекватной гемодинамики у больных с острым инфарктом миокарда диастолическое давление в легочной артерии (отражает давление заполнения левого желудочка) должно быть в пределах от 15 до 22 мм рт. ст. (в среднем около 20 мм). Если диастолическое давление в легочной артерии (ДДЛА) менее 15 мм рт. ст. (или даже в пределах от 15 до 18 мм) — причиной недостаточности кровообращения или фактором, способствующим ее появлению, может быть гиповолемия. В этих случаях на фоне введения жидкости (плазмозамещающих растворов) отмечается улучшение гемодинамики и состояния больных. При кардиогенном шоке отмечается снижение сердечного выброса (сердечный индекс меньше 1,8-2,0 л/мин/м2) и повышение давления заполнения левого желудочка (ДДЛА больше 15-18 мм рт. ст. если нет сопутствующей гиповолемии). Однако ситуация, при которой имеется возможность инвазивного контроля гемодинамики для большинства учреждений практического здравоохранения (тем более в условиях скорой помощи), действительно является идеальной, т.е. такой, которой не существует в действительности.
При умеренно выраженной сердечной недостаточности, клинически проявляющейся небольшой одышкой, крепитирующими хрипами в нижних отделах легких, при нормальном или слегка повышенном АД используют нитраты (нитроглицерин под язык, нитраты внутрь). На этом этапе очень важно не «перелечить», т.е. не вызвать чрезмерного снижения давления заполнения левого желудочка. Используют назначение малых доз ингибиторов АПФ, реже применяют фуросемид (лазикс). У нитратов и ингибиторов АПФ есть преимущество перед диуретиками — они снижают преднагрузку без уменьшения ОЦК.
Последовательность лечебных мероприятий при появлении клинических признаков сердечной астмы или отека легких:
- ингаляция кислорода,
- нитроглицерин (под язык повторно или в/в),
- морфин (в/в по 2-5 мг),
- лазикс (в/в по 20-40 мг и более),
- дыхание с положительным давлением на выдохе,
- искусственная вентиляция легких.
Даже при развернутой клинической картине отека легких после сублингвального приема 2-3 таблеток нитроглицерина может быть заметный положительный эффект уже через 10 мин. Вместо морфина можно использовать другие наркотические анальгетики и/или реланиум. Лазикс (фуросемид) при отеке легких у больных с инфарктом миокарда используют в последнюю очередь, осторожно, начиная с 20 мг, если сохраняется выраженная одышка, при необходимости увеличивая дозу в 2 раза при каждом повторном введении. При отеке легких у больных с инфарктом миокарда, как правило, нет задержки жидкости, поэтому при передозировке лазикса может развиться выраженная гиповолемия и гипотония.
В некоторых случаях достаточно применения только одного из препаратов (чаще всего нитроглицерина), иногда приходится вводить все 3 препарата почти одновременно, не дожидаясь появления эффекта от каждого средства в отдельности. Ингаляцию кислорода проводят с увлажнением, пропуская через стерильную воду или спирт. При выраженном пенообразовании можно проколоть трахею тонкой иглой и ввести 2-3 мл 96° спирта.
При возникновении отека легких на фоне повышенного АД лечебные мероприятия почти такие же, как и при нормальном АД. Однако при резком повышении АД или сохранении высокого АД, несмотря на введение нитроглицерина, морфина и лазикса, дополнительно используют дроперидол, пентамин, инфузию нитропруссида натрия.
Отек легких на фоне снижения АД — особенно тяжелое состояние. Это кардиогенный шок с преобладанием симптомов застоя в легких. В этих случаях нитроглицерин, морфин и лазикс применяют в уменьшенных дозах на фоне инфузии инотропных и вазопрессорных препаратов: добутамин, допамин или норадреналин. При незначительном снижении АД (около 100 мм рт. ст.) можно начать с инфузии добутамина (с 200 мкг/мин, при необходимости повышая скорость введения до 700-1000 мкг/мин). При более резком снижении АД используют допамин (150-300 мкг/мин). При еще более выраженном снижении АД (менее 70 мм рт. ст.) показано введение норадреналина (с 2-4 мкг/мин до 15 мкг/мин) или проведение внутриаортальной баллонной контрпульсации. Глюкокортикоидные гормоны при кардиогенном отеке легких не показаны.
Лечение зависит от степени тяжести. При умеренно выраженной сердечной недостаточности назначают петлевые диуретики (например, фуросемид от 20 до 40 мг внутривенно 1 раз в день) для уменьшения давления заполнения желудочков, и этого часто бывает достаточно. В тяжелых случаях используют вазодилататоры (например, внутривенное введение нитроглицерина) для уменьшения пред- и постнагрузки; во время лечения часто измеряют давление заклинивания легочной артерии путем катетеризации правых камер сердца (с использованием катетера Суона-Ганца). Ингибиторы АПФ используют до тех пор, пока систолическое АД остается выше 100 мм рт. ст. Для начала терапии предпочтительнее назначение ингибиторов АПФ короткого действия в малых дозах (например, каптоприл по 3,125-6,25 мг каждые 4-6 ч, увеличивая дозу по переносимости). Как только максимальная доза достигнута (максимум для каптоприла составляет 50 мг 2 раза в день), назначают ингибитор АПФ более длительного действия (например, фозиноприл, лизиноприл, рамиприл) на продолжительное время. Если сердечная недостаточность сохраняется на уровне II функционального класса по NYHA либо более высокого класса, необходимо добавить антагонисты альдостерона (например, эплеренон или спиронолактон). При тяжелой сердечной недостаточности применяют внутриартериальную баллонную контр-пульсацию для обеспечения временной гемодинамической поддержки. В тех случаях, когда невозможно выполнить реваскуляризацию или хирургическую коррекцию, рассматривают вопрос о пересадке сердца. Долговременные левожелудочковые или бивентрикулярные имплантируемые устройства можно использовать до трансплантации; если пересадка сердца невозможна, эти вспомогательные устройства иногда применяет в качестве постоянного метода лечения. Иногда использование таких устройств приводит к восстановлению функций желудочков, и устройство может быть удалено через 3-6 мес.
Если сердечная недостаточность приводит к развитию гипоксемии, назначают ингаляции кислорода через носовые катетеры (для поддержания раО на уровне приблизительно 100 мм рт. ст.). Это может способствовать оксигенации миокарда и ограничению зоны ишемии.
Функциональная недостаточность папиллярных мышц возникает приблизительно у 35 % больных в течение первых нескольких часов инфаркта. Ишемия папиллярных мышц приводит к неполному смыканию створок митрального клапана, что затем проходит у большинства больных. Однако у некоторых пациентов появление рубцов в папиллярных мышцах или свободной стенке сердца приводит к постоянной митральной регургитации. Функциональная недостаточность папиллярных мышц проявляется поздним систолическим шумом и обычно исчезает без лечения.
Разрыв папиллярной мышцы наиболее часто возникает при нижнезаднем инфаркте миокарда, связанном с окклюзией правой венечной артерии. Это приводит к появлению острой выраженной митральной регургитации. Разрыв папиллярной мышцы характеризуется внезапным появлением громкого голосистолического шума и дрожания на верхушке, обычно с отеком легкого. В некоторых случаях, когда регургитация не вызывает интенсивной аускультативной симптоматики, но клинически возникает подозрение на это осложнение, выполняют эхокардиографию. Эффективный метод лечения — пластика или замена митрального клапана.
Разрыв межжелудочковой перегородки или свободной стенки желудочка происходит у 1 % больных с острым инфарктом миокарда и становится причиной 15 % госпитальной летальности.
Разрыв межжелудочковой перегородки, тоже будучи редким осложнением, встречается в 8-10 раз чаще, чем разрыв папиллярной мышцы. Разрыв межжелудочковой перегородки характеризуется внезапным появлением громкого систолического шума и дрожания, определяемых на уровне от середины до верхушки сердца, вдоль левого края грудины на уровне третьего и четвертого межреберных промежугков, сопровождается артериальной гипотензией с признаками недостаточности левого желудочкаили без них. Диагноз может быть подтвержден при использовании катетеризации баллонным катетером и сравнении сатурации О2 или рО2 в правом предсердии, правом желудочкеи отделах легочной артерии. Существенное увеличение рО2 в правом желудочке диагностически значимо, как и данные допплеровской эхокардиографии. Лечение хирургическое, оно должно быть отсрочено на 6 нед после инфаркта миокарда, поскольку необходимо максимальное заживление поврежденного миокарда. Если сохраняется выраженная гемодинамическая нестабильность, проводят более раннее хирургическое вмешательство, несмотря на высокий риск смертности.
Частота разрывов свободной стенки желудочка увеличивается с возрастом, чаще такой разрыв происходит у женщин. Это осложнение характеризуется внезапным падением артериального давления с сохранением синусового ритма и (часто) признаками тампонады сердца. Хирургическое лечение редко бывает успешным. Разрыв свободной стенки почти всегда бывает фатальным.
Ограниченное выбухание стенки желудочка, чаще левого, может происходить в зоне обширного инфаркта миокарда. Аневризма желудочка часто встречается при больших трансмуральных инфарктов миокарда (обычно передних). Аневризма может развиваться через несколько дней, недель или месяцев после инфаркта миокарда. Разрыв аневризм происходит редко, однако они могут приводить к рецидивирующим желудочковым аритмиям, низкому сердечному выбросу и пристеночному тромбозу с системной эмболией. Аневризму желудочков подозревают, когда выявляются парадоксальные движения в прекардиальной области. ЭКГ демонстрирует постоянный подъем сегмента ST, а рентгенологическое исследование грудной клетки выявляет характерную выпуклость сердечной тени. Для подтверждения диагноза и выявления тромбов выполняют эхокардиографию. При наличии левожелудочковой недостаточности или аритмии можно назначить хирургическое иссечение. Применение ингибиторов АПФ во время острого инфаркта миокарда уменьшает ремоделирование миокарда и может снижать частоту развития аневризм.
Псевдоаневризма представляет собой неполный разрыв свободной стенки левого желудочка, ограничивающийся перикардом. Псевдоаневризмы почти всегда содержат тромбы и часто разрываются полностью. Лечение проводят хирургическим путем.
Артериальная гипотензия может быть обусловлена уменьшенным наполнением желудочков или снижением силы сокращения вследствие обширного инфаркта миокарда. Значимую артериальную гипотензию (систолическое АД < 90 мм рт. ст.) с тахикардией и признаками недостаточного кровоснабжения периферических органов (уменьшенное выделение мочи, нарушения сознания, обильное потоотделение, холодные конечности) называют кардиогенным шоком. При кардиогенном шоке быстро развивается отек легких.
Уменьшение наполнения левого желудочканаиболее часто вызвано уменьшенным венозным возвратом, обусловленным гиповолемией, особенно у больных, получающих интенсивную терапию петлевыми диуретиками, однако оно может быть признаком инфаркта миокарда правого желудочка. Выраженный отек легких свидетельствует о потере силы сокращений левого желудочка (левожелудочковая недостаточность), ставшей причиной шока. Лечение зависит от причины этого состояния. У некоторых больных для выяснения причины необходима катетеризация легочной артерии для измерения внутрисердечного давления. Если давление заклинивания легочной артерии ниже 18 мм рт. ст. более вероятно уменьшение наполнения, связанное с гиповолемией; если давление выше 18 мм рт. ст. вероятна левожелудочковая недостаточность. При артериальной гипотензии, связанной с гиповолемией, возможна осторожная заместительная терапия 0,9 % раствором натрия хлорида без развития перегрузки левых камер сердца (чрезмерного повышения давления в левом предсердии). Однако иногда функционирование левого желудочка настолько изменено, что возмещение жидкости резко увеличивает давление заклинивания легочной артерии до уровня, характерного для отека легких (> 25 мм рт. ст.). Если давление в левом предсердии высокое, артериальная гипотензия, вероятно, связана с недостаточностью левого желудочка, и при неэффекгивности диуретиков может требоваться инотропная терапия или поддержка адекватного кровообращения.
При кардиогенном шоке временно эффективными могут быть а- или b-агонисты. Допамин, катехоламин, воздействующий на рецепторы и назначают в дозе 0,5-1 мкг/кг в минуту с ее увеличением до достижения удовлетворительного ответа либо до достижения дозы приблизительно 10 мкг/кг в минуту. Более высокие дозы стимулируют вазоконстрикцию и вызывают предсердные и желудочковые аритмии. Добутамин, а-агонист, можно назначать внутривенно в дозе 2,5-10 мкг/кг в минуту или больше. Это часто приводит к развитию артериальной гипотензии или усиливает ее. Назначение наиболее эффективно в том случае, когда гипотензия обусловлена низким сердечным выбросом с высоким периферическим сопротивлением сосудов. Допамин может быть более эффективен, чем добутамин, когда необходим вазопрессорный эффект. В рефрактерных случаях возможно использование комбинации допамина и добутамина. Как временную меру можно использовать внутриаортальную баллонную контрпульсацию. Направленный лизис тромба, ангиопластика или экстренное АКШ могут существенно улучшать функции желудочка. НОВА или АКШ рассматривают при сохраняющейся ишемии, рефрактерной желудочковой аритмии, гемодинамической нестабильности или шоке, если анатомические особенности артерий это позволяют.
Примерно у половины больных с нижним инфарктом миокарда имеется вовлечение правого желудочка, в т. ч. у 15-20% гемодинамически значимое. Клинически у таких больных наблюдается гипотония или шок в сочетании с признаками венозного застоя в большом круге: набухание вен шеи, увеличение печени, периферические отеки (признаки венозного застоя могут отсутствовать при сопутствующей гиповолемии и появиться после инфузии жидкости). «Классическая триада инфаркта миокарда правого желудочка»: набухание шейных вен, отсутствие застоя в легких и гипотония. Кроме этого, отмечается выраженная одышка без ортопноэ. Клиническая картина напоминает тампонаду сердца, констриктивный перикардит, тромбоэмболию легочной артерии. При инфаркте миокарда правого желудочка более часто возникает АВ-блокада II-III степени и мерцание предсердий. Одним из признаков вовлечения правого желудочка является резкое снижение АД, вплоть до обморока, при приеме нитроглицерина.
На ЭКГ-признаки инфаркта миокарда, обычно нижней локализации, а в отведении V1 и в правых грудных отведениях (VR4-R6) регистрируется подъем сегмента ST. В случае вовлечения задне-базальных отделов левого желудочка в отведениях V1-V2 наблюдается депрессия сегмента ST и увеличение высоты зубца R. При зондировании правых отделов сердца отмечается повышение давления в правом предсердии и желудочке (диастолическое более 10 мм рт. ст.). При эхокардиографии наблюдается нарушение сократимости и увеличение размеров правого желудочка, отсутствие значительного выпота в полости перикарда и тампонады.
Основным способом лечения гипотонии при инфаркте миокарда правого желудочка является в/в введение жидкости («объем-зависимый инфаркт миокарда»). Инфузию плазмозамещающих растворов (физраствор, реополиглюкин) проводят со скоростью, обеспечивающей повышение диастолического давления в легочной артерии до 20 мм рт. ст. или АД до 90-100 мм рт. ст. (при этом признаки венозного застоя в большом круге и ЦВД нарастают) — единственная «движущая сила» при инфаркте миокарда правого желудочка — повышенное давление в правом предсердии. Первые 500 мл вводят струйно (болюсом). В некоторых случаях приходится вводить несколько литров плазмозамещающих растворов — до 1-2 литров за 1-2 часа (по словам одного из кардиологов: «необходимо лить жидкость, вплоть до анасарки»).
При появлении признаков застоя в легких скорость инфузии уменьшают или введение плазмозамещающих растворов прекращают. При недостаточном эффекте от инфузии жидкости к лечению добавляют добутамин (допамин или норадреналин). В самых тяжелых случаях применяют внутриаортальную контрпульсацию.
Противопоказано назначение вазодилататоров (включая нитроглицерин и наркотические анальгетики) и диуретиков. Под влияние этих препаратов наблюдается резкое снижение АД. Повышенная чувствительность к действию нитратов, морфина и диуретиков является диагностическим признаком инфаркта миокарда правого желудочка. Самым эффективным способом лечения инфаркта миокарда с вовлечением правого желудочка является восстановление коронарного кровотока (тромболитическая терапия или хирургическая реваскуляризация). Прогноз при правильном лечении больных с инфарктом миокарда правого желудочка в большинстве случаев вполне благоприятный, улучшение функции правого желудочка отмечается в первые 2-3 сут, а признаки застоя в большом круге обычно исчезают в течение 2-3 нед. При правильном лечении прогноз зависит от состояния левого желудочка.
Тяжелым и, к сожалению, нередко наблюдающимся осложнением при инфаркте миокарда правого желудочка является полная АВ-блокада. В этих случаях может потребоваться проведение двухкамерной электрокардиостимуляции, т. к. при инфаркте миокарда правого желудочка очень важное значение имеет сохранение эффективной систолы правого предсердия. При отсутствии возможности двухкамерной электрокардиостимуляции применяют внутривенное введение эуфиллина и электростимуляцию желудочков.
Таким образом, выявление и своевременная коррекция трех курабельных состояний: рефлекторной гипотонии, гиповолемии и инфаркта миокарда правого желудочка позволяет добиться существенного улучшения в этой группе больных даже при клинической картине шока. Не менее важно и то, что неправильное лечение, например применение вазопрессоров при гиповолемии, вазодилататоров или диуретиков при инфаркте миокарда правого желудочка, нередко является причиной ускорения летального исхода.
Любая боль в груди, которая сохраняется или повторяется в течение 12-24 ч после инфаркта миокарда, может быть проявлением продолжающейся ишемии. Постинфарктная ишемическая боль указывает, что сохраняется риск развития инфаркта больших участков миокарда. Обычно продолжающуюся ишемию можно идентифицировать по обратимым изменения интервала ST-T на электрокардиограмме; возможно повышение АД. Однако, поскольку продолжающаяся ишемия может быть безболевой (изменения данных ЭКГ при отсутствии болевого синдрома) приблизительно у трети больных обычно назначают серию ЭКГ через каждые 8 ч в первый день и далее ежедневно. При продолжающейся ишемии лечение аналогично нестабильной стенокардии. Прием нитроглицерина под язык или внутривенно обычно эффективен. Для сохранения ишемизированного миокарда целесообразно рассмотреть вопрос о коронарной ангиопластике и НОВА или АКШ.
Пристеночный тромбоз развивается приблизительно у 20 % больных с острым инфарктом миокарда. Системную эмболию выявляют приблизительно у 10 % больных с тромбами в левом желудочке. Риск наиболее высок в первые 10 дней, но сохраняется по крайней мере в течение 3 мес. Наиболее высокий риск (более 60 %) у больных с обширным передним инфарктом миокарда (особенно с вовлечением дистальных отделов межжелудочковой перегородки и верхушки), расширенным левым желудочкоми распространенными зонами гипокинеза либо постоянной мерцательной аритмией. Для уменьшения риска эмболии назначают антикоагулянты. При отсутствии противопоказаний внутривенно вводят гепарин натрия, назначают внутрь варфарин на 3-6 мес с поддержанием MHO между 2 и 3. Антикоагулянтную терапию проводят длительно, если у больного расширенный с распространенными зонами гипокинеза левого желудочка, аневризма левого желудочкаили постоянная мерцательная аритмия. Также возможет длительный прием ацетилсалициловой кислоты.
Перикардит развивается вследствие распространения некроза миокарда через стенку желудочка на эпикард. Это осложнение развивается приблизительно у трети больных с острым трансмуральным инфарктом миокарда. Шум трения перикарда обычно появляется начиная с 24 до 96 ч после дебюта инфаркта миокарда. Более раннее появление шума трения необычно, хотя геморрагический перикардит иногда осложняет раннюю стадию инфаркта миокарда. Острая тампонада развивается редко. Перикардит диагностируют с помощью ЭКГ, которая демонстрирует диффузный подъем сегмента STn (иногда) депрессию интервала PR. Эхокардиографию выполняют часто, но обычно данные бывают нормальными. Иногда выявляют небольшое количество жидкости в перикарде или даже бессимптомную тампонаду. Прием ацетилсалициловой кислоты или других НПВС обычно уменьшает проявления. Высокие дозы или дпительное использование НПВС либо глюкокортикоидов могут тормозить заживление инфаркта, что необходимо учитывать.
Постинфарктный синдром развивается у некоторых пациентов через несколько дней, недель или даже месяцев после острого инфаркта миокарда. В последние годы отмечают уменьшение частоты его развития. Синдром характеризуется лихорадкой, перикардитом с шумом трения перикарда, появлением жидкости в перикарде, плевритом, жидкостью в плевральной полости, легочными инфильтратами и распространенной болью. Этот синдром вызван аутоиммунной реакцией на некротическую ткань миоцитов. Он может повторяться. Дифференциальная диагностика постинфарктного синдрома с прогрессированием или повторением инфаркта миокарда может быть затруднительной. Однако при постинфарктном синдроме не происходит заметного увеличения количества кардиоспецифических маркеров, и изменения данных ЭКГ неопределенные. НПВС обычно эффективны, но синдром может повторяться несколько раз. В тяжелых случаях может потребоваться короткий интенсивный курс другого НПВС или глюкокортикоида. Высокие дозы НПВС или глюкокортикоида не используют дольше нескольких дней, поскольку они могут препятствовать раннему заживлению желудочка после острого инфаркта миокарда.
Содержание:Инфаркт миокарда: общие сведенияИнфаркт миокарда: причиныИнфаркт миокарда: симптомыИнфаркт миокарда: диагностикаИнфаркт миокарда: лечениеИнфаркт миокарда: осложненияИнфаркт миокарда: прогноз и реабилитация