Патогенез
Следствием и проявлением сердечной недостаточност является уменьшение или увеличение кровенаполнения, кровотока или (и) давления в тех или иных центральных и периферических звеньях кровообращения. Эти изменения возникают не только как прямое механическое следствие нарушения насосной функции сердца, но и как результат неадекватности адаптационных реакций. К таким реакциям относятся тахи- и брадикардия, изменения сосудистого периферического и легочного сопротивления, «централизация» кровообращения и другие формы перераспределения кровенаполнения, задержка жидкости, натрия, гипертрофия и расширение отдельных камер сердца и пр. Нарушения гемодинамики в свою очередь ведут к патологическим изменениям как в самом сердце и сосудах, так и в других органах и системах и сопровождаются расстройствами, ограничивающими жизненную активность больного и, в конечном счете, угрожающими его жизни.
Симптомы, течение неодинаковы для различных форм и стадий сердечной недостаточности.
Клинические формы:
-
Застойная левожелудочковая недостаточность характерна для митрального порока, для тяжелых форм ИБС — особенно у больных с артериальной гипертензией. Повышенное давление в легочных венах способствует наполнению левого желудочка и сохранению достаточного минутного объема сердца. В то же время застойные изменения в легких нарушают функцию внешнего дыхания и являются основным фактором, отягощающим состояние больного при этой форме СН. Проявления: одышка, ортопноэ, признаки застоя в легких аускультативные (сухие хрипы ниже уровня лопаток, мигрирующие влажные хрипы) и рентгенологические, сердечная астма и отек легких, вторичная легочная гипертензия, тахикардия. Левожелудочковая недостаточность выброса характерна для аортального порока, ИБС, артериальной гипертензии. Проявления: недостаточность мозгового кровообращения (головокружение, потемнение в глазах, обмороки), коронарная недостаточность, сфигмографические и эхокардиографические гризнаки низкого выброса. В тяжелых случаях возможны дыхание Чейна — Стокса, альтернирующий пульс (редко), пресистолический ритм галопа (патологический IV тон), клинические проявления застойной левожелудочковой недостаточности. В терминальной стадии может присоединиться правожелудочковая недостаточность. Застойная правожелудочковая нвдостаточность характерна для митрального и трикуспидального порока, констриктивного перикардита. Обычно присоединяется к застойной левожелудочковой недостаточности. Проявления: набухание шейных вен, высокое венозное давление, акроцианоз, увеличение печени, субиктеричность, отеки — полостные и периферические. Правожелудочковая недостаточность выброса характерна для стеноза легочной артерии, легочной гипертензии. Диагностируется и основном рентгенологически (обедненный периферический легочный сосудистый рисунок). Могут обнаруживаться другие признаки этой формы: одышка при строго определенном пороговом уровне физической нагрузки, гипертрофия правого желудочка — пальпаторные, затем и ЭКГ-признаки по типу «нагрузки давлением» (высокий зубец Я и снижение зубца Т в правых грудных отведениях). В особо тяжелых случаях серая окраска кожных покровов. Дистрофическая форма. Как правило, терминальная стадия правожелудочковой недостаточности. Варианты: а) кахектический; б) отечно-дистрофический с дистрофическими изменениями кожи (истончение, блеск, сглаженность рисунка, дряблость), отеками — распространенными или ограниченными подвижными, гипоальбуминвмией, в наиболее выраженных случаях — анасарка; в) некорригируемое солевое истощение.
В ряде случаев на первый план выступают изменения самого сердца (кардиомегалия, атриомегалия, мерцательная аритмия), что позволяет говорить о «центральной» форме сердечной недостаточности. В качестве особых форм со специфическими механизмами нарушения кровообращения и проявлениями рассматривают СН при «синих» врожденных пороках с недостаточным кровотоком в малом круге и несниженным или избыточным — в большом, при легочном сердце, тиреотоксикозе, анемии, артериовенозном соустье, циррозе печени, а также аритмогенную сердечную недостаточность. У больных с детства может развиться «пассивная адаптация» (малые масса тела и рост, плохое физическое развитие, резко сниженная физическая активность, инфантилизм). Перечисленные формы сердечной недостаточности встречаются в различных сочетаниях, часто удается выделить лишь ведущую форму.
Стадии развития и степень тяжести застойной сердечной недостаточности
Из многочисленных признаков СН. перечисляемых при описании той или иной стадии, необходимо выделить немногие, каждый из которых достаточен для определения конкретной стадии.
Стадия I. субъективные симптомы СН при умеренных или более значительных нагрузках. Стадия IIА.
-
выраженные субъективные симптомы СН при незначительных нагрузках; ортопноэ; приступы удушья; рентгенографические, в части случаев — и электрокардиографические признаки вторичной легочной гипертензии; повторное появление отеков; повторное увеличение печени ; кардиомегалия без других признаков этой стадии; мерцательная аритмия без других признаков этой стадии.
Стадия IIБ.
-
повторные приступы сердечной астмы; постоянные периферическив отеки; существенные полостные отеки — постоянные или появляющиеся повторно; стойкое увеличение печени, которая в ходе лечения может сократиться, но остается увеличенной; атриомегалия; кардиомегалия в сочетании хотя бы с одним из признаков предыдущей стадии; мерцательная аритмия в сочетании хотя бы с одним из признаков предыдущей стадии.
Стадия III, терминальная.
-
тяжелые субъективные расстройства при минимальных нагрузках или в покое; неоднократные в течение недели эпизоды сердечной астмы; дистрофические изменения органов и тканей.
Если имеется хотя бы один «достаточный» признак более тяжелой стадии, то должна быть установлена именно эта стадия. Приоритет отдается клиническим критериям. Отрицательные результаты инструментальных исследований часто оказываются непоказательными. Такие наиболее очевидные конечные проявления СН, как снижение минутного объема, недостаточное кровоснабжение органов и тканей и недостаточное обеспечение их кислородом могут отсутствовать не только в покое, но и при доступной больному нагрузке. Подобно артериальному давлению соответствующие показатели могут не выходить за широкие пределы вариантов нормы и при тяжелой СН — вплоть до последних дней и часов жизни больного («компенсация на патологическом уровне»).
Наиболее существенные «прямые» проявления СН, определяющие качество жизни больного, оцениваются по шкале, принятой в международной практике модифицированной классификации Нью-Йоркской кардиологической ассоциации. Функциональные классы (ФК) определяются появлением тягостной одышки, сердцебиения, чрезмерного утомления или ангинозной боли — хотя бы одного из этих субъективных проявлений СН. Эти проявления отсутствуют при «ФК О». При классах I — IV они возникают при нагрузках той или иной интенсивности;
ФК I — при нагрузках выше ординарных (при быстрой ходьбе по ровному месту или при подъеме по отлогому склону); ФК II — при ординарных, сопровождающих повседневную жизнедеятельность, умеренных нагрузках (появляются, когда больной идет наравне с другими людьми своего возраста по ровному месту); ФК III — при незначительных, менее ординарных нагрузках, которые заставляют останавливаться при ходьбе по ровному месту в обычном темпе, при небыстром подъеме на один этаж; ФК IV — при минимальных нагрузках (несколько шагов по комнате, надевание халата, рубашки) или в покое.
Для оценки толерантности к физической активности проводятся пробы с дозированной физической нагрузкой (велоэргометр, тредмил). При острых и подострых формах ИБС, аортальном и субаортальном стенозе, высокой артериальной гипертензии, выраженной СН они противопоказаны.
В развернутом диагнозе должны фигурировать форма и степень (стадия) СН, а также ее основные проявления: мерцательная аритмия. сердечная астма (редкие, частные эпизоды), отек легких, вторичная легочная гипертензия, гепатомегалия, асцит гидроперикард, анасарка, кахексия, кардиомегалия, атриомегалия.
Следует объективно оценивать субъективные симптомы и убедиться, что они обусловлены именно СН, а не другой причиной — такой, например, как заболевание легких или невротическая реакция. В сомнительных случаях необходимо исключить легочную, почечную недостаточность, цирроз печени, микседему.
Категория: Болезни органов кровообращения
Распространенность и причины анемии у пациентов с хронической сердечной недостаточностью
Несмотря на значительные успехи, достигнутые в лечении больных, хроническая сердечная недостаточность (ХСН) ассоциируется с высокими показателями заболеваемости и смертности. Кроме того, в настоящее время ХСН уже не являются исключительно “кардиологической” проблемой и приобретает ряд междисциплинарных аспектов для специалистов различных областей клинической медицины. Все большее внимание исследователей привлекает сочетание ХСН и анемии, которая зачастую лечится неадекватно или вообще не корригируется, а порой даже не выносится в диагноз. Между тем анемия вносит потенциальный вклад в развитие и прогрессирование ХСН [1].
Распространенность анемии среди пациентов c ХСН, по разным данным, составляет от 10 до 50 %. Такой большой разброс показателей можно объяснить отсутствием единого подхода к диагностике анемий, различиями в возрастном и половом составе пациентов [2], наличием сопутствующей патологии, в частности хронической почечной недостаточности, артериальной гипертензии [3] и степенью тяжести ХСН [4]
Причины и патогенетические механизмы анемии при ХСН неоднозначны. По данным J. Ezekowitz, у 58 % пациентов встречается анемия хронических заболеваний (АХЗ), у 21 % – железодефицитная анемия (ЖДА) [3]. Согласно сведениям J.N. Nanas, ЖДА диагностирована в 73 % случаев, АХЗ – в 18,9 %, у 5,7 % пациентов выявлена гемодилюция, а у 2,4 % – анемия трактовалась как следствие приема лекарств [5].
Дефицит витамина В12 и фолиевой кислоты встречается у пациентов с ХСН довольно редко [6]. Дефицит железа среди больных ХСН диагностировался, по разным данным, в 5–21 % случаев [3, 5, 7, 8]. ЖДА у больных ХСН может развиваться в результате синдрома мальабсорбции и скрытых желудочно-кишечных кровотечений, вызванных приемом ацетилсалициловой кислоты. В исследовании R. de Silva и соавт. показано, что в 43 % случаев встречается снижение концентрации либо сывороточного железа, либо ферритина, однако микроцитарная анемия обнаруживается лишь в 6 % случаев [9]. В то же время, согласно данным J.N. Nanas и соавт. снижение запаса железа в костном мозге обнаруживается у 73 % пациентов. При этом уровень сывороточного железа, ферритина и эритропоэтина (ЭПО) в сыворотке оставался в пределах нормы, а средний объем эритроцита соответствовал нижней границе нормы, что не укладывалось в микроцитарный характер анемии [5]. Эти данные свидетельствуют скорее о возможном “перераспределении” железа при ХСН из костного мозга в другие макрофагальные депо, где оно оказывается недоступным для эритропоэза даже при нормальном уровне сывороточного железа и ферритина, как это происходит при АХЗ [10].
Таким образом, абсолютный или относительный дефицит железа довольно часто встречается среди пациентов с ХСН и приводит к развитию анемического синдрома.
Нарушение функции почек
У больных ХСН нередко имеет место дисфункция почек с нарушением выработки ЭПО. Последний синтезируется преимущественно специализированными фибробластами, расположенными внутри коркового и мозгового слоев почек [11]. Основным сигналом для повышения выработки ЭПО служит снижение парциального давления кислорода. Как известно, почка весьма чувствительна к гипоксии, несмотря на то что получает около 25 % от сердечного выброса, а использует менее 10 % полученного кислорода. Согласно данным ряда авторов, уровень эндогенного ЭПО в крови у пациентов с ХСН достоверно выше, чем у здоровых людей, причем чем тяжелее степень ХСН, тем выше концентрация ЭПО [12, 13]. В то же время у пациентов с ХСН и наличием анемии чаще встречается низкая концентрация ЭПО. По-видимому, усиление выработки этого гормона почками в ответ на снижение перфузии при застойной ХСН непродолжительно [14]. При снижении фракции выброса на фоне застойной ХСН происходит уменьшение почечного кровотока [15], что в конечном итоге приводит к почечной дисфункции, которая обусловливает снижение выработки ЭПО с последующим развитием анемии [16].
Нарушения в ренин-ангиотензиновой системе
Анемия при ХСН может развиваться из-за нарушения в ренин-ангиотензиновой системе, а также вследствие приема ингибиторов ангиотензинпревращающего фермента (АПФ). Ренин-ангиотензиновая система играет важную роль в регуляции объема плазмы и числа эритроцитов. Увеличение концентрации ангиотензина II (АТ-II) в плазме приводит к изменению перитубулярного парциального давления кислорода [17]. Снижение парциального давления кислорода в перитубулярных фибробластах коркового вещества приводит к повышению концентрации активных форм кислорода внутри клетки, которые активируют фактор гипоксии HIF-1, увеличивая экспрессию гена ЭПО [18], т. е. АТ-II увеличивает секрецию ЭПО за счет эффектов снижения почечного кровотока и усиления реабсорбции в проксимальных канальцах. Имеются данные о том, что АТ-II оказывает прямое стимулирующее воздействие на эритроидный росток костного мозга [19]. Таким образом, применение ингибиторов АПФ и антагонистов рецепторов AT-II вызывает анемию путем снижения выработки ЭПО [20, 21]. В оригинальном исследовании А. Ishani и соавт. показано, что у пациентов с ХСН с нормальными показателями гематокрита на фоне приема эналаприла увеличивается частота выявления анемий в течение года. Тем не менее у пациентов, получавших эналаприл, выживаемость была выше по сравнению с пациентами, не получавшими данный препарат, даже при развитии анемического синдрома [20]. Это свидетельствует о том, что, несмотря на способность ингибиторов АПФ вызывать анемию, они остаются препаратами первого ряда при лечении ХСН.
Железоперераспределительный механизм (АХЗ)
При развитии ХСН отмечено нарастание концентрации фактора некроза опухоли α (ФНО-α), интерлейкина-6 (ИЛ-6) и других провоспалительных цитокинов [22], а также С-реактивного белка [23], что может приводить к уменьшению концентрации гемоглобина (Hb) [24]. Показано, что ИЛ-6 и ФНО-α ингибируют синтез ЭПО в почках путем активации гена GATA II и нуклеарного фактора В [25]. Это объясняет, почему у пациентов с ХСН снижается выработка эндогенного ЭПО после кратковременной стимуляции его синтеза. Кроме того, интерлейкины способны напрямую ингибировать эритроидный росток костного мозга [26], усугубляя анемию, хотя механизмы их действия остаются невыясненными. В экспериментах на крысах с индуцированной ХСН показано уменьшение числа клеток-предшественников эритроидного ростка и клеток, синтезирующих ЭПО [25].
В клиническом исследовании С. Opasich и соавт. причина анемии среди 148 пациентов с ХСН была выявлена лишь у 43 %, причем только у 5 % больных была диагностирована ЖДА. У остальных 57 % пациентов верифицировать генез анемии не удалось. Следует подчеркнуть, что именно у данной категории больных были выявлены нарушения синтеза гема, а также низкий уровень эндогенного ЭПО и высокая активность провоспалительных цитокинов, несмотря на адекватные депо железа в организме [8]. Еще одним механизмом развития анемии в условиях высокой концентрации ИЛ-6 является увеличение синтеза гепсидина печенью, который в свою очередь уменьшает всасывание железа в кишечнике. Кроме того, ИЛ-6 ингибирует экспрессию белка ферропортина на мембране клеток-депо железа (энтероцитов, гепатоцитов, макрофагов). Этот белок отвечает за транспорт железа из клетки наружу, т. е. снижение его количества приводит к нарушению высвобождения железа из депо [10]. Аналогичный механизм развития анемии наблюдается у онкологических пациентов [27]. Таким образом, активация провоспалительных цитокинов – основной механизм развития АХЗ – во многом обусловливает развитие анемии у пациентов с ХСН. На рис. 1 представлены основные патогенетические механизмы анемии при ХСН.
Влияние анемии на прогноз больных ХСН
Большинство исследователей приходят к заключению о неблагоприятном влиянии анемического синдрома на прогноз у больных ХСН. Так, у пациентов с тяжелой ХСН снижение содержания Hb оказалось независимым предиктором смертности (относительный риск – 1,131, 95 % доверительный интервал – 1,045–1,224 для снижения уровня Hb на 1 г/дл) [28].
В исследовании W.H.W. Tang и соавт. пациенты с ХСН и анемией имели значительно худший 3-летний прогноз, чем лица с нормальным уровнем Hb: общая смертность составила 47 и 26 % соответственно (р < 0,0001). При дальнейшем мониторинге общая смертность за 3 года составила 58 % при персистирующей анемии и 45 % при вновь выявленной анемии против 31 % в отсутствие анемии [29]. Имеются данные о более частых повторных госпитализациях больных ХСН с наличием анемии по сравнению с пациентами, имеющими нормальные показатели Hb [30].
Анализ исследования SOLVD (Studies Of Left Ventricular Dysfunction) показал, что уровень гематокрита является независимым фактором смертности при ХСН, а по данным Фрамингемского исследования, анемия сама по себе расценена как независимый фактор риска для ХСН [31]. По-видимому, неблагоприятное влияние анемии на прогноз пациентов с ХСН обусловлен ремоделированием миокарда левого желудочка (ЛЖ) в условиях нейрогуморальной активации [32], перегрузки объемом и дополнительной гипоксии. В экспериментальных работах показано развитие гипертрофии миокарда, а в дальнейшем и дилатирование камер сердца при индуцированной тяжелой анемии у крыс [33]. В клинических исследованиях выявлена гипертрофия миокарда ЛЖ у пациентов с анемией на фоне хронических заболеваний почек, хотя не ясно, была ли она связана с анемическим синдромом или же с артериальной гипертензией [34]. Данных, указывающих на прямую взаимосвязь гипертрофии миокарда ЛЖ и анемии, в зарубежной литературе не встречается. В то же время в исследовании RENAISSANCE (Randomized Etanercept North American Strategy to Study Antagonism of Cytokines) показано, что увеличение уровня Нb на 10 г/л в течение 24 недель у больных хронической болезнью почек сопровождается снижением массы миокарда ЛЖ на 4,1 г/м² [35]. По данным Е.В. Гончаровой, у больных хронической ЖДА в 89,3 % случаев развивается кардиомиопатия, характеризующаяся на поздних стадиях заболевания глобальной диастолической дисфункцией обоих желудочков и развитием гипертрофии ЛЖ – в основном за счет межжелудочковой перегородки [36].
Нами проведено исследование влияния анемии на показатели центральной гемодинамики у больных ХСН [37]. Показано, что у большинства (91 %) пациентов с ХСН с наличием тяжелой анемии происходит инотропная стимуляция миокарда с развитием гиперкинетического типа кровообращения. Выявлена сильная обратная корреляционная связь (r = -0,78, р < 0,05) между величиной фракции выброса (ФВ) ЛЖ и уровнем Hb (рис. 2 ).
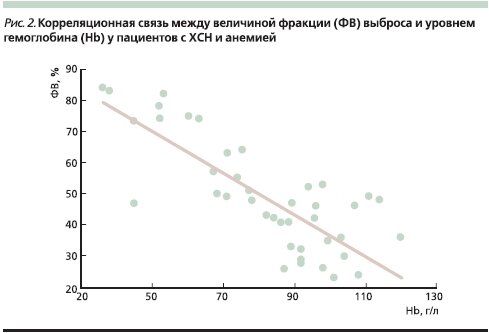
При этом оказалось, что увеличение ФВ и ударного объема происходило только вследствие изменения конечно-систолического объема без “привлечения” механизма Франка–Старлинга. В результате инотропной стимуляции миокарда на фоне анемической гипоксии ЛЖ способен развивать бoльшие напряжение и силу сокращения кардиомиоцитов при одной и той же величине конечного диастолического объема. Таким образом, тяжелая анемия вызывает у больных ХСН своеобразную эндогенную инотропную стимуляцию ЛЖ, что может оказывать негативное влияние на прогноз у данной категории пациентов. Такое предположение базируется на результатах многочисленных многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследований, которые показали, что использование негликозидных инотропных стимуляторов увеличивает риск смерти больных ХСН. Так, в исследовании PROMISE показано, что применение инотропного препарата милринон у пациентов с ХСН вызвало рост общей смертности на 28 %, сердечно-сосудистой – на 34 %, а летальность в наиболее тяжелой группе больных застойной ХСН IV функционального класса по NYHA (New York Heart Association) возросла на 53 % [38].
Таким образом, коморбидность ХСН с анемией представляет собой важную клиническую проблему, требующую дальнейшего изучения и уточнения механизмов развития анемии при ХСН, влияния ее на прогноз больных, разработку оптимальных способов коррекции анемического синдрома.
Анемии при хронической сердечной недостаточности
Копылов Ф.Ю. Щекочихин Д.Ю.
За последние десятилетия значительно увеличилась продолжительность жизни больных с хронической сердечной недостаточностью (ХСН). В этой связи перед кардиологами и терапевтами встал ряд новых вопросов относительно ведения больных с большим количеством сопутствующих заболеваний и состояний, таких как анемия и снижение функции почек.
В 2006 г. группа исследователей под руководством Д. Сильверберга (Donald Silverberg) сформулировала понятие о «кардиоренальном анемическом синдроме» (cardio renal anemia syndrome) при ХСН, что способствовало некоторым изменениям в тактике лечения данных пациентов [24]. Также за последнее время получены результаты нескольких исследований, позволяющих сделать определенные выводы относительно патогенеза и лечения анемии при ХСН, которые нашли свое отражение в настоящем обзоре.
Распространенность
и прогностическое значение
Согласно определению ВОЗ, анемия регистрируется у взрослых женщин при снижении концентрации гемоглобина ниже 12 г/дл, а у мужчин – ниже 13 г/дл [1].
Распространенность анемии среди пациентов с сердечно&ndash ;сосудистыми заболеваниями относительно хорошо изучена. Анемия является частым сопутствующим заболеванием при ХСН [2–10], ее распространенность варьирует в широком диапазоне от 4 до 61% (в среднем 18%) в зависимости от тяжести основного заболевания (функционального класса по NYHA) и применяемых критериев анемии [6].
Считается, что увеличение распространенности и тяжести анемии при ХСН [11,12] вызвано сочетанием нескольких факторов: увеличением возраста пациентов, что само по себе связано с более низким значением гемоглобина, возрастающей частотой хронической болезни почек, высокой заболеваемостью сахарным диабетом.
Факт увеличения общей и сердечно&ndash ;сосудистой смертности при наличии анемии у больных с ХСН подтвержден в большом количестве исследований. Так, в ретроспективном исследовании SOLVD показано, что снижение гематокрита на 1% увеличивает общую смертность больных ХСН на 2,7% [13]. Исследование OPTIME продемонстрировало увеличение риска смерти или повторной госпитализации на 12% при уровне гемоглобина менее 12 г/дл [14]. При этом более тяжелый функциональный класс СН по NYHA ассоциировался с более низким уровнем гемоглобина и высоким уровнем креатинина.
Анемия при ХСН также является независимым фактором риска более тяжелого течения заболевания: высокого функционального класса, сниженной переносимости физических нагрузок, когнитивных нарушений, низкого качества жизни [15].
Этиология и патогенез
Причины анемии у пациента кардиологического профиля столь же разнообразны, как и в общей популяции. Однако если рассматривать группу больных ХСН, то основными этиопатогенетическими факторами анемии, которые практически всегда сочетаются, можно считать следующие [11,12]:
1. анемия за счет гемодилюции (псевдоанемия);
2. анемия хронических заболеваний;
3. анемия за счет недостатка железа/витаминов;
4. нарушение функции почек – снижение продукции эритропоэтина;
5. действие лекарственных препаратов.
Анемия за счет гемодилюции (псевдоанемия)
Предполагается, что у многих больных ХСН анемия может быть вызвана гемодилюцией [10]. Данная причина анемии, или псевдоанемии, связана с избыточным «разбавлением» крови и характерна для пациентов с повышенным объемом плазмы. Однако проведенные исследования показали, что несмотря на увеличение общего объема плазмы у подавляющего большинства пациентов с систолической и диастолической ХСН истинный дефицит эритроцитов имеется у 88% больных анемией при диастолической ХСН и у 59% при систолической ХСН [16].
Анемия хронических заболеваний
Анемия, возникающая у пациентов с инфекцией, воспалением, опухолями, хронической почечной и сердечной недостаточностью и продолжающаяся более 1 мес. обозначается как анемия хронических заболеваний (АХЗ) — «анемия воспаления», «цитокинопосредованная анемия».
АХЗ по распространенности занимает 2–е место среди анемий в популяции (после железодефицитной – ЖДА) [7]. В случае наличия ХСН данный вид анемии является самым распространенным и отмечается у 58% пациентов [8].
В настоящее время считается, что в основе АХЗ лежит иммуноопосредованный механизм: цитокины и клетки РЭС вызывают изменения в гомеостазе железа, пролиферации эритроидных предшественников, продукции эритропоэтина и продолжительности жизни эритроцитов [9].
Открытие гепсидина (hepcidin) – железорегулирующего острофазового белка – позволило во многом прояснить связь между иммунным механизмом нарушения гомеостаза железа и развитием АХЗ: именно через усиление синтеза в печени гепсидина под влиянием воспалительных стимулов (главным образом интерлейкина–6) происходят снижение абсорбции железа в кишечнике и блокирование высвобождения железа из макрофагов. Дисрегуляция гомеостаза железа ведет к последующей недостаточности доступного железа для эритроидных предшественников, ослаблению пролиферации этих клеток вследствие негативного влияния на них нарушения биосинтеза гема.
Анемия за счет недостатка железа
Необходимо отметить, что еще 50 лет назад было показано непосредственное влияние железодефицита на ферментативные процессы, даже в отсутствие анемии [21]. Экспериментальные исследования на животных показали возможность непосредственного влияния железодефицита на диастолическую функцию, провоцирование сердечной недостаточности. фиброза миокарда, уменьшение уровня циркулирующего эритропоэтина, влияние на молекулярные сигнальные пути и активацию воспаления [22].
ЖДА, как уже сказано, является самой распространенной формой в популяции, однако у пациентов ХСН уступает первенство АХЗ и составляет до 21% [17]. Распространенность железодефицитного состояния при ХСН во многом зависит от критериев определения. Если учитывать лишь снижение насыщения трансферина менее 16%, то его можно обнаружить у 78% пациентов с ХСН с наличием анемии и у 61% при отсутствии снижения уровня гемоглобина, если к критериям добавить уровень ферритина менее 100 мг/л, то распространенность снизится до 25 и 26% соответственно [18]. В другом исследовании с аналогичными критериями железодефицита нарушения выявлены у 61% пациентов с анемией и у 43% без анемии среди больных ХСН [19]. Это стало основанием исследованиям роли терапии внутривенными препаратами железа у больных ХСН с железодефицитом вне зависимости от наличия анемии.
В качестве причины железодефицитного состояния у больных ХСН обсуждается, прежде всего, патология желудочно–кишечного тракта, в том числе кровотечения, связанные с применением антикоагулянтов и антиагрегантов.
Анемия при почечной недостаточности
У больных с хроническими заболеваниями почек наиболее важный вклад в развитие анемии вносят снижение продукции эритропоэтина вследствие уменьшения массы функциональных тканей почек и антипролиферативным действием уремических токсинов. Кроме того, развитие анемии может быть вызвано сокращением продолжительности жизни эритроцитов со 120 дней до 70–80, потерей крови, ингибированием эритропоэза в результате хронического воспаления, недостатком свободного железа в организме, дефицитом нутриентов. По современным представлениям, в случае ХПН можно говорить о едином патогенетическом механизме с АХЗ [23].
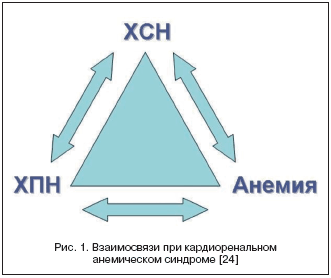
У большинства пациентов с ХСН и анемией имеется снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин./1,73 м2 Такое сочетание ХСН, анемии и хронической почечной недостаточности (ХПН) Silverberg D.S. с соавт. предложили называть уже упомянутом «кардиоренальным анемическим синдромом», каждое из трех составляющих которого ухудшает течение остальных двух [24] (рис. 1).
Действие лекарств
Среди большого количества фармакологических препаратов, обычно применяемых у пациентов с ХСН для лечения основного и сопутствующих заболеваний, можно выделить три основных лекарственных воздействия, которые могут провоцировать возникновение и поддержание анемии.
1. Иигибиторы ангиотензинпревращающего фермента и антагонисты к рецепторам ангиотензина могут уменьшать продукцию эритропоэтина и чувствительность к нему костного мозга, так как ангиотензин является мощным стимулятором синтеза эритропоэтина и эритропоэза [20].
2. Непосредственное подавление костного мозга (вплоть до апластической анемии) могут вызывать следующие лекарственные препараты: НПВП, мерказолил, метамизол.
3. Невозможность восстановления присутствующего в пище трехвалентного железа до двухвалентного (всасывающегося во много раз быстрее, чем трехвалентное) в связи с относительной гипоацидностью (обусловленной сопутствующим применением антисекреторных или антацидных препаратов).
Лечение
Терапевтические мероприятия, направленные на коррекцию анемии, должны быть обращены в первую очередь на устранение этиологического фактора. В соответствии с этим пациенты должны проходить полноценное обследование для выяснения причины анемии. В качестве основной терапии применяются пероральные и внутривенные препараты железа и препараты эритропоэтина.
Препараты железа
Терапия препаратами железа (ПЖ) должна проводиться при ЖДА как при наличии потенциально устранимой причины (эрозивно–язвенные и опухолевые поражения ЖКТ, миома матки, энтериты, алиментарная недостаточность и др.), так и при невозможности повлиять на источник железодефицита.
В настоящее время мы имеем широкий выбор препаратов железа для приема внутрь, которые назначаются в большинстве случаев (при отсутствии специальных показаний). Основные ПЖ в виде солей представлены сульфатом, глюконатом, хлоридом, фумаратом, глицинсульфатом. Среди ПЖ в виде железосодержащих комплексов, обладающих большей степенью абсорбции, имеются железо–полимальтозный комплекс, железо–сорбитоловый комплекс, протеин сукцинилат железа, железо–сахаратный комплекс.
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 3–4 нед. при этом минимальная суточная доза свободного железа должна составлять не менее 100 мг (оптимальная 150–200 мг). Поддерживающая терапия показана в тех ситуациях, когда сохраняется или трудно устранима причина дефицита железа (меноррагии, беременность, патология кишечника).
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Показания для внутривенного введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности: состоянием кишечного всасывания, а также переносимостью и эффективностью пероральных ПЖ.
Однако при сравнении эффективности пероральных и внутривенных препаратов железа в нефрологической практике показан лучший ответ при меньшем количестве побочных эффектов в последнем случае [25,26].
Учитывая общность патогенеза в большинстве случаев анемии при хронической болезни почек и ХСН данный подход был применен в кардиологической практике. В последние годы проведено несколько исследований, демонстрирующих значимый эффект препаратов внутривенного железа при ХСН [27–29], а именно достоверное увеличение уровня гемоглобина, фракции выброса левого желудочка, функционального класса ХСН, качества жизни, функции почек, снижение натрийуретических пептидов, С–реактивного белка, а также уменьшение частоты госпитализаций в связи с декомпенсацией ХСН.
Более того, даже у больных ХСН с дефицитом железа без анемии показано повышение функционального класса ХСН, потребления кислорода и общего состояния даже при отсутствии повышения гемоглобина при применении внутривенных препаратов железа [30].
На этом фоне интересным представляется появление в распоряжении врачей нового препарата железа в виде карбоксимальтозатного комплекса (Феринъект), обладающего существенно более удобным режимом введения (1 раз/нед.) и лучшим профилем безопасности по отношению к другим препаратам железа. Данная форма железа применялась в одном из недавних крупных исследований, аналогичном упомянутым выше, у пациентов с ХСН и дефицитом железа вне зависимости от наличия анемии – FAIR–HF, показавшем при 6–месячном наблюдении достоверный переход в более низкий функциональный класс ХСН и улучшение показателей качества жизни при применении внутривенного препарата железа вне зависимости от наличия снижения уровня гемоглобина [31].
В настоящий момент отсутствуют полноценные данные о влиянии монотерапии внутривенными препаратами железа на смертность и другие неблагоприятные исходы ХСН при долговременном наблюдении, для окончательного решения этого вопроса необходимы длительные крупные исследования, по результатам которых будут внесены изменения в соответствующие рекомендации.
Эритропоэтины
В нескольких исследованиях применения эритропоэтина в качестве монотерапии анемии или в сочетании с парентеральными препаратами железа у больных ХСН было показано снижение смертности и частоты госпитализаций [32]. Наряду с этим показано положительное влияние от данной терапии на различные клинические и функциональные показатели: систолическую и диастолическую функцию правого и левого желудочка, дилатацию камер сердца, гипертрофию левого желудочка, функциональный класс сердечной недостаточности, переносимость физических нагрузок, потребление кислорода, калорийность потребляемой пищи, качество жизни, активность эндотелиальных прогениторных клеток [32].
Эритропоэтины и их производные, позволяющие увеличить уровень гемоглобина в среднем на 2 г/дл, считаются основными препаратами для коррекции выраженной анемии при ХСН. Однако широкое применение этих средств, помимо сравнительно высокой стоимости, сдерживает ряд нерешенных вопросов.
Данные, полученные в онкологических исследованиях, свидетельствуют о повышенной частоте сердечно–сосудистых неблагоприятных исходов (в основном за счет тромботических осложнений) при превышении уровня гемоглобина более 12 г/дл. При этом стоит отметить, что дозы эритропоэтинов в данных исследованиях в несколько раз превышали, используемые при ХСН.
С другой стороны, у пациентов с ХСН и ХПН не выявлено дополнительного преимущества повышения уровня гемоглобина выше 11–12 г/дл, более того, отмечено повышенное количество неблагоприятных исходов при повышении уровня гемоглобина выше 13 г/дл, т.н. U–образная зависимость уровня гемоглобина и смертности [33].
Учитывая эти данные, при отсутствии официальных рекомендаций по целевому уровню гемоглобина при ХСН большинство исследователей сходятся на значении – 12 г/дл [32].
Заключение
В настоящее время существуют достоверные данные о необходимости активного выявления и коррекции анемии у пациентов ХСН. Накопленная доказательная база у данных больных по лечению анемии эритропоэтинами в качестве монотерапии или в сочетании с препаратами внутривенного железа не позволяет однозначно определить целесообразность и безопасность такого подхода.
Данные исследований по применению внутривенных препаратов железа в качестве монотерапии у больных ХСН и железодефицитом вне зависимости от наличия анемии могут существенно расширить показания для их применения при данной патологии.
Этот и некоторые другие вопросы, как, например, поиск универсального маркера ответа при терапии препаратами железа, целевые уровни гемоглобина при различных заболеваниях требуют своего разрешения в научных работах.
Литература
1. World Health Organization. Nutritional Anemias: Report of a WHO Scientific Group. Geneva: World Health Organization, 1968.
2. Dallman et al. In: Iron Nutrition in Health and Disease. London, UK: John Libbey & Co; 1996:65–74.
3. Sarnak MJ, Tighiouart H, Manjunath G, et al: Anemia as a risk factor for cardiovascular disease in The Atherosclerosis Risk in Communities (ARIC) study. J Am Coll Cardiol 40:27–33, 2002
4. Lipgic E. Asselbergs F.W. van der Meer P. Tio R.A. Voors A.A. van Gilst W.H. Zijlstra F. van Veldhuisen D.J. Anaemia predicts cardiovascular events in patients with stable coronary artery disease Netherlands Heart Journal, 2005, 13,7/8, 254–258;
5. McKechnie RS, Smith D, Montoye C, Kline–Rogers E, O’Donnell MJ, DeFranco AC, Meengs WL, McNamara R, McGinnity JG, Patel K, Share D, Riba A, Khanal S, Moscucci M;Blue Cross Blue Shield of Michigan Cardiovascular Consortium (BMC2). Prognostic implication of anemia on in–hospital outcomes after percutaneous coronary intervention. Circulation. 2004 Jul 20;110(3):271–7.
6.Tang Y.–D. Katz S.D. Anemia in Chronic Heart Failure: Prevalence, Etiology, Clinical Correlates, and Treatment Options Circulation 2006;113;2454–2461
7. Cash J.M. Slars D.A. The anemia of chronic disease: spectrum of associated diseases in series of unselected hospitalized patients // Am. J. Med. — 1989; — 87: 638.
8. Ezekowitz JA, McAlister FA, Armstrong PW. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12 065 patients with new–onset heart failure. Circulation. 2003 Jan 21;107(2):223–25
9. Weiss G. Goodnough L.T. Anemia of Chronic Disease // New. Eng. J. Med. — 2005. — Vol 352. — 10. — 1011—1023.
10. Androne AS, Katz SD, Lund L, LaManca J, Hudaihed A, Hryniewicz K, Mancini DM: Hemodilution is common in patients with advanced heart failure. Circulation 2003; 107: 226–229
11. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM: Secular trends in renal dysfunction in hospitalized heart failure patients. J Card Fail 2006; 12: 257– 262.
12. Dunlay SD, Weston SA, Redfield MM, Killian JM, Roger VL: Anemia and heart failure: a community study. Am J Med 2008; 121: 726–732.
13. Al–Ahmad A, Rand WM, Manjunath G, Konstam MA, Salem DN, Levey AS, Sarnak MJ. Reduced kidney function and anemia as risk factors for mortality in patients with left ventricular dysfunction. J Am Coll Cardiol. 2001 Oct;38(4):955–62.
14. Felker GM, Shaw LK, Stough WG, O’Connor CM. Anemia in patients with heart failure and preserved systolic function. Am Heart J. 2006 Feb;151(2):457–62.
15. Ghali JK, Anand IS, Abraham WT, Fonarow GC, Greenberg B, Krum H, Massie BM, Wasserman SM, Trotman ML, Sun Y, Knusel B, Armstrong P; Study of Anemia in Heart Failure Trial (STAMINA–HeFT) Group. Randomized double–blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation. 2008 Jan 29;117(4):526–35.
16. Abramov D, Cohen RS, Katz SD, Mancini D, Maurer MS: Comparison of blood volume characteristics in anemic patients with low versus preserved left ventricular ejection fraction. Am J Cardiol 2008; 102: 1069–1072.
17. Anand IS. Anemia and chronic heart failure: implications and treatment options. J Am Coll Cardiol 2008;52:501–11.
18. Murphy CL, Fitzsimons EJ, Jardine AJ, Sattar N, Mcmurray JJV: Routine assessment of iron status in all patients with heart failure may identify those at risk of developing anemia. Eur J Heart Fail Suppl 2007; 61: 24
19. Grzeslo A, Jankowska EA, Witkowski T, Majda J, Petruk–Kowalczyk J, Banasiak W, Ponikowski P: Iron deficiency is a common finding in patients with stable chronic heart failure. Eur J Heart Fail Suppl 2006; 5: 132.
20. Орлов В.А. Гиляревский С.Р. Урусбиева Д.М. Даурбекова Л.В. Влияние побочных эффектов ингибиторов ангиотензинпревращающего ферменты на тактику лечения сердечно–сосудистых заболеваний. Российский кардиологический журнал, 2005, N3, 45–49.
21. Beutler E, Larsh SE, Gurney CW: Iron therapy in chronically fatigued, nonanemic women: a double–blind study. Ann Intern Med 1960; 52: 378–394.
22. Naito Y, Tsujino T, Matsumoto M, Sakoda T, Ohyanagi M, Masuyama T: Adaptive response of the heart to long–term anemia induced by iron deficiency. Am J Physiol Heart Circ Physiol 2009; 296:H585–H593.
23. Weiss G: Iron metabolism in the anemia of chronic disease. Biochim Biophys Acta 2009; 1790: 682–693.
24. Silverberg DS, Wexler D, Iaina A, Steinbruch S, Wollman Y, Schwartz D. Anemia, chronic renal disease and congestive heart failure––the cardio renal anemia syndrome: the need for cooperation between cardiologists and nephrologists. Int Urol Nephrol. 2006;38(2):295–310.
25. Van Wyck DB, Roppolo M, Martinez CO, Mazey RM, McMurray S, for the United States Iron Sucrose (Venofer) Clinical Trials Group: A randomized, controlled trial comparing IV iron sucrose to oral iron in anemic patients with nondialysis–dependent CKD. Kidney Int 2005; 68: 2846–2856.
26. Rozen–Zvi B, Gafter–Gvili A, Paul M, Leibovici L, Shpilberg O, Gafter U: Intravenous versus oral iron supplementation for the treatment of anemia in CKD: systematic review and meta–analysis Am J Kidney Dis 2008; 52: 897–906.
27. Bolger AP, Bartlett FR, Penston HS, O‘Leary J, Pollock N, Kaprielian R, Chapman CM: Intravenous iron alone for the treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol 2006; 48: 1225–1227.
28. Usmanov RI, Zueva EB, Silverberg DS, Shaked M: Intravenous iron without erythropoietin for the treatment of iron deficiency anemia in patients with moderate to severe congestive heart failure and chronic renal insufficiency. J Nephrol 2008; 21: 236–242.
29. Toblli J, Lombrana A, Duarte P, Di Gennaro F: Intravenous iron reduces NT–pro–brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol 2007; 50: 1657–1665.
30. Okonko DO, Grzeslo A, Witkowski T, Mandal AK, Slater RM, Roughton M, Foldes G, Thum T, Majda J, Banasiak W, Missouris CG, Poole–Wilson PA, Anker SD, Ponikowski P: Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC–HF: a randomized, controlled, observer–blinded trial. J Am Coll Cardiol 2008; 51: 103–112.
31. Anker SD, Comin Colet J, Filippatos G, Willenheimer R, Dickstein K, Drexler H, Luscher TF, Bart B, Banasiak W, Niegowska J, Kirwan BA, Mori C, von Eisenhart Rothe B, Pocock SJ, Poole–Wilson PA, Ponikowski P; FAIR–HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009 Dec 17;361(25):2436–48.
32. Silverberg DS, Wexler D. Iaina A. SchwartzD.Chronic Heart Failure: The Cardiorenal Anemia Syndrome Transfusion Alter Transfusion Med. 2009;10(4):189–196.
33. [KDOQI; National Kidney Foundation. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease. Am J Kidney Dis 2006; 47 (5 Suppl.3): S11–145].