Как себя вести после операции ангиопластики и стентирования коронарных артерий?
К сожалению, медицина еще не научилась полностью устранять последствия атеросклероза. Чтобы после проведения процедуры ангиопластики и стентирования сохранить достигнутый положительный эффект максимально длительное время, придется постоянно соблюдать некоторые несложные правила.
Во-первых, это режим рационального питания. Чтобы обеспечить потребности организма, питаться следует разнообразно. Пища должна доставлять организму энергию, белки, витамины, минеральные вещества и клетчатку.
Содержание в диете жиров животного происхождения нужно снизить. При приготовлении пищи дома сливочное масло и маргарин лучше заменить растительными маслами. среди которых предпочтительнее оливковое и рапсовое.
Не забывайте об овощах и фруктах, зернопродуктах. Они должны быть на столе ежедневно. От сахара лучше отказаться или хотя бы ограничиться парой кусочков в сутки. Вместо него в умеренных количествах лучше использовать мед или сладкие сухофрукты. Не стоит полностью отказываться от соли, но ее дневное потребление не должно превышать пяти граммов .
Измените отношение к алкоголю. Его опасность в том, что он поставляет организму непропорционально большое количество энергии, но не содержит практически никаких питательных веществ. Полностью откажитесь от крепких напитков и пива. В качестве исключения можно позволить себе небольшое количество (не более стакана в сутки) натурального сухого некрепленого виноградного красного вина.
Иногда больные стенокардией боятся физических нагрузок. После перенесенного инфаркта боязнь усиливается. Косвенно этому способствует господствующий метод лечения инфарктов, основанный на длительном обездвиживании пациента.
Но, тем не менее, разумные физические нагрузки необходимы сердцу. Рационально подобранный режим физической активности ничего, кроме положительного эффекта, не принесет. Посильная нагрузка способствует экономной работе сердца за счет снижения пульса, нормализации артериального давления и улучшения холестеринового обмена. Кроме того, движение способствует снижению массы тела и улучшению психологического состояния.
Не стоит бросаться в другую крайность и сломя голову бежать на стадион. Виды физической активности и их интенсивность подбираются строго индивидуально по рекомендации лечащего врача .
Физические тренировки должны быть регулярными. Если вы не привыкли к этому, придется постараться и заставить себя заниматься как минимум через день на протяжении 30-50 минут. Методика занятия стандартна: разминка, основная тренировка и восстановление. Не забывайте контролировать пульс и давление. Напомню, что для здорового человека максимально возможная частота пульса определяется как 220 минус на количество прожитых лет. Ориентируйтесь на цифры, не превышающие 60% от этого значения. Предельные цифры давления, еще считающегося нормальным – 140/90.
Почувствовав себя здоровым человеком после операции ангиопластики и стентирования коронарных артерий, не забывайте, что на самом деле болезнь только отступила. Обязательно посещайте лечащего врача хотя бы пару раз в год и неукоснительно выполняйте его рекомендации. Даже если самочувствие отличное.
Доброго здоровья и долгой жизни.
P.S. Совсем забыл. НЕ КУРИТЕ.
Питание после стентирования сосудов сердца
Содержание
 Стентирование сосудов, особенно коронарных артерий, — очень важная операция, с помощью которой облегчается состояние пациента. Она помогает избежать серьезных осложнений, так как способствует восстановлению кровотока.
Стентирование сосудов, особенно коронарных артерий, — очень важная операция, с помощью которой облегчается состояние пациента. Она помогает избежать серьезных осложнений, так как способствует восстановлению кровотока.
Решение о таком оперативном вмешательстве принимает врач, однако, не все могут позволить себе ее из-за немалой стоимости.
Однако стоит приложить усилия, чтобы все же сделать ее, иначе это может стоить жизни. Конечно, такая операция принесет пользу только в том случае, если соблюдать режим питания и физической активности после нее. Очень важно следить за состоянием своего организма, тогда будет виден хороший результат. Давайте посмотрим, насколько важна эта операция и как нужно жить после нее.
Значимость
Наш образ жизни и современная экология сильно сказывается на здоровье, что приводит проблемам в различных органах и системах. Зачастую в первую очередь страдает сердечно-сосудистая система. Стентирование помогает нормализовать кровообращение в нашем жизненном моторе. Эту операцию начали проводить с 1993 года. Это стало настоящим открытием, тем более что сегодня заболевания сердца и сосудов поражают все больше людей.
Статистика говорит о том, что раньше возраст пациентов, испытывающих проблемы в этой области, составлял около 50 лет. Сегодня возраст молодеет и все чаще такие недуги обнаруживаются у пациентов в молодом возрасте.
Такое происходит из-за экологии, условий труда, уровня жизни и генетической предрасположенности. Однако наша цель не рассмотреть причины сбоя в работе сердца, нам нужно понять, насколько важно проводить стентирование, если его назначает врач, и как жить после этой операции.
Сердце является главным органом в человеческом организме. Именно с помощью него обеспечивается циркуляция крови в тканях и органах. Если этот мотор работает плохо, ткани и органы перестают получать необходимые вещества и элементы, что приводи к развитию различных заболеваний. Для того чтобы все составляющие нашего организма были обеспечены необходимыми питательными элементами и кислородом, нужна разветвленная сеть коронарных артерий и их правильная работа.
Если в артериях происходя отрицательные изменения, ухудшается работа кровоснабжения сердца, из-за чего развиваются опасные заболевания. В последнее время очень частым явлением стало сужение коронарных сосудов, которое приводит к повреждению миокарда и ишемической болезни сердца.
 Долгое время специалисты проводили операции, которые были основаны на полноценном хирургическом вмешательстве. Это не всегда приносило ожидаемую пользу. Более того, после таких операций шел долгий период восстановления.
Долгое время специалисты проводили операции, которые были основаны на полноценном хирургическом вмешательстве. Это не всегда приносило ожидаемую пользу. Более того, после таких операций шел долгий период восстановления.
К счастью, были изобретены малотравматичные методы, которые позволяют избежать серьезной хирургической операции. Одним из них является как раз стентирование коронарных сосудов.
Несмотря на это, многие пациенты испытывают сильный страх даже перед таким оперативным вмешательством. Таким людям важно понять, что, если врач посоветовал сделать стентирование, это единственный способ, позволяющий спасти жизнь и избежать осложнений. Чтобы уменьшить страх, рассмотрим суть стентирования.
Стент – это тонкая трубка, которая состоит из металлических ячеек. С помощью катетера он вводится в поврежденный сосуд, после чего раздувается специальным баллончиком. Стент вжимается в артериальные стенки, тем самым раздвигая их. Это способствует восстановлению кровяного тока по артерии.
Обычно такая операция проводится под местным наркозом, так как в том месте, где расположена бедренная артерия, куда вводят катетер и стент, делается прокол. Анестезия позволит не чувствовать боли, поэтому ее бояться не нужно. Самому человеку дают успокаивающие средства. Пациент не ощущает боли во время операции еще и потому, что внутренние артериальные стенки не имеют нервных окончаний. Часто люди боятся именно боли, в этом случае, как мы увидели, такого не происходит.
Осложнения
 Многие боятся, что после операции могут возникнуть осложнения. Для начала стоит понять, что риск осложнений после проведения операции намного меньше, чем, если операцию вообще не провести, ведь это может стоить жизни.
Многие боятся, что после операции могут возникнуть осложнения. Для начала стоит понять, что риск осложнений после проведения операции намного меньше, чем, если операцию вообще не провести, ведь это может стоить жизни.
Так как операция малотравматичная, последствия после нее минимальные. В редких случаях могут возникнуть некоторые осложнения:
- нарушение целостности ткани во время операции и открытие кровотечения;
- проблемы с почками;
- гематомы в области прокола;
- тромбирование тканей в месте установки стента.
Еще реже может произойти закупорка артерии. Однако стоит учитывать, что после стентирования пациент находится под постоянным контролем, поэтому при возникновении чрезвычайной ситуации будут приняты необходимые меры. В случае закупорки артерий проводится срочная операция.
Осложнения, которые вызываются возникновением тромба, устраняются приемом лекарственных препаратов, обладающих противосвертывающим действием, хотя такие лекарства нельзя принимать тем, у кого есть нарушения, связанные с работой печени или почек.
Для того чтобы свести риск осложнений к минимуму необходимо соблюдать все меры после операции, о которых скажет врач. Период реабилитации после операции очень важен и включает в себя несколько важных моментов, включая диету.
Реабилитация
Часто до операции и до того момента, пока не выявились серьезные проблемы с сосудами, человек ведет неправильный образ жизни.
Он очень много или очень мало двигается, курит, употребляет спиртные напитки, испытывает частый стресс и питается теми продуктами, которые только усугубляют его состояние.
После операции необходимо в корне изменить такие привычки и начать жить, как говорится, с чистого листа.
- После операции пациент должен придерживаться строгого постельного режима. В это время ведется особо тщательный контроль, позволяющий увидеть последствия после операции.
- После того как пациента выписали домой, он должен обеспечить себе покой. Важно избегать физических нагрузок. Нельзя принимать горячий душ или ванну. Не нужно рисковать опасными обстановками, пока не нормализуется состояние, а это значит, что не стоит садиться за руль. Однако то, что следует воздерживаться от физических нагрузок, не значит, что совсем нельзя шевелиться. Движения полезны, но в меру. Нужно гулять спокойным прогулочным шагом, но расстояния поначалу должны быть небольшими.
- Важно принимать специальные лекарственные препараты, назначенные врачом.
 Стентирование убирает последствия ишемии, но причина, которая вызвала атеросклероз и сужение сосуда, осталась. Это значит, что остались и факторы риска. Реабилитация предполагает, что необходимо выполнять комплекс процедур, даже несмотря на хорошее самочувствие. Нельзя прекращать прием назначенных лекарств или самостоятельно менять их дозу
Стентирование убирает последствия ишемии, но причина, которая вызвала атеросклероз и сужение сосуда, осталась. Это значит, что остались и факторы риска. Реабилитация предполагает, что необходимо выполнять комплекс процедур, даже несмотря на хорошее самочувствие. Нельзя прекращать прием назначенных лекарств или самостоятельно менять их дозу
Некоторые пациенты хотят как можно быстрее войти в привычный для них ритм жизни, однако, в этом деле спешить не стоит. Стентирование – серьезная процедура, которая требует соблюдения определенного графика.
Очень важно не допускать повышения артериального давления, если же это происходит, нужно принимать назначенные лекарства, чтобы избежать развития инфаркта. Если стентирование проводилось человеку, который страдает сахарным диабетом, ему необходимо принимать препараты, снижающие уровень сахара в крови.
После определенного периода пациенту можно делать определенные упражнения. При этом важно соблюдать несколько правил.
- Гимнастика выполняется каждый день минимум по 30 минут. Это поможет поддерживать правильный вес, укрепить мышечную ткань и нормализовать давление.
- Упражнения необходимо выполнять и после периода реабилитации.
Очень важный момент, о котором никак нельзя забывать после операции, — диета. Правильное питание – залог хорошего здоровья.
Диета
Диета направлена на нормализацию веса. Кроме того, она помогает минимизировать негативные факторы, способствующие развитию ИБС. Питаясь, необходимо учитывать некоторые важные моменты.
-
 В продуктах должно содержаться минимум жиров. Жиры животного происхождения следует полностью исключить из рациона.
В продуктах должно содержаться минимум жиров. Жиры животного происхождения следует полностью исключить из рациона. - Следует отказаться от крепкого чая и кофе.
- Нужно перестать кушать сливочное масло, можно заменить его растительным.
- Новый рацион должен включать в себя много фруктов, овощей и ягод.
- Хорошо, если меню будет содержать много продуктов с полиненасыщенными кислотами.
- Стоит ограничить употребление соли.
- Кушать нужно 6 раз в день небольшими порциями. Нельзя кушать на ночь. Перед сном нельзя кушать за три часа.
- За сутки не стоит употреблять более 2300 калорий.
Прогноз
Стентирование является относительно безопасной операцией, которая приносит хорошие плоды. Риск осложнений очень мал. После нее пациент не просто возвращается к обычному жизненному темпу, но и восстанавливает работоспособность.
Неправильный образ жизни после операции вновь станет причиной закупорки артериального просвета, поэтому необходимо следить за своим питанием и режимом, тогда операция принесет видимую пользу.
Рекомендуем также почитать
Как вести больного после чрескожного коронарного вмешательства?
Карпов Ю.А. Буза В.В.
В нашей стране ведущей причиной смертности, особенно в трудоспособном возрасте, является ишемическая болезнь сердца (ИБС), вследствие которой ежегодно погибают около 600 тыс. человек. При этом заболевании, связанном с атеросклерозом коронарных артерий, могут применяться как медикаментозные, так и инвазивные методы лечения, причем последние обязательно должны сочетаться с полномасштабной лекарственной терапией. Инвазивные методы – чрескожные коронарные вмешательства (ЧКВ), в том числе стентирование и коронарное шунтирование (КШ) – играют значительную роль в решении двух основных задач при лечении ИБС. Первая – улучшить прогноз, предотвратить возникновение инфаркта миокарда (ИМ) и внезапную смерть и, соответственно, увеличить продолжительность жизни. Вторая – уменьшить частоту и снизить интенсивность приступов стенокардии и тем самым улучшить качество жизни пациента.
Успешно выполненное ЧКВ приводит у большинства больных к устранению или уменьшению приступов стенокардии (ишемии миокарда), а в некоторых случаях предотвращает развитие острого коронарного синдрома (ОКС), улучшает отдаленный прогноз. Однако ЧКВ не устраняет причину ИБС – атеросклероз, а лишь нивелирует патофизиологическое влияние гемодинамически значимой атеросклеротической бляшки. Атеросклеротический процесс может прогрессировать как в стентированном или баллонированном, так и в других сегментах коронарного русла. Кроме того, имплантация инородного тела – стента может породить ятрогенную болезнь – тромбоз стента, который может развиться и в отдаленном периоде. В этой ситуации необходимо неукоснительно соблюдать все меры вторичной профилактики ИБС, для которых доказано снижение риска развития коронарных и церебральных осложнений, сердечно–сосудистой смертности у больных после ЧКВ.
Немедикаментозные мероприятия
Прекращение курения является одной из самых важных мер по изменению образа жизни больных ИБС, поэтому всем пациентам необходимо настоятельно рекомендовать бросить курить. Разумно подчеркивать вредное влияние курения именно на сердечно–сосудистую систему, в том числе обратить внимание на высокую вероятность повторного вмешательства в будущем при его продолжении. При невозможности прекращения курения сразу рекомендуется разработка плана постепенного сокращения числа выкуренных сигарет. В период отмены для уменьшения абстинентных симптомов возможно использование никотиновых пластырей, а также применение других способов фармакопрофилактики (например, назначение антидепрессанта бупропиона). Больной должен не только отказаться от активного курения, но и избегать нахождения в помещениях, где курят другие люди (пассивное курение).
Всем больным после ЧКВ при выписке необходимо рекомендовать увеличение физической активности. Уровень физической активности должен быть индивидуализирован с учетом полноты реваскуляризации, наличия перенесенного ИМ, хронической сердечной недостаточности (ХСН) и т.д. Если больной без ИМ, ХСН в анамнезе после полной реваскуляризации, сразу после заживления места пункции практически не имеет ограничений в плане физической нагрузки, то больной с ХСН или недавним перенесенным ИМ требует специальной реабилитации с постепенным увеличением и расширением уровня нагрузки. В целом пациентам после вмешательства. как и другим больным ИБС, рекомендовано не менее 30–60 мин. умеренной аэробной активности несколько дней в неделю (в идеале – ежедневно). Классическим примером умеренной аэробной активности является быстрая ходьба, однако возможны и занятия домашними делами, работа на даче и др.
Во время нахождения в стационаре пациентам обязательно рассчитывают индекс массы тела (ИМТ), а также измеряют окружность талии. Если ИМТ выше 24,9 кг/м2, необходим комплекс мер, направленных на снижение веса. Они обязательно включают уменьшение калорийности потребляемой пищи, увеличение физической активности. Важно подчеркнуть, что снижение веса должно носить постепенный характер. Первой целью является снижение массы тела на 10% и закрепление полученного результата. В дальнейшем возможно снижение веса для достижения ИМТ менее 24,9 кг/м2. Кроме того, при окружности талии у женщин 89 см и более, а у мужчин 102 см и более требуются дополнительные меры, связанные с лечением метаболического синдрома.
У пациентов с сахарным диабетом (СД) необходимо проводить комплекс мер, включающих диетические мероприятия, прием гипогликемических препаратов, с целью снижения уровня гликированного гемоглобина менее 6,5%. При этом особое значение имеют нормализация веса, увеличение физической активности, достижение целевого уровня АД и нормализация липидного профиля. Все эти меры должны координироваться эндокринологом.
Больным с уровнем АД 140/90 мм рт.ст. и выше необходимо рекомендовать комплекс мер, направленных на снижение уровня АД. Эти меры включают в себя снижение веса, увеличение физической активности, ограничение употребления алкоголя, снижение употребления поваренной соли, увеличение потребления свежих овощей и фруктов, а также молочных продуктов с низким содержанием жира. В случае назначения гипотензивной терапии следует начинать с b–блокаторов, ингибиторов АПФ, а при необходимости добавить другие препараты.
В последнее время всем больным ИБС рекомендуется проведение сезонной вакцинации от гриппа, что снижает вероятность ухудшения течения заболевания, особенно в период вспышек гриппа.
Медикаментозное лечение
Важнейшее значение среди мероприятий вторичной профилактики придается коррекции уровня липидов крови. Обязательно назначение гиполипидемической диеты, включающей снижение уровня потребления насыщенных жиров – менее 7% от общего калоража пищи; ограничение употребления продуктов с высоким содержанием холестерина (в идеале – со снижением потребления общего холестерина до уровня менее 200 мг в сутки). Рекомендуется увеличить потребление пищевых волокон до уровня более 10 г в сутки, растительных стеролов, станолов – до 2 г и более в сутки, что также дополнительно снижает уровень ХС ЛПНП.
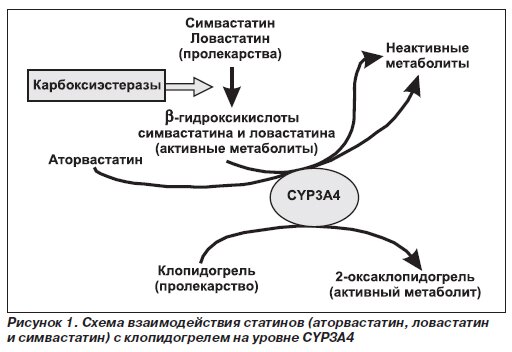
Липидснижающая терапия. Важнейшим направлением медикаментозного лечения больных ИБС является применение лекарственных средств, понижающих содержание липидов в крови. Основными средствами, снижающими уровни холестерина и холестерина липопротеидов низкой плотности (ХС ЛПНП) в плазме крови, являются ингибиторы синтеза холестерина – статины. Наиболее важной целью коррекции липидного профиля является снижение уровня ХС ЛПНП менее 2,5 ммоль/л, а у пациентов высокого риска – менее 1,8 ммоль/л. Одним из наиболее широко применяемых статинов в клинической практике является аторвастатин.
Аторвастатин (Атомакс) обеспечивает снижение повышенных уровней общего холестерина, холестерина ЛПНП, аполипопротеина B и триглицеридов и повышение уровня холестерина ЛПВП у пациентов с первичной гиперхолестеринемией, гетерозиготной семейной и несемейной гиперхолестеринемией и комбинированной (смешанной) гиперлипидемией (типы IIa и IIb по Фредриксону) в сочетании с диетой. Атомакс назначают в среднем 10 мг 1 раз/сут. Доза варьирует от 10 до 80 мг. Препарат можно принимать в любое время дня независимо от приема пищи. Дозу подбирают с учетом исходных уровней холестерина/ЛПНП, цели терапии и индивидуального эффекта. В начале лечения и/или во время повышения дозы Атомакса необходимо каждые 2–4 нед. контролировать уровни липидов в плазме крови и соответствующим образом корригировать дозу. В большинстве случаев бывает достаточным назначение дозы 10 мг препарата Атомакс 1 раз/сут. Существенный терапевтический эффект наблюдается, как правило, через 2 нед. максимальный терапевтический эффект обычно наступает уже через 4 нед. При длительном лечении этот эффект сохраняется.
В ранних крупных исследованиях только у относительно небольшого числа больных до включения были выполнены ЧКВ – от 8% до 1/3 пациентов, а терапия статинами начиналась в среднем через 6 мес. после вмешательства. Тем не менее, по данным ретроспективного анализа исследования CARE, польза от их применения у этого контингента была бо’льшей, чем в основной группе больных.
Еще сравнительно недавно врачи пренебрегали назначением статинов у больных с ЧКВ. В одном европейском исследовании только 25% больных получали терапию статинами через 6 мес. после ЧКВ. По данным проведенного в одной из клиник США исследования, в котором анализировалось течение ИБС у 5052 больных после ЧКВ в течение 1993–1999 гг. частота назначения статинов составила 26,5%. Таким образом, несмотря на снижение числа неблагоприятных событий после ЧКВ (замедление прогрессирования атеросклеротического поражения коронарных артерий), профилактическое действие статинов в плане предупреждения развития рестеноза после ЧКВ представляется сомнительным.
Влияние применения статинов на частоту развития рестеноза после стентирования менее изучено. В ретроспективном исследовании Walter с участием 525 больных было показано, что применение статинов после стентирования привело к меньшей частоте ангиографически определяемого рестеноза с 38% в группе плацебо по сравнению с 25,4% в группе лечения статинами (р<0,005). Это может быть связано с тем, что в механизме рестеноза после стентирования основную роль играет пролиферация интимы.
Были проведены исследования по оценке влияния статинотерапии, назначенной до ЧКВ, на риск развития осложнений процедуры и течение заболевания. В исследовании ARMYDA изучалась гипотеза о профилактическом действии краткосрочного приема статинов при проведении инвазивного лечения. В исследование было включено 153 пациента со стабильным течением ИБС (не получавших ранее статинов), которым предстояло проведение ЧКВ. Больные были рандомизированы в две группы: в одной группе (n=76) в течение 7 дней до проведения вмешательства был назначен аторвастатин в дозе 40 мг, вторая группа (n=77) получала плацебо. Через 6 и 24 ч после проведения ЧКВ у больных измерялись уровни маркеров некроза миокарда – КФК–МБ, тропонина I, миоглобина.
По данным этого исследования, прием аторвастатина в течение 7 дней до проведения процедуры привел к выраженному защитному эффекту. Число больных, у которых отмечалось повышение уровня маркеров повреждения миокарда (выше верхней границы нормы), было равно: по КФК МБ – 12% в группе аторвастатина против 35% в группе плацебо (p<0,001), по тропонину I – 20% в группе аторвастатина против 48% в группе плацебо (p<0,0004), по миоглобину – 22% против 51% соответственно (p<0,0005). В группе лечения аторвастатином реже отмечалось развитие ИМ, который, согласно новым критериям, определялся как повышение уровня КФК МВ выше 2 верхних границ нормы (5% в группе аторвастатина против 18% в группе плацебо; p<0,025). В группе лечения статином было меньше максимальное значение данных маркеров повреждения миокарда, т.е. по всем наиболее значимым маркерам повреждения миокарда эффект аторвастатина был выраженным и статистически достоверным.
Таким образом, статины, в частности, аторвастатин (Атомакс), снижают не только уровень атерогенных липидов, но и риск развития осложнений ЧКВ и оказывают благоприятный эффект на течение заболевания.
После достижения целевого уровня ХС ЛПНП необходимо снизить уровень ХС ЛПВП до 3,36 ммоль/л, а в идеале – менее 2,6 ммоль/л. С этой целью интенсифицируют ЛПНП–снижающую терапию, назначают фибраты или никотиновую кислоту.
После ЧКВ необходимо рекомендовать продолжать прием лекарственных препаратов, улучшающих прогноз пациентов с ИБС, в частности, b–блокаторов (у больных после ОКС) и ингибиторов АПФ (при наличии систолической дисфункции левого желудочка).
Антиагрегантная терапия. Помимо указанных выше мер, выполнение которых требуется для всех пациентов с ИБС, терапия антиагрегантами после ЧКВ имеет ряд особенностей. Это касается двойной антиагрегантной терапии – как ацетилсалициловой кислотой (АСК), так и тиенопиридинами. Хотя оптимальная поддерживающая доза АСК у больных после ЧКВ окончательно не установлена, наиболее часто в клинической практике используется поддерживающая доза АСК 75–100 мг/сут. которая обеспечивает практически максимальное действие. Вместе с тем известно, что побочные эффекты действия АСК (в частности, кровотечение и непереносимость со стороны желудочно–кишечного тракта) являются дозозависимыми.
Ситуация усложнилась с появлением стентов с лекарственным покрытием (СЛП) и проблемой поздних ТС. В двух первых главных исследованиях с СЛП TAXUS IV и SIRIUS АСК использовалась в дозе 325 мг/сут. В дальнейшем в других исследованиях применялись различные дозы АСК (от 75 до 325 мг/сут.). Убедительных данных о снижении частоты подострых и поздних ТС при использовании высоких доз АСК (160–325 мг/сут.) по сравнению с низкими дозами (75–100 мг/сут.) нет. С другой стороны, с увеличением дозы АСК растет число геморрагических осложнений, особенно в случае комбинированной терапии с тиенопиридинами. Согласно последним рекомендациям ACC/AHA/SCAI 2007 г. доза и продолжительность приема АСК зависят как от типа стента, так и от риска кровотечения у данного больного. В ранний срок после стентирования (после имплантации ГМС – 1 мес. СПС – 3 мес. СПП – 6 мес.) пациенты должны принимать АСК в повышенной дозе – 162–325 мг/сут. В последующем ее прием должен быть продолжен на постоянной основе в дозе 75–162 мг/сут вне зависимости от типа стента. В случае повышенного риска кровотечений разрешается использовать АСК в дозе 75–162 мг/сут. и сразу после стентирования.
Прием тиенопиридинов является важнейшей профилактической мерой развития тромбоза стента, в том числе и позднего. Согласно современным рекомендациям после имплантации СЛП в случае отсутствия высокого риска кровотечения пациенты должны принимать клопидогрел в дозе 75 мг/сут. в течение, по крайней мере, 12 мес. Часть экспертов рекомендуют после имплантации СЛП в случае низкого риска кровотечений и хорошей переносимости продолжить терапию клопидогрелом пожизненно. С учетом важности приема двойной антиагрегантной терапии в плане профилактики поздних тромбозов СЛП рекомендуется отложить элективные операции (например, плановую холецистэктомию) до окончания курса приема клопидогрела. После имплантации голометаллического стента (ГМС) пациенты должны принимать клопидогрел в дозе 75 мг/сут. в течение, как минимум, 1 мес. а в идеале – до 12 мес. В случае высокого риска кровотечений срок приема клопидогрела должен составлять минимум 2 нед.
Все больше пациентов с ИБС в настоящее время принимают пероральные антикоагулянты вследствие сопутствующих заболеваний (наиболее часто это профилактика тромбоэмболических осложнений при наличии мерцательной аритмии или тромбоза глубоких вен нижних конечностей). Прием варфарина на фоне двойной антиагрегантной терапии, которую принимают пациенты после ЧКВ, достоверно повышает риск кровотечений. Для его снижения рекомендуется уменьшить целевое значение МНО у этих больных до 2,0–2,5, а также использовать наименьшую из эффективных доз АСК – 75 мг/сут. У этих больных необходимо максимально тщательно контролировать МНО (чаще, чем 1 раз в месяц).
Необходимо отметить, что все указанные меры должны быть начаты еще в учреждении, в котором проводится ЧКВ, так как в противном случае у пациента часто складывается неправильное представление о том, что меры вторичной профилактики ему не требуются и он уже здоров. После выписки пациент, как правило, направляется под наблюдение участкового терапевта, поэтому основная задача по поддержанию и расширению мер вторичной профилактики ложится на врачей поликлиник.
Для оценки приверженности пациентов после ЧКВ к лекарственной части вторичной профилактики мы провели собственное исследование. В него на ретроспективной основе последовательно включали больных ИБС, которым в отделе эндоваскулярных методов исследования ФГУ РКНПК Минздравсоцразвития с марта 2002 по сентябрь 2004 года проводилось по показаниям ЧКВ с имплантацией ГМС или СПС–стента CYPHER™. Из исследования исключались больные, если у них присутствовал один или более из нижеперечисленных критериев: 1) наступление во время процедуры стентирования или первичной госпитализации летальных исходов и развитие сердечно–сосудистых осложнений; 2) наличие выявленного при первичной госпитализации во время коронароангиографии стеноза ствола левой коронарной артерии ≥50%; 3) проведение первичной ангиопластики со стентированием по поводу острого ИМ с подъемом сегмента ST.
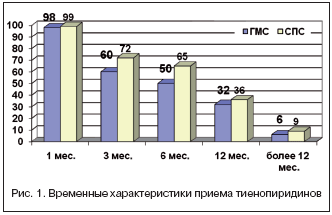
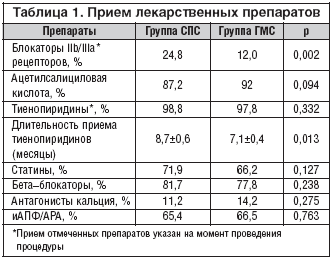
Особое внимание в нашей работе уделялось оценке лекарственной терапии. В таблице 1 представлены данные о приеме пациентами лекарственных препаратов на момент завершения исследования. В обеих группах приверженность к терапии, которая влияет на прогноз пациентов с ИБС, на момент завершения исследования была относительно высокой. Частота приема статинов составила 70%, b–блокаторов – более 80%. В группе СПС 87% пациентов и 92% в группе ГМС продолжали принимать АСК. Подавляющее большинство (95%) пациентов принимали АСК в дозе 100 мг/сут. 2% пациентов – 150 мг/сут. 3% – в неадекватной дозе 50 мг/сут. Практически все в качестве тиенопиридина использовали клопидогрел – на долю тиклопидина приходилось менее 1,5%, что значительно меньше, чем в Западной Европе, где частота использования данного препарата достигает 10%. Пациенты в группе СПС принимали тиенопиридины в течение более длительного времени (8,7 против 7,1 мес. p=0,013). Распределение частоты приема тиенопиридинов по месяцам представлено на рисунке 1.
В целом частота назначения других лекарственных препаратов в обеих группах достоверно не различалась.
Таким образом, в реальной клинической практике приверженность пациентов после ЧКВ к лекарственной терапии, влияющей на прогноз, выше, чем в общей популяции больных ИБС, однако все еще далека от идеальной. Требуется проведение комплекса мер, направленных на ее увеличение.
Заключение
Успешно проведенное ЧКВ не устраняет причину ИБС – атеросклероз коронарных артерий, а лишь нивелирует влияние гемодинамически значимой атеросклеротической бляшки. Все меры вторичной профилактики ИБС действительны и для больных после ЧКВ. Основными мерами вторичной профилактики являются: отказ от курения, снижение веса, увеличение физической активности, гиполипидемическая диета. Важными моментами являются достижение целевого уровня АД, снижение уровня липидов крови, а у больных СД – достижение компенсации углеводного обмена. Особенностью вторичной профилактики после ЧКВ является назначение двойной антиагрегантной терапии в адекватных дозах и необходимой продолжительности. По данным исследований, в РФ приверженность пациентов к лекарственной терапии, влияющей на прогноз после ЧКВ, остается недостаточной.
Литература
1. Карпов Ю.А. Самко А.Н.,Буза В.В. Отдаленные результаты коронарного стентирования: роль антиагрегантной терапии. РМЖ, том 16,№21, 1419–1423.
2. Smith, Jr, John W. Hirshfeld, Jr, Alice K. Jacobs,Writing on Behalf of the 2005 Writing Committee, ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention, Practice Guidelines, 2007 Writing Group to Review New Evidence and Update the American College of Cardiology/American Heart Association Task Force on Percutaneous Coronary Intervention J. Am. Coll. Cardiol. 2008;51;172–209;
3. Mauri L, Normand SL.Studies of drug–eluting stents: to each his own? Circulation. 2008 Apr 22;117(16):2047–50
4. Boden WE, O’Rourke RA, Teo KK, et al. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med 2007;356:1503–16.
5. Wong EML, Wu EB, Chan CM, et al. A review of the management of patients after percutaneous coronary intervention. Int J Clin Pract. 2006;60:582–589
6. Fox KM; EURopean Trial on Reduction of Cardiac Events with Perindopril in Stable Coronary Artery Disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double–blind, placebo–controlled, multicentre trial (the EUROPA study). Lancet 2003 September 6; 362: 7828.