Газета «Новости медицины и фармации» Кардиология (305) 2009 (тематический номер)
Вернуться к номеру
Насущные вопросы без ответов, или Как долго больному после стентирования коронарных артерий нужно принимать клопидогрель
Авторы: О.Н. Лазаренко, Национальная медицинская академия последипломного образования им. П.Л. Шупика МЗ Украины, кафедра кардиологии и функциональной диагностики; Т.А. Алексеева, Институт металлофизики им. В.Г. Курдюмова НАНУ, отдел медицинского материаловедения
Версия для печати
В 1986 г. в Тулузе Жаком Пуэлем был имплантирован первый коронарный стент [1], что породило новую проблему эндоваскулярной хирургии — тромбоз стента (ТС), частота которого до появления и разработки двойной антиагрегантной терапии достигала 9 % [2].
Для чего нужна двойная антитромбоцитарная терапия в профилактике тромбозов после стентирования?
Тромбоз стента развивается наиболее часто в течение первого месяца после стентирования и, как правило, заканчивается Q-инфарктом миокарда (ИМ) или смертью пациента. С постепенным совершенствованием технологии имплантации стента и обязательным приемом двойной антиагрегантной терапии (аспирин + тиенопиридин) в течение 1 месяца, с последующим продолжением приема аспирина без ограничений по времени частота развития ТС снизилась до приемлемого 1 % [3]. С учетом важности приема аспирина, в случае известной аллергии на него во время чрескожного коронарного вмешательства (ЧКВ) обязательно применение антагонистов IIb/IIIa рецепторов. Существуют также различные протоколы десенсибилизации к АСК, позволяющие преодолеть аллергические реакции [4].
Если необходимость приема аспирина во время и после проведения ЧКВ не вызывает сомнения, то доза, которая обеспечивает оптимальное соотношение эффективности/безопасности, в настоящее время окончательно не установлена. Уже в дозе 30 мг/сут аспирин ингибирует продукцию тромбоксана А2, что и является основным механизмом снижения частоты развития тромботических осложнений. Таким образом, использующаяся в клинической практике доза 75 мг/сут обеспечивает практически максимальное фармакодинамическое действие [5]. Согласно последним рекомендациям американских экспертов (AHA/ACC/SCAI, 2007 г .) [6], во время проведения процедуры прием аспирина обязателен, однако его доза и продолжительность приема зависят как от типа стента, так и от риска кровотечения у данного больного. Длительность приема клопидогреля также зависит от двух указанных факторов.
С учетом важности двойной антиагрегантной терапии рекомендуется отложить элективные операции до окончания курса приема клопидогреля. В случае невозможности отложить операцию рекомендуется продолжить терапию аспирином во всех возможных случаях, а прием клопидогреля возобновить как можно скорее [7].
В последнее время в связи с появлением данных, указывающих на возможное увеличение частоты развития поздних тромбозов после имплантации drug-eluting стентов, особое внимание уделяется антиагрегантной терапии. Наиболее частой причиной отмены препарата является развитие разнообразных желудочно-кишечных расстройств вследствие раздражающего влияния аспирина на слизистую оболочку желудка, которые могут проявляться ощущением дискомфорта в области живота, изжогой, тошнотой и т.д. Длительный, без ограничения по времени прием аспирина предъявляет повышенные требования к переносимости препарата. Этот вопрос можно решить с помощью создания более безопасных форм. Невсасывающиеся антациды часто применяются при лечении язвенной болезни.
Что произойдет с больным, если он перестанет принимать двойную антитромбоцитарную терапию?
Прекращение приема антиагрегантов является важным фактором развития поздних тромбозов у больных с «голым» стентом (ГМС). В одном исследовании, проводившемся среди пациентов с ангиографически документированным поздним ТС, ни у одного больного, продолжавшего прием двойной антиагрегантной терапии, тромбоз не развился. В другом 9-месячном исследовании, где было зарегистрировано 14 подострых и 15 поздних тромбозов, самым важным фактором риска развития указанных событий было преждевременное прекращение приема антиагрегантов, что повышало риск развития тромбоза в 90 раз [8]. Преждевременное прекращение приема двойной антитромбоцитарной терапии также оказалось значимым фактором риска подострого и позднего тромбоза в регистре пациентов, которым был имплантирован drug-eluting стент в месте бифуркации сосуда, — повышение риска в 17 раз [9].
При анализе крупного регистра из 4666 пациентов, которым проводилось стентирование в одном из госпиталей США, Eisenstein [10] продемонстрировал, что длительный прием тиенопиридинов не влияет у пациентов с ГМС на частоту смерти и ИМ. Однако у пациентов с имплантированными drug-eluting стентами прием клопидогреля более 6 и 12 месяцев привел к значительному снижению как смерти, так и комбинированной точки смерть/ИМ.
Кроме того, несмотря на прием двойной терапии, у части пациентов достаточного антиагрегантного эффекта не наблюдается вследствие неадекватной дозы, лекарственного взаимодействия, различия в эффекте препарата на рецепторном уровне, увеличения вклада других путей активации тромбоцитов. В некоторых исследованиях был продемонстрирован важный вклад в патогенез ТС резистентности к клопидогрелю [11].
Развитие резистентности к аспирину и клопидогрелю. Что делать?
В группе больных, которым проводилось плановое ЧКВ (в 75 % использовались drug-eluting стенты), повышенная агрегация тромбоцитов до процедуры стентирования приводила к увеличению частоты ишемических событий в течение последующих 12 месяцев. При этом достаточно часто встречается комбинированная резистентность к аспирину и клопидогрелю. У аспирин-резистентных лиц в 47,4 % случаев отмечалась также резистентность к клопидогрелю. Это может быть причиной развития ТС, несмотря на прием антиагрегантной терапии. В одном из исследований у 14 из 61 пациента (23 %) поздний ТС развился, несмотря на прием двойной антиагрегантной терапии, в то время как только 26 % (16 пациентов) не получали антиагрегантов на момент развития позднего ТС [12]. У 31 пациента поздний ТС развился на фоне приема аспирина и у подавляющего большинства (97 %) произошел после окончания рекомендованного срока приема клопидогреля.
По данным исследования CHARISMA, более длительная двойная антиагрегантная терапия не приводит к снижению ишемических событий среди больных с атеротромбозом и лиц с факторами риска его развития [13]. Такая терапия сопровождалась повышенным риском кровотечений. В исследовании CREDO, куда включались пациенты с плановым ЧКВ и использованием ГМС, разницы по комбинированной конечной точке смерть/ИМ между группами клопидогреля и плацебо (все получали аспирин) во временном промежутке 1 и 6 месяцев отмечено не было [14]. Таким образом, вопрос о более длительном приеме клопидогреля после ЧКВ, чем рекомендуется в настоящее время, остается открытым. Одним из возможных путей преодоления поздних ТС является использование более мощных, чем клопидогрель, ингибиторов агрегации тромбоцитов, например прасугреля.
В исследовании TRITON-TIMI 38 в общей популяции 13 608 больных с острым коронарным синдромом (ОКС) умеренного и высокого риска применение прасугреля привело к более значительному снижению риска ишемических событий по сравнению с клопидогрелем, хотя и сопровождалось увеличением риска кровотечений [15]. Отдельно были проанализированы 12 844 пациента, которым в ходе исследования проводилось стентирование. Среди них 5743 пациентам был имплантирован drug-eluting стент, а у 6461 пациента использовались только ГМС. На фоне прасугреля снизилась частота развития сердечно-сосудистых осложнений, нефатального ИМ, острых нарушений мозгового крово-обращения у больных с ОКС при имплантации как ГМС, так и drug-eluting стентов. Применение прасугреля снизило также частоту развития определенного ТС по классификации ARC [16] независимо от типа стента, однако при этом отмечалось более частое развитие кровотечений.
Эффекты клопидогреля при стентировании металлическим стентом и стентами с покрытием. В чем разница?
Клопидогрель обратил на себя пристальное внимание докторов после его длительного применения у пациентов с имплантированными drug-eluting стентами. При установке стентов, покрытых антипролиферативными препаратами, рекомендуется пролонгированный прием двойной антитромбоцитарной терапии. В частности, при стентировании протезами, выделяющими сиролимус, длительность приема клопидогреля должна составлять не менее 3 месяцев, после имплантации стентов, покрытых паклитакселем, — не менее 6 месяцев. Однако в ряде недавно проведенных обсервационных исследований показано, что даже такие режимы терапии могут быть недостаточными для предотвращения поздних тромбозов.
Группа американских ученых из Центра сердца Дюка (Duke Heart Center) провела исследование на популяции больных, последовательно поступивших в Центр для первого ЧКВ с использованием ГМС (с 2001 г. по 31 июля 2005 г .) или drug-eluting стентов (с 1 апреля 2003 г. по 31 июля 2005 г .) [17].
Из исследования были исключены пациенты с врожденными пороками сердца, умеренными и тяжелыми клапанными поражениями, ранее выполненными ЧКВ и коронарным шунтированием и со значительным (≥ 75 %) стенозом ствола левой коронарной артерии. Наблюдение закончилось 7 сентября 2006 г. таким образом составив не менее 12 месяцев для каждого участника исследования. Анализу подвергались два основных события — смертность и нефатальный ИМ, а также использование 2 препаратов — аспирина и клопидогреля. Клинические исходы были утверждены центральным комитетом в случае смерти либо основывались на диагнозе лечащего врача в случае ИМ. Использование антиагрегантов определялось по опросу пациентов при контрольных визитах через 6, 12 и 24 месяца после проведения ЧКВ. Верификация приверженности к антитромбоцитарной терапии не проводилась. При наблюдении использовались 2 временные точки: 6-месячное использование клопидогреля (да/нет) и 12-месячное использование клопидогреля (да/нет). Пациенты, которые не переносили коронарных событий в течение первых 6 месяцев (смерти, ИМ и повторных реваскуляризаций), были разделены на 4 группы: 1) drug-eluting стент с приемом клопидогреля; 2) drug-eluting стент без приема клопидогреля; 3) «голый» стент с приемом клопидогреля; 4) «голый» стент без приема клопидогреля. Исходы у них были прослежены до 24 месяцев наблюдения. Сходный анализ проведен в 4 аналогичных группах у больных, не имевших коронарных событий в течение первых 12 месяцев после ЧКВ.
Из 4666 пациентов ГМС были имплантированы 3165, drug-eluting стенты — 1501 больному. Через 6 месяцев без осложнений оставалось 3609 пациентов. Все 4 группы были сопоставимы по возрасту, полу и расовой принадлежности, но с небольшими различиями по частоте диабета, сердечной недостаточности, ИМ в анамнезе, уровню дохода, частоте регулярного использования аспирина. Многофакторный анализ (пропорциональная модель рисков по Коксу) показал, что в течение последующих 2 лет больные с установленными drug-eluting стентами при приеме клопидогреля (1-я группа, n = 637) имели значительно меньший риск клинических событий, чем пациенты с такими же стентами без приема клопидогреля (2-я группа, n = 579): соответственно 2 против 5,3 % — для смерти (отношение риска [ОР] 2,43; р = 0,03) и 3,1 против 7,2 % — для комбинированной точки (ОР 1,93; р = 0,02) при сопоставимой частоте ИМ (1,3 против 2,6 %; р = 0,24). При сравнении обеих групп пациентов с ГМС (3-я группа, n = 417, против 4-й группы, n = 1976), группы drug-eluting стентов с клопидогрелем и ГМС с клопидогрелем (1-я группа против 3-й группы) различий по клиническим исходам не отмечено. Лишь при сопоставлении группы drug-eluting стентов с клопидогрелем с группой ГМС с клопидогрелем обнаружены статистически значимые различия в пользу 1-й группы в отношении смертности (р = 0,01) и комбинированной точки (р = 0,02). Через 12 месяцев после ЧКВ без осложнений оставались 2518 пациентов. Участники всех 4 групп были сопоставимы по полу, возрасту, расе и социоэкономическому статусу. В многофакторном анализе больные 1-й группы (n = 252) опять имели меньший риск смертельного исхода и комбинированной точки (смерть/ИМ), чем больные 2-й группы (n = 276): соответственно 0 против 3,5 % (р = 0,004) и 0 против 4,5 % (р
Результаты данного обсервационного исследования наводят на мысль о том, что пациенты с имплантированным drug-eluting стентом, получающие длительную терапию клопидогрелем, имеют значительно лучший долгосрочный прогноз, чем такие же пациенты без длительного приема препарата. Исследователи полагают, что, весьма вероятно, все больные с установленным drug-eluting стентом должны принимать клопидогрель не менее 12 месяцев после ЧКВ. В то же время ГМС могут быть более подходящим выбором для тех пациентов, которые не способны принимать клопидогрель столь длительное время. Ученые утверждают, что необходимо срочное проведение рандомизированного контролируемого исследования для определения оптимальной продолжительности терапии клопидогрелем после ЧКВ с имплантацией drug-eluting стента. В таком испытании авторы предлагают в течение 3 лет сравнить исходы 3 групп участников: с прекращением приема клопидогреля через 12, 24 и 36 месяцев, что потребует включения примерно 10 000 пациентов.
К вопросу о взаимодействии клопидогреля и статинов. Какова роль изофермента цитохрома CYP3A4?
Практически всем пациентам после установки стента назначаются статины. В последнее время в литературе широко обсуждается вопрос о возможном взаимодействии клопидогреля и аторвастатина на уровне CYP3A4 (рис. 1). Антиагрегант клопидогрель является пролекарством, которое под действием CYP3А4 метаболизируется до активного 2-оксаклопидогреля, блокирующего АДФ-рецепторы тромбоцитов. Причем доказано, что чем выше активность CYP3A4, тем более выражен антиагрегантный эффект клопидогреля [18]. Так, ингибирование CYP3A4 (например, кетоконазолом) значительно снижает антиагрегантное действие клопидогреля при его применении как в малых, так и в больших дозах [19].
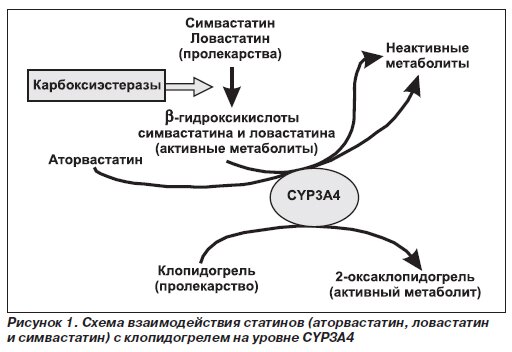
Ингибитор ГМГ-КоА-редуктазы аторвастатин также метаболизируется под действием CYP3A4, но до неактивных метаболитов. Биотрансформации до неактивных метаболитов подвергаются активные метаболиты ловастатина и симвастатина (b-гидроксикислоты). Впервые взаимодействие аторвастатина и клопидогреля описано в исследовании Т. Clarke и соавт. in vitro, выполненном на микросомах печени; продемонстрировано, что аторвастатин на 90 % ингибирует биотрансформацию клопидогреля до активного 2-оксаклопидогреля. Авторы объясняют этот феномен существованием «метаболической» конкуренции между клопидогрелем и b-гидроксикислотным метаболитом аторвастатина за CYP3A4 [20].
В то же время W. Lau и соавт. показали, что у больных ишемической болезнью сердца (ИБС) после стентирования коронарных сосудов аторвастатин значительно уменьшал антиагрегантное действие клопидогреля. При этом правастатин не давал подобного эффекта [21].
В исследовании Н. Neubauer и соавт. продемонстрировано, что предшествующее применение статинов, метаболизирующихся CYP3A4 (ловастатин, симвастатин и аторвастатин), у больных ИБС способствует менее выраженному подавлению АДФ-индуцированной агрегации тромбоцитов при применении клопидогреля в 1-е сутки [22].
Подгрупповой анализ того же исследования CREDO выявил отсутствие различий во влиянии клопидогреля на конечные точки в группе лиц, получающих статины, метаболизирующиеся CYP3A4 (аторвастатин, симвастатин, ловастатин, церивастатин), и в группе лиц, получающих статины, не метаболизирующиеся CYP3A4 (правастатин, флувастатин) [23].
С 2004 г. началась публикация серии работ, полностью опровергающих существование взаимодействия между аторвастатином и клопидогрелем. Так, J. Mitsios и соавт. не обнаружили различий в антиагрегантном действии клопидогреля при его длительном применении (5 недель) у больных с ОКС, принимающих аторвастатин или правастатин (не метаболизируется CYP3A4) [24].
Аналогичные данные получены и в исследованиях М. Piorkowski и соавт. и S. Smith и соавт. у больных после стентирования коронарных артерий, Р. Wenaweser и соавт. у больных с ТС коронарных артерий, Y. Han у больных с ОКС, которым проведено стентирование коронарных сосудов [25–30]. В исследовании V. Serebruany сравнивалось влияние клопидогреля на функцию тромбоцитов (оценивали 19 характеристик агрегометрии) в группах больных с установленными коронарными стентами, принимающих аторвастатин, принимающих другие статины и не принимающих статины. Оказалось, что в указанных группах динамика показателей функции тромбоцитов на фоне лечения клопидогрелем не различалась. О. Gorchakova и соавт. показали отсутствие различий в антиагрегантном действии клопидогреля в высокой дозе 600 мг/сут у больных перед стентированием коронарных артерий, принимающих статины (аторвастатин, симвастатин) и не принимающих таковых [32]. На этом фоне неожиданными выглядят результаты исследования S. Gulec и соавт. [33]. Авторы изучили влияние терапии клопидогрелем на риск развития мионекрозов (по увеличению уровня тропонина Т выше 0,1 нг/мл) после проведения стентирования коронарных сосудов в группах больных, получающих аторвастатин и симвастатин (114 человек), правастатин и флувастатин (37 человек) и не получающих статины (60 человек). Оказалось, что мионекрозы возникали в группе больных, получающих аторвастатин или симвастатин, чаще, чем у больных, получающих правастатин или флувастатин (41,6 против 8 %; р = 0,004). В группе, не получавшей статины, частота мионекрозов также была выше, чем у больных, получавших правастатин или флувастатин (32,5 против 8 %; р = 0,001). Авторы связывают приведенные результаты с взаимным «ослаблением» эффектов клопидогреля и аторвастатина или симвастатина из-за конкурирующего взаимодействия на уровне CYP3А4. Видимо, клинические последствия этого феномена продемонстрированы и в крупном фармакоэпидемиологическом исследовании J. Brophy и соавт. в котором участвовали 2927 пациентов после стентирования коронарных сосудов, 727 пациентов принимали клопидогрель и аторвастатин, а 2200 — клопидогрель без аторвастатина [34]. Частота неблагоприятных сердечно-сосудистых событий (ИМ, нестабильная стенокардия, внезапная смерть, инсульт, потребность в повторной реваскуляризации) в течение 1 месяца после процедуры была выше у больных, получавших аторвастатин (4,54 %), по сравнению с больными, не получавшими его (3,09 %). Однако частота неблагоприятных сердечно-сосудистых событий в течение 6 месяцев после процедуры у больных, получавших и не получавших аторвастатин, не различалась. Погрупповой анализ крупного мультицентрового исследования CHARISMA, в котором участвовали 15 603 пациента, также не выявил различий в частоте неблагоприятных сердечно-сосудистых событий в течение 28 месяцев у пациентов, получавших статины, метаболизирующиеся и не метаболизирующиеся CYP3A4 [26].
Таким образом, данные о взаимодействии клопидогреля и статинов, метаболизирующихся CYP3A4, в том числе аторвастатина, противоречивы. На наш взгляд, «отрицательные» результаты исследований вовсе не означают, что подобные взаимодействия не имеют клинического значения. По-видимому, взаимодействие все-таки имеется, но его клинические проявления зависят от различных факторов, включая изменяющуюся активность CYP3A4. В настоящее время В. Кукес и соавт. [35] изучают клиническое значение взаимодействия клопидогреля и аторвастатина в различных дозах (10; 20; 40 и 80 мг/сут) у больных с нестабильной стенокардией, исследуя влияние аторвастатина на антиагрегантное действие клопидогреля по динамике показателей индуцированной агрегации тромбоцитов. Активность CYP3A4 они оценивают по отношению 6b-гидроксикортизол/кортизол в моче.
Необходимо провести серьезные исследования с участием как терапевтических, так и хирургических подразделений для решения вопроса о длительном приеме клопидогреля с разработкой методической литературы, которая поможет врачам не допускать ошибок в сложных клинических ситуациях.
Список литературы / References
1. Бобров В.А. Лазаренко О.Н. Сморжевский В.И. Нанотехнологии в разработке и исследовании новых тромборезистентных и антипролиферативных покрытий стентов для сосудов малого диаметра. — К. Издательский Дом «Здоров’я України», 2007. — 164 с.
2. Windecker S. Meier B. Late coronary stent thrombosis // Circulation. — 2007. — Vol. 116 (17). — P. 1952-1965.
3. Moreno R. Fernandez C. Hernandez R. Drug-eluting stent thrombosis: Results from a pooled analysis including 10 randomized studies // J. Am. Coll. Cardiol. — 2005. — 45. — P. 954-959.
4. Silberman S. Neukirch-Stoop C. Steg P.G. Rapid desensitization procedure for patients with aspirin hypersensitivity undergoing coronary stenting // Am. J. Cardiol. — 2005. — Vol. 95. — P. 509-510.
5. Patrono C. Rodriguez L.A.G. Landolfi R. et al. Low-dose aspirin for the prevention of atherothrombosis // N. Engl. J. Med. — 2005. — Vol. 353. — P. 2373-2383.
6. Grines C.L. Bonow R.O. Casey D.E. Jr. et al. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronaryartery stents: a science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians // J. Am. Coll. Cardiol. — 2007. — Vol. 49. — P. 734-739.
7. Smith Jr. John W. Hirshfeld, Jr. Alice K. Jacobs, Douglass A. Morrison, and David Writing on Behalf of the 2005 Writing Committee, Spencer B. King, III, Sidney C. ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention, Practice Guidelines, 2007 Writing Group to Review New Evidence and Update the American College of Cardiology/American Heart Association Task Force on 2007 Focused Update of the ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention // J. Am. Coll. Cardiol. — 2008. — Vol. 51. — P. 172-209.
8. Jaffe R. Strauss B.H. Late and very late thrombosis of drug-eluting stents: evolving concepts and perspectives // J. Am. Coll. Cardiol. — 2007. — Vol. 50 (2). — P. 119-127.
9. Chieffo A. Aranzulla T.C. Colom-bo A. Drug eluting stents: focus on Cypher sirolimus-eluting coronary stents in the treatment of patients with bifurcation lesions // Vasc. Health Risk Manag. — 2007. — Vol. 3 (4). — P. 441-451.
10. Eisenstein E.L. Anstrom K.J. Kong D.F. et al. Clopidogrel use and long-term clinical outcomes after drug-eluting stent implantation // JAMA. — 2007. — Vol. 297. — P. 159-168.
11. Gurbel P.A. DiChiara J. Tantry U.S. Antiplatelet therapy after implantation of drug-eluting stents: duration, resistance, alternatives, and management of surgical patients // Am. J. Cardiol. — 2007. — Vol. 100 (8B). — P. 18M-25M.
12. Daemen J. Serruys P.W. Does prolonged clopidogrel therapy improve outcome in patients with drug-eluting or bare-metal stents? // Nat. Clin. Pract.Cardiovasc. Med. — 2007. — Vol. 4 (6). — P. 302-303.
13. Bhatt D.L. Fox K.A. Hacke W. et al. CHARISMA Investigators. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events // N. Engl. J. Med. — 2006. — Vol. 354 (16). — P. 1706-1717.
14. Steinhubl S.R. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial // JAMA. — 2002. — Vol. 288. — P. 2411-2420.
15. Wiviott S.D. Braunwald E. McCa-be C.H. et al. TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. — 2007. — Vol. 357 (20). — P. 2001-2021.
16. Cutlip D.E. Windecker S. Roxa-na M. Clinical End Points in Coronary Stent Trials A Case for Standardized Definitions // Circulation. — 2007. — Vol. 115. — P. 2344-2351.
17. Eisenstein E.L. Anstrom K.J. Kong D.F. et al. Clopidogrel Use and Long-term Clinical Outcomes After Drug-Eluting Stent Implantation // JAMA. — 2007. — Vol. 297. Published online December 5, 2006.
18. Lau W.C. Gurbel P.A. Watkins P.B. et al. Contribution of hepatic cytochrome P450 3A4 metabolic activity to the phenomenon of clopidogrel resistance // Circulation. — 2004. — Vol. 109 (2). — P. 166-171.
19. Farid N.A. Payne C.D. Small D.S. et al. Cytochrome P450 3A inhibition by ketoconazole affects prasugrel and clopidogrel pharmacokinetics and pharmacodynamics differently // Clin. Pharmacol. Ther. — 2007. — Vol. 81 (5). — P. 735-741.
20. Clarke T.A. Waskell L.A. The metabolism of clopidogrel is catalyzed by human cytochrome P450 3A and is inhibited by atorvastatin // Drug Metab Dispos. — 2003. — Vol. 31 (1). — P. 53-59.
21. Lau W.C. Waskell L.A. Watkins P.B. et al. Atorvastatin reduces the ability of clopidogrel to inhibit platelet aggregation: a new drug-drug interaction // Circulation. — 2003. — Vol. 107 (1). — P. 32-37.
22. Neubauer H. Gunesdogan B. Hanefeld C. et al. Lipophilic statins interfere with the inhibitory effects of clopidogrel on platelet function — a flow cytometry study // Eur. Heart J. — 2003. — Vol. 24 (19). — P. 1744-1749.
23. Saw J. Steinhubl S.R. Berger P.B. et al. Clopidogrel for the Reduction of Events During Observation Investigators. Lack of adverse clopidogrel-atorvastatin clinical interaction from secondary analysis of a randomized, placebo-controlled clopidogrel trial // Circulation. — 2003. — Vol. 108 (8). — P. 921-924.
24. Mitsios J.V. Papathanasiou A.I. Rodis F.I. et al. Atorvastatin does not affect the antiplatelet potency of clopidogrel when it is administered concomitantly for 5 weeks in patients with acute coronary syndromes // Circulation. — 2004. — Vol. 109 (11). — P. 1335-1338.
25. Piorkowski M. Weikert U. Schwimmbeck P.L. et al. ADP induced platelet degranulation in healthy individuals is reduced by clopidogrel after pretreatment with atorvastatin // Thromb Haemost. — 2004. Sep. — Vol. 92 (3). — Р. 614-620.
26. Saw J. Brennan D.M. Steinhubl S.R. et al. С HARISMA Investigators. Lack of evidence of a clopidogrel-statin interaction in the CHARISMA trial // J. Am. Coll. Cardiol. — 2007. — Vol. 50 (4). — P. 291-295.
27. Saw J. Steinhubl S.R. Berger P.B. et al. Clopidogrel for the Reduction of Events During Observation Investigators. Lack of adverse clopidogrel-atorvastatin clinical interaction from secondary analysis of a randomized, placebo-controlled clopidogrel trial // Circulation. — 2003. — Vol. 08 (8). — P. 921-924.
28. Shakeri-Nejad K. Stahlmann R. Drug interactions during therapy with three major groups of antimicrobial agents // Expert Opin Pharmacother. — 2006. — Vol. 7 (6). — P. 639-651.
29. Smith S.M. Judge H.M. Peters G. et al. Multiple antiplatelet effects of clopidogrel are not modulated by statin type in patients undergoing percutaneous coronary intervention // Platelets. — 2004. — Vol. 15 (8). — P. 465-474.
30. Wenaweser P. Windecker S. Billinger M. et al. Effect of atorvastatin and pravastatin on platelet inhibition by aspirin and clopidogrel treatment in patients with coronary stent thrombosis // Am. J. Cardiol. — 2007. — Vol. 99 (3). — P. 353-356.
31. Zhou S.F. Xue C.C. Yu X.Q. et al. Metabolic activation of herbal and dietary constituents and its clinical and toxicological implications: an update // Curr. Drug Metab. — 2007. — Vol. 8 (6). — P. 526-553.
32. Gorchakova O. von Beckerath N. Gawaz M. et al. Antiplatelet effects of a 600 mg loading dose of clopidogrel are not attenuated in patients receiving atorvastatin or simvastatin for at least 4 weeks prior to coronary artery stenting // Eur. Heart J. — 2004. — Vol. 25 (21). — P. 1898-1902.
33. Gulec S. Ozdol C. Rahimov U. et al. Myonecrosis after elective percutaneous coronary intervention: effect of clopidogrel-statin interaction // J. Invasive Cardiol. — 2005. — Vol. 17 (11). — P. 589-593.
34. Brophy J.M. Babapulle M.N. Costa V. et al. A pharmacoepidemiology study of the interaction between atorvastatin and clopidogrel after percutaneous coronary intervention // Am. Heart J. — 2006. — Vol. 152 (2). — P. 263-269.
35. Кукес В. Сычев Д. Раменская В. и др. Оценка активности CYP3A4 и проблема взаимодействия клопидогреля и аторвастатина у больных с ишемической болезнью сердца // Врач. — 2008. — № 3. — С. 13-19.
Транслюминальная баллонная ангиопластика (ТЛБАП) и стентирование коронарных артерий или чрескожное коронарное вмешательство (ЧКВ). Подготовка к операции, техника операции, рекомендации после операции
Как подготовиться к операции стентирования коронарных артерий.
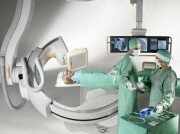
В случаях инфаркта миокарда, нестабильной стенокардии операции стентирования коронарных артерий проводятся в экстренном порядке. При стабильной ИБС она запланирована заранее, давая вам время, чтобы подготовиться. Операция проводится в рентген-операционной.
Общие принципы включают в себя:
• В ночь перед операцией проводиться очищение кишечника.
• В утренние часы отмена приема лекарств.
Особое внимание следует уделить обязательному приему следующих препаратов до операции:
Аспирин
Аспирин снижает частоту ишемических осложнений после ЧКВ. Минимальная эффективная доза аспирина при ЧКВ точно не определена, традиционно рекомендуется прием эмпирически подобранной дозы 80-325 мг, как минимум, за 2 часа до вмешательства.
+ Аспирин. Рекомендации Европейского общества кардиологов, 2013г. Класс доказательства I.
1. Всем пациентам до операции стентирования коронарных артерий следует принимать аспирин в дозе 81-325мг ежедневно.
2. Пациентам, регулярно не принимающим аспирин, следует назначить аспирин кишечно-нерастворимую форму (ацетилсалициловую кислоту) в дозе 325мг, как минимум, за 2 часа до операции стентирования коронарных артерий.
3. После операции стентирования коронарных артерий аспирин следует принимать неопределенно долго (постоянно)
Ингибиторы P2Y12-рецепторов тромбоцитов: клопидогрель, празугрель, тикагрелор, тиклопидин.
Тиклопидин первоначально использовался во время интракоронарных вмешательств. Тиклопидин обладает многими серьезными побочными эффектами, включая желудочно-кишечные расстройства (20%), кожные высыпания (4,8% — 15%), патологические реакции со стороны печени и крови (выраженная нейтропения, тромбоцитопеническая пурпура), поэтому в большинстве случаев рекомендуется прием клопидогреля.
Клопидогрель в насыщающей дозе 600 мг до операции с переходом на поддерживающую дозу после операции 75 мг ежедневно на протяжении 1 года. Для достижения максимума антитромбоцитарного эффекта, следует назначить клопидогрель, как минимум, за 72 часа до процедуры.
+ Ингибиторы P2Y12-рецепторов тромбоцитов. Рекомендации Европейского общества кардиологов, 2013г. Класс доказательства I.
1. Всем пациентам до операции стентирования коронарных артерий следует принять насыщающую дозировку препаратов группы ингибиторов P2Y12-рецепторов тромбоцитов:
а. Клопидогрель 600 мг (как при остром коронарном синдроме, так и при стабильной ИБС);
б. Празугрель 60мг (при остром коронарном синдроме);
в. Тикагрелор 180мг (при остром коронарном синдроме).
2. Пациентам после фибринолитической терапии до операции стентирования коронарных артерий следует принять насыщающую дозировку клопидогреля:
а. менее 24 часов от фибринолитической терапии – 300мг;
б. 24 часа и более от фибринолитической терапии – 600мг.
3. После операции стентирования коронарных артерий препараты из группы ингибиторов P2Y12-рецепторов тромбоцитов следует принимать по следующим схемам:
а. пациентам, которым имплантированы стенты (металлические или стенты с лекарственным покрытием) во время ЧКВ при ОКС, рекомендуемое время прием препаратов, как минимум, 12 месяцев. Дозировка клопидогреля – 75мг в день, празугрель – 10мг в день, тикагрелора 90мг 2 раза в день.
б. пациентам, которым имплантированы стенты с лекарственным покрытием при стабильной ИБС, следует принимать клопидогрель 75мг в день, как минимум, 12 месяцев, при отсутствии высокого риска кровотечения.
в. пациентам, которым имплантированы металлические стенты при стабильной ИБС, следует принимать клопидогрель 75мг в день, как минимум, 1 месяц, оптимально – 12 месяцев.
Двойная антиагрегантная терапия
Применение антитромбоцитарной терапии у пациентов с высоким риском сердечно-сосудистых заболеваний уменьшает возможность их возникновения на 25%. К настоящему времени целый ряд крупных рандомизированных исследований продемонстрировал, что комбинации двух препаратов с различными механизмами действия – аспирина и клопидогреля – уменьшает риск ишемических событий при сравнимой безопасности. Наибольшие преимущества двойной антитромбоцитарной терапии оказались у больных с ОКС (снижение риска сердечно-сосудистых событий: повторного инфаркта миокарда, инсульта, смерти) и после операций стентирования коронарных артерий (снижает риск тромбоза стента и рестеноза внутри стента). Одно из наиболее частых побочных эффектов, в 1,7% случаев, двойной антитромбоцитарной терапии – гемморагические осложнения (кровотечения): желудочно-кишечные, черепно-мозговые, кровотечения из места пункции.
+ Двойная антиагрегантная терапия. Рекомендации Европейского общества кардиологов, 2013г. Класс доказательства I.
Пациенты должны быть информированы о необходимости и рисках двойной антиагрегантной терапии перед операцией стентирования коронарных артерий, особенно при имплантации стентов с лекарственным покрытием. Если пациенты не расположены или не в состоянии соблюдать рекомендуемую продолжительность двойную антиагрегантную терапию следует рассмотреть альтернативные методы лечения (АКШ или медикаментозная терапия с модификацией факторов риска).
Статины или холестерин-снижающие препараты.
Лечение статинами после операции приводит к снижению частоты всех сердечно-сосудистых осложнений и общей смертности на 30%. Цель – достижение целевого уровня общего холестерина – 4,6ммоль/л и липопротеидов низкой плотности (ЛПНП)
Баллонная ангиопластика и стентирование коронарных артерий
Всего голосов 0
Коронарная ангиопластика – эндоваскулярная операция, направленная на ликвидацию стеноза в коронарной артерии и восстановление в ней кровотока.
Врачи называют эту процедуру «чрескожной транслюминальной баллонной ангиопластикой». что означает:
- Чрескожная – операция осуществляется путем прокола кожи и катетеризации сосудов.
- Транслюминальная – не требуется разреза и отрытого хирургического вмешательства.
- Баллонная – кровоток восстанавливается с помощью раздувания баллона, находящегося на конце катетера.
- Ангиопластика – устраняется стеноз, обтурация, закупорка сосуда.
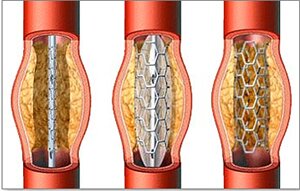
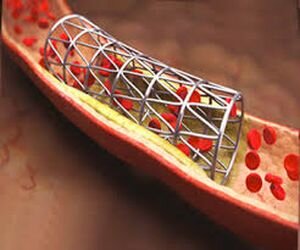
На современном этапе ангиопластика почти всегда сопровождается стентированием – установкой в расширенном участке артерии металлического каркаса, трубчатой формы (стента). Стентирование препятствует развитию повторного стеноза коронарной артерии после баллонной ангиопластики.
Баллонная ангиопластика и стентирование являются новыми и в то же время эффективными методами лечения ишемической болезни сердца.
История вопроса
В 1977 году произошел настоящий переворот в эндоваскулярной хирургии, который поменял всю стратегию лечения атеросклероза и ИБС. Именно тогда швейцарский кардиолог Андреас Грюнтциг выполнил первую коронарную ангиопластику, использовав баллон, сконструированный им же в домашних условиях. С его подачи ангиопластика начала быстро распространяться во всем мире. И правда, кому не хочется вылечиться от ИБС без хирургической операции?
Однако спустя некоторое время выяснилось, что у половины прооперированных больных уже на первом году происходил рестеноз – повторное сужение сосуда. Тогда было предложено использовать специальный металлический каркас, который препятствовал бы спаданию дилатированной артерии. В 1986 первое стентирование почти одновременно выполнили Сигвард в Лозанне (Швейцария) и Пуэль в Тулузе (Франция).
Сущность метода
Коронарная ангиопластика со стентированием относятся к малоинвазивным вмешательствам и являются признанной альтернативой медикаментозного и хирургического лечения ИБС. Вмешательство проводится в специально оборудованной операционной под контролем рентгеноскопической техники.
Суть метода заключается в устранении облитерации и стеноза коронарной артерии с помощью раздуваемого баллончика, находящегося на конце катетера, который доставляется к сосудам сердца через периферическую артерию (как правило, бедренную). В дальнейшем, на месте дилатации сосуда устанавливается стент, препятствующий рестенозу коронарной артерии.
Стенты бывают различных размеров и форм, что определяется местом имплантации и диаметром сосуда. Они могут быть саморасправляющимися или устанавливаться с помощью баллончика. В настоящее время предпочтительнее использовать стенты со специальным лекарственным или биосовместимым покрытием. Конечно, такие устройства стоят дороже, но зато дольше функционируют и реже подвергаются тромбозу.
Показания к ангиопластике и стентированию
- Стабильная стенокардия напряжения, не поддающаяся медикаментозной терапии.
- Гемодинамически значимые стенозы коронарных артерий, даже если они протекают бессимптомно.
- Острый инфаркт миокарда (как альтернатива тромболитической терапии).
- Стенозы венозных шунтов после АКШ.
Противопоказания
- Диффузное поражение коронарного русла.
- Острое желудочно-кишечное кровотечение.
- Недавно перенесенный инсульт.
- Лихорадка и инфекционное заболевание.
- Выраженная анемия.
- Тяжелое системное или психическое заболевание.
- Интоксикация сердечными гликозидами.
- Наличие аллергии на контрастное вещество.
Техника операции
Перед оперативным вмешательством, больной должен быть госпитализирован в стационар для проведения полного кардиологического обследования, включая физикальные и лабораторно-инструментальные методы. Обязательно проводится коронарография. Только она может наглядно показать локализацию, протяженность и характер стеноза.
Перед операцией запрещается есть и пить, отменяются медикаментозные препараты, которые больной принимал ранее (возможно, не все).
- Местная анестезия кожи в области пункции.
- Пункция бедренной артерии (чаще всего) и катетеризация сердца.
- Продвижение катетера к месту стеноза и баллонная дилатация (расширение) коронарной артерии.
- Установка стента в области дилатации.
- Повторная коронарография для оценки результатов операции.
- Удаление катетеров, наложение давящей повязки на место пункции сосуда.
После окончания стентирования больной должен еще некоторое время находиться в больнице под круглосуточным наблюдением врачей. В первый день назначается постельный режим. Ногу, на которой лежит повязка, необходимо держать в горизонтальном положении (не сгибать) в течении 12-24 часов. На вторые сутки больной может вставать, ходить, выполнять обычную работу, особо не нагружаясь физически. На 3–5-е сутки, если все в порядке, пациента выписывают с рекомендациями.
Преимущества стентирования перед хирургической операцией (аортокоронарное шунтирование):
- Минимальный риск возникновения осложнений (меньше 1 % в крупных медицинских центрах).
- Меньшая продолжительность операции.
- Относительная дешевизна процедуры.
- Выполнение под местной анестезией.
- Отсутствие необходимости в использовании искусственного кровообращения и кардиоплегии.
- Возможность использовать в экстренных ситуациях и, тем самым, быстро восстановить кровоток.
- Возможность применения у тяжелых больных, которые не способны перенести сложную операцию.
- Быстрая реабилитация прооперированных больных.
- Отсутствие разрезов и послеоперационных рубцов.
Несмотря на вышеописанные достоинства, не стоит считать стентирование панацеей от ишемической болезни. Нет, это не так. Как и любое инвазивное вмешательство, данный метод имеет четкие показания, противопоказания, недостатки и может приводить к различным осложнениям (кровотечения, артериовенозные фистулы, рестенозы, аллергические реакции и прочее).
Ангиопластику и стентирование предпочтительнее использовать при единичных стенозах артерий сердца. При сужении ствола левой коронарной артерии, многососудистом поражении, а также сопутствующем сахарном диабете рекомендуют аортокоронарное шунтирование, у которого отдаленные результаты лучше.