Коррекция гликемии у больных сахарным диабетом в условиях перитонеального диализа

При проведении перитонеального диализа в разных диализных центрах используются различные схемы инсулинотерапии. Так в США по данным USA NIH CAPD Registry, 36% пациентов используют только подкожное введение инсулина, 54% — только интраперитонеальное, в 10% случаев — комбинация подкожного и интраперитонеального введения инсулина.
Интраперитонеальное введение инсулина позволяет уменьшить риск относительной гиперинсулинемии в периферической циркуляции, что, в свою очередь, снижает риск прогрессии атеросклероза . При этом не меняется уровень аполипопротеинов A-I и A-II. Кроме того, при введении инсулина с диализирующим раствором требуется меньшая его доза для коррекции алиментарной нагрузки глюкозой.
В ряде случаев переход на интарперитонеальное введение инсулина целесообразно не ранее чем через 4-5 недель после начала ПД. При этом в первые дни большинству пациентов требуется введение в диализирующий раствор 100% дозы подкожного инсулина. Для избежания эпизодов гипер- и гипогликемии, в этот период необходим более частый контроль уровня глюкозы в крови, с обязательным его определением между обменами диализирующего раствора. В последующем суточная доза инсулина может быть уменьшена. Изменения режима ПД: увеличение суточных объемов гиперосмолярных растворов может потребовать коррекции дозы интраперитонеального инсулина. При развитии диализного перитонита абсорбация инсулина из брюшной полости может увеличиваться, в связи с чем вероятны эпизоды гипогликемии, поэтому в период клинической манифестации воспалительного процесса необходим более интенсивный мониторинг уровня глюкозы крови.
Поражения нервной системы при эндокринных заболеваниях.
Поражения нервной системы при эндокринных заболеваниях
А.Л.Верткин, доктор медицинских наук, профессор О.Н. Ткачева, доктор медицинских наук, профессор
Х.М . Торшхоева, кандидат медицинских наук ,К.Э. Пироева.
Московский государственный медико-стоматологический университет
Городская клиническая больница №50, Москва
Городская клиническая больница №80, Москва
Среди патологических состояний нервной системы, возникающих при заболеваниях эндокринных желез, особое место занимают неврологические расстройства при сахарном диабете (СД) и дисфункции щитовидной железы. Это обусловлено не только распространенностью подобных нарушений, но и их тяжестью, значительному влиянию на прогноз и качество жизни.
Сахарный диабет
При СД поражаются все отделы нервной системы: ЦНС (энцефалопатия, миелопатия ), периферическая нервная система (поли- и мононейропатии) и периферическая вегетативная нервная система (автономная нейропатия). Некоторые авторы к поражениям ЦНС при СД относят также инсульт и острые нервно-психические расстройства [3].
Для диабетической энцефалопатии прежде всего характерен астенический синдром: общая слабость, повышенная утомляемость, снижение работоспособности, эмоциональная лабильность, тревожность, нарушение концентрации внимания. Часто выявляется цефалгический синдром, причем головная боль носит характер боли напряжения (сжимающая, стискивающая, по типу «тесного головного убора») или ишемически-гипоксической (чувство тяжелой головы и невозможность сосредоточиться). У пациентов практически всегда отмечается синдром вегетативной дистонии с развитием вегетативных пароксизмов, предобморочных состояний и обмороков. Кроме астенических и вегетативно-дистонических проявлений обнаруживаются очаговые нарушения: верхнестволовые (анизокория, расстройство конвергенции, признаки пирамидной недостаточности), вестибулярно-атаксический синдром (головокружение, шаткость походки, отклонения при выполнении проб на координацию движений). Указанные изменения сочетаются с расстройствами когнитивных функций: нарушением памяти, внимания, замедлением мышления, апатией, депрессией, указывающими на преимущественную дисфункцию неспецифических срединных структур головного мозга.
При СД часто встречается депрессия: как показывают наблюдения, более 32% пациентов, страдающих СД, подвержены депрессии. Кроме влияния на общее самочувствие, депрессия опасна в данном случае потерей контроля над течением самого заболевания, правильным питанием и применением инсулина. По мнению специалистов, одной из причин склонности больных СД к депрессии являются некоторые биохимические изменения в организме. Другая причина – постоянная зависимость людей, обусловленная болезнью.
Диабетическая миелопатия развивается одновременно с диабетической энцефалопатией у больных с продолжительным стажем заболевания. Она проявляется легкими проводниковыми чувствительными расстройствами, рефлекторной пирамидной недостаточностью, дисфункцией произвольного мочеиспускания и дефекации.
Доказано, что СД типа 2 – самостоятельный и независимый фактор риска инсульта. наряду с артериальной гипертензией, дислипопротеинемией, нарушениями сердечного ритма, курением, гиподинамией и другими факторами. Многочисленные исследования показали, что при СД типа 2 даже без сопутствующей артериальной гипертензии риск инсульта повышается в 2–3 раза. Чаще всего инсульт при СД носит ишемический характер. Патогенез инсульта связан с избыточным накоплением углекислоты, расширением мозговых сосудов, регионарным снижением вследствие этого артериального давления, что приводит к нетромботическому размягчению мозговой ткани. Коматозные состояния отличаются большой длительностью (от 1 до 3–5 сут и более). Геморрагический инсульт отмечается при сочетании СД с гипертонической болезнью или является осложнением диабетической комы в результате токсического воздействия на сосуды кетоновых тел.
Острые нервно-психические расстройства (ОНПР) возникают на фоне осложнений СД (кетоацидотические, гипогликемические, гиперосмолярные состояния, лактат-ацидоз). В развитии ОНПР играют роль гипер- и гипогликемия, изменения реологических свойств крови с нарушением микроциркуляции, микротромбообразованием и гипоксией, компенсаторное перераспределение мозгового кровотока в пользу функционально более значимых срединных структур, сдвиги в кислотно-основном состоянии, водно-солевом балансе и др. В одних случаях ОНПР занимают центральное место в клинической картине, а в других нивелируются выраженными соматическими расстройствами. Манифестация СД с ОНПР порой значительно затрудняет диагностику, маскируя психические и неврологические заболевания (инсульт, субарахноидальное кровоизлияние, травма или опухоль мозга). ОНПР сопровождаются разнообразными психическими (по типу делирия, острого галлюцинаторного психоза, кататонического синдрома) и неврологическими нарушениями (афазия, гемипарез, тетрапарез, полиморфные сенсорные нарушения, патологические сухожильные рефлексы и т.д.).
Наиболее раннее и частое осложнение СД – диабетическая нейропатия (ДН) [1, 2]. По данным разных авторов, она встречается у 90–100% больных СД. В некоторых случаях ДН предшествует появлению клинических признаков СД. После открытия СД как самостоятельного заболевания в XVIII в. и первых работ по нейродиабетологии интерес к ДН неуклонно растет, поскольку ее развитие оказывает существенное влияние на качество жизни, трудоспособность и социальную активность больных, увеличивает общую летальность при СД в 2–3 раза.
Симметричная дистальная полинейропатия – типичное диабетическое поражение периферических нервов. Больных беспокоят покалывания, онемение, зябкость стоп или ощущение жжения, боль в конечностях. В течение нескольких лет эти явления отмечаются в основном в состоянии покоя, мешая ночному сну, а в последующем принимают постоянный и интенсивный характер. Уже в начале заболевания часто удается выявить снижение чувствительности (болевой, тактильной, температурной, вибрационной) по типу «носков» и «перчаток». ослабление рефлексов, двигательные нарушения.
Боль интенсивная, симметричная, носит жгучий характер, усиливается при соприкосновении с одеждой или постельным бельем. Часто болевые ощущения сопровождаются депрессией, нарушением сна и аппетита, иногда даже развитием невротической кахексии. Дифференциально-диагностический критерий полинейропатических болей – их стихание после физической нагрузки, в отличие от болей при поражении периферических сосудов.
Чувствительные нарушения постепенно распространяются от дистальных отделов ног к проксимальным, затем вовлекаются в процесс и руки. Двигательные нарушения выражены минимально и проявляются легкой слабостью и атрофией мышц стопы. Изредка возникает паралич разгибателей стоп, в результате чего развивается походка «степпаж», в последующем может присоединяться слабость мышц кисти. В проксимальных отделах конечностей слабость обычно не ощущается, а происходит ослабление сухожильных рефлексов (вначале ахилловых, затем коленных). Степень утраты рефлексов связана преимущественно с поражением не столько двигательных, сколько чувствительных (тонких или толстых) волокон. Кроме того, при вовлечении в процесс толстых волокон глубокой чувствительности нарушается координация и затрудняется передвижение (сенсорная атаксия).
Вследствие поражения вегетативных волокон развиваются вегетативно-трофические расстройства в виде нейроартропатий, проявляющихся прогрессирующей деформацией голеностопного сустава или суставов стопы. Кроме того, образуются безболезненные язвы, в патогенезе которых, кроме вегетативно-трофических расстройств, играют роль поражение сосудов, нарушение чувствительности и инфекция. Нейропатические язвы и артропатии могут привести к развитию остеомиелита или гангрены (диабетическая стопа).
Симметричная проксимальная моторная нейропатия встречается довольно редко и характеризуется слабостью и атрофией проксимальных мышц нижних конечностей (четырехглавой мышцы бедра, подвздошно-поясничной, задних мышц бедра), иногда – мышц плечевого пояса и плеча. Выпадают сухожильные и периостальные рефлексы, регистрируются минимальные расстройства чувствительности. В спинномозговой жидкости выявляется повышение уровня белка до 1 г/л.
Асимметричная проксимальная моторная нейропатия (диабетическая амиотрофия) обусловлена очаговым или многоочаговым повреждением верхнепоясничных корешков (L 1 –L 3 ) и/или поясничного сплетения. Начало острое или подострое, характеризующееся интенсивными жгучими болями в области передней поверхности бедра или поясницы, нарушения чувствительности минимальны. На фоне болевого синдрома возникают парез и атрофия передних мышц бедра. Объективно выявляется выпадение коленного рефлекса, слабость сгибателей бедра и разгибателей голени, а также мышц, отводящих бедро. Неврологические расстройства могут быть достаточно выраженными, но прогноз благоприятен.
При диабетической радикулопатии чаще поражаются нижнегрудные корешки Th 6 –Th 12. Характерна интенсивная опоясывающая боль в средней или нижней части грудной клетки, иррадиирующая в верхние или средние отделы живота, имитируя патологию органов брюшной полости, сердца, плевры. Объективно выявляется гипестезия или гиперестезия в соответствующих дерматомах. При вовлечении в процесс двигательных корешков, иннервирующих мышцы стенки живота, возможно формирование грыжи живота. Болевой синдром проходит в течение нескольких дней, нарушение чувствительности регрессирует около 1 мес. Поражение нижнепоясничных и верхнекрестцовых корешков L 5 –S 2 возникает реже. При поражении L 5 отмечается слабость разгибателей стопы, больной не может встать на пятку, появляется так называемая свисающая стопа. При двустороннем поражении возникает походка «степпаж», как при тяжелой дистальной полинейропатии. Радикулопатия шейных корешков, чаще всего С 5 –С 8. с соответствующей клинической симптоматикой развивается гораздо реже. Нижнепоясничную и шейную радикулопатию следует дифференцировать от вертеброгенной патологии, лечение которой представляет значительные трудности. При диабетической радикулопатии подвижность позвоночника не ограничена, сколиоза, напряжения паравертебральных мышц не отмечается, боль не уменьшается в положении лежа, усиливается ночью. Рентгенологическая картина в виде дегенеративно-дистрофических изменений позвоночника не является основанием для диагностики вертеброгенной патологии.
При диабетической мононейропатии наиболее часто поражаются лицевой, отводящий и седалищный нервы. Множественная мононейропатия проявляется острым одновременным или последовательным ишемическим поражением отдельных нервов.
Помимо соматической, для СД характерна и автономная нейропатия. Обычно она сопутствует сенсомоторным нарушениям, но иногда ее проявления выходят на первый план. Клиническая картина зависит от того, какая система вовлечена в патологический процесс.
При дисфункции сердечно-сосудистой системы отмечаются тахикардия покоя, ригидный ритм, ортостатическая гипотензия. Также возможны безболевая ишемия и инфаркт миокарда, артериальная гипертензия. Автономная нейропатия с поражением сердечно-сосудистой системы – одно из самых тяжелых и распространенных осложнений СД, которое в 5 раз повышает риск летального исхода у таких больных и может стать причиной внезапной смерти.
При желудочно-кишечной форме автономной нейропатии развиваются дисфагия, диспепсия, диабетический гастропарез, дискинезия желчных путей, нарушение функции пищевода, энтеропатия с диареей, запорами и в ряде случаев недержанием кала. Апноэ, гипервентиляционный синдром, нарушение контроля ЦНС за дыханием, снижение выработки сурфактанта могут возникнуть при дисфункции бронхолегочной системы. Мочеполовая форма автономной нейропатии приводит к эректильной дисфункции, ретроградной эякуляции, нарушению мочеиспускания (из-за атонии мочеточников и мочевого пузыря). Нарушение иннервации надпочечников является причиной ослабления вегетативной реакции на гипогликемию (бессимптомная гипогликемия ). поэтому больные перестают ее ощущать, что создает определенные трудности для своевременного устранения гипогликемии. Для автономной нейропатии характерно также и нарушение функции потоотделения (потливость лица и верхней половины туловища во время еды).
Тиреотоксикоз
Поражение нервной системы при тиреотоксикозе возникает практически всегда, поэтому раньше его называли «нейротиреозом» или «тиреоневрозом». В патологический процесс вовлекаются ЦНС, периферические нервы и мышцы.
Воздействие избытка тиреоидных гормонов в первую очередь приводит к развитию симптоматики неврастенического характера. Типичны жалобы на повышенную возбудимость, беспокойство, раздражительность, навязчивые страхи, бессонницу, отмечается изменение поведения – суетливость, плаксивость, избыточная моторная активность, потеря способности концентрировать внимание (больной резко переключается с одной мысли на другую), эмоциональная неустойчивость с быстрой сменой настроения от ажитации до депрессии. Истинные психозы редки. Синдром заторможенности и депрессии, названный «апатичным тиреотоксикозом», обычно возникает у пожилых больных. «Вся их деятельность по сути дела неполноценна. Быстрая истощаемость нервной системы делает их умственную деятельность малопродуктивной, а значительная мышечная слабость обесценивает их физический труд», – писал Н.А. Шерешевский. К этому присоединяется множество невротических, абулических, фобических симптомов.
Фобические проявления весьма характерны для тиреотоксикоза. Часто возникает кардиофобия, клаустрофобия, социофобия.
В ответ на физическую и эмоциональную нагрузку возникают панические атаки, проявляющиеся резким учащением пульса, повышением артериального давления, побледнением кожи, сухостью во рту, ознобоподобным дрожанием, страхом смерти.
Невротические симптомы при тиреотоксикозе неспецифичны, а по мере развития и утяжеления заболевания угасают, сменяясь тяжелыми органными поражениями.
Тремор – ранний симптом тиреотоксикоза. Этот гиперкинез сохраняется и в покое, и при движениях, причем эмоциональная провокация усиливает его выраженность. Тремор захватывает руки (симптом Мари – тремор пальцев вытянутых рук), веки, язык, а иногда и все тело («симптом телеграфного столба»).
В результате нарушения вегетативной иннервации глаз развиваются глазные симптомы (их описано более 50). При взгляде вниз появляется участок склеры между верхним веком и радужкой (симптом Грефе), при взгляде вверх – между нижним веком и радужкой (симптом Кохера), при взгляде прямо – между верхним веком и радужкой (симптом Дельримпля). Развитие этих симптомов связано с усилением тонуса гладких мышечных волокон, участвующих в поднимании верхнего века, которые иннервируются симпатической нервной системой. Нарушается конвергенция (симптом Мебиуса).
По мере утяжеления заболевания прогрессируют быстрая утомляемость, мышечная слабость, диффузное похудение, атрофия мышц. У некоторых больных мышечная слабость достигает крайней степени тяжести и даже приводит к смерти. Исключительно редко при тяжелом тиреотоксикозе могут внезапно возникнуть приступы генерализованной мышечной слабости (периодический тиреотоксический гипокалиемический паралич), захватывающей мышцы туловища и конечностей, в том числе и дыхательные мышцы. В некоторых случаях параличу предшествуют приступы слабости в ногах, парестезии, патологическая утомляемость мышц. Паралич развивается бурно. Такие приступы иногда могут быть единственным проявлением тиреотоксикоза. При электромиографии у больных с периодическим параличом выявляются полифазия, уменьшение потенциалов действия, наличие спонтанной активности мышечных волокон и фасцикуляций.
Хроническая тиреотоксическая миопатия возникает при длительном течении тиреотоксикоза, характеризуется прогрессирующей слабостью и утомляемостью в проксимальных группах мышц конечностей, чаще ног. Отмечаются затруднения при подъеме по лестнице, вставании со стула, расчесывании волос. Постепенно развивается симметричная гипотрофия мышц проксимальных отделов конечностей.
Гипотиреоидные неврологические расстройства часты и многообразны, и неврологи регулярно сталкиваются с ними на практике. [3, 4].
Наиболее распространены у больных с гипотиреозом психоневрологические расстройства как проявления гипотиреоидной энцефалопатии. Формированию органического поражения нервной системы способствует резкое угнетение энергетических и анаболических процессов в веществе мозга. Отмечаются замедление мышления и речи, заторможенность, сонливость, ухудшение памяти, дизартрия, обусловленная снижением подвижности губ и языка, а также отеком голосовых связок, что приводит к снижению тембра голоса и охриплости. Пациенты, как правило, подавлены и практически всегда сами находят для этого какую-то внешнюю причину. Некоторые из них, описывая свое состояние, говорят, что у них как будто «отключили питание» или «хочется лежать и ни о чем не думать». Для тяжелого гипотиреоза характерна эмоциональная бедность. Насколько «богат» эмоциями и переживаниями тиреотоксикоз, настолько им «беден» гипотиреоз. В литературе можно встретить много описаний тяжелых психических изменений и так называемого микседематозного делирия, в результате которых пациенты ошибочно госпитализировались в психиатрические клиники [4]. Больные жалуются на частые головокружения, а при обследовании выявляются и элементы мозжечковой атаксии. При тяжелом гипотиреозе возможна псевдодеменция с угнетением когнитивных функций, нарушением социальной адаптации, даже навыков самообслуживания. От истинной деменции она отличается обратимостью [6].
Нередким проявлением гипотиреоза являются приступы, похожие на панические атаки, характерные для тиреотоксикоза. Данные пароксизмальные состояния с выраженной эмоциональной и вегетативной окраской отличаются стереотипностью, развиваются в одной и той же обстановке и в одно и то же время.
Выраженные изменения при гипотиреозе обнаруживаются и со стороны периферической нервной системы. В результате отека мягких тканей происходит ущемление периферических нервов в узких костно-связочных каналах и под сухожилиями мышц, вследствие чего развиваются тоннельные нейропатии – синдром ущемления срединного нерва в запястном канале (синдром канала запястья), синдром ущемления наружного кожного нерва бедра, большеберцового нерва (синдром тарзального канала), синдром ущемления четвертого подошвенного нерва пальцев стопы.
Кроме тоннельных нейропатий, у многих больных выявляется картина полинейропатий, характеризующаяся болями, парестезиями, мышечной слабостью, судорогами, ослаблением или выпадением сухожильных рефлексов. Подобные проявления усиливаются вплоть до полной обездвиженности в холодном помещении или в зимний период.
Для поражения мышечной системы (гипотиреоидная миопатия) типичны слабость и миотонические феномены (неспособность произвольно быстро расслабить мышцы). При миопатических нарушениях у взрослых (синдром Гофмана) отмечаются гипертрофия и уплотнение мышц на ощупь, болезненность, болезненные судороги, увеличение механической возбудимости мышц при перкуссии.
Головной мозг чрезвычайно чувствителен к дефициту тиреоидных гормонов в организме, и уже при субклиническом гипотиреозе, то есть когда при гормональном исследовании выявляется только повышение уровня тиреотропного гормона, могут развиваться определенные изменения. Как уже указывалось, чаще всего страдает эмоциональная сфера. Это проявляется подавленным настроением и депрессией. Распространенность депрессии при субклиническом гипотиреозе, по данным разных авторов, колеблется от 38% до 56%, тогда как в общей популяции – от 6% до 20%. Среди больных с депрессией частота скрытого гипотиреоза выше, чем в общей популяции, а частота обнаружения зоба достигает 86% [7].
При гипотиреозе имеет место нарушение обмена и продукции ряда медиаторов. И развитие депрессии при субклиническом и манифестном гипотиреозе связывают со снижением активности в ЦНС 5-гидрокситриптамина [5].
Назначение больших доз трийодтиронина в ряде случаев позволяет уменьшить выраженность характерной для гипотиреоза рефрактерной депрессии и увеличить эффективность антидепрессантов.
Список литературы
1. Балаболкин М.И. Эндокринология.– М. Универсум Паблишинг, 1998.– С. 367–470.
2. Дедов И.И. Мельниченко Г.А. Фадеев В.В. Эндокринология (учебник для студентов медицинских вузов).– М. Медицина, 2000.
3. Калинин А.П. Котов С.В. Неврологические расстройства при эндокринных заболеваниях.– М. 2001.
4. Фадеев В.В. Мельниченко Г.А. Гипотиреоз (руководство для врачей).– М. РКИ Северо пресс, 2002.
5. Cleare A.J. et al. Neuroendocrine evidence for an assocition between hypothyroidism, reduced central 5-HT activity and depression // Clin. Endocrinol.– 1995.– V. 43.– P. 713–719.
6. Dugbartey A.T. Neurocognitive aspects of hypothyroidism // Arch. Int. Med.– 1998.– V. 158.– P. 1413–1418.
7. Haggerty J.J. Prange A.J. Borderline hypothyroidism and depression // Anu. Rev. Med. select. Top. Clin. Sci.– 1995.– V. 46.– P. 37–46.
Проблема гипогликемий при СД 2–го типа и современные возможности ее решения
Аметов А.С. Абаева Ф.Т.
Гипогликемия является одной из важнейших нерешенных задач современной диабетологии и зачастую представляет собой серьезное препятствие на пути к достижению должного гликемического статуса пациента.
Пристальное внимание к проблеме влияния гипогликемии на развитие осложнений было привлечено после оглашения результатов исследования ACCORD (Action to Control Cardiovascular Risk in Diabetes), которое имело целью оценить влияние интенсивного (с целевым значением HbA1с 6,0%) и стандартного (с целевым значением HbA1с 7,0–7,0%) лечения на риск развития осложнений у пациентов с HbA1с≥7,5% и наличием макрососудистых осложнений в анамнезе. В группе интенсивного лечения HbA1c удалось снизить спустя 4 мес. до 6,7%, спустя 1 год – до 6,4%. Однако главным результатом исследования стало увеличение смертности в группе интенсивной терапии на 22% по сравнению с группой стандартной терапии. Среди главных причин, вызвавших неблагоприятное развитие событий, обсуждались частые гипогликемические состояния (16,2% тяжелых гипогликемий в группе интенсивного контроля по сравнению с 5,1% – в группе стандартного контроля) (рис. 1). Ретроспективный анализ, проведенный в рамках данного исследования, подтвердил четкую взаимосвязь между частотой развития тяжелых гипогликемий и повышенным риском смертности, что было выявлено как в группе интенсивной, так и традиционной терапии. В то же время, другое базовое исследование ADVANCE продемонстрировало благоприятный исход в группе интенсивного контроля (цель – HbA1c – 6,5%), где снижение риска микро– и макрососудистых осложнений составило 10% (pгипогликемий (0,7 на 100 пациентов в год) (табл. 1). По данным зарубежных авторов, 5% пожилых больных СД 2–го типа. получающих инсулин, при уровне HbA1c 8,5% имеют как минимум одну тяжелую гипогликемию в год.
В настоящее время не существует единого определения гипогликемии. У человека без СД гипогликемией считают снижение уровня гликемии менее 2,8 ммоль/л, сопровождающееся определенной клинической симптоматикой, или до уровня 2,2 ммоль/л вне зависимости от наличия симптоматики. К пациенту с СД это определение применимо не всегда, т.к. больные, у которых длительно наблюдается близкий к нормальному уровень гликемии или имеющие вегетативную нейропатию, не ощущают снижения гликемии до уровня 2 ммоль/л. В то же время, длительно декомпенсированные больные чувствуют симптомы гипогликемии при уровне глюкозы крови 4–5 ммоль/л. Американская диабетическая ассоциация определила гипогликемию как «любое снижение уровня глюкозы крови, способное принести вред», с минимальным показателем для глюкозы плазмы крови 3,9 ммоль/л при наличии или отсутствии симптомов активации нейроэндокринной контррегуляции. Согласно данным ВОЗ, нормальные значения глюкозы крови находятся в пределах 3,3–5,5 ммоль/л, при этом стандарт для нижней границы также не установлен. Однако известно, что первый контррегуляторный механизм, а именно – угнетение эндогенной секреции инсулина, активируется при достижении значения уровня плазмы крови 4,0–4,2 ммоль/л. Дальнейшее снижение уровня глюкозы ниже 3,7 ммоль/л ведет к повышению уровня контринсулярных гормонов. В связи с этими механизмами, вероятно, гипогликемию следует определять как снижение уровня глюкозы крови ниже 4,0–4,2 ммоль/л [4].
Основной причиной развития гипогликемии является дисбаланс между уровнем инсулина и поступлением углеводов извне (с пищей) или из эндогенных источников (продукция глюкозы печенью). Пусковыми факторами, провоцирующими дисбаланс между уровнем инсулина и глюкозой крови у пациентов с СД 2–го типа. являются передозировка инсулина, препаратов СМ и глинидов, изменение фармакокинетики инсулина или ПССП (вследствие замедленного клиренса, неправильной техники инъекции, лекарственного взаимодействия препаратов СМ), а также повышение чувствительности к инсулину (длительная физическая нагрузка).
В физиологических условиях при достижении порогового уровня гликемии 3,7 ммоль/л запускается гормональный контррегуляторный ответ на гипогликемию, который состоит из нескольких событий. Первым этапом является подавление секреции инсулина β–клетками поджелудочной железы и стимуляция секреции α–клеток с выделением глюкагона, который в свою очередь стимулирует гликогенолиз и глюконеогенез. Лишь при недостаточном эффекте глюкагона происходит стимуляция высвобождения адреналина мозговым веществом надпочечника и норадреналина нервными окончаниями постганглионарных симпатических нервных волокон. Кортизол и СТГ реагируют только при более длительной гипогликемии при недостаточном эффекте от предыдущих механизмов [1,4] (табл. 2).
Таким образом, система контррегуляторного ответа функционирует и у пациентов, имеющих небольшой стаж СД. С увеличением длительности заболевания развивается нарушение функционирования системы контррегуляции, при этом самым ранним нарушением гормонального ответа является снижение секреции глюкагона, позднее – и адреналина, что повышает риск тяжелых гипогликемий. Причинами нарушения системы контррегуляции часто являются автономная нейропатия и снижение распознавания гипогликемии. Кроме этого, гормональный ответ на гипогликемию нарушается на фоне высокой концентрации инсулина крови.
Немаловажным является тот факт, что сама гипогликемия способна вызывать снижение нейроэндокринного ответа на последующие эпизоды гипогликемии. В исследовании S. Heller и P. Cryer с помощью измерения контррегуляторных ответов было установлено, что два эпизода умеренной гипогликемии приводят к значительному снижению уровней глюкагона, адреналина и кортизола в плазме крови на следующий день после гипогликемии [10]. Параллельно с этим ослабевают нейрогенные симптомы. Таким образом, однократный эпизод продолжительной гипогликемии снижает гормональный ответ на следующую гипогликемию, а каждая новая гипогликемия вносит свой губительный вклад в прогрессирующее снижение контррегуляторного ответа. Это дает основания для формирования мотивации к предупреждению минимальной вероятности развития гипогликемии у пациентов с СД 2–го типа.
Указанные механизмы нарушения контррегуляторного ответа у пациентов с СД 2–го типа осложняют подбор сахароснижающей терапии (ССТ), ведь хорошо известно, что применение инсулина, ПСМ и глинидов сопровождается увеличением риска развития гипогликемий (рис. 2). В то же время доказано, что интенсификация ССТ должна проводиться своевременно, с целью не получить реализацию «эффекта метаболической памяти», что, как известно, значительно ухудшает прогноз пациентов с СД 2–го типа. При этом исходы упомянутых выше базовых исследований свидетельствуют о необходимости поиска терапевтических возможностей. которые помимо достаточного сахароснижающего эффекта сопряжены с низким риском развития гипогликемии. Сегодня набрела обувной магазин, где Женская Обувь Больших размеров выставлена в разнообразнейшем выборе среди лучших обувных бутиков Москвы.
Физиологичность действия и, как следствие, низкий риск побочных эффектов, в том числе и гипогликемии, обусловливают интерес к препаратам из группы ингибиторов дипептидилпептидазы – 4 (ДПП–4).
В основе их действия лежит реализация физиологических сахароснижающих механизмов гормонов ЖКТ глюкагоноподобного пептида–1 (ГПП–1) и глюкозозависимого инсулинотропного полипептида (ГИП) путем ингибирования фермента дипептидилпептидазы–IV (DPP–IV), который в течение нескольких минут расщепляет ГПП–1 и ГИП, тем самым препятствуя их действию. Больший интерес при СД 2–го типа вызывает ГПП–1, т.к. его секреция у пациентов с СД 2–го типа сохранена, а ГИП – снижена. Инактивация фермента DPP–IV позволяет осуществить эффекты ГПП–1 [4,5]. Воздействие ГПП–1 на β–клетку поджелудочной железы состоит в потенцировании секреции инсулина, которая зависит от уровня гликемии: при достижении уровня сахара крови около 4,5 ммоль/л инсулинстимулирующий эффект не реализуется [5,7,15]. Воздействие на рецепторы к ГПП–1 в α–клетках поджелудочной железы приводит к снижению секреции глюкагона, что, в свою очередь, снижает продукцию глюкозы печенью. При этом важно, что и данный эффект глюкозозависим.
Таким образом, глюкозозависимая стимуляция секреции инсулина и глюкозозависимое подавление секреции глюкагона, осуществляемые ГПП–1, являются механизмами защиты от гипогликемии [2,7]. Инактивация фермента ДПП–IV дает возможность реализовать эффекты ГПП–1, что ведет к восстановлению чувствительности α– и β–клеток и баланса уровней инсулина и глюкагона, предотвращая тем самым развитие гипогликемии.
Одним из наиболее изученных препаратов из группы ингибиторов ДПП–4 является вилдаглиптин, клиническое изучение которого доказало высокую эффективность и достоверную безопасность. Препарат обеспечивает улучшение гликемического контроля при назначении как в монотерапии, так и в комбинации, что сопряжено с низким риском гипогликемии и нейтральным влиянием на массу тела.
Среди всех факторов контррегуляции гипогликемии глюкагон играет наиболее значимую роль, в первую очередь потому, что его секреция является первым физиологическим ответом на патологическое снижение гликемии. Однако даже при небольшой длительности СД 2–го типа уже проявляются дефекты в гормональном ответе на гипогликемии, и выражаются они в замедлении инсулиновой реакции и неадекватном уровне глюкагона. В связи с этим основная возможность снижения риска гипогликемии заключается в восстановлении баланса гормонов, участвующих в контррегуляторном ответе. В исследовании B. Ahrén, A. Schweizer, S. Dejager, посвященном изучению влияния вилдаглиптина на уровень глюкагона при гипер– и гипогликемии в сравнении с плацебо после приема стандартного завтрака у 28 пациентов с СД 2–го типа, не получающих ПССТ и имеющих HbA1c≥7,5% [6], было установлено, что вилдаглиптин увеличивает на 38% (р
S. Dejager и соавт. изучали эффективность препарата в ходе плацебо–контролируемого исследования длительностью 24 нед. у 632 пациентов. После рандомизации пациенты основной группы получали вилдаглиптин в дозе 50 мг 2 р./сут. или 50–100 мг однократно. По сравнению с исходными данными отмечено снижение HbA1c в среднем на 0,8% в группах, получающих вилдаглиптин. При этом за 24 нед. исследования зарегистрировано 3 случая гипогликемии легкой степени у пациентов, получавших вилдаглиптин [15].
Исследование E. Ferrannini, V. Fonseca длительностью 52 нед. имело целью выявить эффективность и безопасность вилдаглиптина (50 мг 2 р./сут.) по сравнению с глимепиридом (средняя доза – 4 мг/сут.) у пациентов, имеющих недостаточный контроль (HbA1c 6,5–8,5%) на фоне монотерапии метформином. Через 52 нед. пациенты обеих групп продемонстрировали достоверное снижение HbA1c, при этом равное число пациентов в группах достигли уровня HbA1c 7%. Однако в отношении частоты возникновения гипогликемии были зафиксированы существенные различия. Частота развития гипогликемий в группе, получающей вилдаглиптин, оказалась в 10 раз ниже по сравнению с группой, получающей глимепирид (30 эпизодов против 554, р
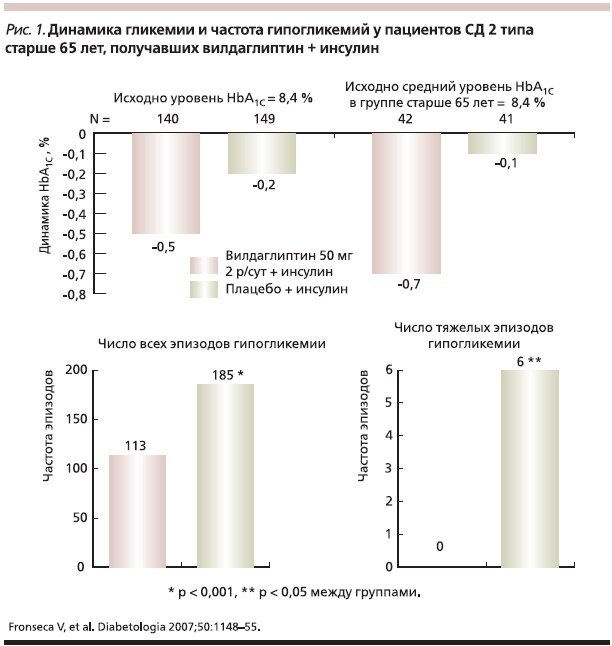
V. Fonseca и соавт. изучали эффективность вилдаглиптина (50 мг/сут.) по сравнению с плацебо у пациентов с неудовлетворительным контролем гликемии (HbA1с 7,5–11%) на фоне терапии инсулином НПХ в дозе более 30 ЕД/сут. в течение 24 нед. К концу наблюдения уровень HbA1с в основной группе снизился на 0,5%, в группе контроля – всего на 0,2%. Необходимо отметить, что эпизоды гипогликемии регистрировались существенно реже в основной группе, что, вероятно, обусловлено повышением чувствительности α–клеток поджелудочной железы к глюкозе [15]. Добавление вилдаглиптина к инсулину достоверно уменьшало риск гипогликемий по сравнению с терапией только НПХ. Общее число эпизодов гипогликемии составило 113 и 185 в группе вилдаглиптин + НПХ и группе НПХ соответственно (р
Таким образом, применение нового класса препаратов, ингибиторов ДПП–4, позволяет получить адекватный гликемии сахароснижающий эффект за счет глюкозозависимого характера стимуляции β–клетки и способности снижать патологически повышенный уровень глюкагона. При этом восстановление чувствительности α–клеток и глюкозозависимая стимуляция секреции глюкагона обеспечивают защиту от гипогликемии.
Статья опубликована по заказу и при финансовой поддержке ООО «Новартис Фарма» (Россия) в соответствии с внутренней политикой общества и действующим законодательством Российской Федерации. Согласно договоренности с ООО «Новартис Фарма», авторам статьи не следовало иметь никаких относящихся к данной статье договоренностей или финансовых соглашений с любыми третьими лицами, статья подлежала написанию без посторонней помощи со стороны любых третьих лиц
Литература
1. Дедов И.И. Шестакова М.В. Инкретины: новая веха в лечении сахарного диабета 2 типа. – М. ФГУ ЭНЦ, 2010.
2. Аметов А.С. Физиология метаболизма глюкозы // Сахарный диабет 2 типа: проблемы и решения. 2011. – С. 21–51.
3. Аметов А.С. Карпова Е.В. Инкретиномиметики – новый этап в лечении сахарного диабета 2–го типа // РМЖ. – 2010. – Т. 18, № 23 (387). – С. 1410–1415.
4. Аметов А.С. Иванова Е.В. Гипогликемия // Сахарный диабет 2 типа: проблемы и решения. 2011. – С. 115–143.
5. Workgroup on Hypoglycemia, American Diabetes Association. Defining and reporting hypoglycemia in diabetes: a report from the American Diabetes Association Workgroup on Hypoglycemia // Diabetes Care. 2005. Vol. 28. P. 1245–1249.
6. Ahran B. Schweizer A. Dejager S. et al. Vildagliptinenhancesisletresponsiveness to both hyper– and hypoglycemia in patients with type 2 diabetes // J. Clin. Endocrinol. Metab.2009. Vol. 94(4). P. 1236–1243.
7. Ferrannini E. Fonseca V. Zinman B. et al. Fifty–two–week efficacy and safety of vildagliptin vs. glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy // Diabetes. Obes. Metab. 2009. Vol. 11(2). P. 157–166.
8. Desouza C.V. Bolli G.B. Fonseca V. Hypoglycemia, diabetes, andcardiovascularevents // Diabetes Care. 2010. Vol. 33. P. 1389–1394.
9. Barnett A.H. Avoiding hypoglycaemia while achieving good glycaemic control in type 2 diabetes through optimal use of oral agent therapy // Curr. Med. Res. Opin. 2010. Vol. 26. P. 1333–1342.
10. Heller S. Chapman J. McCloud J. Ward J. Unreliability of reports of hypoglycaemia bydiabetic patients // BMJ. 1995. Vol. 310. P. 440.
11. Wild D. von Maltzahn R. Brohan E. et al. A critical review of the literature on fear of hypoglycemia in diabetes: implications for diabetes management and patient education // Patient Educ. Couns. 2007. Vol. 68. P. 10–15.
12. Vexiau P. Mavros P. Krishnarajah G. et al. Hypoglycaemia in patients with type 2 diabetes treated with a combination of metformin and sulphonylurea therapy in France // Diabetes Obes. Metab. 2008. Vol. 10 (suppl. 1). P. 16–24.
13. Davis S.N. Mann S. Briscoe V. J. et al. Effects of intensive therapy and antecedent hypoglycemia on counterregulatory responses to hypoglycemia in type 2 diabetes // Diabetes. 2009. Vol. 58. P. 701–709.
14. Fonseca V. Baron M. Shao Q. Dejager S. Sustained efficacy and reduced hypoglycemia during one year of treatment with vildagliptin added to insulin in patients with type 2 diabetes mellitus // New Orleans, Louisiana: Endocrinology Department, Tulane University Health Sciences Center, 70112, USA.
15. Dejager S. Razac S. Foley J.E. Schweizer A. Vildagliptin in drug–naive patients with type 2 diabetes: a 24–week, double–blind, randomized, placebo–controlled, multiple–dose study // Horm. Metab. Res. 2007. Vol. 39. P. 218–223.