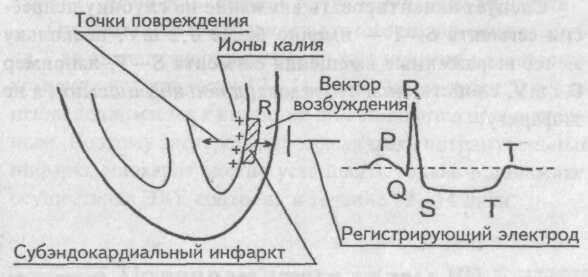
Заднедиафрагмальный инфаркт миокарда (или инфаркт нижней стенки левого желудочка)
Прочитайте:
При этой локализации ИМ поражаются преимущественно нижние отделы задней стенки, прилежащие к диафрагме, поэтому такое расположение инфаркта нередко называют инфарктом нижней стенки. Иногда при заднедиафрагмальном инфаркте процесс распространяется на заднюю часть МЖП. Заднедиафрагмальный (нижний) ИМ развивается при окклюзии проксимальных отделов правой коронарной артерии.
ЭКГ признаками заднедиафрагмального (нижнего) ИМ являются:
· наличие прямых признаков инфаркта (патологического зубца Q или QS, уменьшения амплитуды зубца R, подъема интервала ST, отрицательного коронарного зубца Т) в отведениях II, III, aVF, D по Небу, причем наибольшая роль в диагностике заднедиафрагмального инфаркта принадлежит отведению aVF;
· появление реципрокных изменений ЭКГ в отведениях I, aVL, V1 -V3 (депрессия сегмента ST, высокий положительный зубец Т);
· увеличение амплитуды зубца R в отведении aVR>1 мм (признак непостоянный).
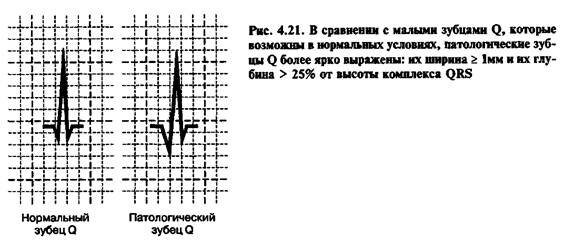
Важнейшую роль в ЭКГ-диагностике заднедиафрагмального (нижнего) ИМ играет правильная оценка зубца Q в отведениях III и aVF
Критерии патологического зубца Q в отведениях III и aVF (В. Н. Орлов, 1983):
· ширина зубца Q>0.03 с;
· глубина зубца Q> 1/2 амплитуды зубца R в тех же отведениях, однако, в отведении aVF может наблюдаться зубец Q<1/2 R aVF, особенно в рубцовой стадии инфаркта;
· патологический зубец QIII обязательно сочетается с патологическим зубцом Q aVF;
· патологический зубец QIII обязательно сочетается с патологическим зубцом QII. при этом глубина QII < 1/2 RII. но > 10% RII ;
· зубцы QIII и QaVF. обусловленные наличием ИМ в заднедиафрагмальном отделе, никогда не исчезают и не уменьшаются во время глубокого вдоха и в вертикальном положении больного; напротив, глубокие QIII и QaVF. не обусловленные инфарктом миокарда, исчезают или значительно уменьшаются во время вдоха и в вертикальном положении пациента;
· патологический зубец Q III, aVF нередко зазубрен или расщеплен;
· патологический зубец QIII, aVF скорее всего патологический, если он сочетается с отрицательным зубцом Т или подъемом интервала ST, или если следующий за ним зубец R зазубрен или расщеплен.

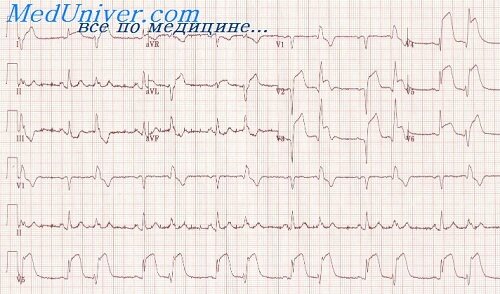
Рис. Заднедиафрагмальный (нижний) инфаркт. Прямые признаки инфаркта (патологический зубец Q, подъем интервала ST, формирование отрицательного зубца Т) в отведениях II, III, aVF, реципрокные изменения (депрессия интервала ST, высокий положительный зубец Т) в отведениях I, aVL, V1 ,V2 ,V3 .
#image.jpg
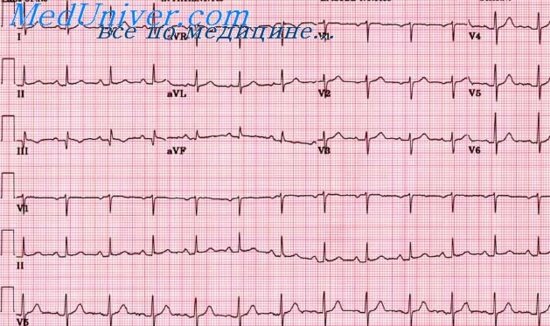
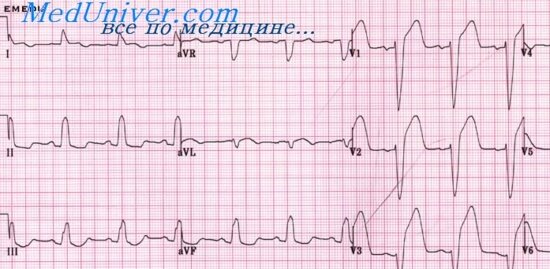
Рис. Острый крупноочаговый инфаркт миокарда нижней стенки ЛЖ.
#image.jpg
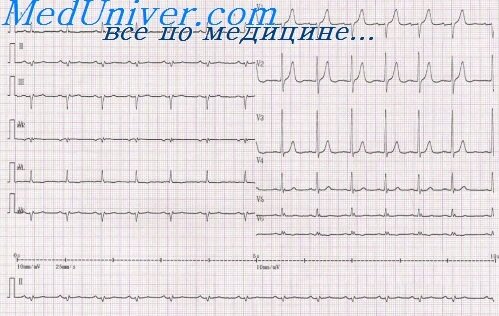
Рис. Острый крупноочаговый инфаркт миокарда нижней стенки ЛЖ, осложненный АВ-блокадой I степени.
Заднедиафрагмальный инфаркт миокарда
При таком расположении инфаркта поражаются преимущественно нижние отделы задней стенки. Нередко процесс распространяется также на заднюю часть межжелудочковой перегородки. Характерные для такого инфаркта миокарда признаки определяются в отведениях III, aVF, Dorsallis по Небу, а также во II стандартном отведении. Зубец Q в отведениях III, aVF считается патологическим, если он больше половины амплитуды зубца R в этих отведениях или шире 0,03 с.
Однако в отведении aVF при несомненном инфаркте может наблюдаться зубец Q<½R, особенно в рубцовой стадии заболевания. Патологический зубец QIII, aVF обычно сочетается со значительным уменьшением высоты следующего за ним зубца RIII, aVF и с характерными изменениями сегмента ST и зубца Т. Следует учитывать, чтя выраженный зубец QIII нередко наблюдается и у здоровых людей, а также при некоторых заболеваниях, не связанных с инфарктом миокарда.
Для инфаркта миокарда характерно также соотношение QII>QI (в норме QI>QII). В рубцовую стадию инфаркта зубец qII может быть мало выражен или даже отсутствовать. В рубцовую стадию заднедиафрагмального инфаркта иногда ЭКГ во II, III и aVF отведениях и в отведении Dorsalis может иметь вид rS или rSR. Если в норме RaVF>RIII, то на рубцовые изменения в задней стенке может указывать соотношение raVF «Руководство по электрокардиографии», В.Н.Орлов Инфаркт миокарда — острая коронарная недостаточность с некрозом участка миокарда. В подавляющем большинстве случаев инфаркт миокарда является следствием атеросклероза коронарных артерий и обычно возникает в результате их тромбоза. Инфаркт миокарда называют трансмуральным. если он охватывает всю толщу стенки сердца, и субэндокардиальным. если он охватывает лишь участок субэндокардиального слоя, наиболее чувствительного к коронарной недостаточности. Как правило, инфаркт возникает в стенке левого желудочка и иногда распространяется на правый желудочек и предсердия. Если инфаркт достаточно велик, то может развиться острая сердечная недостаточность, обычно левожелудочковая, что еще более ухудшает коронарный кровоток. Чрезвычайно редко инфаркт миокарда возникает вне связи с коронарным атеросклерозом — вследствие коронариита или эмболии коронарное артерии. Инфаркт миокарда провоцируется теми же воздействиями, что и стенокардия, главным образом физическими и эмоциональными нагрузками. Клиническая картина. У многих больных инфаркту предшествует обострение ишемической болезни сердца — учащение и усиление приступов стенокардии, изменение характера боли («прединфарктное состояние»). В типичных случаях в клинической картине ведущим является острый болевой синдром. Как и при стенокардии, боль возникает за грудиной, иррадиирует в левую руку, шею, эпигастральную область или может иррадиировать более широко и менее определенно. В отличие от стенокардии приступ более продолжителен — до нескольких часов. Нитроглицерин не дает стойкого обезболивания или вообще не действует. Болевой приступ сопровождается страхом. В нетипичных случаях боль может быть слабой, стертой, локализуется только в местах иррадиации (особенно в эпигастральной области, иногда с тошнотой и рвотой) или вовсе отсутствует (безболевой инфаркт миокарда). Иногда уже в начале приступа на первый план в клинической картине выходят осложнения (см. ниже). Физическое обследование не позволяет выявить каких-либо надежных диагностических признаков, подтверждающих или отвергающих инфаркт миокарда, но важно для оценки тяжести состояния и своевременного выявления осложнений. Больной обычно беспокоен, бледен. Кожа часто покрыта холодным липким потом. Обнаруживается тахикардия. Артериальное давление может быть значительно повышено во время болевого приступа, но в дальнейшем характерно снижение его, иногда резкое (по сравнению с фоном, свойственным данному больному). У части больных нарастают признаки левожелудочковой недостаточности и появляются другие ранние осложнения. Изредка в ближайшие дни после возникновения инфаркта над предсердечной областью выслушивается шум трения перикарда. Возникновение некроза в миокарде обусловливает небольшое или умеренное повышение температуры в ближайшие 2—5 дней после приступа, лейкоцитоз (до 15000) со сдвигом влево, а позже — увеличение СОЭ. Активность глутаминовой трансаминазы достигает максимума через 48 ч после возникновения инфаркта, активность креатинфосфокиназы — через 24 ч, активность лактатдегидрогеназы (изоэнзим I) —на 4-е сутки. Диагностическое значение имеет не столько отклонение этих показателей, сколько их характерная динамика после приступа, которая может быть прослежена лишь при частых повторных исследованиях. Локализация и распространение инфаркта определяются по тому, в каких преимущественно отведениях обнаруживаются характерные изменения ЭКГ. Наиболее часты инфаркты следующих локализаций: обширный передний, переднеперегородочный, боковой, заднедиафрагмальный (диафрагмальный, нижний, задний). При заднедиафрагмальном инфаркте изменения менее четки. При более обширных инфарктах изменения обнаруживаются в большем числе отведений. У части больных изменения ЭКГ нехарактерны, выявляются лишь через несколько дней или отсутствуют. ЭКГ имеет ограниченное диагностическое значение при повторных инфарктах миокарда, которые лишь в ‘/4 случаев сопровождаются типичными изменениями; у некоторых из этих больных возможно ложное улучшение ЭКГ. При блокаде левой ножки пучка Гиса возникновение инфаркта может не сопровождаться новыми изменениями ЭКГ или приводит к нехарактерным или малозаметным изменениям. Оценить размеры и локализацию инфаркта по ЭКГ при этом трудно. Во всех случаях важнейшее значение имеет сопоставление повторно снятых ЭКГ. Мелкоочаговый инфаркт миокарда часто протекает атипично. Болевой синдром и ферментативные сдвиги выражены меньше, чем при обширном инфаркте. Изменения ЭКГ касаются только конечной части желудочкового комплекса, иногда — только зубца Т. Нередко изменения ЭКГ нехарактерны или не регистрируются. Улучшение и стабилизация ЭКГ происходят быстрее, чем при крупном инфаркте. Хотя клиническое течение в общем более благоприятно, но возможны различные осложнения и смертельный исход. Иногда выделяют коронарную недостаточность с очагами дистрофии. Допускается, что у части больных ишемическое повреждение миокарда, не приводя к некрозу, может сопровождаться кратковременными местными и общими воспалительными реакциями и изменениями конечной части желудочкового комплекса ЭКГ. Клиническое выделение этой формы условно. Осложнения. Аритмии наблюдаются у большинства больных, особенно в первые 3 сут болезни. У многих больных выявляется синусовая тахикардия. Наиболее опасны мерцание желудочков и полная поперечная блокада на уровне внутрижелудочковой проводящей системы с остановкой сердца — главные причины смерти в первые сутки. Мерцанию желудочков часто предшествуют желудочковые тахикардия и экстрасистолия. Последняя вообще наблюдается у 3/4 больных. Особенно прогностически опасны частые ранние и политопные экстрасистолы. Стойкие или преходящие нарушения внутрижелудочковой проводимости, возникшие одновременно с болевым приступом, иногда сами по себе свидетельствуют об инфаркте миокарда, хотя собственно инфарктные изменения на ЭКГ при этом могут быть затушеваны. Блокада передней ветви левой ножки иногда сопутствует переднебоковому и переднеперегородочиому инфаркту, блокада задней ветви — заднедиафрагмальному инфаркту. Повторные инфаркты могут привести к установлению блокады нехарактерной локализации. Блокада правой ножки иногда возникает при вовлечении межжелудочковой перегородки. Бифасцикулярные блокады сравнительно часты при инфарктах разной локализации. степени и дисфункция синусового узла чаще наблюдаются при заднедиафрагмальном инфаркте. Нарушения предсердно-желудочковой проводимости при инфаркте могут быть также следствием интенсивного противоаритмического лечения. Сердечная недостаточность, обычно левожелудочковая, возникает нередко в остром периоде заболевания и проявляется застойными хрипами, сердечной астмой или отеком легких. В дальнейшем могут присоединиться и признаки правожелудочковой недостаточности. Треть больных инфарктом миокарда, осложненным отеком легких, погибают. Кардиогенный шок — особая и наиболее тяжелая форма левожелудочковой недостаточности, приводящая в большинстве случаев к смерти, может возникнуть при обширном инфаркте. Кардиогенный шок обусловлен уменьшением сердечного выброса и проявляется падением артериального давления, тахикардией и признаками ухудшения периферического кровообращения (холодная бледная кожа, цианоз, нарушения сознания, падение диуреза). Это осложнение само по себе может способствовать дальнейшему распространению инфаркта. Эмболии в системе легочной артерии (из правого сердца или из глубоких вен ног) или в большом круге кровообращения (от пристеночных тромбов, возникающих в левом желудочке при трансмуральном инфаркте) — более редкое осложнение. Клиническая картина различна в зависимости от места эмболии. Острая массивная эмболия в крупную ветвь легочной артерии может быть причиной внезапной смерти. Разрыв сердца происходит примерно у 5% лиц, погибающих от инфаркта. Это осложнение возникает обычно при обширном трансмуральном инфаркте в первые дни болезни. В течение нескольких минут после разрыва еще может обнаруживаться тахикардия. В редких случаях, если область разрыва прикрыта перикардом, больные не погибают сразу. Если разрыв происходит в межжелудочковой перегородке, то возникает громкий систолический шум по левому краю грудины, иногда с дрожанием. При этом выраженность клинической картины зависит от величины дефекта, объема шунта и состояния миокарда. Митральная недостаточность возникает сравнительно часто, если инфаркт захватывает одну из сосочковых мышц и происходит пролапс створки вследствие ее ослабления. При этом возникает мягкий систолический шум, чаще с максимумом в конце систолы. Изредка инфаркт сосочковой мышцы приводит к ее разрыву. Это сопровождается появлением грубого систолического шума ближе к верхушке и обычно острой сердечной недостаточностью. Острая аневризма левого желудочка больших размеров может быть распознана клинически по парадоксальной пульсации участка предсердечной области и стабилизации ЭКГ, а также подтверждена рентгенологически. Острая аневризма угрожает усугублением левожелудочковой недостаточности, разрывом сердца, а формирующийся пристеночный тромб может стать источником эмболии. В редких случаях, если аневризма локализуется в межжелудочковой перегородке, то выпячивание ее в полость правого желудочка может привести к выраженной правожелудочковой недостаточности. Постинфарктный синдром — позднее осложнение, возникающее через одну, две или несколько недель после инфаркта как иммунологическая реакция на некроз ткани. Чаще он проявляется признаками перикардита и плеврита. Бывают и стертые формы — артралгии, эозинофилия и другие неспецифические реакции. Диагноз основывается главным образом па наличии болевого синдрома, изменений крови, особенно гиперферментемии, и изменений ЭКГ с характерной динамикой. Выявление одного из указанных трех синдромов заставляет заподозрить инфаркт, а выявления двух синдромов достаточно, чтобы считать диагноз установленным. Дифференциальный диагноз проводят прежде всего с тяжелым приступом стенокардии (без некроза). Предсердные и предсердно-желудочковые аритмии возникают иногда при инфаркте предсердий или могут быть связаны с лечением сердечными гликозидами, гипокалемией, но в общем они менее характерны. Примерно в 10% случаев регистрируется мерцательная аритмия, обычно преходящая. Преходящие или стойкие нарушения предсердно-желудочковой проводимости различной к исходному виду. Изменения крови не выявляются. Осложнения не характерны. При остром перикардите боли обычно усиливаются при глубоком дыхании и уменьшаются в положении сидя с наклоном вперед. Боли могут сопровождаться перикардиальным шумом. На ЭКГ обнаруживается подъем сегмента 5Г в стандартных отведениях, особенно во II, который через 1—2 нед снижается (медленнее, чем при инфаркте), затем могут формироваться отрицательные зубцы Т. При эмболии легочной артерии боли связаны с дыханием. На ЭКГ отмечаются признаки перегрузки правых отделов сердца и иногда изменения, напоминающие заднедиафрагмальный инфаркт. Характерна тахикардия, возможна преходящая блокада правой ножки пучка Гиса и даже мерцание предсердий. В первые 1—2 дня дифференциальный диагноз может быть очень трудным. В дальнейшем характерна более быстрая, чем при инфаркте, динамика ЭКГ с возвращением или приближением к исходному виду через 3— 5 дней. При проведении дифференциального диагноза следует также иметь в виду расслаивающую аневризму аорты, острую пневмонию, пневмоторакс, острый холецистит и др. (см. соответствующие разделы). Все больные инфарктом миокарда или с подозрением на инфаркт госпитализируются по возможности в специализированное отделение, имеющее оснащение для проведения интенсивной терапии. Как правило, лечение начинают на до госпитальном этапе и продолжают в стационаре. Важнейшей начальной целью лечения является устранение боли и поддержание правильного сердечного ритма. Для снятия боли вводят 1 мл 1% раствора морфина или 1—2 мл 1—2% раствора промедола с 0,5 мл 0,1% раствора атропина, 1—2 мл фентанила с 1—2 мл дроперидола, используют ингаляции закиси азота с кислородом и другие анальгетики. Дополнительный обезболивающий эффект может быть достигнут назначением кислорода, что важно также при сердечной недостаточности и шоке. При наличии желудочковых экстрасистол вводят лидокаин по 50—100 мг внутривенно с возможным повторением этой дозы через 3—5 мин. Профилактическое введение лидокаина целесообразно при всяком обширном инфаркте, не осложненном шоком и поперечной блокадой. Если в остром периоде наблюдается брадикардия с желудочковым ритмом менее 55 в 1 мин, то целесообразно внутривенно ввести 0,5—1 мл 0,1% раствора атропина. При отсутствии заметного эффекта эту дозу можно ввести повторно через 5—10 мин. В первые 5—7 дней после инфаркта показан строгий постельный режим. В дальнейшем режим постепенно расширяют, начиная с движений в постели, желательно под руководством инструктора ЛФК. При отсутствии серьезных осложнений и при условии стабилизации ЭКГ обычно с 10—20-го дня разрешают сидеть. При не осложненном мелкоочаговом инфаркте режим расширяют быстрее. Повторные приступы стенокардии и различные осложнения вынуждают расширять режим позже и медленнее. Важно создать для больного удобную и спокойную обстановку. Полезны легкие седативные средства. Ежедневного стула добиваются легкими слабительными и, если это не удается, клизмами. Питание должно быть легким, суточный рацион рассчитывают на 1500— 1800 ккал и 2—3 г поваренной соли. Лечение антикоагулянтами в большинстве случаев признается существенным. С первого дня назначают антикоагулянт прямого действия, обычно гепарин в количестве 15000 ЕД внутривенно и далее по 7500—10000 ЕД внутривенно или внутримышечно каждые 4—6 ч, контролируя время свертывания крови перед каждым введением. Со 2—5-го дня переходят на антикоагулянт непрямого действия (фенилин, неодикумарин), поддерживая протромбиновый индекс на уровне 40—60%. Лечение антикоагулянтами заканчивают, как правило, сразу после выписки из стационара, снижая дозу в течение 10—15 дней. Лечение антикоагулянтами проводят только при возможности быстрого и точного лабораторного контроля. При нечетком контроле лечение может осложниться тяжелыми кровотечениями. При лечении гепарином антидотом является протамина сульфат, который вводят внутривенно нз расчета 1 мл 1% раствора на каждые 1000 ЕД последней введенной дозы гепарина. Если кровотечение возникло при лечении антикоагулянтами непрямого действия, вводят витамин К. При тяжелых геморрагических осложнениях может потребоваться переливание крови. Лечение антикоагулянтами противопоказано при тяжелых поражениях печени, геморрагическом синдроме и заболеваниях со склонностью к кровотечениям (язвенная болезнь, геморрой). Лечение осложнений. Лечение аритмий значительно более эффективно в условиях постоянного кардиомониторного наблюдения. При стойкой и значительной брадикардии, не устраняемой лекарственным лечением, если состояние больного ухудшается, целесообразно временно использовать искусственный водитель ритма. При мерцательной аритмии (обычно обратимой) назначают сердечные гликозиды. Если при этом остается частый желудочковый ритм и нарастает сердечная недостаточность, прибегают к электрической дефибрилляции. При нарушении предсердно-желудочковой проводимости в сочетании с брадикардией обычно эффективно введение атропина. Еще более активен изопротеренол, который надо вводить капельно (алупент — 5—10 мг в 250 мл изотонического раствора натрия хлорида, 8 капель в 1 мин) при непрерывном электрокардиографическом контроле, поскольку он может способствовать развитию эктопических аритмий. При неэффективности лекарственного лечения используют искусственный водитель ритма. Этот метод более показан при тяжелых нарушениях внутрижелудочковой проводимости, в частности при неполной поперечной блокаде типа Мобица, когда искусственный водитель ритма можно использовать профилактически. При частых и множественных желудочковых экстрасистолах капельно вводят лидокаин со скоростью 1—5 мг/мин. Если это лечение неэффективно, можно назначить новокаинамид внутримышечно по 0,5 г через 4—6 ч, дифенин по 0,1—0,2 г каждые 4—8 ч. При возникновении желудочковой тахикардии немедленно вводят внутривенно 100 мг лидокаина и при отсутствии эффекта в течение нескольких минут производят электрическую дефибрилляцию. Возникновение мерцания желудочков требует немедленной электрической дефибрилляции. При внезапной остановке сердца производят наружный массаж сердца, искусственное дыхание, налаживают искусственный водитель ритма. В случае развития отека легких больному придают удобное полусидячее положение, вводят морфин с атропином, дают кислород. Полезны венозные жгуты на 2—3 конечности с временным ослаблением через каждые 20 мин. Вводят диуретики быстрого действия, например лазикс (1—2 мл), сердечные гликозиды (строфантин или коргликон). Учитывая склонность этих больных к желудочковым аритмиям, гликозиды следует вводить в меньшей дозе и медленнее, чем обычно. При кардиогенном шоке необходимо по возможности устранить факторы, дополнительно уменьшающие сердечный выброс, например аритмию. Вводят внутривенно строфантин (капельно), изопротеренол или норадреналин, альфа-адреноблокаторы, глюкагон, большие дозы преднизолона. Важна оксигенотерапия, борьба с метаболическим ацидозом. Лечение следует проводить под контролем центрального венозного давления. В отдельных случаях введение физиологического раствора натрия хлорида позволяет повысить артериальное давление без существенного изменения венозного давления. В целом результаты лечения кардиогенного шока остаются неудовлетворительными. Предложены хирургические методы временного вспомогательного кровообращения. Тромбоэмболические осложнения требуют более активного лечения антикоагулянтами. Разрыв межжелудочковой перегородки и ослабление или надрыв сосочковой мышцы, если эти осложнения резко ухудшают состояние больного, требуют консультации кардиохирурга, поскольку в отдельных случаях могут быть устранены хирургическим путем. Постинфарктный синдром обычно вынуждает временно прекратить лечение антикоагулянтами и назначить противовоспалительное лечение — умеренные дозы преднизолона или бутадион, ацетилсалициловую кислоту.Инфаркт миокарда его осложнения. Инфаркт миокарда