Из таламуса с любовью
Житель Торонто (Канада) стал вторым в мире человеком, у которого в результате повреждения головного мозга развилась синестезия. Обычно эта особенность восприятия является врожденным свойством. После локализованного в таламусе — области мозга, связанной с реакцией на эмоциональные стимулы — инсульта мужчина возненавидел слова, написанные синим цветом, а музыкальная тема из фильмов о Джеймсе Бонде начала вызывать у него экстатические переживания. Этот клинический случай описан в августовском номере журнала Neurology главой отделения неврологических исследований торонтской больницы Святого Михаила Томом Швейцером (Tom Schweizer).
Синестезией называется особенность восприятия, заключающаяся в том, что сигнал, воспринимаемый одними органами чувств, автоматически вызывает ощущения, соответствующие другому органу чувств. Наиболее ярким примером такого восприятия является так называемый «цветной слух», когда определенные звуки воспринимаются как обладающие различными цветами. Также цвета, звуки, вкусовые и тактильные ощущения могут связываться с графическими знаками, геометрическими фигурами и словами. К настоящему времени описано более 50 видов синестезий. Наиболее известные синестетики — Владимир Набоков, Ференц Лист, Василий Кандинский. Синестезия встречается примерно у одного-двух процентов взрослых людей, а недавние исследования американских ученых показали. что она является нормальным качеством всех новорожденных, достигая пика к двухмесячному возрасту и постепенно исчезая после этого.
Пациент, о котором пишет Швейцер, почувствовал странные изменения в своем восприятии через девять месяцев после перенесенного инсульта. 45-летний мужчина обратил внимание на то, что слова, написанные определенным оттенком синего цвета, вызывают у него сильное чувство неприязни, а желтым — наоборот, нравятся больше. При этом синий цвет у него почему-то стал ассоциироваться с малиной, а малина, соответственно — с синим цветом. Кроме того, высокотональные звуки духовых инструментов — в особенности соответствующая музыкальная тема из фильмов о Джеймсе Бонде — начали вызывать у него чувство экстаза, чего прежде никогда не бывало, и светло-голубые вспышки на поле периферийного зрения. Эти ощущения пропадали при вступлении эуфониума — теноровой тубы, духового инструмента более низкого, баритонового регистра.
Мужчина испугался необычных сигналов, посылаемых его мозгом, и обратился к специалистам в больнице Святого Михаила. Доктор Швейцер изучил активность головного мозга пациента с помощью магнитно-резонансной томографии во время прослушивания той самой музыкальной темы из фильмов о Джеймсе Бонде и соло эуфониума. В контрольную группу входили шесть мужчин того же возраста и образовательного уровня.
Оказалось, что мозг «торонтского пациента» реагирует именно на эту музыку совершенно иначе, чем на другие мелодии или звуковые стимулы, а также иначе, чем мозг участников контрольной группы. МРТ показало необычную активность таламуса, гиппокампа и слуховой коры в обоих полушариях, которые оставались неактивными в других случаях.
Пациенту и другим участникам исследования также в течение десяти секунд демонстрировали блоки слов, написанных черным, желтым и синим шрифтом. Головной мозг членов контрольной группы никак не отреагировал на изменение цвета букв, в отличие от мозга синестетика, который в ответ на синий, наиболее неприятный для него, цвет продемонстрировал резкое повышение активности в регионах, ответственных за обработку сенсорной информации и эмоциональных стимулов. Желтый, менее отвратительный для пациента цвет, вызвал, соответственно, менее яркую реакцию мозга.
По мнению Швейцера, наблюдаемый феномен связан с тем, что инсульт у «торонтского пациента» произошел именно в таламусе — области головного мозга, отвечающей за перераспределение информации от органов чувств к коре. Предыдущий описанный случай приобретенной синестезии также был связан с повреждением таламуса. Кроме того, полагает специалист, столь специфические и направленные реакции мозга на определенные стимулы говорят о том, что перекрестные связи возникли в процессе восстановления тканей после инсульта.
Изолированный инфаркт таламуса: клинические синдромы, диагностика, лечение и исход
Резюме. Проведено комплексное клинико-нейровизуализационное обследование 22 больных с изолированным таламическим инфарктом. Результаты исследования показали, что инфаркт чаще локализовался в классических таламических территориях — парамедианной (27,3%), нижнелатеральной (40,9%), реже в пограничных сосудистых зонах — латеральной (22,7%) и центральной (9,1%). Описаны клинические синдромы и специфические симптомы при инфаркте разных таламических территорий. Установлена высокая терапевтическая эффективность применения препарата Цераксон® (цитиколин) в сочетании с Актовегином в лечении пациентов с острым изолированным таламическим инфарктом
Введение
Для более глубокого понимания и лучшего описания клинических синдромов, которые могут возникать при ишемическом повреждении определенной анатомической и артериальной территории таламуса, важное значение имеют представления о его анатомии, физиологии, особенностях васкуляризации.
Как известно, таламус относится к промежуточному мозгу и представляет собой объемистое, парное скопление серого вещества по бокам ІІІ желудочка. Он состоит из клеточных элементов, сгруппированных во многочисленные ядра, среди которых выделяют 4 группы: переднее, латеральное, внутреннее и заднее ядра. В вентральном отделе латерального ядра выделяют как особое образование вентролатеральное ядро, а в наружном отделе внутреннего, или медиального ядра — срединное и парафасцикулярное ядра (Привес М.Г. и соавт. 2002).
По функциональному значению таламические ядра подразделяют на специфические, неспецифические и ассоциативные. В специфические чувствительные ядра (вентролатеральное, ядра задней группы в подушке, медиальное коленчатое ядро, латеральное коленчатое ядро и др.) поступает информация от афферентных систем (чувствительная, зрительная, слуховая и др.), здесь в клетках импульсы переключаются на волокна третьего нейрона и направляются к коре больших полушарий головного мозга. В неспецифических ядрах (парафасцикулярное и ядра ростральных отделов ретикулярной формации мозгового ствола) заканчиваются аксоны спинномозгово-сетчатых путей, а также коллатерали спинномозгово-таламических путей, которые проводят болевые и температурные раздражения (большей частью нелокализованные). В сетчатом образовании импульсы разряжаются и поступают в таламус (центр протопатической чувствительности), а затем — в кору больших полушарий, оказывая на нее диффузное активирующее влияние. Об активирующем влиянии подкорки на кору больших полушарий многократно говорил И.П. Павлов. Ассоциативные ядра (латеральное заднее, медиальное дорсальное ядро и ядра подушки таламуса) не получают импульсов от определенных восходящих сенсорных систем, а образуют многочисленные связи с другими ядрами таламуса и корой больших полушарий головного мозга (Ґанонг В.Ф. 2002).
В соответствии с анатомической топографией головного мозга таламус относится к дистальной интракраниальной сосудистой территории мозгового ствола (Tatu L. et al. 1996) и является связующим звеном между сегментарным аппаратом спинного мозга, стволом головного мозга и надсегментарными корковыми образованиями.
Кровоснабжение таламуса
Артериальное кровоснабжение таламуса осуществляется 5 артериями, из которых 3 основные (таламо-субталамические, или таламоперфорирующие, таламогеникулярные и задние ворсинчатые) являются ветвями задней мозговой артерии (ЗМА). Другие 2 артерии относятся к сосудистой территории каротидной системы: передняя ворсинчатая артерия отходит непосредственно от внутренней сонной артерии (ВСА) проксимальнее средней мозговой артерии (СМА); полярные, или тубероталамические артерии, обычно отходят от задней соединительной артерии, которая также является ветвью ВСА (рис. 1).
Рис. 1
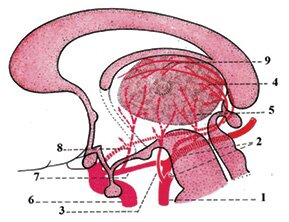
Схема кровоснабжения таламуса (по Lazorthes G. (Ed.), 1961), модифицированная
Заднециркулярный бассейн: 1 — основная артерия; 2 — ЗМА; 3 — таламо-субталамические (парамедианные, таламоперфорирующие) артерии; 4 — таламогеникулярные артерии; 5 — задние ворсинчатые артерии.
Каротидный бассейн: 6 — внутренняя сонная артерия; 7 — задняя соединительная артерия; 8 — полярные (тубероталамические) артерии; 9 — передние ворсинчатые артерии
Разные отделы таламуса соответственно группам артерий, которые их васкуляризируют, подразделяют на четыре классические таламические территории. каждая из которых имеет отношение к определенной группе ядер (Tatu L. et al. 1998). Передняя территория кровоснабжается полярными артериями, также известными как тубероталамические (Foix C. Hillemand P. 1925), хотя в ⅓ случаев эти артерии отсутствуют и васкуляризация осуществляется из парамедианных артерий (Percheron G. 1973). Парамедианная территория получает кровь из парамедианных артерий, известных также как таламо-субталамические, или таламоперфорирующие (Foix C. Hillemand P. 1925); в 30% случаев парамедианные ветви, направляющиеся к обоим таламусам, берут начало общей ножкой (артерия Перчерона) только от одной ЗМА (Percheron G. 1973). Нижнелатеральная территория васкуляризируется таламогеникулярными артериями (5–6 небольших ветвей) (Foix C. Hillemand P. 1925); задняя территория таламуса кровоснабжается задними ворсинчатыми артериями (Neau J.P. Bogousslavsky J. 1996).
Разные отделы таламуса соответственно группам артерий, которые их васкуляризируют, подразделяют на четыре классические таламические территории. каждая из которых имеет отношение к определенной группе ядер (Tatu L. et al. 1998). Передняя территория кровоснабжается полярными артериями, также известными как тубероталамические (Foix C. Hillemand P. 1925), хотя в ⅓ случаев эти артерии отсутствуют и васкуляризация осуществляется из парамедианных артерий (Percheron G. 1973). Парамедианная территория получает кровь из парамедианных артерий, известных также как таламо-субталамические, или таламоперфорирующие (Foix C. Hillemand P. 1925); в 30% случаев парамедианные ветви, направляющиеся к обоим таламусам, берут начало общей ножкой (артерия Перчерона) только от одной ЗМА (Percheron G. 1973). Нижнелатеральная территория васкуляризируется таламогеникулярными артериями (5–6 небольших ветвей) (Foix C. Hillemand P. 1925); задняя территория таламуса кровоснабжается задними ворсинчатыми артериями (Neau J.P. Bogousslavsky J. 1996).
Патология таламуса
Закупорка артерий, васкуляризирующих таламус, вызывает развитие острых таламических инфарктов. Частота их составляет примерно 23–25% случаев от всех инсультов в вертебробазиллярном бассейне, обычно в сочетании с поражением иных структур (Bogousslavsky J. 1995; Виничук С.М. и соавт. 2005). В другом, недавно опубликованном исследовании, сообщается, что частота таламических инфарктов составляет 11,0% случаев среди всех заднециркулярных инфарктов (López-Serna R. et al. 2009).
С учетом анатомической, сосудистой территории и клиники инфаркты таламуса разделяют на четыре основные группы: передние, парамедианные, нижнелатеральные и задние (Percheron G. 1973; Schmahmann J.D. 2003). Клинические описания инфарктов разных территорий таламуса встречаются нечасто. Отдельные таламические инфаркты описаны при проведении проспективных и ретроспективных исследований, посвященных характеристике симптомов (Bogousslavsky J. et al. 1988; Annoni J.M. et al. 2003; Віничук С.М. Прокопів М.М. 2006), синдромов (Déjerine J. Roussy G. 1906; Foix C. Hillemand P. 1925; Schmahmann J.D. 2003), таламических территорий (Percheron G. 1976; Caplan L.R. et al. 1988; Neau J.P. Bogousslavsky J. 1996; Ворлоу Ч.П. и соавт. 1998; Carrera E. et al. 2004), клинико-радиологических корреляций (Lehéricy S. et al. 2001; Küker W. et al. 2002). Однако до настоящего времени в отечественной литературе остается недостаточно освещенным и малоизученным спектр клинических синдромов, специфических симптомов, которые возникают при инфарктах разных анатомических и сосудистых таламических территорий. Между тем, описание клинических проявлений в период их максимальной выраженности при изолированном инфаркте таламуса является особенно важным для выбора стратегии лечения, прогнозирования исхода. Актуальны также исследования для выявления особенностей и закономерностей восстановления неврологических функций у больных с разными клиническими сосудистыми синдромами при ишемическом повреждении разных таламических территорий.
Цель нашего исследования — описать клинические синдромы и специфические симптомы у пациентов с острыми изолированными инфарктами разных таламических сосудистых территорий, определить особенности восстановления неврологических функций у них и оценить прогноз.
Объект и методы исследования
Проведено комплексное клинико-неврологическое обследование 22 пациентов (12 мужчин и 10 женщин) в возрасте 50–89 лет (средний возраст — 61,9±10,2 года) с подтвержденным с помощью методики магнитно-резонансной томографии (МРТ) диагнозом острого изолированного инфаркта таламуса. Пациенты поступали в первые 24 ч с момента развития заболевания. В исследуемую группу включали лишь больных с наличием ишемического инсульта в одной из четырех классических сосудистых территорий или в пограничных артериальных зонах. Не включали пациентов с геморрагическими повреждениями, при выявлении на МРТ давних очагов ранее перенесенных инсультов, а также больных с острым сочетанным таламическим инсультом (повреждение таламуса и разных отделов мозгового ствола, чаще — среднего мозга, моста, мозжечка; таламуса и затылочных долей или задних отделов височных долей головного мозга). Все пациенты обследованы в соответствии со стандартным протоколом, принятым в клинике: неврологический мониторинг, оценка поведения пациента, выявление нарушений речи, памяти (в том числе амнезии), идеаторного и конструктивного праксиса, которые ухудшают или ограничивают когнитивные функции пациента (Fisher C.M. 1991); компьютерная томография (КТ)/МРТ головного мозга; допплеровское ультразвуковое исследование магистральных артерий головы в экстракраниальном отделе и интракраниальных артерий с помощью транскраниальной допплерографии и триплексного допплеровского сканирования; 12-канальная электрокардиограмма (ЭКГ); стандартные анализы крови. Топографический диагноз таламического инфаркта идентифицировали в первые 5 сут с помощью МРТ головного мозга на аппарате «Magnetom Symphony» («Siemens», США) и на аппарате «Flexart» («Toshiba», Япония) с напряженностью магнитного поля 1,5 Тл. Применяли стандартный протокол сканирования, включающий получение TIRM (Turbo Inversion Recovery Magnifucle) в Т2 -взвешеных изображениях (Т2 -ВИ) в аксиальной плоскости, Т1 -взвешенных изображений (Т1 -ВИ) в сагиттальной и коронарных плоскостях. Дополнительно диффузионно-взвешенные изображения (ДВИ) в сагиттальной плоскости выполнены при обследовании 12 пациентов. Клиническое обследование предполагало использование шкального метода оценки неврологического дефицита: шкалы тяжести инсульта Национального института здоровья — NIHSS (National Institute of Health Stroke Scale), модифицированной шкалы Рэнкина (мШР), индекса Бартел (ИБ). При определении клинических синдромов, вызванных изолированными инсультами разных сосудистых таламических территорий, учитывали данные нейровизуализации и неврологические симптомы в период их максимальной выраженности.
При лечении 15 больных применяли сочетание препаратов Цераксон ® (цитиколин) («Nycomed», Австрия) и Актовегин («Nycomed», Австрия). Остальные 7 пациентов получали традиционную терапию. Обоснованность применения препарата Цераксон ® при остром ишемическом инсульте определяется целым рядом потенциально полезных свойств коррекции ишемии мозговой ткани: он тормозит активность фермента фосфолипазы А2 и предупреждает повреждение клеточных мембран, восстанавливает их структурную целостность; стимулирует механизмы нейропластичности за счет активации синтеза главного липидного компонента биологических мембран фосфатидилхолина, ингибирует продукцию свободных радикалов, активизирует систему внутриклеточной антиоксидантной защиты; уменьшает избыточное высвобождение из аксональных терминалей эксайтотоксинов, ингибирует апоптоз нейронов (Secades J.J. Lorenzo J.L. 2006). Установлена целесообразность назначения препарата Цераксон ® при полушарном ишемическом инсульте с преимущественным поражением подкорковых или стволовых структур головного мозга (Віничук С.М. та співавт. 2008; Davalos A. Secades J. 2011). Представляет интерес исследование терапевтического эффекта сочетания препаратов Цераксон ® и Актовегин при таламическом инфаркте. Тромболизис в лечении не применяли, но все больные получали ацетилсалициловую кислоту.
Особенности и закономерности восстановления неврологических функций у пациентов оценивали по изменению показателей клинических шкал инсульта, динамике нейропсихологического дефицита. Клинически значимой исходной точкой оценки состояния пациента после лечения были его жалобы и неврологические симптомы. Первичной конечной точкой эффективности лечения был показатель полного восстановления неврологических функций (выздоровления) по данным глобального теста: NIHSS ≤1 балла, мШР ≤1 балла, ИБ ≥95 баллов. Критерием благоприятного исхода лечения считали достижение на фоне терапии по мШР 0–2 балла, неблагоприятного исхода — 3–5 баллов.
Пациентов оценивали также по показателям шкал, определяющих степень инвалидизации, на 90-й день: средняя степень — мШР ≤2 балла, ИБ ≥80 баллов; тяжелая степень — мШР >2 баллов, ИБ
Результаты и их обсуждение
За период с 2001 по 2011 г. в отделении цереброваскулярной патологии Александровской клинической больницы г. Киева нами обследовано 204 больных с острым ишемическим инсультом в заднециркулярном бассейне с МРТ-доказанными инсультами в разных отделах мозгового ствола, таламуса, мозжечка, затылочных долей или задних отделах височных долей головного мозга. Из этой группы мы отобрали для анализа 22 (10,8%) пациента с острым изолированным инфарктом таламуса и локализацией очага в одной из четырех таламических территорий. У 9 (40,9%) больных очаг локализовался в правом таламусе, у 12 (54,5%) — в левом и в 1 (4,6%) случае имело место двустороннее поражение таламуса. У 15 (68,2%) пациентов инфарктные очаги выявляли в классических сосудистых таламических территориях (парамедианной и нижнелатеральной), у 7 (31,8%) — в пограничных сосудистых зонах (центральной и латеральной). Соответственно локализации таламического инфаркта у обследованных больных выделено четыре сосудистых и анатомических территории с характерными клиническими проявлениями (рис. 2).
Рис. 2
Рис. 3
МРТ головного мозга пациентки Ф. 66 лет, Т2 -взвешенное изображение, аксиальная проекция, проведена на 3-и сутки от начала заболевания. В области таламусов с обеих сторон (показано стрелками) визуализируются ишемические очаги с неровными контурами, размером справа 25×16×23 мм, слева – 17×15×23 мм, соответствующие двустороннему таламическому инфаркту
Основными причинами развития парамедианных таламических инфарктов были артериальная гипертензия (у 3 пациентов), ишемическая болезнь сердца с мерцательной аритмией (у 2), сахарный диабет (у 1).
Для иллюстрации приводим МРТ-исследование головного мозга больного М. 62 года, с типичной клинической картиной таламического инфаркта центральной сосудистой территории, развившегося на фоне дисциркуляторной гипертонической и атеросклеротической энцефалопатии ІІІ стадии (рис. 4).
Рис. 4
МРТ головного мозга больного М. 62 лет, проведенная через 60 ч от начала инсульта: а — в Т2 -взвешенном аксиальном срезе визуализируется гиперинтенсивный очаг (показан стрелкой), что свидетельствует об инфаркте центральной территории левого таламуса; б — в ДВ-изображении (аксиальная проекция) определяется гиперинтенсивный яркий очаг в таламусе слева (показан стрелкой), что подтверждает диагноз таламического инфаркта; в — на карте диффузии выявлен гипоинтенсивный темный очаг таламического инфаркта слева (показан стрелкой) со сниженным коэффициентом диффузии
Рис. 5
МРТ головного мозга пациентки Я. 70 лет, проведенное на 6-е сутки от начала заболевания: а — в Т2 TIRM-взвешенном изображении (аксиальная проекция) в латеральном отделе правого таламуса визуализируется ишемический очаг (показан стрелкой) неправильной формы с гиперинтенсивным МР-сигналом размером 9×5×9 мм; б — в Т1 -взвешенном изображении определяется изоинтенсивный очаг (показан стрелкой)
Основными факторами риска развития таламического инфаркта латеральной сосудистой территории была артериальная гипертензия (у 3 больных), а также сахарный диабет и гиперхолестеринемия (у 2 пациентов).
У 2 больных с обширным инфарктом нижнелатеральной территории выявляли таламический синдром. который впервые подробно описали французский невролог Жюль Жозеф Дежерин и его ученик Гюстав Русси в 1906 г. (Déjerine J. Roussy G. 1906). Для синдрома Дежерина — Русси характерны такие клинические проявления: умеренный преходящий гемипарез на противоположной очагу поражения стороне без признаков спастичности мышц, выраженная гемигипестезия, гемиатаксия, боль и парестезия после инсульта в дистальных отделах конечностей, часто распространяющиеся на всю половину тела, — гемиалгия. Для иллюстрации приводим МРТ головного мозга в Т2 — и Т1 -взвешенных изображениях и ДВ-МРТ больного с инфарктом нижнеталамической территории справа, развившимся на фоне артериальной гипертензии и сахарного диабета (рис. 6).
Рис. 6
МРТ головного мозга больного И. 57 лет, проведенная на 4-е сутки от начала инсульта: а — в Т2 TIRM-взвешенном изображении (аксиальная проекция) в нижнелатеральном отделе правого таламуса определяется очаг (показан стрелкой) размером 11×7×5 мм с гиперинтенсивным МР-сигналом; б — в ДВ-изображении (аксиальная проекция) визуализируется гиперинтенсивный яркий очаг (показан стрелкой) в правом таламусе, что подтверждает диагноз инфаркта нижнелатеральной таламической территории
Наиболее частыми причинами развития инфаркта таламуса нижнелатеральной территории были микроангиопатии у больных с артериальной гипертензией и гиперхолестеринемией (5 пациентов), сахарным диабетом (2 пациента), кардиоэмболией (2 пациента).
Мы не диагностировали ни одного случая инфаркта передней или задней таламической территорий, которые кровоснабжаются соответственно полярными (тубероталамическими) и задними ворсинчатыми артериями.
Результаты проведенного нами клинического исследования показывают, что изолированные таламические инфаркты не являются редкостью, поскольку определялись в 10,8% случаев из 204 обследованных больных с острым ишемическим инсультом в бассейне задней мозговой циркуляции. В свете современных представлений об анатомических и артериальных территориях головного мозга таламус относят к дистальной интракраниальной территории заднециркулярного бассейна (Tatu L. et al. 1996). Но васкуляризация его, как и ножек головного мозга, осуществляется артериями двух бассейнов — вертебробазилярного и каротидного. Поэтому в клинической практике диагноз таламического инфаркта неприемлемо подменять всеобъемлющим термином «ишемический инсульт в вертебробазилярном бассейне» или «ишемический инсульт в бассейне средней мозговой артерии». В эпоху применения нейровизуализации некорректно также отождествлять таламический инфаркт с нередко используемой формулировкой «инфаркт в вертебробазилярном бассейне», ибо термин «инфаркт мозга», предложенный в 1879 г. Рудольфом Вирховым, свидетельствует о необратимых морфологических изменениях мозговой ткани инфарктзависимой артерии, но не сосудистого бассейна в целом. Кроме того, используемые дефиниции не соответствуют рубрикам І63–І64 Международной статистической классификации болезней 10-го п ересмотра. Клинико-нейровизуализационное обследование пациента позволяет сейчас точно верифицировать топографию таламического, мозжечкового или стволового инфаркта и соответствующую ему артериальную территорию, вовлекаемую в патологический процесс при инсульте в вертебробазилярном или каротидном бассейнах кровоснабжения.
Изолированные таламические инфаркты являются идеальной моделью для изучения особенностей нарушений функций таламуса при поражении классических таламических территорий или пограничных сосудистых зон, а также для оценки функциональных последствий инсульта.
Среди 22 пациентов с острым таламическим инфарктом, классифицируемым с использованием системы TOAST (Trial of Org 10172 in Acute Stroke Treatment), которая основана на учете факторов риска, клинических особенностей и данных нейровизуализации, у 7 (31,8%) больных диагностировали поражение артерий малого калибра, или лакунарные инфаркты (диаметр очага ≤1,5 см) на фоне типичных факторов риска (артериальная гипертензия, сахарный диабет) в отсутствие стеноза крупных артерий и потенциального источника кардиоэмболии. Лакунарный таламический инфаркт чаще определяли в латеральной (у 5 пациентов) и нижнелатеральной (у 2) сосудистых территориях таламуса.
Нелакунарный (тотальный) инфаркт диаметром > 1,5 см выявляли у 15 (68,2%) больных. Возникал он вследствие окклюзии таламических артерий, в основном ветвей ЗМА. Ишемическое поражение таламуса у 4 пациентов было обусловлено кардиоэмболией (гипокинезия после инфаркта миокарда — в 2 случаях, мерцательная аритмия — в 1, патология клапанов сердца — в 1); у 11 больных диагностировали атеротромботический интракраниальный подтип ишемического инсульта. Нелакунарные таламические инфаркты в основном локализовались в классических таламических территориях (у 11 больных), реже — в пограничных сосудистых зонах (у 4).
Односторонний инфаркт парамедианной территории клинически проявляется заднемедиальным таламическим синдромом, включающим расстройство сознания, памяти, парез взора вверх и выраженные нейропсихологические нарушения. Считают, что угнетение сознания является следствием поражения задних отделов дорсомедиального и интраламинарных ядер, а также нарушения взаимосвязи их с восходящей ретикулярной формацией и корой (Bassetti C. et al. 1996). Механизм возникновения галлюциноза до конца не установлен. Поскольку таламус является важным звеном подкорково-коркового функционального кольца с обратной связью, инфаркт парамедианной таламической территории может генерировать поступление чрезмерной импульсации к коре височной доли, которая принимает участие в восприятии и обработке визуальной информации, что обусловливает развитие галлюциноза (Middleton F.A. Strick P.L. 1996). Возникновение селективного нарушения взора вверх подтверждает, что парамедианный таламический инфаркт оказывает патологическое влияние на супрануклеарные тракты, ответственные за вертикальный контроль взора, без поражения рострального отдела среднего мозга (Clark J.M. Albers G.W. 1995).
Эти нарушения были более выраженными при билатеральном инфаркте парамедианной территории. Возникал парамедиальный таламический инфаркт-синдром с акинетическим мутизмом, амнестическими расстройствами, которые чаще сопровождают поражения дорсомедиального ядра таламуса. В нашем наблюдении у пациентки Ф. с двусторонним таламическим инфарктом через 1 год после инсульта сформировалась таламическая деменция, которая возникает при повреждении медиального дорсального ядра таламуса вместе с мамиллярными тельцами (Victor M. et al. 1971). Билатеральный инфаркт парамедианной территории возникает вследствие атероматозной или эмболической окклюзии общей ножки таламо-субталамической артерии, известной как артерия Перчерона.
Изолированный таламический инфаркт центральной территории часто проявляется гемигипестезией, ассоциированной с атаксией, за счет поражения среднего отдела вентрозаднелатерального ядра таламуса. При этом выявляли разнообразные нейропсихологические нарушения. В 1 случае определяли асимметрию лица при боли, улыбке, смехе, то есть возникал эмоциональный центральный парез мимических мышц, однако произвольные движения мышц лица (нахмуривание бровей, закрывание глаз, оскал зубов) сохранялись. Этот симптом был описан австрийским врачом Карлом Нотнагелем (Nothnagel C.W. 1889); его возникновение связывают с повреждением «психорефлекторного» пути для мимических движений, чувствительная часть которого представлена таламусом, а двигательная — экстрапирамидной системой (Кроль М.Б. Федорова Е.А. 1966). Срединным ядрам таламуса приписывают роль мимического центра (Gerebzoff M.A. 1940). Инфаркт в центральной или парамедианной территории прерывает эту дугу, и развивается эмоциональный парез мимических мышц. Мимические нарушения при этом бывают односторонними. Нарушения взора вверх мы не выявляли, хотя некоторые авторы считают этот симптом ожидаемым (Carrera E. et al. 2004).
Типичным проявлением лакунарного инфаркта латеральных отделов таламуса были нарушения чувствительности, то есть развитие чисто сенсорного синдрома (ЧСС), обусловленного поражением вентролатерального ядра. При этом синдром гемигипестезии может быть полным или частичным с расстройством чувствительности в необычных сочетаниях, таких как хейро-оральный и хейро-педо-оральный синдромы. Описан также изолированный оральный синдром. Это можно объяснить своеобразной соматотопической организацией таламуса. Сенсорные проекции лица (особенно губ, языка), расположены в вентральном заднемедиальном ядре и имеют особенно большое представительство, что повышает вероятность поражения его при остром инфаркте. Проекционные поля от туловища и проксимальных отделов конечностей относительно малы, соматотопически представлены вентральным заднелатеральным ядром, расположены более дорсально и поэтому могут избирательно оставаться интактными (Kim J.S. Lee M.C. 1994). Умеренно выраженные когнитивные нарушения проявлялись нарушением памяти.
Изолированные инфаркты нижнелатеральной таламической территории проявлялись гетеролатеральной гемигипестезией (в отношении поверхностных видов чувствительности) и контрлатеральной гемиатаксией. Чувствительные расстройства часто сочетались с нарушением моторики за счет поражения прилегающей к инфарктному очагу ткани внутренней капсулы, что определяло развитие сенсомоторного синдрома.
Классический таламический синдром Дежерина — Русси характеризуется умеренным контралатеральным гемипарезом, гемигипестезией, гемиатаксией, гемиалгией и парестезией, а также дизестезией (извращением восприятия чувствительных раздражений). При обширных поражениях нижнелатеральной территории таламуса в противоположной очагу руке может возникать динамическая контрактура пальцев кисти — классическая «таламическая рука» («main thalamique»): основные фаланги умеренно согнуты, средние и концевые — полностью разогнуты («рука акушера»). Пальцы кисти находятся в непрерывном движении — гиперкинез хореоатетозного типа (Кроль М.Б. Федорова Е.А. 1966).
Описанный клинический синдром возникает вследствие поражения заднего вентрального и вентролатерального таламических ядер с распространением инфарктного очага на внутреннюю капсулу. Боль, дизестезия при таламическом синдроме Дежерина — Русси дают основания считать, что на уровне специфических ядер таламуса происходит не просто переключение импульсов для передачи в кору больших полушарий, а осуществляется первичная обработка информации с формированием примитивных ощущений. При инфаркте нижнелатеральной таламической территории возникают очаги возбуждения, что при участии ассоциативных ядер обусловливает появление нелокализованных, диффузных жгучих (протопатических) болей, парестезии.
У всех больных с инфарктом нижнелатеральной таламической территории выявляли разной степени выраженности нарушения когнитивного статуса. Они были более значительными у пациентов с синдромом Дежерина — Русси.
Неврологические нарушения при инфаркте нижнелатеральной и латеральной таламической территории могут имитировать ишемический инсульт с капсулярной локализацией очага поражения (бассейн васкуляризации СМА). Патогномоничной для поражения таламуса является таламическая боль со всеми признаками гиперпатии, эмоциональными и вегетативными проявлениями. В клинической практике картину таламического синдрома составляют гемианестезия, гемианопсия и гемиатаксия, хотя они и не патогномоничны. Кроме чувствительных, важно учитывать наличие других расстройств: психосенсорные (галлюциноз), хореоатетоидные гиперкинезы и дистонические проявления со склонностью к контрактурам динамического типа, эмоциональный центральный парез мимических мышц. В диагностике изолированных инфарктов таламуса значительную роль имеют методы нейровизуализации.
Анализ фонового неврологического дефицита по шкале NIHSS показал, что у пациентов с лакунарными инфарктами он соответствовал легкому инсульту (2–8 балла) — 4,14±0,24 балла, с нелакунарными — инсульту средней степени тяжести (9–12 баллов) — 10,7±0,24. Лишь у 1 пациентки с двусторонним таламическим инфарктом неврологические расстройства были очень тяжелыми (17 баллов). Распределение больных с учетом показателя инвалидизации по мШР таково: у 10 пациентов выявлено легкое нарушение жизнедеятельности, сохранение способности ходить без посторонней помощи (3 балла); у 8 — умеренно тяжелые нарушения жизнедеятельности, пациенты неспособны были ходить и ухаживать за собой без посторонней помощи (4 балла); у 4 больных степень инвалидизации была тяжелой (5 баллов). Более выраженной оказалась инвалидизация у пациентов с парамедианной и центральной локализацией таламического инфаркта.
Комплексная терапия острых изолированных таламических инфарктов у 15 больных предполагала применение гипотензивных средств (гидрохлоротиазид + каптоприл, периндоприл), ацетилсалициловой кислоты, нейропротектора Цераксон ® (2000 мг/сут) и Актовегина (800–1000 мг/сут) в течение 10 дней. Традиционная терапия (7 больных), помимо гипотензивных средств и ацетилсалициловой кислоты, включала применение магния сульфата по 2,5–5 г/сут внутривенно капельно, а также инфузии раствора сорбитола, натрия лактата, натрия, калия, кальция и магния хлорида в течение 10 сут.
Исход лакунарных и нелакунарных таламических инфарктов был неодинаковым. У 4 больных с лакунарным инфарктом полный регресс неврологической симптоматики (неврологическое выздоровление) наступил на 7-е сутки, еще у 3 — на 14-е сутки лечения (в среднем на 10,3±0,98-е сутки). Темпы восстановления неврологических функций у пациентов с нелакунарными инсультами зависели от топографической локализации и объема таламических инфарктов, уровня сознания при поступлении, фоновой тяжести инсульта, применяемой терапии и сопутствующих заболеваний. Лучший краткосрочный прогноз выявили у пациентов с изолированным инфарктом нижнелатеральной и латеральной таламической территории на фоне терапии с использованием Цераксона с Актовегином, худший — у больных с инфарктами парамедианной и центральной сосудистой территории, особенно в случаях со стойкими когнитивными и психическими проявлениями.
В группе, получавшей препараты Цераксон ® и Актовегин, прогноз при изолированных нелакунарных таламических инфарктах на 21-е сутки лечения был благоприятным (мШР ≤2 баллов) у 12 (80,0%) пациентов, неблагоприятным (мШР=3–4 балла) — у 3 (20,0%). Полное восстановление неврологических функций (мШР ≤2 баллов, ИБ ≥95 баллов) наступило у 5 (33,3%) больных (вариант малого ишемического инсульта); умеренное выздоровление (мШР ≤2 балла, ИБ 80–94 балла) — у 7 (46,7%); умеренно тяжелая степень инвалидизации (мШР >2 баллов, ИБ
Весьма хорошие результаты достигнуты на 90-е сутки: благоприятный исход — у 14 (93,3%) больных, из них полное неврологическое выздоровление — у 8 (53,3%), умеренное — у 6 (40,0%), лишь у 1 пациентки с двусторонним таламическим инфарктом сохранялась умеренно тяжелая инвалидизация (мШР=4 балла). Случаев ранней смерти (в первые 2 нед) и в отсроченный период (после 2 нед) не отмечалось. Однако 1 пациентка с билатеральным инфарктом парамедианных территорий с таламической деменцией умерла в отдаленный период после инсульта (через 2 года).
Выводы
Изолированные таламические инфаркты представляют собой гетерогенную группу и соответственно классическим сосудистым и анатомическим территориям распределяются на передние, парамедианные, нижнелатеральные и задние.
Результаты проведенного нами исследования свидетельствуют, что таламический инфаркт чаще локализуется в классических территориях — парамедианной (27,3%) и нижнелатеральной (40,9%), реже — в пограничных сосудистых зонах: латеральной (22,7%) и центральной (9,1%).
Клинические синдромы при инфарктах разных таламических территорий отличаются:
- унилатеральный инфаркт парамедианной территории проявляется заднемедиальным синдромом (угнетение сознания, парез взора вверх, когнитивные и психосенсорные расстройства (галлюциноз)); более тяжелые нарушения наблюдаются при билатеральном инфаркте (парамедиальный таламический инфаркт-синдром);
- при инфаркте центральной территории чаще выявляют потерю сознания, контралатеральные гемигипестезию, гемиатаксию, гомонимную гемианопсию, эмоциональный центральный парез мимических мышц и расстройства когнитивного статуса;
- типичным проявлением лакунарного инфаркта латеральной территории считается развитие чисто сенсорного синдрома (полного или в необычных сочетаниях) или сенсомоторного синдрома, умеренных когнитивных расстройств;
- изолированный инфаркт нижнелатеральной таламической территории проявляется синдромом гетеролатеральной гемигипестезии, гемиатаксии, сочетающихся с нарушением моторики, наличием боли, вегетативных расстройств с признаками гиперпатии, когнитивным дефицитом; специфическим признаком является развитие таламического синдрома Дежерина — Русси.
Установлена высокая терапевтическая эффективность препаратов Цераксон ® и Актовегин в лечении изолированного лакунарного и нелакунарного таламического инфаркта.
Восстановление неврологических функций на фоне лечения оказывается более значительным у пациентов с инфарктом латеральной и нижнелатеральной таламической территорий по сравнению с инфарктом парамедианной и центральной сосудистых территорий. Исход изолированного таламического инфаркта определяется не только локализацией инсультного очага, объемом терапии, но и уровнем индекса коморбидности Чарлсона.
Список использованной литературы
Віничук С.М. Прокопів М.М. (2006) Гострий ішемічний інсульт. Наукова думка, Київ, 280 с.
Віничук С.М. Пустова О.А. Мохнач В.О. та ін. (2008) Нейропротекція в сучасній стратегії лікування гострого ішемічного інсульту: доцільність застосування комплексного підходу. Укр. мед. часопис. 4(66): 3–10.
Виничук С.М. Ялынская Т.А. Виничук И.С. (2005) Инфаркты в вертебрально-базилярном бассейне: клиника и диагностика. Междунар. неврол. журн. 3: 13–21.
Ворлоу Ч.П. Деннис М.С. ван Гейн Ж. и др. (1998) Инсульт: практическое руководство для ведения больных. Политехника, Санкт-Петербург, 629 с.
Ґанонг В.Ф. (2002) Фізіологія людини: підручник. БаК, Львів, 784 с.
Кроль М.Б. Федорова Е.А. (1966) Основные невропатологические синдромы. Медицина, Москва, 311 с.
Привес М.Г. Лысенков Н.К. Бушкович В.И. (2002) Анатомия человека (11-е изд.) Гиппократ, Москва, 704 с.
Annoni J.M. Khateb A. Gramigna S. et al. (2003) Chronic cognitive impairment following laterothalamic infarcts: a study of 9 cases. Arch. Neurol. 60(10): 1439–1443.
Bassetti C. Mathis J. Gugger M. et al. (1996) Hypersomnia following paramedian thalamic stroke: a report of 12 patients. Ann. Neurol. 39(4): 471–480.
Bogousslavsky J. (1995) Thalamic infarcts. Lacunar and other subcortical infarctions. Donnan G.S. Norrving B. Bamford J.M. Bogousslavsky J. (Eds.). Oxford University Press, p. 149–170.
Bogousslavsky J. Van Melle G. Regli F. (1988) The Lausanne Stroke Registry: analysis of 1,000 consecutive patients with first stroke. Stroke, 19(9): 1083–1092.
Caplan L.R. DeWitt L.D. Pessin M.S. et al. (1988) Lateral thalamic infarcts. Arch. Neurol. 45(9): 959–964.
Carrera E. Michel P. Bogousslavsky J. (2004) Anteromedian, central, and posterolateral infarcts of the thalamus: three variant types. Stroke, 35(12): 2826–2831.
Charlson M.E. Pompei P. Ales K.L. MacKenzie C.R. (1987) A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J. Chronic. Dis. 40(5): 373–383.
Clark J.M. Albers G.W. (1995) Vertical gaze palsies from medial thalamic infarctions without midbrain involvement. Stroke, 26(8): 1467–1470.
Davalos A. Secades J. (2011) Результаты доклинических и клинических исследований эффективности цитиколина 2009 и 2010 года. Международный неврол. журнал. 5(43): 49–53.
Déjerine J. Roussy G. (1906) Le syndrome thalamique. Rev. Neurol. 14: 521–532.
Fisher C.M. (1991) Lacunar infarcts — a review. Cerebrovasc. Dis. 1(6): 311–320.
Foix C. Hillemand P. (1925) Les syndromes de la région thalamique. Press Med. 1: 113–117.
Gerebzoff M.A. (1940) Цит. по Кроль М.Б. Федорова Е.А. (1966) Основные невропатологические синдромы. Медицина, Москва, с. 139.
Grips E. Sedlaczek O. Bäzner H. et al. (2005) Supratentorial age-related white matter changes predict outcome in cerebellar stroke. Stroke, 36(9): 1988–1993.
Kim J.S. Lee M.C. (1994) Stroke and restricted sensory syndromes. Neuroradiology, 36(4): 258–263.
Küker W. Weise J. Krapf H. et al. (2002) MRI characteristics of acute and subacute brainstem and thalamic infarctions: value of T2 — and diffusion-weighted sequences. J. Neurol. 249(1): 33–42.
Lazorthes G. (Ed.) (1961) Vascularization et circulation cérébrale. Masson et C-ie, Paris, 323 p.
Lehéricy S. Grand S. Pollak P. et al. (2001) Clinical characteristics and topography of lesions in movement disorders due to thalamic lesions. Neurology, 57(6): 1055–1066.
López-Serna R. González-Carmona P. López-Martínez M. (2009) Bilateral thalamic stroke due to occlusion of the artery of Percheron in a patient with patent foramen ovale: a case report. J. Med. Case Reports, 3: 7392.
Middleton F.A. Strick P.L. (1996) The temporal lobe is a target of output from the basal ganglia. Proc. Natl. Acad. Sci USA, 93(16): 8683–8687.
Neau J.P. Bogousslavsky J. (1996) The syndrome of posterior choroidal artery territory infarction. Ann. Neurol. J. 39(6): 779–788.
Nothnagel С.W. (1889) Цит. по Кроль М.Б. Федорова Е.А. (1966) Основные невропатологические синдромы. Медицина, Москва, 139 с.
Percheron G. (1973) The anatomy of the arterial supply of the human thalamus and its use for the interpretation of the thalamic vascular pathology. Z. Neurol. 205(1): 1–13.
Percheron G. (1976) Les artéres du thalamus human. II. Artéres et territoires thalamiques paramédians de l’ratére basilaire communicante. Rev. Neurol. 32: 309–326.
Schmahmann J.D. (2003) Vascular syndromes of the thalamus. Stroke, 34(9): 2264–2278.
Secades J.J. Lorenzo J.L. (2006) Citicoline: pharmacological and clinical review, 2006 update. Methods Find Exp. Clin. Pharmacol. 28 Suppl. B: 1–56.
Tatu L. Moulin T. Bogousslavsky J. Duvernoy H. (1996) Arterial territories of human brain: brainstem and cerebellum. Neurology, 47(5): 1125–1135.
Tatu L. Moulin T. Bogousslavsky J. Duvernoy H. (1998) Arterial territories of the human brain: cerebral hemispheres. Neurology, 50(6): 1699–1708.
Victor M. Adams R.D. Collins G.H. (1971) The Wernicke-Korsakoff syndrome. A clinical and pathological study of 245 patients, 82 with post-mortem examinations. Contemp. Neurol. Ser. 7: 1–206.
Ізольований інфаркт таламуса: клінічні синдроми, діагностика, лікування і наслідки
С.М. Віничук, М.М. Прокопів, Л.Н. Трепет
Резюме. Проведено комплексне клініко-нейровізуалізаційне обстеження 22 хворих з ізольованим таламічним інфарктом. Результати дослідження показали, що інфаркт частіше локалізувався у класичних таламічних територіях — парамедіанній (27,3%), нижньолатеральній (40,9%), рідше в пограничних судинних ділянках — латеральній (22,7%) і центральній (9,1%). Описані клінічні синдроми і специфічні симптоми у разі інфарктів різних таламічних територій. Встановлена висока терапевтична ефективність застосування препарату Цераксон® (цитиколін) з Актовегіном у лікуванні пацієнтів із гострим ізольованим таламічним інфарктом.
Ключові слова: інфаркт таламусу, клінічні синдроми, лікування, Цераксон® (цитиколін), Актовегін.
Isolated thalamic infarction: clinical syndromes, diagnostic, treatment and outcomes
S.M. Vinychuk, M.M. Prokopiv, L.M. Trepet
Summary. Complex clinico-neuroimaging research of 22 patients with isolated thalamic infarctions was performed. As a result, thalamic infarctions were more frequently occurred in such classic thalamic territories as paramedian (27.3%) and inferolateral (40.9%), and more rare — in lateral (22.7%) and central (9.1%). Specific neurological syndromes and specific symptoms of infarctions in different thalamic territories were described. High therapeutic efficiency of complex use of Ceraxon® (citicoline) and Actovegin in treatment of acute isolated thalamic infarctions was arranged.
Key words: infarction thalamus, clinical syndromes, treatment, Ceraxon® (citicoline), Actovegin.
Международный неврологический журнал 1(55) 2013
Вернуться к номеру
Таламические инфаркты в бассейне артерии Percheron: клиника и диагностика
Авторы: Фурсова Л.А. — Белорусская академия последипломного образования; Науменко Д.В. — ГУ «5-я клиническая больница», г. Минск, Беларусь
Версия для печати
Резюме / Abstract
В статье представлены особенности кровоснабжения зрительного бугра и клинической картины окклюзии артерии Percheron. Особое внимание уделено дифференциальной диагностике парамедианных таламических инфарктов. Показано, что для клинической объективизации сложных неврологических и нейропсихологических нарушений необходимо использовать методы МРТ.
У статті подані особливості кровопостачання зорового бугра й клінічної картини оклюзії артерії Percheron. Особливу увагу приділено диференціальній діагностиці парамедіанних таламічних інфарктів. Показано, що для клінічної об’єктивізації складних неврологічних і нейропсихологічних порушень необхідно використовувати методи МРТ.
The paper presents the features of the blood supply of the thalamus and clinical picture of occlusion of the artery of Percheron. Particular attention is paid to the differential diagnosis of paramedian thalamic infarcts. It is shown that for the clinical objectification of complex neurological and neuropsychological impairments it’s necessary to use MRI methods.
Ключевые слова / Key words
таламический инфаркт, кровоснабжение, артерия Percheron.
таламічний інфаркт, кровопостачання, артерія Percheron.
thalamic stroke, blood supply, artery of Percheron.
Заинтересованность зрительного бугра наблюдается при различных формах ишемии мозга, таких как изолированный таламический инфаркт, инфаркт бассейна задней мозговой артерии (ЗМА), верхний базилярный синдром (top of the basilar syndrome) и расширенный инфаркт задней циркуляции. Несмотря на то что патология этой области была описана более 100 лет тому назад J. Dejerine, G. Roussy, модели инфарктов таламуса, связанные с конкретными сосудистыми территориями, и их этиология изучены недостаточно. О двусторонних ишемических поражениях зрительного бугра в литературных источниках сообщается в ограниченном числе случаев [2–9]. Они возникают в результате особенностей кровоснабжения этой области при сочетании нескольких сосудистых факторов риска, к которым у лиц молодого возраста относят сердечную патологию, артериальную гипертензию, гиперхолестеринемию и курение; у пожилых — атеросклеротическое поражение сосудов, сахарный диабет и коронарную недостаточность.
Артериальное кровоснабжение таламуса осуществляется пятью артериями [10], из которых три основные (таламоперфорирующие, таламогеникулярные и задние ворсинчатые) являются ветвями ЗМА. Две другие — передняя ворсинчатая (ветвь внутренней сонной артерии) и полярные, или тубероталамические, артерии (ветвь задней соединительной артерии — ЗСА) — относятся к территории каротидной системы. Таким образом, кровоснабжение этого подкоркового центра мозга происходит за счет обоих артериальных бассейнов. Однако преимущественно зрительный бугор васкуляризуется сосудами из ЗСА, а также первого (Р1) и второго (Р2) сегментов ЗМА [9]. Выделяют четыре основные сосудистые территории таламуса: переднюю, парамедианную, нижнебоковую и заднюю [11]. Полярные (или тубероталамические) артерии из ЗСА питают переднюю область таламуса, парамедианные (или таламоперфорирующие) артерии из Р1-сегмента ЗМА поставляют кровь для парамедианной зоны, таламогеникулярные артерии — для нижнебоковой и задняя хориоидальная артерия из Р2-сегмента ЗМА — для задней территории зрительного бугра [9]. В 1/3 случаев полярные артерии отсутствуют и васкуляризация осуществляется из парамедианных артерий [12]. Результаты недавно проведенного исследования С.М. Виничука с соавт. (2012) свидетельствуют о том, что таламический инфаркт чаще локализуется в классических территориях — парамедианной (27,3 %) и нижнелатеральной (40,9 %), реже — в пограничных сосудистых зонах — латеральной (22,7 %) и центральной (9,1 %); частота двустороннего поражения таламуса составляет только 4,6 % случаев среди всех изолированных таламических инфарктов.
На долю ишемии парамедианной территории приходится около 22–35 % всех инфарктов таламуса [13]. Эта область зрительного бугра васкуляризуется артериями, отходящими непосредственно из первого сегмента ЗМА с обеих сторон, однако в 1/3 случаев — из одной ножки, известной как артерия Percheron [8, 12, 14]. Артерия Percheron — это единственная артерия, отходящая справа или слева от срединного прекоммунального (мезэнцефалического) сегмента ЗМА (рис. 1). На уровне субталамуса она разделяется и снабжает кровью нижний срединный и передний отделы таламуса и субталамуса с двух сторон. Парамедианные артерии ЗМА отличаются большой вариабельностью, могут поставлять кровь и к передней территории таламуса (в 30–60 % случаев), участвовать в кровоснабжении среднего мозга и ростральной части ствола головного мозга в тех случаях, когда полярные артерии отсутствуют [3, 9, 15].
При окклюзии доминирующей таламоперфорирующей артерии Percheron возможны 4 варианта ишемии [9]: 1) изолированный двусторонний парамедианный таламический инфаркт; 2) двусторонний парамедианный таламический инфаркт с вовлечением среднего мозга; 3) двусторонний сочетанный инфаркт парамедианной и передней областей таламуса вместе со средним мозгом; 4) в редких случаях — двусторонний инфаркт парамедианной и передней зон таламуса.
Полагают [16], что заднемедиальные инфаркты таламуса в основном обусловлены атеросклеротическим поражением церебральных сосудов (large artery disease — 63 %) и кардиоэмболией, а вентролатеральные — микроангиопатией (small artery disease — 72 %). Локализация атероматозного поражения в ЗМА или одной из ее ветвей, а также степень сужения определяют начало, тяжесть течения и характер клинического синдрома. Менее важную роль играют другие факторы — коллатеральный кровоток через ЗСА и вязкость крови. Даже при наличии атеросклеротической бляшки оcновным механизмом развития инсульта обычно является эмболия ЗМА или ее ветвей.
Анатомические особенности кровоснабжения зрительного бугра способствуют возникновению разнообразных клинических синдромов. которые нередко затрудняют диагностику инсульта и определение пораженного сосудистого бассейна. Таламус содержит стратегические ядра и интеграции нескольких важных корковых функций. Те из них, которые пострадали при одностороннем повреждении зрительного бугра, могут быть компенсированы за счет прилегающей здоровой зоны, в то время как двустороннее поражение таламуса приводит к дисфункции соответствующих областей обоих полушарий и появлению специфических симптомов. Типичные клинические проявления этих повреждений приведены в табл. 1 [17].
Ишемия парамедианной сосудистой территории возникает вследствие атероматозной или часто кардиоэмболической (в 40 % случаев, Bogousslavsky J. 1988) окклюзии таламо-субталамической артерии Percheron, поражение которой может вызывать изолированный билатеральный инфаркт таламуса или таламический инфаркт с вовлечением других структур мозга. Билатеральные парамедианные таламические инфаркты характеризуются [11, 18–20] классической триадой симптомов: острым расстройством сознания, нейропсихологическими симптомами и нарушением вертикального взора. Угнетение уровня сознания разной степени выраженности, вплоть до комы, наблюдается у всех пациентов. Может возникать летаргический сон, когда пациента трудно разбудить, или гиперсомния — больные пробудимы, но впадают в глубокий сон вскоре после прекращения стимуляции. Нарушение функции вертикального взора проявляется парезом взора вверх или комбинацией пареза взора вверх и вниз. В чистом виде парез взора вниз обнаруживается только в случаях билатеральных парамедианных инфарктов. Горизонтальная дисфункция менее характерна. Иногда отмечается сходящееся косоглазие. Нейропсихологические расстройства начинают проявляться по мере уменьшения расстройств сознания. Пациенты становятся дезориентированными, тревожными и апатичными. Характерными симптомами являются выраженная и длительная амнезия, абулия, акинетический мутизм, таламическая деменция. КТ и МРТ при окклюзии артерии Percheron позволяют обнаружить в субталамусе и средненижних отделах таламуса двусторонние очаги поражения, напоминающие по своим очертаниям бабочку (рис. 2).
Билатеральные инфаркты в зоне кровоснабжения полярных артерий проявляются нейропсихологическими нарушениями, среди которых острая амнезия с невозможностью запоминания новых событий является ведущим симптомом и не имеет тенденции к уменьшению со временем. Иногда могут отмечаться легкий транзиторный гемипарез или гемисенсорные нарушения на контралатеральной стороне [20]. При сочетанных инфарктах парамедианной и передней территорий таламуса амнезия оказывается более глубокой и стойкой, чем при изолированных парамедианных инфарктах. Полагают [9], что это обусловлено ишемией зоны mammilothalamicus tractus, передних и дорсолатеральных ядер таламуса.
Поражение артерии Percheron может вызывать билатеральный парамедианный инфаркт таламуса с вовлечением среднего мозга (рис. 3). В отличие от изолированного поражения зрительного бугра клиническими особенностями таламо-субталамических парамедианных инфарктов являются: наличие пареза III пары черепных нервов с контралатеральным гемипарезом или гемиатаксией, билатеральным полным птозом, парезом/параличом взора вниз или парезом/параличом взора вверх и вниз, псевдопарезом VI пары черепных нервов со сходящимся косоглазием[20]. Развивается мезэнцефалоталамический синдром [15], который включает нейроофтальмологические, поведенческие и моторные нарушения как результат необычной комбинации клинических признаков.
Возникновение сложных неврологических и нейропсихологических синдромов в остром периоде таламического инсульта побудило нас привести следующие клинические наблюдения.
Клинический случай 1. Пациент С. 49 лет, был найден сидящим в ванной комнате утром в состоянии сопора, с невнятной речью. Анамнестические сведения предоставила жена: у пациента отмечались периодические головные боли и боли в области сердца, хронический гастрит, 7 лет тому назад он перенес эпизод с преходящей слабостью в левых конечностях. При поступлении в стационар жизненно важные функции в норме (АД — 140/90 мм рт.ст. частота дыхания — 18 в 1 мин, частота сердечных сокращений — 78 в 1 мин, температура — 37,2 °С). При неврологическом осмотре: состояние средней тяжести, глубокий сопор, глаза не открывает, инструкции не выполняет, не разговаривает, периодически издает нечленораздельные звуки, проявляет негативизм к осмотру. Зрачки узкие, парез взора вверх, глазные яблоки повернуты вниз. Активные движения в конечностях сохранены, но менее в правой руке. Сухожильные и периостальные рефлексы оживлены, с рук S > D, подошвенные — живые. Патологических и менингеальных знаков не выявлено. Диффузная мышечная гипотония в конечностях. Чувствительность и координацию проверить не представлялось возможным из-за тяжести состояния. Степень тяжести инсульта по шкале NIНSS — 11 баллов. Проведенное КТ-исследование головного мозга позволило исключить субарахноидальное кровоизлияние и геморрагию мозгового ствола. В течение 5 суток пациент находился в палате интенсивной терапии; на фоне проводимого лечения общемозговые, глазо-двигательные и пирамидные симптомы значительно регрессировали, но гиперсомноленция, амнестический синдром и дизартрия длительный период сохранялись. Обследование: УЗИ БЦА: диффузное снижение скоростей по всем БЦА. УЗИ сердца: камеры сердца не расширены. Сократительная функция миокарда желудочков хорошая. Патологических кровотоков на клапанах и полостях сердца не зарегистрировано. Окулист 13.05.2011: ДЗН бледно-розовые, четкие контуры, артерии сужены и извиты, вены нормального калибра. Цереброспинальная жидкость: бесцветная, прозрачная, белок 0,18 г/л, цитоз — 4/3 (лимф. 96 %), глюкоза — 3,8. МРА (TOF) виллизиева круга: убедительных данных об аневризме и стенозе сосудов нет. Инфаркт в ВББА. При выписке: пациент ориентирован, адекватен, выполняет инструкции, психотических и речевых нарушений нет, но сохраняется антероградная амнезия, когнитивные нарушения памяти (по шкале MMSE — 23 из 30 баллов), левосторонняя пирамидная недостаточность. Данные нейровизуализации представлены на рис. 4, 5.
Клинический случай 2. Пациент Л. 1949 г.р. заболел утром 29.01.2012, когда развились нарушения зрения и слабость в левых конечностях. АД не контролировал, гипотензивные препараты не принимал. При поступлении: состояние тяжелое. АД 140/90 мм рт.ст. В сознании, оглушен, ретроградная амнезия, но инструкции выполняет, доступен общению. Периодически дезориентирован в пространстве. Флюктуирующие периоды сонливости. Менингеальных знаков не выявлено. ЧН: справа полный птоз, мидриаз, экзофтальм и ограничение движений глазного яблока вверх, вниз, внутрь; вертикальный парез взора слева, легкая недостаточность VII и XII пар слева. Силовых парезов нет, мышечный тонус конечностей с тенденцией к гипотонии. Сухожильные и периостальные рефлексы оживлены, S > D, симптом Бабинского слева. Чувствительных и координаторных расстройств не выявлено. Оценка состояния по шкале NIНSS — 9 баллов. Обследование: ЭКГ: синусовая брадикардия. Окулист: офтальмоплегия ОД, гипертоническая и атеросклеротическая ангиопатия сетчатки. УЗИ БЦА: брахиоцефальные артерии проходимы, магистральный тип кровотока. Эластичность сосудистой стенки снижена. Умеренное диффузное снижение скоростей по ОАМ, в ПА в сегменте V4 и ОА без существенной асимметрии. Данные МРТ головного мозга представлены на рис. 6. При выписке: ориентирован, когнитивные функции снижены (по шкале MMSE — 25 из 30 баллов), птоз 2-й степени справа, уменьшилась выраженность глазодвигательных нарушений, сохраняется некоторое ограничение вертикального взора; силовых парезов, бульбарных и псевдобульбарных нарушений нет, передвигается без посторонней помощи. Легкая атаксия при ходьбе. Оценка состояния по шкале Рэнкина — 3 балла.
Обсуждение. В обоих описанных случаях при нейровизуализации была выявлена зона двустороннего таламического инфаркта, однако клинические симптомы ишемии существенно отличались друг от друга. В первом случае инфаркт сопровождался классическими признаками поражения таламуса с преобладанием гиперсомнолентного синдрома, антероградной амнезии, парезом вертикального взора, гипофонии и когнитивными мнестическими расстройствами на грани деменции. Полагают [8, 23], что угнетение сознания является следствием поражения задних отделов дорсолатерального и интерламинарных ядер, а также нарушением их связи с восходящей ретикулярной формацией и передней, орбитофронтальной и медиальной префронтальной корой головного мозга. Таламическая деменция возникает при повреждении медиального дорсального ядра таламуса вместе с мамиллярными тельцами [24]. Парез взора вверх связан с интерстициальным ядром медиального продольного пучка, расположенным между промежуточным и средним мозгом. Возникновение селективного нарушения взора вверх свидетельствует о том, что парамедианный таламический инфаркт оказывает влияние на супрануклеарные тракты, ответственные за вертикальный контроль взора, даже без поражения среднего мозга [25].
Во втором случае наблюдались выраженные глазо-двигательные нарушения за счет дисфункции III пары справа, атаксия и пирамидная недостаточность, что позволяет предполагать сочетанное поражение зрительного бугра и рострального отдела среднего мозга, т.е. мезэнцефалоталамический синдром. В дополнение к вышеописанной триаде (изменения психического статуса, вертикальный паралич взора и амнезия) этот мезэнцефалоталамический, или таламопедункулярный. синдром характеризуется другими глазодвигательными нарушениями, мозжечковой атаксией и двигательными расстройствами [2, 26–28]. Наличие мидриаза, птоза и экзофтальма указывает на вовлечение в процесс периакведуктального серого вещества, в котором расположены ядра глазодвигательного нерва. Повреждению подвергаются следующие структуры мозга: межножковые ядра, перекрест верхней мозжечковой ножкой, часть красного ядра, ядра III пары черепных нервов и передняя часть периакведуктального серого вещества, составляющие территорию верхнего среднего мозга или рубральной артерии. Эта артерия может отходить отдельно от проксимальной части ЗМА или иметь общий источник с парамедианной артерией таламуса. Таким образом, двусторонний парамедианный инфаркт таламуса и среднего мозга можно объяснить окклюзией одной артерии Percheron [9].
Дифференциальная диагностика парных поражений таламуса включает метаболические (болезнь Вильсона, болезнь Фара) и токсические процессы (энцефалопатия Вернике, центральный понтинный миелинолиз), инфекции (вирусные энцефалиты, болезнь Крейтцфельдта — Якоба), сосудистые поражения (ишемия в бассейне артерии Percheron, венозная окклюзия вены Галена или прямого синуса, аневризмы основной артерии) и опухоли (глиомы, астроцитомы) [17, 22, 29]. Дифференциация между двусторонними артериальными и венозными инфарктами таламуса проводится с учетом размеров инфаркта, наличия или отсутствия отека мозга и ишемии других территорий мозга. Вовлечение глубоких вен (внутренней мозговой вены, вены Галена, прямого синуса), которые осуществляют отток венозной крови от зрительного бугра, может привести к различным проявлениям венозной гипертензии: острой головной боли с тошнотой, рвотой, судорогами, заинтересованности черепных нервов, иногда изменениям психического статуса. В клинической картине венозного тромбоза доминируют общемозговые нарушения, эпилептические припадки и нейропсихические расстройства. Венозные инфаркты обычно больше по размеру, изолированные и сопровождаются отеком; они не имеют такой конкретной сосудистой территории, как изолированные артериальные таламические очаги, а включают несколько регионов. При нейровизуализации, как правило, определяется двусторонняя ишемия таламуса и базальных ганглиев (рис. 7); геморрагическая трансформация венозного инфаркта считается обычным явлением [22]. Диагностика венозного тромбоза основана на МР-флебографии (рис. 8).
Дифференциальная диагностика при двустороннем парамедианном таламическом инфаркте включает также верхний базилярный синдром (top of the basilar syndrome). который вызывается окклюзией ростральных отделов ОА (рис. 9, 10) и приводит к инфарктам среднего мозга, таламуса, частично височной и затылочной долей [11, 30]. Клинические проявления этого синдрома имеют широкий спектр и включают: глазодвигательные (парезы вертикального взора, III–VI пар черепных нервов), зрительные (гемианопсия, корковая слепота, «оптическая атаксия») и зрачковые расстройства, нарушения сознания и поведения (сомноленция, делирий, педункулярный галлюциноз, нарушение памяти), разнообразные моторные и чувствительные симптомы.
Острому рассеянному энцефаломиелиту часто предшествует вирусная инфекция верхних дыхательных путей или вакцинация. В первую очередь страдает белое вещество головного мозга, затем серое вещество, в том числе и зрительный бугор (в 40 % случаев), что отличает это заболевание от рассеянного склероза. Диагноз становится более вероятным при появлении новых очагов после дебюта первых клинических симптомов.
Астроцитомы таламуса составляют 1–1,5 % всех опухолей головного мозга, встречаются у молодых пациентов и имеют очень плохой прогноз. Клинически они проявляются поведенческими нарушениями, изменениями личности вплоть до слабоумия. На КТ и МРТ (рис. 11) выявляется симметричное образование в области таламуса [22].
Поражение зрительного бугра вместе с базальными ганглиями наблюдается при широком диапазоне заболеваний, в том числе при болезни Вильсона, которая дебютирует неврологическими и психическими расстройствами. Неврологические проявления состоят прежде всего в экстрапирамидных нарушениях, особенно в виде характерного астериксиса («порхающего» тремора), а также дистонии и ригидности. Могут наблюдаться эпилептические припадки. К психическим нарушениям относят эмоциональную лабильность, изменения личности, депрессию. МРТ-признаки при Т2-режиме включают повреждения скорлупы, бледного шара, хвостатого ядра и вентролатеральной зоны таламуса [31]. Клинические особенности метаболических заболеваний дают возможность провести дифференциальную диагностику с инфарктом зрительного бугра. Поражение базальных ганглиев, но не таламуса характерно для системных процессов (отравление, гипер- или гипогликемия, печеночная патология, болезнь Гентингтона и др.), в то время как двустороннее участие таламуса, а не базальных ганглиев чаще связано с фокальными повреждениями (артериальная окклюзия, опухоль) [17].
При энцефалопатии Вернике наряду с амнезией, или корсаковским синдромом, отмечаются глазодвигательные нарушения и атаксия. Большинство пациентов дезориентированы, иногда наблюдается делирий. Глазодвигательные расстройства часто двусторонние и асимметричные; выявляется дисфункция отводящего нерва, нистагм, даже полная наружная офтальмоплегия [31]. Типичные признаки на МРТ в Т2-режиме включают [17, 22, 31] симметричные изменения в медиальной зоне таламуса, сером веществе сильвиева водопровода, мамиллярных тельцах и тектальной пластинке (рис. 12). Zuccolli et al. (2007) отметили, что поражение мамиллярных образований особенно часто отмечается при хроническом алкоголизме.
Основными симптомами центрального понтинного миелинолиза являются тетраплегия и псевдобульбарный паралич, однако более легкие формы заболевания проявляются спутанностью сознания, дизартрией и расстройством содружественных движений глаз с двусторонней дисфункцией отводящих нервов без грубых моторных нарушений конечностей. Олигодендриты, наиболее чувствительные к электролитному дисбалансу, подвергаются осмотической демиелинизации, поэтому при МРТ в Т1- и Т2-режиме в центре варолиева моста (рис. 13), таламуса, скорлупы, наружных коленчатых тел и в других экстрапонтинных зонах выявляются характерные изменения крылообразной формы или в виде симметричного трезубца [22].
Таким образом, двусторонний парамедианный инфаркт таламуса обусловлен возникновением определенных неврологических и нейропсихологических симптомов, которые позволяют предполагать диагноз еще до рентгенологического исследования. При выявлении подобного инфаркта с помощью нейровизуализации в качестве основного диагноза следует рассматривать окклюзию артерии Percheron.
Список литературы / References
1. Dejerine L. Roussy G. Le syndrome thalamique // Rev. Nevrolog. — 1906. — Vol. 41. — P. 521-532.
2. Castaigne P. Lhermitte F. Buge A. et al. Paramedian thalamic and midbrain infarcts: clinical and neuropathological study // Ann. Neurol. — 1981. — 10. — P. 127-148.
3. Bogousslavsky J. Van Melle G. Regli F. The Lausanne Stroke Registry: analysis of 1,000 consecutive patients with first stroke // Stroke. — 1988. — 19(9). — P. 1083-1092.
4. Gentilini M. de Renzi E. Crisi G. Bilateral thalamic artery infarcts: report of eight cases // J. Neurol. Neurosurg. Psychiatry. — 1987. — 50. — P. 900-909.
5. Kumral E. Evyapan D. Balkir K. Kutluhan S. Bilateral thalamic infarction. Clinical, etiological and MRI correlates // Acta Neurol. Scand. — 2001. — 103 (1). — P. 35-42.
6. Raphaeli G. Liberman A. Gomori J. Steiner I. Acute bilateral paramedian thalamic infarcts after occlusion of the artery of Percheron // Neurology. — 2006. — 66. — P. 7.
7. Krampla W. Schmidbauer B. Hruby W. Ischaemic stroke of the artery of Percheron // Eur. Radiol. — 2008. — 18. — P. 192-194.
8. Lopez-Serna R. Gonzalez-Carmona P. Lopez-Martinez M. Bilateral thalamic stroke due to occlusion of the artery of Percheron in a patient with patent foramen ovale: a case report // J. of Medical Case Reports. — 2009. — 3. — P. 7392.
9. Lazzoro N.A. Wright B. Castillo M. Fischbein N.J. et al. Artery of Percheron Infarction: Imaging Patterns and Clinical Spectrum // American J. of Neuroradiology. — 2010. — 31. — P. 1283-1289.
10. Виничук С.М. Прикопив М.М. Трепет Л.Н. Изолированный инфаркт таламуса: клинические синдромы, диагностика, лечение и исход // Укр. медичний часопис. — 2012. — № 2(88) III–IV.
11. Stroke syndromes / J. Bogousslavsky, L.R. Caplan et al. — 2nd ed. — Edinburgh: Cambridge University Press, 2001. — 770 p.
12. Percheron G. The anatomy of the arterial supply of the human thalamus and its use for the interpretation of the thalamic vascular pathology // Z. Neurol. — 1973. — 205. — P. 1-13.
13. Donnan G.S. Norrving B. Bamford J.M. Bogousslavsky J. Thalamic infarcts. Lacunar and others subcortical infarctions. — London: Oxford University Press, 1995. — P. 149-170.
14. Percheron G. Les arteres du thalamus human. Arteres et territoire thalamiques paramedians de l’artere basilaire communicante // Rev. Neurol. — 1976. — 132. — P. 309-324.
15. Matheus M.G. Castillo M. Imaging of Acute Bilateral Paramedian Thalamic and Mesencephalic Infarcts // American J. of Neuroradiology. — 2003. — 24. — P. 2005-2008.
16. Young-Mok Song. Topographic patterns of thalamic infarcts in association with stroke syndromes and aetiologies // J. Neurol. Neurosurg. Psychiatry. — 2011. — 82. — P. 1083-1086.
17. Linn J. Danek A. Hoffmann L.A. et al. Differential Diagnosis of Bilateral Talamic Lesions // Clin. Neuroradiol. — 2007. — № 1. — P. 3-22.
18. Stroke / C. Warlow, P. Sandercock, G. Hankey et al. — 3rd ed. — London: Blackwell Publishing, 2007. — 992 p.
19. Тул Д.Ф. Сосудистые заболевания головного мозга: Руководство для врачей: Пер. с англ. / Под ред. Е.Н. Гусева, А.Б. Гехт. — 6-е изд. — М. ГЭОТАР-Медиа, 2007.
20. Яворская В.А. Бондарь О.Б. Ибрагимова Е.Л. Кривчун В.М. Ишемические таламические инфаркты // Междунар. мед. журн. — 2009. — № 1. — С. 12-15.
21. Teoh H.L. Ahmad A. Yeo L.L. et al. Bilateral thalamic infarctions due to occlusion of artery of Percheron // J. of the Neurological Sciences. — 2010. — 293. — P. 100-111.
22. Hegde A.N. Mohan S. Lath N. Tchoyoson Lim C.C. Differential Diagnosis for Bilateral Abnormalities of the Basal Ganglia and Thalamus // Radiographics. — 2011. — 31. — P. 5-30.
23. Bassetti C. Mathis J. Gugger M. et al. Hypersomnia following paramedian thalamic stroke: a report of 12 patients // Ann. Neurol. — 1996. — 39(4). — P. 471-480.
24. Victor M. Adams R.D. Collins G.H. The Wernicke-Korsakoff syndrome. A clinical and pathological study of 245 patients, 82 with post-mortem examinations // Contemp. Neurol. Ser. — 1971. — 7. — P. 1-206.
25. Clark J.M. Albers G.W. Vertical gaze palsies from medial thalamic infarctions without midbrain involvement // Stroke. — 1995. — 26(8). — P. 1467-1470.
26. Biller J. Sand J.J. Corbett J.J. et al. Syndrome of the paramedian thalamic arteries: clinical and neuroimaging correlation // J. Clin. Neuroophthalmol. — 1985. — 5. — P. 217-23.
27. Lepore F.E. Gulli V. Miller D.C. Neuro-ophthalmological findings with neuropathological correlation in bilateral thalamic-mesencephalic infarction // J. Clin. Neuroophthalmol. — 1985. — 5. — P. 224-228.
28. Waterston J.A. Stark R.J. Gilligan B.S. Paramedian thalamic and midbrain infarction: the mesencephalothalamic syndrome // Clin. Exp. Neurol. — 1987. — 24. — P. 45-53.
29. Frederiksen R. Suodgress S. Kianmahd B. Artery of Percheron infarct: clinical and Radiological Manifestations / www.larad.org/Exhibit1.pps.
30. Caplan L.R. «Top of the basilar» syndrome // Neurology. — 1980. — 30. — P. 2-79.
31. Мументалер М. Маттле Х. Неврология: Пер. с нем. / Под ред. О.С. Левина. — М. МЕДпресс-информ, 2007.
32. Zuccoli G. Gallucci M. Capellades J. et al. Wernicke encephalopathy: MR findings at clinical presentation in twenty-six alcoholic and nonalcoholic patients // Am. J. Neuroradiol. — 2007. — 28(7). — P. 1328-1331.



