Недостаточность сердечная хроническая систолическая — описание, причины, симптомы (признаки), диагностика, лечение.
Краткое описание
Хроническая систолическая сердечная недостаточность — клинический синдром, осложняющий течение ряда заболеваний и характеризующийся наличием одышки при физической нагрузке (а затем и в покое), быстрой утомляемости, периферических отёков и объективными признаками нарушения функций сердца в покое (например, аускультативные признаки, ЭхоКГ — данные).
Код по международной классификации болезней МКБ-10:
- I50 Сердечная недостаточность
Статистические данные. Хроническая систолическая сердечная недостаточность возникает у 0,4–2% населения. С возрастом её распространённость увеличивается: у лиц старше 75 лет она развивается в 10% случаев.
Причины
Этиология • Сердечная недостаточность с низким сердечным выбросом •• Поражение миокарда: ••• ИБС (постинфарктный кардиосклероз, хроническая миокардиальная ишемия) ••• Кардиомиопатии ••• Миокардиты ••• Токсические воздействия (например, алкоголь, доксорубицин) ••• Инфильтративные заболевания (саркоидоз, амилоидоз) ••• Эндокринные заболевания ••• Нарушения питания (дефицит витамина В1) •• Перегрузка миокарда ••• Артериальная гипертензия ••• Ревматические пороки сердца ••• Врождённые пороки сердца (например, стеноз устья аорты) •• Аритмии ••• Наджелудочковые и желудочковые тахикардии ••• Фибрилляция предсердий • Сердечная недостаточность с высоким сердечным выбросом •• Анемия •• Сепсис •• Артериовенозная фистула.
Факторы риска • Отказ больного от фармакотерапии • Назначение ЛС с отрицательным инотропным эффектом, и бесконтрольный их приём • Тиреотоксикоз, беременность и другие состояния, связанные с увеличением метаболических потребностей • Избыточная масса тела • Наличие хронической патологии сердца и сосудов (артериальная гипертензия, ИБС, пороки сердца и др.).
Патогенез • Нарушается насосная функция сердца, что приводит к уменьшению сердечного выброса • В результате снижения сердечного выброса возникает гипоперфузия многих органов и тканей •• Уменьшение перфузии сердца приводит к активации симпатической нервной системы и учащению ритма сердца •• Уменьшение перфузии почек обусловливает стимуляцию ренин — ангиотензиновой системы. Увеличивается выработка ренина, при этом происходит избыточная продукция ангиотензина II, приводящая к вазоконстрикции, задержке воды (отёки, жажда, увеличение ОЦК) и последующему увеличению преднагрузки на сердце •• Снижение перфузии периферических мышц обусловливает накопление в них недоокисленных продуктов метаболизма, а также гипоксия приводят к выраженной утомляемости.
КЛАССИФИКАЦИИ
Классификация XII Всесоюзного съезда терапевтов 1935 г. ( Н.Д. Стражеско, В.Х. Василенко).
• I стадия (начальная) — скрытая сердечная недостаточность, проявляющаяся только при физической нагрузке (одышкой, тахикардией, быстрой утомляемостью).
• II стадия (выраженная) — длительная недостаточность кровообращения, нарушения гемодинамики (застой в большом и малом круге кровообращения), нарушение функций органов и обмена веществ выражены и в покое •• Период А — начало длительной стадии, характеризуется слабо выраженными нарушениями гемодинамики, нарушениями функций сердца или только их части •• Период Б — конец длительной стадии, характеризуется глубокими нарушениями гемодинамики, в процесс вовлекается вся ССС.
• III стадия (конечная, дистрофическая) — тяжёлые нарушения гемодинамики, стойкие изменения обмена веществ и функций всех органов, необратимые изменения структуры тканей и органов.
Классификация Нью — Йоркской кардиологической ассоциации (1964) • I класс — обычная физическая нагрузка не вызывает выраженной утомляемости, одышки или сердцебиения • II класс — лёгкое ограничение физической активности: удовлетворительное самочувствие в покое, но обычная физическая нагрузка вызывает утомление, сердцебиение, одышку или боли • III класс — выраженное ограничение физической активности: удовлетворительное самочувствие в покое, но нагрузка менее обычной приводит к появлению симптоматики • IV класс — невозможность выполнения какой — либо физической нагрузки без ухудшения самочувствия: симптомы сердечной недостаточности имеются даже в покое и усиливаются при любой физической нагрузке.
Классификация общества специалистов по сердечной недостаточности (ОСНН, 2002) принята на Всероссийском конгрессе кардиологов в октябре 2002 г. Удобство данной классификации в том, что она не только отражает состояние процесса, но и его динамику. В диагнозе необходимо отражать как стадию хронической сердечной недостаточности, так и её функциональный класс. Необходимо учитывать, что соответствие стадии и функционального класса не вполне чёткое — функциональный класс выставляют при наличии несколько менее выраженных проявлений, чем это необходимо для выставления соответствующей стадии сердечной недостаточности.
• Стадии хронической сердечной недостаточности (могут ухудшаться несмотря на лечение) •• I стадия — начальная стадия заболевания (поражения) сердца. Гемодинамика не нарушена. Скрытая сердечная недостаточность Бессимптомная дисфункция левого желудочка •• IIА стадия — клинически выраженная стадия заболевания (поражения) сердца. Нарушения гемодинамики в одном из кругов кровообращения, выраженные умеренно. Адаптивное ремоделирование сердца и сосудов •• IIБ стадия — тяжёлая стадия заболевания (поражения) сердца. Выраженные изменения гемодинамики в обоих кругах кровообращения. Дезадаптивное ремоделирование сердца и сосудов •• III стадия — конечная стадия поражения сердца. Выраженные изменения гемодинамики и тяжёлые (необратимые) структурные изменения органов — мишеней (сердца, лёгких, сосудов, головного мозга, почек). Финальная стадия ремоделирования органов.
• Функциональные классы хронической сердечной недостаточности (могут изменяться на фоне лечения как в одну, так и другую сторону) •• I ФК — ограничения физической активности отсутствуют: привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и/или замедленным восстановлением сил •• II ФК — незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением •• III ФК — заметное ограничение физической активности: в покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов •• IV ФК — невозможность выполнить какую — либо физическую нагрузку без появления дискомфорта; симптомы сердечной недостаточности присутствуют в покое и усиливаются при минимальной физической активности.
Симптомы (признаки)
Клинические проявления
• Жалобы — одышка, приступы удушья, слабость, утомляемость •• Одышка в начальной стадии сердечной недостаточности возникает при физической нагрузке, а при выраженной сердечной недостаточности — в покое. Она появляется в результате увеличения давления в лёгочных капиллярах и венах. Это уменьшает растяжимость лёгких и увеличивает работу дыхательных мышц •• Для выраженной сердечной недостаточности характерно ортопноэ — вынужденное положение сидя, принимаемое больным для облегчения дыхания при выраженной одышке. Ухудшение самочувствия в положении лёжа обусловлено депонированием жидкости в лёгочных капиллярах, приводящим к увеличению гидростатического давления. Кроме того, в положении лёжа диафрагма приподнимается, что несколько затрудняет дыхание •• Для хронической сердечной недостаточности характерна пароксизмальная ночная одышка (сердечная астма), обусловленная возникновением интерстициального отёка лёгких. Ночью во время сна развивается приступ выраженной одышки, сопровождающийся кашлем и появлением хрипов в лёгких. При прогрессировании сердечной недостаточности может возникать альвеолярный отёк лёгких •• Быстрая утомляемость у больных сердечной недостаточностью появляется вследствие недостаточного снабжения кислородом скелетных мышц •• Больных с хронической сердечной недостаточностью могут беспокоить тошнота, снижение аппетита, боли в животе, увеличение живота (асцит) вследствие застоя крови в печени и системе воротной вены •• Со стороны сердца могут выслушиваться патологические III и IV тоны сердца. В лёгких определяются влажные хрипы. Характерен гидроторакс, чаще правосторонний, возникающий в результате увеличения плеврального капиллярного давления и транссудации жидкости в плевральную полость.
• Клинические проявления сердечной недостаточности существенно зависят от её стадии •• Стадия I — признаки (быстрая утомляемость, одышка и сердцебиение) появляются при обычной физической нагрузке, в покое проявлений сердечной недостаточности нет •• Стадия IIА — имеются невыраженные нарушения гемодинамики. Клинические проявления зависят от того, какие отделы сердца преимущественно поражены (правые или левые) ••• Левожелудочковая недостаточность характеризуется застоем в малом круге кровообращения, проявляющемся типичной инспираторной одышкой при умеренной физической нагрузке, приступами пароксизмальной ночной одышки, быстрой утомляемостью. Отёки и увеличение печени нехарактерны ••• Правожелудочковая недостаточность характеризуется формированием застойных явлений по большому кругу кровообращения. Пациентов беспокоит боль и тяжесть в правом подреберье, уменьшение диуреза. Характерно увеличение печени (поверхность гладкая, край закруглён, пальпация болезненна). Отличительной особенностью сердечной недостаточности IIА стадии считают полную компенсацию состояния на фоне лечения, т.е. обратимость проявлений сердечной недостаточности в результате адекватного лечения •• Стадия IIБ — имеются глубокие нарушения гемодинамики, вовлечена в процесс вся система кровообращения. Одышка возникает при малейшей физической нагрузке. Больных беспокоят чувство тяжести в правой подрёберной области, общая слабость, нарушение сна. Характерны ортопноэ, отёки, асцит (следствие увеличения давления в печёночных венах и венах брюшины — возникает транссудация, и жидкость накапливается в брюшной полости), гидроторакс, гидроперикард •• III стадия — конечная дистрофическая стадия с глубокими необратимыми нарушениями обмена веществ. Как правило, состояние больных в этой стадии тяжёлое. Одышка выражена даже в покое. Характерны массивные отёки, скопление жидкости в полостях (асцит, гидроторакс, гидроперикард, отёк половых органов). На этой стадии возникает кахексия.
Диагностика
Инструментальные данные
• ЭКГ. можно выявить признаки блокады левой или правой ножки пучка Хиса, гипертрофии желудочков или предсердий, патологические зубцы Q (как признак перенесённого ИМ), аритмии. Нормальная ЭКГ позволяет усомниться в диагнозе хронической сердечной недостаточности.
• ЭхоКГ позволяет уточнить этиологию хронической сердечной недостаточности и оценить функции сердца, степень их нарушения (в частности, определить фракцию выброса левого желудочка). Типичные проявления сердечной недостаточности — расширение полости левого желудочка (по мере прогрессирования — расширение и других камер сердца), увеличение конечного систолического и конечного диастолического размеров левого желудочка, снижение его фракции выброса.
• Рентгенологическое исследование •• Возможно выявление венозной гипертензии в виде перераспределения кровотока в пользу верхних отделов лёгких и увеличения диаметра сосудов •• При застое в лёгких выявляют признаки интерстициального отёка (линии Керли в рёберно — диафрагмальных синусах) либо признаки отёка лёгких •• Обнаруживают гидроторакс (чаще правосторонний) •• Кардиомегалию диагностируют при увеличении поперечного размера сердца более 15,5 см у мужчин и более 14,5 см у женщин (либо при кардиоторакальном индексе более 50%).
• Катетеризация полостей сердца позволяет выявить увеличение давления заклинивания лёгочных капилляров более 18 мм рт.ст.
Диагностические критерии — Фремингемские критерии диагностики хронической сердечной недостаточности, подразделяемые на большие и малые • Большие критерии: пароксизмальная ночная одышка (сердечная астма) или ортопноэ, набухание шейных вен, хрипы в лёгких, кардиомегалия, отёк лёгких, патологический III тон сердца, увеличение ЦВД (более 160 мм вод.ст.), время кровотока более 25 с, положительный «гепатоюгулярный рефлюкс» • Малые критерии: отёки на ногах, ночной кашель, одышка при нагрузке, увеличение печени, гидроторакс, тахикардия более 120 в минуту, уменьшение ЖЕЛ на 1/3 от максимальной • Для подтверждения диагноза хронической сердечной недостаточности необходим либо 1 большой либо 2 малых критерия. Определяемые признаки должны быть связаны с сердечным заболеванием.
Дифференциальная диагностика • Нефротический синдром — наличие в анамнезе отёков, протеинурии, почечной патологии • Цирроз печени • Окклюзионные поражения вен с последующим развитием периферических отёков.
Лечение • Необходимо в первую очередь оценить возможность воздействия на причину недостаточности. В ряде случаев эффективное этиологическое воздействие (например, хирургическая коррекция порока сердца, реваскуляризация миокарда при ИБС) может значительно уменьшить выраженность проявлений хронической сердечной недостаточности • В лечении хронической сердечной недостаточности выделяют немедикаментозные и лекарственные методы терапии. Следует отметить, что оба вида лечения должны дополнять друг друга.
Немедикаментозное лечение • Ограничение употребления поваренной соли до 5–6 г/сут, жидкости (до 1–1,5 л/сут) • Оптимизация физической активности •• Умеренная физическая активность возможна и даже необходима (ходьба как минимум по 20–30 мин 3–5 р/нед) •• Полный физический покой следует соблюдать при ухудшении состояния (в покое урежается ЧСС и уменьшается работа сердца).
Лечение
Лекарственная терапия. Конечная цель лечения хронической сердечной недостаточности — улучшение качества жизни и увеличение её продолжительности.
• Диуретики. При их назначении необходимо учитывать, что возникновение отёков при сердечной недостаточности связано с несколькими причинами (сужением почечных сосудов, увеличением секреции альдостерона, повышением венозного давления. Лечение только диуретиками считают недостаточным. При хронической сердечной недостаточности обычно применяют петлевые (фуросемид) или тиазидные (например, гидрохлоротиазид) диуретики. При недостаточном диуретическом ответе комбинируют петлевые диуретики и тиазиды •• Тиазидные диуретики. Обычно применяют гидрохлоротиазид в дозе от 25 до 100 мг/сут. Следует помнить, что при СКФ почек менее 30 мл/мин использовать тиазиды нецелесообразно •• Петлевые диуретики начинают действовать быстрее, диуретический эффект у них выражен сильнее, но менее продолжителен, чем у тиазидных диуретиков. Применяют фуросемид в дозе 20–200 мг/сут в/в в зависимости от проявлений отёчного синдрома и диуреза. Возможно его назначение внутрь в дозе 40–100 мг/сут.
• Ингибиторы АПФ вызывают гемодинамическую разгрузку миокарда вследствие расширения сосудов, увеличения диуреза, уменьшения давления наполнения левого и правого желудочков. Показаниями для назначения ингибиторов АПФ считают клинические признаки сердечной недостаточности, снижение фракции выброса левого желудочка менее 40%. При назначении ингибиторов АПФ необходимо соблюдать определённые условия по рекомендациям Европейского общества кардиологов (2001) •• Необходимо прекратить приём диуретиков за 24 ч до приёма ингибиторов АПФ •• Следует проводить контроль АД до и после приёма ингибиторов АПФ •• Лечение начинают с малых доз с постепенным их повышением •• Необходимо контролировать функции почек (диурез, относительную плотность мочи) и концентрацию электролитов крови (ионов калия, натрия) при увеличении дозы каждые 3–5 дней, затем каждые 3 и 6 мес •• Следует избегать совместного назначения калийсберегающих диуретиков (их можно назначать только при гипокалиемии) •• Нужно избегать сочетанного применения НПВС.
• Получены первые положительные данные о благоприятном влиянии блокаторов рецепторов ангиотензина II (в частности, лозартана) на течение хронической сердечной недостаточности как альтернативы ингибиторам АПФ при их непереносимости или противопоказаниях к назначению.
• Сердечные гликозиды оказывают положительное инотропное (увеличивают и укорачивают систолу), отрицательное хронотропное (снижение ЧСС), отрицательное дромотропное (замедление АВ — проводимости) действие. Оптимальной поддерживающей дозой дигоксина считают 0,25–0,375 мг/сут (у пожилых пациентов 0,125–0,25 мг/сут); терапевтическая концентрация дигоксина в сыворотке крови составляет 0,5–1,5 мг/л. Показаниями для назначения сердечных гликозидов являются тахисистолическая форма фибрилляции предсердий, синусовая тахикардия.
• b — Адреноблокаторы •• Механизм благоприятного действия — адреноблокаторов при хронической сердечной недостаточности обусловлен следующими факторами ••• Прямая защита миокарда от неблагоприятного воздействия катехоламинов ••• Защита от индуцированной катехоламинами гипокалиемии ••• Улучшение кровотока в венечных артериях вследствие снижения ЧСС и улучшения диастолического расслабления миокарда ••• Уменьшение воздействия сосудосуживающих систем (например, вследствие уменьшения секреции ренина) ••• Потенцирование вазодилатирующей калликреин — кининовой системы ••• Увеличение вклада левого предсердия в наполнение левого желудочка за счёт улучшения расслабления последнего •• В настоящее время из b — адреноблокаторов для лечения хронической сердечной недостаточности рекомендован к применению карведилол — b1 — и a1 — адреноблокатор с вазодилатирующими свойствами. Начальная доза карведилола составляет 3,125 мг 2 р/сут с последующим увеличением дозы до 6,25 мг, 12,5 мг или 25 мг 2 р/сут при отсутствии побочного действия в виде артериальной гипотензии, брадикардии, снижения фракции выброса левого желудочка (по данным ЭхоКГ) и других отрицательных проявлений действия b — адреноблокаторов. Рекомендованы также метопролол, начиная с дозы 12,5 мг 2 р/сут, бисопролол по 1,25 мг 1 р/сут под контролем фракций выброса желудочков с постепенным увеличением дозы через 1–2 нед.
• Спиронолактон. Установлено, что назначение антагониста альдостерона спиронолактона в дозе 25 мг 1–2 р/сут (при отсутствии противопоказаний) способствует увеличению продолжительности жизни больных сердечной недостаточностью.
• Периферические вазодилататоры назначают при хронической сердечной недостаточности в случае наличия противопоказаний или при плохой переносимости ингибиторов АПФ. Из периферических вазодилататоров применяют гидралазин в дозе до 300 мг/сут, изосорбид динитрат в дозе до 160 мг/сут.
• Другие кардиотонические средства. b — Адреномиметики (добутамин), ингибиторы фосфодиэстеразы назначают обычно на 1–2 нед в конечной стадии сердечной недостаточности либо при резком ухудшении состояния больных.
• Антикоагулянты. Больные с хронической сердечной недостаточностью подвержены высокому риску тромбоэмболических осложнений. Возможна как ТЭЛА вследствие венозного тромбоза, так и тромбоэмболия сосудов большого круга кровообращения, обусловленная внутрисердечными тромбами или фибрилляцией предсердий. Назначение непрямых антикоагулянтов больным с хронической сердечной недостаточностью рекомендовано при наличии фибрилляции предсердий и тромбозах в анамнезе.
• Антиаритмические препараты. При наличии показаний к назначению антиаритмических средств (фибрилляция предсердий, желудочковые тахикардии) рекомендуют использовать амиодарон в дозе 100–200 мг/сут. Этот препарат обладает минимальным отрицательным инотропным эффектом, в то время как большинство остальных препаратов этого класса снижают фракцию выброса левого желудочка. Кроме того, сами антиаритмические средства могут провоцировать аритмии (проаритмический эффект).
Хирургическое лечение
• Выбор оптимального метода хирургического лечения зависит от причины, приводящей к сердечной недостаточности. Так, при ИБС во многих случаях выполнима реваскуляризация миокарда, при идиопатическом субаортальном гипертрофическом стенозе — септальная миоэктомия, при клапанных пороках — протезирование или реконструктивные вмешательства на клапанах, при брадиаритмиях — имплантация ЭКС и т.д.
• В случае рефрактерности сердечной недостаточности к адекватной терапии основным хирургическим методом лечения является трансплантация сердца.
• Методы механической поддержки кровообращения (имплантация ассисторов, искусственных желудочков и биомеханических помп), ранее предложенные как временные варианты перед трансплантацией, в настоящее время приобрели статус самостоятельных вмешательств, результаты которых сопоставимы с результатами трансплантации.
• Для предупреждения прогрессирования дилатации сердца проводят имплантацию устройств в виде сетки, препятствующей избыточному расширению сердца.
• При толерантном к лечению лёгочном сердце более целесообразным вмешательством представляется трансплантация комплекса «сердце–лёгкие».
Прогноз. В целом 3 — летняя выживаемость больных хронической систолической сердечной недостаточностью составляет 50%. Смертность от хронической систолической сердечной недостаточности составляет 19% в год.
• Факторы, наличие которых коррелирует с плохим прогнозом у больных с сердечной недостаточностью •• Снижение фракции выброса левого желудочка менее 25% •• Невозможность подъёма на один этаж и движения в нормальном темпе более 3 мин •• Снижение содержания ионов натрия плазмы крови менее 133 мэкв/л •• Снижение концентрации ионов калия плазмы крови менее 3 мэкв/л •• Увеличение содержания в крови норэпинефрина •• Частая желудочковая экстрасистолия при суточном мониторировании ЭКГ.
• Риск внезапной сердечной смерти больных с сердечной недостаточностью в 5 раз выше, чем в общей популяции. Большинство больных хронической сердечной недостаточностью погибают внезапно, преимущественно от возникновения фибрилляции желудочков. Профилактическое назначение антиаритмических средств не предупреждает данного осложнения.
МКБ-10 • I50 Сердечная недостаточность
Лекарственные средства и Медицинские препараты применяемы для лечения и/или профилактики «Недостаточность сердечная хроническая систолическая».
Фармакологическая группа(ы) препарата.
Семейный врач. Терапевт (том 2). Хроническая почечная недостаточность мкб 10
Хроническая почечная недостаточность
Общая информация
Существуют различные определения хронической почечной недостаточности (ХПН), однако суть любого из них сводится к развитию характерного клинико-лабораторного комплекса, возникшего в результате прогрессирующей утраты всех почечных функций.
Хроническая почечная недостаточность (ХПН) – это утрата гомеостатических функций почек на фоне почечного заболевания на протяжении более чем 3 месяцев: снижение клубочковой фильтрации и относительной плотности (осмолярности), повышение концентрации креатинина, мочевины, калия, фосфора, магния и алюминия сыворотки крови, снижение кальция крови, нарушение кислотно-щелочного равновесия (метаболический ацидоз), развитие анемии и артериальной гипертензии.
Эпидемиология
Проблема ХПН активно разрабатывается на протяжении нескольких десятилетий, что обусловлено значительной распространенностью этого осложнения. Так, по данным литературы, число больных с ХПН в странах Европы, США и Японии колеблется от 157 до 443 на 1 млн. населения. Распространенность этой патологии в нашей стране составляет 212 на 1 млн. населения среди больных старше 15 лет. Среди причин летальности ХПН занимает одиннадцатое место.
Этиология
ХПН имеет в своей основе единый морфологический эквивалент – нефросклероз. Нет такой формы патологии почек, которая потенциально не могла бы привести к развитию нефросклероза, а, следовательно, и почечной недостаточности. Таким образом, ХПН – исход любого хронического заболевания почек.
К ХПН могут привести первичные заболевания почек, а также вторичное их поражение в результате длительно существующего хронического заболевания органов и систем. Непосредственное повреждение паренхимы (первичное или вторичное), приводящее к ХПН, условно делится на заболевания с преимущественным поражением клубочкового аппарата или канальцевой системы, или на их сочетание. Среди клубочковых нефропатий наиболее частым является хронический гломерулонефрит, диабетическая нефропатия, амилоидоз, волчаночный нефрит. Более редкими причинами ХПН с поражением клубочкового аппарата являются малярия, подагра, затяжной септический эндокардит, миеломная болезнь. Первичное поражение канальцевой системы, чаще всего, наблюдается при большинстве урологических заболеваний, сопровождаемых нарушением оттока мочи, врожденными и приобретенными тубулопатиями (почечный несахарный диабет, канальцевый ацидоз Олбрайта, синдром Фанкони, который встречается как самостоятельное наследственное заболевание или сопровождает различные заболевания), отравления лекарствами и токсичными веществами. К вторичным повреждениям паренхимы почек могут привести сосудистые заболевания – поражение почечных артерий, эссенциальная гипертензия (первичный нефроангиосклероз), пороки развития почек и мочевыводящих путей (поликистоз, гипоплазия почек, нейромышечная дисплазия мочеточников и др.). Хроническое изолированное повреждение любого отдела нефрона фактически является пусковым механизмом развития ХПН, однако в клинической практике поздние стадии ХПН характеризуются нарушением функций и клубочкового, и канальцевого аппарата.
Патогенез
Независимо от этиологического фактора, механизм развития ХПН основан на уменьшении количества действующих нефронов, значительном снижении скорости клубочковой фильтрации в отдельном нефроне и на сочетании этих показателей. Сложные механизмы поражения почек включают в себя многие факторы (нарушение обменных и биохимических процессов, свертывания крови, нарушение пассажа мочи, инфекция, аномальные иммунные процессы), которые при взаимодействии с другими заболеваниями могут привести к ХПН. В развитии ХПН наиболее важным моментом является медленное, скрытое нарушение всех почечных функций, о которых больной обычно не подозревает. Однако современные методы обследования позволяют выявить скрытую стадию, так как изменения, происходящие в организме при нарушении функциональной способности почек, в настоящее время хорошо известны. Это и является важной задачей клинициста, что позволяет ему предпринять профилактические и лечебные мероприятия, направленные на предупреждение преждевременного развития терминальной стадии почечной недостаточности. Почки обладают значительными резервными возможностями, о чем свидетельствует сохранение и поддержание жизни организма при потере 90% нефронов. Процесс адаптации осуществляется за счет усиления функции сохранившихся нефронов и перестройки всего организма. При прогрессирующей гибели нефронов снижается скорость клубочковой фильтрации, нарушается водно-электролитный баланс, происходит задержка в организме продуктов метаболизма, органических кислот, фенольных соединений, некоторых пептидов и других веществ, которые обусловливают клиническую картину ХПН и состояние больного. Таким образом, нарушение экскреторной и секреторной функций почек способствует развитию патологических изменений в организме, тяжесть которых зависит от интенсивности гибели нефронов и определяет прогрессирование почечной недостаточности. При ХПН нарушается одна из наиболее важных функций почек – поддержание водно-солевого баланса. Уже на ранних стадиях ХПН, особенно обусловленной заболеваниями с преимущественным поражением канальцевого аппарата, наблюдается нарушение концентрационной способности почек, что проявляется полиурией, никтурией, снижением осмолярности мочи до уровня осмотической концентрации плазмы крови (изостенурия) и при далеко зашедшем поражении – гипостенурией (осмотическая концентрация мочи ниже осмотической концентрации плазмы крови). Полиурия, которая носит постоянный характер даже при ограничении жидкости, может быть обусловлена как непосредственным снижением функции канальцев, так и изменением осмотического диуреза. Важной функцией почки является поддержание электролитного баланса, особенно таких ионов, как натрий, калий, кальций, фосфор и др. При ХПН выделение натрия с мочой может быть повышенным и пониженным. У здорового человека 99% фильтруемого через клубочки натрия реабсорбируется в канальцах. Заболевания с преимущественным поражением тубулярноинтерстициальной системы приводят к уменьшению реабсорбции его до 80%, а, следовательно, повышенной его экскреции. Усиление выведения натрия с мочой не зависит от введения его в организм, что особенно опасно при рекомендации в подобных ситуациях больному ограничения приема соли. Однако преобладающее поражение клубочков, уменьшение скорости клубочковой фильтрации, особенно при сохраненной функции канальцев, может привести к задержке натрия, что влечет за собой накопление жидкости в организме, повышение АД. До 95% введенного в организм калия удаляется почками, что достигается секрецией его в дистальном отделе канальцев. При ХПН регуляция баланса калия в организме осуществляется за счет выведения его кишечником. Так, при снижении СКФ до 5 мл/мин, около 50% поступившего калия выводится с калом. Повышение калия в плазме может наблюдаться в олигоанурической фазе ХПН, а также при обострении основного заболевания, при повышенном катаболизме. Так как основное количество калия в организме находится во внутриклеточном пространстве (в плазме – около 5 ммоль/л, во внутриклеточной жидкости – около 150 ммоль/л), в некоторых ситуациях (лихорадочное состояние, оперативное вмешательство и др.) на фоне ХПН может возникать гиперкалиемия, угрожающая жизни больного. Состояние гипокалиемии у больных с ХПН наблюдается гораздо реже и может свидетельствовать о дефиците общего калия в организме и резком нарушении секреторной способности дистального отдела канальцев. Нарушения функций клубочкового и канальцевого аппарата уже на ранних стадиях ХПН приводят к гиперхлоремическому ацидозу, гиперфосфатемии, умеренному повышению магния в сыворотке крови и гипокальциемии.
Повышение в крови концентрации мочевины, аминоазота, креатинина, мочевой кислоты, метилгуанидина, фосфатов и т.д. Рост уровня аминоазота может быть связан с усиленным катаболизмом белка вследствие его избыточного поступления, либо его резкого ограничения при голодании.
Мочевина является конечным продуктом метаболизма белков, образуется в печени из азота дезаминированных аминокислот. В условиях почечной недостаточности отмечается не только затруднение ее выделения, но и, по неизвестным еще причинам, усиление продукции ее печенью.
Креатинин образуется в мышцах тела из своего предшественника креатинина. Содержание креатинина в крови довольно стабильно, нарастание креатинемии параллельно повышению уровня мочевины в крови происходит, как правило, при снижении клубочковой фильтрации до 20-30% от нормального уровня.
Еще большее внимание привлекает избыточная продукция паратгормона как возможного основного токсина уремии. Подтверждением этого является эффективность хотя бы частичной паратиреоидэктомии. Появляется все больше фактов, свидетельствующих о токсичности веществ неизвестной природы, относительная молекулярная масса которых – 100-2000, вследствие чего они получили название «средние молекулы». Именно они накапливаются в сыворотке крови больных с ХПН. Однако все более очевидным становится то, что синдром азотемии (уремии) не обусловлен одним или несколькими токсинами, а зависит от перестройки клеток всех тканей и изменения трансмембранного потенциала. Это происходит в результате нарушений как функции почек, так и систем, регулирующих их деятельность.
Причинами ее являются кровопотери, укорочение продолжительности жизни эритроцитов вследствие дефицита белка и железа в организме, токсическое влияние продуктов азотистого обмена, гемолиз (дефицит глюкозо-6-фосфатдегидрогеназы, избыток гуанидина), пониженный эритропоэтин. Рост средних молекул также угнетает эритропоэз.
Остеодистрофия
Остеодистрофия, бусловленная нарушением метаболизма кальциферола. В почках происходит образование активного метаболита 1,25-дегидроксикальциферола, влияющего на транспорт кальция путем регуляции синтеза связывающих его специфических белков. При ХПН перевод кальциферола в обменно-активные формы блокируется. Водно-электролитный баланс длительно сохраняется близким к физиологическому, вплоть до терминальной фазы. В условиях нарушения ионного транспорта в канальцах, при тубулярных дефектах потеря натрия возрастает, что при недостаточности восполнения его приводит к синдрому гипонатриемии. Гиперкалиемия расценивается как второй по значимости признак ХПН. Это связано не только с нарастающим катаболизмом, характерным для почечной недостаточности, но и с увеличением ацидоза, а главное – с изменением распределения калия вне и внутри клеток.
Изменение КОС происходит в связи с нарушением функции «угольная кислота – гидрокарбонат». При различных вариантах нарушения функций почек, зависящих от характера процесса, может наблюдаться тот или иной тип нарушения КОС. При клубочковом – ограничивается возможность поступления в мочу кислых валентностей, при тубулярном – происходит преимущественное включение аммонио-ацидогенеза.
Артериальная гипертензия
В ее возникновении несомненна роль угнетения продукции вазодилататоров (кининов). Дисбаланс вазоконстрикторов и вазодилататоров при ХПН обусловлен потерей почкой способности контролировать в организме уровень натрия и объем циркулирующей крови. В терминальной фазе ХПН, стойкая гинертензионная реакция может быть адаптационной, поддерживающей фильтрационное давление. В этих случаях резкое снижение артериального давления может быть фатальным.
Согласно МКБ-10, ХПН классифицируют таким образом:
N18 Хроническая почечная недостаточность.
N18.0 – Терминальная стадия поражения почек.
N18.8 – Другая хроническая почечная недостаточность.
N18.9 – Хроническая почечная недостаточность не уточнена.
N19 – Не уточнена почечная недостаточность.
Диагностика
Диагностика ХПН при известном почечном заболевании несложна. Степень ее, а, следовательно, и тяжесть, определяются нарастанием концентрации креатинина в сыворотке крови и снижением СКФ. Как должно быть ясно из изложенного ранее, очень важно следить за состоянием электролитного, кислотно-основного обменов, своевременно регистрировать нарушения деятельности сердца, легких.
Диагностика ХПН, в основном, лабораторная. Первый симптом – снижение относительной плотности мочи до 1,004-1,011, независимо от величины диуреза. Надо иметь в виду, что наличие сахара и белка в моче может повысить относительную плотность мочи (каждый 1% сахара – на 0,004 и 3 г/л – на 0,01).
Исследование электролитного баланса для установления уровня снижения функции почек малоинформативно. То же можно сказать и в отношении степени анемии, и, тем более, уровня артериального давления.
Очень важными становятся точная оценка функции почек, учет состояния других органов, степень дистрофических процессов в организме при решении вопроса о перспективах пересадки почки.
В общетерапевтической практике можно столкнуться с креатининемией без определённого почечного заболевания. Такое наблюдается при застойной сердечной недостаточности. Обычно креатининемия не превышает 0,6-0,8 ммоль/л. Более значительное повышение может наблюдаться при быстро нарастающей декомпенсации сердечной деятельности, например, у больных с осложненным инфарктом миокарда. Особенностью такой креатининемии является необычное сохранение достаточно высокой плотности мочи. Почечная недостаточность возникает при сокращении «почечной квоты» сердечного выброса до 7,8%. Ухудшение почечной гемодинамики связывают с ростом венозного давления, причем снижение почечного кровотока опережает редукцию клубочковой фильтрации, так что фильтрационная фракция обычно повышена. Ухудшение почечной гемодинамики сопровождается перераспределением почечного кровотока. Больше всего страдает наружная часть коркового слоя. Сохранение повышенной плотности мочи связано с замедлением кровотока, особенно в мозговом слое.
Таким образом, необычная для экстраренальных причин «хроническая» креатиниемия без развития диффузного нефросклероза, не сопровождаемая обычной для нее изостенурией, имеет определенное диагностическое и прогностическое значение для кардиальных больных. Специального лечения такая почечная недостаточность не требует. Еще одна особенность снижения функции почек при застойной сердечной недостаточности – появление и нарастание протеинурии. Выделяются, как правило, белки плазмы крови, однако виновником ее является нарушенная канальцевая реабсорбция белка. Гистопатологическая картина такой застойной почки выявляет расширение вен. Клубочки увеличены в размерах, петли капилляров – широкие, содержат эритроциты. Строма почки отечна, канальцы – несколько расширены, их эпителий – в состоянии дистрофии, многие канальцы – с явлениями атрофии. Очаговый интерстициальный фиброз и артериосклероз.
Клинические критерии
Основные проявления:
— симптомы эндогенной интоксикации;
— олигурия;
— отеки;
— тошнота;
— макрогематурия или микрогематурия;
— нарушение мочеиспускания;
— зуд кожи;
— кровотечения.
Уже первое общение с больным и выяснение таких данных из анамнеза, как длительность нефрологического заболевания, наличие или отсутствие хронического гломеруло- или пиелонефрита, артериальной гипертензии, длительность этих заболеваний, частота обострений гломеруло- или пиелонефрита, количество выделяемой мочи за сутки, а также выявление ранних симптомов ХПН, позволяют заподозрить почечную недостаточность и наметить план диагностических и лечебных мероприятий.
Указание в анамнезе на продолжительность нефрологического заболевания более 5-10 лет дает основание заподозрить наличие почечной недостаточности и выполнить все диагностические исследования, подтверждающие или отвергающие этот диагноз. Анализ исследований показал, что суммарное нарушение функции почек и выявление стадии ХПН возможны при использовании традиционных методов исследования мочи и крови.
Астенический синдром: слабость, утомляемость, сонливость, снижение слуха, вкуса.
Дистрофический синдром: сухость и мучительный зуд кожи, следы расчесов на коже, похудание, возможна настоящая кахексия, атрофия мышц.
Желудочно-кишечный синдром: сухость, горечь и неприятный металлический вкус во рту, отсутствие аппетита, тяжесть и боли в подложечной области после еды, нередко – поносы, возможно повышение кислотности желудочного сока (за счет снижения разрушения гастрина в почках), в поздних стадиях могут быть желудочно-кишечные кровотечения, стоматит, паротит, энтероколит, панкреатит, нарушение функции печени.
Сердечно-сосудистый синдром: одышка, боли в области сердца, артериальная гипертензия, гипертрофия миокарда левого желудочка, в тяжелых случаях – приступы сердечной астмы, отека легких; при далеко зашедшей ХПН – сухой или экссудативный перикардит, отек легких.
Анемически-геморрагический синдром: бледность кожи, носовые, кишечные, желудочные кровотечения, кожные геморрагии, анeмия.
Костно-суставной синдром: боли в костях, суставах, позвоночнике (вследствие остеопороза и гиперурикемии).
Поражение нервной системы: уремическая энцефалопатия (головная боль, снижение памяти, психозы с навязчивыми страхами, галлюцинациями, судорожными приступами), полинейропатия (парестезии, зуд, чувство жжения и слабость в руках и ногах, снижение рефлексов).
Мочевой синдром: изогипостенурия, протеинурия, цилиндрурия, микрогематурия.
Ранние клинические признаки ХПН – полиурия и никтурия, гипопластическая анемия; затем присоединяются общие симптомы – слабость, сонливость, утомляемость, апатия, мышечная слабость. В последующем, с задержкой азотистых шлаков, возникают кожный зуд (иногда – мучительный), носовые, желудочно-кишечные, маточные кровотечения, подкожные геморрагии; может развиться «уремическая подагра» с болями в суставах, тофусами. Для уремии характерен диспептический синдром – тошнота, рвота, икота, потеря аппетита, вплоть до отвращения к еде, понос. Кожные покровы – бледно-желтоватого цвета (сочетание анемии и задержки урохромов). Кожа – сухая, со следами расчесов, синяки на руках и ногах; язык – сухой, коричневый. При прогрессировании ХПН нарастают симптомы уремии. Задержка натрия приводит к гипертензии, часто – с чертами злокачественности, ретинопатией. Гипертензия, анемия и электролитные сдвиги вызывают поражение сердца. В терминальной стадии развивается фибринозный или выпотной перикардит, свидетельствующий о неблагоприятном прогнозе. По мере прогрессирования уремии, нарастает неврологическая симптоматика, появляются судорожные подергивания, усиливается энцефалопатия, вплоть до развития уремической комы, с сильным шумным ацидотическим дыханием (дыхание Куссмауля). Характерна склонность больных к инфекциям; часто отмечаются пневмонии.
Лабораторные критерии
Клинический анализ мочи – протеинурия, гипоизостенурия, цилиндрурия, возможна абактериальная лейкоцитурия, гематурия.
Анализ крови:
клинический – анемия, увеличение скорости оседания эритроцитов (СОЭ), возможен умеренный лейкоцитоз, сдвиг лейкоцитарной формулы влево, возможна тромбоцитопения;
биохимический – увеличение уровней мочевины, креатинина, остаточного азота в крови, увеличения общих липидов, В-липопротеидов, гиперкалиемия, гипокоагуляция, гипокальциемия, гиперфосфатемия, возможна гиподиспротеинемия, гиперхолестеринемия.
Лабораторная диагностика
— Анализ крови клинический, с определением тромбоцитов;
— анализ крови биохимический, с определением уровня креатинина, мочевины, холестерина, протеинограммы, электролитов (калий, кальций, фосфор, натрий, хлор);
— определение суточной экскреции белка;
— определение функционального состояния почек (скорость клубочковой фильтрации);
— кислотно-щелочное состояние;
— АЛТ, АСТ;
— рентгенологическое исследование почек, костей, легких.
Дополнительные лабораторные и инструментальные исследования
— Ферритин;
— процент (%) насыщенности трансферрина;
— определение паратиреоидного гормона;
— определение экскреции кальция с мочой;
— определение амилазы крови;
— белково-осадочные пробы;
— определение продуктов деградации фибрина в сыворотке крови;
— радионуклидные исследования (непрямая реноангиография, динамическая и статическая реносцинтиграфия);
— пункционная биопсия почки;
— функциональные исследования мочевого пузыря;
— эхоэнцефалограмма;
— эхокардиография с оценкой функционального состояния сердца, допплерография сосудов.
Дифференциальная диагностика
Диагностика ХПН у клиницистов не вызывает особых затруднений благодаря характерной клинической картине и лабораторным изменениям в крови и моче. Единственное, о чем надо всегда помнить: подобная клиника может быть обусловлена обострением ХПН в результате окклюзирующего фактора и развития острого воспалительного процесса в верхних или нижних мочевых путях. При указанных состояниях истинная стадия ХПН может быть установлена только после восстановления пассажа мочи и ликвидации острого воспалительного процесса. Для нефрологов важным является диагностика ранних и преддиализных стадий ХПН, что позволяет наметить лечебную тактику и определить прогноз нефрологического заболевания.
Выявление ХПН, как правило, проводится параллельно с диагностикой нефрологического заболевания и включает в себя историю заболевания, клинические проявления, изменения в общих анализах крови и мочи, а также специфические исследования, направленные на выявление суммарной функции почек и методов, позволяющих дать оценку морфологическим и функциональным параметрам почек.
Консультации специалистов
— Окулист: состояние глазного дна;
— невропатолог: наличие уремической и гипертонической энцефалопатии;
— гастроэнтеролог: наличие осложнений со стороны желудочно-кишечного тракта (гастрит, гепатит, колит и др.);
— кардиолог: симптоматическая артериальная гипертензия, гипертензионное сердце;
— кардиохирург: уремический перикардит (пункция);
— уролог: наличие конкрементов в чашечно-лоханочном отделе почек, мочеточниках и др.
Цели
Исходя из классификации, лечение ХПН показано уже с уровня клубочковой фильтрации меньше 60 мл/мин, что соответствует уровню креатинина 140 мкмоль/л для мужчин и 105 мкмоль/л – для женщин (ренопротекция показана с уровня СКФ около 90 мл/мин). Рекомендуется стабилизация АД до целевых цифр < 130/80 мм рт.ст. а при протеинурии – < 125/75 мм рт.ст.
Диагностика и борьба с осложнениями.
Уровень лечения
Амбулаторно: терапевт, семейный врач, специалист-кардиолог, гастроэнтеролог и пр.; стацuонарно – показания к стационарному лечению.
Больные с ХПН подлежат диспансерному наблюдению у врача-нефролога, а в случае его отсутствия – у врача-терапевта по месту жительства.
Диспансерное наблюдение должно включать: обследование больных с ХПН I стадии 3 раза в год, с ХПН II стадии – 6 раз в год, а с ХПН III стадии – ежемесячно, назначение адекватного режима, трудоустройства и выбора рациональных диетических и лечебных мероприятий; установление и устранение факторов, которые способствуют прогрессированию ХПН. При возникновении интеркурентных заболеваний больные обследуются дополнительно. Больным с ХПН IV стадии должно проводиться лечение гемодиализом или перитонеальным диализом, или симптоматическая терапия (при наличии противопоказаний для почечной заместительной терапии (ПЗТ) по месту жительства.
Методы лечения
Немедикаментозные (рекомендации к образу жизни, рациону питания, уровню активности и пр.).
Лекарственная терапия базисная (в соответствии с международными стандартами и утвержденными МЗ Украины протоколами: конкретно фармакологическая группа препаратов, доза, длительность курса) и дополнительная.
Хирургическое лечение или другие виды лечения (показания).
Основными задачами диетического лечения при ХПН является уменьшение употребления белка с едой – низкобелковая диета (НБД); контроль потребления жидкости; уменьшение употребления продуктов, которые содержат Na+, K+, Mg2+, Cl-, фосфаты.
Ограничение употребления белка
Низкобелковая диета (НБД) способствует торможению прогрессирования ХПН: уменьшается внутриклубочковая гипертензия и гипертрофия клубочков, протеинурия, снижается частота развития вторичного гиперпаратиреоза, уменьшается уровень продуктов азотистого обмена.
Коррекция кальций-фосфатных нарушений
Повышенный уровень фосфора сыворотки и развитие вторичного гиперпаратиреоза (ВГПТ) не только содействует развитию остеопатии, но и влияет на прогрессирование ХПН. При показателях СКФ 40-50 мл/мин количество фосфора в суточном рационе не должно превышать 800-1000 мг. При СКФ ниже 40 мл/мин, кроме диетического ограничения фосфора до 1 г/сутки, назначают фосфатсвязывающие препараты (ФСП): фосфатбиндеры.
Контроль артериального давления (АД) и уровня протеинурии
Ингибиторы АПФ (ИАПФ):
— эналаприл – от 5 до 40 мг/сутки;
— периндоприл – от 2 до 8 мг/сутки;
— квинаприл – от 5 до 20 мг/сутки;
— моэксиприл – от 3,75 до 15 мг/сутки;
— рамиприл – от 2,5 до 10 мг/сутки;
— спираприл – от 3 до 6 мг/сутки.
Блокаторы рецепторов ангиотензина II (БРАII):
— валсартан – от 80 до 160 мг/сутки;
— лосартан – от 25 до 100 мг/сутки;
— кандесартан – от 8 до 32 мг/сутки;
— ирбесартан – от 150 до 300 мг/сутки;
— телмисартан – от 40 до 80 мг/сутки;
— эпросартан – от 400 до 1200 мг/сутки.
Блокаторы кальциевых каналов:
— амлодипин – от 5 до 10 мг/сутки;
— лерканидипин – от 5 до 10 мг/сутки;
— дилтиазем – от 30 до 90 мг/сутки трижды;
— дилтиазем ретард – от 90 до 300 мг/сутки дважды;
— верапамил – от 40 до 120 мг/сутки от 2 до 3 раз в сутки;
— верапамил ретард – от 240 до 480 мг/сутки.
Ингибиторы АПФ (ИАПФ) и блокаторы рецепторов ангиотензина II (БРАII) более существенно, чем диуретики, антагонисты кальция и b-блокаторы, уменьшают протеинурию и микроальбуминурию.
Блокаторы кальциевых каналов. а именно группа нифедипина (дигидропиридиновые), эффективно уменьшают АД, однако не влияют на уровень протеинурии и прогрессирование ХПН, что связано с их свойством резко уменьшать тонус афферентной артериолы и усиливать гидравлический удар при высоком системном АД. Напротив, негидропиридиновые блокаторы кальциевых каналов (верапамил, дилтиазем) практически не влияют на механизм почечной авторегуляции, способствуют уменьшению протеинурии, тормозят фиброз клубочков. Достижение целевого АД при хронических заболеваниях почек происходит при назначении нескольких препаратов.
Коррекция анемии
Насыщенность организма железом контролируется целевыми минимальными показателями концентрации эритропоэтина сыворотки свыше 100 нг/мл и уровня насыщения трансферрина > 20%. Препараты железа при необходимости назначают в дозе больше 200-300 мг элементарного железа в сутки. Параллельно применяют другие препараты, которые являются обязательными в лечении анемии:
— фолиевая кислота – от 5 до 15 мг/сутки;
— пиридоксин (витамин В6) – от 50 до 200 мг/сутки.
Основным видом заместительной терапии эритропоэтиндефицитной анемии является назначение эритропоэтина:
— эпрекс – от 20 до 100 Ед/кг трижды в неделю;
— рекормон – от 20 до 100 Ед/кг трижды в неделю.
Коррекция гиперазотемии
С целью уменьшения уровня азотемии, токсической нагрузки уремии, используются препараты, усиливающие их экскрецию.
Гипоазотемические фитопрепараты:
— хофитол – от 2 до 3 таблеток трижды в сутки за 15 мин. до еды или по 2 ампулы дважды в сутки внутримышечно или внутривенно ежедневно на протяжении 14-21 дней;
— леспенефрил (леспефлан) – от 3 до 6 чайных ложек в сутки или внутривенно из расчета 1 мл/кг массы больного.
Энтеросорбция с применением энтеросорбентов – за 1,5-2 часа до или после еды и медикаментов:
— активированный уголь – до 5 г от 3 до 4 раз/сутки;
— сферический карбонит – до 5 г от 3 до 4 раз/сутки;
— энтеросгель – по 1 столовой ложке (15,0 г) от 3 до 4 раз/сутки;
— сорбигель – по 1 столовой ложке (15,0 г) от 3 до 4 раз/сутки;
— энтеродез – по 5 мл на 1000 мл воды от 3 до 4 раз/сутки;
— полифепан – по 1 столовой ложке (15,0 г) от 2 до 4 раз/сутки или из расчета 0,5 г/кг массы/сутки.
Кишечный диализ с введением в толстую кишку через зонд от 8 до 10 л раствора, который содержит: сахарозы – 90 г/л; глюкозы – 8 г/л, хлористого калия – 0,2 г/л, гидрокарбоната натрия – 1 г/л, хлористого натрия –1 г/л.
Коррекция дислипидемии
Целевой уровень ХС ЛПНП у взрослых при хронических почечных заболеваниях < 2,6 ммоль/л; уровень ХС ЛПВП > 1 ммоль/л (40 мг/дл); ТГ < 2,3 ммоль/л.
Статины:
— ловастатин – от 10 до 80 мг/сутки;
— симвастатин – от 10 до 40 мг/сутки;
— правастатин – от 10 до 40 мг/сутки;
— аторвастатин – от 10 до 40 мг/сутки;
— флювастатин – от 10 до 40 мг/сутки.
Статины блокируют ключевой фермент синтеза холестерина в печени и имеют выраженное гиполипидемическое действие. Желаемый уровень ХС ЛПНП – < 2,6 ммоль/л.
Фибраты:
— гемфиброзил – 600 мг дважды в сутки;
— фенофибрат – 200 мг/сутки.
Фибраты назначают при уровне ТГ > 5,7 ммоль/л (500 мг/дл), с расчетом дозы соответственно функции почек. Комбинация фибратов и статинов не желательна, поскольку возникает высокий риск развития рабдомиолиза.
Показания к проведению активных методов лечения ХПН:
— уровень сывороточного креатинина – выше 0,528 ммоль/л (при диабетической нефропатии – выше 0,353 ммоль/л), накладывается артериовенозная фистула, при дальнейшем повышении креатинина – «ввод» в гемодиализ;
— перикардит, нейропатия, энцефалопатия, гиперкалиемия, высокая гипертензия, нарушение КОС у больных с ХПН.
На сегодня в Украине применяются следующие активные методы лечения ХПН: хронический гемодиализ в сочетании с гемосорбцией и гемофильтрацией, перитонеальный диализ и трансплантация почек.
Прогноз плохой, улучшается с применением заместительной почечной терапии (ЗПТ) и трансплантации почек.
Профилактика
Своевременное выявление и лечение нефрологических заболеваний, приводящих к развитию ХПН, таких как острый гломеруло- и пиелонефрит, диабетическая нефропатия.
Хроническая сердечная недостаточность. Определение. Классификация. Клиника. Диагностика. Лечение.
Актуальность проблемы
Распространенность клинически выраженной хронической сердечной недостаточности ( ХСН) в популяции не менее 1,5-3,0%. Среди лиц старше 65 лет частота встречаемости ХСН возрастает до 6-10%, и декомпенсация становится самой частой причиной госпитализации пожилых больных. Число больных с бессимптомной дисфункцией лівого желудочка не менее чем в 4 раза превышает количество пациентов с клинически выраженной ХСН. За 15 лет число госпитализаций с диагнозом ХСН утроилось, а за 40 лет увеличилось в 6 раз. Пятилетняя выживаемость больных с ХСН все еще ниже 50%. Риск внезапной смерти в 5 раз выше, чем в популяции. В США насчитывается более 2,5 млн больных с ХСН, ежегодно умирает около 200 тыс. пациентов, 5-летияя выживаемость после появления признаков ХСН составляет 50%.
Хроническая сердечная недостаточность (ХСН) — кардиально обусловленное нарушение (насосной) функции с соответствующими симптомами, заключающееся в неспособности системы кровообращения доставлять органам и тканям необходимое для их нормального функционирования количество крови. Таким образом, это диспропорция между состоянием кровообращения и обменом веществ, которая нарастает с увеличением активности жизненных процессов; патофизиологическое состояние, при котором нарушение функции сердца не позволяет ему поддерживать уровень кровообращения, необходимый для метаболизма в тканях.
Причины.
ХСН может развиться на фоне практически любого заболевания сердечно-сосудистой системы, однако основными тремя являются следующие нозологические формы:
— Ишемическая болезнь сердца ( ИБС )
— А ртериальные гипертензии
— С ердечные пороки.
ИБС. Из существующей классификации особенно часто острый инфаркт миокарда (ОИМ) и ишемическая кардиомиопатия (ИКМП — нозологическая единица, введенная в клиническую практику МКБ-10), приводят к развитию ХСН. Механизмы возникновения и прогрессирования ХСН вследствие ОИМ обусловлены изменением геометрии и локальной сократимости миокарда, названным термином «ремоделирование левого желудочка» (ЛЖ), при ИКМП имеет место снижение тотальной сократимости миокарда, названное термином «гибернация («спячка») миокарда».
Артериальные гипертензии. Вне зависимости от этиологии гипертензии происходит структурная перестройка миокарда, имеющая специфическое название — «гипертоническое сердце». Механизм ХСН в данном случае обусловлен развитием диастолической дисфункции ЛЖ.
Сердечные пороки. Для Украины до настоящего времени характерно развитие ХСН вследствие приобретенных и некорригированных ревматических пороков.
Несколько слов необходимо сказать о дилатационной кардиомиопатии (ДКМП), как о причине ХСН. ДКМП — заболевание достаточно редкое, неуточненной этиологии, которое развивается в относительно молодом возрасте и быстро приводит к сердечной декомпенсации.
Установление причины ХСН необходимо для выбора тактики лечения каждого конкретного больного.
Патогенетические аспекты сердечной недостаточности
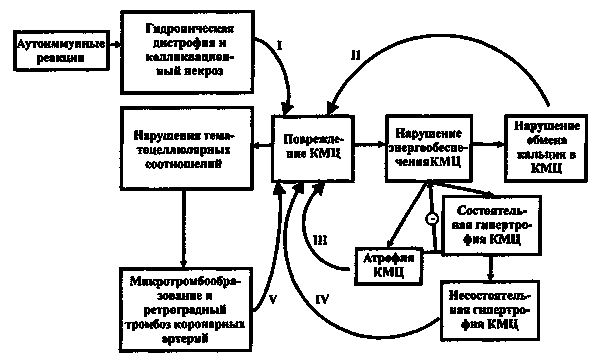
С точки зрения современной теории, основную роль в активизации компенсаторных механизмов (тахикардия, механизм Франка-Старлинга, констрикция периферических сосудов) играет гиперактивация локальных или тканевых нейрогормонов. В основном это симпатико-адреналовая система (САС) и ее эффекторы — норадреналин и адреналин и ренин-ангиотензин-альдостероновая система (РААС) и ее эффекторы — ангиотензин II (А-II) и альдостерон, а также система натрийуретических факторов. Проблема заключается в том, что «запущенный» механизм гиперактивации нейрогормонов является необратимым физиологическим процессом. Со временем кратковременная компенсаторная активация тканевых нейрогормональных систем переходит в свою противоположность — хроническую гиперактивацию. Последняя сопровождается развитием и прогрессированием систолической и диастолической дисфункции лівого желудочка (ремоделирование).
При повреждении сердца ударный объем желудочка будет уменьшаться, а конечно-диастолический объем и давление в этой камере расти. Это увеличивает конечно-диастолическое растяжение мышечных волокон, что приводит к большему систолическому их укорочению (закон Старлинга). Механизм Старлинга помогает сохранить сердечный выброс. но результирующий хронический подъем диастолического давления будет передаваться на предсердия, легочные вены или вены большого круга кровообращения. Увеличивающееся капиллярное давление сопровождается транссудацией жидкости с развитием отеков. Уменьшенный сердечный выброс, особенно при снижении артериального давления, активизирует САС, стимулирующую сокращения миокарда, частоту сердечных сокращений, венозный тонус, а уменьшение перфузии почек ведет к снижению скорости гломерулярной фильтрации, обратному всасыванию воды и хлорида натрия, активации РААС.
Гипоксия тканей при ХСН является не только результирующим звеном патогенеза, но и фактором, имеющим непосредственное провоцирующее действие на остальные ведущие его компоненты — снижение насосной способности сердца, преднагрузку, посленагрузку и ритм сердца. Гипоксия является сложным мультикомпонентным, многоступенчатым процессом. Прямые первичные эффекты гипоксии направлены на мишени, локализованные на самых различных уровнях: организменном, системном, клеточном и субклеточном. На субклеточном уровне гипоксия инициирует развитие апоптоза.
Результатом описанных процессов является увеличение периферического сосудистого сопротивления и обьома циркулирующей крови с соответствующим ростом постнагрузки и преднагрузки.
Клиника сердечной недостаточности
У большинства больных первично развивается недостаточность левого сердца. Наиболее частой жалобой является инспираторная одышка, вначале связанная с физической нагрузкой и прогрессирующая до ортопноэ, пароксизмальной постуральной, до одышки в покое. Характерны жалобы на непродуктивный кашель, никтурию. Больные с ХСН отмечают слабость, утомляемость, которые являются результатом уменьшенного кровоснабжение скелетных мышц и ЦНС.
При правожелудочковой недостаточности появляются жалобы на боль в правом подреберье из-за застоя в печени, потерю аппетита, тошноту из-за отека кишки или уменьшенной гастроинтестинальной перфузии, периферические отеки.
При осмотре можно отметить, что часть больных, даже с выраженной ХСН, в покое выглядят хорошо, у других одышка появляется при разговоре или минимальной активности; больные с длительным и тяжелым течением выглядят кахексичными, цианотичными.
У части больных находят тахикардию, артериальную гипотензию, падение пульсового давления, холодные конечности, потливость (признаки активации САС).
При обследовании сердца выявляется сердечный толчок, расширенный или приподнимающий верхушечный толчок (дилатация или гипертрофия желудочков), ослабление I тона, протодиастолический ритм галопа.
При левожелудочковой недостаточности выслушиваются жесткое дыхание, сухие хрипы (застойный бронхит), крепитация в базальных отделах легких, может определяться тупость в базальных отделах (гидроторакс).
При правожелудочковой СН выявляются набухшие яремные вены, увеличение печени; небольшое надавливание на нее может увеличить набухание яремных вен — положительный гепатоюгулярршй рефлекс. Асцит и анасарка появляются у части больных.
Диагностика сердечной недостаточности
Окончательный клинический диагноз СН может быть установлен только при учете инструментальных данных, в первую очередь, ЭхоКГ, а также рентгенографии ОГК, ЭКГ, данных лабораторных методов исследования.
С помощью ЭхоКГ оценивают: состояние клапанов, наличие шунтов, аневризмы, состояние перикарда, наличие опухоли или, тромбов, а также — сократительную функцию (диффузные изменения или регионарные нарушения, их количественная оценка), наличие гипертрофии миокарда, дилятации камер, определяют глобальную систолическую функцию — ФВ.
Немаловажную роль в диагностике СН играет рентгенологическре исследование ОГП: -оценка размеров сердца (кардиоторакальный индекс); -наличие и выраженность застоя в легких; -дифференциальная диагностика с заболеваниями дыхательной системы; -дигностика и контроль эффективности лечения осложнений СН (пневмония, гидроторакс, ТЭЛА).
Неотемлимой составной обследования при синдроме СН является ЭКГ, которая позволяет выявить гипертрофию, ишемию, очаговые изменения, аритмии и блокады, а также используется для контроля терапии В-адреноблокаторами, диуретиками сердечными гликозидами, амиодароном.
Для определения функционального класса (ФК) у пациентов используют тест с 6-минутной ходьбой. Этот метод широко используется в последние 4-5 лет в США, в том числе и в клинических исследованиях. Состояние пациентов, способных за 6 минут преодолеть от 426 до 550 м, соответствует легкой ХСН; от 150 до 425 м — средней, а тех, кто не способен преодолеть и 150 м, — тяжелой декомпенсации. Таким образом, функциональная классификация ХСН отражает способность больных к выполнению физических нагрузок и очерчивает степень изменений функциональных резервов организма. Это особенно значимо при оценке динамики состояния больных.
Лабораторное обследование при СН предусматривает общий анализ крови (гемоглобин, эритроциты, лейкоциты, тромбоциты, гематокрит, СОЭ), общий анализ мочи, биохимическое исследование крови (электролиты -К+, Na+,креатинин, билирубин, печеночные ферменты — АЛТ, АСТ, щелочная фосфатаза, глюкоза).
Классификация СН
В Украине используется классификация Украинской ассоциаци кардиологов 2006 года, согласно которой выделяют стадии СН (в основе классификация В.Х.Василеноко-Н.Д.Стражеско), варианты дисфункции (по данным ЭхоКГ) и функциональные классы (по классификации NYHA)
Наиболее удобна и отвечает запросам практики функциональная классификация Нью-Йоркской ассоциации сердца, предполагающая выделение четырех функциональных классов по способности больных переносить физические нагрузки. Эта классификация рекомендована к использованию ВОЗ. Принцип, заложенный в ее основу — оценка физических (функциональных) возможностей пациента, которые могут быть выявлены врачом при целенаправленном, тщательном и аккуратном сборе анамнеза, без применения сложной диагностической техники.
Выделено четыре функциональных класса (ФК) ХСН.
I ФК. Больной не испытывает ограничений в физической активности. Обычные нагрузки не провоцируют возникновения слабости (дурноты), сердцебиения, одышки или ангинозных болей.
II ФК. Умеренное ограничение физических нагрузок. Больной комфортно чувствует себя в состоянии покоя, но выполнение обычных физических нагрузок вызывает слабость (дурноту), сердцебиение, одышку или ангинозные боли.
III ФК. Выраженное ограничение физических нагрузок. Больной чувствует себя комфортно только в состоянии покоя, но меньшие, чем обычно, физические нагрузки приводят к развитию слабости (дурноты), сердцебиения, одышки или ангинозных болей.
IV ФК. Неспособность выполнять какие-либо нагрузки без появления дискомфорта. Симптомы сердечной недостаточности или синдром стенокардии могут проявляться в покое. При выполнении минимальной нагрузки нарастает дискомфорт.
Именно динамика ФК при лечении позволяет объективно решить, правильны ли и успешны ли наши терапевтические мероприятия. Проведенные исследования доказали и тот факт, что определение ФК в известной степени предопределяет и возможный прогноз заболевания.
В клинической практике решающее значение для дифференцированного подхода к лечебной тактике имеет определение варианта дисфункции миокарда. Клинически и систолический и диастолический варианты проявляются однотипными симптомами — одышка, кашель, хрипы, ортопноэ. При отсутствии данных ЭхоКГ можна попытаться определить вариант дисфункции с помощью клинико-рентгенологических данных с учетом этиологии СН, аускультативных данных, определения границ сердца перкуторно и рентгенологически, а также данных ЭКГ (гипертрофия, дилатация, рубцовые изменения их локализация, наличие признаков аневризмы сердца и др.).
Лечение ХСН.
Целями лечения СН являются:
· устранение или минимизация клинических симптомов ХСН — повышенной утомляемости, сердцебиения, одышки, отеков;
· защита органов-мишеней — сосудов, сердца, почек, головного мозга (по аналогии с терапией АГ), а также
· предупреждение развития гипотрофии поперечно-полосатой мускулатуры;
· улучшение качества жизни,
· увеличение продолжительности жизни
· уменьшение количества госпитализаций.
Существуют немедикаментозные и медикаментозные методы лечения.
Немедикаментозные методы
Диета. Главный принцип — ограничение потребления соли и в меньшей степени — жидкости. При любой стадии ХСН больной должен принимать не менее 750 мл жидкости в сутки. Ограничения по употреблению соли для больных ХСН I ФК — менее 3 г в сутки, для больных ІІ-ІІІ ФК — 1,2-1,8 г в сутки, для IV ФК – менее 1 г в сутки.
Физическая реабилитация. Варианты — ходьба или велотренажер по 20-30 мин в день до пяти раз в неделю с осуществлением самоконтроля самочувствия, пульса (эффективной считается нагрузка при достижении 75-80% от максимальной для пациента ЧСС).
Медикаментозное лечение СН
Весь перечень лекарственных средств, применяемых для лечения ХСН, подразделяют на три группы: основная, дополнительная, вспомогательная.
Основная группа препаратов полностью соответствуют критериям «медицины доказательств» и рекомендована к применению во всех странах мира: ингибиторы АПФ, мочегонные средства, СГ, ß-адреноблокаторы (дополнительно к иАПФ).
Дополнительная группа, эффективность и безопасность которой доказана крупными исследованиями, однако требует уточнения (проведения мета-анализа): антагонисты альдостерона, антагонисты рецепторов к ангиотензину І, БКК последнего поколения.
Вспомогательные препараты, применение их диктуется определенными клиническими ситуациями. К ним относятся периферические вазодилататоры, антиаритмические средства, антиагреганты, прямые антикоагулянты, негликозидные положительные инотропные средства, кортикостероиды, статины.
Несмотря на большой выбор лекарственных средств, в лечении больных недопустима полипрагмазия (неоправданное назначение большого количества групп препаратов). В то же время сегодня на уровне поликлинического звена основная группа препаратов для лечения ХСН не всегда занимает ведущие позиции, порой отдается предпочтение препаратам второй и третьей групп.
Принципы сочетанного применения основных средств для лечения СН.
1. Монотерапия при лечении ХСН применяется редко, и в этом качестве могут быть использованы только иАПФ при начальных стадиях ХСН.
2. Двойная терапия иАПФ + диуретик оптимально подходит для пациентов с ХСН П-Ш ФК NYHA с синусовым ритмом; применение схемы диуретик + гликозид, чрезвычайно популярная в 50-60-е годы, в настоящее время не применяется.
3. Тройная терапия (иАПФ + диуретик + гликозид) — была стандартом в лечении ХСН в 80-х годах, и сейчас остается действенной схемой в лечении ХСН, однако для пациентов с синусовым ритмом рекомендуется замена гликозида на ß-адреноблокатор.
4. Золотой стандарт с начала 90-х годов по настоящее время — комбинация четырех препаратов — иАПФ + диуретик + гликозид + ß-адреноблокатор.
Острая сосудистая недостаточность
Коллапс
Под этим термином собрано несколько острых нарушений кровообращения, которые не входят в понятие ни остановки кровообращения, ни шока. Граница с последним настолько плохо очерчена, что часто употребляют один термин вместо другого.
Коллапс — это состояние, при котором наступает расстройство периферического кровообращения в результате грубого нарушения соотношения между емкостью сосудистого русла и объемом циркулирующей крови.
Под этим определением подразумевается поражение организма с ненарушенными механизмами защиты. Исход коллапса трудно прогнозировать. Он может привести к смерти, выздоровлению без последствий или перейти в шок.
Патологическая физиология
Главным проявлением коллапса является падение АД, как правило, ниже 10,7 кПа (80 мм рт. ст.) или на 2/3 ниже обычного АД больного с исчезновением периферического пульса. Характерной особенностью этой гипотензии является внезапное ее появление вследствие плохой адаптации организма. Это один из факторов его различия с шоком, при котором включение защитных механизмов приводит к замедленному развитию патологического состояния настоящего синдрома.
Отсутствие этой «защитной реакции» характерно для некоторых тканей и систем:
— миокарда, откуда зарождается брадикардия сердца во время коллапса;
— периферического кровообращения (бледная, холодная, без цианоза, мраморного цвета кожа);
— венозного кровообращения (венозное давление низкое, вены не наполняются под жгутом);
— мозгового кровообращения (частое нарушение памяти, возбуждение и бред, иногда судороги и даже обморок);
— почечного кровообращения (при коллапсе почти постоянно бывает олиго- или анурия);
— нейровегетативная система (повышенное потоотделение, бледность лица, тошнота).
Причины коллапса многочисленны. Он может быть результатом:
а) острой гиповолемии вследствие кровотечения, внеклеточного обезвоживания (в частности, при гипонатриемии);
б) снижения сердечного выброса в связи с нарушением ритма сердца в сторону учащения (желудочковая тахикардия, поворот верхушки сердца) или его урежения (узловая либо синусовая брадикардия, предсердножелудочковая блокада);
в) нарушения кровообращения из-за затрудненного наполнения полостей сердца, например при тампонаде сердца;
г) уменьшения периферического сопротивления вследствие вторичной реакции вазовазального рефлекса у лабильного больного при эмоциональном стрессе;
д) гипервентиляции, которая бывает при искусственной вентиляции у больных, страдающих легочной недостаточностью с гиперкапнией, а также при применении сосудорасширяющих средств.
Эти факторы могут сочетаться. Именно такое сочетание наблюдается при коллапсе, появляющемся в начальной стадии инфаркта миокарда (его следует отличать от кардиогенного шока). В результате отравления барбитуратами при коллапсе возможно скопление жидкости в зоне спланхникуса, для него также характерно угнетающее действие лекарственных препаратов на миокард.
Шок
Шоковое состояние характеризуется синдромом, клиническая сущность которого проявляется диффузным поражением клеток мозга и вторичным несоответствием тканевого кровоснабжения потребностям организма. Оно иногда самостоятельно приводит к смертельному исходу. Однако стадия его необратимости у человека еще четко не определена.
В связи с трудностями клинического определения «шокового состояния» были предложены многочисленные определения, из которых определение Wilson наиболее признанно. По его данным, для больного в состоянии шока характерно наличие трех и более признаков:
— систолическое давление равно или меньше 10,7 кПа (80 мм рт. ст.);
— недостаточное кровоснабжение тканей, что проявляется влажной, холодной, цианотичной, мраморной окраской кожи или снижением сердечного индекса ниже 2,5 л/мин
7м2;
— диурез менее 25 мл/ч;
— ацидоз с содержанием гидрокарбонатов менее 21 ммоль/л и лактацидемией более 15 мг на 100 мл.
Причины шока
Поддержание адекватной гемодинамики в организме — результат рационального взаимодействия между тремя основными факторами: ОЦК, сердечным выбросом и периферическим сопротивлением сосудов. Выраженное изменение одного из этих факторов может привести к «шоковому состоянию».
Гиповолемический шок
Гиповолемический шок развивается при уменьшении объема ОЦК на 20 %. Такая острая потеря объема может быть результатом следующих факторов:
— более или менее значительного наружного кровотечения-
— внутреннего кровотечения, происходящего в полости (брюшная полость, пищевой канал) или в ткани (гематома). Так, например, перелом бедренной кости сопровождается кровопотерей до 1000 мл, перелом костей таза — от 1500 до 2000 мл;
— плазмопотеря (ожог, панкреатит);
— потеря воды (электролитов, например, натрия),
Кардиогенный шок
Шоковое состояние в результате недостаточности сердца может наступить по двум причинам.
Из-за недостаточности функции миокарда и развития в результате этого критического уменьшения сердечного выброса. Декомпенсация наступает при недостаточности сердца или нарушении его ритма (медленный или частый). Инфаркт миокарда, наступивший в результате одного из этих механизмов, представляет собой принципиально отдаленную причину кардиогенного шока.
Препятствие сокращению или систолическому выбросу влечет за собой недостаточное наполнение или приводит к отказу составляющей другого механизма, который позволяет сгруппировать довольно несвязанные причины, такие как перикардиальная тампонада, легочная эмболия, разрыв аорты, внутрисердечный тромбоз и опухоль.
Токсико-инфекционный шок
Токсико-инфекционный (бактериальный) шок представляет собой, по крайней мере, в начальной стадии, довольно частый по своему проявлению шок, вызванный нарушением периферического кровообращения.
Обычно вызывают шок грамотрицательные микроорганизмы (энтеробактерии и особенно псевдомонас), но септицемии, вызванные грамположительными микроорганизмами (сугубо стафилококки), могут также быть причиной бактериальных шоков. Зачастую этот шок является первым признаком септического состояния, но он может появляться и во время его развития. В патогенезе, изученном в основном на животных, отмечают изменение механизмов микроциркуляции. Вслед за периферическим сужением сосудов следует стадия атонии с открытием артериол и закупоркой вен. Это приводит к значительному стазу, преобладающему в области чревной зоны, а следовательно, и к гиповолемии, в результате которой наступает снижение МОС. Этому снижению МОС может способствовать и прямое поражение миокарда токсинами бактерий. Бактериальные эндотоксины (экзотоксины стафилококка) действуют как «пусковой механизм» этих расстройств, освобождая такие сосудо-активные вещества, как гистамин, кинины и катехоламины.
Анафилактический шок
Анафилактический шок является результатом взаимодействия циркулирующих или тканевых антигенов с антителами и развивается по аналогичному с бактериальным шоком механизму.
Нейрогенный шок
Под этим термином объединены нарушения различного происхождения, следующие за поражением центральной нервной системы или являющиеся результатом прямого поражения мозга при повреждении вещества мозга или при фармакологическом воздействии (ганглиоблокаторы). Обе эти причины приводят к снижению ВД и вторичному падению МОС с последующим снижением АД. Торможение рефлекторного сужения сосудов не позволяет корригировать эти нарушения.
Встречаются также шоковые состояния, механизмы которых более сложные. Это относится к шокам, наблюдаемым при массивных отравлениях барбитуратами, где помимо нейрогенной причины шока имеется прямое отрицательное инотропное действие препарата на миокард. Шоковое состояние у человека с политравмой наступает в результате появления двух составляющих: гиповолемии и нейровегетативной реакции. Шок при панкреатите обусловлен гиповолемией, к которой присоединяется токсический элемент, вызывающий, по всей вероятности, вазоплегию.