Инфекционный ( септический ) эндокардит. Лечение.
При внутрисосудистых инфекциях следует назначать антимикробные средства в дозах, создающих концентрации препарата, достаточные для оказания бактерицидного действия, поскольку благодаря наличию эндокардиальных вегетации микроорганизмы защищены от бактерицидного действия нейтрофилов, комплемента и антител окружающим их фибрином и агрегатами из тромбоцитов. Септический эндокардит служит примером заболеваний, при которых препараты, обладающие только бактериостатнческим действием, неэффективны. Излечение возможно лишь при использовании препаратов, обладающих бактерицидным действием. Наилучшие результаты достигаются в тех случаях, когда антимикробный препарат, эффективный в отношении инфицирующего микроорганизма, назначается в ранние сроки заболевания и в большой дозе, а лечение продолжается в течение относительно длительного времени. При инфицировании протезированных клапанов микроорганизмы обычно относительно устойчивы к доступным антимикробным препаратам. При развитии микотической аневризмы или абсцесса миокарда для подавления инфекции в дополнение к антимикробной терапии часто требуется хирургическое вмешательство.
Первым шагом в выборе адекватного антимикробного препарата является взятие проб крови для выделения и идентификации микроорганизма и определения его чувствительности к антимикробным препаратам. Обычно рекомендуют для определения чувствительности микроорганизмов к антимикробным препаратам в макро- или микропробирках создавать их минимальные ингибирующие концентрации, хотя это не всегда необходимо для микроорганизмов с большой зоной ингибирования при оценке чувствительности на диффузионном диске. Чувствительный к пенициллину Streptococcus bovis группы D следует отличать от энтерококка, а метациллинустойчивые S. durens и S. epidermidis — от метациллинчувствительных штаммов. Определение бактерицидной активности антимикробных препаратов в отношении инфицирующего микроорганизма было бы, безусловно, желательным. Однако вследствие того что не существует стандартизированной воспроизводимой лабораторной методики оценки бактерицидного действия, рутинное использование теста минимальной бактериальной концентрации (МБК) для выбора антимикробного препарата или теста сывороточной бактерицидной активности (СБА) для подбора дозы препарата обычно не рекомендуется.
В табл. 188-2 приводятся рекомендуемые схемы назначения антимикробных препаратов против наиболее частых возбудителей септического эндокардита. При лечении больных с инфекцией, вызванной пенициллиночувствительным штаммом зеленящего стрептококка, применение пенициллина и стрептомицина в течение 2 нед столь же эффективно, как назначение только пенициллина в течение 4 нед. При назначении стрептомицина следует определять его минимальную ингибирующую концентрацию (МИК). Если последняя составляет более 2000 мкг/мл, вместо стрептомицина лучше использовать гентамицин. У пожилых больных и у лиц со сниженным слухом или с почечной недостаточностью при применении аминогликозидов отмечают повышенный риск развития осложнений со стороны слуха и почек. Таким образом, следует назначать только пенициллин в течение 4 нед. Возможно назначение пенициллина в течение 2 нед парентерально, а затем в течение 2 нед внутрь. В таких случаях во время приема пенициллина внутрь следует определить его концентрацию в крови, чтобы избежать недостаточной абсорбции препарата из желудочно-кишечного тракта. Амоксициллин при приеме внутрь обладает лучшей абсорбцией, чем пенициллин V. У больных с повышенной чувствительностью к пенициллину, выражающейся в появлении сыпи или лихорадки, вместо пенициллина можно с осторожностью назначить цефазолин. Если же в анамнезе имеются сведения об угрожающих жизни анафилактических реакциях на пенициллин, рекомендуется назначать ванкомицин. У больных с неясным аллергологическим анамнезом в отношении пенициллина при выборе антимикробной терапии следует проводить кожные тесты с большими и малыми пенициллиновыми антигенами. Существует способ проведения десенсибилизации к пенициллину с помощью частого последовательного назначения пенициллина в возрастающих дозах под строгим контролем и в постоянной готовности купировать анафилактические реакции. Однако, учитывая большой выбор антимикробных препаратов, существующих в настоящее время. к этому методу прибегают редко. Пенициллин, назначаемый в виде монотерапевтического средства, не обладает бактерицидным действием в отношении энтерококков (Streptococcus fecalis, S. faecium, S. durans). Лечение больных с эндокардитом, вызванным этими микроорганизмами, проводят пенициллином в комбинации с гентамицином. При этом отмечают синергическое действие этих препаратов в отношении большинства энтерококков, тогда как к пенициллину со стрептомицином устойчивы от 30 до 40 % энтерококков. Об устойчивости возбудителя к пенициллину и стрептомицину можно говорить в том случае, если МИК стрептомицина составляет более 2000 мкг/мл. Пенициллин G можно заменить ампициллином. Небольшие дозы гентамицина (3 мг/кг в день) настолько же эффективны, как и большие, однако в малых дозах гентамицин менее токсичен. Антибиотики из группы цефалоспоринов неактивны в отношении энтерококков, и их не следует использовать для лечения больных с энтерококковыми эндокардитами. В случае повышенной чувствительности к пенициллину больному следует рекомендовать ванкомицин и гентамицин (или стрептомицин). В большинстве случаев курс лечения антибиотиками составляет 4 нед. Однако больным с протезированными клапанами, с вовлечением в процесс левого предсердно-желудочкового клапана или тем, у которых симптомы септического эндокардита существуют в течение более чем 3 мес, лечение антибиотиками следует продлить до 6 нед.
Таблица 188-2. Рекомендации по лечению больных с септическим эндокардитом
Зеленящий стрептококк и неэнтерококковые стрептококки группы D (пенициллин G МИК > 0,1 мкг/мл)
Пенициллин G по 15 000 000 — 24 000 000 ЕД в день внутривенно, дробными дозами каждые 4 — 6 ч с гентамицином в дозе 1 мг/кг внутривенно каждые 8 ч в течение 4 — 6 нед Ампициллин по 2 г внутривенно каждые 6 ч (возможная замена пенициллина) Стрептомицин по 7,5 мг/кг внутривенно или внутримышечно, можно использовать вместо гентамицина, если МИК стрептомицина менее 2000 мкг/мл Ванкомицин по 15 мг/кг внутривенно каждые 12 ч с гентамицином по 1 мг/кг внутривенно каждые 8 ч в течение 4 — 6 нед — в случае повышенной чувствительности к пенициллину
Эндокардит (endocarditis: греч. end ō внутри + kardia сердце + -itis) — воспаление эндокарда (внутренней оболочки сердца). В большинстве случаев Э. не бывает изолированным, сочетаясь с миокардитом, иногда также с перикардитом (при панкардите ), т.е. составляет лишь локализованную в эндокарде часть воспалительного процесса в сердце при различных его заболеваниях и травмах. При этом воспаление может диффузно охватывать внутреннюю выстилку полости желудочка или предсердия (париетальный, или пристеночный, Э.), локализоваться в эндокарде, покрывающем сосочковые мышцы (трабекулярный Э.), образующем хорды (хордальный Э.) или створки клапанов (вальвулит). Вальвулит является самой частой причиной формирования пороков сердца приобретенных .
По происхождению Э. может быть инфекционным, развивающимся вследствие внедрения в эндокард микробных возбудителей, и неинфекционным, возникающим как реакция на метаболические нарушения, механическое повреждение (асептический Э. при травме сердца) или в рамках иммунопатологического процесса, включая случаи, когда инфекционный агент играет роль сенсибилизирующего фактора.
Инфекционный Э. принято подразделять на первичный (возникающий на неизмененных структурах сердца) и вторичный (развивающийся на фоне уже имеющегося врожденного или приобретенного порока сердца), а также на острый и подострый. В отличие от специфических видов инфекционного воспаления в эндокарде, например при туберкулезе, по отношению к неспецифическим инфекционным эндокардитам наметилась тенденция объединять их в самостоятельную форму патологии под общим названием «инфекционный эндокардит. Однако традициям отечественной клиники соответствует нозологическое обособление лишь подострого бактериального Э. (в классическом варианте вызывается зеленящим стрептококком), в то время как острый инфекционный Э. во многих случаях нельзя рассматривать иначе, как частное проявление общего сепсиса, в рамках которого он развивается.
К группе неинфекционных Э. принято относить Э. при ревматизме . диффузных заболеваниях соединительной ткани , при эозинофильном васкулите (так называемый небактериальный тромботический Э.), а также своеобразные поражения эндокарда при карциноидном синдроме и фиброэластозе. Эозинофильному фиброэластическому эндокардиту Леффлера нередко придают нозологическую самостоятельность, однако эта форма патологии во многом остается неясной и рассматривается, с одной стороны, как более широкая в аспекте полисистемности проявлений («эозинофильный коллагеноз», «эозинофильный васкулит с пристеночным эндокардитом»), с другой — как имеющая характер синдрома, развивающегося при длительных эозинофилиях разной природы (см. Леффлера синдромы ).
Патологическая анатомия. Морфологическая картина при Э. характеризуется сочетанием признаков повреждения ткани эндокарда, ее инфильтрации клеточными элементами и пролиферации соединительнотканных клеток. Эти изменения нередко сопрокождаются отложением фибрина (рис. 1 ) и образованием на поверхности измененного эндокарда тромботических наложений в форме бородавок (бородавчатый Э.) или полипообразных (полипозный Э.). Повреждение ткани эндокарда проявляется фибриноидным и мукоидным набуханием коллагеновых волокон, отеком межуточного вещества, слущиванием поверхностного эндотелия. В последующем возникают реактивные изменения в виде инфильтрации поврежденной ткани полиморфно-ядерными гранулоцитами (рис. 2 ), лимфоцитами, эозинофилами, плазматическими клетками (состав инфильтрата во многом определяется происхождением Э.). При некоторых заболеваниях, в частности при ревматизме, в поврежденном эндокарде формируются гранулемы. Пролиферативные процессы представлены увеличением числа эндотелиальных клеток, гистиоцитов и фибробластов. Последние при наличии тромботических наложений (тромбоэндокардит) врастают в них, способствуя организации тромбов, в которых может развиваться грануляционная ткань с новообразованием сосудов. В исходе воспаления формируется фиброз пораженных структур (рис. 3 ).
Различия в соотношении и степени выраженности острых воспалительных изменений, тромбообразования и пролиферативных процессов формируют особенности патоморфологической картины, не только отражающие фазу развития но и зависимые в определенной степени от природы эндокардита. На основании этих различий выделяют такие патоморфологические разновидности, или формы, как диффузный, острый бородавчатый и возвратно-бородавчатый, острый язвенный, полипозный, фибропластические эндокардиты, причем каждая из этих форм в известной мере характерна для Э. определенного происхождения (инфекционного, при ревматизме и т.д.).
Диффузный и острый бородавчатый Э. наблюдаются главным образом при ревматизме. Первый, встречающийся в современной патологоанатомической практике весьма редко, характеризуется выраженным повреждением соединительной ткани с грануломатозом преимущественно в толще створок клапанов сердца (чаще митрального и аортального), второй — сочетанием этих признаков острого воспаления с возникновением на поверхности створок, обращенной к току крови, чаще по линии их смывания, бородавчатых тромботических наложении (острый бородавчатый Э.), которые чаще образуются при обострениях ревматического процесса на уже фиброзированных створках (возвратно-бородавчатый Э.). При системной красной волчанке бородавчатые наложения имеют несколько иную, чем при ревматизме, форму (более плоские и широкие) и располагаются на обеих поверхностях створок ближе к их основанию (атипичный бородавчатый Э.).
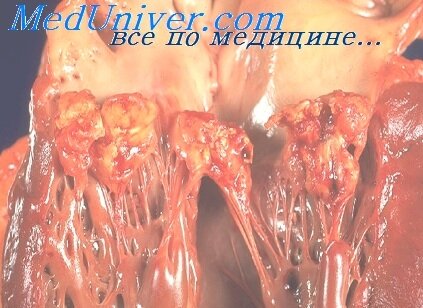
Острый язвенный, полипозно-язвенный и полипозный Э. с преимущественным поражением створок клапанов и хорд характерны для инфекционного (септического) воспаления в эндокарде. При остром Э. развивающемся при сепсисе, вызванном вирулентной флорой, преобладают процессы деструкции створок клапанов, образования в них язвенных дефектов, покрываемых массивными рыхлыми тромботическими наложениями: иногда наблюдаются разрывы хорд. Локализация поражения на клапанах правой или левой половины сердца зависит главным образом от расположения входных ворот инфекции, а при вторичном Э. также от исходной локализации врожденных или ранее приобретенных изменений структуры сердца, в т.ч. после протезирования клапанов (рис. 4 ) и других операций на сердце. Микроскопически выявляют обширные участки некроза створок, скопления колоний микробов и выраженную инфильтрацию ткани и тромботических наложений полиморфно-ядерными гранулоцитами (рис. 5 ). При подостром бактериальном Э. в подавляющем большинстве случаев поражаются створки клапанов левой половины сердца, чаще всего аортального. Так как болезнь имеет затяжное течение, в зонах поражения эндокарда определяются признаки как повреждения ткани, так и организации. Очаги некроза, окруженные инфильтратами (преимущественно из лимфоцитов, макрофагов) чередуются с грануляционной тканью, участками фиброза и отложении извести. Колонии бактерий среди некротических и тромботических масс обнаруживаются несколько реже, чем при остром инфекционном эндокардите. В результате процессов деструкции и склероза при инфекционном Э. образуется стойкая деформация пораженных створок клапанов с нарушением их функции (или усугублением имевшихся нарушений при вторичном эндокардите).
Фибропластический Э. характеризуется преобладанием процессов пролиферации и фиброза в пораженном эндокарде. Фиброз створок клапанов обычно наблюдается в исходе возвратно-бородавчатого Э. при ревматизме, иногда при системной красной волчанке и других Э. а как изначальный патологический процесс фиброзирующий вальвулит (чаще правой половины сердца) в сочетании с фиброзом хорд, приводящим к их укорочению и ограничению подвижности створок, наблюдается при карциноидном синдроме (см. Карциноид ). Париетальный фибропластический Э. характерен для поражения сердца при гиперэозинофилии (эндокардит Леффлера), острая фаза которого, проявляющаяся эозинофильными инфильтратами в миокарде и утолщением эндокарда с пристеночным тромбозом, сменяется в ряде случаев фазой хронического течения с прогрессирующим эндомиокардиальным фиброзом.
Неинфекционные эндокардиты во всех случаях не являются самостоятельной формой патологии. При ревматическом поражении сердца Э. составляет его непременную часть и не выделяется специально в формуле диагноза (поглощаясь в общепринятом более широком определении «ревмокардит»), но он указывается как осложнение в диагнозе тех заболеваний, при которых Э. не относится к обязательным проявлениям болезни, т.к. его возникновение в таких случаях может иметь важное самостоятельное значение для тактики лечения и прогноза болезни. В целом неревматические неинфекционные Э. встречаются редко, поэтому для врача общей практики важна лишь ориентация в патологии, при которой возникновение Э. вероятно и поэтому обязывает к целенаправленному его выявлению или исключению. К таким формам патологии относятся системная красная волчанка, коагулопатии (особенно сопровождающие кахексию), карциноид, системный эозинофильный васкулит; меньшее значение у взрослых имеет так называемый первичный фиброэластоз эндокарда (встречается редко).
Волчаночный эндокардит. или атипичный бородавчатый эндокардит Либмана — Сакса, выявляется примерно в 1 /3 случаев вскрытий умерших от системной красной волчанки. В основном поражается митральный клапан в форме краевого склероза створок с редким формированием клинически значимой митральной недостаточности или стеноза. Сочетанное поражение нескольких клапанов и пристеночного эндокарда, которое ранее считалось характерным для волчаночного Э. практически перестало встречаться.
Клиническими исследованиями показано, что чаще Э. развивается у больных с длительным периодом высокой степени активности основного заболевания и наличием симптомов поражения других оболочек сердца (волчаночного перикардита, миокардита) при малой выраженности других висцеральных проявлений болезни. Возникновение Э. следует предполагать при появлении систолического шума (иногда также нестойких диастолических шумов) в точках выслушивания митрального клапана. В лечебной тактике при появлении признаков поражения сердца основное внимание уделяется подавлению активности болезни рациональным сочетанием глюкокортикоидов и цитостатиков (см. Красная волчанка ).
Небактериальный тромботический эндокардит (называемый также кахектическим, марантическим, терминальным) развивается при тяжелых заболеваниях, сопровождающихся распространенной внутрисосудистой гемокоагуляцией, чаще на фоне кахексии у онкологических больных, при циррозах печени, лейкозах, реже при острых тяжело протекающих инфекционных процессах (массивная острая пневмония, перитонит), кардиогенном шоке; может сочетаться с тромбозами и тромбоэмболиями крупных сосудов. Характеризуется отложением на створках клапанов (преимущественно аортального и митрального) фибрина и тромбоцитов в форме разной величины бородавок (дегенеративный бородавчатый Э.) при незначительной воспалительной реакции в окружающей ткани что оправдывает мнение о более правильном обозначении этой формы поражения сердца как «небактериальный тромбоз эндокарда».
Прижизненная диагностика трудна из-за малой выраженности клинических проявлений. Появление систолического шума (над аортальным или митральным клапаном) отмечается менее чем у половины больных, однако и в этих случаях показания к специальным исследованиям не всегда представляются очевидными, т.к. аускультативная картина не соответствует типичным проявлениям определенного клапанного порока сердца. Обязывают предположить тромбоэндокардит (и подтвердить наличие изменений на створках клапанов с помощью эхокардиографии) наблюдаемые иногда тромбоэмболии большого круга кровообращения обусловленные отрывом тромбов с эндокарда. В таким случаях, особенно если тромбоэмболии сопровождаются лихорадкой, проводят дифференциальный диагноз с подострым бактериальным эндокардитом, против которого могут свидетельствовать кратковременность лихорадки, отсутствие других клинических, а также лабораторных признаков активного воспалительного процесса (если они не свойственны основному заболеванию) и отрицательные результаты посева крови.
Лечение собственно тромботического Э. специально не проводится; применение антикоагулянтов и дезагрегантов показано в периоды проявления коагулопатии и по отношению к Э. имеет не столько лечебное, сколько профилактическое значение.
Карциноидный фиброз эндокарда развивается при длительном течении (в случаях поздней диагностики) карциноидного синдрома у больных с гормонально-активной аргентаффиномой (потенциально злокачественная опухоль), выделяющей в кровь ряд биогенных аминов и других биологически активных веществ, часть из которых (вещество Р, нейрокинин А) стимулирует пролиферацию фибробластов, что становится причиной выраженного склероза соединительной ткани вблизи опухоли и соединительнотканных образований, омываемых оттекающей от опухоли кровью. При наиболее частой локализации опухоли в кишечнике, особенно при метастазах ее в печень, поражается главным образом эндокард правой половины сердца с формированием клапанных пороков; чаще в форме трикуспидальной недостаточности и стеноза легочного ствола. При этом эндокард левого желудочка либо остается интактным, либо поражение его, выявляемое примерно в 1 /3 таких случаев, мало выражено (обычно ограничивается склерозом створок аортального клапана), т.к. выделяемые опухолью в кровь биологически активные вещества в значительной мере инактивируются при протекании крови через легкие. Вероятность поражения эндокарда левых полостей сердца возрастает при наличии дефекта перегородок. Очень редко в связи с метастазами опухоли в легкие (в частности, при первичной локализации карциноида в бронхе) поражение эндокарда левой половины сердца преобладает.
Диагноз предполагают при возникновении шумов и других симптомов поражения трикуспидального клапана или клапана легочного ствола на фоне стойких (телеангиэктазии, пигментация кожи, энтеропатия) или более специфических пароксизмальных проявлений карциноида в виде периодических приступов вегетативной дисфункции, характеризующихся сочетанием бурных вазомоторных реакций (внезапное чувство жара и появление пятен гиперемии на коже лица и верхней половины туловища, резкое падение или, реже, повышение АД) с поносом, иногда с приступом удушья, кашля. Подтверждают диагноз обнаружением повышенной концентрации в моче 5-гидрооксииндолуксусной кислоты или серотонина в крови и топической диагностикой опухоли, а также данными эхокардиографии, указывающими на изменение створок клапанов и стенок правых полостей сердца.
Лечение направлено на основное заболевание; при эффективном хирургическом удалении опухоли может ставиться вопрос о показаниях к хирургической коррекции сформировавшихся клапанных пороков сердца.
Париетальный фибропластический эндокардит при эозинофильном васкулите клинически проявляется увеличением размеров сердца, тахикардией (в ряде случаев мерцательной аритмией), приглушением сердечных тонов, появлением систолического шума (при вальвулите), иногда «хордального писка» (вследствие поражения хорд атриовентрикулярных клапанов), у отдельных больных также тромбоэмболиями в связи с отрывом образующихся на эндокарде тромбов. Одновременно часто определяются признаки миокардита (нарушения проводимости, ритм галопа, изменения зубца Т и снижение сегмента ST на ЭКТ и др.), эозинофильные инфильтраты в легких и в других органах, а также выраженный эозинофильный лейкоцитоз с повышением содержания в периферической крови эозинофилов до 30—85% и появлением в ряде случаев их незрелых форм (лейкемоидная реакция эозинофильного типа). Диагноз не труден в острой фазе заболевания, сопровождающейся высокой эозинофилией, а при развитии сердечной недостаточности в поздних стадиях болезни характерными считаются изменения гемодинамики, специфичные для рестриктивной кардиомиопатии , и выявление с помощью эхокардиографии значительного утолщения эндокарда (чаще левого желудочка) и пристеночных тромбов.
Первичный фиброэластоз эндокарда (врожденный эндокардиальный фиброэластоз, фетальный Э.) характеризуется утолщением стенок сердечных камер (преимущественно левых) за счет увеличения коллагена и разрастания эластической ткани в эндокарде и гипертрофии прилегающего миокарда, что предположительно связывают с внутриутробной вирусной инфекцией. Проявляется нарушениями сердечного ритма, снижением пульсового АД, иногда появлением систолического шума, а также тахикардией, цианозом, отеками и другими симптомами сердечной недостаточности, которая развивается обычно вскоре после рождения ребенка (в первые 6 мес. жизни) и становится чаще всего причиной его смерти в ближайшие несколько недель или месяцев, если летальный исход не наступает внезапно от нарушения сердечного ритма или тромбоэмболии. При появлении первых признаков сердечной недостаточности у детей старше 6 мес. продолжительность жизни может достигать нескольких лет. У взрослых эта форма патологии описывается как казуистическая. Достоверный прижизненный диагноз очень труден, т.к. требует сложных исследований для исключения врожденных пороков сердца. Лечение только симптоматическое, направленное на уменьшение степени сердечной недостаточности.
Острый инфекционный эндокардит по этиологии, патогенезу и клиническим проявлениям имеет много общего с подострым бактериальным Э. что дало основание некоторым исследователям считать их лишь разновидностями течения одного заболевания. Действительно, в 70—80 гг. в 20 в. вероятно в связи с широким применением антибиотиков, различия между этими формами патологии сглаживаются. Однако сохраняются особенности происхождения и проявления, свойственные различиям между остро протекающим сепсисом, при котором поражение эндокарда является клинически важным, ко не обязательным и частным проявлением септического повреждения тканей, и затяжным сепсисом с Э. обособление которого основывается, в частности, на том, что эндокардиту (особенно в варианте вторичного Э.) может принадлежать роль непременного патогенетического фактора самого формирования болезни.
Этиология, патогенез, частота выявления бактериемии и первичного септического очага (значительно большая, чем при подостром бактериальном Э.), а также общие клинические проявления при остром инфекционном Э. в основном соответствуют таковым при остром сепсисе . Разнообразие выделяемых возбудителей, включая очень редкие (описан, например, легионеллезный острый Э.), весьма велико, однако преобладают по частоте высоковирулентные штаммы стрепто- и стафилококков, а также грамотрицательная микрофлора. Значительно чаще, чем при подостром бактериальном Э. поражаются интактные клапаны (первичный Э.) преимущественно правых полостей сердца, что особенно характерно для сепсиса наркоманов и генитального сепсиса.
В клинической картине доминируют общие проявления сепсиса: высокая лихорадка неправильного, гектического или тифоидного типа, сопровождающаяся периодическими потрясающими ознобами с обильным потоотделением, резко выраженная общая слабость, гипотония мышц, снижение АД, тахикардия, симптомы резкой степени угнетения ц.н.с. (вплоть до периодической полной утраты сознания), синдром диссеминированного внутрисосудистого свертывания (см. Тромбогеморрагический синдром ), септикоэмболии с гнойными метастазами в различных органах и др. В крови определяются значительный лейкоцитоз и выраженное повышение СОЭ. Признаки Э. появляются относительно рано и могут сочетаться с симптомами поражения миокарда и появлением преходящего шума трения перикарда (реже развивается гнойный перикардит). Иногда первым замечаемым признаком Э. являются тромбоэмболии в сосуды большого или малого (при поражении эндокарда правого желудочка) кругов кровообращения, но чаще о возникновении Э. свидетельствует появление шума недостаточности пораженных клапанов (трикуспидального, легочного ствола, аортального), интенсивность которого относительно быстро (в течение нескольких дней) может нарастать. В ряде случаев грубый или своеобразный по тембру систолический шум возникает внезапно, что позволяет предполагать разрыв хорды или прободение створки клапана, которые при остром инфекционном Э. отмечаются чаще, чем при подостром. Значительная деструкция створок клапанов может стать причиной быстрого развития сердечной недостаточности, особенно в случаях сочетания Э. с миокардитом.
Диагноз обосновывают ускоренной динамикой аускультативных признаков вальвулита на фоне картины сепсиса: характер поражения эндокарда уточняют с помощью эхокардиографии.
Лечение проводится по тем же принципам, что и при подострим бактериальном Э. См. также Сепсис .
Подострый бактериальный эндокардит соответствует заболеванию, которое во второй половине 19 в. выделено и описано как затяжной септический эндокардит — endocarditis septica lenta, или sepsis lenta. Долгое время оно рассматривалось как этиологически связанное только с зеленящим стрептококком, однако и при других видах бактериальных возбудителей болезнь формируется на принципиально единой патогенетической основе и несущественно различается в своих главных клинических проявлениях. За последние полвека отмечена явная тенденция к большему разнообразию этиологии, клинической картины, структуры заболеваемости по возрастам и других характеристик заболевания.
Из всех случаев инфекционного Э. наблюдаемого у взрослых относительно редко (не более, чем у 0.3% больных, лечащихся в стационаре), подавляющее их большинство — более 90% — приходится на подострый бактериальный эндокардит. Заболеваемость неодинакова в разные годы, отмечена тенденция к значительному ее повышению в периоды социального неблагополучия, как это наблюдалось, например, в первые послевоенные годы (заболеваемость возросла в 3—4 раза), особенно в перенесшем блокаду Ленинграде. Среди взрослых мужчин заболеваемость примерно в 2 раза выше, чем у женщин. До конца 40-х гг. заболевание возникало преимущественно у молодых людей, в форме главным образом вторичного Э. (частота заболевания у лиц старше 50 лет составляла лишь около 11% всех случаев), однако уже к 60-м гг. возрастные различия в заболеваемости сгладились, а в последующие 2 десятилетия возросла и частота первичного Э. (примерно до 1 /4 — 1 /3 всех случаев), что, возможно, в какой-то мере обусловлено не всегда четким клиническим различением подострого (затяжного) и острого сепсиса, значительно изменившего свое течение в связи с более широким и ранним применением антибиотиков. Для затяжного сепсиса остается все же более характерным вторичный Э. который у взрослых чаще всего развивается на фоне ревматических пороков сердца, реже на фоне врожденных пороков и весьма редко при атеросклеротическом поражении клапанов сердца. Новой и относительно нередкой патологией стали вторичные Э. после операций на сердце, в т.ч. после протезирования клапанов.
Этиология подострого бактериального Э. изменилась в направлении значительного расширения спектра возбудителей болезни, причем соотношение частоты обнаружения отдельных возбудителей в материалах разных исследователей колеблется в очень широких пределах. Так, за период между началом 80-х и началом 90-х гг. частота Э. вызванного зеленящим стрептококком (классический вариант sepsis lenta), в среднем оценивалась как соответствующая 30—40% (А.В. Сумароков, 1982). В настоящее время в качестве этиологических факторов инфекционного Э. описаны десятки микроорганизмов разных видов, включая грамотрицательную микрофлору, но наиболее частыми возбудителями подострого Э. кроме зеленящего стрептококка, являются стафилококки и энтерококк. Весьма редко встречаются Э. вызываемые грибковой флорой (аспергиллами, кандидами, криптококками и др.); они рассматриваются обычно как обособленная группа инфекционных Э. но по характеру клинических проявлений соответствуют в основном подострому септическому эндокардиту.
Патогенез подострого бактериального Э. считается недостаточно изученным и рассматривается главным образом с позиции особенностей взаимодействия микро- и макроорганизма, определяющих формирование затяжного сепсиса, повреждение эндокарда, а также характер патологических процессов в различных органах и тканях, обусловливающих внесердечные проявления болезни.
Попадание микробов на клапаны сердца, не имеющие собственной васкуляризации, возможно только из крови в сердечной полости, т.е. только при наличии бактериемии. Установлено, однако, что частота случаев периодической бактериемии, наблюдаемой примерно у трети больных с очагами хронической инфекции и в половине случаев после экстракции зуба, в сотни раз превышает частоту развития при этом сепсиса, т.к. при нормальном противоинфекционном иммунитете микробы, попавшие в кровь, достаточно быстро уничтожаются мононуклеарными фагоцитами в органах с преимущественной их концентрацией (лимфатические узлы, селезенка, костный мозг и т.д.). Сепсис возникает лишь в случаях, когда уровень бактериемии превышает способность иммунных механизмов се ликвидации, что может быть как следствием достижения некоторой критической массы инфекта в крови (например, за счет высокой обсемененности первичного очага), так и следствием иммунодефицита либо предшествующего заболеванию, либо возникающего при нем вторично из-за инфекционно-токсического поражения и истощения иммунной системы, что зависит от свойств возбудителя. Массивность бактериемии, вирулентность флоры и вторичные нарушения иммунитета имеют, вероятно, основное значение при остром сепсисе с определяемым первичным гнойным очагом. В то же время такой очаг значительно реже выявляется при затяжном сепсисе, который к тому же часто вызывается маловирулентной, по существу сапрофитной, флорой. Поэтому в развитии изначально хронического (подострого, затяжного) сепсиса резонно предполагать ведущую роль исходной иммунной недостаточности (например, врожденной, что отмечено в части наблюдений, или в связи с предшествующими заболеваниями, стрессами, гиповитаминозом и пр.) которая повышает вероятность возникновения сепсиса при любой бактериемии и развития при нем, как и при остром сепсисе, первичного эндокардита. Однако это условие не представляется столь же значимым для возникновения вторичного Э. на уже измененных структурах сердца, создающих завихрения крови, которые и являются главной причиной оседания и фиксации микробов на эндокарде. При этом сама локализация фиксированной флоры, отдаленная от активных зон системы мононуклеарных фагоцитов, препятствует быстрому уничтожению микробов. Это создает условия для роста на эндокарде, в частности на клапанах сердца, микробных колоний, которые вызывают местное инфекционное воспаление и начинают выполнять роль как бы первичного септического очага, поддерживающего бактериемию до тех пор, пока стимулированные ею разнообразные механизмы иммунной защиты не станут способными ликвидировать ее.
Иммунные реакции формируются на фоне сенсибилизации организма антигенами возбудителя, которая может предшествовать сепсису, происходя из действительно первичного инфекционного очага (например, в миндалинах), но со времени фиксации микробов и развития инфекционного воспаления в эндокарде она становится обязательным компонентом патогенеза болезни, причем сенсибилизирующими агентами, наряду с микробными антигенами, могут стать измененные инфекционным воспалением ткани (антикардиальные антитела обнаруживаются, по некоторым данным, у половины больных). К характерным проявлениям иммунных реакций в активной фазе подострого септического Э. относятся увеличение числа гистиоцитов в периферической крови, гипергаммаглобулинемия, поликлоновая иммуноглобулинемия, снижение титра комплемента. Особое патогенетическое значение имеет появление антител, с которыми связано образование циркулирующих иммунных комплексов, обнаруживаемых примерно у 90% больных и во многом определяющих системный характер поражения тканей и органов.
Патогенез повреждения эндокарда и других органов при септическом Э. формируют в основном три взаимосвязанных патологических процесса: инфекционный, иммуновоспалительный и тромбообразования. Последнему при вторичном септическом Э. способствует наличие всех трех основных факторов тромбоза: активация свертывающей системы крови (характерная для любого сепсиса), повреждение эндокарда и сосудистых стенок воспалением и замедление потока крови в местах его завихрений на измененных структурах эндокарда. Инфекционно-токсическое повреждение створок клапанов начинается с момента фиксации на них микробов и состоит в формировании микродефектов или изъязвлений на створках, что сопровождается нейтрофильной инфильтрацией ткани створок и образованием тромбов над язвенными дефектами. Тромбы стабилизируют флору на створках, уменьшая или устраняя при этом бактериемию, но способствуя местному активному росту микробных колоний, т.е. увеличению массы инфекта на створках и прогрессированию в них воспалительного процесса. Прорастание колоний на поверхность тромботических масс вновь сопровождается бактериемией и повторными тромботическими наложениями, рыхлые массы которых становятся источниками септических эмболов в микроциркуляторное русло различных тканей (где формируются очаги инфекционного воспаления), а иногда также крупных тромбоэмболов, служащих причиной инфарктов разных органов.
С появлением циркулирующих иммунных комплексов инфекционное воспаление дополняется иммунокомплексным повреждением эндокарда и базальных мембран сосудов (в т.ч. клубочков почек, где обнаруживаются иммунокомплексные депозиты) с формированием картины генерализованного васкулита (часто по типу болезни Шенлейна — Геноха). При этом в поврежденных сосудистых стенках и створках клапанов клеточная реакция представлена их инфильтрацией лимфоцитами, макрофагами, нередко с образованием псевдогранулем; появляются дополнительные отложения фибрина и тромботических масс, причем множественные микротромбозы в сосудистом русле часто сопровождаются коагулопатией, характерной для синдрома диссеминированного внутрисосудистого свертывания. Специфическим для подострого септического Э. хотя и встречающимся все реже, является образование в стенках сосудов микотических аневризм, разрыв которых может привести к кровотечениям. Иммуновоспалительное повреждение тканей может существенно превосходить инфекционное и быть причиной прогрессирования поражения эндокарда и внутренних органов на фоне успешной антибактериальной терапии, однако полная ликвидация инфекции обычно приводит к затуханию и иммуновоспалительного повреждения тканей.
Обусловленные васкулитом и микротромбозами нарушения микроциркуляции в разных органах сопровождаются ишемией их тканей и появлением очаговых некрозов, создающих предпосылки для образования вторичных септических очагов. В зависимости от преобладающего характера и локализации этих повреждений (в ц.н.с. и различных паренхиматозных органах) формируются соответствующие симптомокомплексы сосудистого поражения головного мозга или воспаления его оболочек, картина гепатита, очагового или диффузного гломерулонефрита, миокардита и т.д. В острой фазе повреждения органов отмечаются лихорадка, повышение в крови С-реактивного белка, СОЭ, серомукоида, при гепатите также билирубина, аминотрансфераз. Реакция органов системы мононуклеарных фагоцитов характеризуется их гиперфункцией и гиперплазией; часто отмечается увеличение селезенки. Индивидуальные различия в степени и соотношении инфекционного, иммуновоспалительного и тромботического процессов, а также преимущественной локализации повреждений в тех или иных органах обусловливает большое разнообразие внесердечных проявлений затяжного сепсиса при относительно однотипных признаках поражения клапанов сердца. В подавляющем большинстве случаев формируется (или усугубляется) недостаточность пораженных клапанов — у взрослых преимущественно аортального и митрального. Процесс деструкции створок может протекать очень быстро, что может, как и сопутствующий миокардит, стать причиной раннего развития сердечной недостаточности.
Клиническая картина складывается из общих проявлений инфекционного и иммуновоспалительного процесса, признаков поражения сердца, симптомов васкулита и септического либо тромбоэмболического поражения отдельных паренхиматозных органов.
В классическом варианте sepsis lenta проявляется высокой лихорадкой с ознобами и проливными потами либо периодическим их появлением на фоне субфебрилитета, нарастающими общей слабостью, похуданием, бледностью кожи, иногда желтизной (в связи с анемией, гемолизом) или приобретением ею цвета «кофе с молоком» (при длительной инфекционной интоксикации), болями в суставах (чаще мелких), постепенным изменением формы ногтей в виде часовых стекол и деформацией концевых фаланг пальцев по типу барабанных палочек, увеличением селезенки. Собственно Э. клинически выражается динамикой (при вторичном Э.) или появлением (при первичном Э.) сердечных шумов, причем в большинстве случаев отмечается картина развивающейся недостаточности аортального клапана. Проявления васкулита отличаются определенной специфичностью. Наблюдаются геморрагические высыпания на коже (иногда сливные) и слизистых оболочках, особенно на переходной складке конъюнктивы нижнего века (симптом Лукина — Либмана), появление петехий на коже после ущемления ее пальцами (положительный симптом щипка) или сдавления сосудов конечности жгутом либо манжетой (так называемый симптом жгута, или Кончаловского — Румпеля — Лееде симптом ), образование на кончиках пальцев, коже ладоней, подошв геморрагических пятен или безболезненных, размером до 5 мм кровоподтеков (пятна Джейнуэя) либо болезненных, величиной от пшена до горошины красноватых узелков — так называемых узелков Ослера (симптом считается патогномоничным для септического Э.), красно-коричневых полосок кровоизлияний под ногтями. Характерны признаки поражения почек (гематурия, протеинурия, цилиндрурия) и тромбоэмболические осложнения.
Описанная классическая картина бактериального Э. встречается в настоящее время редко. Изменился характер как общих проявлений сепсиса, так и частных признаков поражения сердца и других органов. Реже встречаются выраженные проявления септического процесса (лихорадка, ознобы, проливные поты, анемия), наблюдаемые главным образом при первичном Э. Начало вторичного Э. может быть представлено мало выраженными неспецифическими проявлениями инфекционной интоксикации в виде утомляемости, общей слабости, снижения аппетита и некоторого похудания на фоне субфебрилитета, который иногда носит лишь периодический характер. Острота течения стала в большей степени совпадать с проявлениями иммунокомплексной патологии — генерализованным васкулитом (в т.ч. с синдромом диссеминированного внутрисосудистого свертывания), артралгиями, артритами (чаще асимметричными), миалгиями на фоне лихорадки, в связи с чем первоначально ошибочно предполагаются активная фаза ревматизма, системная красная волчанка и другие диффузные заболевания соединительной ткани. Иногда при выраженной лихорадке длительно отсутствуют признаки поражения сердца.
Лихорадка при подостром септическом Э. чаще характеризуется неправильным типом температурной кривой, может быть также волнообразной, ремиттирующей. Петехий на коже и слизистых оболочках выявляются примерно у половины больных; узелки Ослера и пятна Джейнуэя в настоящее время почти не встречаются. Поражение сердца стало нередко проявляться сочетанием Э. с клинически выраженными признаками миокардита , в т.ч. ранней сердечной недостаточностью и аритмиями, считавшимися нехарактерными для септического Э.; возросла частота изолированного поражения митрального клапана и первичного Э. с вальвулитом правой половины сердца, хотя, как и прежде, аортальный клапан изолированно или вместе с митральным поражается чаще всего.
Самым ранним клиническим признаком поражения аортального клапана при первичном Э. считается систолический шум в точке Боткина — Эрба, появляющийся обычно через несколько недель от начала заболевания в связи с полипозными отложениями тромботических масс на створках. Позже появляется диастолический шум, интенсивность которого при неэффективном лечении относительно быстро возрастает, что сопровождается появлением периферических симптомов аортальной недостаточности, в частности снижения диастолического АД (см. Пороки сердца приобретенные ). Систолический шум возникает и при изолированном поражении митрального клапана, однако типичная аускультативная картина митрального порока формируется постепенно, и ранняя его диагностика возможна только с помощью дополнительных методов исследования. Редко наблюдается, но имеет большое диагностическое значение специфический для септического Э. симптом прободения створки клапана: внезапное появление музыкального систолического шума на верхушке сердца. Такое же диагностическое значение имеет внезапное появление грубого, обычно голосистолического, шума митральной недостаточности в связи с разрывом хорд; в таком случае появлению шума сопутствуют признаки острой левожелудочковой сердечной недостаточности вплоть до развития отека легких. Вторичный Э. проявляется только динамикой уже имевшихся аускультативных признаков порока, которую и интерпретировать значительно труднее, т.к. у больных с ревматическими пороками Э. и другие проявления болезни могут быть обусловлены активностью основного заболевания. При возникновении Э. на протезированных клапанах сердца аускультативная динамика может вообще отсутствовать, и клинически поражение эндокарда предполагается иногда только по появлению тромбоэмболических осложнений. Сопутствующий миокардит, связанный с поражением микрососудов миокарда (при вторичном Э. миокардит может быть ревматическим), проявляется чаще всего изменениями ЭКГ (в виде признаков атриовентрикулярной блокады, чаще I степени, и нарушений реполяризации) в сочетании с приглушением I тона сердца, иногда ритмом галопа. Более редкими проявлениями миокардита при септическом Э. бывают мерцательная аритмия и развитие сердечной недостаточности. Иногда при подостром бактериальном Э. отмечается преходящий шум трения перикарда — проявления фибринозного перикардита ; как казуистика встречается экссудативный, в т.ч. гнойный, перикардит.
Микотические аневризмы артерий (сонных, конечностей, аорты) обнаруживаются пальпаторно только при достаточно больших их размерах. Над крупными аневризмами определяется в ряде случаев систолический шум (см. Аневризма . Аневризма а орты ).
Поражение почек выявляется почти у всех больных септическим Э. в форме очагового или диффузного гломерулонефрита, а также тромбоэмболических инфарктов. Последние не всегда протекают клинически ярко, обнаруживаясь лишь в виде множественных мелких рубцов в почках при патологоанатомическом исследовании. В типичных случаях инфаркт почки проявляется возникновением острой боли в поясничной области, дизурией и гематурией, которые носят преходящий характер. Относительно устойчивые микрогематурия и малая протеинурия, исчезающие только в процессе эффективного лечения септического Э. характерны для очагового нефрита. При диффузном гломерулонефрите гематурия и протеинурия более выражены, отмечаются цилиндрурия, умеренное повышение АД, иногда небольшие отеки и лишь в редких случаях развивается выраженный нефротический синдром . В отдельных случаях формируется почечная недостаточность с тенденцией к прогрессированию.
Легкие поражаются чаще при вальвулите правых отделов сердца, когда тромбо- и септические эмболии в малый круг кровообращения обусловливают возникновение в легких инфарктов и пневмоний. Однако независимо от того, какие клапаны сердца поражены, возможно развитие иммунокомплексного легочного васкулита, проявляющегося пневмонитом, кровохарканьем.
Из изменений других внутренних органов наиболее часто определяется увеличение селезенки и печени. Отчетливо пальпировать селезенку в левом подреберье удается примерно у 1 /3 больных, перкуторно ее увеличение обнаруживается в большинстве случаев. Увеличение печени в части случаев сочетается с повышением в крови уровня трансаминаз, билирубина, иногда с появлением желтухи, которые указывают на развитие септического гепатита, протекающего обычно сравнительно легко и регрессирующею при эффективном подавлении септического процесса. В редких случаях наблюдаются септико-эмболические абсцессы печени.
Признаки поражения ц.н.с. обычно соответствуют ее угнетению в связи с инфекционной интоксикацией (заторможенность, интеллектуальная утомляемость, головная боль, бессонница и пр.). Возможны, однако, тромбоэмболия артерий головного мозга или разрыв их стенок вследствие септического некроза, а также септический процесс в микрососудах вещества головного мозга и его оболочек. В подобных случаях наблюдается клиническая симптоматика, соответствующая ишемическому или геморрагическому инсульту . энцефалитам . менингиту .
У пожилых лиц, которые стали заболевать инфекционным Э. чаще, отмечен ряд особенностей возникновения и проявлений болезни. У них чаще развивается первичный Э. и Э. на структурах сердца, измененных в связи с атеросклерозом, в т.ч. после инфаркта миокарда. Реже наблюдаются лихорадка, васкулиты, миокардит (при большей частоте развития сердечной недостаточности и аритмий смешанного происхождения); значительно чаще ведущими проявлениями болезни бывают тромбоэмболические осложнения.
Диагноз септического Э. из-за редкой встречаемости классической картины болезни в последние годы стал трудным, в связи с чем в большинстве случаев болезнь распознается поздно (через 6—12 мес. после начала). Устанавливают диагноз на основе данных широкого комплекса диагностических исследований, большая часть из которых возможна только в стационаре. На догоспитальном этапе предположить правильный диагноз удается главным образом при уже длительной (более 2 нед.) постоянной или периодической лихорадке, особенно протекающей с ознобами и обильной потливостью, если одновременно выявляются либо признаки васкулита (петехиальная и иная геморрагическая сыпь, положительные симптомы Лукина— Липмана и Кончаловского — Румпеля — Лееде), либо динамика сердечных шумов (или появление их впервые). Имеют значение обнаружения увеличенной селезенки и такие данные анамнеза, как наличие очагов хронической инфекции (например, в миндалинах, зубах), тем более предшествующее заболеванию их обострение либо выполнение экстракции зуба, внутривенных манипуляций, а также существование врожденного или приобретенного порока сердца. В подобных случаях амбулаторно произведенные анализы крови и мочи могут подкрепить предположительный диагноз, если обнаруживаются повышение СОЭ до 40—60 мм/ч. анемия, нейтрофилез (возможный на фоне как лейкоцитоза, так и лейкоцитопении), токсическая зернистость нейтрофилов, гематурия.
В условиях стационара наличие воспалительного процесса дополнительно подтверждается выявлением в крови С-реактивного белка повышения серомукоида, но диагноз болезни устанавливают по результатам специальных диагностических исследований, направленных, во-первых, на объективизацию наличия Э., во-вторых на доказательство его связи с сепсисом, а не другими заболеваниями (в порядке дифференциальной диагностики). Эндокардит подтверждают динамичностью (появлением) сердечных шумов, выявляемой аускультативно и с помощью повторных фонокардиографических исследований, и более достоверно обнаружением при эхокардиографии (в разных режимах) вегетаций на клапанах, хордах, разрывов хорд, перфорации створок, а также динамики (при повторных исследованиях) объема регургитации крови в процессе формирования недостаточности пораженного клапана. Косвенным подтверждением Э. являются повторные тромбоэмболии артерий большого круга кровообращения, (инфаркты печени, селезенки и т.д.). Тромбоэмболию легочных артерий (при Э. правых полостей сердца) труднее интерпретировать из-за более частой ее связи с тромбозом периферических вен, чем с эндокардитом.
Диагноз сепсиса обосновывают результатами иммунологических и бактериологических исследований. Для подострого септического Э. характерны диспротеинемия с повышением уровня g -глобулинов, положительные тимоловая и формоловая пробы, повышение содержания в крови иммуноглобулинов, в частности lgM, снижение концентрации комплемента, появление циркулирующих иммунных комплексов, антигенов возбудителя (стрептококка, стафилококка или др.) и противобактериальных антител, положительная проба Битторфа — Тушинского (повышение числа гистиоцитов в крови из мочки уха после ее легкого массажа); часто обнаруживается ревматоидный фактор. Важнейшее значение для доказательства бактериальной природы заболевания и установления этиологического диагноза сепсиса имеет выделение гемокультуры с последующим бактериологическим исследованием. При соблюдении ряда условий положительные результаты посева крови удается получить в 70—90% случаев. К этим условиям относятся: как можно более раннее (желательно до назначения антибиотиков), а затем повторное в каждый из последующих 3 дней взятие крови (при необходимости то же осуществляют после недельного перерыва в антибактериальной терапии); забор крови на высоте лихорадки (лучше всего во время озноба) одновременно в несколько пробирок (3—5) с оптимальным подбором питательных сред; длительное (3—4 нед.) содержание посева в термостате для выявления медленно растущих культур. До получения результатов посева высокую вероятность связи заболевания с бактериальной инфекцией может подтвердить положительный тест восстановления нейтрофилами больного растворимой краски нитроблуттетразолиум (НБТ) в преципитат формазина с появлением окрашенных (НБТ-позитивных) клеток. Тест считается положительным при наличии более 10% НБТ-позитивных клеток. Отрицательные результаты посева крови не исключают диагноз септического Э. в то же время получаемая гемокультура не во всех случаях соответствует возбудителю заболевания (возможен случайный занос микроба в питательную среду), поэтому этиологический диагноз обосновывается совокупностью данных повторных посевов, оценки спектра действия эффективных антибиотиков, а в ряде случаев также исследованиями наличия антител в крови больного к микробу из гемокультуры.
Дифференциальный диагноз очень труден у пожилых больных с нетипичным проявлением септического Э. под различными клиническими масками, в т.ч. под масками распространенных в этой возрастной группе заболеваний (ишемической болезни сердца, дисциркуляторной энцефалопатии, злокачественных новообразований, пиелонефрита и др.), с которыми септический Э. может реально сочетаться. В сомнительных случаях следует проводить пробную терапию антибактериальными средствами.
У молодых людей при высокоактивном течении заболевания с высокой лихорадкой, артралгиями, артритами, кожным васкулитом дифференциальный диагноз чаще всего проводится с активной фазой ревматизма (особенно при вторичном Э.) и системной красной волчанкой. Он основывается на оценке вероятности ряда симптомов при каждом из этих заболеваний и характерных для них особенностей результатов иммунологических и других специальных исследований (табл. ). Учитывается, в частности, что ознобы при лихорадке, спленомегалия, повторные тромбоэмболии, выделение гемокультуры, наличие циркулирующих иммунных комплексов с бактериальными антигенами. вегетации на клапанах и деструкция створок и хорд (по данным эхокардиографии), часто выявляемые при септическом Э. не характерны или отсутствуют при ревматизме и системной красной волчанке. С другой стороны, для септического Э. не характерны высокие титры антител к антигенам стрептококка, свойственные активному ревматизму, и высокие титры противоядерных антител, определяемые при системной красной волчанке. В ряде случаев существенно влияют на диагноз результаты пробной терапии антибиотиками и глюкокортикоидами: достижение ремиссии с помощью антибиотиков возможно только при бактериальном Э. в то время как при системной красной волчанке эффективны глюкокортикоиды, а при ревматизме также нестероидные противовоспалительные средства.
Таблица
Характеристика основных клинических данных, имеющих значение для дифференциальной диагностики септического эндокардита, активной фазы ревматизма и системной красной волчанки
Затяжной септический эндокардит
Затяжной септический эндокардит — это медленно развивающееся тяжелое заболевание эндокарда, сопровождающееся изъязвлением клапанов. Наиболее часто процесс локализуется на аортальных (до 40%) и на митральных клапанах (до 20%). Нередко отмечается изъязвление обоих клапанов. иногда вовлекается в процесс и трехстворчатый клапан. От острого септического эндокардита это заболевание отличается: 1) медленным началом и течением; 2) отсутствием первичного гнойно-септического очага; 3) наличием латентных очагов инфекции; 4) предшествующим поражением ревматическим процессом клапанного аппарата сердца.
Этиология и патогенез
При этом заболевании наиболее часто (60%) высевается из крови зеленящий стрептококк (Streptococcus viridans), реже энтерококки, белый и золотистый стафилококк. С увеличением числа резистентных штаммов стафилококков возрастает число стафилококковых эндокардитов.
Несмотря на то что некоторые звенья развития подострого септического эндокардита изучены не до конца, в настоящее время установлено, что для возникновения этого заболевания необходимо сочетание нескольких факторов: 1) септикопиемии; 2) сенсибилизации организма к патогенным бактериям; 3) нарушения структурной целостности эндокарда. Изменение эндотелиального покрова и деформация клапанов способствуют фиксации в них бактерий.
Патологическая анатомия
Затяжной септический эндокардит характеризуется наличием язвенного поражения эндокарда с тромботическими наложениями, имеющими полипозный вид, главным образом, на клапанах. Отмечено, что вначале возникают дистрофические изменения с последующим развитием воспалительной реакции. Изменения миокарда, наблюдаемые в большинстве случаев, характеризуются токсической дегенерацией мышечных волокон с множественными мелкими некрозами. Отмечаются изменения сосудистой системы, в наибольшей степени страдают стенки капилляров и мелких артерий, что приводит к нарушению проницаемости, разрывам, появлению кровоизлияний. Поражение почек может проявляться развитием очагового или диффузного нефрита, инфарктами. реже — развитием амилоидоза. В селезенке на фоне диффузной гиперплазии пульпы обнаруживаются инфаркты. Отмечаются значительные дистрофические изменения в печени с последующим развитием фиброза, изъязвления слизистой .оболочки желудка и кишечника.
Симптомы затяжного септического эндокардита
Начало заболевания почти всегда малозаметное, общее состояние больного ухудшается постепенно. Отмечаются легкая утомляемость, слабость, неприятные ощущения в области сердца, нерезкие и неопределенные боли в суставах. Так как у большинства больных имеется порок сердца, они и не предполагают возникновения новой болезни. В редких случаях заболевание проявляется остро: озноб, резкое повышение температуры, сердцебиение, боли в какой-либо части тела. Эти симптомы зависят от внезапно наступивших эмболии при латентно протекавшем эндокардите.
Лихорадка является наиболее постоянным симптомом; в виде редкого исключения она может отсутствовать у лиц старческого возраста. Повышение температуры вначале бывает незначительным. В дальнейшем температура становится высокой, неправильного типа, ремиттирующей или интермиттирующей. Нередко на фоне субфебрильной. температуры отмечается периодическое повышение температуры тела до 39° С и более, как правило, с ознобом и профузными потами. Часто отмечается познабливание, реже — выраженный озноб. Наряду с лихорадкой всегда прогрессирует анемия гипохромного типа. Кожа бледная, с желтоватым оттенком. Бледность кожи и слизистых оболочек может быть малозаметной при значительном цианозе. В большинстве случаев пальцы имеют вид барабанных палочек.
В большинстве случаев имеются признаки, клапанного приобретенного или врожденного порока сердца, предшествовавшие развитию септического эндокардита. Соответственно тому или иному пороку сердца отмечаются изменения размеров сердца и выслушиваются характерные шумы. С развитием заболевания характер последних изменяется, присоединяются функциональные шумы, вследствие вторичного расширения сердца и анемии и новые органические шумы вследствие подострых воспалительных изменений клапанов или даже их перфорации. Систолический и диастолический шумы при септическом эндокардите имеют непостоянный характер. В течение короткого периода они то усиливаются, то исчезают. Музыкальный шум внезапно появляется при разрыве хорды или клапана. Аортальные клапаны наиболее часто поражаются эндокардитом, поэтому обнаруживаются признаки недостаточности клапанов аорты. Размеры сердца еще больше увеличиваются вследствие сопутствующего миокардита. Нередко отмечается экстрасистолия. В ряде случаев можно обнаружить нарушение атриовентрикулярной и внутрижелудочковой проводимости. Мерцательная аритмия бывает реже, чем при стенозе левого предсердно-желудочкового отверстия. Заслуживает внимания то, что подострый эндокардит обычно возникает у лиц с хорошо компенсированным пороком сердца, поэтому вначале редко наблюдаются признаки недостаточности сердца. Она развивается только при прогрессировании поражения клапанов и сопутствующего миокардита. Шум трения перикарда обнаруживается очень редко, главным образом при уремии. Эмболия венечной артерии частицами эндокардиальных разрастаний сопровождается внезапным появлением ангинозных болей и шоком, который нередко оканчивается летально.
Одним из самых характерных проявлений септического эндокардита являются эмболии в малые или большие сосуды почек, мозга, селезенки, кожи, конечностей или желудочно-кишечного тракта с образованием инфарктов Внутренних органов и соответствующими симптомами внезапных осложнений болезни со стороны внутренних органов и нервной системы. Одним из частых проявлений септического подострого эндокардита является системное поражение сосудов (артериит и капиллярит). Почти во всех случаях можно обнаружить кровоизлияния в кожу, в виде изолированных петехий и распространенных кровоизлияний. Центр петехий нередко имеет белесоватый цвет. Они не возвышаются над уровнем кожи, как это бывает при остром септическом эндокардите. Иногда петехиальные высыпания бывают видны только на коже ног. Они могут исчезать и вновь появляться. Изредка кожные кровоизлияния бывают весьма распространенными. В этих случаях наблюдается тромбопения, удлинение времени кровотечения. Очень часто встречаются кровоизлияния в конъюнктиву (признак Лукина) нижнего века. Могут быть кровоизлияния в слизистую оболочку полости рта, особенно в мягкое и твердое небо. Диагностическое значение имеет появление болезненных поражений кожи — узелков Ослера, цианотично-красного цвета узелков величиной с булавочную головку и более, которые появляются на пальцах, на ладонях или подошвах. Их возникновение сопровождается острой болью, через 2—3 дня узелок рассасывается. Иногда отмечаются узелковые изменения кожи в виде эритематозных или геморрагических безболезненных поражений. Описаны кровоизлияния под ногтями в виде геморрагических полосок. Точечные кровоизлияния в кожу можно воспроизвести при повышении венозного и капиллярного давления путем наложения манжетки или жгута (симптом Кончаловского—Румпеля—Лееде). Хрупкость капилляров обнаруживается также после легкой травмы кожи (симптом щипка).
Могут наблюдаться симптомы, вызванные эмболией и инфарктом легких, а также застоем в Малом круге кровообращения. Плевральный выпот встречается реже. Может развиться геморрагический экссудативный плеврит при инфарктной пневмонии. При пальпации живота почти всегда удается обнаружить увеличенную плотную селезенку, иногда она достигает значительной величины. При инфаркте селезенки и перисплените возникают боли в области левого подреберья и шум трения брюшины. Очень часто определяется увеличение печени вследствие развития токсического гепатита и застоя крови.
Поражение центральной нервной системы связано с развитием артериита или эмболии сосудов мозга. Эмболии крупных сосудов вызывают параличи, потерю сознания, иногда являются причиной внезапной смерти. В некоторых случаях в результате множественных бактериальных эмболии и артериита развивается картина диффузного менингоэнцефалита (затемнение сознания, сонливость, головокружения, диплопия, мышечные подергивания).
Гипохромная анемия является постоянным признаком эндокардита. В ряде случаев количество эритроцитов уменьшается до 3 ДО12 л (3 ООО ООО). Отмечаются тромбопения и увеличение СОЭ. Количество лейкоцитов нормальное или у верхней границы нормы. Однако после эмболических инфарктов наблюдается лейкоцитоз со сдвигом лейкоцитарной формулы влево. Нередко встречаются выраженный моноцитоз и появление в крови макрофагов или гистиоцитов. Важным диагностическим тестом является увеличение количества этих клеток после разминания мочки уха перед взятием крови (признак Битторфа—Тушинского). Очень часто бывают положительными сулемовая, формоловая, золотоколло-идальная и тимоловая реакции. Содержание а2 и углобулиновой фракций белка в сыворотке крови повышено. Реакция Вассермана может быть положительной. В 70% случаев из крови высевается возбудитель болезни.
В отличие от активного ревматического процесса титры антигиалуронидазы и антистрептолизина О чаще бывают нормальными.
Альбуминурия и гематурия обнаруживаются почти во всех случаях. Макрогематурия наблюдается при более или менее значительной эмболии в сосуды почек. Однако чаще выявляется микрогематурия, протеинурия, цилиндрурия. Вместе с развитием очагового нефрита и особенно подострого диффузного гломерулонефрита прогрессирует недостаточность почек: снижается относительная плотность мочи вплоть до изостенурии, нарастает азотемия и нередко наступает уремия, приводящая больных у смерти.
Течение
Продолжительность заболевания — от нескольких месяцев до 5—8 лет. Периоды обострения чередуются с ремиссиями. В основном встречаются три варианта течения: 1) безлихорадочная форма; 2) торпидная — доброкачественная форма с небольшим повышением температуры и медленным течением; 3) под-острая форма—с высокой температурой, значительной анемией, геморрагиями, эмболиями. Более тяжело протекает первичная форма sepsis lentae с развитием тромбоязвенных поражений неизмененных ранее клапанов. Септический эндокардит, развивающийся у больных с ранее измененным клапанным аппаратом, протекает более мягко и принимает торпидное течение. К этой же вторичной форме можно отнести развитие sepsis lentae у больных с врожденными пороками, артериовенозными аневризмами. Безлихорадочная форма sepsis lentae давно известна клиницистам. Она характеризуется преобладанием симптомов сепсиса. У больных отмечаются склонность к тромбозам и эмболиям, прогрессирование поражения почек с выраженной гипертонической реакцией. Увеличение числа случаев латентно протекающего септического эндокардита за последнее время объясняется, по-видимому, изменением реактивности организма и широким применением антибиотиков в дозах, недостаточных для ликвидации септического процесса.
Диагноз и дифференциальный диагноз
Важным фактором в диагностике является обнаружение в крови патогенных микроорганизмов. Наиболее чувствительным методом выявления возбудителя является биологический метод вну-трибрюшного заражения белых мышей кровью больного, что позволяет установить характер возбудителя в 90% случаев.
При наличии типичной клинической картины sepsis lentae установление диагноза не вызывает затруднений. В случаях развития первичного эндокардита диагноз затруднен, так как в начале заболевания отсутствуют симптомы поражения клапанного аппарата сердца. Необходимо отличать sepsis lentae от ревматического эндокардита, при котором отсутствуют ознобы, гектическая температура, профузные поты, анемия, упорная гематурия, увеличение селезенки, увеличенное СОЭ. Обнаружение в начале заболевания перикардита и других проявлений полисерозита, поражения суставов и хороший результат противовоспалительной терапии свидетельствуют в пользу ревмокардита.
В редких случаях, при сочетании ревмокардита и sepsis lentae, могут отмечаться признаки обоих заболеваний.
Диагностические трудности представляет затяжной септический эндокардит у больных с открытым боталловом протоком, при травматических артериовенозных аневризмах, когда активный септический очаг локализуется не на клапанах, а в местах сосудистых дефектов. Он может возникать и в пораженной сифилисом или атеросклерозом аорте или легочной артерии.
В некоторых случаях необходимо дифференцировать sepsis lentae и системную красную волчанку, протекающую с гектической лихорадкой, ознобами, поражением суставов, сердца, с увеличением селезенки. Однако специфические кожные проявления, особенно на лице, обнаружение в крови «волчаночных клеток», отсутствие эффекта от антибиотикотерапии решают вопрос в пользу системной волчанки. Дифференциальный диагноз с бруцеллезом не вызывает затруднения, так как при последнем заболевании не наблюдается порока сердца, поражения почек, анемии, мало изменены осадочные реакции, посев крови и положительны проба Бюрне и реакция Райта—Хеддльсона.
Лечение затяжного септического эндокардита
Лечение подострого септического эндокардита должно быть своевременным и комплексным, проводиться в условиях стационара и включать: 1) антибактериальную, 2) антивоспалительную, 3) кардиотоническую, 4) дезинтоксикационную, 5) метаболическую и 6) антианемическую терапию.
Общие принципы антибактериальной терапии следующие: рекомендуется вводить большие дозы антибиотиков широкого спектра действия в зависимости от чувствительности патогенного микроорганизма: полусинтетические пенициллины, тетрациклины, цефалоспорины, аминогликозиды. При малой чувствительности к одному антибиотику или высеванию из крови двух возбудителей рекомендуется комбинация одного из первых трех групп с аминогликозидами. При стафилококковом эндокардите рекомендуются комбинация метациклина или оксациллина с ампициллином или цепорином, стафилококковый анатоксин, аутовакцины и т. д. Хороший эффект отмечен при присоединении к антибиотикам сульфаниламидов длительного действия (сульфадиметоксина) с триметопримом. Присоединение указанных препаратов показано при снижении дозы антибиотиков, плохой их переносимости, развитии кандидомикоза. Антибиотикотерапию отменяют не раньше чем через 20—60 дней после нормализации температуры и стабилизации состояния, возможно на фоне приема сульфаниламидов. При клинической картине эндокардита необходимо применение антивоспалительной терапии (салицилаты, пирамидон, бутадион, индометоцин, бруфен и т. д.) и по показаниям— стероидов (преднизолон, триамцинолон, урбазон и т. д.), поскольку последние уменьшают воспалительную реакцию и блокируют аллергический компонент. Кардиотоническая терапия при явлении сердечной недостаточности проводится осторожно во избежание возникновения эмболии. При нарушении водно-электролитного обмена назначают салу ретин, спиролактоны. При развитии анемии показано применение лекарственных средств, содержащих железо в сочетании с витаминами С, группы В, возможно переливание цельной крови или эритроцитарной массы, если к этому нет абсолютных противопоказаний. Необходимо проводить общеукрепляющую и симптоматическую терапию.
Прогноз
Широкое применение антибиотиков, сульфаниламидов, нитрофуранов позволяет добиться излечения более чем 60% больных подострым септическим эндокардитом. Обострение может наступить через 4—6 нед после прекращения лечения. Это обосновывает необходимость длительной пролонгированной терапии антимикробными препаратами.