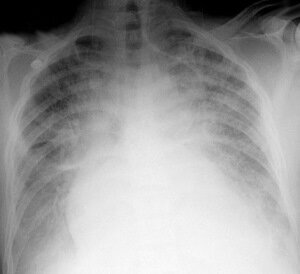
Причины отека легких
Нарушение нормального газообмена в легких и, как следствие, скопление жидкости может быть вызвано двумя основными причинами: физиологической и медикаментозной.
Физиологическая причина заключается в следующем: проведение операции на органе, влияющем на малый круг кровообращения, снижает интенсивность кровотока по нему, застаивание крови приводит к проникновению жидкой составляющей крови через стенки сосудов в легочные альвеолы.
Медикаментозная причина: в послеоперационный период проводится прием медикаментов, некоторые имеют негативное влияние на соотношение между внутрилегочным давлением и гидростатическим давлением капилляров в легких.
Возможно нарушение нормы коллоидно-осматического давления крови из-за нахождения в ней медикаментозных препаратов. Как результат — нарушение газообмена и отек легких.
Симптомы отека легких
Как правило, симптомы легочного отека после операции проявляются внезапно. Появляется затрудненное дыхание, повышается частота вдохов и сердечных сокращений, характерен сухой непродуктивный кашель.
Даже в полусидящем положении облегчения дыхания не происходит. Через некоторое время после первых проявлений симптомов происходит откашливание пенообразной массы.
Лечение послеоперационного отека легких
Терапевтические меры проводятся в нескольких направлениях:
- приведение в норму соотношения давления в газовой среде респиронов и в мелких кровеносных сосудах;
- блокировка процессов, приводящих к пенообразованию и гипоксемии;
- угнетение возбужденного состояния и уменьшение гиперактивности симптоадреналовой системы;
- снижение нагрузки малого круга кровообращения и легких жидкостью.
Все эти мероприятия проводятся в условиях клиники и под присмотром медработников. Для уменьшения пенообразования часто применяют вдыхание паров этилового спирта через ингалятор. Соотношение давлений выравнивается наркозным аппаратом под определенным давлением.
Возбужденное состояние снимается введением внутривенно успокоительных препаратов — мидазолама, сибазона, дроперидола или натрия оксибутирата. Самый простой способ снижения нагрузки на малый круг — наложение венозных жгутов или пневмоманжетов.
ПОСЛЕОПЕРАЦИОННЫЙ ОТЕК ЛЕГКИХ
Отек легких (ОЛ) во время и после хирургического вмешательства еще недавно считался одним из наиболее тяжелых осложнений, легочным проявлением сердечной недостаточности или гиперинфузии. Его возникновение обусловлено переходом жидкой части крови из легочных капилляров в воздухоносные пространства респиронов в связи с изменением нормальных соотношений между гидростатическим давлением в капиллярах и противоположно действующим внутрилегочным давлением, а также коллоидно-осмотичским давлением крови.
В результате существенных изменений этих факторов, уменьшается градиент давлений между микрососудами легких и газовой средой диффузионной зоны легких, которая, по сути, представляет легочный интерстиций.
Повышение проницаемости альвеолокапиллярной мембраны под воздействием различных гуморальных факторов осложненного послеоперационного периодах (БАВ, другие ЭТС), а также применение длительной аспирации из бронхиального дерева в ходе его санации, способствует начальному переходу внутрисосудистой жидкости, содержащей белок, в газовую среду легких. Вода на поверхности легочной диффузионной мембраны устраняет поверхностно-активные свойства сурфактанта легких (Johnson J.W.C. et al. 1964), что резко снижает податливость легких и повышает энерготраты на дыхание.
Переход значительных количеств поверхностно-активного фосфолипида и белка в выпотевающую в просвет респиронов жидкость способствует образованию стойкой пены, заполняющей воздухоносную зону легких, что и считается проявлением альвеолярного OJI (Luizada А.А. 1965). Заполнение воздухоносных путей пеной еще больше нарушает распределение газа и в легких и предельно снижает эффективность легочного газообмена при значительном возрастании энерготрат на дыхание.
Конкретный генез раннего послеоперационного ОЛ сложен. Гиперактивация симпатоадреналовой системы, особенно при недостаточном обезболивании, увеличение уровня так называемых травматических медиаторов и МСМ, острое снижение КОД крови под влиянием избыточной инфузии солевых растворов на фоне дефицита плазменного альбумина, непосредственное влияние гипоксии и венозной гипоксемии, ацидоза, гипереферментемии на проницаемость легочных капилляров в сочетании со снижением производительности сердца, — могут комбинироваться в каждом конкретном случае ОЛ после операции в различных сочетаниях.
Сейчас большинство реаниматологов склоняется к представлению, что гемодинамические причины раннего ОЛ играют существенную роль только у пациентов с исходным токсическим или метаболическим повреждением миокарда, сопутствующим клапанным пороком сердца или прямой травматизацией миокарда во время кардиохирургического вмешательства.
Нередко острая гипертензия малого круга кровообращения развивается вторично и может быть связана с прямым повреждением факторами ОДН (гипоксемия, гиперкапния, ацидоз) инвалидной сердечной мышцы. Это расстройство четко проявляется на фоне повышенного системного сосудистого сопротивления в связи с низким ОЦК или, наоборот, высоким АД крови в большом круге кровообращения, что может быть реально в ближайшем послеоперационном периоде. Ранние клинические наблюдения легочных хирургов А.Д. Ярушевича (1955), И.С. Колесникова (1960) подчеркивают, что развитие ОЛ обычно совпадал с периодом наибольшей нестабильности легочного газообмена у таких больных: после резекции легких он возникал в первые часы и не позднее первых суток после вмешательства.
Более поздние послеоперационные OJI развиваются не только на фоне гемодинамических расстройств (со значительным снижением МОК), которые сопровождает другие послеоперационные осложнения, такие как двусторонняя пневмония или пневмония единственного легкого, острый инфаркт миокарда.
Нередко OJI становятся финалом тяжелой белковой недостаточности с предельной гипопротеинемией, инфекционно- воспалительного эндотоксикоза, или декомпенсации сопутствующей гипертонической болезни на фоне нарушения мозгового кровообращения. Такие OJI развиваются медленно, через стадию интерстициального отека с задержкой жидкости в перибронхиальной ткани. Интенсивность накопления воды в легких во многом зависит от величины системного АД (гипертонический криз) в связи с увеличением скорости фильтрации тканевой жидкости из системы бронхиальных сосудов (Симбирцев С.А. Сериков В.Б. 1985).
Клиника и диагностика. Во многих случаях начальная стадия послеоперационного OJI возникает внезапно. Лишь иногда ей предшествует типичный синдром в виде чувства давления за грудиной, ощущения нехватки воздуха и особенно сухого непродуктивного кашля. Но вскоре пациент принимает положение ортопноэ. Вдох затруднен, требует значительного физического усилия, тахипноэ более 40 в мин. При аускультации дыхание над легкими вначале жесткое, нередко сопровождается непродуктивным кашлем. При этом нарастает тахикардия, несмотря на отсутствие причин для гиповолемии. Подъем системного АД, а иногда и ЦВД, а также умеренное расширение зрачков, свидетельствующее об избыточной активации симпатоадреналовой системы и дополняют картину осложнения.
На фоне развернутой стадии ОЛ над легочными полями при перкуссии выявляется высокий тимпанит, особенно над их верхними отделами, прослушивается огромное количество влажных хрипов, которые иногда слышны на расстоянии. Тоны сердца такого больного едва различимы. Дыхание быстро становиться клокочущим с отхождением белой, желтоватой или розовой пенистой мокроты, количество которой в течение 1-2 ч может достигать 2-3 л.
В терминальной стадии OJI на фоне спутанного или утраченного сознания, цианоза кожных покровов, клокочущего дыхания, иногда агонального типа и выделения большого количества мокроты регистрируется предельная тахикардия (140-180 сокращений в мин), а иногда, наоборот, брадикардия, регистрируется неустойчивое системное АД на фоне стойкого и значительного повышения ЦВД.
При пульсоксиметрии и лабораторном контроле в начальной стадии ОД артериальная гипоксемия сочетается со значительной гипокапнией, а в терминальной — гипокапния незадолго до смерти сменяется гиперкапнией. При рентгенологическом контроле легких негомогенное затенение, регистрированное ранее в нижних отделах легких, постепенно заполняет все легочные поля. Если у данного больного для интенсивного наблюдения за состоянием гемодинамики катетеризирована легочная артерия или есть возможность использовать такой доступ для мониторинга по мере надобности (через центральный венозный катетер), исследуют легочное капиллярное давления (давление заклинивания). На высоте истинного альвеолярного OJI оно оказывается выше 28-30 мм рт.ст.
Лечение.
Основные направления терапии послеоперационного ОЛ состоят в лечебных мероприятиях, обеспечивающих несколько направлений лечебного воздействия:
— восстановление обычного соотношения давлений в легочных капиллярах и газовой среде респиронов;
— устранение пенообразования и гипоксемии;
— снятия возбуждения и гиперактивности симпатоадреналовой системы;
— уменьшение перегрузки малого круга и легких жидкостью;
эти воздействия дополняют мероприятиями по уменьшению гидратации плазмы и восстановлению КОД, нормализации проницаемости альвеолокапиллярной мембраны.
Ингаляция О2 через наркозный аппарат под давлением 10-15 мм рт.ст. (14-20 см вод. ст.) или другое устройство, обеспечивающее СД с ПД применяется в тех случаях OJI, когда осложнение имеет преимущественно гемодинамический генез. Чрезмерное повышение давления в дыхательных путях (выше 18-20 мм рт. ст.) недопустимо, так как значительное сопротивление току крови в легочных капиллярах и нарушение заполнения правого предсердия усиливают гемодинамические расстройства у таких пациентов.
Нередко лечение OJI начинают с устранения пенообразования и восстановления активности легочных сурфактантов. Наиболее доступным для этой цели считается вдыхание паров этилового алкоголя, которые получают пропусканием 02 через 96°"й этанол, налитый в обычный барботажный увлажнитель. Такую обогащенную этиловым спиртом и кислородом газовую смесь подают больному через носоглоточные катетеры.
Продолжительность сеанса такой ингаляции 30-40 мин с 15-20 мин перерывами. При использовании кислородно-воздушной смеси во время СД с ПД этанол заливают в испаритель наркозного аппарата. Реже, в более трудных условиях, просто вливают шприцом 2-3 мл этилового алкоголя в трахею проколом щитовидно-перстневидной связки, особенно, если сознание больного заторможено. Возможно также использование ингаляций аэрозоля 20-30% водного раствора этанола, создаваемого ультразвуковым туманообразователем.
Эффективнее всего гасит легочную пену производное полисилоксана — антифомсилан. Эффект пеногашения в таких обстоятельствах зависит от соблюдения основных условий его применения: быстрая назотрахеальная аспирация пены из трахеи и постепенная адаптация к вдыханию препарата. Оксигенотерапия с пеногашением антифомсиланом за 15-20 мин позволяет уменьшить явления выраженного альвеолярного OJI, что по праву позволяет относить это средство к специфическим аналептикам.
Быстрое купирование альвеолярного OJI позволяет в спокойной обстановке провести необходимое обследование больного и установить с определенной долей вероятности причину осложнения. Адинамичные больные переносят ингаляцию антифомсилана легко; у резко возбужденных — ингаляция пеногасителя затруднена и потому малоэффективна.
Психическое возбуждение на этом этапе устраняют внутривенным введением мидазолама (дормикум, флормидал) по 5 мг, реже сибазона (до 0,5 мг/кг МТ больного), натрия оксибутирата (70-80 мг/кг МТ), еще реже дроперидола (до 0,2 мг/кг МТ) или 2-3 мл таламонала у взрослых пациентов, дополняя седацию антигистаминными Н-блокаторами (димедролом, дипразином).
Давняя рекомендация использовать на фоне развернутой картины OJI у ажиатированных больных морфин внутривенно имеет достаточные функциональные основания: кроме необходимой в таких случаях седатации, этот опиат в дозе 10-20 мг вызывает повышение тонуса дыхательных бронхиол, создавая более высокий уровень давления в диффузионной зоне легких.
Антигистаминные препараты оказывают и патогенетическое действие, а именно уменьшают проницаемость альвеолокапиллярной мембраны. Для чего также назначают ГКС (преднизолон, дексометазон), витамины Р и С в значительных дозах, а также 30% раствор мочевины из расчета 1-1,5 г/кг МТ больного.
Инфузия раствора лиофилизированной мочевины (при отсутствии азотемии!) в отличие от вливания маннитола или сорбитола не создает перегрузки сосудистого русла, хорошо переносится больными и не только уплотняет альвеолокапиллярную мембрану легких, способствует резорбции в кровь отечной жидкости, но и оказывает положительное инотропное действие на миокард.
Избыточный внутрисосудистый объем жидкости уменьшают салуретиками (40-60 мг лазикса, 20 мг уната, 1-2 мг буфенокса внутривенно) в сочетании с мерами, снижающими приток крови к правому сердцу:
— наложение венозных жгутов (лучше пневматических манжет) на конечности на 25-30 мин;
— управляемая гипотония (арфонадом, нитроглицерином, реже пентамином), особенно при гипертензионной реакции АД на фоне OJI;
— распространенная блокада местными анестетиками при наличии у больного катетера в эпидуральном пространстве, поставленного с другими целями.
Действие салуретиков, особенно лазикса, определяется не только их диуретическим эффектом: нередко явления OJI стихают еще до того, как проявиться мочегонное действие препарата. При высоком гематокрите особенно показано кровопускание с заготовкой аутокрови на цитратном консерванте и заменой части удаляемой крови на онкотически активные кровезаменители.
При наличии данных о гипергидратации организма на фоне нормального или сниженного внутрисосудистого объема и гипоальбуминемии желательно использовать и концентрированные белковые кровезаменители с последующей легкой вазоплегией. Решающий эффект для выведения больного из OJI, особенно резистентного к обычной терапии, иногда оказывает ГФ (реже изолированная ультрафильтрация крови). Она показана при низком показателе гематокрита и отчетливых признаках гипергидратации тканей с высоким показателем волдырной пробы.
Нередко, исходя из «дыхательного» генеза раннего OJI, при прогрессировании дыхательной недостаточности (тенденция к гиперкапнии, смешанный ацидоз, развитие отек-пневмонии), спутанности сознания следует принимать решение о переводе больного на контролируемую ИВЛ в режиме ПерПД (Castanig G. 1973) с использованием для эндотрахеальной интубации мидазолама, препаратов диазепама, рогипнола или стероидных анестетиков (альтезин).
Возникновение ОЛ в позднем послеоперационном периоде обычно происходит на фоне персистирующего другого легочного или внелегочного жизнеопасного осложнения: пневмонии, коматозного состояния, сепсиса и др.
В этих случаях предпочтение должно быть отдано контролируемой ИВЛ с ПДКВ (Кассиль В.Л. Рябова Н.М. 1977) в редком ритме (14-18 циклов в мин) с высоким ДО (не менее 700 мл у взрослого пациента) и высоким Fi02, которое снижают по мере разрешения артериальной гипоксемии.
Такой режим позволяет добиваться эффективной оксигенации крови в легких и резорбции отечной жидкости с поверхности легочной диффузионной мембраны, уменьшает наполнение легочного кровеносного русла и снижает энергозатраты больного на вентиляцию, чего не может обеспечить любой метод СД в режиме ПД. В таких случаях исчезает необходимость в отсасывании пенистой жидкости из воздухоносных путей. Терапию позднего послеоперационного OJI с применением ИВЛ с ПДКВ следует дополнять мероприятиями по повышению КОД плазмы крови, стабилизации сократительной способности миокарда, предупреждению легочной инфекции.
Иногда клиническая картина, напоминающая ОЛ, может явиться следствием так называемой «молчащей» регургитации, частота которой может составлять 8-15% ко всем больным, оперированным в условиях общей анестезии с выключением защитных глоточно-гортанных рефлексов (Blitt et al. 1970; Turndorf et al. 1974). Регургитация желудочного содержимого наиболее часто возникает в экстренной абдоминальной хирургии, при ограниченности возможности подготовки ЖКТ, но может возникать и у пациентов, достаточно хорошо подготовленных к плановым операциям.
«Молчащей» регургитации способствует затрудненный выдох с повышением внутрибрюшного давления, эзофагоэктазия или большой дивертикул пищевода, а также применение деполяризующих миорелаксантов для интубации трахеи без специальных мер для предотвращения фибрилляции произвольных мышц при введении в анестезию, например, использование прекураризации с помощью нерелаксирующей дозы одного из недеполяризующих релаксантов (павулон, ардуан).
Послеоперационный отек легких. Эмболии легочной артерии после операции
Начинающие торакальные хирурги нередко принимают за отек легких задержку мокроты при затруднении откашливания ее в первые дни после операции. Если при резекции легкого бронхоэктазы удалены только частично, что особенно часто наблюдается при двухсторонних поражениях, то больной продолжает отделять мокроту, а откашлять ее не может из-за слабости кашлевого толчка и болевых ощущений.
В результате мокрота накапливается в крупных бронхах и трахее и дает картину клокочущего дыхания. Его слышно на расстоянии, а при аускультации оно проявляется в виде крупнопузырчатых влажных хрипов больше по средней линии груди. Чтобы освободить дыхательные пути от гноя, нужно создать дренажное положение: поднять таз, а верхнюю половину туловища больного и голову спустить к кровати так, чтобы угол наклона туловища к горизонтали достигал 45—60°.
Не обращая внимания на стоны больного, нужно заставить его энергично откашляться в таком положении и после того, как отойдет несколько крупных плевков мокроты, дыхание сразу становится свободным и все явления «отека легких» исчезают. Еще лучше отсосать мокроту через бронхоскоп.
К сожалению, это осложнение может закончиться не столь безобидно, если в оставшемся легком имеется большой активный гнойный очаг. В начале 1950 года один наш больной буквально захлебнулся мокротой, выделявшейся из бронхоэктазов второго легкого, которым мы не придали должного значения до операции.
Этот случай послужил нам хорошим уроком на будущее в отношении строгой проверки «здорового» легкого и необходимости предоперационной подготовки для ликвидации бронхитов.
Эмболии легочной артерии за последние годы все чаще фигурируют в статистиках зарубежных хирургов как одна из причин смерти после резекции легких. Они постепенно выходят на одно из первых мест, поскольку другие смертельные осложнения встречаются все реже и реже.
Патогенез тромбоэмболии до сих пор недостаточно выяснен. По данным Б. К. Осипова, Г. Ф. Николаева и нашим собственным наблюдениям, эмболии легочной артерии чаще встречаются у пожилых людей, после особенно сложных и продолжительных операций, и у больных с низкими функциональными показателями сердечно-сосудистой и дыхательной систем.
В отечественной литературе описаны лишь единичные случаи эмболии легочной артерии после операций на легких. У Б. К. Осипова умер один больной от этого осложнения. Г. Ф. Николаев указывает на случай тромбоэмболии после тяжелой операции пневмонэктомии, окончившейся также смертью больного. В институте А. В. Вишневского (А. И. Смайлис) было восемь больных с тромбоэмболией легочной артерии после операций на легких, из них шесть умерли.
При этом лишь один больной погиб от хронического нагноительного заболевания, а семь — при операциях по поводу рака легкого.
В большинстве случаев эмболии легочной артерии развиваются внезапно, среди относительного благополучия. Реже они осложняют сердечно-легочную недостаточность. Сроки развития — первая неделя после операции.
Оглавление темы «Послеоперационный период легочных операций»: