Произошла ошибка. Приносим свои извинения.
© Электронное издание «Наука и технологии России».
Публикуется с 2004 года при поддержке Министерства образования и науки РФ. Издатель ООО «Парк-медиа».
Применение стволовых клеток в борьбе с сердечной недостаточностью, в ее хроническом протекании, нацелено на ликвидацию непосредственных причин, приводящих к заболеванию
Лечение стволовыми клетками — heart-disease.ru — 2012
 Хроническая сердечная недостаточность — состояние, когда нормальная жизнедеятельность человека затруднена, сердце неспособно снабдить организм достаточным количеством крови. Такое состояние развивается вследствие слабых усилий мышцы сердца по выбрасыванию крови из левого желудочка. День ото дня ткани и органы недополучают жизненно необходимые питательные вещества и кислород. Провоцировать такое состояние может ослабление самого миокарда, сердечных клапанов, центровой сердечной аорты и периферических артерий. Причиной могут стать и различные заболевания сердца.
Хроническая сердечная недостаточность — состояние, когда нормальная жизнедеятельность человека затруднена, сердце неспособно снабдить организм достаточным количеством крови. Такое состояние развивается вследствие слабых усилий мышцы сердца по выбрасыванию крови из левого желудочка. День ото дня ткани и органы недополучают жизненно необходимые питательные вещества и кислород. Провоцировать такое состояние может ослабление самого миокарда, сердечных клапанов, центровой сердечной аорты и периферических артерий. Причиной могут стать и различные заболевания сердца.
Человек, долгое время страдающий сердечной недостаточностью начинает ощущать недомогание, к примеру, появляется одышка при выполнении физических нагрузок, а в запушенных случаях одышка заметна даже в состоянии покоя. Дополнительным симптомом может быть и тахикардия, когда сердце начинает неистово колотиться. Все это вызвано долгосрочным кислородным голоданием, которое спровоцировано заторможенным кровообращением. По этой же причине могут «синеть» кончики пальцев ног и рук, ведь кровь и кислород к ним поступает совсем в скудных дозировках.
Трудно обратимые последствия маломощного сердечного выброса имеют два негативных последствия: происходит застой крови в венозном кровотоке и снижается объем крови в общей системе кровообращения. Болевые ощущения можно заметить в зоне подреберья с правой стороны (так как вены печени переполнены) и очевидна отечность конечностей.
Клеточная терапия хронической сердечной недостаточности
Применение стволовых клеток в борьбе с сердечной недостаточностью, в ее хроническом протекании, нацелено на ликвидацию непосредственных причин, приводящих к заболеванию, а также на нормализацию деятельности миокарда, стабилизацию артериального давления в безопасных приделах и укрепление стенок сердечной аорты и сосудов.
Трансплантация аутологичных кардиомиобластов, которые по своей природе являются стволовыми клетками пациента, успешно производится в отдельных киниках современной медицины. И она эффективна даже у пациентов, перенесших инфаркт и испытывавших длительную сердечную недостаточность. При запущенных формах заболевания этот метод также эффективен.
Следствием лечения стволовыми клетками стала ярко выраженная переносимость физических нагрузок, уменьшение болевых приступов стенокардии, и даже их полное стихание, сокращение силы отдышки и отечности конечностей.
Что касается восстановления работы сердца при помощи вживления стволовых клеток, то результаты так же радуют: удовлетворительные показатели ЭхоКГ, увеличение объема изгоняемой крови из левого желудочка, активизация деятельности миокарда, нормализация ритма и крово-проводимости по системе кровотока, а также отмечена деактивация симптомов коронарной недостаточности по ЭКГ.
Также применение стволовых клеток в случае в сердечной недостаточностью не имеет никаких побочных эффектов и не дает нагрузку на работу других органов в организме пациента. Также важна наименьшая инвазивность данной методики.
Можно сказать, что более простого, эффективного и безопасного метода лечения длительной сердечной недостаточности просто не существует.
Эффективность клеточной терапии в лечении хронической сердечной недостаточности
Недавно и российские ученые подтвердили эффективности использования стволовых клеток при хронической форме сердечной недостаточности. Исследования проводились в Санкт-Петербургском университете государственного уровня и в высокотехнологичном научном центре хирургических технологий.
Они неоднократно проводили клинические исследования воздействия аутологичных СК (стволовых клеток) на деятельность сердечной мышцы. В итоге была представлена работа с итогами проведенных исследований.
В ходе клинических испытаний были задействованы 34 пациента, у которых была диагностирована прогрессирующая функциональная стадия хронической недостаточности сердца. В большинстве случаев это были больные, перенесшие ишемическое заболевание или острые воспалительные процессы. Такая тяжелая форма заболевания уже не дает надежды на успешное медикаментозное лечение, здесь предлагался лишь путь трансплантации донорского сердца или проведения хирургических операций. Но всем пациентам был предложен потенциально более эффективный и безопасный метод – подсадка стволовых клеток, взятых из их собственного организма.
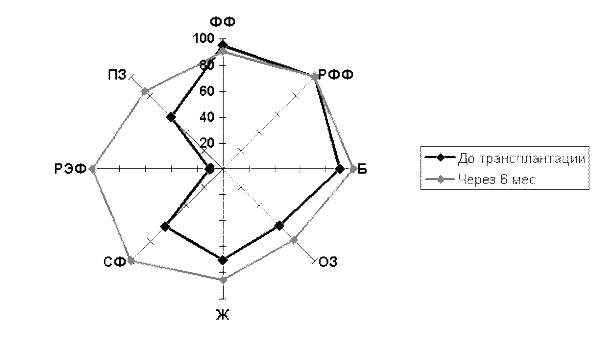
Состояние больных было клинически испытано и зафиксировано несколько раз: непосредственно перед вживлением стволовых клеток, спустя три месяца после проведения данной процедуры и спустя год после пройденного лечения.
Результаты оказались более обнадеживающими, чем при медикаментозном и оперативном лечении данного состояния. Обследование, проведенное спустя три месяца после выписки, показало следующие изменения в самочувствии больных: снижение конечно-диастолических параметров левого желудочка (в соотношении в 1,2 раза). Также внутривенное вживление аутологичных СК привело к ярко выраженному увеличению выносливости и нормализации повседневной жизни пациентов.
Как проводится курс клеточной терапии при ХСН
Пациент поступает в клинику для обследований, сдачи анализов, определения совместимости с используемыми препаратами и для забора собственного костного мозга больного. Все данные процедуры занимают период от 3-х дней.
Спустя две-три недели после первоначального пребывания в клинике проводиться первая подсадка стволовых клеток, таких процедур потребуется три, каждая с интервалом в три-шесть месяцев. Все сроки регулируются индивидуальными клиническими показаниями пациента.
Процесс ожидания не требует постоянного пребывания в клинике, каждая госпитализация потребует всего два-три дня.
Оформление заявки по телефону – (495) 585-92-41
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
КЛЕТОЧНЫЕ ТЕХНОЛОГИИ ПРИ ГИБРИДНЫХ ОПЕРАЦИЯХ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Текст научной статьи по специальности « Медицина и здравоохранение »
Новости науки
Magic Leap пустит разработчиков в дополненную реальность
Компания Magic Leap официально объявила о создании платформы для разработчиков дополненной реальности. Оставить контакты можно в соответствующем разделе на сайте компании. Об этом представители компании сообщили в рамках конференции EmTech Digital.
Аннотация
Проведен анализ клинического опыта применения аутогенных мононуклеарных клеток костного мозга (МККМ] и феталь-ных клеток СФЮ в комбинации с хирургическими методами лечения пациентов с ишемической кардиомиопатией. Через год проспективного наблюдения установлено, что методики введения стволовых клеток безопасны и хорошо переносятся больными. Отмечено положительное влияние проведенного вмешательства на течение коронарной и сердечной недостаточности. Проводимое ультразвуковое исследование показало, что улучшение показателей внутрисердечной гемодинамики отмечалось только у больных после лечения фетальными клетками по сравнению с контрольной группой больных и группой лечения пациентов с помощью МККМ.
Текст
Клинический опыт
КЛИНИЧЕСКИЙ ОПЫТ
Клеточные технологии при гибридных операциях лечения хронической сердечной недостаточности
Ш.Д. Ахмедов, В.Е. Бабокин, МЛ. Дьякова*, И.В. Кистенева, И.Н. Ворожцова,
ИЛ. Буховец, А.Г. Лавров, В.М. Шипулин
НИИ кардиологии Сибирского отделения РАМН, Томск
Cell Technologies in Hybrid Surgery of Chronic Cardiac Insufficiency
Sh.D. Akhmedov, V.E. Babokin, ML. D'yakova, I.V. Kisteneva, I.N. Vorozhtsova, I.L. Bukhovets, A. G.Lavrov, V.M. Shypulin State Research Institute of Cardiology of the Tomsk Scientific Center, SB RAMS
Проведен анализ клинического опыта применения аутогенных мононуклеарных клеток костного мозга (МККМ] и фетальных клеток (ФК) в комбинации с хирургическими методами лечения пациентов с ишемической кардиомиопатией. Через год проспективного наблюдения установлено, что методики введения стволовых клеток безопасны и хорошо переносятся больными. Отмечено положительное влияние проведенного вмешательства на течение коронарной и сердечной недостаточности. Проводимое ультразвуковое исследование показало, что улучшение показателей внутрисердечной гемодинамики отмечалось только у больных после лечения фетальными клетками по сравнению с контрольной группой больных и группой лечения пациентов с помощью МККМ.
Ключевые слова: сердечная недостаточность, клеточные технологии, кардиохирургия.
Analysis of clinical experience of autologous mononuclear bone marrow cells (MBMC) and fetal cells (FC) use in combination with surgical methods of treatment in patients ischemic cardiomyopathy was made. A year of prospective follow-up period showed that methods of stem cells introduction are safe and well-tolerated by patients. Positive effect of the intervention performed on the course of coronary and heart insufficiency was noticed. Ultrasonic examination showed that improved values of intracardiac hemodynamic was noticed only in the patients after treatment with fetal cells in comparison with the control group of patients and with the group of patients treated with MBMC.
Key words: heart insufficiency, cellular technologies, cardiac surgery.
Сердечная недостаточность является самым распространенным осложнением у больных, перенесших инфаркт миокарда. Использование традиционных методов лечения с применением современных лекарственных препаратов часто носит временный положительный клинический эффект у данной категории пациентов. В научной литературе мало работ, в которых проводится анализ клинического материала использования клеточной терапии [1, 2]. Пока нет окончательного мнения ни об используемом материале, ни об оптимальном способе введения клеток в миокард, ни об их количестве. Часто дискутируется вопрос о том, какие стволовые клетки (СК) лучше использовать в клинической практике: аутогенные, алло-генные, фетальные, либо эмбриональные? Не до конца изученным является вопрос о том, как поведут себя в дальнейшем клетки после их адресной доставки в миокард.
Поэтому целью нашей работы явился анализ клинического опыта применения аутогенных мононуклеарных клеток костного мозга (МККМ) и фетальных клеток (ФК) у тяжелой категории пациентов с ишемической кардиомиопатией.
Материал и методы
В исследование включено 94 больных ИБС, с по-стинфарктной дисфункцией левого желудочка, прояв-
e-mail: [email protected]
Клеточная трансплантология и тканевая инженерия Том IV, № 1, 2009
лениями сердечной недостаточности II—III ФК по 1МУНА. Было сформировано 3 группы больных: 1 группа — 38 пациентов, которым проводилась клеточная терапия с использованием МККМ во время хирургического вмешательства (аортокоронарное шунтирование и/или резекция аневризмы левого желудочка), либо эндо-васкулярной реваскуляризации миокарда; 2 группа — 28 больных, которым также проводилась реваскуля-ризация миокарда в сочетании с клеточной терапией фетальными клетками; 3 группа — контрольная, ее составили 28 пациентов, перенесших реваскуляризацию миокарда без выполнения клеточной терапии. Пациенты всех групп были сопоставимы между собой по клинико-ангиологическим показателям. Срок проспективного наблюдения составил 1 год.
Следует отметить, что работа с МККМ проводилась в рамках научной темы ГУ НИИ кардиологии ТНЦ СО РАМН «Профилактика и лечение сердечной недостаточности в кардиохирургии. Фундаментальное обоснование современной стратегии», которая утверждена в СО РАМН. Основанием для использования ФК в клинической практике послужила статья Л.А. Бокерия с соавт. [3], а также решения Ученого Совета от 29.10.2004 г. и Этического комитета ГУ НИИ кардиологии ТНЦ СО РАМН от 22.11.2004 г. Все больные, которым в качестве лечения использовались стволовые клетки, подписывали информированное согласие.
Клинический опыт
Выделение клеточного материала из костного мозга
Для выделения аутогенных МККМ получение костного мозга производили в условиях операционного блока из крыла подвздошной кости в количестве 100^120 мл. Из полученной взвеси клеток костного мозга выделяли МККМ методом градиентного центрифугирования [4]. После этого клетки ресуспендировались в концентрации 2×108/ мл. По данным Е.Д. Гольдберг [5], в общем составе МККМ содержится до 2% гемопоэтических стволовых клеток, остальную долю составляют клетки-предшественницы мононуклеаров. По данным проведенной проточной цитофлуориметрии суспензия МККМ у отдельных пациентов достигает следующего качествен-
Выделение гемопоэтических фетальных клеток из исследуемого материала
Непосредственный забор биологического материала производился в клиниках ГУ НИИ акушерства, гинекологии и перинаталогии Томского научного центра СО РАМН. Клетки печени, селезенки, тимуса выделялись из абортивного материала сроком гестации 9^12 нед. механическим способом в стерильных условиях в ламинарном боксе. Гемопоэтические клетки дезинтегрировали, суспензия отмывалась на центрифуге («BECKMAN», США) в отмывочной среде. Подсчитывали количество жизнеспособных гемопоэтических клеток с помощью трипанового синего. Проводилось определение жизнеспособности клеток (жизнеспособных клеток должно было быть не менее 85%). Непосредственно перед осуществлением выделения клеточного материала, производилось тестирование тканей на вирусоносительство (ВИЧ, гемоконтактные гепатиты). Затем проводили криоконсервирование гемопоэтических клеток. Общее количество вводимых клеток на одного пациента, как в условиях операционного блока, так и ангиографическо-го кабинета составило 40+1,8×10е. По данным проточной цитофлуориметрии качественный состав ФК перед их введением в сердце состоял: 16,52% CD34+; 13,27% CD38+; 7,16% CD34+/CD38-.
Методы введения клеточного материала в миокард
Техническая процедура доставки в сердце клеточного материала осуществлялась: в операционном блоке при выполнении основного этапа операции АКШ и в условиях ангиографического кабинета.
Доставка клеточного материала в сердце во время операции АКШ осуществлялась перед снятием зажима с аорты двумя способами: интрамиокардиального и внут-рикоронарного введения взвеси клеток. Интрамиокар-дильный способ представлял собой радиальное введение шприцем клеток в миокард ЛЖ в 14^15 точках со стороны эпикарда. Расстояние между точками составляло 1,5^2 см. Глубина введения иглы в миокард до 1 см. В том случае, если операция АКШ сочеталась с резекцией аневризмы, то обкалывание производили со стороны эндокарда после иссечения аневризматического мешка. При этом введение клеток производилось по внутреннему диаметру левого желудочка с общим числом вколов до 10. Количество вводимых клеток на одну
1мл. Внутрикоронарный способ включал в себя последовательное введение клеточного материала в коронарные
артерии через вновь сформированные шунты. Количество клеток на один шунт составляло 20^25×1О8 с концентрацией 1,5^2×108 в мл, и 13^22×108 фетальных клеток с концентрацией 3,8^4,2×108 в мл.
В условиях ангиографического кабинета МККМ вводились 17 пациентам с ИКМП. В их число вошли 2 пациента, которым ранее проводилось стентирование коронарных артерий, и 3 пациента, у которых спустя год после АКШ стали нарастать признаки сердечной недостаточности.
Результаты
При сравнительном анализе двух способов введения МККМ, внутрикоронарного в условиях ангиоблока и сочетанного (внутрикоронарного и интрамиокардиального) во время АКШ, были выделены 2 подгруппы пациентов, соответственно л=17ил=21.У всех больных отмечалось клиническое улучшение, проявлявшееся в понижении степени сердечной недостаточности по классификации 1МУНА, а также в уменьшении ФК стенокардии.
Субъективное улучшение качества жизни по данным Миннесотского опросника отмечали все 17 пациентов, которым клеточная терапия проводилась в условиях ангиографического кабинета, а также большинство пациентов второй подгруппы. Толерантность к физической нагрузке при проведении теста 6-минутной ходьбы статистически значимо увеличивалась через 12 мес. после введения МККМ любым способом (р=0,029) по сравнению с исходным значением.
При изучении показателей функции левого желудочка у больных обеих групп нами установлена положительная динамика, при этом статистически значимых различий между двумя подгруппами выявлено не было.
Таким образом, в ходе статистического анализа динамики коронарной и сердечной недостаточности, показателей качества жизни, теста 6-минутной ходьбы, ЗхоКГ статистически значимого различия между показателями подгрупп получено не было, что позволило в дальнейшем выполнять межгрупповой сравнительный анализ без разделения на подгруппы по способу введения клеток.
Через 1 год проспективного наблюдения у пациентов всех трех групп отмечена положительная динамика в виде уменьшения выраженности и тяжести симптомов коронарной и сердечной недостаточности. В первой группе у трех пациентов (7%) через 1 год зарегистрированы нарушения ритма: в двух случаях желудочковая экст-расистолия III градации по Ьом/п, у одного пациента — регистрировались пароксизмы фибрилляции предсердий. У одного пациента второй группы (использование фетальных клеток) зарегистрирован эпизод развития нестабильной стенокардии, причем при проведении коронарографии не выявлено прогрессирования атеросклероза в коронарном русле. Нарушения ритма в процессе наблюдения выявлены в 4 случаях (14%). В трех случаях у пациентов при обследовании через 1 год после вмешательства выявлены нарушения ритма — желудочковая экстрасистолия III и IV градации по 1_ом/п. В одном случае через 6 мес. после вмешательства регистрировался пароксизм желудочковой тахикардии и пароксизмальная форма фибрилляции предсердий. У двух пациентов с нарушениями ритма проводилась диагностическая коронаро-шунтография, которая выявила окклюзии ранее выполненных шунтов. Таким образом, можно предположить, что появление нарушений ритма у пациентов было вызвано состоянием ишемии миокарда на фоне нарушений проходимости шунтов, а не явилось
Клеточная трансплантология и тканевая инженерия Том IV, № 1, 2009
Клинический опыт
последствием клеточной терапии. В одном случае отмечено явное нарастание симптомов ХСН через 1 год — увеличение НК с 1 до 26, ФК по 1МУНА с II до IV, при проведении коронарографии также отмечено нарушение проходимости шунта, что возможно объясняет ухудшение состояния пациента. В группе контроля у трех пациентов (10,7%) в процессе проспективного наблюдения зарегистрированы нарушения ритма сердца в виде желудочковой экстрасистолии II градации по Шип, в двух случаях (7%) — установлена постоянная форма фибрилляции предсердий.
В таблице 1 представлены показатели внутрисердеч-ной гемодинамики у пациентов трех групп. Через 1 год после проведенного вмешательства определялась достоверная положительная динамика показателей (фракция выброса левого желудочка, конечный диастолический объем, конечный систолический объем) во всех группах. Необходимо отметить, что через 1 год в группе 2 (с применением фетальных клеток) отмечалось более низ-
кое значение КДО (134,5 мл) по сравнению с группой контроля (165,3 мл) и группой 1-МККМ (167,5 мл) при уровне значимости р<0,05.
Согласно рекомендациям Американской ассоциации эхокардиографии оценивали сократимость 16 сегментов миокарда ЛЖ. Сократимость каждого сегмента оценивали в баллах: нормальная сократимость — 1 балл, гипокинезия — 2 балла, акинезия — 3 балла, дискинезия — 4 балла, гиперкинезия — 0 баллов. Сумму баллов делили на общее число исследованных сегментов. Недостаточно четко визуализированные сегменты не учитывали. Критериям жизнеспособности соответствовало улучшение регионарной сократимости миокарда на 1 балл и более в двух соседних сегментах. Динамика показателей локальной сократимости во всех группах имела одинаковую направленность: уменьшение количества гипокинетич-ных, акинетичных и дискинетичных сегментов и увеличение количества сегментов с нормальной сократимостью (табл. 2).
Таблица 1, Показатели внутрисердечной гемодинамики
Показатель Группа контроль (N=28) Группа I — МККМ (N=38) Группа 2 — ФК (N=28)
Исходно:
Конечный диастолический объем, мл 198,3 ± 28,7 187,6 ± 30,3 196,2±36,2
Конечный систолический объем, мл 114,7±41,4 110,2±29,8 115,0±35,9
Фракция выброса, % 44,0 ±11,0 42,1±8,0 42,3 ± 10,4
Через I год:
Конечный диастолический объем, мл 165,3 ± 16,2* 167,5 ± 12,6* 134,2 ± 21,7*#$
Конечный систолический объем, мл 86,3 ± 10,8* 83,5 ± 16,3* 67,2 ± 10,6*#
Фракция выброса, % 48,1 ±2,0* 50,3 ± 3,2* 52,9 ± 2,2*#
Примечание: * — статистически значимые различия по сравнению с исходным состоянием [р<0,05); # — статистически значимые различия по сравнению с группой контроля [р<0,05); $ — статистически значимые различия по сравнению с группой 1 (МККМ) (р<0,05).
Таблица 2. Динамика локальной сократимости по данным ЭхоКГ
Показатель Срок Абсолютное значение (%)
Контроль (N=28) МККМ (N=38) ФК (N=28)
Дискинез Исход 30 (6,7%) 272(9,9%) 282(7,6%)
Через 1 год 1 (0,6%)* — —
Акинез Исход 64 (14,3%) 48 (17,6%) 57 (15,5%)
Через 1 год 3 (1,9%)* 1 (0,9%)* 12(0,2%)*
Гипокинез Исход 138 (30,8%) 81 (29,8%) 117 (31,8%)
Через212год 16 (10%)* 10 (8,9%)* 12 (5,8%)*
Асинергия Исход 232 (51,8%) 156 (57,3%) 2022(54,9%)
Через212год 20 (12,5%)* 11 (9,8%)* 13 (6,0%)*#
Нормокинез Исход 216 (48,2%) 116 (42,7%) 166 (45,1%)
Через212год 1402(87,5%)* 101 (90,2%)* 195(93,75%)*#
Примечание: * — статистически значимые различия по сравнению с исходным состоянием [р<0,05); # — статистически значимые различия по сравнению с группой контроля [р<0,05).
Клеточная трансплантология и тканевая инженерия Том IV, № 1, 2009
Клинический опыт
Через 1 год после операции в группе 2 (с применением фетальных клеток) наблюдались более выраженные изменения по сравнению с группой контроля. Количество асинергичных сегментов в группе 2 через 1 год составило 13 (6,0%) против 20 (12,5%) в группе контроля, а количество нормокинетичных сегментов ^195 (93,75%) и 140 (87,5%), соответственно (все при р<0,05). Между группой 1 (с применением мононуклеарных клеток костного мозга) и группой контроля статистически значимых различий не выявлено.
Из параметров, характеризующих геометрию левого желудочка, через 1 год после лечения отмечено статистически значимое (р<0,05) уменьшение по сравнению с дооперационным состоянием продольных и поперечных размеров ЛЖ как в систолу, так и в диастолу во всех обследованных группах.
Обсуждение
Теоретически, в основе ожидаемого эффекта от воздействия клеточной терапии лежит теория асимметричного деления стволовой клетки, а именно когда стволовая клетка, попадая в новую для себя среду, в нашем случае миокард, начинает делиться на две клетки: себе подобную клетку и кардиомиобласт. Считается, что этот процесс кардиомиогенеза лежит в основе предотвращения дальнейшего ремоделирования миокарда после перенесенного острого инфаркта миокарда [2, 6]. Однако до настоящего времени неизвестно, какой фенотип клеток все-таки лучше использовать для решения этой важной задачи. Общеизвестно, что взвесь МККМ, которую мы использовали в своей работе, состоит из стволовых клеток (1,5—2%), а также мезенхимальных, гемопоэтических и эндотелиальных клеток-предшествен-ниц [5]. Все эти клетки содержат большое количество различных биологически активных веществ, ростовых факторов, способных обеспечивать им не только их выживание в новой среде, но и вызывать стимуляцию регенерации поврежденных тканей реципиента. Особая роль при этом уделяется такому не менее значимому фактору как неоангиогенез [7, 6].
На основании клинического материала мы с уверенностью говорим только о том, что искусственным путем создаем в отдельных местах миокарда высокую концентрацию стволовых клеток. Существует несколько способов введения клеток в миокард: во время открытой операции на сердце, когда клетки вводят непосредственно в коронарные артерии и методом обкалывания в толщу стенки левого желудочка, а также в условиях ангиографического кабинета, где клетки могут доставляться в сердце
через коронарные артерии, либо со стороны полости левого желудочка, используя специальный катетер с иглой. В предыдущей нашей работе одной из главных задач была попытка проследить у пациентов с ишемической кардиомиопатией пути миграции меченых радио-изотопной меткой МККМ, после их адресной доставки в миокард через коронарные артерии [7, 8]. Было показано, что при таком способе введения в миокарде, спустя 24 час. может фиксироваться только до 2% МККМ. Остальной, больший объем клеток в основном уходил в печень и селезенку. После чего мы сделали предположение, что способ введения МККМ в сердце может и не играть решающей роли в изменении клинической картины течения сердечной недостаточности у больных с ишемической КМП. В настоящей работе это нашло подтверждение, а именно показатели внутрисердечной гемодинамики в проспективном наблюдении у больных I группы достоверно не изменились по сравнению с пациентами контрольной группы.
Клиническое применение криоконсервированных фетальных клеток печени является актуальным [9] и перспективным направлением в трансплантологии [10]. По данным Ю.А. Петренко [11 ] содержание CD 45+ клеток в печени 6^12 нед. гестации составляет более 23%. По данным A.I. Tarasov с соавт. [9] содержание СК по
получены и нами. Нам пока трудно объяснить клиническую эффективность, проявляющуюся в достоверных улучшениях показателей внутрисердечной гемодинамики у пациентов II группы в проспективном наблюдении. Либо это обусловлено изначально высоким содержанием СК в фетальной клеточной взвеси, либо имеет место особенность фенотипичного взаимодействия между ФК и миокардом пациентов. Об этом свидетельствует и работа V.l. Grischenko с соавт. [12], которые показали, что колониеобразующая способность фетальных клеток значительно выше, чем у клеток костного мозга человека
Таким образом, наши предварительные клинические результаты по оценке нового гибридного способа лечения больных с ишемической кардиомиопатией с использованием клеточной терапии показали следующее:
• методики введения стволовых клеток безопасны и хорошо переносятся больными;
мики отмечалось только у больных после лечения фетальными клетками по сравнению с контрольной группой больных и группой лечения пациентов с помощью МККМ.
ЛИТЕРАТУРА:
1. Беленков Ю.Н. Агеев Ф.Т. Мареев В.(О. Сычев А.В. Саидова М.О. Стволовые клетки и их применение для регенерации миокарда. Сердечная недостаточность 2003; 4[4): 168—73.
2. Orlic D. Kajstura J. Chimenti S.et al. Bone marrow cells regenerate infracted myocardium. Nature 2001; 410: 701—5.
3. Бокерия Л.А. Георгиев Г.П. Голухова Е.З. и др. Клеточные и интерактивные технологии в лечении врожденных и приобретенных пороков сердца и ишемической болезни сердца. Вестник РАМН 2DD4; 9: 48—55.
4. Boyum A. Separation of leucocyties from blood and bone marrow. Scandinavian J of clinical and laboratory investigation 1968; 21, suppl. 97: 91-106.
5. Гольдберг Е.Д. Справочник по гематологии. Изд-во Томского государственного университета; 1989: 370.
6. Tomita S. Mickle D.A. Weisel R.V. et al. Improved heart function with myogenesis and angiogenesis after autologus porcine marrow stromal cell transplantation. J. Thorac. Cardiovasc. Surg. 2DD2; 123: 1132—5.
7. Ахмедов Ш.Д. Бабокин B.E. Рябов В.В. с др. Клинический опыт применения аутологичных мононулеарных клеток костного мозга
в лечении больных с ишемической болезнью сердца и дилятационной кардиомиопатией. Кардиология 2DD6; 7: 10—4.
8. Lishmanov Y.B. Sazonova S.I. Chernov V.l. et al. Tracking of autologous mononuclear bone marrow cells after intracoronary infusion by direct labeling with 99mTc-HMPA0 in patients with cardiac disease. Abstract. Europ. J. Nucl. Med.Mol. Imaging 2DD4; 31, Suppl. 2: S321.
9. Tarasov A.I. Petrenko A.Y. Jones D.R. Grischenko V.l. Phenotypic analysis colony-forming activity of cryopreserved hemopoietic cells in human fetal liver. Exp. Oncol. 2002; 24: 180-3.
10. Абдулкадыров K.M. Балашова B.A. Клеточный состав печени и селезенки в фетальном периоде. Клеточная трансплантология и тканевая инженерия 2008; 3[1): 46—8.
11. Петренко Ю.А. Иммунорегуляторные свойства клеток фетальной печени человека. Клеточная трансплантология и тканевая инженерия 2007; 2 [31: 57-61.
12. Grischenko V.I. Tarasov A.I. Rudenko S.V. Petrenko A.Y. The sensitivity of human fetal liver cells of 7-12 weeks of gestation to programmed freezing and cyclic freeze-thawing. Probl. Cryobiol. 2000; 4: 37-44.
Поступила 21.12.2008
Клеточная трансплантология и тканевая инженерия Том IV, hl< 1, 2009